Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mess-Zellzyklus-Progression Kinetics mit Metabolische Markierung und Durchflusszytometrie
In diesem Artikel
Zusammenfassung
Tracking-feine Veränderungen in der Progression und die Kinetik der Zellzyklusstadien kann durch Verwendung einer Kombination von metabolische Markierung von Nukleinsäuren mit BrdU und genomischer Gesamt-DNA-Färbung über Propidiumiodid durchgeführt werden. Dieses Verfahren vermeidet die Notwendigkeit von chemischen Synchronisation der Rad-Zellen, wodurch die Einführung von nicht-spezifischen DNA-Schäden, die sich wiederum auf den Ablauf des Zellzyklus.
Zusammenfassung
Präzise Kontrolle der Einleitung, die Progression durch die verschiedenen Phasen des Zellzyklus sind von größter Bedeutung in proliferierenden Zellen. Handy-Zyklus-Teilung ist ein integraler Bestandteil von Wachstum und Vermehrung und Deregulierung wichtiger Zellzyklus Komponenten in den auslösende Ereignisse der Karzinogenese 1,2 gebracht. Molekulare Wirkstoffe in Anti-Krebs-Therapien zielen häufig biologische Pfade für die Regulation und Koordination von Zellzyklus-Division 3. Obwohl Zellzykluskinetik bis nach Zelltyp unterschiedlich neigen, ist die Verteilung der Zellen unter den vier Phasen des Zellzyklus und nicht konsistent innerhalb einer bestimmten Zelllinie durch die ständige Praxis Mitogen und Wachstumsfaktor Ausdruck. Gentoxische Ereignisse und andere zelluläre Stressoren können in einem temporären Block des Zellzyklus führen, was zu einer vorübergehenden Festnahme oder Pause in einer bestimmten Zelle Zyklusphase für Institutionen ermöglichensuchung der entsprechenden Antwort-Mechanismus.
Die Fähigkeit, experimentell zu beobachten, das Verhalten einer Zellpopulation mit Bezug auf die Zellzyklusprogression Stufe ist ein wichtiger Fortschritt in der Zellbiologie. Gemeinsame Verfahren wie die mitotische abzuschütteln, differentielle Zentrifugation oder auf Basis der Durchflusszytometrie Sortierung werden verwendet, um Zellen in bestimmten Phasen des Zellzyklus 4-6 zu isolieren. Diese fraktionierte, Zellzyklus-Phase angereicherte Populationen werden dann auf experimentelle Behandlungen unterzogen. Ausbeute, Reinheit und Lebensfähigkeit der getrennten Fraktionen können oft kompromittiert Verwendung dieser physikalische Trennverfahren werden. Wie gut, kann die Zeitspanne zwischen Trennung der Zellpopulationen und dem Beginn der experimentellen Behandlung, wobei die Zellen aus der fraktionierten ausgewählten Zellzyklus-Stadium fortschreiten kann, vor erhebliche Herausforderungen bei der erfolgreichen Umsetzung und Interpretation dieser Experimente.
Andere Ansätze zur Study Zellzyklusstadien umfassen die Verwendung von Chemikalien, um Zellen zu synchronisieren. Behandlung der Zellen mit chemischen Inhibitoren der wichtigsten Stoffwechselprozesse für jede Phase des Zellzyklus sind nützlich bei der Blockierung der Verlauf des Zellzyklus zur nächsten Stufe. Zum Beispiel, begrenzen die Ribonucleotid-Reduktase-Inhibitor Hydroxyharnstoff hält Zellen in der G1 / S Stelle durch die Zufuhr von Desoxynukleotiden, die Bausteine von DNA. Andere bemerkenswerte Chemikalien umfassen eine Behandlung mit Aphidicolin, um eine Polymerase-Inhibitor alpha für G1-Arrest, Behandlung mit Colchicin und Nocodazol, die beide mit mitotischen Spindel stören Zellen in M-Phase zu stoppen und schließlich die Behandlung mit dem DNA-Kettenterminator 5-fluorodeoxyridine zu initiieren S-Phase Festnahme 09.07. Die Behandlung mit diesen Chemikalien ist ein wirksames Mittel zur Synchronisation eines gesamten Population von Zellen in einer bestimmten Phase. Mit Entfernung der chemischen herkommend Zellen den Zellzyklus unisono. Die Behandlung des Testmittels folgenden Releaseaus dem Zellzyklus blockierende chemische sichergestellt, dass die Reaktion auf Arzneimittel hervorgerufen von einer gleichförmigen, Phase des Zellzyklus-spezifischen Population ist. Allerdings sind da viele der chemischen Synchronisierungen genotoxische Verbindungen bekannt, Hänseleien auseinander die Beteiligung der verschiedenen Response-Wege (zu den Synchronisierungen im Vergleich zu den Test-Agenten) ist eine Herausforderung.
Hier beschreiben wir eine Methode zur metabolischen Markierung nach einer Subpopulation von Zellen aktiv Radfahren durch ihre Progression aus der DNA-Replikation Phase, durch die Teilung und Trennung von ihren Tochterzellen. In Verbindung mit Durchflusszytometrie Quantifizierung ermöglicht dieses Protokoll für die Messung der kinetischen Fortschreiten des Zellzyklus in Abwesenheit von entweder mechanisch oder chemisch induzierte zelluläre betont gewöhnlich mit anderen Zellzyklus-Synchronisation Methoden 10 zugeordnet ist. In den folgenden Abschnitten werden wir die Methodik, sowie einige seiner Anwendungen in der biomedizinischen Forschung.
Protokoll
1. Zellpräparation
- Tafel Zellen eine Dichte von etwa 60% Konfluenz zu erreichen. Die Zellen müssen in der log-Phase zum Zeitpunkt der Sammlung sein. Für MCF7-Zellen, wird dies durch Impfen mit 5 × 10 5 Zellen / 10 cm Platte in den entsprechenden Medien durchgeführt. HT29 und LS180 Zellen werden bei 6 x 10 5 Zellen / 6 cm Platte ausgesät. Wir verwendeten DMEM-Medium mit 10% FBS und 1 x Penicillin / Streptomycin ergänzt. Achten Sie darauf, Saat-Platten für den richtigen positiven und negativen Kontrollen inZusätzlich zu Ihrem Testproben. Dazu gehören die folgenden:
| ich | Positiv-Kontrolle | BrdU nur |
| ii | Positiv-Kontrolle | PI nur |
| iii | Negativ-Kontrolle | BrdU negativ, PI negativ |
(Es sei darauf hingewiesen, dass ein Vorversuch mit mehreren Zeitpunkten wie die in diesem Protokoll beschrieben verwendet werden, um Eingrenzung der Zeitraum, während dessen Durchführung zukünftige Sammlungen werden.)
- Die ausplattierten Zellen bei 37 ° C, 5% CO 2 für 24-48 h, wodurch Zellen zu gewinnen und zu befestigen.
- Zur Markierung von Zellen mit Bromdesoxyuridin (BrdU)-Pulses wird DMEM ersetzt with frisches Medium mit 10 uM BrdU. Die Zellen werden für 1 h bei 37 ° C, 5% CO 2 für BrdU-Einbau in die DNA zu ermöglichen. Achten Sie darauf, eine Platte zu unbehandelten als negative Kontrolle agieren zu lassen.
- Die Puls-Etikettenmedium wird entfernt und die Zellen kurz in 1X PBS gespült.
- Frische Wachstumsmedium zugegeben (abzüglich der BrdU) und die Zellen werden darf, weiterhin bei 37 ° C, 5% CO 2, bis die geeignete Zeitpunkt für die Ernte erreicht wird.
2. Ernte und Fixierung
- Unbehandelte Zellen aus Schritt 1.3 werden als die Null-Zeitpunkt. In diesem Beispiel kann zusammen mit dem Zeitpunkt 1 h, die unmittelbar nach der Behandlung wurden BrdU geerntet werden.
- Um die Zellen zu ernten, wird das Medium entfernt und die Platten werden einmal mit 1 × PBS gespült.
- Die Zellen werden trypsiniert, gesammelt in Kulturmedien und danach pelletiert durch Zentrifugation bei 1500 UpM für 5 min Supernatant wird verworfen.
- Spülen Sie 1-10 x 10 6 Zellen in 5 ml eiskaltem 1X PBS. Zentrifugieren bei 1500 UpM für 5 min Überstand wird verworfen.
- Das Zellpellet wird dann in 100 ul eiskaltem PBS / 1% FBS resuspendiert. Die Zugabe von 1% FBS in PBS vorbeugend gegen Zellverklumpung.
- In diese Zellen tropfenweise zu 5 ml von -20 ° C, 70% Ethanol, um die Zellen zu fixieren.
- Inkubieren auf Eis für 30 min oder bei 4 ° C über Nacht. Dies ist ein idealer Schritt, an dem die Entnahme von Proben aus den verschiedenen Zeitpunkten zu stoppen. Die Proben können in Ethanol für mehrere Tage belassen werden, so dass sie gleichzeitig durch den Rest des Protokolls verarbeitet werden.
3. BrdU-und PI-Färbung
- Pellet-Zellen durch Zentrifugation für 5 min bei 1500 Umdrehungen pro Minute.
- Entfernen Sie das Fixativ, aber lassen Sie ~ 50 ul, in dem das Pellet durch Vortexen lösen.
- Um die DNA zu denaturieren, langsam 1 ml 2N HCl / Triton X-100tropfenweise unter Vortexen. Inkubieren Proben bei Raumtemperatur für 30 min.
- Pellet-Zellen durch Zentrifugieren von Proben für 5 min bei 1500 Umdrehungen pro Minute. Absaugen und den Überstand verwerfen.
- Das Zellpellet in 1 ml 0,1 M Natriumtetraborat, pH 8,5, um die Denaturierung zu neutralisieren.
- Zentrifuge Zellen für 5 min bei 1500 Umdrehungen pro Minute. Absaugen und den Überstand verwerfen.
- Zellpellet in 75 ul BrdU Färbung Mix (50 ul 0,5% Tween 20/1% BSA / PBS + 20 ul FITC-konjugierten Anti-BrdU + 5 ul 10 mg / ml RNase).
- Bei Raumtemperatur für 45 min vor Licht geschützt.
- Die Zellen zu pelletieren, zentrifugieren Sie die Proben für 5 min bei 1500 Umdrehungen pro Minute. Absaugen und den Überstand verwerfen.
- Das Zellpellet in 1 ml PBS, enthaltend 5 mg / ml Propidiumiodid.
4. Durchflusszytometrie
- Um die Zellen zu analysieren, ein Durchflusszytometer mit einem 488 nm-Laser und der ausgestattetgeeignete Filter erforderlich ist. Analyse-Software wie CellQuest ist nötig, die Rollen unten beschrieben zu schaffen.
- Bei der Ausführung der Probe durch das Durchflusszytometer, erstellen Sie eine Forward Scatter (SSC-H) vs Side Scatter (FSC-H) Plot um die richtige Größe Verteilung der Zellen (Abbildung 1A) zu gewährleisten. Diese beiden Parameter werden auf einer linearen Skala aufgetragen.
- Gleichzeitig sehen ein Grundstück von FL3-H (PI-Färbung) vs FL2-W (Abbildung 1B). Diese grafische Darstellung wird verwendet, um ein Gate (R3), um die Fraktion von Zellen, die innerhalb des normalen Verteilungsmuster des Zellzyklus zu isolieren erstellen. Im allgemeinen wird diese Verteilung, das durch zwei Gruppen von Zellen aus dem 2N und 4N DNA-Gehalt von PI-Färbung, die die G1 und G2-Phasen des Zellzyklus, jeweils ist. Eine Reihe von Zellen zwischen diesen 2-Clustern angeordnet ist repräsentativ für laufende DNA-Replikation, die in der S-Phase des Zellzyklus erfolgt.
- Erstellen Sie ein Grundstück displaying der Gated-Zellen (R3) aus Schritt 4.3, mit FL1-H (FITC, log-Kurve) auf der y-Achse und PI (lineare Darstellung) auf der x-Achse (Abbildung 1C). Dieses Grundstück wird verwendet, um die restlichen Parameter mit Hilfe der verschiedenen Steuerelemente in 1.1 skizziert, sowie Daten zur Analyse zu sammeln eingestellt werden.
- Platzieren Sie die PI nur gebeizt Probe auf das Zytometer. Stellen Sie den Gain auf G1 bei ~ 200 Stellen auf der x-Achse. Dies wird es leichter zu visualisieren in einem Histogramm Plot des PI-Färbung.
- Eine zweite Kontrolle betrifft Betrieb eines BrdU-Probe nur am Durchflusszytometer. Stellen Sie die Verstärkung, so dass die zwei Populationen von Zellen (BrdU positive vs BrdU negativ) auf dem Grundstück erscheinen. Idealerweise sind die BrdU-negativen Zellen positioniert ist, um direkt unter 10 -1 zu sehen.
- Die Endkontrolle ist der BrdU / PI negative Probe. Führen diese negative Kontrolle, um sicherzustellen, dass Zellen nicht in einem der oberen rechten Quadranten oder angezeigt.
- Nachdem die Parameter der verschiedenen Parzellen festgelegt wurden, dieDurchflusszytometer ist kalibriert und bereit für die Verarbeitung von BrdU-und PI-gefärbten Zellen. Ein Minimum von 10.000 Zellen, die gated in der richtigen PI-Fraktion (siehe 4.3 Schritt) sind, müssen pro Sammlung gelesen werden.
- Um die gesammelten Daten zu analysieren, die Software wie FlowJo oder FacsDiva genutzt. Jede der oben genannten Handlungen können in dieser Programme neu erstellt werden und quantitative und statistische Analysen durchgeführt.
- Der Endpunkt der Analyse umfasst mehrere aufeinanderfolgende Schritte. Erstellen einer Parzelle von FITC vs PI mit PI-Zellen gated als positiv von der PI vs FL2-W Grundstück ermöglicht es, die Rad-Bevölkerung zu unterscheiden. Ein zweites Tor wird von diesem Grundstück durch Isolierung des BrdU-positiven Bevölkerung geschaffen. Ausdruck dieses unverwechselbare Bevölkerung in einem Histogramm Plot mit PI auf der x-Achse erlaubt es, den zeitlichen Verlauf des Zellzyklus zu verfolgen. Dies kann weiter visualisiert, indem die Anzahl der BrdU-positive Zellen mit G1 oder G2 als eine Funktion der Zeit.
5. Repräsentative Ergebnisse
Normalerweise Rad Zellen mit Propidiumiodid gefärbt haben unterschiedliche Peaks bei G1 und G2, entsprechend Zellen mit 2N und 4N DNA-Gehalt, jeweils (2). Puls-Markierung mit BrdU ermöglicht selektive Markierung von einer Subpopulation von Zellen, die aktiv sind Synthetisieren DNA (dh S-Phase). Kurz nach dem Entfernen des BrdU-Reagenz, sind alle markierten Zellen in S-Phase (Abbildung 3). Durch die Beschränkung auf die Kennzeichnung eines kurzen Impulses man in der Lage, diese nun verschiedene Sub-Population von Zellen, während zahlreiche Zeitpunkten folgen, als sie durch den späteren Phasen des Zellzyklus passieren. Dies kann an der 1 h Zeitpunkt in Abbildung 3 als deutlichen Mangel an G1 und G2 Peaks visualisiert.
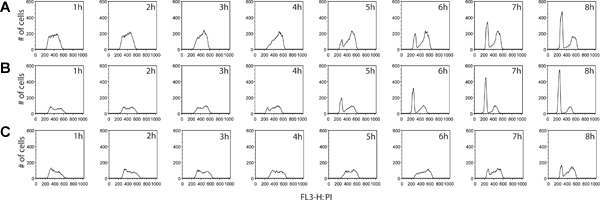
Zusätzliche Informationen können aus dem BrdU-Markierung Schritt abgeleitet werden. Nicht nur kann der Anteil von aktiv teilenden Zellen gemessen werden, aber ein EstiMate von Zellzyklusstadium Verteilung zwischen zwei Proben können ebenso bestimmt werden. Durch Sammeln von Zellen in gleichmäßig beabstandeten Intervallen nach der Entfernung des BrdU-Reagenz, kann Zellen zurückgeführt, wie sie Zyklus Fortschritte G2 fortgesetzt werden und schließlich durch die Zellteilung der ursprünglichen Zellen zu bewegen, endlich dabei als BrdU-positive Tochterzellen mit G1 DNA-Gehalt (Abbildung 4). Ein Beispiel für Zellzyklusphase Quantifizierung und kinetische Analyse ist in 5 vorgesehen.
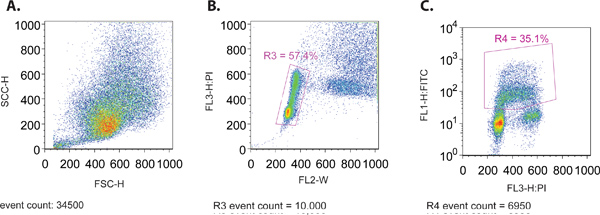
Abbildung 1. (A) gegen Forward Scatter Side Scatter Plot einer repräsentativen MCF7 Zellpopulation. (B) im Vergleich zu PI-Breite (FL-W) Plot einer repräsentativen MCF7 Zellpopulation. Gating wird gezeigt, dass Zell-Dubletten in letzter Instanz (R3) auszuschließen. Zellendubletten wird eine größere Impulsbreite als eine einzelne Zelle, wie sie mehr passieren zu durch den Laserstrahl und therefErz kann aus der Analyse ausgeschlossen werden. (C) im Vergleich zu PI-FITC (BrdU) Plot einer repräsentativen MCF7 Zellpopulation. Gating wird gezeigt, dass nur die FITC (BrdU)-positiven Zellen (R4) umfassen.
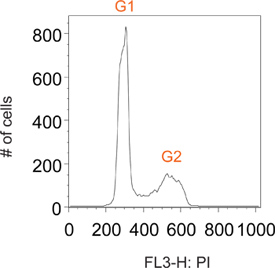
Abbildung 2. Vertreter Histogramm Plot von einer Gesamtbevölkerung von normalerweise proliferierender Zellen.

3. Histogramm Diagramm der Zellen, die 1h haben nach dem Entfernen des BrdU-Impuls erfasst, nachdem Gating für FITC (BrdU)-positive Zellen. BrdU-positive Zellen in einem frühen Zeitpunkt nach der Entfernung des Etiketts für PI-Profile, die den Proben-DNA Anzeige Inhalt, der mit Zellen, die in der S-Phase des Zellzyklus sind, über die erfolgreiche Markierung von Zellen nur während der DNA-Synthese entsprechen.
 lt = "Bild 4" />
lt = "Bild 4" />
Abbildung 4. Vergleich von Zellzyklus-Kinetik zwischen Krebszelllinien, Darmkrebs HT29 (A) und LS180 (B), sowie Brustkrebs MCF7 (C). Die Zellen wurden jede Stunde für 8 Stunden gesammelt, nach dem Entfernen des BrdU Puls. Bei diesem Experiment beobachteten wir ein klares Profil des beschleunigten Fortschreiten des Zellzyklus durch die G2-Phase des Zellzyklus in der kolorektalen Zelllinie LS180. Vergleicht man die Kinetik zwischen den beiden Profilen von Darmkrebs-Zellen, ist die Entstehung eines G1-Peak bei T = 4h post-BrdU zeigt sich in den LS180-Zellen, verglichen mit dem entsprechenden Zeitpunkt für die HT-29-Zellinie, die diesen Gipfel fehlt. Im Vergleich mit entweder einer der beiden kolorektalen Zelllinien MCF7-Zellen werden zu einem deutlich reduzierten Rate Radfahren. Klicken Sie hier für eine größere Abbildung anzuzeigen .
re 5 "/>
Bild 5. (A) Quantitative Zellzyklusphase Analyse BrdU-markierten Krebszellen. Der Dekan / Jett / Fox-Algorithmus wurde an HT29, LS180 und MCF7 (dargestellt in Grün) angewendet. Die resultierenden Zellzyklusphase Verteilungen von jeder Probe werden als% insgesamt BrdU-positive Zellen für jede Phase exprimiert. Nur ausgewählte Zeitpunkte für jede Zelllinie angezeigt werden, wie die Analysen für einige der früheren Zeitpunkten produziert falschen Ergebnissen führen. In diesen früheren Zeitpunkten, sind alle BrdU-positive Zellen in S-Phase und daher nicht verschiedene G1 und G2 Peaks, die für Algorithmus Anwendung geeignet sind. (B) Histogramme von Krebszellen zeigt die Kinetik der Progression durch G2 / M-Phasen des Zellzyklus. Progression durch G2 / M Phase ist am schnellsten für LS180-Zellen, von HT29 und MCF7 gefolgt. Klicken Sie hier für eine größere Abbildung anzuzeigen .
jpg "alt =" Abbildung S1 "/>
Abbildung S1. Durchflusszytometrie Kontrollen. MCF7-Zellen werden als (A) negative Kontrolle, wo Zellen sind weder PI oder BrdU gefärbten gezeigt. (B) nur PI angefärbt. (C) BrdU-FITC markierten Proben.

Abbildung S2. Schematische Darstellung, die die Beziehung zwischen Fluoreszenzemissionsspektrum des PI gegenüber FITC (BrdU). Die spektralen Fenstern Sammlung für Leuchtstofflampen Kanal 1 (FL1, für FITC) und Fluoreszenz-Kanal 3 (FL3, für PI) in entsprechenden Kästchen angezeigt. Es gibt keine Überschneidungen zwischen Farbstoffspektren FL1 und FL3 Erkennung. Offensichtlich ist Fluoreszenzkompensation nicht erforderlich, wenn experimentelle Daten von PI und FITC-BrdU-markierte Zellen co in den FL1/FL3 Kanäle jeweils gesammelt. Fluoreszenzspektren wurden von BD Biosciences Website erhältlich:target = "_blank"> http://www.bdbiosciences.com/research/multicolor/spectrum_viewer. Klicken Sie hier für eine größere Abbildung anzuzeigen .
Access restricted. Please log in or start a trial to view this content.
Diskussion
Durch die Kombination von Durchflusszytometrie mit BrdU-Einbau, wir haben die notwendigen Werkzeuge, um die Kinetik des Zellzyklus zu studieren. Das markante Eigenschaft von BrdU als Thymidinanalogon funktionieren ist das, was für DNA-Gehalt Quantifizierung einer Rad-Zelle. Der Einbau von BrdU in einen wachsenden Tochter-DNA-Strang während der Synthese-Phase des Zellzyklus ist, was erlaubt es, eine Subpopulation von Zellen handelt durch die Replikation der DNA in S-Phase zu folgen, einer Wachstumsphase bei G2 und schl...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Wir danken Andy Johnson von der Biomedical Research Center an der UBC für die Unterstützung bei FACS-Analyse. Cancer Research Funding im Wong Laboratory wird von der kanadischen Krebsgesellschaft Research Institute (Betriebskostenzuschuss # 019250) und vom Forschungszentrum Reinvestment Mittel der Fakultät für Pharmazeutische Wissenschaften, UBC zur Verfügung gestellt. JMYW wird durch die Forschung Kanada Stühle und der Michael Smith Foundation for Health Research Career Development Programme unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Firma | Katalog-Nummer | Kommentare |
| Bromdesoxyuridin | Becton Dickinson | 55089 | |
| Propidiumiodid | Sigma | 287075 | 1mg/ml Lager |
| FITC-anti-BrdU | Becton Dickinson | 347583 | |
| Natriumtetraborat | Fischer | S80172 | 0,1 M, pH 8,5 |
| FACS Caliber | Becton Dickinson |
Referenzen
- Musgrove, E. A., Caldon, C. E., Barraclough, J., Stone, A., Sutherland, R. L. Cyclin D as a therapeutic target in cancer. Nat. Rev. Cancer. 11, 558-572 (2011).
- Molchadsky, A., Rivlin, N., Brosh, R., Rotter, V., Sarig, R. p53 is balancing development, differentiation and de-differentiation to assure cancer prevention. Carcinogenesis. 31, 1501-1508 (2010).
- Dickson, M. A., Schwartz, G. K. Development of cell-cycle inhibitors for cancer therapy. Curr. Oncol. 16, 36-43 (2009).
- Banfalvi, G. Cell cycle synchronization of animal cells and nuclei by centrifugal elutriation. Nat. Protoc. 3, 663-673 (2008).
- van Opstal, A., Boonstra, J. Inhibitors of phosphatidylinositol 3-kinase activity prevent cell cycle progression and induce apoptosis at the M/G1 transition in CHO cells. Cell Mol. Life Sci. 63, 220-228 (2006).
- Gasnereau, I. Flow cytometry to sort mammalian cells in cytokinesis. Cytometry. A. 71, 1-7 (2007).
- Harper, J. V. Synchronization of cell populations in G1/S and G2/M phases of the cell cycle. Methods Mol. Biol. 296, 157-166 (2005).
- Pedrali-Noy, G. Synchronization of HeLa cell cultures by inhibition of DNA polymerase alpha with aphidicolin. Nucleic Acids Res. 8, 377-387 (1980).
- Merrill, G. F. Cell synchronization. Methods Cell Biol. 57, 229-249 (1998).
- Fleisig, H. B., Wong, J. M. Telomerase promotes efficient cell cycle kinetics and confers growth advantage to telomerase-negative transformed human cells. Oncogene. , (2011).
- Cai, D., Byth, K. F., Shapiro, G. I. AZ703, an imidazo[1,2-a]pyridine inhibitor of cyclin-dependent kinases 1 and 2, induces E2F-1-dependent apoptosis enhanced by depletion of cyclin-dependent kinase 9. Cancer Res. 66, 435-444 (2006).
- Pozarowski, P., Darzynkiewicz, Z. Analysis of cell cycle by flow cytometry. Methods Mol. Biol. 281, 301-311 (2004).
- Sherwood, S. W., Rush, D. F., Kung, A. L., Schimke, R. T. Cyclin B1 expression in HeLa S3 cells studied by flow cytometry. Exp. Cell Res. 211, 275-281 (1994).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten