Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерительная ячейка Кинетика цикла прогрессии с метаболическим Маркировка и проточной цитометрии
В этой статье
Резюме
Отслеживание тонкие изменения в прогрессии и кинетики стадии клеточного цикла может быть достигнуто путем использования сочетания метаболических маркировки нуклеиновых кислот с BrdU и общая окраска геномной ДНК с помощью йодида пропидия. Этот метод позволяет избежать химического синхронизации велосипедного клеток, тем самым предотвращая внедрение неспецифического повреждения ДНК, которые, в свою очередь влияет на прогрессию клеточного цикла.
Аннотация
Precise control of the initiation and subsequent progression through the various phases of the cell cycle are of paramount importance in proliferating cells. Cell cycle division is an integral part of growth and reproduction and deregulation of key cell cycle components have been implicated in the precipitating events of carcinogenesis 1,2. Molecular agents in anti-cancer therapies frequently target biological pathways responsible for the regulation and coordination of cell cycle division 3. Although cell cycle kinetics tend to vary according to cell type, the distribution of cells amongst the four stages of the cell cycle is rather consistent within a particular cell line due to the consistent pattern of mitogen and growth factor expression. Genotoxic events and other cellular stressors can result in a temporary block of cell cycle progression, resulting in arrest or a temporary pause in a particular cell cycle phase to allow for instigation of the appropriate response mechanism.
The ability to experimentally observe the behavior of a cell population with reference to their cell cycle progression stage is an important advance in cell biology. Common procedures such as mitotic shake off, differential centrifugation or flow cytometry-based sorting are used to isolate cells at specific stages of the cell cycle 4-6. These fractionated, cell cycle phase-enriched populations are then subjected to experimental treatments. Yield, purity and viability of the separated fractions can often be compromised using these physical separation methods. As well, the time lapse between separation of the cell populations and the start of experimental treatment, whereby the fractionated cells can progress from the selected cell cycle stage, can pose significant challenges in the successful implementation and interpretation of these experiments.
Other approaches to study cell cycle stages include the use of chemicals to synchronize cells. Treatment of cells with chemical inhibitors of key metabolic processes for each cell cycle stage are useful in blocking the progression of the cell cycle to the next stage. For example, the ribonucleotide reductase inhibitor hydroxyurea halts cells at the G1/S juncture by limiting the supply of deoxynucleotides, the building blocks of DNA. Other notable chemicals include treatment with aphidicolin, a polymerase alpha inhibitor for G1 arrest, treatment with colchicine and nocodazole, both of which interfere with mitotic spindle formation to halt cells in M phase and finally, treatment with the DNA chain terminator 5-fluorodeoxyridine to initiate S phase arrest 7-9. Treatment with these chemicals is an effective means of synchronizing an entire population of cells at a particular phase. With removal of the chemical, cells rejoin the cell cycle in unison. Treatment of the test agent following release from the cell cycle blocking chemical ensures that the drug response elicited is from a uniform, cell cycle stage-specific population. However, since many of the chemical synchronizers are known genotoxic compounds, teasing apart the participation of various response pathways (to the synchronizers vs. the test agents) is challenging.
Here we describe a metabolic labeling method for following a subpopulation of actively cycling cells through their progression from the DNA replication phase, through to the division and separation of their daughter cells. Coupled with flow cytometry quantification, this protocol enables for measurement of kinetic progression of the cell cycle in the absence of either mechanically- or chemically- induced cellular stresses commonly associated with other cell cycle synchronization methodologies 10. In the following sections we will discuss the methodology, as well as some of its applications in biomedical research.
протокол
1. Сотовые подготовка
- Пластина клетки для достижения плотности примерно на 60% слияния. Клетки должны быть в логарифмической фазе во время сбора. Для MCF7 клеток, это достигается путем посева на 5 х 10 5 клеток / 10 см пластины в соответствующих средствах массовой информации. HT29 и LS180 клетки высевают на 6 х 10 5 клеток / 6 см тарелку. Мы использовали средства массовой информации DMEM с добавлением 10% FBS и 1 пенициллина / стрептомицина. Будьте уверены, чтобы семена пластины для правильного положительного и отрицательного контроля вдополнение к вашей образцах. Они включают в себя следующее:
| я | положительный контроль | BrdU только |
| II | положительный контроль | П.И. только |
| III | Отрицательный контроль | BrdU негативный, П. отрицательный |
(Следует отметить, что предварительный эксперимент с несколькими моменты времени такой как указано в этом протоколе может быть использована, чтобы сузить временные рамки, в течение которых осуществляют будущей коллекции.)
- Покрытие клетки инкубировали при 37 ° C, 5% СО 2 в течение 24-48 ч, что позволяет клеткам восстановиться и присоединить.
- Для импульсной метки клеток бромдезоксиуридин (BrdU), DMEM заменяется шм свежей среде, содержащей 10 мкМ BrdU. Клетки инкубировали в течение 1 часа при 37 ° C, 5% CO 2, чтобы обеспечить включение BrdU в ДНК. Обязательно оставьте одну пластину необработанной в качестве отрицательного контроля.
- Импульс маркировки СМИ удаляется, а клетки промываются кратко 1X PBS.
- Свежий медиа роста добавил (минус BrdU) и клетки могут продолжать инкубацию при 37 ° C, 5% СО 2 до соответствующего timepoint для сбора урожая не будет достигнуто.
2. Сбор и фиксация
- Необработанных клетках, начиная с шага 1.3 считается нулевым timepoint. Этот пример может быть собрано вместе с 1 ч. timepoint которые собираются сразу после лечения BrdU.
- Для уборки клетки, средства массовой информации удаляется, а пластины промывают один раз 1X PBS.
- Клетки трипсином, собранные в культивировании СМИ, а затем осаждали центрифугированием при 1500 оборотов в минуту в течение 5 мин Супаernatant отбрасывается.
- Промыть 1-10 х 10 6 клеток в 5 мл ледяной 1X PBS. Центрифуга на 1500 оборотов в минуту в течение 5 мин супернатант удаляется.
- Осадок клеток затем ресуспендировали в 100 мкл ледяной PBS / 1% FBS. Добавление 1% FBS в PBS средства для предотвращения слипания клетки.
- Добавить эти клетки по капле на 5 мл -20 ° C, 70% этанолом, чтобы исправить клеток.
- Инкубировать на льду в течение 30 мин или хранить при 4 ° С в течение ночи. Это идеальный шаг, на котором заканчивается сбор образцов из различных моменты времени. Образцы можно оставить в этаноле в течение нескольких дней, что позволяет им обрабатывать одновременно через оставшуюся часть протокола.
3. BrdU и PI Окрашивание
- Гранул клеток путем центрифугирования в течение 5 мин со скоростью 1500 оборотов в минуту.
- Снимите фиксатор, но оставить ~ 50 мкл, в котором, чтобы ослабить осадок на вортексе.
- Для денатурации ДНК, медленно добавляют 1 мл 2N HCl / Triton X-100по каплям при встряхивая. Инкубируйте образцы при комнатной температуре в течение 30 мин.
- Гранул клеток путем центрифугирования образцов в течение 5 мин со скоростью 1500 оборотов в минуту. Аспирируйте и отказаться от супернатант.
- Ресуспендируйте осадок клеток в 1 мл 0,1 М тетраборат натрия, рН 8,5, для нейтрализации денатурации шаг.
- Центрифуга клеток в течение 5 мин со скоростью 1500 оборотов в минуту. Аспирируйте и отказаться от супернатант.
- Ресуспендируйте осадок клеток в 75 мкл Смесь для окрашивания BrdU (50 мкл 0,5% Твин-20/1% BSA / PBS + 20 мкл FITC сопряженных анти-BrdU + 5 мкл 10 мг / мл РНКазы).
- Инкубируйте при комнатной температуре в течение 45 минут защищенном от света месте.
- Чтобы шарик клеток, центрифуги образцов в течение 5 мин со скоростью 1500 оборотов в минуту. Аспирируйте и отказаться от супернатант.
- Ресуспендируйте осадок клеток в 1 мл PBS, содержащий 5 мкг / мл пропидия йодида.
4. Проточной цитометрии
- Для анализа клеток, проточной цитометрии оснащен лазерным 488 нм исоответствующие фильтры необходимо. Анализ программного обеспечения, таких как CellQuest необходимо создать участки описаны ниже.
- При выполнении пробы через проточной цитометрии, создать вперед рассеяния (SSC-H) в зависимости от стороны рассеяния (FSC-Н) для обеспечения правильного распределения размеров клеток (рис. 1А). Оба эти параметры приведены в линейном масштабе.
- Одновременный просмотр участка FL3-H (PI пятна) по сравнению с FL2-W (рис. 1б). Этот участок используется для создания ворота (R3) выделить долю клеток, которые находятся в пределах нормального распределения клеточного цикла. В общем, эта картина распределения характеризуется двумя скопления клеток из 2N и 4N содержание ДНК П.И. окрашивания представляет G1 и G2 фазах клеточного цикла, соответственно. Строка клеток, расположенных между этими 2 кластерами представитель текущей репликации ДНК, что происходит в фазу S клеточного цикла.
- Создать сюжет displayiнг закрытых ячеек (R3) с шагом 4.3, с FL1-H (FITC, журнал участка) по оси ординат и PI (линейный участок) на оси абсцисс (рис. 1в). Этот участок будет использоваться для установки остальных параметров использования различных элементов управления, изложенные в 1.1, а также для сбора данных для анализа.
- Поместите PI только окрашенных образцов на цитометра. Регулировка усиления разместить G1 на ~ 200 на оси абсцисс. Это будет легче представить себе в виде гистограммы сюжет PI пятно.
- Второй элемент управления включает в себя запуск BrdU только образец на проточной цитометрии. Регулировка усиления, так что 2 популяций клеток (BrdU положительные против BrdU отрицательный) появятся на участке. В идеале, BrdU негативные клетки расположены появляться чуть ниже 10 -1.
- Окончательный контроль BrdU / PI отрицательный пример. Запустите этот отрицательный контроль, чтобы клетки не появляются ни в одном из верхней или правой стороны квадранта.
- После того, параметры различных участках были установлены,проточной цитометрии откалиброван и готов к обработке BrdU и PI окрашенных клеток. Не менее 10000 клеток, которые закрытого в правильном часть PI (см. шаг 4.3) следует читать в коллекции.
- Для анализа собранных данных, программное обеспечение, такое как FlowJo или FacsDiva используются. Каждый из вышеупомянутых участков могут быть воссозданы в этих программах, а также количественные и статистический анализ выполняется.
- Конечная точка анализа включает в себя несколько последовательных шагов. Создание участка FITC против PI с ячейками закрытого в качестве ИП положительного от участка PI против FL2-W позволяет различать велосипедные населения. Вторые ворота создается из этого участка, выделяя положительные BrdU населения. Выражая это отличительная населения на гистограмме участка с ИП на оси абсцисс позволяет отслеживать время ход клеточного цикла. Это может быть дополнительно визуализируются построения число BrdU-положительных клеток в G1 или G2 содержание в зависимости от времени.
5. Представитель Результаты
Обычно велосипедные клеток, окрашенных йодистым пропидия имеют разные пики на G1 и G2, соответствующие клетки, содержащие 2N и 4N содержание ДНК, соответственно (рис. 2). Импульсный маркировки с BrdU позволяет избирательный маркировки субпопуляции клеток, активно синтезирующие ДНК (фаза, т.е. S). Вскоре после удаления реагента BrdU, все меченых клеток в S фазе (рис. 3). Ограничивая маркировки на короткий импульс человек способен следовать этому в настоящее время отдельные субпопуляции клеток по всему многочисленные моменты времени, когда они проходят через последующие этапы клеточного цикла. Это могут быть визуализированы в 1 час времени точка на рисунке 3, явный недостаток G1 и G2 пиков.
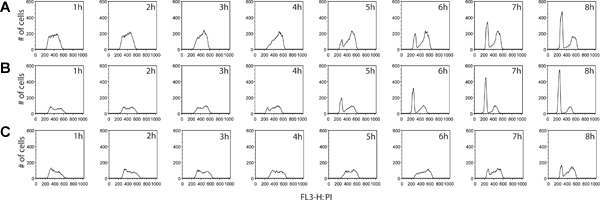
Дополнительная информация может быть получена из шаг маркировки BrdU. Мало того, что доля активно делящиеся клетки измеряется, но ЭСТimate клеточного цикла стадии распределения между двумя образцами можно определить, как хорошо. Собирая клеток одинаково промежутки времени после удаления реагента BrdU, клетки можно проследить, как они продолжают цикл, прогресс в G2 и, наконец, двигаться до клеточного деления исходной клетки, в конце концов превращается в BrdU-положительных дочерние клетки с G1 Содержание ДНК (рис. 4). Например клеточного цикла количественного этапа и кинетический анализ осуществляется на рисунке 5.
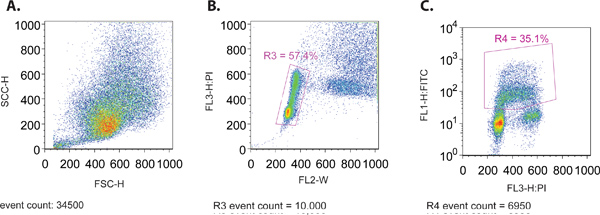
Рисунок 1. (A) вперед по сравнению с Scatter участок бокового рассеяния представителя MCF7 клеточной популяции. (B) PI по сравнению Ширина (FL-W) земельный представитель MCF7 клеточной популяции. Память показана для исключения дубликатов клетки в конечном счете (R3). Сотовые дублетов будет иметь больший импульс, чем ширина одной ячейки, так как они дольше проходить через лазерный луч и therefруды могут быть исключены из анализа. (C) PI по сравнению с FITC (BrdU) земельный представитель MCF7 клеточной популяции. Память показано, включают в себя только FITC (BrdU) положительных клеток (R4).
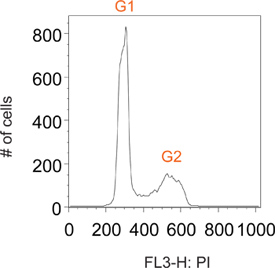
Рисунок 2. Представителю гистограмма участок общей численности населения обычно велосипеде клеток.

Рисунок 3. Гистограмма участок клетки, которые были собраны 1 час после удаления BrdU импульса, после стробирования для FITC (BrdU)-положительных клеток. BrdU-положительных клеток на ранней timepoint после удаления этикетки показать PI профилями, которые соответствуют образцы отображения содержания ДНК в соответствии с клетками, которые находятся в S-фазе клеточного цикла, подтверждающий успешное маркировки клеток только в синтезе ДНК.
 л = "Рисунок 4" />
л = "Рисунок 4" />
Рисунок 4. Сравнение клеточного цикла между кинетики раковых клеток линий колоректального рака HT29 (А) и LS180 (B), а также рак молочной железы MCF7 (C). Клетки собирали каждый час в течение 8 часов, после удаления BrdU импульса. В этом эксперименте мы наблюдали четкий профиль ускорения прогрессии клеточного цикла через G2 фазе клеточного цикла в толстой LS180 клеточной линии. Сравнение кинетики между двумя профилями клеток колоректального рака, возникновение пика G1 бросается в глаза при Т = 4 часа после BrdU в LS180 клеток, по сравнению с соответствующим моменту времени для HT-29 клеточная линия которой не хватает этого пика. По сравнению с любой из двух клеточных линий колоректального, MCF7 клетки велосипеде по значительно сниженной ставке. Нажмите здесь, чтобы увеличить рисунок .
RE 5 "/>
Рисунок 5. (А) Количественные клеточного цикла фаза анализа BrdU-меченых клеток рака. Дин / Джетта / Fox алгоритм был применен к HT29, LS180 и MCF7 (показано зеленым цветом). В результате клеточного цикла фазовых распределений из каждого образца выражается в% от общего BrdU-положительных клеток на каждом этапе. Только выбора момента времени для каждой ячейки строки отображается, так как анализы для некоторых более ранних моментов времени производится недействительными результаты. В эти ранние моменты времени, все BrdU-положительных клеток в S-фазе и, следовательно, не имеют различных G1 и G2, пики, которые необходимы для применения алгоритма. (B) Гистограммы раковых клеток показывает кинетики движения через G2 / M фазах клеточного цикла. Прогресс через G2 / M фазах быстрым для LS180 клетки, а затем и HT29 MCF7. Нажмите здесь, чтобы увеличить рисунок .
JPG "ALT =" Рисунок S1 "/>
Рисунок S1. Контроля проточной цитометрии. MCF7 клеток показано, как (А) отрицательный контроль, когда клетки не являются ни ИП, ни BrdU окрашенные. (B) PI только окрашивают. (C) BrdU-FITC помечены образцы.

Рисунок S2. Схематическое изображение, показывающие связь между флуоресцентной спектр излучения ИП по сравнению с FITC (BrdU). Спектрального окна коллекции для люминесцентных канала 1 (FL1 для FITC) и флуоресцентные канала 3 (FL3 для PI) приведены в соответствующих полях. Существует не флуорофора перекрытия спектров между FL1 и FL3 обнаружения. Очевидно, что флуоресценция компенсация не нужна, когда экспериментальные данные PI и FITC-BrdU со-меченых клеток собираются в FL1/FL3 каналов соответственно. Флуоресцентные спектры были получены с сайта BD Biosciences:целевых = "_blank"> http://www.bdbiosciences.com/research/multicolor/spectrum_viewer. Нажмите здесь, чтобы увеличить рисунок .
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Объединив проточной цитометрии с включением BrdU, у нас есть необходимые инструменты для изучения кинетики клеточного цикла. Отличительной особенностью BrdU функционировать как аналог тимидина то, что позволяет для содержания ДНК количественное велосипедные клетки. Включение BrdU в расту...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Мы благодарим Энди Джонсон из Центра биомедицинских исследований в UBC для помощи в анализе FACS. Cancer Research финансирование в Вонг лаборатории обеспечивается канадской онкологическое общество Научно-исследовательский институт (рабочее грант № 019250), а также исследований реинвестирования средств факультет фармацевтических наук, UBC. JMYW поддерживается исследований кафедр и Канады Майкл Смит Фонд исследований в области здравоохранения программ развития карьеры.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | Компания | Номер по каталогу | Комментарии |
| бромдезоксиуридин | Becton Dickinson | 55089 | |
| пропидия йодид | Сигма | 287075 | 1mg/ml акции |
| FITC анти-BrdU | Becton Dickinson | 347583 | |
| тетрабората натрия | Рыбак | S80172 | 0,1 М, рН 8,5 |
| FACS Caliber | Becton Dickinson |
Ссылки
- Musgrove, E. A., Caldon, C. E., Barraclough, J., Stone, A., Sutherland, R. L. Cyclin D as a therapeutic target in cancer. Nat. Rev. Cancer. 11, 558-572 (2011).
- Molchadsky, A., Rivlin, N., Brosh, R., Rotter, V., Sarig, R. p53 is balancing development, differentiation and de-differentiation to assure cancer prevention. Carcinogenesis. 31, 1501-1508 (2010).
- Dickson, M. A., Schwartz, G. K. Development of cell-cycle inhibitors for cancer therapy. Curr. Oncol. 16, 36-43 (2009).
- Banfalvi, G. Cell cycle synchronization of animal cells and nuclei by centrifugal elutriation. Nat. Protoc. 3, 663-673 (2008).
- van Opstal, A., Boonstra, J. Inhibitors of phosphatidylinositol 3-kinase activity prevent cell cycle progression and induce apoptosis at the M/G1 transition in CHO cells. Cell Mol. Life Sci. 63, 220-228 (2006).
- Gasnereau, I. Flow cytometry to sort mammalian cells in cytokinesis. Cytometry. A. 71, 1-7 (2007).
- Harper, J. V. Synchronization of cell populations in G1/S and G2/M phases of the cell cycle. Methods Mol. Biol. 296, 157-166 (2005).
- Pedrali-Noy, G. Synchronization of HeLa cell cultures by inhibition of DNA polymerase alpha with aphidicolin. Nucleic Acids Res. 8, 377-387 (1980).
- Merrill, G. F. Cell synchronization. Methods Cell Biol. 57, 229-249 (1998).
- Fleisig, H. B., Wong, J. M. Telomerase promotes efficient cell cycle kinetics and confers growth advantage to telomerase-negative transformed human cells. Oncogene. , (2011).
- Cai, D., Byth, K. F., Shapiro, G. I. AZ703, an imidazo[1,2-a]pyridine inhibitor of cyclin-dependent kinases 1 and 2, induces E2F-1-dependent apoptosis enhanced by depletion of cyclin-dependent kinase 9. Cancer Res. 66, 435-444 (2006).
- Pozarowski, P., Darzynkiewicz, Z. Analysis of cell cycle by flow cytometry. Methods Mol. Biol. 281, 301-311 (2004).
- Sherwood, S. W., Rush, D. F., Kung, A. L., Schimke, R. T. Cyclin B1 expression in HeLa S3 cells studied by flow cytometry. Exp. Cell Res. 211, 275-281 (1994).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены