Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Postproduction Verarbeitung von Elektrogesponnene Fasern für Tissue Engineering
In diesem Artikel
Zusammenfassung
Elektrogesponnene Gerüste können Post-Production für das Tissue Engineering-Anwendungen verarbeitet werden. Hier beschreiben wir Methoden für die Spinnerei komplexe Gerüste (durch aufeinander folgende Spinning), für die Herstellung dicker Gerüste (durch Multi-Schichtung mit Hitze und Dunst Glühen), für das Erreichen Sterilität (aseptische Produktion oder Postproduktion Sterilisation) und für die Erreichung entsprechenden biomechanischen Eigenschaften.
Zusammenfassung
Elektrospinnen ist eine häufig verwendete und vielseitige Methode, um Gerüste (oft biologisch abbaubar) für 3D-Tissue-Engineering zu produzieren. 1, 2, 3 Viele Gewebe in vivo biaxiale Dehnung unterzogen werden in unterschiedlichem Ausmaß wie Haut, Blase, Beckenboden und sogar den harten Gaumen als Kinder wachsen. Bei der Herstellung Gerüste für diese Zwecke besteht ein Bedarf an Gerüste der entsprechenden biomechanischen Eigenschaften entwickeln (ob mit oder ohne Zellen erreicht) und die steril sind für den klinischen Gebrauch. Der Schwerpunkt dieser Arbeit ist nicht, wie grundlegende Elektrospinnen Parameter (wie es umfangreiche Literatur über Elektrospinnen) zu schaffen, sondern darüber, wie gesponnenen Gerüste Postproduktion verändern, dass sie für das Tissue Engineering Zwecke passen - hier Dicke, mechanische Eigenschaften und Sterilisation (erforderlich für klinischen Einsatz) werden berücksichtigt und wird auch beschrieben, wie Zellen auf Gerüsten kultiviert werden können und einer biaxialen Dehnung zu konditionieren für spezifische Anwendungen.
Elektrospinnen neigt dazu, dünne Bleche zu produzieren, als das Elektrospinnen Sammler wird beschichtet mit isolierenden Fasern wird es ein schlechter Leiter, so dass Fasern nicht mehr Pfand drauf. Daher beschreiben wir Ansätze zur dickeren Strukturen durch Wärme oder Dampf Glühen Erhöhung der Festigkeit von Gerüsten, aber nicht notwendigerweise die Elastizität erzeugen. Sequentielle Spinnen von Gerüsten aus verschiedenen Polymeren, komplexe Gerüste zu erreichen, wird ebenfalls beschrieben. Sterilisation Methoden kann sich negativ auf die Festigkeit und Elastizität von Gerüsten. Wir vergleichen drei Methoden für deren Auswirkungen auf die biomechanischen Eigenschaften auf elektrogesponnenen Gerüste aus Polymilchsäure-co-Glykolsäure (PLGA).
Imaging von Zellen auf Gerüsten und Bewertung der Produktion der extrazellulären Matrix (ECM) Proteine von den Zellen auf Gerüsten beschrieben. Kultivierung von Zellen in vitro auf Gerüsten verbessern können Schafott Festigkeit und Elastizität, aber das Tissue Engineering literature zeigt, dass die Zellen oft nicht angemessen ECM produzieren, wenn unter statischen Bedingungen kultiviert. Es gibt nur wenige kommerzielle Systeme zur Verfügung, mit denen ein zur Kultivierung von Zellen auf Gerüsten unter dynamischen Konditionierung Regimen -. Ein Beispiel ist die Bose ElectroForce 3100, mit der eine Konditionierung Programm auf Zellen in Scaffolds statt mit mechanischen Griffe innerhalb Medien gefüllte Kammer ausüben können, werden vier Eine Annäherung an ein Budget Zellkultur-Bioreaktor für die kontrollierte Verzerrung in zwei Dimensionen beschrieben wird. Wir zeigen, dass Zellen induziert werden kann, um Elastin unter diesen Bedingungen zu produzieren. Schließlich Bewertung der biomechanischen Eigenschaften der verarbeiteten Gerüsten mit oder ohne Zellen kultiviert wird, beschrieben.
Protokoll
1. Elektrospinnen von Random und ausgerichtet Fibres
Elektrospinnen erstellt feinfaserigen Netzwerke unter Verwendung elektrisches Potential, um eine Polymerlösung zu einer geerdeten Behälter eingezogen. Sammler können in sehr vielen Formen sein und können statisch oder, häufiger, zu drehen. Das Lösungsmittel verdampft, bevor die Lösung kommt zu dem Kollektor und der Strahl in eine Faser verfestigt.
Jedes Polymer benötigt eine eigene Reihe von Bedingungen, um eine bestimmte Art von Faser zu produzieren. Die Konzentration des Polymers, des Lösungsmittels, der Abstand zwischen dem gepumpten Lösung und dem geerdeten Kollektor, wobei die Potentialdifferenz zwischen den beiden, wird die Geschwindigkeit des rotierenden Kollektor, der Strömungsgeschwindigkeit, Temperatur und Feuchtigkeit beeinflussen alle Elektrospinnen. Es gibt viele Studien, die das Auswahl Elektrospinnen Parameter und wie diese Auswirkungen auf den Stützgerüsten hergestellt (zB Faserdurchmesser, Morphologie und Ausrichtung). 5, 6, 7, 8In diesen Experimenten Gerüste wurden basierend auf den Bedingungen in unseren früheren Studien ausgewählt gesponnen. 2, 9
Die folgenden Verfahren sind für die Herstellung von elektrogesponnenen Gerüste aus PLGA, Polymilchsäure (PLA), Poly ε-Caprolacton (PCL) und Poly hydroxybutyrat-co-hydroxyvalerat (PHBV) mit einer rotierenden Kollektor wie in 1 gezeigt. Während das Lösungsmittel Dichlormethan (DCM) verwendet wird. Die Methode hier produziert mikrofibröse PLGA, PLA und PCL und nanofibrous PHBV Gerüst mit mikro-kleinen Kügelchen ("Perlenkette" Morphologie).
- Bestreichen Sie die rotierenden Dorn Sammler mit Alu-Folie, mit der polierten / glänzenden Seite nach außen zeigt. Unsere Dorn betrug 20 cm breit und 10 cm im Durchmesser.
- Planen Polymerlösungen, PLA, PCL und PHBV sind, werden als 10 Gew.% ige Lösung in DCM hergestellt. PLGA wird als 20 Gew.% ige Lösung in DCM hergestellt.
- Platz 4 Spritzen von 5 ml Volumen auf einer Spritzenpumpe. Spritzen werden bis c geladenontain 5 ml des Polymers jede, so dass insgesamt 20 ml.
- Für PLA, verwenden PCL und PHBV eine Fließgeschwindigkeit von 40 μLmin -1 pro Spritze.
- Für PLGA verwenden eine Fließgeschwindigkeit von 30 μLmin -1 pro Spritze.
- Für PLA, verwenden Sie PCL-und PLGA einen Arbeitsabstand von 17 cm von Nadelspitze zu Dorn.
- Für PHBV mit einem Arbeitsabstand von 10 cm von Nadelspitze zu Dorn.
- Laden Sie die Spritze Nadeln zu 17.000 V (P 73030, Genvolt, Shropshire, UK) und Elektrospinnen aus dem entsprechenden Abstand auf die Aluminiumfolie beschichtete Dorn.
- Für Wirrfasern drehen Sie den Dorn bei 200 Umdrehungen pro Minute.
- Für ausgerichteten Fasern drehen Sie den Dorn bei 1000 Umdrehungen pro Minute.
- Gerüste können auf der Aluminiumfolie unter trockenen Bedingungen gelagert werden. Empfohlene Lagerung in einem verschlossenen Behälter bei 4 ° C in Gegenwart eines Trocknungsmittels. Nach unserer Erfahrung Gerüste bleiben für mindestens 4 Monate (ggf. länger) unter diesen Bedingungen stabil (wir sind nicht bekannt, dass published Studien über die langfristige Lagerung Bedingungen für Gerüste).
2. Herstellung von komplexen Gerüste von Sequential Spinning
Sequential Spinnerei stellt ein Verfahren zur Kombination der Eigenschaften von verschiedenen Materialien, um ein Material, das das Beste aus beiden Eigenschaften zu erstellen. PHBV ergibt sich eine flache, dichte, brüchige Blatt während PLA-oder PCL-Spinnerei produziert niedriger Dichte elastischen Platten. Beide Materialien unterstützen Zelladhäsion. Nachfolgend Spinnen dieser Materialien ergibt eine dichte Zell-undurchlässige Membran, die elastisch ist.
- Richten Sie das Elektrospinnen rig gemäß Abschnitt 1, mit PHBV Spinnbedingungen.
- Elektrospinnen PHBV wie oben.
- Ohne den Aluminiumfolie, Elektrospinnen ein zweites Polymer auf unter Benutzung der Parameter und normalen Bedingungen für dieses Polymer (zB 17 cm, um die Nadel Trommel, 17000 V, 200 UpM für PLA). Diese Additiv-Verfahren baut sich eine doppelte Schicht von Gerüst Herstellung einer Doppelschicht.
3. Herstellung von mehrschichtigen Gerüste durch Glühen Mehrere Schichten zusammen
- Gerüste können durch die Verwendung von Wärme Glühen mehrschichtig sein. Um diese 4 Blätter von PLGA auf übereinander gelegt zu tun und dann bei 60 ° C für 3 Stunden geglüht Wärme.
- Gerüste können auch durch Dampf Glühen geglüht werden. Hier 4 Blätter von PLGA werden übereinander gelegt und suspendiert 2 cm über einen Pool von DCM (10 ml) für 1 Stunde. Dies ist in einem verschlossenen Behälter bei Raumtemperatur durchgeführt.
4. Aseptische Produktion und Postproduktion Sterilisation von Elektrogesponnene Gerüste
- Aseptische Produktion Gerüst kann durch Elektrospinnen in einer aseptischen Umgebung einer sterilen Werkbank in einer Reinraum-Umgebung erreicht werden. Um dies zu tun dies entweder steril Polymere für medizinische Zwecke oder Polymere durch Inkubation in DCM sterilisiert verwendet werden können. Einmal gelöst, sind Polymere, auf sterile Folie eingewickelt um als elektroversponnenterilised Dorn. Gerüste werden dann behandelt aseptisch. Sterilität wird durch Inkubation von Proben des Gerüsts in Antibiotika-freien Nährmedien für die entsprechende Zeit verifiziert.
- Für Ethanol Desinfektion (dies ist der Einsatz experimentell aber nicht eine anerkannte Methode zur Sterilisation, die in die Klinik getroffen werden können) werden kurz Gerüste (15 Min.) in einer 70% v / v Lösung von Ethanol in destilliertes Wasser gegeben. Für die praktische experimentelle Zwecke ist dies in der Regel ausreichend, um Gerüste desinfizieren, so dass sie dann erfolgreich mit kultivierten Zellen kombiniert werden.
- Für Peressigsäure Gerüste werden in Peressigsäure eingetaucht (0,1% v / v in Phosphat-gepufferter Salzlösung (PBS)) resuspendiert und für 3 Stunden bei Raumtemperatur wie in Selim et al. 9
- Für Gamma-Sterilisation Gerüsten mit einer Dosis von 3 kGy bestrahlt mit einer Cäsium-Quelle nach Selim et al. 9
5. Biomechanischen Tests von Gerüsten
- Gerüste werden in Rechtecke geschnitten 5 mm x 20 mm, für Dicke mit einem Mikrometer, gemessen und in ein Bose ElectroForce 3100 Instrument. Diese Maschine eine Kraft von 0-22 N bis zu einer Verschiebung von 6 mm und Rollen die Last gegen die Verschiebung als eine Spannungs / Dehnungs-Kurve. Dies ermöglicht der Young-Modul und Elastizität zu berechnen.
6. Visualisierung Cells auf Gerüsten und Beurteilung der ECM-Produktion
Die Zellen können mit lebenswichtigen Fluoreszenzfarbstoffe, die man Zellen auf den Gerüsten sehen, wie sie zu befestigen, migrieren und proliferieren können gefärbt werden. Beitrag Kultur das Vorliegen von Zellen auf Gerüsten kann durch Färbung Zellkerne mit 4 ',6-Diamidino-2-phenylindol-dihydrochlorid (DAPI) bestimmt werden. Die Herstellung von ECM von Zellen auf dem Gerüst kann durch Anfärben der Zellen für eine Reihe von ECM-Proteine, einschließlich Elastin wie in diesem Beispiel gezeigt, beurteilt werden. Alle Gerüste wurden verwendet, gemessen, um eine müssenDicke von mindestens 0,2 mm und in Quadrate schneiden 1,5 cm x 1,5 cm vor der Aussaat.
In diesen Studien menschlichen Hautfibroblasten werden während wegen der Rolle, die sie in die Rekonstruktion von Weichteilen unserem Labor das primäre Forschungsinteresse gilt eingesetzt.
Die Zellen werden aus Hautproben von Patienten nach elektiven Chirurgie für eine Brustverkleinerung oder Bauchstraffung (Zustimmung wurde für ihre Gewebe gegeben, um für die Forschung verwendet werden) erhalten. Gewebe werden anonym erhoben und verwendet unter Forschung Tissue Bank Licence 12179. Die Gewebe werden mit PBS, enthaltend Streptomycin (0,1 mg / ml) und Penicillin (100 IU / ml) und Amphotericin B (0,5 g / ml) gewaschen. Gewebeproben werden in 0,1% w / v Trypsin und 0,1% Glucose in PBS (12-18 Stunden, 4 ° C) inkubiert. Die Dermis ist abgezogen, zerkleinert fein und mit 10 ml Collagenase (0,5% w / v in DMEM und 10% FCS, 37 ° C für 18 Stunden). Die Zentrifugation der resultierenden Zelle suspensIonen (400 g für 10 Minuten), produziert ein Pellet von Zellen, die kultiviert und subkultiviert in DMEM kann ergänzt mit fötalem Kälberserum (FCS, 10% v / v), Streptomycin (0,1 mg / ml), Penicillin (100 IU / ml) und Amphotericin B (0,5 ug / ml). Nur Fibroblasten der Passage 4-9 werden in Experimenten verwendet.
- Humane dermale Fibroblasten, einmal in einer konfluenten T75 (EasyFlask, Nunc, New York, USA) durch Zugabe von Trypsin / EDTA (5 ml, 5 mg / ml Trypsin, 2 mg / ml EDTA in Kochsalzlösung) ausgesät, Inkubation für 5 Minuten bei 37 ° C Die Suspension wird für 10 Minuten (150 g) zentrifugiert. Die Zellen werden in 5 ml DMEM (ergänzt mit FCS (10% v / v), Streptomycin (0,1 mg / ml), Penicillin (100 IU / ml) und Amphotericin B (0,5 g / ml)) resuspendiert und gezählt unter Verwendung eines Hämocytometers, und die Konzentration zum Impfen eingestellt. Die Zellen werden in der Regel mit 50.000 Zellen pro Vertiefung ausgesät.
- Falls erforderlich, vor der Aussaat Zellen auf dem Gerüst können die Zellen sein voretikettierten mit CellTracker rot oder grün. Die Zelles werden mit 3 × 5 ml PBS gewaschen. Eine Lösung von 10 mM CellTracker in serumfreiem, Zell-gegebenenfalls Medium (10 ml) wird zugegeben und die Zellen werden für 45 Minuten inkubiert bei 37 ° C Nach der Inkubation werden die Zellen in 3 × 5 ml PBS, die sie auf folgenden Gerüsten ausgesät gewaschen. Danach wird die Oberfläche der Gerüste in einem Axon ImageExpress Mikroskop (Molecular Devices, Sunnyvale, USA) bei 570 nm λex abgebildet werden kann - λem 620 nm (CellTracker rot) und 480 nm λex - λem 533 nm (CellTracker grün). Um das Eindringen von Zellen tiefer in ein Gerüste Multiphotonen konfokalen Mikroskop verwendet werden können untersuchen. Dies kann erreicht etwa 200 Mikron Eindringen in den meisten Gerüsten mit oder ohne Zellen.
- Stellen Sie Kultur Proben werden in 1 ml 3,7% Formaldehyd in PBS bei 37 ° C für 20 Minuten fixiert und dann mit 3 × 1 ml PBS gewaschen.
- 200 ul Elastin primäre Antikörper zu jeder Probe zugegeben (5% v / v in PBS, Kaninchen-Anti-Human-alpha elasZinn, AbDserotec, Kidlington, UK) und bei 37 ° C für 30 Minuten inkubiert.
- Die Proben werden mit 3 × 1 ml PBS gewaschen und dann in eine Lösung von sekundärem Antikörper (0,5% v / v Ziegen-Anti-Kaninchen-IgG (FC): FITC) inkubiert in PBS enthaltenden DAPI (1 ug / ml) für 30 Minuten.
- Anschließend werden die Proben mit 3 × 1 ml PBS gewaschen.
- Λem 460 nm für DAPI und 480 nm λex - - λem 533 nm für den sekundären Antikörper DAPI und sekundären Antikörper gefärbten Proben werden dann auf einer Axon ImageExpress Fluoreszenzmikroskop, λex 365 nm belichtet. DAPI färbt die Kerne und ermöglicht es, die Verteilung der Zellen innerhalb der Fasern sehr gut zu sehen.
7. Unterziehen Cells auf Gerüsten zu Biaxiale Dynamische Konditionierung
Um die Wirkung der dynamischen Konditionierung auf Fibroblasten ECM-Produktion zu untersuchen, entwickelten wir eine einfache Proof-of-Concept-Bioreaktor, dies zu erforschen.
- Montieren Ballon und FlutRegelvorrichtung und bereiten Systems, damit es leicht in ein steriles Gefäß für die Zellkultur gebracht werden, sobald es beschichtet wird.
- Autoklav wobei die Vorrichtung des Ballons (122 ° C, 220 mbar für 1 Stunde). Wir können bestätigen, dass Ballons überleben, ohne Beeinträchtigung ihrer Funktion durch Aufblasen und Entleeren sie wiederholt Autoklavieren.
- In einem Reinraum, packen Sie das Gerät in einer sterilen Werkbank in der Lage, elektrospinnbarer auf.
- Den Ballon auf die erforderliche Fläche (Sie erinnern sich der Ballon muss noch in die Kultur Gefäß passen) mit Phosphat-gepufferte Kochsalzlösung und verbinden Sie das PBS zu einer elektrischen Erde an einem Punkt in dem Gerät, das nicht braucht steril sein (Abzweigrohr auf 3-Wege-Hahn).
- Elektrospinnen die erforderliche Polymer auf den Ballon mit den normalen Spinnbedingungen, mit einem Arbeitsabstand von 10 cm. Lassen Sie das Gerüst für 1 Stunde trocknen lassen. Die "nassen" Fasern sind "klebrig" genug, um an der Brandung haltenAss des Ballons ohne anschließend Abnehmen.
- Setzen Sie den Ballon in ein steriles Gefäß und transportieren sie zu einer Sterilbank für Zellkulturen.
- Entfernen des Ballons aus dem Behälter und auf ein sterile Oberfläche (Petrischale) und wiederholt (alle 20 Sekunden) pipettieren Zellsuspension (1 × 10 6 Zellen in 5 ml DMEM) auf dem beschichteten Ballon für 20 Minuten, um zu versuchen zu verteilen Zellen gleichmäßig über die Oberfläche.
- Legen Ballon in dem Kulturgefäß, und geben vorgewärmten geeignete Medien für den Zelltyp.
- Schließen Sie das Gerät an die Inflation eine Spritzenpumpe (Kent Scientific, Genie Plus, Connecticut, USA) und aufblasen / die Luft aus dem Ballon als erforderlich, um biaxiale Dehnung zu geben. Computergesteuertes Spritzenpumpe verwendet werden, um eine komplexere Ausdehnung Regelung zu erreichen.
8. Repräsentative Ergebnisse
Die folgenden Zahlen sind repräsentativ für Ergebnisse, die erwartet werden kannwenn die obigen Verfahren befolgt werden.
Elektrospinnen genutzt werden können, Gerüsten mit zufälligen und geordnete Architekturen (1) verwendet werden, ist das wiederholbare und die Fasern einheitlich sind. Viele Arten von Polymeren mit Eigenschaften, die sehr unterschiedlich, wie in 2 für PHBV, PLA oder PCL nachgewiesen werden kann elektroversponnen werden. Elektrospinnen produzieren kann Licht flauschige Gerüsten oder dichtes undurchdringliches Zelle Membranen (siehe Abbildung 3). Alle hier dargestellt Gerüsten erleichtert die Zellanheftung und-proliferation. Frühere Arbeiten haben gezeigt, dass Zellen durch diesen Gerüsten bis zu einer Tiefe von mindestens 500 bis 600 um migrieren 9 Für PLA der durchschnittliche Faserdurchmesser ist 3 um;. Für PHBV ist 0,3 um mit Perlen im Bereich von 5-20 um, für PCL ist es 3 um, und es ist für PLGA 11 um. Andere Studien unter Verwendung anderer Lösungsmittel-Systeme berichten, dass PHBV kann elektrogesponnenen als Fasern sein, ohne Perlen oder Polymer-Perlen. 10,11
Wenn dicker Gerüste benötigt werden Dampf und Hitze Glühen eingesetzt werden, um Schichten von Gerüsten zusammen Glühen werden (siehe Abbildung 4). Diese Gerüst Schichten nicht delaminiert und es kann sehr schwierig sein, um den Übergang zwischen den Schichten zu finden.
Wir zeigen, dass Doppelschicht-Membranen hergestellt werden, wo die Zellen A und B jeweils auf einer separaten Membran ohne Vermischung, wie in 5 gezeigt, kultiviert werden. Hier zeigen wir dies durch den Einsatz menschlichen Hautfibroblasten farbig mit zwei verschiedenen fluoreszierenden Farbstoffen Zelle Tracker. Eine solche Bilayer-Membran würde nützlich sein, wenn das Kultivieren von Zellen, um eine harte Gewebe, wie Knochen oder Knorpel auf der einen Seite aus Zellen entwickelt, um eine weiche Form abgetrennt (und in der Regel schneller wachsenden) Gewebe auf der anderen Seite, wie Gaumenspalte oder rekonstruktive parodontalen bilden Chirurgie. 12, 13
Im Hinblick auf die Auswirkungen der Sterilisation auf elektrogesponnenen Gerüste haben wirbereits berichtet, dass das Verfahren der Sterilisation Auswirkungen auf das Gerüst und anschließende Zellkultur. 9 Diese in 6 dargestellt, die zeigt die Effekte von Peressigsäure, Gamma-Bestrahlung und Ethanol auf den Faserdurchmesser und Zugfestigkeit und der Elastizitätsmodul eines PLGA Gerüst .
Gamma-Bestrahlung hat keinen signifikanten Effekt auf Faserdurchmesser während Peressigsäure und Ethanol zu reduzieren Faserdurchmesser von ca. 50%. In Bezug auf Reißfestigkeit jeder der Methoden der Sterilisation verändert die Zugfestigkeit und die Elastizität der Gerüste. Kultur von Zellen auf diesen Gerüsten weiter verringert die Zugfestigkeit, aber erhöht die Elastizität.
Schließlich wird ein Verfahren zum Testen der Wirkung der dynamischen biaxiale Dehnung auf Zellen auf Gerüsten elektrogesponnenen kultiviert dargestellt. Dieser Proof-of-Concept-Ansatz zeigt, dass die Zellen lebensfähig bleiben während der dynamischenDehnung, sondern auch zu produzieren erhöhte Mengen an Elastin unter diesen Bedingungen. Dies steht in starkem Kontrast zu dem Mangel an Elastin, wenn die gleichen Zellen auf dem gleichen Gerüst unter statischen Bedingungen eingehalten werden (siehe Abbildung 7).
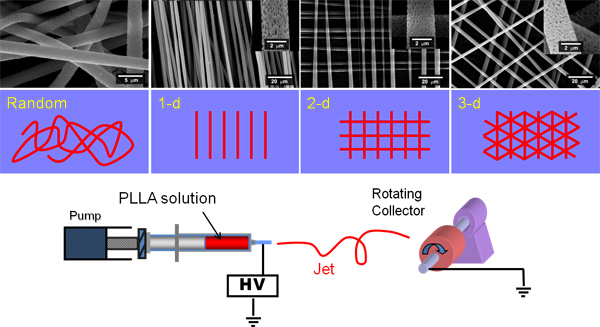
Abbildung 1. Zeigt eine Karikatur eines Elektrospinnen Rigg und der Spinnerei von zufälligen und parallelen Fasern und dann Schichten von Fasern über einander gelegt. Senkrecht Fasern können durch Elektrospinnen einen Satz von ausgerichteten Fasern auf eine Aluminiumfolie, Drehen der Folie um 90 ° und dann sofort Elektrospinnen eines zweiten Satzes von ausgerichteten Fasern oben auf diesen angelegt werden.

Abbildung 2. Zeigt die Morphologie der zufälligen elektrogesponnenen Matten aus (A) PLA (Maßstab ist 100 Mikrometer), (B) PHBV (Maßstab ist 100 Mikrometer), (C) PCL (Maßstab ist 100 um) und (D) PLGA (Maßstab ist 200 um). Beachten Sie, dass PLA-, PCL-und PLGA alle mikrofibröse einheitliche Gerüste sind. PHBV wird als "Perlenkette" mit Nanofasern Anschluss um 20.05 kleinen Kügelchen gedreht. Klicken Sie hier für eine größere Abbildung anzuzeigen .

3. Herstellung eines mehrschichtigen Gerüst. Hier werden die Gerüste werden zunächst mit PHBV gesponnen und dann Spritzen mit PLA-oder PCL-gefüllt werden. Diese werden auf der Oberseite des PHBV Gerüst gesponnen. Die Abbildung zeigt die Darstellung dieser vielschichtigen Gerüste, (a) eine einzige Schicht PHBV, (B) einen Querschnitt eines PHBV-PLA-Doppelschicht, die die dichte nanofibrous, 'Perlenkette' PHBV Schicht (links) und offenere mikrofibröse PLA Schicht (rechts) und (C) Eine einzelne Schicht PLA.nk "> Klicken Sie hier für eine größere Abbildung zu sehen.
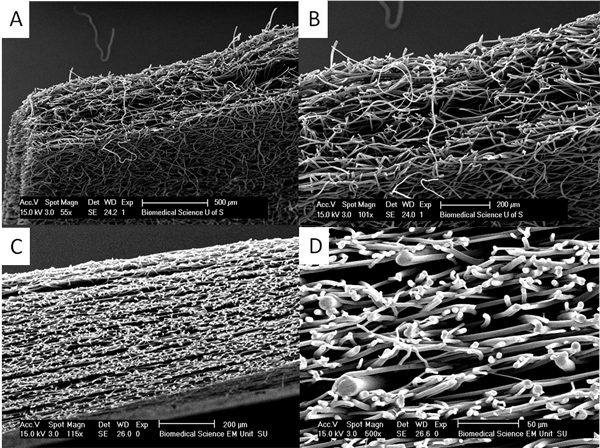
Abbildung 4. Dickere Gerüste können durch Hitze und Dampf Glühen Glühen hergestellt werden. (A) und (B) zeigen einen Schnitt durch eine Dampf angelassen PLA Schafott, wo anfängliche faserigen Gerüste von etwa 150 um zusammen sind und platziert Dichlormethandämpfe wird verwendet, um viel dicker Gerüste von bis zu 500 pm zu machen. In (C) und (D) kann man sehen, dass das Gerüst aus Schichten von viel dicker Fasern mit Schichten dünnere Fasern durch Hitze Glühen Schichten von dünnen und dicken Fasern zusammen erstellt durchsetzt besteht. Dieser Ansatz kann verwendet werden, um Gerüste von komplexen mechanischen Eigenschaften herzustellen. Klicken Sie hier für eine größere Abbildung anzuzeigen .
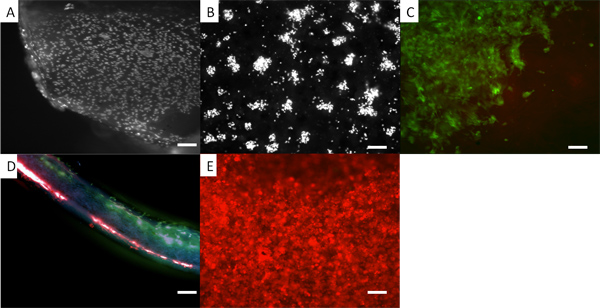
Fi gur 5. Aussehen der Zellen auf einem Gerüst Doppelschicht. In allen Fällen werden die Zellen vorhanden sind humanen dermalen Fibroblasten. (A) Fibroblasten auf elektrogesponnenen PLA, wo die Zellen fixiert und mit DAPI gefärbt. (B) DAPI gefärbten Zellen auf PHBV. In (C) die Fibroblasten sind pre-gebeizt mit einem vitalen Farbstoff, CellTracker grün, und Sie können das Aussehen von ihnen auf der PLA-Seite der Doppelschicht zu sehen. (D) einen Schnitt durch die Doppelschicht mit rot fluoreszierenden Fibroblasten auf der unteren Oberfläche und PHBV grün fluoreszierenden Fibroblasten auf der oberen Oberfläche PLA. (E) Fibroblasten Pre-gefärbt mit CellTracker rot auf der Oberfläche PHBV gewachsen. Die Verwendung von vitalem Fluoreszenzfarbstoffe bietet eine bequeme Methode zur Betrachtung der Verteilung von Zellen auf dem Gerüst, während die Zellen noch wachsen. Man kann routinemäßig nutzen diese Farbstoffe für mindestens 7 Tage. Doch die Konzentration des Farbstoffs wird verdünnt, da die Zellen teilen. Maßstabsbalken gleich 0,1 mm.
g6.jpg "alt =" Bild 6 "/>
Abbildung 6. Biomechanischen Eigenschaften elektrogesponnenen Gerüst werden unter Verwendung eines Bose ElectroForce Tensiometer Gerät (A). (B) Spannung / Dehnungs-Kurven von PLGA Gerüste durch Gamma-Bestrahlung, Alkohol, Peressigsäure oder aseptisch hergestellt sterilisiert. Die Zugfestigkeit (UTS), an dem die Faser unterworfen, bevor es bricht die Zugbruchdehnung und der Young-Modul werden: Drei Messungen können von einem solchen Graphen erhalten werden. Letztere gibt einen Hinweis auf die Elastizität des Gerüsts. (C) Die Wirkung der einzelnen Sterilisationsverfahren auf PLGA Faserdurchmesser in mu m. Jede Sterilisation Methodik verringert UTS. Sowohl Peressigsäure und Gamma-Bestrahlung reduzieren den Elastizitätsmodul zu einer etwas elastische Gerüst, macht Alkohol das Gerüst besonders spröde. Klicken Sie hier für eine größere Abbildung anzuzeigen .

7. Diese Figur zeigt die Verwendung eines einfachen Ballon eines biaxialen, auf dem Bioreaktor Gerüsten (und Zellen, die innerhalb der Stützgerüste) einer biaxialen Dehnung für Zeiträume unterzogen werden kann, bereitzustellen. (A) einer entleerten Ballon auf dem elektrogesponnenen Fasern, PHBV, hinterlegt worden. Zu diesem Zeitpunkt wird der Ballon teilweise mit Fasern bedeckt ist. (B) Ein Ballon vollständig mit PHBV und PLA-Fasern beschichtet. (C) eine Zellsuspension wird wiederholt auf den Ballon pipettiert. (D) ein Ballon, der in einer Flasche steriles Medium, wo der Ballon mit einer Spritzenpumpe und PBS (verwendet als leitenden Elektrolyten) verbunden angeordnet wird verwendet, um leicht aufzublasen und zu ermöglichen Entleeren des Ballons gegen einen programmierten Zeitplan. (E) Zellen auf Gerüsten aus dem Ballon am Ende des Experiments und Analysemethoden für die Lebensfähigkeit der Zellen wie in durchgeführt entfernt (F), wo lebensfähige Zellen eine dunkelblaue Farbe zu entwickeln Verwendung der metabolischen indicator 3 - (4,5-Dimethylthiazol-2-yl) -2,5-diphenyltetrazoliumbromid. (G) zeigt, dass die Zellen (blau) auf dieser Ballon und vorbehaltlich der biaxialen Dehnung entwickeln Elastinfasern (grün, gebeizt mit Elastin-spezifischen Antikörpern) kultiviert, während die gleichen Zellen auf einem identischen Gerüst (H) unter statischen Bedingungen kultiviert vernachlässigbar Elastin-Produktion haben . Maßstabsbalken gleich 0,025 mm.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Elektrospinnen ist eine sehr beliebte Technik zur Herstellung von Scaffolds für das Tissue Engineering. 14, 15, 16 Während es relativ einfach ist es, grundlegende elektrogesponnenen Gerüste für experimentelle Zwecke produzieren die Technik ist auch komplex und vielschichtig mit vielen Variablen. 6 Es gibt viele Studien beschreiben, wie die Elektrospinnen Parameter bestimmen das Gerüst hergestellt. In dieser Studie liegt der Fokus auf die großen Herausforderungen der Postproduktion auf Gerüst...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken BBSRC für die Finanzierung einer Promotion für Herrn Frazer Bye.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Polymilchsäure-co-Glykolsäure | Sigma Aldrich | ||
| Polymilchsäure | Sigma Aldrich | 81273 | Die inhärente Viskosität ~ 2.0dl / g |
| Poly ε-Caprolacton | Sigma Aldrich | ||
| Poly hydroxybutyrat-co-hydroxyvalerat 00.01 | Goodfellow | 578-446-59 | PHB88/PHV12 |
| Dichlormethan | Sigma Aldrich oder Fisher | 270997 oder D/1850/17 | > 99,8% enthält 50-150ppm Amylen Stabilisator |
| 50 Luftballons bunt | Wilkinson-Baumärkte GmbH | 0105790 | |
| Ziege anti-Kaninchen-IgG (FC): FITC | AbDserotec | STAR121F | |
| Kaninchen anti-human alpha Elastin | AbDserotec | 4060-1060 | |
| Schraubkappe GL45 PP 2-Port, PK / 2 | SLS | 1129750 | |
| 4 ',6-Diamidino-2-phenylindoldihydrochlorid | Sigma Aldrich | 32670 | |
| CellTracker grün CMFDA | Invitrogen | C7025 | |
| CellTracker rot CMTX | Invitrogen | C34552 |
Referenzen
- Canton, I., McKean, R., Charnley, M., Blackwood, K., Fiorica, C., Ryan, A., MacNeil, S. Development of an Ibuprofen-releasing biodegradable PLA/PGA electrospun scaffold for tissue regeneration. Biotechnology and bioengineering. 105, 396-408 (2010).
- Blackwood, K., McKean, R., Canton, I., Freeman, C., Franklin, K., Cole, A., Brook, I., Farthing, P., Rimmer, S., Haycock, J., Ryan, A., MacNeil, S. Development of biodegradable electrospun scaffolds for dermal replacement. Biomaterials. 29, 3091-3104 (2008).
- Yang, F., Maurugan, R., Wang, S., Ramakrishna, S. Electrospinning of nano/micro scale poly(L-lactic acid) aligned fibers and their potential in neural tissue engineering. Biomaterials. 26, 2603-2610 (2005).
- Sittichokechaiwut, A., Edwards, J. H., Scutt, A. M., Reilly, G. C. Short bouts of mechanical loading are as effective as dexamethasone at inducing matrix production by human bone marrow mesenchymal stem cell. Eur. Cell Mater. 20, 45-57 (2010).
- Sill, T. J., von Recum, H. A. Electrospinning: applications in drug delivery and tissue engineering. Biomaterials. 29 (13), 1989-2006 (2008).
- Deitzel, J., Kleinmeyer, J., Harris, D., Beck Tan, N. C. The effect of processing variables on the morphology of electrospun nanofibers and textiles. Polymer. 42, 261-272 (2001).
- Fridrikh, S., Yu, J., Brenner, M., Rutledge, G. Controlling the fiber diameter during electrospinning. Physical review letters. 90, 1-4 (2003).
- Fong, H., Chun, I., Reneker, D. Beaded nanofibers formed during electrospinning. Polymer. 40 (16), 4585-4592 (1999).
- Selim, M., Bullock, A. J., Blackwood, K. A., Chapple, C. R., MacNeil, S. Developing biodegradable scaffolds for tissue engineering of the urethra. BJU Int. 107 (2), 296-302 (2010).
- Tong, H. -W., Wang, M. An investigation into the influence of electrospinning parameters on the diameter and alignment of poly(hydroxybutyrate-co-hydroxyvalerate) fibers. Journal of Applied Polymer Science. 120 (3), 1694-1706 (2011).
- Tong, H. -W., Wang, M. Electrospinning of poly(hydroxybutyrate-co-hydroxyvalerate) fibrous tissue engineering scaffolds in two different electric fields. Polymer Engineering & Science. 51 (7), 1325-1338 (2011).
- Retzepi, M., Donos, N. Guided Bone Regeneration: biological principle and therapeutic applications. Clinical oral implants research. 21, 567-576 (2010).
- Moreau, J., Caccamese, J., Coletti, D., Sauk, J., Fisher, J. Tissue engineering solutions for cleft palates. Journal of oral maxillofacial. 65, 2503-2511 (2007).
- Yang, F., Both, S., Yang, X., Walboomers, X., Jansen, J. Development of an electrospun nano-apatite/PCL composite membrane for GTR/GBR application. Acta biomaterialia. 5, 3295-3304 (2009).
- Yoshimoto, H., Shin, Y., Terai, H., Vacanti, J. A biodegradable nanofiber scaffold by electrospinning and its potential for bone tissue engineering. Biomaterials. 24, 2077-2082 (2003).
- Telemeco, T., Ayres, C., Bowlin, G., Wnek, G., Boland, E., Cohen, N., Baumgarten, C., Mathews, J., Simpson, D. Regulation of cellular infiltration into tissue engineering scaffolds composed of submicron diameter fibrils produced by electrospinning. Acta biomaterialia. 1, 377-385 (2005).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten