Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Озвучка обработка волокна Electrospun для тканевой инженерии
В этой статье
Резюме
Electrospun леса могут быть обработаны пост-продакшн для применения тканевой инженерии. Здесь мы опишем методы для прядения комплекс лесов (последовательным спиннинг), для изготовления толстых лесов (на несколько слоев с использованием тепла или пара, отжиг), для достижения стерильности (асептического производства или производства стерилизации должности) и для достижения соответствующих биомеханические свойства.
Аннотация
Electrospinning is a commonly used and versatile method to produce scaffolds (often biodegradable) for 3D tissue engineering.1, 2, 3 Many tissues in vivo undergo biaxial distension to varying extents such as skin, bladder, pelvic floor and even the hard palate as children grow. In producing scaffolds for these purposes there is a need to develop scaffolds of appropriate biomechanical properties (whether achieved without or with cells) and which are sterile for clinical use. The focus of this paper is not how to establish basic electrospinning parameters (as there is extensive literature on electrospinning) but on how to modify spun scaffolds post production to make them fit for tissue engineering purposes - here thickness, mechanical properties and sterilisation (required for clinical use) are considered and we also describe how cells can be cultured on scaffolds and subjected to biaxial strain to condition them for specific applications.
Electrospinning tends to produce thin sheets; as the electrospinning collector becomes coated with insulating fibres it becomes a poor conductor such that fibres no longer deposit on it. Hence we describe approaches to produce thicker structures by heat or vapour annealing increasing the strength of scaffolds but not necessarily the elasticity. Sequential spinning of scaffolds of different polymers to achieve complex scaffolds is also described. Sterilisation methodologies can adversely affect strength and elasticity of scaffolds. We compare three methods for their effects on the biomechanical properties on electrospun scaffolds of poly lactic-co-glycolic acid (PLGA).
Imaging of cells on scaffolds and assessment of production of extracellular matrix (ECM) proteins by cells on scaffolds is described. Culturing cells on scaffolds in vitro can improve scaffold strength and elasticity but the tissue engineering literature shows that cells often fail to produce appropriate ECM when cultured under static conditions. There are few commercial systems available that allow one to culture cells on scaffolds under dynamic conditioning regimes - one example is the Bose Electroforce 3100 which can be used to exert a conditioning programme on cells in scaffolds held using mechanical grips within a media filled chamber.4 An approach to a budget cell culture bioreactor for controlled distortion in 2 dimensions is described. We show that cells can be induced to produce elastin under these conditions. Finally assessment of the biomechanical properties of processed scaffolds cultured with or without cells is described.
протокол
1. Электропрядения случайных и неприсоединения волокна
Электропрядения создает тонкий волокнистый сети с помощью электрического потенциала сделать раствор полимера к заземленным коллектором. Коллекторы могут находиться в очень многих формах и могут быть статическими или, чаще, вращается. Растворитель испаряется до решения поступает в коллектор и струи застывает в волокно.
Каждый полимер требуется свой набор условий для производства данного вида волокна. Концентрация полимера, растворителя, расстояние между перекачиваемой решения и заземленным коллектором, разность потенциалов между ними, скорость коллектора вращения, расхода, температуры и влажности будет влиять на все электропрядения. Есть много исследований, описывающих выбор электропрядения параметры и как они влияют на строительные леса производства (например, диаметр волокна, морфологии и ориентации). 5, 6, 7, 8В этих экспериментах леса были выделены на основе выбранных условий в наших предыдущих исследований. 2, 9
Следующие методы предназначены для производства electrospun леса из PLGA, поли молочной кислоты (PLA), поли-ε капролактона (PCL) и поли гидроксибутират-со-hydroxyvalerate (PHBV) с помощью вращающегося коллектора, как показано на рисунке 1. На протяжении растворителя дихлорметан (DCM) не используется. Метод здесь производит microfibrous PLGA, PLA и PCL и nanofibrous PHBV эшафот с микро бисером (морфология "жемчужное ожерелье").
- Пальто вращающиеся оправки коллектор с алюминиевой фольгой, с полированной / блестящей стороной наружу. Наши оправки был 20 см в ширину и 10 см в диаметре.
- Подготовка растворов полимеров, PLA, PCL и PHBV составлены в виде 10 мас% раствор в DCM. PLGA составлен в виде 20 мас% раствор в DCM.
- Place 4 шприца по 5 мл на объем шприца. Шприцы загружаются сontain 5 мл каждого полимера, давая 20 мл в целом.
- Для PLA, PCL и PHBV использовать скорость потока 40 μLmin -1 в шприц.
- Для PLGA использовать скорость потока 30 μLmin -1 в шприц.
- Для PLA, PCL и PLGA использовать рабочее расстояние 17 см от кончика иглы для оправки.
- Для PHBV использовать рабочее расстояние 10 см от кончика иглы для оправки.
- Зарядка шприц иглы +17000 V (73030 P, Genvolt, Шропшир, Великобритания) и electrospin от соответствующего расстояния на алюминиевой фольги покрытой оправки.
- Для случайных волокон вращать оправку на 200 оборотов в минуту.
- В соответствие волокна вращать оправку на 1000 оборотах в минуту.
- Леса могут быть сохранены на алюминиевую фольгу в сухих условиях. Рекомендуется хранить в плотно закрытой таре при температуре 4 ° C в присутствии осушителя. По нашему опыту леса остаются стабильными в течение 4 месяцев (возможно, гораздо больше), в этих условиях (мы не знаем любого пуblished исследования долгосрочных условий для хранения леса).
2. Производство комплекса Леса последовательными Spinning
Последовательная вращающийся предлагает способ, сочетающий свойства различных материалов для создания материала, который имеет лучшие свойства обоих. PHBV производит плоский, плотный, в то время как хрупкий лист PLA или PCL вращающийся производит низкой плотностью упругие листы. Оба материала поддерживать клеточном уровне. Последовательно спиннинг этих материалов приводит к плотной клеточной мембраны, непроницаемые эластична.
- Настройка электропрядения установки в соответствии с п. 1, с PHBV спиннинг условиях.
- Electrospin PHBV как указано выше.
- Не меняя алюминиевой фольги, electrospin второй полимер на вершину по параметрам и нормальные условия для этого полимера (например, 17 см барабана иглы, 17000 V, 200 оборотов в минуту для PLA). Эта добавка процесс создает двойной слой эшафот производства двухслойной.
3. Производство многослойных Леса отжига несколько слоев вместе
- Леса могут быть многослойной за счет использования тепла отжига. Для этого 4 листа PLGA размещены в верхней части друг с другом, а затем термически отжигали при температуре 60 ° С в течение 3 часов.
- Леса также может быть отжигали паром отжига. Здесь 4 листа PLGA расположены на верхней части друг с другом и приостановил на 2 см выше пул DCM (10 мл) в течение 1 часа. Это осуществляется в закрытой посуде при комнатной температуре.
4. Асептического производства и постпродакшн Стерилизация Electrospun Строительные леса
- Асептического производства леса может быть достигнуто путем электропрядения в асептической среде капот ламинарного течения в чистой окружающей среде комнаты. Для этого либо стерильный полимеров медицинского назначения и полимеров стерилизовать путем инкубации в DCM могут быть использованы. После растворения полимеров electrospun на стерильную пленку обернутые вокруг, какterilised оправки. Строительные леса, затем обрабатывается асептическим. Бесплодие проверяется путем инкубации образцы леса к антибиотикам свободных средств массовой информации рост за соответствующий период.
- Для дезинфекции этанола (это использования экспериментально, но не признанной методологии стерилизации которые могут быть приняты в клинику) леса расположены кратко (15 мин) на 70% объем / объем раствором этанола в дистиллированной воде. Для практических целей экспериментального это обычно бывает достаточно для дезинфекции лесов, так что они могут быть успешно сочетается с культивируемых клетках.
- Для стерилизации надуксусной кислоты леса погружены в надуксусной кислоты (0,1% г / г в фосфатный буферный раствор (PBS)) и выдерживают в течение 3 часов при комнатной температуре, как описано в Селима и др. 9.
- Для гамма-стерилизации леса облучении с дозой 3 кГр использованием цезия источник, как описано в Селима и др. 9.
5. Биомеханические испытания Строительные леса
- Строительные леса не нарезанные на прямоугольники 5 мм х 20 мм, измеренная по толщине помощью микрометра, и помещается в прибор бозе Electroforce 3100. Эта машина применяется сила N 0-22 до смещения 6 мм и участков нагрузки по сравнению с перемещением в качестве напряжения / деформации кривой. Это позволяет модуль Юнга и эластичности рассчитывается.
6. Визуализация Ячейки Леса и оценка ECM производства
Клетки могут быть окрашены с жизненно флуоресцентных красителей, которые позволяют увидеть клетки на строительные леса, поскольку они придают, мигрировать и размножаться. Сообщение культуры наличие клеток на леса может быть определена окрашивания клеточных ядер с 4 ',6-диамидино-2-фенилиндола дигидрохлорид (DAPI). Производство ECM клетками на эшафоте может быть оценено путем окрашивания клеток для ряда белков ECM в том числе эластин, как показано в следующем примере. Все леса использовались измеряли, чтобы иметьтолщиной не менее 0,2 мм и нарезать на квадраты 1,5 см х 1,5 см до посева.
В этих исследованиях фибробластов кожи человека используются во всем, потому что роль, которую они играют в мягкие ткани, реконструкции является основной научный интерес нашей лаборатории.
Клетки получены из образцов кожи от пациентов, перенесших плановые операции по уменьшению груди или живота (было дано согласие на их ткани, которая будет использоваться для научных целей). Ткани собираются и используются анонимно под Исследование тканей банка лицензии 12179. Ткани промывают PBS, содержащим стрептомицин (0,1 мг / мл) и пенициллин (100 МЕ / мл) и амфотерицина В (0,5 мкг / мл). Образцы ткани инкубировали в 0,1% м / трипсина и 0,1% глюкозы в PBS (12-18 часов, 4 ° C). Дермы снимают, мелко рубленый и инкубировали с 10 мл коллагеназы (0,5% вес / объем в DMEM и 10% FCS, 37 ° C в течение 18 часов). Центрифугирования полученной suspens клеткииона (400 г в течение 10 мин), производит гранулы из ячеек, которые можно культивировать и пересевают в DMEM дополнить эмбриональной телячьей сыворотки (FCS, 10% об / об), стрептомицин (0,1 мг / мл), пенициллин (100 МЕ / мл) и амфотерицина В (0,5 мкг / мл). Только фибробластов прохождения 4-9 используются в экспериментах.
- Фибробластов кожи человека, один раз в сливной T75 (EasyFlask, Nunc, Нью-Йорк, США) высевают добавлением трипсина / ЭДТА (5 мл, 5 мг / мл трипсина, 2 мг / мл ЭДТА в физиологическом растворе), инкубации в течение 5 минут 37 ° C. Суспензию центрифугировали в течение 10 минут (150 г). Клетки ресуспендировали в 5 мл DMEM (дополнено ФТС (10% об / об), стрептомицин (0,1 мг / мл), пенициллин (100 МЕ / мл) и амфотерицина В (0,5 мкг / мл)) и рассчитывали с использованием гемоцитометра, а концентрация регулируется для посева. Клетки, как правило, высевают 50000 клеток на лунку.
- Если требуется, до посева клеток на эшафот, клетки могут быть предварительно меченых использованием CellTracker красный или зеленый. Ячейкас промывают 3 х 5 мл PBS. Решение 10 мМ CellTracker в сыворотке крови свободного, клеточной необходимости, средние (10 мл) и клетки инкубировали в течение 45 минут при температуре 37 ° C. После инкубации клетки промывают в 3 х 5 мл PBS, после чего они высевают на леса. После этого поверхность леса может отражаться в микроскоп Axon ImageExpress (Molecular Devices, Sunnyvale, США) при 570 нм λex - 620 нм λem (CellTracker красный) и 480 нм λex - 533 нм λem (CellTracker зеленый). Для исследования проникновения клеток вглубь леса многофотонной конфокальной микроскопии может быть использована. Это может достичь около 200 микрон проникновение в самые строительные леса с или без клетки.
- Сообщение образцы культуры устанавливаются в 1 мл 3,7% формальдегида в PBS при температуре 37 ° С в течение 20 минут, а затем промывают 3 х 1 мл PBS.
- 200 мкл эластина первичные антитела добавляются к каждому образцу (5% объем / объем в ФБР, кролик анти-человеческий альфа-упругихолово, AbDserotec, Кидлингтон, Великобритания) и инкубировали при 37 ° С в течение 30 минут.
- Образцы промывают 3 х 1 мл PBS и инкубировали в растворе вторичных антител (0,5% об / козий анти-IgG кролика (ФК): FITC) в PBS, содержащем DAPI (1 мкг / мл) в течение 30 минут.
- После этого образцы промывают 3 х 1 мл PBS.
- DAPI и вторичные антитела, окрашенных образцов затем отображается на Axon ImageExpress флуоресцентный микроскоп, 365 нм λex - 460 нм λem для DAPI и 480 нм λex - 533 нм λem для вторичных антител. DAPI окрашивает ядра и позволяет видеть распределение клеток в волокна очень легко.
7. Подвергая Ячейки Леса для двухосных динамического кондиционирования
Чтобы изучить влияние динамических кондиционирования на фибробластов производство ECM мы разработали простое доказательство правильности концепции биореактор для изучения этого.
- Соберите воздушный шар и потокаппарат регулирования и подготовить систему так, он может быть легко помещается в стерильный сосуд подходит для культуры клеток, как только это покрытие.
- Автоклав аппараты, включая воздушный шар (122 ° C, 220 мбар в течение 1 часа). Мы можем подтвердить, что воздушные шары выжить автоклавирования без отрицательного влияния на их функцию, раздувая и выкачивая их повторно.
- В чистой комнате, распакуйте аппарат в капюшоне ламинарного течения в состоянии быть на electrospun.
- Накачивается шар до требуемого поверхности (помните шар все еще нуждается, чтобы вписаться в культуру судна) с фосфатным буферным раствором и подключить PBS к электрической земле в точке, в аппарате, который не должен быть стерильным (патрубок на 3-ходовой кран).
- Electrospin необходимых полимеров на воздушном шаре, используя обычный спиннинг условиях, используя рабочее расстояние 10 см. Позвольте леса высохнуть в течение 1 часа. "Мокрый" волокна "липкие" достаточно, чтобы присоединиться к поискуТуз шара без последующего отключения.
- Поместите шар в стерильный сосуд и транспортировать его на капот ламинарный поток подходит для клеточных культур.
- Снимите воздушный шар с судна и места на стерильной поверхности (Петри) и неоднократно (каждые 20 секунд) пипетировать клеточной суспензии (1 х 10 6 клеток в 5 мл DMEM) на покрытие шара в течение 20 минут, чтобы попытаться распространить клетки равномерно по всей поверхности.
- Поместите шар в культуру судна, а также добавлять подогретого СМИ соответствующий тип клеток.
- Подключить аппарат к инфляции шприцевой насос (Kent научных, Genie Plus, штат Коннектикут, США) и надуть / выкачать шара в соответствии с требованиями дать двухосного растяжения. С компьютерным управлением насос шприца может быть использована для достижения более сложных расширение режима.
8. Представитель Результаты
Следующие цифры представляют результаты, которые можно ожидатьесли вышеупомянутые методы следуют.
Электропрядения могут быть использованы для создания лесов со случайной и упорядоченной архитектуры (рис. 1), это повторяющиеся и волокна однородны. Многие виды полимеров можно electrospun с характеристиками, которые могут значительно различаться, как показано на рисунке 2 PHBV, PLA или PCL. Электропрядения может производить легкий пушистый леса или плотной непроницаемой мембраны клетки (рис. 3). Все леса показано здесь способствовало присоединение и пролиферации клеток. Предыдущие исследования показали, что клетки могут мигрировать через эти леса до глубины по крайней мере 500-600 мкм 9 Ибо PLA средний диаметр волокна составляет 3 мкм. Для PHBV это 0.3 мкм с жемчугом от 5-20 мкм, а для PCL это 3 мкм, а для PLGA это 11 мкм. Другие исследования с использованием других систем растворителей сообщают, что PHBV может быть electrospun как волокна без бисером или жемчугом полимера. 10,11
<с классом = "jove_content"> Если толстые леса требуется пара и тепла отжига может быть использована для отжига слоев леса вместе (см. рисунок 4). Эти леса слои не расслаиваться и это может быть очень трудно найти переход между слоями.Мы покажем, что бислой мембраны могут быть сделаны, когда клетки А и В могут быть культурным каждый на отдельном мембраны без смешения, как показано на рисунке 5. Здесь мы демонстрируем это с помощью фибробластов кожи человека цветные с двумя различными флуоресцентными красителями трекер клетки. Такая двухслойная мембрана может быть полезно при культивировании клеток с образованием твердых тканей, таких как кости или хряща с одной стороны, отделена от клетки предназначены для формирования мягкой (и как правило, быстрее растущих) тканей, с другой стороны, такие как расщелина неба ремонт или реконструктивные пародонта операции. 12, 13
Что касается влияния стерилизации electrospun леса у нас естьРанее сообщалось, что метод стерилизации воздействие на культуры клеток лесов и последующей 9. Это показано на рисунке 6, в которой показано влияние надуксусной кислоты, гамма-облучения и этанола на диаметр волокна и предел прочности при растяжении и модуль Юнга PLGA леса .
Гамма-облучение не оказывает существенного влияния на диаметр волокна, тогда как надуксусной кислоты и этанола уменьшить диаметр волокна примерно на 50%. В связи с пределом прочности на растяжение каждый из методов стерилизации изменила предел прочности на растяжение и упругость леса. Культуры клеток на эти леса дальнейшее сокращение предела прочности на растяжение, но увеличилась эластичность.
Наконец, метод тестирования эффекта динамической двухосного растяжения на клетки культивировали на electrospun леса представлены. Это доказательство правильности концепции подход показывает, что клетки остаются жизнеспособными при динамическомрастяжение, но и производить повышенное количество эластина в этих условиях. Это заметно контрастирует с отсутствием эластина, когда те же клетки на том же леса ведутся в статических условиях (см. Рисунок 7).
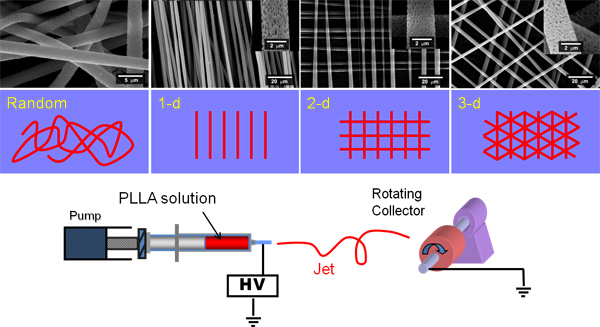
Рисунок 1. Показывает мультфильм электропрядения установки и вращающийся случайных и параллельных волокон и слоев волокон помещаются друг над другом. Перпендикулярно волокон могут быть созданы электропрядения набор унифицированных волокон на алюминиевую фольгу, фольгу вращения на 90 °, а затем сразу электропрядения второй набор унифицированных волокон поверх них.

Рисунок 2. Показывает морфологии случайного коврики electrospun (А) PLA (шкалы составляет 100 мкм), (B) PHBV (шкалы составляет 100 мкм), (C) PCL (масштаб бар 100 мкм) и (D) PLGA (шкалы составляет 200 мкм). Обратите внимание, что НОАК, PCL и PLGA все microfibrous единый леса. PHBV вращается как «жемчужное ожерелье» с подключением нановолокна размером 5-20 мкм бисера. Нажмите здесь, чтобы увеличить рисунок .

Рисунок 3. Производство многослойной эшафот. Здесь леса изначально нити использованием PHBV и шприцы заполненные PLA или PCL используются. Эти нити в верхней части PHBV эшафот. На рисунке показан внешний вид этих многослойных леса, (А) один слой PHBV, (B) сечение PHBV-PLA бислоя, показывая плотные nanofibrous "жемчужное ожерелье" PHBV слоя (слева) и более открытыми microfibrous PLA слой (справа) и (C) один слой НОАК.НК "> Нажмите здесь, чтобы увеличить цифру.
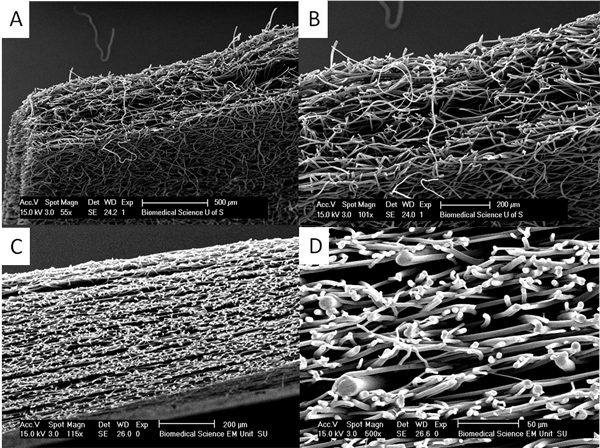
Рисунок 4. Толстые леса могут быть получены путем отжига тепла и пара отжига. (А) и (Б) показывают разрез пара отожженной PLA леса, где первоначальный волокнистых леса около 150 мкм были помещены вместе и дихлорметан пар используется, чтобы сделать гораздо толще леса до 500 мкм. В (С) и (D) можно видеть, что леса состоит из слоев волокон значительно толще перемежаются со слоями тонкие волокна создается тепло отжига слоев тонких и толстых волокон вместе. Этот подход может быть использован для создания лесов сложных механических свойств. Нажмите здесь, чтобы увеличить рисунок .
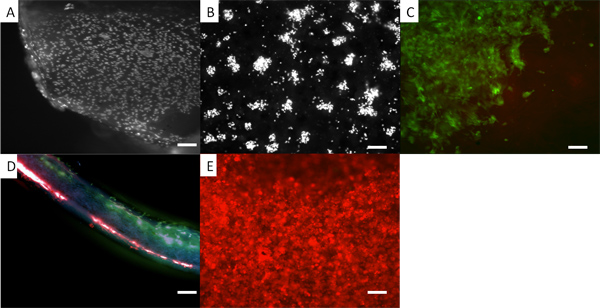
Fi рисунке 5. Внешний вид ячеек на двухслойной эшафот. Во всех случаях клетки присутствуют фибробластов кожи человека. (A) фибробластов на electrospun НОАК, где клетки фиксировали и окрашивали DAPI. (B) DAPI окрашенных клеток на PHBV. В (С) фибробласты предварительно окрашенных витальным красителем, CellTracker зеленый, и вы можете увидеть появление их на сторону PLA бислоя. (D) сечение бислоя с красным окрашенных фибробластов на нижней поверхности PHBV и зеленый окрашенный фибробластов на верхней поверхности НОАК. (E) Фибробласты предварительно окрашенных CellTracker красный, выращенных на поверхности PHBV. Использование жизненно флуоресцентных красителей обеспечивает удобную методологию, глядя на распределение клеток на эшафоте, а клетки продолжают расти. Можно регулярно пользоваться этими красителями, по крайней мере 7 дней. Однако концентрация красителя становится разбавляют, как клетки делятся. Масштаб барах равны 0,1 мм.
g6.jpg "ALT =" Рисунок 6 "/>
Рисунок 6. Биомеханических свойств electrospun леса получены с использованием бозе Electroforce тензиометра устройство (A). (В) напряжения / деформации кривых PLGA леса стерилизованы гамма-облучение, алкоголь, надуксусной кислоты, или асептически производства. Три измерения могут быть получены из такого графика: предельное напряжение растяжения (ЕТС), к которому волокна могут быть подвергнуты, прежде чем они появляются, предельной деформации при растяжении и модуль Юнга. Последнее дает указание эластичность на эшафот. (C) влияние каждого метода стерилизации на PLGA диаметр волокна, мкм. Каждая методика стерилизации снизился ОТС. Оба надуксусной кислоты и гамма-облучения уменьшение модуля Юнга дает более упругой леса, алкоголь делает леса особенно хрупкой. Нажмите здесь, чтобы увеличить рисунок .

Рисунок 7. На этом рисунке показано использование простой воздушный шар, чтобы обеспечить двухосный биореактор, на которых леса (и клеток, растущих в лесах) могут быть подвергнуты двухосного растяжения по времени. (А), спущенный воздушный шар, на котором electrospun волокон, PHBV, были сданы на хранение. На этом этапе баллон частично покрытые волокна. (B), воздушный шар полностью покрыты PHBV и PLA волокон. (C) клеточной суспензии неоднократно пипеткой на воздушном шаре. (D) воздушный шар помещается в бутылку стерильной среды, где шар подключен к насосу шприц и PBS (используется в качестве электролита проведения) используется для слегка надуть и позволит дефляции шара против расписанию. (E) Ячейки леса удаляются из баллона в конце эксперимента и анализа, проведенного на жизнеспособность клеток показано в (F), где жизнеспособных клеток развиваются темно-синий цвет с помощью метаболического индicator 3 - (4,5-диметилтиазол-2-ил) -2,5-diphenyltetrazolium метила. (G) показывает, что клетки (синие) культивировали на этом шаре и в соответствии с двухосным растяжением развитие эластиновых волокон (зеленый, тонированный использованием эластина специфических антител), в то время как те же ячейки на идентичные леса (H) культивировали в статических условиях, имеют незначительное производство эластина . Масштаб барах равны 0,025 мм.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Электропрядения очень популярный метод получения леса для тканевой инженерии. 14, 15, 16 В то время как относительно простые по производству основных леса electrospun для экспериментального использования техники также является сложной и многогранной со многими переменными. 6 Суще?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим СИББН финансирования кандидат для свидания г-н Фрейзер.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Поли молочной-со-гликолевой кислоты | Sigma Aldrich | ||
| Поли молочная кислота | Sigma Aldrich | 81273 | Характеристической вязкости ~ 2.0dl / г |
| Поли ε-капролактона | Sigma Aldrich | ||
| Поли гидроксибутирата-со-hydroxyvalerate 12:01 | Гудфеллоу | 578-446-59 | PHB88/PHV12 |
| Дихлорметан | Sigma Aldrich или Фишера | 270997 или D/1850/17 | > 99,8% содержит 50-150ppm амилен стабилизатор |
| 50 разноцветных воздушных шаров | Уилкинсон Магазины оборудования ООО | 0105790 | |
| Коза анти-IgG кролика (ФК): FITC | AbDserotec | STAR121F | |
| Кролик анти-человеческий альфа-эластин | AbDserotec | 4060-1060 | |
| Винтовая крышка GL45 PP 2 порта, р / 2 | SLS | 1129750 | |
| 4 ',6-диамидино-2-фенилиндола дигидрохлорид | Sigma Aldrich | 32670 | |
| CellTracker зеленый CMFDA | Invitrogen | C7025 | |
| CellTracker красный CMTX | Invitrogen | C34552 |
Ссылки
- Canton, I., McKean, R., Charnley, M., Blackwood, K., Fiorica, C., Ryan, A., MacNeil, S. Development of an Ibuprofen-releasing biodegradable PLA/PGA electrospun scaffold for tissue regeneration. Biotechnology and bioengineering. 105, 396-408 (2010).
- Blackwood, K., McKean, R., Canton, I., Freeman, C., Franklin, K., Cole, A., Brook, I., Farthing, P., Rimmer, S., Haycock, J., Ryan, A., MacNeil, S. Development of biodegradable electrospun scaffolds for dermal replacement. Biomaterials. 29, 3091-3104 (2008).
- Yang, F., Maurugan, R., Wang, S., Ramakrishna, S. Electrospinning of nano/micro scale poly(L-lactic acid) aligned fibers and their potential in neural tissue engineering. Biomaterials. 26, 2603-2610 (2005).
- Sittichokechaiwut, A., Edwards, J. H., Scutt, A. M., Reilly, G. C. Short bouts of mechanical loading are as effective as dexamethasone at inducing matrix production by human bone marrow mesenchymal stem cell. Eur. Cell Mater. 20, 45-57 (2010).
- Sill, T. J., von Recum, H. A. Electrospinning: applications in drug delivery and tissue engineering. Biomaterials. 29 (13), 1989-2006 (2008).
- Deitzel, J., Kleinmeyer, J., Harris, D., Beck Tan, N. C. The effect of processing variables on the morphology of electrospun nanofibers and textiles. Polymer. 42, 261-272 (2001).
- Fridrikh, S., Yu, J., Brenner, M., Rutledge, G. Controlling the fiber diameter during electrospinning. Physical review letters. 90, 1-4 (2003).
- Fong, H., Chun, I., Reneker, D. Beaded nanofibers formed during electrospinning. Polymer. 40 (16), 4585-4592 (1999).
- Selim, M., Bullock, A. J., Blackwood, K. A., Chapple, C. R., MacNeil, S. Developing biodegradable scaffolds for tissue engineering of the urethra. BJU Int. 107 (2), 296-302 (2010).
- Tong, H. -W., Wang, M. An investigation into the influence of electrospinning parameters on the diameter and alignment of poly(hydroxybutyrate-co-hydroxyvalerate) fibers. Journal of Applied Polymer Science. 120 (3), 1694-1706 (2011).
- Tong, H. -W., Wang, M. Electrospinning of poly(hydroxybutyrate-co-hydroxyvalerate) fibrous tissue engineering scaffolds in two different electric fields. Polymer Engineering & Science. 51 (7), 1325-1338 (2011).
- Retzepi, M., Donos, N. Guided Bone Regeneration: biological principle and therapeutic applications. Clinical oral implants research. 21, 567-576 (2010).
- Moreau, J., Caccamese, J., Coletti, D., Sauk, J., Fisher, J. Tissue engineering solutions for cleft palates. Journal of oral maxillofacial. 65, 2503-2511 (2007).
- Yang, F., Both, S., Yang, X., Walboomers, X., Jansen, J. Development of an electrospun nano-apatite/PCL composite membrane for GTR/GBR application. Acta biomaterialia. 5, 3295-3304 (2009).
- Yoshimoto, H., Shin, Y., Terai, H., Vacanti, J. A biodegradable nanofiber scaffold by electrospinning and its potential for bone tissue engineering. Biomaterials. 24, 2077-2082 (2003).
- Telemeco, T., Ayres, C., Bowlin, G., Wnek, G., Boland, E., Cohen, N., Baumgarten, C., Mathews, J., Simpson, D. Regulation of cellular infiltration into tissue engineering scaffolds composed of submicron diameter fibrils produced by electrospinning. Acta biomaterialia. 1, 377-385 (2005).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены