Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Traitement post-production des fibres électrofilées de génie tissulaire
Dans cet article
Résumé
Échafaudages électrofilées peuvent être traitées de post-production pour les applications d'ingénierie tissulaire. Nous décrivons ici les méthodes de filature échafaudages complexes (par filage consécutives), pour faire plus épais échafaudages (par le multi-couches en utilisant la chaleur ou de vapeur recuit), pour atteindre la stérilité (production aseptique ou la stérilisation post-production) et pour la réalisation appropriées des propriétés biomécaniques.
Résumé
Électrofilage est un procédé couramment utilisé et polyvalent pour produire des échafaudages, souvent biodégradables) pour l'ingénierie tissulaire en 3D. 1, 2, 3 De nombreux tissus in vivo l'objet d'une distension biaxiale à des degrés divers tels que la peau, la vessie, du plancher pelvien et même le palais dur que les enfants croître. En produisant des échafaudages à ces fins, il est nécessaire de développer des échafaudages de appropriées propriétés biomécaniques (si réalisée sans ou avec des cellules) et qui sont stériles à usage clinique. L'objectif de ce papier n'est pas la façon d'établir les paramètres de base (électrofilage comme il existe une littérature abondante sur électrofilage), mais sur la façon de modifier filé la post-production échafaudages pour les adapter à des fins d'ingénierie tissulaire - ici l'épaisseur, les propriétés mécaniques et la stérilisation (obligatoire pour les utilisation clinique) sont considérés et nous décrivons aussi comment les cellules peuvent être cultivées sur des échafaudages et soumis à une contrainte biaxiale à les conditionner pour des applications spécifiques.
Électrofilage tend à produire des feuilles minces, comme le collecteur électrofilage est recouverte d 'isolation des fibres, il devient un mauvais conducteur de telle sorte que les fibres ne sont plus sur ce dépôt. Par conséquent, nous décrivons les approches pour produire structures plus épaisses par la chaleur ou la vapeur de recuit en augmentant la résistance des échafaudages, mais pas nécessairement l'élasticité. Filage séquentiels d'échafaudages de polymères différents pour parvenir à des échafaudages complexes est également décrite. Méthodologies de stérilisation peuvent affecter la force et l'élasticité des échafaudages. Nous comparons trois méthodes pour leurs effets sur les propriétés biomécaniques sur des échafaudages électrofilées du poly lactique-co-acide glycolique (PLGA).
L'imagerie de cellules sur des échafaudages et d'évaluation de la production de la matrice extracellulaire (ECM) des protéines par les cellules sur des échafaudages est décrite. La culture de cellules in vitro sur des échafaudages peut améliorer la force et l'élasticité échafaud, mais le génie tissulaire literature montre que les cellules ne parviennent souvent pas à produire ECM appropriée lorsqu'il est cultivé dans des conditions statiques. Il ya peu de systèmes commerciaux disponibles qui permettent de cellules en culture sur des échafaudages en vertu de régimes de conditionnement dynamiques -. Un exemple est le ElectroForce Bose 3100 qui peut être utilisée pour exercer un programme de conditionnement sur les cellules dans des échafaudages tenue l'aide des poignées mécaniques au sein des médias chambre rempli 4 Une approche à un bioréacteur de culture cellulaire pour le budget distorsion contrôlée en 2 dimensions est décrite. Nous montrons que les cellules peuvent être induites à produire élastine dans ces conditions. Enfin l'évaluation des propriétés biomécaniques des échafaudages transformés cultivées avec ou sans cellules est décrite.
Protocole
1. Électrofilage des fibres aléatoires et alignés
Électrofilage crée de beaux réseaux fibreux en utilisant le potentiel électrique de dessiner une solution de polymère vers un collecteur de terre. Les collectionneurs peuvent être dans des formes très nombreuses et peuvent être statiques ou, plus couramment, en rotation. L'évaporation du solvant avant la solution arrive au niveau du collecteur et le jet se solidifie en une fibre.
Chaque polymère nécessite son propre ensemble de conditions nécessaires pour produire un type donné de fibres. La concentration du polymère, le solvant, la distance entre la solution et le pompage de collecteur mis à la terre, la différence de potentiel entre les deux, la vitesse de rotation du collecteur, le débit, la température et l'humidité affectent tous électrofilage. Il existe de nombreuses études décrivant la sélection des paramètres et électrofilage l'impact de ces produits sur les échafaudages (diamètre de la fibre par exemple, la morphologie et orientation). 5, 6, 7, 8Dans ces expériences, les échafaudages ont été filés en fonction des conditions choisies dans nos études précédentes. 2, 9
Les méthodes suivantes sont adaptés pour la production d'échafaudages électrofilées de PLGA, l'acide poly lactique (PLA), poly ε-caprolactone (PCL) et le poly-hydroxybutyrate-co-hydroxyvalérate (PHBV) en utilisant un collecteur tournant comme indiqué dans la figure 1. Tout au long du solvant dichlorométhane (DCM) est utilisé. La méthode ici produit microfibreuse PLGA, PLA et PCL et nanofibrous PHBV échafaud avec micro-perles de taille (morphologie »collier de perles»).
- Enduire la. Rotation collecteur mandrin avec une feuille d'aluminium, avec le côté poli / brillant vers l'extérieur Notre mandrin est de 20 cm de large et 10 cm de diamètre.
- Préparer des solutions de polymère; PLA, PCL et PHBV sont constitués en tant que solution à 10% en poids dans du DCM. PLGA est constitué comme une solution de 20% en poids dans du DCM.
- Place 4 seringues de 5 ml de volume sur une pompe à seringue. Les seringues sont chargés de contain 5 ml du polymère chacune, à raison de 20 ml au total.
- Pour le PLA, PCL et PHBV utiliser un débit de 40 μLmin -1 par seringue.
- Pour PLGA utiliser un débit de 30 μLmin -1 par seringue.
- Pour le PLA, PCL et PLGA utiliser une distance de travail de 17 cm de pointe de l'aiguille à mandrin.
- Pour utiliser PHBV une distance de travail de 10 cm de la pointe d'aiguille à mandrin.
- Chargez les aiguilles de seringues à 17000 V (73030 P, Genvolt, Shropshire, Royaume-Uni) et electrospin de la distance appropriée sur le mandrin papier d'aluminium revêtu.
- Pour les fibres aléatoires tourner le mandrin à 200 rpm.
- Pour les fibres alignées tourner le mandrin à 1000 rpm.
- Les échafaudages peuvent être stockées sur la feuille d'aluminium dans des conditions sèches. De stockage recommandée est dans un contenant hermétique à 4 ° C en présence de déshydratant. Dans notre expérience échafaudages reste stable pendant au moins 4 mois (peut-être beaucoup plus) dans ces conditions (nous ne sommes pas au courant d'aucune puétudes blished sur les conditions de stockage à long terme pour les échafaudages).
2. La production des échafaudages complexes par Spinning séquentiels
Filage séquentiel fournit une méthode de combiner les propriétés de différents matériaux pour créer un matériau qui a le meilleur des deux propriétés. PHBV produit un appartement, dense, feuille cassante alors que le PLA ou PCL filature produit des fiches de faible densité élastiques. Les deux matériaux en charge la fixation des cellules. Consécutivement filer ces résultats matériels dans un réseau dense de cellules imperméable membrane qui est élastique.
- Mettre en place la plate-forme électrofilage conformément à la section 1, avec des conditions de filage pHBV.
- Electrospin PHBV comme ci-dessus.
- Sans changer la feuille d'aluminium, electrospin un second polymère sur-dessus en utilisant les paramètres et les conditions normales pour que le polymère (par exemple 17 cm de tambour à l'aiguille, 17000 V, 200 tours par minute pour le PLA). Ce processus additif construit une double couche de la production d'un échafaudage bicouche.
3. La production des échafaudages multicouches par recuit Plusieurs couches Ensemble
- Échafaudages peut être multicouche par l'utilisation de la chaleur de recuit. Pour ce faire ces 4 feuilles de PLGA sont placés sur le dessus les uns des autres, puis à chauffer recuit à 60 ° C pendant 3 heures.
- Les échafaudages peuvent aussi être recuite par la vapeur de recuit. Ici 4 feuilles de PLGA sont placés les uns sur les autres et suspendue 2 cm au-dessus d'une piscine de DCM (10 ml) pendant 1 heure. Ceci est réalisé dans un récipient fermé à température ambiante.
4. La production aseptique et la stérilisation de postproduction des échafaudages électrofilées
- Aseptique de production d'échafaudage peut être obtenue par électrofilage dans un environnement aseptique d'une hotte à écoulement laminaire à l'intérieur d'un environnement de salle blanche. À faire ce polymères soit de qualité médicale stérile ou polymères stérilisés par incubation dans du DCM peut être utilisé. Une fois dissous, les polymères sont électrofilées sur une feuille stérile enroulée autour deterilised mandrin. Les échafaudages sont ensuite traitées de façon aseptique. La stérilité est vérifiée par incubation des échantillons de l'échafaud dans les médias de croissance sans antibiotique pour la période appropriée.
- Pour la désinfection d'éthanol (ce qui est de l'utilisation expérimentale, mais n'est pas une méthode reconnue de la stérilisation qui pourraient être prises à la clinique) Les échafaudages sont placés brièvement (15 min) dans un 70% v / v solution d'éthanol dans l'eau distillée. Pour pratiques des fins expérimentales cela est généralement suffisant pour désinfecter les échafaudages afin qu'ils puissent ensuite être combinées avec succès avec des cellules en culture.
- Pour peracétique échafaudages stérilisation acides sont plongés dans l'acide peracétique (0,1% v / v en tampon phosphate salin (PBS)) et incubées pendant 3 heures à température ambiante, comme décrit dans Selim et al. 9
- Pour le gamma échafaudages stérilisation sont irradiées à une dose de 3 kGy utilisant une source de césium comme décrit dans Sélim et al. 9
5. Tests biomécaniques des échafaudages
- Les échafaudages sont découpées en rectangles de 5 mm x 20 mm, mesurée pour une épaisseur à l'aide d'un micromètre, et placés dans un instrument Bose ElectroForce 3100. Cette machine applique une force de 0-22 N à un déplacement de 6 mm et les parcelles de la charge en fonction du déplacement comme une courbe contrainte / déformation. Cela permet au module de Young et de l'élasticité doit être calculé.
6. Visualisation des cellules sur des échafaudages et d'évaluer la production ECM
Les cellules peuvent être colorées avec des colorants fluorescents vitaux qui permettent de voir les cellules sur les échafaudages, en se fixant, migrent et prolifèrent. La culture post la présence de cellules sur des échafaudages peut être déterminé par coloration des noyaux de cellules avec 4 ',6-diamidino-2-phénylindole dichlorhydrate (DAPI). La production de l'ECM par des cellules sur l'échafaud peut être évaluée par coloration des cellules pour une gamme de protéines de la MEC, y compris l'élastine comme indiqué dans cet exemple. Tous les échafaudages utilisés ont été mesurés pour avoir unépaisseur d'au moins 0,2 mm et couper en carrés de 1,5 cm x 1,5 cm avant le semis.
Dans ces études, les fibroblastes dermiques humains sont utilisés tout au long en raison du rôle qu'ils jouent dans la reconstruction des tissus mous qui est l'intérêt de notre laboratoire de recherche primaire.
Les cellules sont obtenues à partir des échantillons de peau chez des patients subissant une chirurgie élective pour une réduction mammaire ou plastie abdominale (consentement a été donné pour leur tissu pour être utilisé à des fins de recherche). Les tissus sont recueillis et utilisés de manière anonyme en vertu de tissus recherche de la Banque de licence 12179. Les tissus sont lavés avec de la streptomycine PBS contenant (0,1 mg / ml) et de la pénicilline (100 UI / ml) et de l'amphotéricine B (0,5 pg / ml). Des échantillons de tissus sont incubés dans 0,1% p / v de trypsine et 0,1% de glucose dans du PBS (12-18 heures, 4 ° C). Le derme est décollée, hachée finement et incubées avec 10 ml de collagénase (0,5% p / v dans du DMEM et 10% de FCS, 37 ° C pendant 18 heures). La centrifugation des cellules résultant des suspensions (400 g pendant 10 minutes), produit un culot de cellules qui peuvent être cultivées et repiquées dans du DMEM supplémenté avec du sérum de veau foetal (FCS, 10% v / v), la streptomycine (0,1 mg / ml), la pénicilline (100 UI / ml) et de l'amphotéricine B (0,5 pg / ml). Seuls les fibroblastes de passage 4-9 sont utilisés dans des expériences.
- Fibroblastes dermiques humains, une fois confluentes dans un T75 (EasyFlask, Nunc, New York, Etats-Unis) sont ensemencées en ajoutant la trypsine / EDTA (5 ml, 5 mg / ml de trypsine, 2 mg / ml d'EDTA dans une solution saline), une incubation de 5 minutes à 37 ° C. La suspension est centrifugée pendant 10 minutes (150 g). Les cellules sont remises en suspension dans 5 ml de DMEM (complétée par FCS (10% v / v), la streptomycine (0,1 mg / ml), la pénicilline (100 UI / ml) et de l'amphotéricine B (0,5 pg / ml)) et comptées en utilisant un hémocytomètre, et la concentration est ajustée pour l'ensemencement. Les cellules sont normalement semées à 50.000 cellules par puits.
- Si nécessaire, avant le semis des cellules sur l'échafaud, les cellules peuvent être pré-étiquetées à l'aide CellTracker rouge ou vert. La cellules sont lavées avec 3 x 5 ml de PBS. Une solution de 10 mM dans le sérum CellTracker libre, cellulaire appropriée, moyen (10 ml) est ajouté et les cellules sont incubées pendant 45 minutes à 37 ° C. Après incubation, les cellules sont lavées dans 3 x 5 ml de PBS suivant laquelle ils sont ensemencées sur des échafaudages. Suite à cette la surface des échafaudages peuvent être visualisées dans un microscope ImageExpress Axon (Molecular Devices, Sunnyvale, Etats-Unis) à 570 nm λex - 620 nm (rouge CellTracker) λem et 480 nm λex - 533 nm λem (CellTracker vert). À rechercher la pénétration de cellules plus profondément dans un microscope échafaudage multiphotonique confocal peut être utilisé. Cela peut atteindre environ 200 microns de pénétration dans la plupart des échafaudages avec ou sans cellules.
- Échantillons culture post sont fixées dans 1 ml de formaldéhyde 3,7% dans du PBS à 37 ° C pendant 20 minutes, puis lavé avec 3 x 1 ml de PBS.
- 200 ul d'anticorps primaires élastine sont ajoutés à chaque échantillon (5% v / v dans du PBS, l'ELAS lapin anti-alpha de l'hommel'étain, AbDserotec, Kidlington, Royaume-Uni) et incubées à 37 ° C pendant 30 minutes.
- Les échantillons sont lavés avec 3 x 1 ml de PBS et ensuite incubées dans une solution d'anticorps secondaire (0,5% v / v de chèvre anti-IgG de lapin (FC): FITC) dans du PBS contenant du DAPI (1 pg / ml) pendant 30 minutes.
- Après cela, les échantillons sont lavés avec 3 x 1 ml de PBS.
- DAPI et des échantillons d'anticorps secondaires colorées sont ensuite reproduite sur un microscope ImageExpress Axon fluorescente, 365 nm λex - 460 nm pour λem DAPI et 480 nm λex - 533 nm λem pour l'anticorps secondaire. DAPI taches les noyaux et permet de voir la distribution des cellules dans les fibres très facilement.
7. Les cellules en soumettant au échafaudages pour Conditionnement dynamique biaxiale
Pour examiner l'effet de conditionnement dynamique sur la production des fibroblastes ECM, nous avons développé un simple preuve de concept bioréacteur pour explorer cette possibilité.
- Assemblez ballon et le débitun dispositif de régulation et de préparer le système de sorte qu'il peut être facilement placé dans un récipient stérile approprié pour la culture cellulaire une fois qu'il est couché.
- Autoclave l'appareil comprenant le ballonnet (122 ° C, 220 mbar pendant 1 heure). Nous pouvons confirmer que les ballons survivre autoclave sans nuire à leur fonction par le gonflage et le dégonflage les reprises.
- Dans une salle blanche, déballer l'appareil dans une hotte à flux laminaire en position d'être électrofilées sur.
- Gonfler le ballonnet à la surface requise (rappeler le ballonnet a encore besoin d'entrer dans le récipient de culture) avec une solution saline tamponnée de phosphate et connecter le PBS à une masse électrique à un point dans l'appareil qui n'a pas besoin d'être stérile (tuyau de dérivation sur 3-way du robinet).
- Electrospin le polymère requise sur le ballonnet à l'aide des conditions normales de filage, en utilisant une distance de travail de 10 cm. Autoriser l'échafaud à sécher pendant 1 heure. Les «mouillés» sont des fibres «collantes» suffisant pour adhérer à la vague déferlanteAs du ballon sans suite détacher.
- Placez le ballon dans un récipient stérile et le transporter vers une hotte à flux laminaire approprié pour la culture cellulaire.
- Retirer le ballon de la cuve et la placer sur une surface stérile (boîte de Pétri) et à plusieurs reprises (toutes les 20 secondes) à la pipette une suspension de cellules (1 x 10 6 cellules dans 5 ml de DMEM) sur le ballon revêtu pendant 20 minutes pour tenter de distribuer cellules uniformément sur la surface.
- Placez ballon dans le récipient de culture, et ajouter préchauffées médias appropriés pour le type de cellule.
- Connectez l'appareil d'inflation à une pompe à seringue (Kent scientifique, Genie De plus, le Connecticut, aux États-Unis) et de gonfler / dégonfler le ballon au besoin pour donner une distension biaxiale. Une pompe à seringue contrôlée par ordinateur peut être utilisé pour parvenir à un régime de distension plus complexe.
8. Les résultats représentatifs
Les chiffres suivants sont représentatifs des résultats qui peuvent être attendussi les méthodes ci-dessus sont suivies.
Électrofilage peut être utilisé pour créer des échafaudages avec des architectures aléatoires et ordonnées (figure 1), c'est reproductible et les fibres sont uniformes. De nombreux types de polymères peuvent être électrofilées avec des caractéristiques qui peuvent varier considérablement comme le montre la figure 2 pour PHBV, PLA ou PCL. Électrofilage peut produire de la lumière échafaudages moelleux ou des membranes cellulaires denses impénétrables (voir Figure 3). Tous les échafaudages, présentés ici facilité l'attachement et la prolifération cellulaire. Des travaux antérieurs ont montré que les cellules peuvent migrer à travers ces échafaudages jusqu'à une profondeur d'au moins 500-600 um 9 Pour PLA le diamètre des fibres moyenne est de 3 um;. Pour PHBV il est 0.3μm avec des perles allant de 5-20 um; pour PCL, il est 3 um, et pour PLGA il est de 11 um. D'autres études utilisant d'autres systèmes de solvants signaler que PHBV peut être électrofilées que les fibres sans billes ou des perles de polymère. 10,11
Si épaisses échafaudages sont tenus de vapeur et thermique de recuit peut être utilisé pour recuire les couches d'échafaudages ainsi (voir figure 4). Ces couches d'échafaudage ne décollera pas et il peut être très difficile de trouver la jonction entre les couches.
Nous montrons que les membranes bicouches peuvent être faites lorsque les cellules A et B peuvent chacun être cultivés sur une membrane séparée sans se mêler, comme indiqué dans la figure 5. Ici, nous le démontrer en utilisant des fibroblastes dermiques humains de couleur avec deux différents colorants fluorescents trackers cellulaires. Une telle membrane bicouche serait utile lorsque la culture de cellules pour former un tissu dur, tel que l'os ou de cartilage sur un côté séparé des cellules destinées à former une molle (et normalement croissance plus rapide) du tissu de l'autre côté comme la réparation ou la fente palatine reconstructrice parodontale chirurgie. 12, 13
En ce qui concerne l'impact de la stérilisation sur les échafaudages électrofilées nous avonsdéjà signalé que la méthode des impacts de stérilisation sur la culture cellulaire échafaudage et les suivantes. 9 Ceci est illustré à la figure 6 qui montre les effets de l'acide peracétique, l'irradiation gamma et de l'éthanol sur le diamètre des fibres et résistance à la traction et le module de Young d'un échafaudage PLGA .
L'irradiation gamma n'a pas d'effet significatif sur le diamètre des fibres tandis que l'acide peracétique et de l'éthanol de réduire le diamètre des fibres d'environ 50%. En ce qui concerne résistance à la traction de chacun des méthodes de stérilisation changé la résistance à la traction et l'élasticité des échafaudages. Culture de cellules sur ces échafaudages a encore réduit la charge de rupture, mais il a augmenté l'élasticité.
Enfin, un procédé de test l'effet de distension biaxiale dynamique sur des cellules cultivées sur des échafaudages électrofilé est présenté. Cette approche proof-of-concept montre que les cellules restent viables pendant dynamiquedistension, mais aussi produire des quantités accrues d'élastine dans ces conditions. Ceci contraste nettement de l'absence de l'élastine, lorsque les cellules mêmes sur le même échafaud sont maintenus dans des conditions statiques (voir Figure 7).
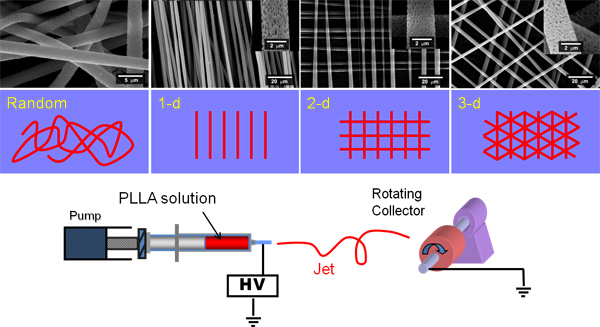
Figure 1. Affiche une bande dessinée d'un banc d'électrofilage et de la filature de fibres aléatoires et parallèles, puis des couches de fibres, placés les uns sur les autres. Fibres perpendiculaires peuvent être créée par électrofilage un ensemble de fibres alignées sur une feuille d'aluminium, la feuille de rotation de 90 °, puis immédiatement électrofilage un second ensemble de fibres alignées au-dessus de ceux-ci.

Figure 2. Montre la morphologie des tapis électrofilées aléatoires de (A) PLA (barre d'échelle est de 100 um), (B) PHBV (barre d'échelle est de 100 um), (C) PCL (barre d'échelle est 100 m) et (D) PLGA (barre d'échelle est de 200 um). Notez que le PLA, PCL et PLGA sont tous les échafaudages de microfibres uniformes. PHBV est filé comme un «collier de perles» avec nanofibres de connexion 5-20 um perles de taille. Cliquez ici pour agrandir la figure .

Figure 3. Production d'un échafaudage multicouche. Ici, les échafaudages sont d'abord filé à l'aide PHBV puis seringues remplies avec le PLA ou PCL sont utilisés. Ceux-ci sont filé au-dessus de l'échafaud PHBV. La figure montre l'apparition de ces échafaudages multicouches, (A) Une seule couche PHBV, (B) Une section transversale d'un bicouche PHBV-PLA, montrant la nanofibrous dense, «collier de perles» PHBV couche (à gauche) et microfibreuse plus ouvert PLA couche (à droite) et (C) Une seule couche PLA.nk "> Cliquez ici pour agrandir la figure.
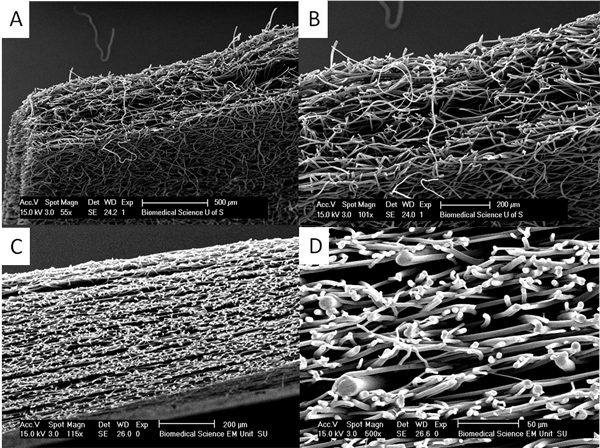
Échafaudages Figure 4. Plus épais peut être produite par la chaleur de recuit et de vapeur recuit. (A) et (B) montrent une coupe à travers un échafaudage de vapeur recuit PLA où initiales échafaudages fibreux d'environ 150 um sont été placés ensemble et de dichlorométhane vapeur est utilisée pour faire des échafaudages beaucoup plus épais allant jusqu'à 500 um. En (C) et (D) on peut voir que l'échafaud se compose de couches de fibres beaucoup plus épaisses intercalées avec des couches de fibres très fines créées par recuit thermique de couches de fibres minces et épaisses ensemble. Cette approche peut être utilisée pour produire des échafaudages de complexes propriétés mécaniques. Cliquez ici pour agrandir la figure .
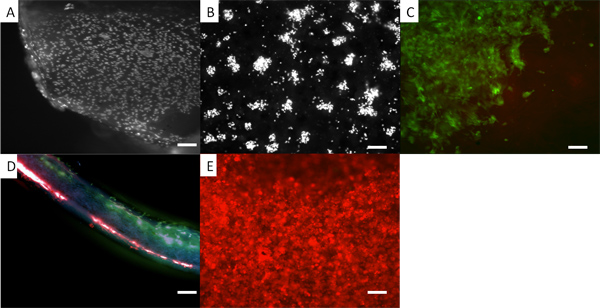
Fi gure 5. Apparence des cellules sur un échafaudage bicouche. Dans tous les cas, les cellules présentes sont des fibroblastes dermiques humains. (A) sur des fibroblastes électrofilées PLA où les cellules sont fixées et colorées avec du DAPI. (B) des cellules DAPI colorées sur PHBV. En (C) les fibroblastes sont pré-teint avec un colorant vital, vert CellTracker, et vous pouvez voir l'apparence d'entre eux sur le côté de l'APL de la bicouche. (D) Un article à travers la bicouche avec rouges fibroblastes colorées sur la surface inférieure PHBV et verts fibroblastes colorées sur la surface supérieure de PLA. (E) fibroblastes pré-teint avec du rouge CellTracker cultivées sur la surface PHBV. L'utilisation de colorants fluorescents vitaux fournit une méthodologie pratique pour regarder la distribution des cellules sur l'échafaud, tandis que les cellules sont encore en croissance. On peut régulièrement utiliser ces colorants pendant au moins 7 jours. Toutefois, la concentration de colorant se dilue que les cellules se divisent. Traits d'échelle est égal à 0,1 mm.
g6.jpg "alt =" Figure 6 "/>
Figure 6. Propriétés biomécaniques de électrofilées échafaudage sont obtenus en utilisant un condensat de Bose ElectroForce tensiomètre dispositif (A). (B) de contrainte / déformation courbes de PLGA échafaudages stérilisé par irradiation gamma, l'alcool, l'acide peracétique, ou aseptiquement produit. Trois mesures peuvent être obtenues à partir d'un tel diagramme: la contrainte maximale à la traction (Rm) à laquelle la fibre peut être soumis avant de se rompre, la souche à la traction et le module de Young. Celui-ci donne une indication de l'élasticité de l'échafaud. (C) L'effet de chaque méthode de stérilisation sur le diamètre des fibres PLGA en um. Chaque méthode de stérilisation a diminué UTS. L'acide peracétique et l'irradiation gamma diminuer le module d'Young donnant une plus élastique échafaud, l'alcool fait l'échafaud particulièrement fragiles. Cliquez ici pour agrandir la figure .

Figure 7. Cette figure montre l'utilisation d'un ballon simple de fournir un bioréacteur biaxiale sur lequel échafaudages (et les cellules en croissance dans les échafaudages) peuvent être soumis à la distension biaxiale pour des périodes de temps. (A) un ballon dégonflé sur lequel électrofilé fibres, PHBV, ont été déposés. A ce stade, le ballon est partiellement recouverte de fibres. (B) un ballon entièrement revêtue d'PHBV et PLA fibres. (C) Une suspension de cellules est à plusieurs reprises à la pipette sur le ballon. (D) Un ballonnet placé à l'intérieur d'une bouteille de milieu stérile où le ballonnet est relié à une pompe à seringue et le PBS (utilisé comme électrolyte conducteur) est utilisé pour gonfler lentement et permettre le dégonflage du ballon contre un programme programmé. (E) Cellules sur les échafaudages ont été retirés du ballon à la fin de l'expérience et les analyses effectuées pour la viabilité cellulaire montré dans (F) où les cellules viables développer une couleur bleu foncé en utilisant le métabolisme indicator 3 - (4,5-diméthylthiazol-2-yl) -2,5-diphényltétrazolium. (G) indique que les cellules (bleu) en culture sur ce ballon et soumise à une distension biaxiale élaborer les fibres d'élastine (vert, teinté en utilisant des anticorps spécifiques d'élastine), tandis que les mêmes cellules sur une identiques échafaudage (H) cultivée dans des conditions statiques ont négligeable d'élastine . Traits d'échelle est égal à 0,025 mm.
Access restricted. Please log in or start a trial to view this content.
Discussion
Électrofilage est une technique très populaire pour la production d'échafaudages pour l'ingénierie tissulaire. 14, 15, 16 Bien qu'il soit relativement simple à réaliser échafaudages électrofilées de base pour l'utilisation expérimentale de la technique est aussi complexe et multiforme avec de nombreuses variables. 6 Il existe de nombreuses études décrivant la façon dont le électrofilage paramètres déterminent l'échafaud produit. Dans cette étude l'accent es...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions le BBSRC pour le financement d'un doctorat de M. Frazer Bye.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Polylactique-co-acide glycolique | Sigma-Aldrich | ||
| Acide polylactique | Sigma-Aldrich | 81273 | La viscosité inhérente ~ 2.0dl / g |
| Poly ε-caprolactone | Sigma-Aldrich | ||
| Poly-hydroxybutyrate-co-hydroxyvalérate 12:01 | Goodfellow | 578-446-59 | PHB88/PHV12 |
| Dichlorométhane | Sigma-Aldrich ou de Fisher | 270997 ou D/1850/17 | > 99,8% contient un stabilisant 50-150ppm amylène |
| 50 multi-ballons colorés | Wilkinson Hardware Stores Ltd | 0105790 | |
| De chèvre anti-IgG de lapin (FC): FITC | AbDserotec | STAR121F | |
| De lapin anti-alpha humain élastine | AbDserotec | 4060-1060 | |
| Vis GL45 PP 2 Port, pk / 2 | SLS | 1129750 | |
| 4 ',6-diamidino-2-phénylindole dichlorhydrate | Sigma-Aldrich | 32670 | |
| CellTracker vert CMFDA | Invitrogen | C7025 | |
| CellTracker rouge CMTX | Invitrogen | C34552 |
Références
- Canton, I., McKean, R., Charnley, M., Blackwood, K., Fiorica, C., Ryan, A., MacNeil, S. Development of an Ibuprofen-releasing biodegradable PLA/PGA electrospun scaffold for tissue regeneration. Biotechnology and bioengineering. 105, 396-408 (2010).
- Blackwood, K., McKean, R., Canton, I., Freeman, C., Franklin, K., Cole, A., Brook, I., Farthing, P., Rimmer, S., Haycock, J., Ryan, A., MacNeil, S. Development of biodegradable electrospun scaffolds for dermal replacement. Biomaterials. 29, 3091-3104 (2008).
- Yang, F., Maurugan, R., Wang, S., Ramakrishna, S. Electrospinning of nano/micro scale poly(L-lactic acid) aligned fibers and their potential in neural tissue engineering. Biomaterials. 26, 2603-2610 (2005).
- Sittichokechaiwut, A., Edwards, J. H., Scutt, A. M., Reilly, G. C. Short bouts of mechanical loading are as effective as dexamethasone at inducing matrix production by human bone marrow mesenchymal stem cell. Eur. Cell Mater. 20, 45-57 (2010).
- Sill, T. J., von Recum, H. A. Electrospinning: applications in drug delivery and tissue engineering. Biomaterials. 29 (13), 1989-2006 (2008).
- Deitzel, J., Kleinmeyer, J., Harris, D., Beck Tan, N. C. The effect of processing variables on the morphology of electrospun nanofibers and textiles. Polymer. 42, 261-272 (2001).
- Fridrikh, S., Yu, J., Brenner, M., Rutledge, G. Controlling the fiber diameter during electrospinning. Physical review letters. 90, 1-4 (2003).
- Fong, H., Chun, I., Reneker, D. Beaded nanofibers formed during electrospinning. Polymer. 40 (16), 4585-4592 (1999).
- Selim, M., Bullock, A. J., Blackwood, K. A., Chapple, C. R., MacNeil, S. Developing biodegradable scaffolds for tissue engineering of the urethra. BJU Int. 107 (2), 296-302 (2010).
- Tong, H. -W., Wang, M. An investigation into the influence of electrospinning parameters on the diameter and alignment of poly(hydroxybutyrate-co-hydroxyvalerate) fibers. Journal of Applied Polymer Science. 120 (3), 1694-1706 (2011).
- Tong, H. -W., Wang, M. Electrospinning of poly(hydroxybutyrate-co-hydroxyvalerate) fibrous tissue engineering scaffolds in two different electric fields. Polymer Engineering & Science. 51 (7), 1325-1338 (2011).
- Retzepi, M., Donos, N. Guided Bone Regeneration: biological principle and therapeutic applications. Clinical oral implants research. 21, 567-576 (2010).
- Moreau, J., Caccamese, J., Coletti, D., Sauk, J., Fisher, J. Tissue engineering solutions for cleft palates. Journal of oral maxillofacial. 65, 2503-2511 (2007).
- Yang, F., Both, S., Yang, X., Walboomers, X., Jansen, J. Development of an electrospun nano-apatite/PCL composite membrane for GTR/GBR application. Acta biomaterialia. 5, 3295-3304 (2009).
- Yoshimoto, H., Shin, Y., Terai, H., Vacanti, J. A biodegradable nanofiber scaffold by electrospinning and its potential for bone tissue engineering. Biomaterials. 24, 2077-2082 (2003).
- Telemeco, T., Ayres, C., Bowlin, G., Wnek, G., Boland, E., Cohen, N., Baumgarten, C., Mathews, J., Simpson, D. Regulation of cellular infiltration into tissue engineering scaffolds composed of submicron diameter fibrils produced by electrospinning. Acta biomaterialia. 1, 377-385 (2005).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon