Method Article
Bewertung von Muscle Funktion des Extensor digitorum longus
In diesem Artikel
Zusammenfassung
Änderungen in den Extremitäten Muskeln kontraktilen und passiven mechanischen Eigenschaften sind wichtige Biomarker für Muskelerkrankungen. Dieses Manuskript beschreibt physiologischen Tests, um diese Eigenschaften in der murinen extensor digitorum longus und tibialis anterior messen.
Zusammenfassung
Körperbewegungen werden hauptsächlich durch mechanische Funktion Skelettmuskel vorgesehen ist. Skelettmuskulatur besteht aus zahlreichen Bündel von Muskelfasern, die durch intramuskuläre Bindegewebe ummantelt zusammengesetzt sind. Jedes myofiber enthält viele Myofibrillen, die in Längsrichtung verlaufen entlang der Länge des myofiber. Myofibrillen sind die kontraktilen Apparates von Muskel-und sie wiederholten kontraktilen Einheiten Sarkomere bekannt komponiert. Ein Sarkomer Gerät enthält Aktin und Myosin-Filamente, die durch die Z-Discs und Titin-Protein beabstandet sind. Mechanische Funktion der Skelettmuskel von den kontraktilen und passiven Eigenschaften des Muskels definiert. Die kontraktilen Eigenschaften werden verwendet, um die Größe der Kraft während der Muskelkontraktion, die Zeit des Krafterzeugung und Zeit der Muskelentspannung erzeugt charakterisieren. Jeder Faktor, Muskelkontraktion (wie Wechselwirkung zwischen Aktin und Myosin-Filamente, Homöostase von Calcium, ATP / ADP-Verhältnis usw.) beeinflusst beeinflusst die kontraktilen properties. Die passiven Eigenschaften beziehen sich auf die elastischen und viskosen Eigenschaften (Steifigkeit und Viskosität) des Muskels in Abwesenheit von Kontraktion. Diese Eigenschaften werden durch die extrazellulären und intrazellulären den strukturellen Komponenten (wie Titin) und Bindegewebe (insbesondere Kollagen) 1-2 bestimmt. Die kontraktilen und passiven Eigenschaften sind zwei untrennbare Aspekte der Muskelfunktion. Beispielsweise wird Ellenbogenflexion durch Kontraktion von Muskeln im vorderen Abteil der Oberarm und passive Dehnung von Muskeln in der hinteren Kammer des Oberarms erreicht. Um wirklich zu verstehen Muskelfunktion, sollten beide kontraktilen und passiven Eigenschaften untersucht werden.
Die Kontraktilität und / oder passiven mechanischen Eigenschaften des Muskels sind auch an Muskelerkrankungen kompromittiert. Ein gutes Beispiel ist die Duchenne-Muskeldystrophie (DMD), einer schweren Muskelschwund Krankheit durch Dystrophin-Mangel 3 verursacht. Dystrophin ist ein Zytoskelett protedaß stabilisiert die Muskelzellmembran (Sarkolemm) während der Muskelkontraktion 4. In Abwesenheit von Dystrophin, wird die Sarkolemm durch die Scherkraft während Kraftübertragung erzeugten beschädigt. Diese Membran reißt initiiert eine Kettenreaktion, die Muskelzelle Tod und Verlust der kontraktilen Maschinen führt. Als Folge davon wird Muskelkraft reduziert und toten Muskelfasern werden durch fibrotischen Geweben 5 ersetzt. Diese spätere Änderung erhöht Muskelsteifheit 6. Genaue Messung dieser Veränderungen bietet wichtige Orientierungshilfe bis zur Krankheitsprogression zu bewerten und therapeutische Wirksamkeit von neuartigen Gen / Zelle / pharmakologische Interventionen zu bestimmen. Hier präsentieren wir zwei Methoden, um sowohl kontraktilen und passiven mechanischen Eigenschaften des extensor digitorum longus (EDL) Muskel-und der kontraktilen Eigenschaften des tibialis anterior (TA) Muskeln zu bewerten.
Protokoll
Ein. Die Auswertung der kontraktile und passive Eigenschaften der EDL Muscle Ex vivo
Die kontraktilen und passiven Eigenschaften des EDL Muskel ex vivo mit dem Aurora Scientific in vitro Muskeltest gemessen. Siehe Tabelle 1 für Materialien und Geräte.
1,1 Vorbereitung der Ausrüstung
- Montage des gewebespezifischen Organbad durch Befestigen des oxytube dem Wassermantel Gewebebad. Befestigen Sie den montierten Bad auf den Muskel Bestückungsvorrichtung. Schließen Sie die Gasleitung zum oxytube. Befestigen Sie die Wasserzirkulation Leitungen an das Wasser-jacket Gewebe Bad und legen Sie das Nadelventil in die Badewanne Entwässerung.
- Einschalten des zirkulierenden Wasserbad und die Temperatur auf 30 ° C 7. Erlauben 5 PSI (pounds per square inch) von 95% O 2 -5% CO 2, um durch die oxytube fließen. Füllen Sie die Badewanne mit Ringer-Puffer. Äquilibrieren der Puffer für mindestens10 min mit einem konstanten Gasstrom durch Einstellen der oxytube Ventil.
- Schalten Sie die Instrumente (Stimulator, Dual-Mode-Hebel-System und Signal-Schnittstelle). Legen Sie die dynamische Steuerung der Muskulatur (DMC) Software nach Herstellerangaben.
1,2 EDL Muskel-Dissektion
Alle Tierversuche müssen vom Institutional Animal Care und Use Committee genehmigt werden.
- Anästhesieren der Maus bei intraperitonealer Injektion von 2,5 ul / g Körpergewicht des Narkosemittels Cocktail (siehe Materialien Abschnitt). Während des gesamten chirurgischen Eingriffs wurde die Tiefe der Sedierung durch Durchführen einer Zehe Pinch überprüft. Ein Zuschlag von 10% des anfänglichen Betäubung Dosis verabreicht wird, wenn nötig, um das Tier in Narkose zu halten. Rasieren Hinterbein. Pflegen Sie die Körperkerntemperatur bei 37 ° C vor der Dissektion Prozedur, indem Sie die Maus auf einem Heizkissen. Die Körpertemperatur wird durch die ständige Messung der rektalen temperat überwachture Verwendung einer thermischen Sonde.
- Bewegen Sie die Maus in Rückenlage auf der Dissektion Platine (Abbildung 1). Ziehen Sie das Bein Haut zu entlarven die Hinterbein Muskeln. Sichern des Beines auf der Sylgard Block unter Verwendung von zwei Pins damenschneiderin, eine in dem Fuß und das andere in der gracilis. Platzieren einer Wärmelampe über dem Körper, um die Maus Kernkörpertemperatur bei 37 ° C zu halten Ständig superfuse alle freiliegenden Muskeln mit Ringer-Puffer. Überschüssiges Puffer durch eine Saugleitung.
- Setzen Sie den distalen TA Sehne und die extensor Ligamentum unter einem Stereomikroskop durch Sezieren die Haut in Richtung des Fußes. Entfernen Sie vorsichtig die Blende für den TA Muskel. Schneiden Sie die extensor Ligamentum das distale TA Sehnen befreien.
- Entzieht dem distalen TA Sehne und es verwenden, um beim Abziehen der TA Muskel. Entfernen Sie vorsichtig die TA Muskel an seinem proximalen Befestigung. Legen Sie ein dünnes Stück Ringer-Puffer getränkte Baumwolle neben dem EDL Muskel Blutungen durch den Bruch der TA Muskel Gefäßsystem zu absorbieren. Verwenden Sie die Vakuum-Leitung, um überschüssige Puffer und Blut zu entfernen.
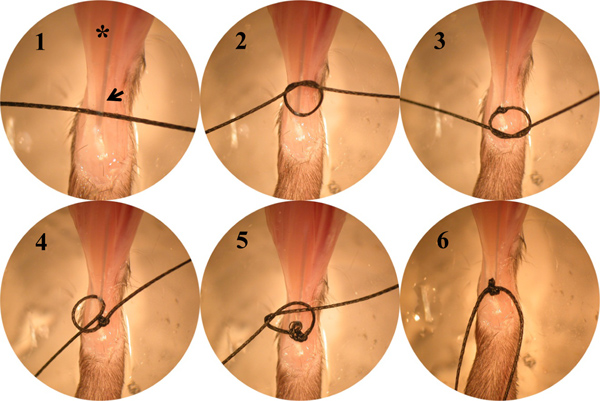
- Binden Sie eine doppelte eckige Knoten durch eine Schlaufe knoten mit einem Brot Seidennaht am Muskel-Sehnen-Übergang (MTJ) des distalen EDL Muskel (Abbildung 2). Einen Einschnitt in dem distalen Teil des M. biceps femoris, um das proximale EDL Muskel freizulegen. Wiederholen den gleichen Satz von Knoten (Abbildung 2) an der MTJ des proximalen EDL Sehne. Befestigen Sie den Hebelarm Haken entweder an den proximalen oder der distalen Äste mit einem doppelten Kreuzknoten mit der gleichen Naht. Schneiden Sie die restliche Naht.
- Schneiden Sie den proximalen EDL Sehne über dem proximalen Naht Knoten. Heben Sie die EDL Muskel mit dem Haken und schneiden Sie das Gefäßsystem unter dem Muskel. Schneiden Sie den distalen EDL Sehne schlechter als die distale Nahtmaterial Knoten, um die EDL Muskel von der hinteren Extremität zu entfernen. Bedecken Sie den exponierten Hinterbein mit einem Stück Ringer-Puffer getränkte Baumwolle.
- Bringen Sie den Haken, um den Hebelarm. Richten Sie den Muskel vertikalzwischen zwei Elektroden. Sichern Sie den distalen Naht an dem feststehenden Ständer. Heben Sie das Gewebe Bad zu tauchen der Muskel in Ringer-Puffer. Einstellen der Ruhespannung bis 1,0 g unter Verwendung des dualen grob / fein Translationsbühne und erlauben der Muskel für mindestens 10 min sich ausgleichen lassen.
1,3 Messung der kontraktilen und passiven Eigenschaften des EDL Muskel
Verwenden Sie Tabelle 2, um die Parameter in der DMC-Software für jede der folgenden Messungen. Analyse der Daten unter Verwendung der dynamischen Muskel Analyse (DMA)-Software.
1.3.1 Messung der kontraktilen Eigenschaften des EDL Muskel
- Stimulieren die EDL Muskel dreimal bei 150 Hz mit 60 sec auseinander, um die Muskel-8 zu stabilisieren.
- Stimulieren die EDL Muskel an verschiedenen Ruhestätte Spannungen, die optimale Länge (Lo) zu bestimmen. Die optimale Länge ist die Länge, bei der Muskeln entwickelt ein maximales twitch Spannung. Lassen Sie den MuskelEntspannung für 2 min.
- Passen Sie die Ruhespannung auf Lo. Messen Muskelkraft an einzelnen twitch Stimulation. Bestimmen Sie die absolute Zuckungskraft (Pt), Zeit bis zum Peak Spannung (TPT) und die Hälfte Relaxationszeit (½ RT) des Pt. Lassen Sie die Muskeln für 2 min entspannen.
- Passen Sie die Ruhespannung auf Lo. Messen tetanische Muskelkraft bei unterschiedlichen Anregungsfrequenzen (50, 80, 100, 120, 150 und 200 Hz) erzeugt. Bestimmen Sie die absolute maximale tetanische Muskelkraft (Po), wo Muskelkraft erreicht maximal. Messen Sie die TPT und ½ RT des Po 9.
- Lassen Sie die Muskeln für 5 min zu entspannen. Passen Sie die Ruhespannung auf Lo. Übernehmen 10 Zyklen von exzentrischen Kontraktionen mit 2 min Pause zwischen den Zyklen. Berechne die relativen Kraftverlust des Po nach jedem Zyklus der exzentrischen Kontraktion.
- Nehmen Sie die EDL Muskel aus dem Gerät und schneiden die Sehnen an der Nahtstelle. Bestimmen Sie den Muskel Nassgewicht und berechnen den Muskel Querschnittsfläche (CSA)6,10.
1.3.2 Messung der passiven Eigenschaften des EDL Muskel
- Sezieren die kontralateralen EDL Muskel und befestigen Sie es an der Vorrichtung, wie in Abschnitt 1.2, Schritte 2 bis 7.
- Betrifft die EDL Muskel zu einer sechsstufigen Dehnen Protokoll, bei dem die Muskulatur zu 160% Lo mit einer Schrittweite von 10% Lo wird gespannt. Analysieren Sie die Spannungs-Dehnungs-Profil 6.
- Bewerten Sie die viskose Eigenschaft des EDL Muskel durch Messung der Spannungsrelaxation Rate (SRR) auf den folgenden Zeitrahmen nach dem Dehnen und Halten der Muskeln bei 10% Min: von Gipfel zu 0.1s post-peak (pp), von 0,1 bis 0,2 s pp, von 0,2 bis 0,5 s pp von 0,5 bis 1s pp und von 1 bis 1,5 s S.
- Am Ende der Studie euthanize die Maus durch zervikale Dislokation und / oder Dekapitation während die Maus noch in Narkose. Nehmen Sie die EDL Muskel aus dem Gerät und schneiden die Sehnen an der Nahtstelle. Bestimmen Sie den Muskel Nassgewicht und berechnen den Muskel Kreuz sectional Bereich (CSA) 6, 10.
2. Die Auswertung der kontraktilen Eigenschaften der TA Muscle In situ
Die kontraktilen Eigenschaften der TA Muskeln werden mit dem Aurora Scientific in situ Muskel-Testsystem. Siehe Tabelle 1 für Materialien und Geräte.
2,1 Vorbereitung der Ausrüstung
- Heizen Sie den thermo-kontrollierten Tierreich bis 37 ° C mit dem zirkulierenden Wasserbad.
- Schalten Sie die Instrumente (Stimulator, Dual-Mode-Hebel-System und Signal-Schnittstelle). Legen Sie die DMC Software nach Herstellerangaben.
2.2 Herstellung der TA Muskel für in situ Kraftmessung
- Anesthetize die Maus, rasieren die Hinterbein und setzen die TA Muskel wie in den Schritten 1 bis 3 beschrieben in Abschnitt 1,2.
- Binden Sie eine doppelte eckige Knoten um die Patella Ligament using ein Brot Seidennaht. Binden Sie einen Doppelklick Kreuzknoten durch eine Schleife Knoten an der MTJ des distalen TA Muskel (Abbildung 2) gefolgt, binden ein weiteres doppeltes Kreuzknoten Verlassen eines ~ 10 mm Schleife von der distalen TA Sehne Knoten mit der gleichen Naht. Legen Sie die zweite doppelte eckige Knoten auf der Seite der Schleife.
- Entfernen Sie die Stifte aus dem Hinterbein und positionieren das Tier anfällig. Setzen Sie den biceps femoris. Einen Einschnitt in der Mittellinie den Ischiasnerv zu offenbaren. Binden Sie einen Doppelklick Kreuzknoten um das proximale Ende der Ischiasnerv. Trimmen einer Seite der Nahtlinien und schneiden den Nerv überlegen den Knoten. Sanft, ziehen Sie den Ischiasnerv in Richtung Knie mit der Naht und deaktivieren Sie das umgebende Bindegewebe zu befreien ~ 5 mm seiner Länge. Dehnen Sie nicht den Nerv während dieser Prozedur und ständig superfuse den Nerv mit Ringer-Puffer.
- Bereiten Sie den kontralateralen TA Muskel wie in den Schritten 1 bis 3 beschrieben. Deckung eines von der freiliegenden Hintergliedmaße mit einem Stück Ringer-Puffer getränkt Baumwolle. Ständig superfuse beide Hinterbeine mit vorgewärmter (37 ° C) Ringer-Puffer. Entfernen Sie das überschüssige Puffer durch eine Saugleitung.
- Positionieren Sie das Tier in Bauchlage auf dem Tier-Plattform. Bringen Sie die Knie Klemmhalter für das Tier-Plattform und sichern beide Knie zum Metallstift mit doppelte eckige Knoten über die Patella Bandnaht Linien. Merken beide Füße auf den Sylgard Block mit Schneiderin Pins. Sichern Sie das Tier-Plattform auf die thermo-kontrollierten Phase. Positionieren des Wärmelampe, um das Tier Kernkörpertemperatur bei 37 ° C zu halten
- Sichern Sie den Elektrodenhalter für das Tier-Plattform und legen den Ischiasnerv auf der Elektrode mit der Naht. Halten der Elektrode weg von den hinteren Extremität Muskeln. Schneiden Sie den distalen TA Sehne des ungedeckten Hinterbein an der MTJ Nahtstelle. Kleben Sie den distalen TA Sehnennaht Schleife mit dem Hebelarm Haken. Bedecken Sie den exponierten Hinterbein Muskel mit einem warmen Ringer-Puffer getränkte Baumwolle.
2,3 Messung der kontraktilen Eigenschaften der TA Muskel
- Verwenden Sie Tabelle 2, um die Parameter in der DMC-Software eingestellt. Folgen Sie dem gleichen Protokoll in Abschnitt 1.3.1 beschrieben, um die kontraktilen Eigenschaften der TA Muskel zu bestimmen. Analyse der Daten unter Verwendung des DMA-Software.
- Nach kontraktilen Messung der Eigenschaften, nehmen Sie den distalen TA Sehnennaht Schleife von der Richtmaschine arm Haken. Entfernen Sie die TA Muskel. Bestimmen Sie den Muskel Nassgewicht und berechnen die CSA 10.
- Messen die kontraktilen Eigenschaften der kontralateralen Muskeln TA nach Schritten 1 bis 3 beschrieben. Euthanize die Maus nach den Richtlinien des Instituts am Ende der Studie.
Ergebnisse
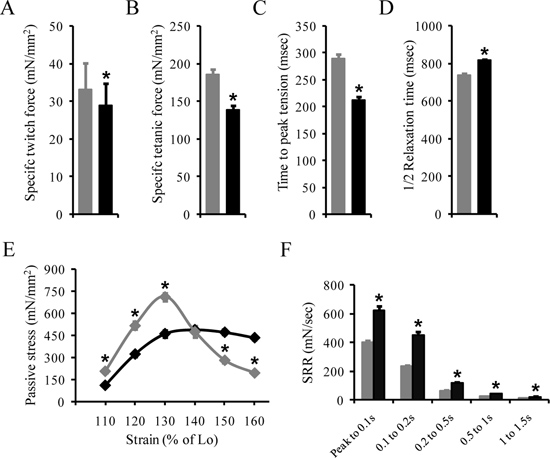
Die folgenden Ergebnisse sind eine Darstellung von unseren früheren Berichten 6,9. Die Daten sind als Mittelwert ± Standardabweichung der mittleren vorgestellt. Tabelle 3 zeigt die morphometrischen Eigenschaften der EDL Muskel im normalen BL10 und Dystrophin-defizienten (MDX) Mäusen bei 4 bis 6 Monate alt. Abbildung 4 zeigt repräsentative kontraktilen und passiven Eigenschaften der EDL Muskel von BL10 und mdx-Mäusen. Die kontraktilen Eigenschaften der EDL Muskeln werden durch die folgenden Begriffe einschließlich der spezifischen (absolute Kraft durch den CSA geteilt) Zuckungskraft (4A), spezifische maximale tetanische Kraft (4B), TPT und ½ RT der absolute maximale tetanische Kraft beschrieben (4C und D). Die TPT und ½ RT kann auch aus der absoluten Zuckungskraft berechnen. Die Spannungs-Dehnungs-Profil (Abb. 4E) und SRR (4F) einewieder verwendet, um die passive Eigenschaften der EDL Muskel beschreiben.
Fehlen von Dystrophin hat einen signifikanten Einfluss auf die kontraktilen und passiven Eigenschaften des EDL Muskel 6,9. Spezifische zucken und tetanischen Kräfte sind deutlich in der mdx EDL Muskel reduziert. Die TPT ist deutlich schneller, während die ½ RT ist deutlich langsamer in der mdx EDL Muskel. Die Spannungs-Dehnungs-Profil legt nahe, dass die Steifigkeit signifikant in der mdx EDL Muskeln erhöht. Die mdx EDL Muskel ergibt auch eine deutlich höhere Beständigkeit Kraft (passiver Stress) vor Erreichen der Peak-Belastung, während die Nachspitzen-Spannungen wesentlich schneller sinken. Ferner betrug die SRR signifikant höher in der EDL mdx Muskels verglichen zu der des BL10 EDL Muskel.
Statistische Analyse
Statistische Signifikanz zwischen beiden Gruppen wird durch den Student-t-Test analysiert. Für sTATISTISCHE Bedeutung unter mehreren Gruppen, Einweg-oder Zwei-Wege-ANOVA Analyse Bonferroni post-hoc-Analyse gefolgt wird empfohlen mit der SAS-Software (SAS Institute Inc., Cary, NC). Differenz wird als signifikant angesehen, wenn p <0,05.
Tabelle 1. Materialien und Geräte.
| Experiment | Ruhespannung (Gramm) | Pulsfrequenz (Hz) | Impulsbreite (ms) | Stimulation Dauer (ms) | Stretch Länge | Stretch Dauer (ms) | Stretch bewerten | Kommentare |
| Ein. Evaluation der kontraktilen und passiven Eigenschaften des EDL Muskel ex vivo | ||||||||
| 1.3.1 Messung der kontraktilen Eigenschaften des EDL Muskel | ||||||||
| Ein. Wärmen | 1,0 | 150 | 0,2 | 300 | Ruhen die Muskeln für 60 Sekunden zwischen jedem Impuls. Diese vorläufigen tetanische Kontraktionen Stabilisierung der Muskulatur für weitere Messungen. | |||
| 2. Optimal Muskellänge (Lo) | 0,5, 1,0, 1,5 und 2,0 | 1 | 0,2 | 300 | Lassen Sie die Muskeln für 30 Sekunden zwischen jedem Stimulus entspannen. Messen Sie den Muskel optimale Länge mit einem digitalen Messschieber. | |||
| 3. Einzel twitch Kraft (Pt) | Passen Ruhespannung auf Lo | 1 | 0,2 | 300 | ||||
| 4. Tetanic Muskelkraft | Passen Ruhespannung auf Lo | 50, 80, 100, 120, 150 und 200 | 0,2 | 300 | Lassen Sie die Muskeln für 1 Minute zwischen jedem Stimulus entspannen. Bestimmen Sie die Frequenz, die die maximale absolute tetanische Kraft (Po) zu generieren. | |||
| 5. Exzentrischen Kontraktion | Passen Ruhespannung auf Lo | Verwenden Sie die Frequenz, die die maximale tetanische Kraft (Po) erwirtschaftet | 0,2 | 700 | 10% Lo | letzten 200 ms der Stimulationsdauer | 0,5 Min / sec | Wiederholen Sie den exzentrischen Kontraktion für 10 Zyklen mit 2 min Pause zwischen den Zyklen. |
| 6. CSA der EDL Muskel | CSA = (Muskelmasse (g) / [1,06 g / cm 3 x (Lo x 0,44)]. 1,06 g / cm 3 ist die Muskel-Dichte und 0,44 ist die EDL Muskelfaser Länge-Verhältnis Lo. | |||||||
| 1.3.2 Messung der passiven Eigenschaften des EDL Muskel | ||||||||
| Ein. Sechs-Schritt-Stretching-Protokoll | Passen Ruhespannung auf Lo | 10% Lo | 2 cm / sec | Wiederholen der Dehnung Protokoll mit einer Schrittweite von 10% bis 160% Lo Lo erreicht ist. Alow 1,5 sec zwischen Dehnungszyklen. | ||||
| 2. SRR | Passen Ruhespannung auf Lo | 10% Lo | 2 cm / sec | SSR wird durch Teilen der Differenz in der Belastung mit der t berechnetime zwischen zwei Zeitpunkten in einem Zeitrahmen verstrichen ist. | ||||
| 2,3 Messung der kontraktilen Eigenschaften der TA Muskel | ||||||||
| Ein. Wärmen | 4,0 | 150 | 0,2 | 300 | Ruhen die Muskeln für 60 Sekunden zwischen jedem Impuls. | |||
| 2. Optimal Muskellänge (Lo) | 3,0, 4,0, 5,0, 6,0 und 7,0 | 1 | 0,2 | 300 | Lassen Sie die Muskeln für 30 Sekunden zwischen jedem Stimulus entspannen. Messen Sie den Muskel optimale Länge mit einem digitalen Messschieber. | |||
| 3. CSA der TA Muskel | CSA = (Muskelmasse (g) / [1,06 g / cm 3 x (Lo x 0,6)]. 0,6 TA ist die Muskelfaser Länge Lo ratio. | |||||||
Tabelle 2. Parameter für die Beurteilung der mechanischen Eigenschaften der EDL und TA Muskeln.
| Belasten | Alter (Monate) | Körpergewicht (g) | EDL Gewicht (mg) | EDL Lo (mm) | EDL CSA (mm 2) |
| BL10 | 6 | 32,03 ± 0,57 | 13,90 ± 0,77 | 14,09 ± 0,04 | 2,12 ± 0,12 |
| mdx | 6 | 35,44 ± 0,42 * | 16,73 ± 0,42 * | 13,93 ± 0,05 * | 2,57 ± 0,07 * |
Tabelle 3. Morphometrischen Eigenschaften der EDL Muskel. * Der Wert in MDx Mäusen signifikant verschieden von der BL10-Mäuse im Alter passende.
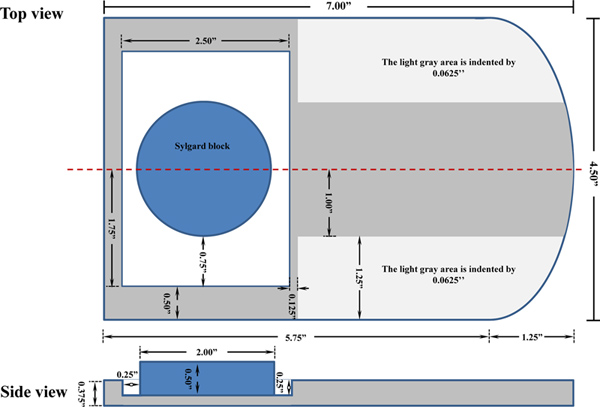
Abbildung 1. Eine schematische Darstellung der maßgeschneiderten Maus Dissektion Bord. Die Dissektion Bord wird von einem ½ Zoll dick Plexiglas gefertigt und wurde auf der institutionellen Geschäft hergestellt. Klicken Sie hier für eine größere Abbildung zu sehen .
 />
/>
Abbildung 2. Eine Serie von digitalen Bildern, das die Schritte der Kopplung eine doppelte Kreuzknoten durch eine Schleife Knoten am MTJ gefolgt. Asterisk, dieEDL Muskel, Arrow, das distale Sehne des EDL Muskel.
 />
/>
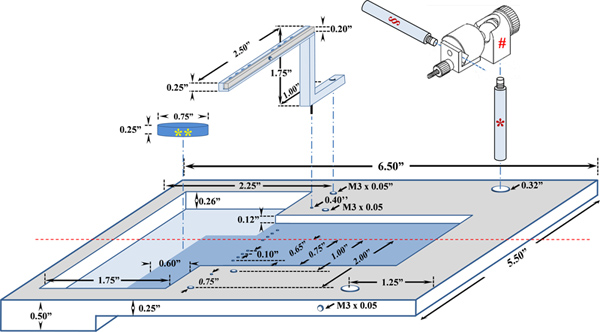
Abbildung 3. Eine schematische Darstellung der maßgeschneiderte Plattform für in situ TA Muskelfunktion Assay. Das Plexiglas Tier-Plattform und die Edelstahl Kniehalter wurden entwickelt, um auf dem 809B in situ Maus Apparat montieren. * Stab aus Edelstahl (Cat # MPR-2.0 , Siskiyou, Grants Pass, OR); #, Universal Elektrodenhalter (Cat # MXB, Siskiyou, Grants Pass, OR), §, Elektrode Befestigungsstange (Cat # MPR-3.0, Siskiyou, Grants Pass, OR); ** Sylgard Block. Klicken Sie hier für eine größere Abbildung zu sehen .
 />
/>
Abbildung 4. Repräsentative Ergebnisse für die kontraktilen und passiven Eigenschaften des EDL Muskel. Die kontraktilen Eigenschaften der EDL Muskel werden durch die spezifische Zuckungskraft (A), dem spezifischen tetanische Kraft (B), die Zeit bis zur maximalen Spannung (C) und die Halb-Relaxationszeit (D) aufweist. Die passiven Eigenschaften des EDL Muskels durch das Spannungs-Dehnungs-Profil (E) und dem SSR beurteilt. * Sind mdx-Mäusen signifikant von BL10 Mäusen Alter abgestimmt.
Diskussion
In diesem Protokoll haben wir physiologischen Assays zur Messung der Kontraktionskraft und passiven Eigenschaften die EDL Muskel und die kontraktilen Eigenschaften des Muskels TA dargestellt. Ein wichtiges Anliegen in der Muskelphysiologie Studien ist die Sauerstoffversorgung des Zielmuskel. Für große Muskeln (z. B. die TA-Muskel), wird die in situ-Ansatz bevorzugt, da Sauerstoffdiffusion von Ringer-Puffer nicht erreichen kann die Mitte des Muskels in einem in vitro-Assay. In situ-Ansatz nicht stört normalen Blutzufuhr und Hypoxie-assoziierten künstlichen Effekte vermieden werden. Die EDL Muskel ist einer der am häufigsten verwendeten Muskeln in der Physiologie Studie. Ausreichende Sauerstoffversorgung des gesamten Muskel kann in einem in vitro-System werden wegen der geringen Größe des Muskels erreicht. Ferner stellt die in vitro-System einen geschlossenen Umgebung, um die Konzentrationen von Ionen (Ca 2 +, Na + und K +) manipulieren und chemischcals (ATP und Glucose), die notwendig für eine optimale Muskelkraft Generation. Dies bietet eine gute Gelegenheit, um die Wirkung dieser Variablen auf die Kraftentwicklung zu studieren.
Genaue Messung der Kontraktionskraft und passiven Eigenschaften des Schenkels Muskel ist kritisch für Skelettmuskelfunktion studieren. Charakteristische Veränderungen dieser Eigenschaften werden oft als Kennzeichen der verschiedenen Muskelerkrankungen betrachtet. Veränderungen dieser Parameter sind auch wichtige Indikatoren, um zu bestimmen, ob eine experimentelle Therapie wirksam ist oder nicht.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde durch Zuschüsse aus dem National Institutes of Health (AR-49419, DD), Gesellschaft für Muskeldystrophie (DD) und NIH Ausbildungsförderung T90DK70105 (CH) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Material | Hersteller | Technische Daten und Kommentare | |
| Tissue-Organbad | Radnoti LLC, CA, USA | Water-jacket Gewebe Bad (Cat # 158351-LL), Sauerstoff Dispergierer Rohr (Cat # 160192), Luer-Ventil (Cat # 120722) | |
| Zirkulierenden Wasserbad | Fisher Scientific, Waltham, MA, USA | ||
| Gas-Mix | Airgas National, Charlotte, NC, USA | 95% O 2 und 5% CO 2 | |
| In vitro Muskelfunktion Prüfvorrichtung | Aurora Scientific, Aurora, ON, Kanada | Das System besteht aus einem Stimulator (Modell # 701A), eine Dual-Modus-Hebel-System (Modell # 300C oder 305C), einer Signal-Schnittstelle (Modell # 604B) und einem Test apparatus (Model # 800A) vertikal montieren Gewebe Organbad | |
| In vitro Muskelfunktion Assay-Software | Dynamische Muskelkontrolle (DMC) und dynamische Software-Muskel Steuerdaten Analyse (DMA)-Software | ||
| Maus Anästhesie Cocktail in 0,9% NaCl gemischt | Beziehen sich auf die institutionellen Richtlinien | Ketamin (25 mg / ml), Xylazin (2,5 mg / ml) und Acepromazin (0,5 mg / ml). Während des gesamten chirurgischen Eingriffs kann ein Zuschlag von 10% der ursprünglichen Dosis benötigt wird, um Tier in Narkose zu halten. | |
| Sylgard | World Precision Instruments | Cat # SYLG184 | |
| Ein maßgeschneidertes Plexiglas Dissektion Bord | In Haus entworfen | Siehe Abbildung 1 | |
| Heizlampe | Tensor Lighting Company,Boston, MA, USA | 15 Watt-Lampe, um die Maus warmen beim Präparieren halten | |
| Ringer-Puffer | Chemikalien werden von Fisher Scientific, Waltham, MA, USA gekauft | Zusammensetzung in mM: 1,2 NaH 2 PO 4 (Cat # S369), 1 MgSO 4 (Cat # M63), 4,83 KCl (Cat # P217), 137 NaCl (Cat # 217), 24 NaHCO 3 (Cat # S233), 2 CaCl 2 (Cat # C79) und 10 Glukose (Cat # D16). Lösen Chemikalien einzeln und mischen in der oben angegebenen Reihenfolge. Lagerung bei 4 ° C. | |
| Stereo Binokular | Nikon, Melville, NY, USA | ||
| Dissection Tools | Fine Science Tools, Foster City, CA, USA | Grob Pinzette, grob Schere, feinen Pinzette (gerade und 45 °-Winkel) | |
| Braided Seidennaht # 4-0 | SofSilk USSC Suturen, Norwalk, CT, USA | Cat # SP116 | |
| Eine maßgeschneiderte Edelstahl-Haken | Small Parts, Inc. | 2'' langen S / S 304V (0,18'' Durchmesser) für Kraftaufnehmer 305C oder 2,5'' long S / S 304V (0,012'' Durchmesser) für Wandler 300C (Cat # ASTM A313) | |
| In situ Muskelfunktion Assaysystem | Aurora Scientific, Aurora, ON, Kanada | Das System (809B, in situ Maus Vorrichtung) aus einem Stimulator (Modell # 701B), eine Dual-Modus-Hebel-System (Modell # 305C), einer Signal-Schnittstelle (Modell # 604A) und einer Fußplatte temperaturgeregelt Vorrichtung (Modell # 809A ) | |
| In vitro Muskelfunktion Assay-Software | Aurora Scientific, Aurora, ON, Kanada | Dynamische Muskelkontrolle (DMC) und dynamische Software-Muskel Steuerdaten Analyse (DMA)-Software | |
| Ein maßgeschneidertes TA Assay Tier-Plattform | In Haus entworfen | Siehe Abbildung 2 | |
| Eine maßgeschneiderte Edelstahl-Haken | Small Parts, Inc. | Cat # ASTM A313 | 0,5'' long S / S 304V (0,18'' Durchmesser) |
| Custom-made 25G Platinelektroden | Chalgren Enterprises, Gilroy, CA | Solder zwei 0,016'' dicken Platin-Drähte an zwei 24G elektrischen Leitungen |
Tabelle 1. Materialien und Geräte.
Referenzen
- Huijing, P. A. Muscle as a collagen fiber reinforced composite: a review of force transmission in muscle and whole limb. J. Biomech. 32, 329-345 (1999).
- Moss, R. L., Halpern, W. Elastic and viscous properties of resting frog skeletal muscle. Biophys. J. 17, 213-228 (1977).
- Hoffman, E. P., Brown, R. H., Kunkel, L. M. Dystrophin: the protein product of the Duchenne muscular dystrophy locus. Cell. 51, 919-928 (1987).
- Petrof, B. J., Shrager, J. B., Stedman, H. H., Kelly, A. M., Sweeney, H. L. Dystrophin protects the sarcolemma from stresses developed during muscle contraction. Proc. Natl. Acad. Sci. U.S.A. 90, 3710-3714 (1993).
- Pastoret, C., Sebille, A. mdx mice show progressive weakness and muscle deterioration with age. J. Neurol. Sci. 129, 97-105 (1995).
- Hakim, C. H., Grange, R. W., Duan, D. The passive mechanical properties of the extensor digitorum longus muscle are compromised in 2- to 20-mo-old mdx mice. J. Appl. Physiol. 110, 1656-1663 (2011).
- Segal, S. S., Faulkner, J. A. Temperature-dependent physiological stability of rat skeletal muscle in vitro. Am. J. Physiol. 248, 265-270 (1985).
- Grange, R. W., Gainer, T. G., Marschner, K. M., Talmadge, R. J., Stull, J. T. Fast-twitch skeletal muscles of dystrophic mouse pups are resistant to injury from acute mechanical stress. Am. J. Physiol. Cell Physiol. 283, 1090-1101 (2002).
- Hakim, C. H., Duan, D. Gender differences in contractile and passive properties of mdx extensor digitorum longus muscle. Muscle Nerve. 45, 250-256 (2012).
- Hakim, C. H., Li, D., Duan, D. Monitoring murine skeletal muscle function for muscle gene therapy. Methods Mol. Biol. 709, 75-89 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten