Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Protokoll für Relative Hydrodynamische Beurteilung der Tri-Polymer Merkblatt Ventile
In diesem Artikel
Zusammenfassung
Es wurde Interesse an der Entwicklung Polymer Ventile erneuert. Hier sind die Ziele, um die Machbarkeit der Modifizierung eine kommerzielle Puls duplicator zu tri-Merkblatt Geometrien aufnehmen und ein Protokoll zu definieren Polymer Ventil hydrodynamischen Daten im Vergleich zu nativen und Klappenprothese Daten unter nahezu identischen Bedingungen gesammelt präsentieren zu demonstrieren.
Zusammenfassung
Einschränkungen der derzeit verfügbaren künstliche Herzklappen, Xenotransplantate und Homografts eine aktuelle Wiederaufleben der Entwicklungen im Bereich der Tri-Broschüre Polymer Klappenprothesen aufgefordert. Allerdings ist die Identifizierung eines Protokolls für die erste Bewertung der Polymer Ventil hydrodynamischen Funktionalität während der frühen Phasen des Design-Prozesses im Vordergrund. Traditionell in vitro Puls duplicator Systeme sind nicht so konfiguriert, dass flexible tri-Merkblatt Materialien aufnehmen, darüber hinaus, Bedarfsanalyse von Polymer Ventil Funktionalität in einem relativen Zusammenhang zu nativen und künstlichen Herzklappen unter identischen Testbedingungen hergestellt werden, so dass die Variabilität in Messungen aus verschiedenen Instrumente können vermieden werden. Dementsprechend führten wir hydrodynamischen Beurteilung i) Muttersprache (n = 4, mittlerer Durchmesser, D = 20 mm), ii) bi-Merkblatt mechanische (n = 2, D = 23 mm) und iii) polymer Ventile (n = 5, D = 22 mm) über die Verwendung eines handelsüblichen Puls duplicator System (ViVitro LabsInc, Victoria, BC), die wurde modifiziert, um tri-Merkblatt Ventil Geometrien unterzubringen. Tri-Broschüre Silikon Ventile an der University of Florida entwickelt umfasste die Gruppe Polymer Ventil. Ein Gemisch im Verhältnis von 35:65 Glycerin zu Wasser wurde verwendet, um Blut physikalischen Eigenschaften nachzuahmen. Momentanen Durchfluss an der Grenzfläche der linken Herzkammer und Aorta-Einheiten gemessen wird, während Druck an den Ventrikel und Aorta Positionen aufgenommen wurde. Bi-Broschüre und natürlichen Klappe Daten aus der Literatur wurde verwendet, um Durchfluss und Druck Lesungen validieren. Die folgenden hydrodynamischen Metriken wurden gemeldet: Vorlauf Druckabfall bedeuten Aortenwurzel Feld vorwärts Durchfluss, Aorten-Schließung, Leckage und Regurgitationsvolumen, transaortale endet, Leckage, und insgesamt Energieverluste. Repräsentative Ergebnisse zeigten, dass hydrodynamische Metriken aus den drei Gruppen erfolgreich Ventil könnte durch den Einbau eines custom-built-Baugruppe in einem handelsüblichen Puls duplicator und subsequentl erhalten werdeny, objektiv gegenüber Erkenntnisse über funktionelle Aspekte der Polymer Ventil Design bieten.
Einleitung
Herzklappenerkrankungen resultiert oft aus degenerative Verkalkung Ventil 1, 2 rheumatischen Fiebers, Endokarditis 3,4 oder angeborene Missbildungen. Wenn das Ventil Schaden tritt verursacht Stenose und / oder Erbrechen Ventil Prolaps und operativ nicht repariert werden kann, wird die natürliche Klappe normalerweise durch eine Herzklappe ersetzt. Die derzeit verfügbaren Optionen umfassen mechanische Ventile (Käfig-Kugelhähne, Kipp-Ventile, etc.), Homograft und bioprothetischen Ventile (Schwein und Rind Ventile). Mechanische Klappen werden oft bei jüngeren Patienten auf ihre Haltbarkeit beruhen empfohlen, aber der Patient ist erforderlich, um auf gerinnungshemmende Therapie zu verhindern thrombotischen Komplikationen 5 bleiben. Homograft und biologische Klappenprothesen wurden effektive Entscheidungen zu Blutverdünner Therapie zu vermeiden, jedoch haben diese Ventile erhöhten Risiko für Fibrose, Verkalkung, Degeneration, und immunogen Komplikationen führt zu Ausfall des Ventils 6. Tissue-Engineering-Ventile werden als eine neue Technologie 7-9 untersucht, aber es bleibt noch viel aufgedeckt werden. Alternative langlebig, biokompatibel, künstliche Herzklappen sind notwendig, um die Lebensqualität der Herzklappenerkrankungen Patienten zu verbessern. Auch hier könnte dieses Ventil Design ersetzen die Bioprothese in transcatheter Ventil-Technik verwendet, mit transcatheter Ansätze zeigt das Potenzial für die Umwandlung der Behandlung von ausgewählten Patienten mit Herzklappenerkrankungen 10.
Wie von aktuellen Standards angegeben, ein erfolgreicher Herzklappe Ersatz sollte folgende Leistungsmerkmale haben: "1) ermöglicht Vorlauf mit annehmbar kleinen mittleren Druckdifferenz Tropfen, 2) verhindert, retrograde Strömung mit akzeptabler kleine Aufstoßen, 3) widersteht Embolisation; 4) widersteht Hämolyse, 5) widersteht Thrombusbildung, 6) ist biokompatibel; 7) ist kompatibel mit in vivo diagnostische Techniken, 8) ist lieferbar und implantierbare im ZielBevölkerung; 9) fixiert bleibt einmal platziert; 10) hat eine akzeptable Lärmpegel; 11) reproduzierbar Funktion; 12) behält seine Funktionalität zu einem vernünftigen Leben im Einklang mit seinen generische Klasse; 13) behält seine Funktionalität und Sterilität zu einem vernünftigen Regal Leben vor der Implantation. "11. Einige der Mängel des bestehenden Klappenprothesen kann möglicherweise durch eine Polymer-Ventil überwunden werden. biokompatible Polymere wurden Top-Kandidaten auf der Grundlage Biostabilität, anti-Hydrolyse, Anti-Oxidation, und vorteilhafte mechanische Eigenschaften wie als hohe Festigkeit und Viskoelastizität. Insbesondere kann Elastomerpolymere bieten Materialumformung ähnelt natürlichen Klappe Dynamik. Elastomere zugeschnitten werden, um Weichgewebe Eigenschaften nachzuahmen, und sie können nur die künstlichen Materialien zur Verfügung, die bio-tolerant sind, und das kann die gekoppelte widerstehen, in vivo, Fluid-induzierte, Biege-und Zugspannungen, aber in einer Weise ähnlich gesund zu bewegen,nativen Klappe Bewegung. Darüber hinaus können Elastomere in Massenproduktion hergestellt werden in einer Vielzahl von Größen, mit Leichtigkeit gespeichert werden soll kostengünstige Geräte sein und strukturell mit Faserverstärkung verstärkt werden.
Das Konzept der Verwendung von Polymer-Materialien, um eine tri-Merkblatt Ventil montieren ist nicht neu und war bereits Gegenstand mehrerer Untersuchungen Forschung in den letzten 50 Jahren 12, die weitgehend wurden aufgrund der begrenzten Haltbarkeit Ventil aufgegeben. Doch mit dem Aufkommen der neuen Fertigungsmethoden 13,14, die Verstärkung von Polymerwerkstoffen 15,16 und potenziell nahtlose Integration von Polymer Klappenersatzprodukten mit transcatheter Ventil-Technik, hat es vor kurzem ein erneutes Interesse und Aktivität bei der Entwicklung von Polymer-Ventile als potenziell Alternative zu derzeit verfügbaren kommerziellen Ventile. In diesem Licht betrachtet, ist ein Protokoll zu ermöglichen Erprobung dieser Ventile hydrodynamischen Funktionalität beurteilen der erste Schrittin der Auswertung, doch im Handel erhältlich Pulssimulators Systeme in der Regel kommen nicht ausgestattet, um tri-Merkblatt Ventilkonstruktionen aufnehmen und enthalten einen ringförmigen Abstand zu kommerziell erhältlichen Herzklappen (zB Kippscheibenprothese, bi-Merkblatt mechanische Herzklappen) einzufügen. Zweitens sind Ventile Polymer eine neue Technologie, deren Hydrodynamik kann nur in einer relativen Kontext beurteilt werden. Obwohl nativen Herzklappe Druck und Durchfluss Daten verfügbar sind, ist es wichtig, für die Versuche an nativen Schweine-Aorta-Ventile, die biologisch ähnlich dem menschlichen Ventile durchzuführen, unter Verwendung der gleichen pulsatile Simulator, mit der die Polymer-Ventile so zu bewerten, um Konto für Messung Unterschiede, die vom System abhängig kann. Somit war das Ziel dieser Studie zu zeigen, wie ein im Handel erhältliches Puls Simulator mit einer Baugruppe zu tri-Merkblatt Ventil Konstrukte aufzunehmen und systematisch zu evaluieren Polymer Ventil hydrodynamischen Metriken in einer relativen cont montiert werdenext im Vergleich zu mechanischen und nativen Herzklappe vom Schwein Pendants. In unserem Fall, neuartige Tri-Broschüre Siliconpolymers Ventile zuvor an der Universität von Florida 13 umfasste die Polymer Ventil Gruppe entwickelt.
Protokoll
1. Vorbereitung
- Entwerfen und fertigen eine Assembly zu einer tri-Merkblatt Ventil Geometrie unterzubringen. Dies wird auf Minimum ein Ventil Inhaber Nahtmaterial in der Klappenblättchen und ein Rohr, um das Ventil Halter und Zubehör rund um Haus, um die Montage auf dem Puls duplicator System zu sichern. In unserem Fall verwendeten wir ein im Handel erhältliches Puls duplicator System ab ViVitro Labs Inc. (Victoria, BC). Ventil Halter Design sowie Pre-und Post Baugruppenkonfigurationen sind in Abbildung 1 dargestellt.
- Die gesamte Schleife müssen vor der Verwendung grundiert werden. Dies erfolgt in zwei Schritten: i) die Reinigung des gesamten Kreislaufsystem mit Seifenlauge und Wasser, einschließlich Austausch aller Rohre abgebaut vor dem Gebrauch und ii) die Kalibrierung der Instrumente, die mit der Schleife, nämlich die Pumpe verwendet wird, den Strom-Sonde und die Druckwandler (in der Regel bei Vorhof-, Aorten-und ventrikuläre Stellen gemessen). Die Kalibrierung kann initbeugende Wartung durchgeführt unter Verwendung von 1% iger Kochsalzlösung und sollte vor der Verwendung von Blut-Analog-Glycerin-Lösung wiederholt werden.
2. Ureinwohner Aortenklappe Dissection
- Erhalten Sie 4 frische Schwein Herzen mit der Aorta aus einer intakten USDA zugelassenen Schlachthof (Institutional Animal Care und Use Committee (IACUC) Genehmigung erforderlich sein). In unserem Fall wurde unser Dissektion Protokoll vom IACUC an der Florida International University (: 11-020 Protocol Approval Number) genehmigt. Spülen Sie das Herz mit VE-Wasser und legen Sie es in eine Steckdose mit der 1%-Antimykotikum / Antibiotikum und steriler Phosphat-gepufferter Kochsalzlösung (PBS)-Lösung und Transport auf Eis zur hydrodynamischen Prüflabor gefüllt.
- Zeigen Herzen in einer Pfanne und sezieren vorsichtig den Herzbeutel. Positionieren Sie das Herz, so dass ventralen Seite Ihnen zugewandt ist. Sichtprüfung und Identifizierung der vier Kammern des Herzens und suchen Sie den Aortenbogen am intakten Aorta.
- Trennen Sie das Herz in two Hälften quer horizontal unterhalb etwa 0,75 in dem Ringraum, also die Verbindung zwischen der Aorta und des linken Ventrikels. Vorsichtig isolieren intakt Aorta noch an der linksventrikulären Gewebeabschnitt befestigt.
- Untersuchen der Aortenklappe in der Aortenwurzel, der Bereich zwischen der aufsteigenden Aorta und dem unteren Ringraum, um sicherzustellen, dass keine Schäden oder Anzeichen von Verkalkung befindet.
- Teilen Sie die Aorta bei ~ 1 in den Ring oben und trennen Sie die linksventrikuläre Gewebe Segment unterhalb des Rings um die Aortenklappe (Abbildung 2a) zu isolieren.
3. Polymer und Native Ventil Naht Prozess
- Platzieren Sie die Herzklappe im Ventilhalter, daß die Basis jedes Ventil mit der Basis des Pfostens Halter ausgerichtet ist. Sichern Sie das Ventil an Ort und Stelle bei jedem Post vorübergehend mit einer Büroklammer, aber darauf achten, nicht die Commissuren oder die Höcker beschädigen.
- Legen Sie den Faden in dieNadel. Beginnen Nähen an der Unterseite der Ventilhalter, indem die Nadel durch das erste Loch von außen nach innen, so dass die Nadel leicht aus dem Boden gezogen werden. In einem Looping Mode, Nähen beginnen das Ventil senkrecht nach oben den Pfosten des Ventils Inhaber.
- Fortschritt mit Naht (Abb. 2b) entlang des Umfangs des Halters und mit zusätzlichen Naht um den Spitzen der Halter Beiträge. Büroklammern (Abbildung 2c) kann entfernt werden, wenn das Ventil vollständig gesichert ist mit Nähten an den 3 Beiträge und am Umfang des Ventils Halter (Abb. 2d und 2e) werden.
4. Hydrodynamische Bewertung
Hinweis: Die tatsächliche Protokoll variieren je nach spezifischer Impuls duplicator System verwendet wird. Alle Informationen caontained hierin verwendet die ViVitro Pulse Duplikator Sysytem (ViVitro Labs, Inc., Vancouver, BC).
- Bi-Broschüre valve
- Set Herzfrequenz Puls duplicator System bis 70 Schläge / min.
- Wähle einen Flow-Kurve, um die Pumpe (in dem Fall des Systems der ViVitro S35 Wellenform wurde für alle hydrodynamischen gewählten Prüfungen) anzutreiben. Die speziellen Wellenform in unseren Experimenten verwendet wird, von Lim et al. (2001) 17 dargestellt.
- Schalten Sie Verstärker und Kolbenpumpe. Warm up für 15 min.
- Platz zwei Plättchen Ventil (Abbildung 2f) in der Aorta Position.
- Smear Vakuumfett auf allen Kreuzungen der Einrichtung, wo Lecks auftreten könnten.
- Gießen Glycerin / salzhaltigen Flüssigkeit im Vorhof Fach. Beachten Sie, dass der pulsierende duplicator System auf 2 l Flüssigkeit läuft mit: 35% / 0,7 L Glycerin und 65% / 1,3 l Kochsalzlösung. Die Salzlösung wird unter Verwendung von Kochsalz gut gelöst in entionisiertem Wasser bei einer Konzentration von 9 mg / ml (Gewicht / Volumen).
- Schalten Sie den Strom-Messwandler, der in der Aorta Position gebracht worden ist.
- Kalibrieren the Pumpe.
- Gehen Sie mit dem Fluss Prüfkopfjustierung von den Drucksensoren gefolgt. Ähnlich wie bei der Pumpe, folgen Sie einfach den Anweisungen des ViVitest Software (ViVitro Labs Inc.) für jeden Fluss und Druck unter der Registerkarte Kalibrierung gegeben.
- Sobald die Kalibrierung abgeschlossen ist, starten Sie die Pumpe bei einer niedrigen Drehzahl, bis die Flüssigkeit füllt den Aorten-Fach. Dichtheit prüfen. Verwenden Sie zusätzliche Vakuumfett wenn nötig.
- Drehen Sie die beiden Absperrhähne (Aorten-und ventrikuläre Wandler) in die geöffnete Position.
- Erhöhen Sie die Drehzahl der Pumpe bis das Hubvolumen erreicht 80 ml / Beat.
- Erlauben Sie das System für 10 Minuten laufen, bis Flow hat sich stabilisiert. Flow-Stabilisierung kann durch die Beobachtung der Strömung und Druck Wellenformen in dem Bildschirm überprüft werden. Niedrig bis keine Unterschiede zwischen den Zyklen ist ein guter Indikator für das System vorher stabilisieren.
- In der Software wählen ViVitest erwerben Modus.
- Klicken Sie auf sammeln 10 Zyklen.
- Von der Analyse-Modus, clecken auf dem Tisch, und speichern Sie die Datei. Sichern Sie auch ein Bild der Wellenformen mit der Foto-snap Option in ViVitest.
- Ureinwohner und Polymerventile
- Für Polymer und Tier Ventile, befolgen Sie die gleichen Schritte 3.1.1 - 3.1.3 aus den bi-Ventil Packungsbeilage beachten.
- Legen Sie die Halterung mit dem Ventil vernäht Ventil innerhalb der Glasröhre aus dem Maß Montage. Sandwich das Rohr mit der oberen und unteren Stücke und sicher an Ort und Stelle mit seitlichen Schrauben und Muttern.
- Ablage-Anordnung zwischen der Aorta und der Kammer eine Aortenklappe Halter.
- Wiederholen Sie die Schritte 3.1.5 - 3.1.16 aus den bi-Ventil Packungsbeilage beachten.
5. Nachbearbeitung
- Strömungs-und Druckkurven
- Durchschnittlich werden die Daten für jede der Wellenformen gesammelt, dh Aortendruck (AP), ventrikuläre Druck (VP) und Strömungsrate (Q) gesammelt.
- Für jede Gruppe von Ventil (Polymer-, Schweine-ntive Aortenklappe und bi-Prospekt), zeichnen Sie die entsprechenden AP, VP und Q gegen die Zeit Beziehungen auf dem gleichen Grundstück.
- Für die AP, überlagern normal, nativen Aortenklappe 18 und bi-Merkblatt Klappenprothese 19 Grundstücke aus der Literatur für die Validierung.
- Hydrodynamische Metriken
- Für jedes Ventil getestet, sollten die folgenden hydrodynamischen Metriken berechnet werden: a) Vorlauf Druckabfall und maximale transvalvuläre Druck (TVP), b) die Aorten-Root Mean Square (RMS) vorwärts Durchfluss, c) Aorten-Vorlauf, Schließen, Leckage und insgesamt Regurgitationsvolumen, d) Ventil Ende Mündungsbereich (EOA), e) transaortale Vorlauf, Schließen, Leckage und der gesamten Energieverluste.
- Vorlauf Druckabfall von TVP Messwerte berechnet und kann in 3 Zeitintervallen P kategorisiert werden: Intervall beginnt und endet mit 0 TVP, F: Intervall mit Vorlauf und H: Intervall mit 0 beginnend und endend mit TVP 0 fließen. Maximale TVP ist die maximum Druckgefälle über das Ventil von der Aorta und ventrikulären Druckwerte erfasst.
- Der RMS-Vorlauf (Q eff) ein nützliches Maß für die Quantifizierung der Größenordnung von Vorwärtsströmungsgeschwindigkeit wie folgt:

Wo 'n' die Anzahl der Zeitpunkte ist gesammelt, 'Q i' ist die momentane Durchflussmessung in Auftrag gesammelt 'i'. - Die Aorta nach vorn, Schließ-und Leckage-Volumes werden basierend auf den folgenden Zeitintervallen, Vorwärts berechnet: Beginn der Vorlauf durch das Ventil (t o), bis zum Ende der Vorlauf (t 1); Closing: ab 1 t bis die Instanz des Ventilschließkörpers (t 2); Leckage: von t 2 bis zum Ende des Herzzyklus (t 3). Insgesamt Regurgitationsvolumen ist einfach die Summe der closing und Leckage Bände.
- Die EOA auf Blut Eigenschaften basieren, können für die 3 Intervalle, P, F und H aus dem Mittelwert TVP während jeder dieser Perioden als 20 berechnet werden:
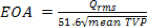
- Energieverluste werden wie folgt definiert 21:
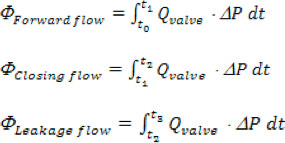
- Für jedes Ventil getestet, sollten die folgenden hydrodynamischen Metriken berechnet werden: a) Vorlauf Druckabfall und maximale transvalvuläre Druck (TVP), b) die Aorten-Root Mean Square (RMS) vorwärts Durchfluss, c) Aorten-Vorlauf, Schließen, Leckage und insgesamt Regurgitationsvolumen, d) Ventil Ende Mündungsbereich (EOA), e) transaortale Vorlauf, Schließen, Leckage und der gesamten Energieverluste.
Ergebnisse
Repräsentative Durchfluss und Druck Wellenformen sind in den 3, 4 und 5 gezeigt. Die Grundstücke wurden über die Stichprobengröße von Ventilen für jede Gruppe, die getestet wurde gemittelt, n = 5, 4, und 2 Ventile für Polymer-, Schweine-und nativen bi-Faltblatt-Gruppe. Der hydrodynamische Metriken und die Standardabweichung des Mittelwerts für diese Stichproben sind in Tabelle 1 dargestellt.
Diskussion
In dieser Studie haben wir die Brauchbarkeit Modifizieren eines handelsüblichen pulsatile Doppeleinheit bis dreifach Klappenventil Geometrien aufnehmen, so dass hydrodynamische Prüfung von Polymer und nativen Schweine-Ventile durchgeführt werden gezeigt. Speziell in unserem Fall war das System geändert a ViVitro linken Herzens und systemische Simulator (Abbildung 1a) über die ViViTest Datenerfassungssystem (ViVitro Systems, Inc, Victoria, BC, Kanada). Allerdings ist das System nicht im Gegensatz zu...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Ein Samen Zuschuss von der University of Florida - College of Medicine wird dankbar anerkannt. NIH / NIGMS R25 GM061347: Forschungsinitiative für die wissenschaftliche Weiterentwicklung (MBRS-RISE) Kameradschaft - Graduate Studien (Manuel Salinas) wurden durch eine Minderheit Möglichkeiten in der biomedizinischen Forschung Programmen unterstützt. Finanzielle Unterstützung aus dem Wallace H. Coulter Foundation durch Florida International University, ist Biomedical Engineering Department auch gedankt. Schließlich danken die Autoren folgende Studenten für ihre Unterstützung während der verschiedenen Phasen der experimentellen Prozess: Kamau Pier, Malachi Suttle, Kendall Armstrong und Abraham Alfonso.
Materialien
| Name | Company | Catalog Number | Comments |
| Pump | ViVitro Labs | http://vivitrolabs.com/products/superpump/ | |
| Flow Meter and Probe | Carolina Medical | Model 501D | http://www.carolinamedicalelectronics.com/documents/FM501.pdf |
| Pressure Transducer | ViVitro Labs | HCM018 | |
| ViVitro Pressure Measuring Assembly | ViVitro Labs | 6186 | |
| Valve holder | WB Engineering | Designed by Florida International University. Manufactured by WB Engineering | |
| Pulse Duplicator | ViVitro Labs | PD2010 | http://vivitrolabs.com/wp-content/uploads/Pulse-Duplicator-Accessories1.pdf |
| Pulse Duplicator Data Acquisition and Control System, including ViViTest Software | ViVitro Labs | PDA2010 | http://vivitrolabs.com/products/software-daq |
| Porcine Hearts and Native Aortic Valves | Mary's Ranch Inc | ||
| Bi-leaflet Mechanical Valves | Saint Jude Medical | http://www.sjm.com/ | |
| High Vacuum Grease | Dow Corning Corporation | http://www1.dowcorning.com/DataFiles/090007b281afed0e.pdf | |
| Glycerin | McMaster-Carr | 3190K293 | 99% Natural 5 gal |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | MT21031CV | 100 ml/heart |
| Antimycotic/Antibiotic Solution | Fisher Scientific | SV3007901 | 1 ml in 100 ml of PBS/heart; 20 ml for ViVitro System |
| NaCl | Sigma-Aldrich | S3014-500G | 9 g/L of deionized water |
| Deionized Water | EMD Millipore Chemicals | Millipore Deionized Purification System. 1.3 L for ViVitro System, 200 ml for heart valve dissection process |
Referenzen
- Rajamannan, N. M., et al. Calcific aortic valve disease: not simply a degenerative process: A review and agenda for research from the National Heart and Lung and Blood Institute Aortic Stenosis Working Group. Executive summary: Calcific aortic valve disease-2011 update. Circulation. 124, 1783-1791 (2011).
- Marijon, E., Mirabel, M., Celermajer, D. S., Jouven, X. Rheumatic heart disease. Lancet. 379, 953-964 (2012).
- Karaci, A. R., et al. Surgical treatment of infective valve endocarditis in children with congenital heart disease. J. Card. Surg. 27, 93-98 (2012).
- Knirsch, W., Nadal, D. Infective endocarditis in congenital heart disease. Eur. J. Pediatr. 170, 1111-1127 (2011).
- Korossis, S. A., Fisher, J., Ingham, E. Cardiac valve replacement: a bioengineering approach. Biomed. Mater. Eng. 10, 83-124 (2000).
- Ghanbari, H., et al. Polymeric heart valves: new materials, emerging hopes. Trends Biotechnol. 27, 359-367 (2009).
- Mol, A., Smits, A. I., Bouten, C. V., Baaijens, F. P. Tissue engineering of heart valves: advances and current challenges. Expert Rev. Med. Devices. 6, 259-275 (2009).
- Ramaswamy, S., et al. The role of organ level conditioning on the promotion of engineered heart valve tissue development in using mesenchymal stem cells. Biomaterials. 31, 1114-1125 (2010).
- Sacks, M. S., Schoen, F. J., Mayer, J. E. Bioengineering challenges for heart valve tissue engineering. Annu. Rev. Biomed. Eng. 11, 289-313 (2009).
- Zamorano, J. L., et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. J. Am. Soc. Echocardiogr. 24, 937-965 (2011).
- ANSI/AAMI/ISO. Cardiovascular Implants - Cardiac Valve Prostheses. Assoc. Adv. Med. Instrum. 71, (2005).
- Gallocher, S. L. . Durability Assessment of Polymer Trileaflet Heart Valves PhD thesis. , 313 (2007).
- Carroll, R., Boggs, T., Yamaguchi, H., Al-Mously, F., DeGroff, C., Tran-Son-Tay, R. Blood Cell Adhesion on Polymeric Heart Valves. , (2012).
- Pierre, K. K., Salinas, M., Carroll, R., Landaburo, K., Yamaguchi, H., DeGroff, C., Al-Mousily, F., Bleiweis, M., Ramaswamy, S. Hydrodynamic Evaluation of a Novel Tri-Leaflet Silicone Heart Valve Prosthesis. , (2012).
- Cacciola, G., Peters, G. W., Schreurs, P. J. A three-dimensional mechanical analysis of a stentless fibre-reinforced aortic valve prosthesis. J. Biomech. 33, 521-530 (2000).
- De Hart, J., Cacciola, G., Schreurs, P. J., Peters, G. W. A three-dimensional analysis of a fibre-reinforced aortic valve prosthesis. J. Biomech. 31, 629-638 (1998).
- Lim, W. L., Chew, Y. T., Chew, T. C., Low, H. T. Pulsatile flow studies of a porcine bioprosthetic aortic valve in vitro: PIV measurements and shear-induced blood damage. J. Biomech. 34, 1417-1427 (2001).
- Gutierrez, C., Blanchard, D. G. Diastolic heart failure: challenges of diagnosis and treatment. Am. Fam. Physician. 69, 2609-2616 (2004).
- Shi, Y., Yeo, T. J., Zhao, Y., Hwang, N. H. Particle image velocimetry study of pulsatile flow in bi-leaflet mechanical heart valves with image compensation method. J. Biol. Phys. 32, 531-551 (2006).
- Chandran, K. B., Yoganathan, A. P., Rittgers, S. E. . Biofluid Mechanics: The Human Circulation. , 277-314 (2007).
- Akins, C. W., Travis, B., Yoganathan, A. P. Energy loss for evaluating heart valve performance. J. Thorac. Cardiovasc. Surg. 136, 820-833 (2008).
- Fung, Y. C. . Biomechanics: Circulation. , (1997).
- Keener, J., Sneyd, J. . Mathematical Physiology, II: Systems Physiology. , (1998).
- Quick, C. M., Berger, D. S., Noordergraaf, A. Apparent arterial compliance. Am. J. Physiol. 274, H1393-H1403 (1998).
- Wang, Q., Jaramillo, F., Kato, Y., Pinchuk, L., Schoephoerster, R. T. Hydrodynamic Evaluation of a Minimally Invasive Heart Valve in an Isolated Aortic Root Using a Modified In Vitro Model. J. Med. Devices. 3, 011002.1-011002.6 (2009).
- Baldwin, J. T., Campbell, A., Luck, C., Ogilvie, W., Sauter, J. Fluid dynamics of the CarboMedics kinetic bileaflet prosthetic heart valve. Eur. J. Cardiothorac. Surg. 11, 287-292 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten