Method Article
Neuronalen Schaltkreis-Aufnahme von einem intakten Nervensystem Schabe
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt die Kakerlake Bauchmark Dissektion und Aufnahmen aus dem extrazellulären cercal Nerven und Verknüpfungen. Hervorgerufenen Reaktionen werden durch elektrische Stimulation der Nerven-oder cercal direkte mechanische Stimulation der Cerci erzeugt.
Zusammenfassung
Die Schabe Bauchmark Zubereitung ist ein gefügig System für neuroethology Versuche, neuronale Netzwerkmodellierung und Testen die physiologischen Wirkungen von Insektiziden. Dieser Artikel beschreibt den Umfang der Schabe sensorischen Modalitäten, die verwendet werden können, um zu untersuchen, wie eine Insektennervensystem reagiert auf Umweltstörungen. Der Schwerpunkt liegt hier auf dem Fluchtverhalten von Cerci zu riesigen Faserübertragungs in Periplaneta americana vermittelt. Diese in situ-Herstellung erfordert nur mäßige Seziersaal Geschick und elektrophysiologische Know-how, um reproduzierbare Aufnahmen der neuronalen Aktivität zu erzeugen. Peptide oder andere chemische Reagenzien kann dann direkt mit dem Nervensystem in Lösung mit physiologischer Kochsalzlösung angewendet werden. Insektizide könnte auch vor der Dissektion verabreicht werden und die Flucht Schaltung kann als Proxy für den erregbaren Zustand des Zentralnervensystems dienen. In diesem Zusammenhang sind die hierin beschriebenen Tests würden auch nützlich sein, um Researchers interessiert Regeneration von Gliedmaßen und der Evolution der Entwicklung des Nervensystems, für die P. americana ist ein etablierter Modellorganismus.
Einleitung
Es gibt mehr als 4.000 Schabenarten, aber nur etwa 30 sind bekannte Schädlinge. Vielleicht die bekannteste ist die falsch benannte Amerikanische Schabe Periplaneta americana, die in Afrika entstanden und wird heute fast überall auf dem Planeten gefunden. Neben seiner schnellen Laufgeschwindigkeit ein und Ausweichverhalten, in den Tropen P. americana ist in der Lage Flug 2,3.
Die vorherrschenden Merkmale der Schabe Zentralnervensystem (ZNS) sind die segmentierten Natur und Dezentralisierung von Steuerungsprozessen 4,5. Das Gehirn-, Brust-und Bauchganglien werden von gepaart interganglionic Verknüpfungen miteinander verbunden, um die Bauchmark (VNC) zu bilden.
Die Ganglien bei jedem Segment integrieren Mitte. Sie bestehen aus einem äußeren, kortikalen Bereich enthaltenden Zellen für die Blut-Hirn-Schranke Lässigkeit unmittelbar unterhalb verantwortlich, und die Zellkörper der Neuronen ursprüng zusammenUrsprung in diesem Ganglion. Diese Somata kann Inter, modulatorischen Neuronen oder Motoneuronen gehören. Sie liefern Axone, die in der Ganglienherkunfts (lokale Interneuron) bleiben oder Axone, die zwischen den Ganglien des ZNS (interganglionic Inter) oder dass an peripheren Muskelzellen (Motoneurone) beenden zu projizieren. Die meisten Zellkörper ventral oder ventrolateral in der Ganglien Kortex 5 positioniert. Die gepaarten, interganglionic Verknüpfungen enthalten nur Axonen und keine neuronalen Zellkörpern.
Das Neuropil eines Ganglien enthält Gliazellen (Neuroglia), Axon Wege, Bündel von Axonen und Dendriten (Neuriten) von Neuronen. Neuropil frei von neuronalen Zellkörpern. Dies ist der Bereich innerhalb des Ganglion wo direkte synaptische Kommunikation zwischen Nervenzellen und Integration von Eingängen auf.
Die Fähigkeit der amerikanischen Schabe P. americana zu erkennen und zu reagieren, plötzlich zu einem Raubtier nähert (Fuß-, Han-d, etc.) hat zu einer Reflexschaltung, der Cerci und Riesenfasersystem besteht aus 6,7 zugeschrieben worden. Die Cerci sind ein Paar von hornartigen Windempfindlichen Strukturen am Ende der Bauchhöhle (Abbildung 1). P. americana die ventrale Oberfläche jedes cercus enthält etwa 200 fadenförmige (Thread) Haare, die in 14 Spalten organisiert sind. Neun dieser Spalten konsistent in verschiedenen Tieren nach den Antworteigenschaften des zugehörigen Empfängerzelle und Axon identifiziert werden. Jedes Haar ist in einer Fassung, die sie am leichtesten in einer Ebene, die Spalte spezifisch verbiegen können. Bewegung der Haare in einer Richtung entlang ihrer Ebene induziert eine Depolarisation der Rezeptorzelle und eine Burst-Aktionspotentiale (APs) in sensorischen Neuronen. Bewegung in die entgegengesetzte Richtung hemmt keine laufenden spontanen APs 8. Die bevorzugte Ablenkungsebene und Direktionalität der Reaktion unterscheidet sich in jeder Spalte. Somit ist die filiform Haar-Rezeptor-Komplexe sind nicht nur für das Erfassen der Bewegung der Luft, sondern auch für "Codieren", in Form von APs, die Richtung, aus der der Luftstrom stammt. Die Verarbeitung dieser Informationen durch das ZNS führt zu einer "angemessen" Fluchtreaktion 6,7. Diese funktionelle, säulen Spezifität der Sinneshärchen wird von Tier zu Tier erhalten.
Die Rezeptorzelle jedes fadenförmigen Haar ist zur Umwandlung der mechanischen Auslenkung der Haare in ein neuronales Ereignis (was zu einem Burst oder Hemmung von APs in Axon 9 der Rezeptorzelle verantwortlich. Die APs zu reisen, um das Terminal Abdominalganglion (A6) über cercal Nerven XI, wo sie mit riesigen Axone des Bauchmark (VNC) Synapsen. Die riesigen Axone sind vermutlich für die Übertragung und nachfolgende Anregung von Motoneuronen, die in einem Fluchtverhalten 6,10,11 Ergebnisse verantwortlich zu sein.
Die Verhaltens Latenz of die Fluchtreaktion von P. americana ist eine der kürzesten aller Tier 7. Verhaltens-Latenzzeit ist die Zeit zwischen der Ankunft eines Reizes zu einem Mechanorezeptor und die Einleitung einer Fluchtreaktion. In Versuchen mit hoher Geschwindigkeit, um die Filmfluchtversuch von einem angreifenden Kröte aufzunehmen, wurde die Kakerlake beobachtet, um seine Abkehr von der Kröte in der etwa 40 ms (Zeit von Beginn der Zunge Erweiterung beginnen, Bewegung 7,12 Kakerlake. Mit gesteuert Wind Windbeutel könnte die Verhaltens Latenz bis 11 ms reduziert werden. Weitere Experimente zeigten, dass eine Mindestwindgeschwindigkeit von Blätterteig 12 mm / ms (bei einer Beschleunigung von 600 mm / ms 2) einen Fluchtantwort hervorzurufen, während noch niedrigere Geschwindigkeiten (3 mm / sec) verursacht langsam zu Fuß bewegen Schaben 12 zu stoppen.
Die starke Korrelation, die in der Regel besteht zwischen Riesenfasersysteme und Fluchtverhalten ist gut dokumentiert 13,14. In instances wo eine bestimmte Zelle notwendig und ausreichend ist, um ein bestimmtes Verhalten hervorzurufen ist, wird die Zelle als Befehls Neuron 15,16 bezeichnet. Rieseninter (GIS) in der Wind Flucht Schaltung von P. americana sind nicht notwendig für den Reflex. Tiere, die experimentell abgetragen GIs haben zeigen immer noch die Fluchtverhalten daher sind diese GIs werden nicht als Befehl Neuronen 17,18. Abtrennen zervikalen Verknüpfungen, die rostral sensomotorischen Schaltung wird auch das Verhalten, das anzeigt, dass absteigend Eingabe vom Gehirn hat eine Wirkung auf die Fluchtrichtung 19. Diese Aspekte der Feinsteuerung und Redundanz sind entscheidend, um das Überleben des Organismus und werden durch neurochemische Modulation über biogene Amine 20 ergänzt.
Die P. americana Nervenstrang Vorbereitung hat in den letzten vielen Jahrzehnten, beginnend mit der Pionierarbeit von Roeder 21. Es ermöglicht Studierenden, ihre Ein 22,23,24 aufzeichnen, anzeigen und analysieren primären sensorischen Aktivität und die daraus resultierenden Reaktionen von riesigen Inter. Neben der Vermittlung der Idee, dass identifizierbare neuronalen Schaltkreise zugrunde liegen Verhaltensreaktionen auf die Umwelt sollten diese Übungen eine Wertschätzung für die biologischen Beiträge dieses gemeinsamen Haushalt Schädling gemacht zu vermitteln.
Protokoll
1. Präparation
Schabe in diesem Protokoll verwendeten Kochsalzlösung hat die folgende Zusammensetzung:
Cockroach Kochsalzlösung 36: (Gramm für 100 ml)
210 mM NaCl (1.227 g)
2,9 mM KCl (0,0216 g)
1,8 mM CaCl 2 (0,0265 g)
0,2 mM NaH 2 PO 4 • 2H 2 O (0,0032 g)
1,8 mM Na 2 HPO 4 • 7H 2 O (0,0483 g)
(PH 7,2. Der pH-Wert mit 1 M NaOH oder 1 M HCl).
- Wählen Sie einen männlichen Kakerlake aus dem Vorratsbehälter, die robust Cerci (Abbildung 1). Die letzten Segmente des Mannes sind schmal im Vergleich zu den weiblichen, und die keine Eierstöcke und Eiermasse, sind Männer leichter zu sezieren. Die Männchen von P. americana ein Paar kurze Taster zwischen der Cerci. Diese Taster sind in den Weibchen beobachtet.
- Schneiden Sie die Flügel, Beine und Kopf und stecken den Körper, Bauchseite bis zu einer dish mit Silikon-Elastomer ausgekleidet.
- Mit Zange holen die Bauchplatten und schneiden Sie sie mit einer feinen Schere, beginnend am hinteren Ende und nach vorne arbeiten. Die inneren Organe immer feucht zu halten mit Kochsalzlösung beim Versuch, die Cerci trocken zu halten. Man kann Wachs oder Stücke von Gummi verwenden, um den Bauch nach oben zu positionieren, um die Kochsalzlösung benetzt die Cerci zu verhindern. Wenn sie nass wird, trocknen Sie sie mit einem Stück Seidenpapier. Drücken Sie auf die Seite, die inneren Organe und die weiße Substanz (Fett-Körper). Der VNC ist in der Mitte des Feldes, läuft über die Länge des Bauches und sollte zwischen der glänzenden Tracheen sichtbar sein. Der Nervenstrang ist durchscheinend und kann anfangs schwierig sein, zu sehen, bis die Beleuchtung richtig (Abbildung 2) angepasst. NICHT behandeln die VNC mit einer Pinzette oder Insektenstifte; Verwendung von Glassonden statt manipulieren.
- Räumen Sie Tracheen-System der Tiere so gut wie möglich aus der Nervenstrang mit einer Zange und mit einem Paar von feinen Glas Notwendigkeitles, sehr sorgfältig spalten die VNC-Verknüpfungen in Längsrichtung zwischen A6 und A5 und A4-oder A5-Ganglien (Abbildung 3). Cradle die Cerci und Bauch nach oben aus dem Solebad mit verkürzten Insektenstifte und Wachs oder ein Keil des Silikon-Elastomers, die schneiden kann, um die Vorbereitung (4A und B) zu passen. Seien Sie in der letzten Bauchsegment nicht auf die Nerven, die cercal in die Ganglien projizieren beschädigen besonders vorsichtig (Figuren 2D und 5).
2. Extrazelluläre Aufnahme
- Die Vorbereitung seziert, Mikroskop, und Aufzeichnungsgerät sollte in einem Setup-Faraday-Käfig sein, externe, insbesondere AC, elektrische Felder, die Signale von Nervenzellen außer Kraft setzen konnte (Abbildung 6) zu blockieren.
- Positionieren Sie das Mikroskop, so dass es mit Blick auf den Mikroskoptisch. Sobald das Präparat auf der Bühne platziert, passen Sie die Position der Beleuchtungsstrahl hoher Intensitätfür die beste Visualisierung von ihm.
- Verbinden Sie den AC / DC-Differenzverstärker mit der integrierten Datenaufzeichnungseinheit (Details auf den spezifischen Hardware-und Software-Einstellungen wurden bereits beschrieben 25). Der Kopf der Bühne hält eine Saug-Elektrode sollte an den Verstärker angeschlossen werden. Eine silberne Erdungskabel, die mit Cl beschichtet worden ist - in den Bauch führt zu stabileren Aufnahmen eingefügt. Der Grund ist, wenn die Lösung in die Körperhöhle nicht in Kontakt mit der Badeflüssigkeit in der Schüssel, der mit der Aufzeichnungselektrode geerdet bleibt zugehörigen Fluid.
- Stellen Sie die Aufnahmefrequenz auf 4 kHz. Stellen Sie die Spannungsskala (y-Achse) bis 500 mV (dieser kann eingestellt werden, um die Visualisierung der Messkurve zu optimieren). Führen Sie das Aufnahme-Software in kontinuierlicher oder Oszilloskop-Modus, um neuronale Aktivität in Reaktion auf Reize aufzuzeichnen.
- Schneiden Sie eine der VNC-Verknüpfungen in der Nähe von A5 und legen Sie das Schnittende bis A6 in eine Saug-Elektrode angebracht. Achten Sie darauf, pull Salzlösung in die Saug-Elektrode, um die Silberdraht im Inneren vor dem Ansaugen in der Nerven abzudecken.
- Mit einer Pipette trocken blasen Luft an die Haare auf jeden cercus entfernt. Sehen Sie, wenn die Stimulierung der Haare auf dem cercus ipsilateral zu der aufgezeichneten Verbindungs gibt eine andere Antwort als die kontralateralen ein. Nehmen die Amplituden der Reaktionen und der Anzahl der Spitzen in einem gegebenen Zeitintervall, während der Stimulation.
- Bewegen Sie die Saug-Elektrode mit einem cercal Nerven für die Aufnahme. Um eine bessere Passform, wechseln Sie zu einer Elektrodenspitze mit einer kleineren Öffnung bei Bedarf zu bekommen.
- Schneiden Sie die cercal Nerven Nähe von A6 und saugen dann die Nerven, die zum cercus. Es sollte spontane Abfeuern von Aktionspotentialen sein. Nun blasen Luft auf die cercus und beachten Sie die Antworten.
3. Elektrische Stimulation der sensorischen Nerven zu ermitteln Recruitment
- Ändern Sie den Aufnahme-Software zu fegen Modus, so dass es Aufzeichnungen Spuren (100-500 msec.) jedes Mal, wenn ein Reiz ausgelöst wird.
- Verbinden der Stimulationselektrode mit dem Ausgang des Stimulators.
- Verbinden Sie den Stimulator Kabel mit den beiden Mini-Haken Leitungen oder Clips.
- Die BNC-Trigger-Ausgang von dem Stimulator mit dem Triggereingang der Aufzeichnungseinheit.
- 10 ms, Frequenz::;: Dauer: Verzögerung 0,3 s Die folgenden Stimulationsparameter sollten eine Reaktion hervorrufen 1 Hz, Spannung: nach Bedarf anpassen, um ein Signal in den Aufnahmen zu erhalten (knapp über Schwelle und in der Lage, eine maximale Antwort zu erhalten). Es gibt keinen Grund zu Spannungen viel höher als maximale Schwellenwert für die Einstellung gehen, wie eine hohe Spannung beschädigt werden, um den Nerv.
- Schneiden Sie die cercal Nerven als distale wie möglich, so dass eine lange Nervenwurzel kann in der stimulierenden Elektrode Sog gezogen (Abbildung 7, Pfeilspitze) werden. Die Binde zwischen A6 und A5 oder ein anderes Segment weiter vorn verwendet werden.
- Stellen Sie den Aufnahme Saug-Elektrode, so können Sie puwerde ein Schnitt Binde in die Elektrode. Seien Sie sicher, etwas Kochsalzlösung in den Saug-Elektroden ziehen, um den Silberdraht im Inneren vor dem Ansaugen in den Nerven zu decken. Sicherzustellen, dass die Stimulationselektrode ist ebenfalls in dem Bad Salz geerdet (in der Bauchhöhle in der Nähe von A3 ist ideal).
- Liefern Sie eine Reihe von Einzelreize, aus zunehmender Spannung, bis ein Aktionspotential auf dem Bildschirm erscheint. Man sollte eine Aufzeichnung der minimalen Stimulationsspannung und Dauer machen, um eine Antwort zu rekrutieren. Erhöhen Sie die Intensität, bis eine Reaktion in den synaptischen Verknüpfungen beobachtet. Die große Spitze (extrazelluläre APs) von den riesigen Axone erscheint zuerst, und dann andere kleinere AP kann auch beobachtet werden.
Ergebnisse
Die Stimulation der Haare auf der Cerci von einem Luftstoß verursacht Einleitungen von primären sensorischen Neuronen, die mit extrazellulären Saug-Elektroden entweder Verknüpfungen zwischen Bauchganglien oder der cercal Nerven selbst (Abbildung 8) befestigt aufgezeichnet werden können. Spike-Amplituden von den beiden Bereichen aufgezeichnet sind, in der Größenordnung von einigen Mikrovolt an Millivolt. Aufgrund der sensorischen Integration in die Ganglien die Anzahl der in der Verbindung Aktionspotential oder von der cercal Nerven aufgenommenen Einzel Spikes beobachteten Spitzen ist bemerkenswert größer als in Aufnahmen aus den Verknüpfungen beobachtet. Aber auch beachten, dass es wesentlich weniger Rauschen in der Aufnahme an der Binde durch die dichtere Abdichtung zwischen der Elektrode und dem Nervengewebe.
Durch schnaufend Luft an den Cerci große Spitzen in den Verknüpfungen (8A) beobachtet werden. Mit dieser Methode anregend, Aufnahmen zwischen A3 und A4 typischen ly zeigen eine große Spitze Merkmal der Riesenintern (n). Aufnehmen von einem cercal Nerven während körperlich Reiben der Cerci mit einer Pinzette erzeugt eine starke Büste der Aktivität (8B 1). In einer anderen Aufnahme, 2 Luftstöße jedes produzierte eine schnelle Zerschlagung Antwort in der cercal Nerven (8B 2). Wenn die elektrische Stimulation der Nerven cercal mit einem Saug-Elektrode und die Aufnahme in die Binde zwischen A3 und A4, kann man eine Schwelle an der Stimulation zu beobachten, um Reaktionen hervorgerufen (8C 1). Die elektrische Stimulation des Nerven cercal klar löst eine Reaktion in Verknüpfungen, die für manipulative Studien mit pharmakologischen Wirkstoffen oder den lokalen Umwelt umgibt, wie Temperatur quantifiziert werden kann (Fig. 8C 2).
fig1.jpg "/>
Abbildung 1. Periplaneta americana mit intakten Cerci.
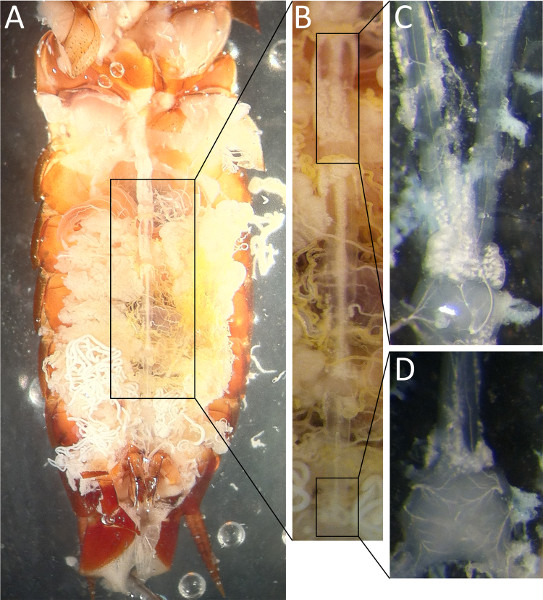
Abbildung 2. Ventrale Ansicht der Schabe Nervenstrang wie bei der ventralen Nagelhaut entfernt gesehen (A). Eine vergrößerte Ansicht des Segments durch Pfeile skizziert ist in (B) gesehen. In (C) wurden die Verknüpfungen zwischen A4 und A3 mit einer Glassonde verschüttet. Die 6. Abdominalganglion ist in (D) mit den beiden cercal Nerven verlassen am Schwanzende gezeigt.
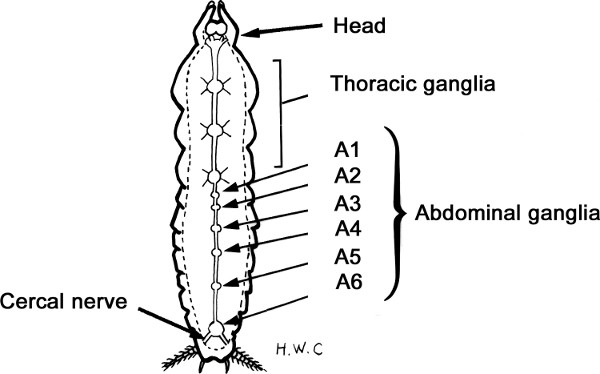
Abbildung 3. Schematische Ansicht der ventralen Nervenstrang Kakerlake.
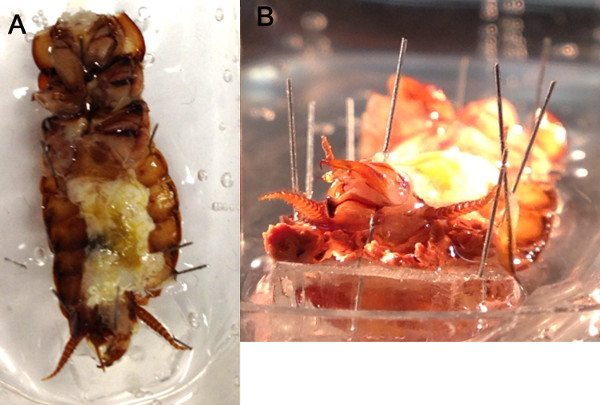
Abbildung 4. Die Cerci sind nach oben aus dem Solebad positioniert. Die geöffneten Bauchraum mit Kochsalzlösung (A) mit dem Schwanzende des Plötze mit einem kleinen keilförmigen Stück Silikon-Elastomer, um die Cerci draußen zu halten erhöht überflutet werden der Badewanne (B).
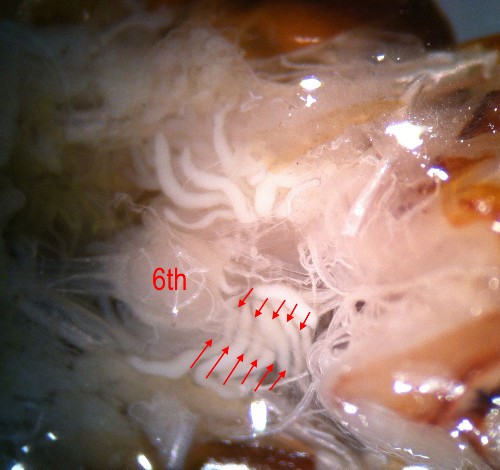
Abbildung 5. Die 6. Abdominalganglion mit der cercal Nerven (durch Pfeile angedeutet).

Abbildung 6. Das Gerät einrichten. Klicken Sie hier, um zu sehen larger Figur.

Abbildung 7. Stimulating und Aufzeichnungselektrode einrichten.
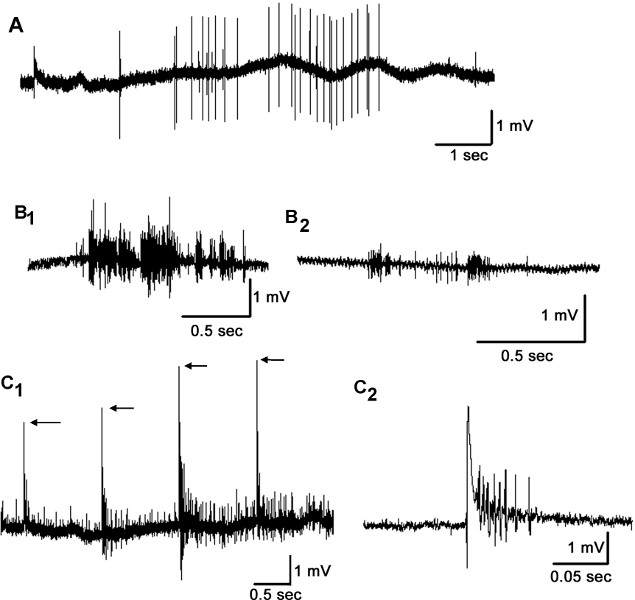
Abbildung 8. Neural Aufnahmen der Verknüpfungen und cercal Nervenstimulation mit verschiedenen Verfahren. Aufnahme mit einer Saug-Elektrode aus den Verknüpfungen zwischen A3 und A4, während schnaufend Luft an der Cerci (A). Aufnahme aus den primären cercal Neuronen mit einer Saug-Elektrode, während entweder physisch Reiben (B 1) oder die Erbringung von Flugwindbeutel (B 2) führt zu einer schnellen Ausbrüche von Aktivität in der cercal Nerv. Elektrisch Stimulierung des Nerven cercal produziert Antworten in Verknüpfungen ( C-1). Beachten Sie die schrittweise Erhöhung der Stimulationsintensität (Pfeile geben die Amplitude des Stimulationsartefakt) und die Intensität des folgenden hervorgerufenen Reaktionen. Die elektrische Stimulation des Nerven cercal bietet eine relativ kontrolliert mittels Stimulierung des Nerven cercal für Konsistenz in der Stimulation für die Quantifizierung der Antworten (C 2).
Diskussion
Einer der Gründe für die ausstellenden Techniken für diese klassische Zubereitung ist, dass die Cerci System war und ist ein aktives Forschungsgebiet in ein auf Fragen der Entwicklung der neuronalen Schaltkreise sowie Fragen zur synaptischen Reparatur und Regeneration 26-31. Beide Verfahren hervorzurufen Aktivität in der Schabe Bauchmark verwendet werden, um die Auswirkungen der pharmakologischen Mitteln oder Insektiziden auf Funktion des Nervensystems zu untersuchen. Diese Experimente werden durch einfaches Lösen neuroaktiven Chemikalien in Kochsalzlösung getan. Nach dem Austausch dieser Lösung mit dem normalen Bademedium kann Veränderungen in evozierten oder spontane Aktivität während der Aufnahme von Verknüpfungen oder einer motorischen Nerven, um eine konsistente Auslesen der Wirkung der Chemikalie auf ZNS-Funktion geben, beobachtet werden.
Wie in allen neurophysiologischen Experimente ein häufiges Problem ist elektrisches Rauschen. Wahrscheinlich der größte Faktor bei der Signalqualität für diesen Vorbereitungen is die Saug-Elektrode Siegel auf dem Nervengewebe. Die Dichtheit, die nicht vollständig in der cercal Nerven-oder Bindegewebe ziehen, ist ideal. Die Aufnahmen können auch mit Doppelhaken Elektroden unter der Nervenstrang und Isolierung des VNC mit einer Mischung aus Mineralöl und Petrolatum platziert werden. Die Mischung kann in eine Spritze geladen und um die Nervenkabel 32 ausgewiesen werden. Auch eine sorgfältige Präparation ist so kritisch hier wie in CNS Vorbereitung. Manche finden es einfacher, das ZNS durch Zerlegung der dorsalen Kutikula zugreifen. Während dies reduziert die Möglichkeit der Beschädigung der Bauchmark kann es sich als schwierig, alle Eingeweide mit diesem Ansatz zu entfernen.
Es wird hier nicht beschrieben, aber diese Vorbereitung ist zugänglich für die intrazelluläre Aufnahme in den riesigen Inter 32,33. Das gesamte Nervenstrang kann auch entfernt werden, um mehrere Aufnahme-und Stimulationselektroden gleichzeitig aufnehmen. In der Tat Erforschung des Antennallobus, Pilz-body, und anderen ZNS-Frontstrukturen ist noch im Gange 34-35. Während die Kakerlake CNS weiterhin Licht auf modernen neurobiologischen Forschung werfen diese besondere Zubereitung ist einfach genug, um in grundständigen akademischen Laboratorien verwendet werden.
Offenlegungen
Die Autoren erklären, dass es keine Interessenkonflikte.
Danksagungen
Wir danken Hyewon Cooper für Illustrationen.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Sylgard | Dow Corning | 182 silicone kit | 182 silicone elastomer kit |
| NaCl | Sigma-Aldrich | S7653 | |
| KCl | Sigma-Aldrich | P9333 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| NaH2PO4•2H2O | Sigma-Aldrich | 71505 | |
| Na2HPO4•7H2O | Sigma-Aldrich | S9390 | |
| NaOH | Sigma-Aldrich | 221465 | To adjust pH |
| HCl | Sigma-Aldrich | H1758 | To adjust pH |
| Material Name | |||
| Dissecting tools | World Precision Instruments | assortment | |
| Insect Pins | Fine Science Tools, Inc | 26001-60 | |
| Dissecting microscope | World Precision Instruments | PZMIII-BS | |
| Glass electrodes | Sigma-Aldrich | CLS7095B5X | Box of 200, suction electrodes |
| Micromanipulator | World Precision Instruments | MD4-M3-R | Can fix for base or on a metal rod |
| Silver wire (10/1,000 inch) | A-M Systems | 782500 | |
| Computer | any company | ||
| AC/DC differential amplifier | A-M Systems | Model 3000 | |
| PowerLab 26T |  AD Instruments AD Instruments | 27T | |
| Head stage |  AD Instruments AD Instruments | Comes with AC/DC amplifier | |
| LabChart7 |  AD Instruments AD Instruments | ||
| Electrical leads | any company | ||
| Glass tools | make yourself | For manipulating nerves | |
| Cable and connectors | any company | ||
| Pipettes with bulbs | Fisher Scientific | 13-711-7 | Box of 500 |
| Beakers | any company | ||
| Wax or modeling clay | any company or local stores | ||
| Stimulator | Grass Instruments | SD9 or S88 | |
| Plastic tip for suction electrode | local hardware store (Watt's brand) | ¼ inch OD x 0.170 inch ID | Cut in small pieces. Pull out over a flame and cut back the tip to the correct size. |
Referenzen
- Full, R. J., Tu, M. S. Mechanics of a rapid running insect: two-, four- and six-legged locomotion. J. Exp. Biol. 156, 215-231 (1991).
- Ritzmann, R. E., Tobias, M. L., Fourtner, C. R. Flight activity initiated via giant interneurons of the cockroach: Evidence for bifunctional trigger interneurons. Science. 210, 443-445 (1980).
- Libersat, F., Camhi, J. M. Control of cercal position during flight in the cockroach: a mechanism for regulating sensory feedback. J. Exp. Biol. 136, 483-488 (1988).
- Ganihar, D., Libersat, F., Wendler, G., Cambi, J. M. Wind-evoked evasive responses in flying cockroaches. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology. 175, 49-65 (1994).
- Pipa, R. a. D., F, . The American Cockroach. , 175-216 (1981).
- Westin, J., Langberg, J. J., Camhi, J. M. Responses of giant interneurons of the cockroach; Periplaneta americana to wind puffs of different directions and velocities. Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology. 121, 307-324 (1977).
- Camhi, J. M., Tom, W., Volman, S. The escape behavior of the cockroach Periplaneta americana. J. Comp. Physiol. A Neuroethol. Sens. Neural Physiol. 128, 203-212 (1978).
- Nicklaus, R. Die Erregung einzelner Fadenhaare von Periplaneta americana in Abhängigkeit von der Grösse und Richtung der Auslenkung. Z. Vgl. Physiol. 50, 331-362 (1965).
- Westin, J. Responses to wind recorded from the cercal nerve of the cockroach Periplaneta americana. J. Comp. Physiol. A Neuroethol. Sens. Neural Physiol. 133, 97-102 (1979).
- Ritzmann, R. E. . Neural Mechanisms of Startle Behavior. , 93-131 (1984).
- Ritzmann, R. E., Pollack, A. J. Identification of thoracic interneurons that mediate giant interneuron-to-motor pathways in the cockroach. J. Comp. Physiol. A Neuroethol. Sens. Neural Physiol. 159, 639-654 (1986).
- Plummer, M. R., Camhi, J. M. Discrimination of sensory signals from noise in the escape system of the cockroach - the role of wind acceleration. J. Comp. Physiol. 142, 347-357 (1981).
- Bullock, T. H. . Neural Mechanisms of Startle Behavior. , 1-14 (1984).
- Pollack, A. J., Ritzmann, R. E., Watson, J. T. Dual pathways for tactile sensory information to thoracic interneurons in the cockroach. J. Neurobiol. 26, 33-46 (1995).
- Atwood, H. L., Wiersma, C. A. Command interneurons in the crayfish central nervous system. J. Exp. Biol. 46, 249-261 (1967).
- Olson, G. C., Krasne, F. B. The crayfish lateral giants as command neurons for escape behavior. Brain Res. 214, 89-100 (1981).
- Comer, C. M. Analyzing cockroach escape behavior with lesions of individual giant interneurons. Brain Res. 335, 342-346 (1985).
- Comer, C. M., Dowd, J. P., Stubblefield, G. T. Escape responses following elimination of the giant interneuron pathway in the cockroach, Periplaneta americana. Brain Res. 445, 370-375 (1988).
- Keegan, A. P., Comer, C. M. The wind-elicited escape response of cockroaches (Periplaneta americana) is influenced by lesions rostral to the escape circuit. Brain Res. 620, 310-316 (1993).
- Casagrand, J. L., Ritzmann, R. E. Biogenic amines modulate synaptic transmission between identified giant interneurons and thoracic interneurons in the escape system of the cockroach. J. Neurobiol. 23, 644-655 (1992).
- Roeder, K. D. Organization of the ascending giant fiber system in the cockroach, Periplaneta americana. J. Exp. Zool. 108, 243-261 (1948).
- Ramos, R. L., Moiseff, A., Brumberg, J. C. Utility and versatility of extracellular recordings from the cockroach for neurophysiological instruction and demonstration. J. Undergrad. Neurosci. Educ. 5, (2007).
- Oakley, B., Schafer, R. Experimental neurobiology. , (1978).
- Welsh, J. H., Smith, R. I., Kammer, A. E. . Laboratory exercises in invertebrate physiology. , (1968).
- Leksrisawat, B., Cooper, A. S., Gilberts, A. B., Cooper, R. L. Muscle receptor organs in the crayfish abdomen: a student laboratory exercise in proprioception. J. Vis. Exp. (45), e2323 (2010).
- Bacon, J. P., Blagburn, J. M. Ectopic sensory neurons in mutant cockroaches compete with normal cells for central targets. Development. 115, 773-784 (1992).
- Blagburn, J. M. Co-factors and co-repressors of Engrailed: expression in the central nervous system and cerci of the cockroach, Periplaneta americana. Cell Tiss. Res. 327, 177-187 (2007).
- Blagburn, J. M., Gibbon, C. R., Bacon, J. P. Expression of engrailed in an array of identified sensory neurons: comparison with position, axonal arborization, and synaptic connectivity. J. Neurobiol. 28, 493-505 (1995).
- Booth, D., Marie, B., Domenici, P., Blagburn, J. M., Bacon, J. P. Transcriptional control of behavior: engrailed knock-out changes cockroach escape trajectories. J. Neurosci. 29, 7181-7190 (2009).
- Schrader, S., Horseman, G., Cokl, A. Directional sensitivity of wind-sensitive giant interneurons in the cave cricket Troglophilus neglectus. J. Exp. Zool. 292, 73-81 (2002).
- Libersat, F., Goldstein, R. S., Camhi, J. M. Nonsynaptic regulation of sensory activity during movement in cockroaches. Proc. Natl. Acad. Sci. U.S.A. 84, 8150-8154 (1987).
- Stern, M., Ediger, V. L., Gibbon, C. R., Blagburn, J. M., Bacon, J. P. Regeneration of cercal filiform hair sensory neurons in the first-instar cockroach restores escape behavior. J. Neurobiol. 33, 439-458 (1997).
- Blagburn, J. M. Synaptic specificity in the first instar cockroach: patterns of monosynaptic input from filiform hair afferents to giant interneurons. J. Comp. Physiol A. 166, 133-142 (1989).
- Watanabe, H., Ai, H., Yokohari, F. Spatio-temporal activity patterns of odor-induced synchronized potentials revealed by voltage-sensitive dye imaging and intracellular recording in the antennal lobe of the cockroach. Front. Sys. Neurosci. (6), 55 (2012).
- Nishino, H., et al. Visual and olfactory input segregation in the mushroom body calyces in a basal neopteran, the American cockroach. Arthropod Struct. Dev. 41, 3-16 (2012).
- Elia, A. J., Gardner, D. R. Long-term effects of DDT on the behavior and central nervous system activity in Periplaneta americana. Pestic. Biochem. Physiol. 21, 326-335 (1984).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten