Method Article
Intraduktale Injection für Lokalisierte Drug Delivery auf die Maus Milchdrüse
In diesem Artikel
Zusammenfassung
Ein Protokoll für die nicht-invasive intraductal Lieferung von wässrigen Reagenzien zu der Brustdrüse der Maus beschrieben. Die Methode nutzt lokalisierte Injektion in den Brustwarzen der Brustdrüsen Targeting Milchgänge speziell. Diese Technik ist für eine Vielzahl von Verbindungen, einschließlich siRNA, chemotherapeutischen Mitteln und kleinen Molekülen anpaßbar.
Zusammenfassung
Hier beschreiben wir ein Protokoll, um verschiedene Reagenzien zu der Brustdrüse der Maus über intraduktalen Injektionen zu liefern. Lokalisierten Arzneimittelabgabe und Knock-down von Genen innerhalb der Brust Epithel war schwierig, aufgrund des Fehlens geeigneter Targeting-Moleküle, die unabhängig von Entwicklungsstufen wie Schwangerschaft und Stillzeit zu erzielen. Hier beschreiben wir eine Technik für die lokale Verabreichung von Reagenzien an der Brustdrüse bei über intraduktale Injektion in die Brustwarzen von Mäusen jeder Phase im Erwachsenenalter. Die Injektionen können auf lebende Mäuse unter Anästhesie durchgeführt werden, und damit für eine nicht-invasive und lokalisierte Arzneimittelabgabe auf die Brustdrüse. Ferner können die Injektionen über mehrere Monate ohne Beschädigung der Brustwarze wiederholt. Vital-Farbstoffe, wie Evans Blue sind sehr hilfreich, um die Technik zu lernen. Nach intraductal Injektion des blauen Farbstoffs wird das gesamte Milchgangbaum für das Auge sichtbar. Weiterhin fluoreszierend markierten Reagenzien ermöglichen auchVisualisierung und Verteilung in der Brustdrüse. Diese Technik ist für eine Vielzahl von Verbindungen, einschließlich siRNA, chemotherapeutische Mittel und kleine Moleküle anpassbar.
Einleitung
Die Maus-Brustdrüse eines komplexen duktalen-alveoläre Struktur, die in einen zentralen Kanal an der Brustwarze konvergiert besteht. Bei Mäusen als auch Menschen, die Mehrheit von Brusttumoren entstehen in den Epithelzellen der Milchgänge. Aktuell verfügbare Behandlungen gehören intravenöse Chemotherapie, Bestrahlung und Operation. Lokalisierte intraduktalen Behandlungen erforscht worden 1-3 und bieten erhebliche Vorteile in Bezug auf reduzierte Toxizität und Nebenwirkungen. Allerdings bleiben einige Herausforderungen bevor diese weiter verbreitet angewandt werden. Die Fähigkeit, vergleichbare Verfahren in der Brustdrüse der Maus ausführen erleichtert die Charakterisierung von intraduktalen Interventionen. Hier präsentieren wir eine nicht-invasive Methode für die Lieferung von Reagenzien direkt in die Maus-Brustkanal.
Intraduktales Lieferung von Chemotherapeutika in beiden Brustkrebspatienten und Mausmodellen wurde zuvor gezeigt, als hoch wirksam ohne Anzeichen vonsystemische Toxizität oder langfristige histopathologischen Veränderungen 6.3. Außerdem Tumorzellinjektion und Lentivirusvektor Lieferung von Onkogenen sind gezeigt worden, zuvor möglich sein über intraduktale Injektion 10.07.
Neben der Medikamentenabgabe, ist diese Vorgehensweise sinnvoll für lokale Schweigen der Brustdrüse Gene durch intraduktale Injektion von siRNA. Injektion kleiner Mengen von siRNA-Lösung wirksam ist, ohne die Anatomie und Physiologie der Milchdrüse. In unserem Labor haben wir vor kurzem erfolgreich Silencing Schlüsselvermittler Genen in transgenen Mäusen, die spontan resultierenden Brusttumoren in der Prävention von Tumorprogression (Brock et al., Unveröffentlicht) gezeigt. Wir waren in der Lage, alle zwei Wochen Injektionen in die gleiche Nippel bis zu 7 mal in 2-wöchigen Intervallen ohne sichtbare Gewebeschädigung oder toxische Wirkungen zu wiederholen.
Intraduktale Injektionen können in einer erwachsenen Maus, um Ent-Adresse zeitgesteuert werdenrelevant Entwicklung der Brustdrüse opmentally spezifische Ereignisse während der Schwangerschaft, Stillzeit und Rückbildung oder späteren Stadien während der Tumorentstehung und Progression Ziel. Virgin Frauen so jung wie Alter von 8 Wochen haben nicht-invasiv in unserem Labor injiziert.
Protokoll
1. Vorbereitung der Injektionslösung
- Planen 0,2% Evans-Blau-Farbstoff in phosphatgepufferter Salzlösung (PBS) oder eine andere wässrige Lösung von Interesse. Diese Vitalfarbstoff ist nützlich für die Beurteilung des Erfolgs der intraduktalen Injektionen und wird als Visualisierungshilfe empfohlen, bei der Entwicklung von Know-how in der Technik.
Das erforderliche Volumen hängt von der Anzahl und Lage der Drüsen zu injizierenden abhängen. Alle 10 Brustdrüsen weiblicher Mäuse injiziert werden kann, aber aufgrund der geringeren Größe der Kabelverschraubung sind Drüsenpaare 1 und 5 in der Regel mit 10 ul Lösung injiziert. Alle anderen Milchpaare werden mit 20 &mgr; l injiziert. Diese Mengen reichen aus, um den gesamten duktalen Baum zu füllen.
2. Die präoperative Vorbereitung
- Nehmen Sie das Körpergewicht von jeder Maus. Wie bei allen präklinischen Studien sollten Tiergewichte regelmäßig überwacht werden (zweimal pro Woche oder länger), um mögliche Toxizität zu beurteilen.
- Anesthetize die mouse mit einem Isofluran Kammer und gelten Auge Schmiermittel. Während des Verfahrens Mäusen wird weiterhin mit eingeatmeten Konzentration von 2-4% Isofluran in Sauerstoff über eine Nasenkegel betäubt werden. Die Maus für Änderungen der Atemfrequenz sorgfältig zu überwachen, die Anpassung der Höhe der Isofluran entsprechend.
- Injizieren Meloxicam (5-10 mg / kg) subkutan vor dem Verfahren, wie Analgesie.
- Tragen Sie eine Over-the-counter-Haarentfernung Creme auf die Brustwarze. Warten Sie 5 min und entfernen sanft lose Haare mit einem Baumwoll-Spitze-Applikator mit kreisenden Bewegungen. Entfernen Sie die Creme mit feuchten Papiertüchern mit warmem Wasser benetzt. Rasur aufgrund der Gefahr einer Beschädigung der Brustwarzen empfohlen.
- Sichern Sie die Maus unter dem Stereoskop durch leichtes Abklebewerkzeugs die Extremitäten.
- Saubere Injektionsstelle bei Alkoholtupfer.
3. Intraduktale Injektion
- Suchen Sie geeignete Brustwarzen unter dem Stereoskop eingespritzt werden. Verwenden feinen Mikro Sezieren tweezers, jede tote Haut, die die Brustwarze Öffnung abdeckt entfernen.
- Last 10-20 ul Injektionslösung in einen 50 ul-Spritze mit einer 33 G Nadel Metall Nabe befestigt. Manchmal ist nach der Injektion kleiner Mengen (1 ul oder weniger) kann der Nippel beim Herausziehen der Nadel auslaufen. Daher ist es empfehlenswert, 11 oder 21 &mgr; l Injektion jeweils für den möglichen Verlust zu berücksichtigen.
- Halten Sie die Brustwarze sanft mit den feinen Pinzette und leicht anheben, um sie für die Injektion zu positionieren. Es ist nicht notwendig, den Nippel zu schneiden.
- Injizieren Sie die Lösung langsam, um mögliche Schäden durch sich schnell bewegende Flüssigkeit in den duktalen Lumen zu minimieren. Die Einspritzgeschwindigkeit sollte bei etwa 40 ul / min gehalten werden.
4. Postoperative Behandlung
- Beachten Sie die Injektionsstelle. Es sollte keine Anzeichen von Trauma an der Brustwarze umgebenden Bereich oder Gewebe sein. Schwellung im Bereich um die Brustwarze zeigt wahrscheinlich eine Brustfettpolster Injektion Rather als eine erfolgreiche intraduktale Injektion.
- Nehmen Sie das Tier von der Nase Kegel-und an einem separaten Käfig für die Verwertung. Setzen Sie den Käfig unter einer Wärmelampe zu Unterkühlung zu verhindern, und helfen bei der Wiederherstellung. Mäuse werden einzeln untergebracht und wird eng überwacht werden, bis sie das Bewusstsein und die Mobilität wieder zu erlangen.
5. Analyse von Brustdrüsengewebe
- Nach Abschluss der Untersuchung werden die Mäuse durch zervikale Dislokation nach CO 2-Druckgas in einer Isolationskammer getötet. Milchdrüsen sind ausgeschnitten und können für ganze Berg Vorbereitung 11, Histologie, oder RNA-und Proteinisolierung verwendet werden.
Ergebnisse
Die Brustwarzen kann leicht mit einem Stereomikroskop einmal Haare in der Umgebung ist (Abbildung 1A) entfernt lokalisiert werden. Um die Injektionstechnik zu beherrschen, ist es empfehlenswert, Evans blauen Farbstoff zu injizieren und zu überwachen, die Integrität der Drüse (1B und C). Dieser Ansatz ermöglicht auch die Bestimmung der angemessenen Mengen in jeder Drüse injiziert als eine visuell beurteilt, ob der Farbstoff die gesamte Milchgangsystem (1C und 2A) erreicht werden. Ein Bild des injizierten Evans-Blau Bild kann dann auf die gesamte montierte Brustdrüse, bei dem die gesamte Milchgang Baum wird mit Alaun Karmin-Farbstoff (2B) gefärbt verglichen werden.
Bitte beachten Sie, dass die Robustheit dieses Injektionsverfahren ist stark abhängig von der Bedienungsperson. Zum Beispiel wird das Perforieren des Kanals in einer Brustfettpolster Injektion führen und Injizieren der Lösung zu schnell kann das duktale Epithel cel beschädigenls und provozieren eine entzündliche Reaktion. Erfolgreiche intraductal Injektion ermöglicht die lokalisierte Arzneimittelabgabe an die Brustdrüse und vermindert unspezifische Nebenwirkungen oft nicht anders festgestellt.
Ein Beispiel einer Bildführung mit fluoreszierend markierten injiziert siRNA Targeting Cyclophilin (ein nicht-essentielles Gen) ist in Abbildung 3 dargestellt.
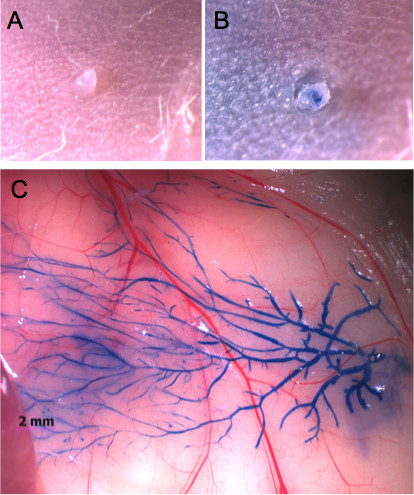
Fig. 1 ist. Ein Leistenbrustdrüse injiziert durch den Nippel mit Evans-Blau-Farbstoff. A) Aussehen der Brustwarze vor Injektion und B) nach der Injektion von 20 &mgr; l Evans-Blau-Farbstoff. Kein Quellen oder Gewebeschäden. C) Beim Öffnen der Haut beobachtet, erlaubt der Farbstoff Visualisierung des gesamten Brust duktalen Baum.
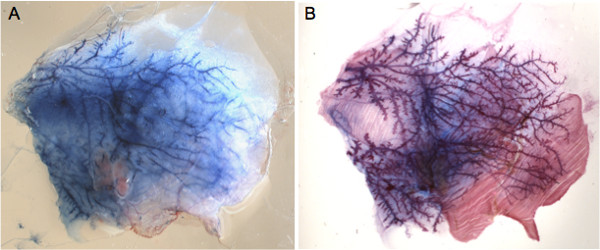
2. Whole-mount Analyse von Evans-Blau-inzogen Drüse. A) Repräsentative Bild einer seziert Drüse aus dem Tier herausgeschnitten und auf einen Objektträger unmittelbar nach der Injektion. B) insgesamt Mount-Färbung der gleichen Verschraubung mit Farbstoff Karmin nach Fett ausgebreitet hatte geräumt. Der Vergleich mit A) bestätigt, dass die injizierten Lösung füllt den Brust duktalen Baum und die Drüse ist anatomisch intakt.
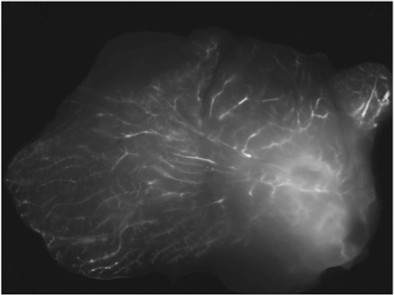
3. Intraduktale Lieferung von fluoreszierenden siRNA. Vertreter Bild der frischen Gewebeprobe herausgeschnitten 48 Stunden nach der Injektion.
Diskussion
Transgene und Knockout-Mäuse sind wertvolle Werkzeuge für die Untersuchung der in vivo-Rolle der einzelnen Gene bei Brustkrebs. Es ist jedoch kostspielig und zeitaufwendig, diese Tiere zu erzeugen, und das Gen Zuschlags gewöhnlich überall die manchmal schließt uns Erkennen der spezifischen Wirkung des Gens auf die Brustdrüse. Daher wäre eine gezielte Zuschlags Probleme der unspezifischen Nebenwirkungen und Toxizitäten in anderen Organen zu verringern.
Die intraduktale Injektion von siRNA hier vorge ermöglicht die lokalisierte Gen-Knockdown in der Maus Brustdrüse. Es ist eine schnelle Methode für eine gezielte und lokale Arzneimittelabgabe an der Brustdrüse nicht siRNA begrenzt. Solch eine Brustdrüse spezifische Arzneimittelabgabe vermeidet unspezifische Nebenwirkungen und Toxizität für andere Organe und ermöglicht die Untersuchung von Gen-Veränderungen zu bestimmten Zeitpunkten während der Entwicklung der Brustdrüse und Brusttumorbildung. Es gibt keine Beweise für siRNA-Partikel in nicht-injizierten Drüsen, der Leber oder anderen Organen ein weiterer Beweis, dass dieses Verfahren stellt eine bevorzugte Weise zur lokalisierten Gens Zuschlag in der Brustdrüse. Darüber hinaus können die intraduktalen Injektionen pro Woche oder alle zwei Wochen über mehrere Monate wiederholt werden, um langfristige Überwachung von therapeutischen Wirkstoffen ermöglichen.
Diese Technik eröffnet die Möglichkeit zur Untersuchung der intraductal Lieferung verschiedener Reagenzien auf die Maus-Brustkanälen. Fortschritte in der lokalisierte Abgabe in gut charakterisierten Mausmodellen sollte die Anwendung der nicht-invasiven beschleunigen, gezielte Therapiestrategien beim Menschen.
Offenlegungen
Die Autoren haben keine finanziellen Angaben.
Danksagungen
Die Autoren bedanken sich bei Michael Goldberg zur Herstellung von stabilisierten siRNA-Lösung und Heather Tobin für ihre Unterstützung bei den Tieren bedanken. Diese Studie wurde von DOD Innovator Award W81XWH-08-1 bis 0659 um DEI finanziert. Die Postdoc-Ausbildung von SK wurde von der Susan G Komen Stiftung (KG101329) unterstützt. Die Autoren bedanken sich bei Kristin Johnson für die Vorbereitung der schematische danken.
Materialien
| Name | Company | Catalog Number | Comments |
| isoflurane | 2-4% | ||
| meloxicam | 5-10 mg/ml | ||
| Evans blue dye | Sigma-Aldrich | E2129-10G | 0.2% in PBS |
| hair removing cream | Veet | Choose sensitive option | |
| stereoscope | Zeiss | Stemi DV4 | |
| micro-dissecting tweezers | Roboz | rs-4976 | With a 0.10 x 0.06 mm tip made of dumostar |
| Hamilton syringe | Hamilton | 7637-01 | |
| 33-gauge needle | Hamilton | 7803-05 | point style 4, 12 degree bevel (standard) |
| siGLO cyclophilin B control siRNA | Dharmacon | D-001610-01-05 |
Referenzen
- Dooley, W. C., et al. Ductal lavage for detection of cellular atypia in women at high risk for breast cancer. J Natl Cancer Inst. 93, 1624-1632 (2001).
- Jacobs, L., Sukumar, S., Stearns, V. Intraductal therapy for the prevention of breast cancer. Curr Opin Investig Drugs. 11, 646-652 (2011).
- King, B. L., Love, S. M. The intraductal approach to the breast: raison d'etre. Breast Cancer Res. 8, 206(2006).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Res. 66, 638-645 (2006).
- Stearns, V., et al. Preclinical and clinical evaluation of intraductally administered agents in early breast cancer. Sci Transl Med. 3, 106ra108(2011).
- Flanagan, M., Love, S., Hwang, E. S. Status of Intraductal Therapy for Ductal Carcinoma in Situ. Curr Breast Cancer Rep. 2, 75-82 (2010).
- Nguyen, D. -A., Beeman, N., Lewis, M., Schaack, J., Neville, M. C. Methods in mammary gland biology and breast cancer research. Ip, M. M., Asch, B. B. , Kluwer Academic/ Plenum Publishers. 259-270 (2000).
- Behbod, F., et al. An intraductal human-in-mouse transplantation model mimics the subtypes of ductal carcinoma in situ. Breast Cancer Res. 11, R66(2009).
- Bu, W., Xin, L., Toneff, M., Li, L., Li, Y. Lentivirus vectors for stably introducing genes into mammary epithelial cells in vivo. J Mammary Gland Biol Neoplasia. 14, 401-404 (2009).
- Reddy, J. P., Li, Y. The RCAS-TVA system for introduction of oncogenes into selected somatic mammary epithelial cells in vivo. J Mammary Gland Biol Neoplasia. 14, 405-409 (2009).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. J. Vis. Exp. , e2828(2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten