Method Article
Внутрипротоковый впрыска для локализованной доставки лекарств к молочной железы мыши
В этой статье
Резюме
Протокол для неинвазивного внутрипротокового поставки водных реагентов к мыши молочной железы описан. Метод использует локализованной инъекции в сосков молочных желез, ориентированных на молочные протоки специально. Этот метод адаптации для различных соединений, включая миРНК, химиотерапевтических агентов и малых молекул.
Аннотация
Здесь мы опишем протокол для доставки различных реагентов на мыши молочной железы через внутрипротокового инъекций. Локализованные доставки лекарств и нокдауна генов внутри эпителия молочных желез было трудно достичь из-за отсутствия соответствующих ориентации молекул, независимыми от стадии развития, таких как время беременности и лактации. Здесь мы описываем технику для локализованной доставки реагентов в молочной железе на любой стадии в зрелом возрасте через внутрипротокового инъекции в сосках мышей. Инъекции могут быть выполнены на живых мышах, под наркозом, и позволяют неинвазивным и локализованной доставки лекарств в молочной железе. Кроме того, инъекции можно повторить в течение нескольких месяцев, не повреждая сосок. Vital красители, такие как Evans Blue, очень полезно узнать технику. После внутрипротокового инъекции синего красителя, весь протоков дерево становится видимым для глаз. Кроме того, флуоресцентно меченые реагенты также позволяютвизуализация и распределение в молочной железе. Этот метод адаптации для различных соединений, включая миРНК, химиотерапевтические агенты и малых молекул.
Введение
Мышь молочной железы состоит из сложного протоков и альвеол дерева, которая сходится в центральный канал в соске. У мышей, а также людей, большинство опухолей молочной железы возникают в эпителиальных клетках, выстилающих молочных протоков. Текущие доступные методы лечения включают внутривенной химиотерапии, облучение, и хирургию. Локализованные внутрипротокового лечения были изучены 1-3 и имеют значительные преимущества в плане сокращения воздействия токсичности и побочных. Тем не менее, ряд проблем остается до они могут быть применены более широко. Возможность выполнять сопоставимых процедур в мышь молочной железы облегчает характеристику внутрипротокового вмешательств. Здесь мы представляем неинвазивного метода на поставку реагентов непосредственно в мыши молочной канала.
Внутрипротоковый поставка химиотерапевтических агентов в обоих больных раком молочной железы и мышиных моделях Ранее было показано, чтобы быть очень эффективным без признаковсистемная токсичность или долгосрочный гистопатологическое меняет 3-6. Кроме того, инъекции опухолевых клеток и лентивирусный вектор поставка онкогенов, как было показано ранее, чтобы быть возможным через внутрипротокового инъекции 7-10.
В дополнение к доставки лекарств, эта процедура полезна для местного молчание молочной железы генов через внутрипротокового инъекции миРНК. Введение небольших объемов раствора миРНК является эффективным без изменения анатомии и физиологии молочной железы. В нашей лаборатории мы недавно показали успешную молчание ключевых генов посредником в трансгенных мышей, которые спонтанно развиваются опухоли молочной железы в результате чего профилактики прогрессирования опухоли (Брок и др.., Не опубликовано). Мы были в состоянии повторить раз в две недели инъекции в те же соски до 7 раз в 2-недельными интервалами без видимого повреждения тканей или токсичности.
Внутрипротокового инъекции может быть назначена во взрослой мыши для решения Developmentally-определенные события, относящиеся к развитию молочной железы во время беременности, лактации и инволюции или пристреливают поздние стадии в процессе развития и прогрессии опухоли. Виргинские женщины столь же молодые как 8-недельного возраста были введены неинвазивного в нашей лаборатории.
протокол
1. Подготовка инъекции решения
- Подготовка 0,2% синего красителя Эванса в фосфатном буферном растворе (PBS) или другого водного раствора интерес. Этот жизненно важный краситель полезен для оценки успешности внутрипротокового инъекций и рекомендуется в качестве помощи визуализации при разработке опыт в технике.
Объем требуется, будет зависеть от количества и расположения желез, который будет введен. Все 10 молочные железы самок мышей может быть введен, но за счет меньшего размера железы, железы пары 1 и 5, как правило, вводят по 10 мкл раствора. Все другие молочные пары вводили 20 мкл. Эти объемы достаточны, чтобы заполнить весь протоков дерево.
2. Предоперационная подготовка
- Запись вес тела каждой мыши. Как и во всех доклинических исследований, вес животных должны регулярно контролироваться (два раза в неделю или больше) для оценки потенциальной токсичности.
- Обезболить мУз помощью ИФ камеру и применять глаз смазку. Во время процедуры мыши по-прежнему будет под наркозом с использованием ингаляционных концентрацию изофлураном в кислороде 2-4% через носовой конус. Тщательно контролировать мышь для изменений в частоте дыхания, регулируя уровень изофлураном соответственно.
- Введите мелоксикам (5-10 мг / кг) подкожно до процедуры, как обезболивания.
- Нанести удаления волос крем по-счетчик в область соска. Подождите 5 мин и осторожно удалите распущенные волосы ватным наконечником аппликатора, используя круговые движения. Снимите крем с помощью влажные салфетки, смоченной теплой водой. Бритье не рекомендуется в связи с риском повреждения сосков.
- Закрепите мышь под стереоскоп, осторожно лентой вниз конечностей.
- Чистые места инъекций с спиртовые тампоны.
3. Внутрипротоковый впрыска
- Найдите соответствующие соски, который будет введен в стереоскоп. Используйте прекрасно микро-рассечение свистЦерс удалять любую мертвую кожу, которая покрывает отверстие соска.
- Нагрузка 10-20 мкл раствора для инъекций в 50 мкл шприц с 33 г металла ступицы иглы, прикрепленной. Иногда после инъекции, в небольших количествах (1 мкл или меньше) может вытекать из соска при вытягивании иглы. Поэтому рекомендуется вводить 11 или 21 мкл соответственно для учета потенциальных потерь.
- Держите сосок осторожно изобразительного пинцетом и слегка приподнимите его позиционировать его для инъекций. Это не обязательно, чтобы сократить сосок.
- Введите решение медленно, чтобы минимизировать потенциальный ущерб, причиненный быстро движется жидкость внутри протоков люмен. Скорость впрыска должна поддерживаться на уровне примерно 40 мкл / мин.
4. Ведение послеоперационного периода
- Соблюдайте место инъекции. Там не должно быть никаких признаков травмы в области соска или окружающие ткани. Отек в области, окружающей сосок, вероятно, указывает молочной жировой ткани впрыска Ratheг, чем успешного внутрипротокового инъекции.
- Снимите животное от носового конуса и перейти к отдельной клетке для восстановления. Поместите клетку под инфракрасной лампой, чтобы предотвратить переохлаждение и помочь в восстановлении. Мыши размещаются поодиночке и будут пристально следить, пока они не пришел в сознание и подвижность.
5. Анализ ткани молочной железы
- После завершения исследования, мышей умерщвляли смещением шейных позвонков следующее CO 2 сжатый газ в одиночной камере. Молочные железы, вырезают и может быть использовано для всего препарата монтирования 11, гистологии или РНК и белка изоляции.
Результаты
Соски могут быть легко локализована с использованием стереомикроскопа раз волосы были удалены в области окружающей его (рис. 1А). Освоить технику инъекции, рекомендуется вводить синего красителя Эванса и контролировать целостность железы (рис. 1В и С). Этот подход также позволяет для определения соответствующих объемов который будет введен в каждой железы, как можно визуально оценить, достигло ли краситель на всю систему протоков (рис. 1C и 2A). Изображение впрыскиваемого голубого Эванса изображение затем можно сравнить с всей монтажа молочной железы, в которой вся протоков дерево окрашивали красителем Carmine квасцов (рис. 2В).
Обратите внимание, что прочность этого метода инжекции в значительной степени зависит от оператора. Например, перфорации канала приведет к молочной инъекции жировой ткани и введения раствора слишком быстро может привести к повреждению эпителия протоков CELлс и спровоцировать воспалительный ответ. Успешное Intraductal впрыска позволяет локализованной доставки лекарств в молочной железе и снижает неспецифические побочные эффекты часто наблюдаемые в противном случае.
Примером образ железы вводят флюоресцентно отмеченных миРНК ориентации циклофилин (незаменимой гена) показан на рисунке 3.
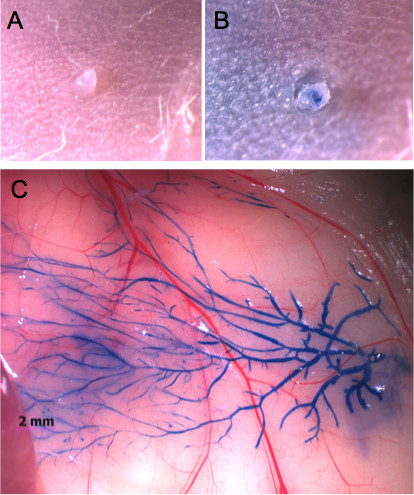
Рисунок 1. Паховая молочной железы вводят через соску с синего красителя Эванса. А) Внешний вид соска перед инъекцией и В) после инъекции с 20 мкл синего красителя Эванса. Нет опухоль или повреждение тканей не наблюдается. C) При открытии кожу, краситель позволяет визуализацию всей молочной протоков дерева.
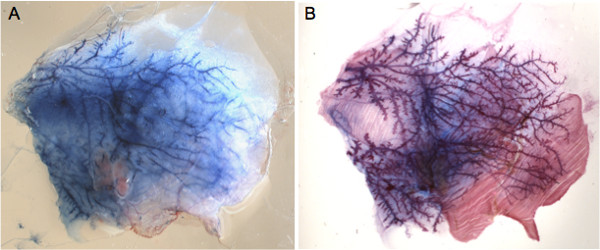
Рисунок 2. Анализ голубого Эванса-в целом монтажаотвергается железы. А) представитель изображение рассеченной железы вырезали из животного и наносили на предметное стекло сразу же после инъекции. B) Всего монтирования окрашивания той же железы с кармин красителя после жира были очищены. Сравнение с А) подтверждает, что вводят раствор заполняет молочной протоков дерево и железа анатомически нетронутыми.
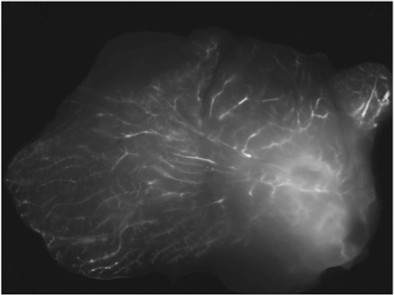
Рисунок 3. Внутрипротоковый поставка флуоресцентного миРНК. Представитель образ образца свежей ткани, вырезали 48 часов после инъекции.
Обсуждение
Трансгенные и мышей нокаутом являются бесценными инструментами для изучения роли в естественных условиях отдельных генов при раке молочной железы. Однако, это дорого и отнимает много времени для генерации этих животных и ген нокдаун, как правило, повсеместно которые иногда не позволяет нам признать специфические эффекты этого гена на молочной железе. Таким образом, целевая нокдаун бы облегчить вопросы неспецифических побочных эффектов и токсичности в других органах.
Intraductal инъекция миРНК представлены здесь позволяет локализованное гена нокдаун в мыши молочной железы. Это быстрый метод целенаправленного и локализованной доставки лекарств в молочной железе не ограничиваясь миРНК доставки. Такая молочной железы конкретных доставки лекарств позволяет избежать неспецифических побочных эффектов и токсичности в других органах и позволяет для изучения генных изменений в определенные моменты времени в течение молочной железы развития и формирования опухоли молочной железы. Там нет никаких доказательств из сиРНК частиц в неинжектируемыми желез, печени или других органах, обеспечивающие дополнительные свидетельства, что этот метод представляет собой предпочтительный способ локализованного гена нокдауна в молочной железе. Кроме того, внутрипротокового инъекции можно повторить в неделю или раз в две недели в течение нескольких месяцев для обеспечения долгосрочного мониторинга терапевтических агентов.
Этот метод открывает возможность для опробования на внутрипротокового доставку различных реагентов к молочной железы мыши протоков. Достижения в локализованной доставки в хорошо известных мышиных моделях должно ускорить применение неинвазивной, целевые терапевтические стратегии в людях.
Раскрытие информации
Авторы не имеют никаких финансовых раскрытия.
Благодарности
Авторы хотели бы поблагодарить Майкла Голдберга для приготовления стабилизированного раствора миРНК и Хизер Тобина за помощь с животными. Это исследование было профинансировано DOD Новатор премии W81XWH-08-1-0659 к DEI. Докторской подготовки SK при поддержке фонда Сьюзен Комен G (KG101329). Авторы хотели бы поблагодарить Кристин Джонсон для подготовки схеме.
Материалы
| Name | Company | Catalog Number | Comments |
| isoflurane | 2-4% | ||
| meloxicam | 5-10 mg/ml | ||
| Evans blue dye | Sigma-Aldrich | E2129-10G | 0.2% in PBS |
| hair removing cream | Veet | Choose sensitive option | |
| stereoscope | Zeiss | Stemi DV4 | |
| micro-dissecting tweezers | Roboz | rs-4976 | With a 0.10 x 0.06 mm tip made of dumostar |
| Hamilton syringe | Hamilton | 7637-01 | |
| 33-gauge needle | Hamilton | 7803-05 | point style 4, 12 degree bevel (standard) |
| siGLO cyclophilin B control siRNA | Dharmacon | D-001610-01-05 |
Ссылки
- Dooley, W. C., et al. Ductal lavage for detection of cellular atypia in women at high risk for breast cancer. J Natl Cancer Inst. 93, 1624-1632 (2001).
- Jacobs, L., Sukumar, S., Stearns, V. Intraductal therapy for the prevention of breast cancer. Curr Opin Investig Drugs. 11, 646-652 (2011).
- King, B. L., Love, S. M. The intraductal approach to the breast: raison d'etre. Breast Cancer Res. 8, 206(2006).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Res. 66, 638-645 (2006).
- Stearns, V., et al. Preclinical and clinical evaluation of intraductally administered agents in early breast cancer. Sci Transl Med. 3, 106ra108(2011).
- Flanagan, M., Love, S., Hwang, E. S. Status of Intraductal Therapy for Ductal Carcinoma in Situ. Curr Breast Cancer Rep. 2, 75-82 (2010).
- Nguyen, D. -A., Beeman, N., Lewis, M., Schaack, J., Neville, M. C. Methods in mammary gland biology and breast cancer research. Ip, M. M., Asch, B. B. , Kluwer Academic/ Plenum Publishers. 259-270 (2000).
- Behbod, F., et al. An intraductal human-in-mouse transplantation model mimics the subtypes of ductal carcinoma in situ. Breast Cancer Res. 11, R66(2009).
- Bu, W., Xin, L., Toneff, M., Li, L., Li, Y. Lentivirus vectors for stably introducing genes into mammary epithelial cells in vivo. J Mammary Gland Biol Neoplasia. 14, 401-404 (2009).
- Reddy, J. P., Li, Y. The RCAS-TVA system for introduction of oncogenes into selected somatic mammary epithelial cells in vivo. J Mammary Gland Biol Neoplasia. 14, 405-409 (2009).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. J. Vis. Exp. , e2828(2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены