Method Article
Iniezione intraduttale per Localizzato Drug Delivery per il mouse ghiandola mammaria
In questo articolo
Riepilogo
Un protocollo per la consegna intraduttale non invasiva di reagenti acquosi alla ghiandola mammaria topo è descritto. Il metodo si avvale di iniezione localizzato nei capezzoli delle ghiandole mammarie destinati dotti mammari in particolare. Questa tecnica è adattabile per una varietà di composti compresi siRNA, agenti chemioterapici e piccole molecole.
Abstract
Qui descriviamo un protocollo per consegnare vari reagenti al mouse ghiandola mammaria tramite iniezioni intraduttali. Consegna della droga localizzata e knock-down di geni all'interno dell'epitelio mammario è stato difficile da raggiungere a causa della mancanza di adeguati molecole di targeting che sono indipendenti di stadi di sviluppo come la gravidanza e l'allattamento. Qui, descriviamo una tecnica per la consegna localizzata dei reagenti alla ghiandola mammaria in qualsiasi fase adulta mediante iniezione intraduttale nei capezzoli di topi. Le iniezioni possono essere eseguite su topi vivi, sotto anestesia, e consentono una consegna non invasiva e localizzata farmaco alla ghiandola mammaria. Inoltre, le iniezioni possono essere ripetute per diversi mesi senza danneggiare il capezzolo. Coloranti vitali come il Blu di Evans sono molto utili per imparare la tecnica. Una volta iniettato intraduttale del colorante blu, l'intero albero duttale diventa visibile all'occhio. Inoltre, reagenti fluorescente consentono anchevisualizzazione e distribuzione all'interno della ghiandola mammaria. Questa tecnica è adattabile per una varietà di composti compresi siRNA, agenti chemioterapici, e piccole molecole.
Introduzione
La ghiandola mammaria mouse è composto da un albero duttale-alveolare complesso che converge in un condotto centrale al capezzolo. Nei topi che nell'uomo, la maggior parte dei tumori al seno hanno origine nelle cellule epiteliali che rivestono i dotti galattofori. Trattamenti attualmente disponibili comprendono la chemioterapia endovenosa, radioterapia e chirurgia. Intraduttali trattamenti localizzati sono state esplorate 1-3 e offrono vantaggi significativi in termini di tossicità ed effetti collaterali ridotti. Tuttavia, molte sfide restano prima che queste possano essere applicate più ampiamente. La possibilità di eseguire procedure comparabili nella ghiandola mammaria topo facilita la caratterizzazione degli interventi intraduttale. Presentiamo qui un metodo non invasivo per la fornitura di reagenti direttamente nel condotto mammaria mouse.
Consegna intraduttale di agenti chemioterapici in entrambe le pazienti con carcinoma mammario e modelli di topo è stato precedentemente dimostrato di essere altamente efficace senza evidenza ditossicità sistemica o istopatologico cambiamenti a lungo termine 3-6. Inoltre, l'iniezione di cellule tumorali e consegna vettore lentivirale di oncogeni hanno dimostrato in precedenza di essere realizzabile tramite iniezione intraduttale 7-10.
Oltre alla somministrazione di farmaci, questa procedura è utile per silenziamento locale di geni della ghiandola mammaria mediante iniezione intraduttale di siRNA. L'iniezione di piccoli volumi di soluzione siRNA è efficace senza alterare l'anatomia e la fisiologia della ghiandola mammaria. Nel nostro laboratorio abbiamo recentemente dimostrato con successo il silenziamento di geni mediatore chiave in topi transgenici che sviluppano spontaneamente tumori mammari con conseguente prevenzione della progressione tumorale (Brock et al., Inedito). Siamo stati in grado di ripetere le iniezioni bisettimanali negli stessi capezzoli fino a 7 volte a intervalli di 2 settimane, senza danni ai tessuti visibili o tossicità.
Iniezioni intraduttali possono essere a tempo in un topo adulto per affrontare develeventi opmentally specifici rilevanti per lo sviluppo della ghiandola mammaria durante la gravidanza, l'allattamento, e involuzione o di indirizzare fasi successive durante lo sviluppo e progressione tumorale. Femmine vergini giovani come 8 settimane di età sono state iniettate in modo non invasivo nel nostro laboratorio.
Protocollo
1. Preparazione della soluzione per l'iniezione
- Preparare 0,2% Evans blu colorante in tampone fosfato salino (PBS) o altra soluzione acquosa di interesse. Questo colorante vitale è utile per valutare il successo delle iniezioni intraduttali ed è consigliato come un aiuto di visualizzazione durante lo sviluppo di competenze nella tecnica.
Il volume richiesto dipenderà dal numero e la posizione delle ghiandole da iniettare. Tutti 10 ghiandole mammarie di topi femmina possono essere iniettati ma a causa delle dimensioni della ghiandola minore, coppie ghiandola 1 e 5 sono tipicamente iniettati con 10 ml di soluzione. Tutte le altre coppie mammarie sono iniettati con 20 microlitri. Questi volumi sono sufficienti a riempire l'intero albero duttale.
2. Preparazione preoperatoria
- Registrare il peso corporeo di ciascun topo. Come per tutti gli studi preclinici, i pesi degli animali devono essere controllati regolarmente (due volte alla settimana o più) per valutare la potenziale tossicità.
- Anestetizzare il mOuse utilizzando una camera di isoflurano e applicare lubrificante occhio. Durante la procedura di topi continueranno ad essere anestetizzato con inalatoria concentrazione 2-4% di isoflurano in ossigeno attraverso un cono di naso. Monitorare attentamente il mouse per i cambiamenti nella frequenza respiratoria, regolando il livello di isoflurano conseguenza.
- Iniettare meloxicam (5-10 mg / kg) per via sottocutanea prima della procedura come analgesia.
- Applicare una crema di rimozione over-the-counter capelli per la zona del capezzolo. Aspettare 5 minuti e rimuovere delicatamente i capelli sciolti con un applicatore di cotone punta con un movimento circolare. Togliere la crema usando tovaglioli di carta umidi bagnate con acqua tiepida. Rasatura non è raccomandato a causa del rischio di danneggiare i capezzoli.
- Fissare il mouse sotto lo stereoscopio con nastro adesivo dolcemente verso le estremità.
- Siti di iniezione puliti con tamponi imbevuti di alcool.
3. Iniezione intraduttale
- Individuare capezzoli adeguate per essere iniettato sotto lo stereoscopio. Utilizzare multa micro-dissezione tweeZers per rimuovere tutta la pelle morta che copre l'apertura capezzolo.
- Carico 10-20 ml di soluzione iniettabile in una siringa da 50 ml con un 33 G hub metallo ago apposto. A volte, dopo l'iniezione, piccole quantità (1 ml o meno) possono fuoriuscire dal capezzolo su estraendo l'ago. Pertanto, si raccomanda di iniettare 11 o 21 ml rispettivamente per tenere conto della perdita potenziale.
- Tenere il capezzolo delicatamente con le belle pinzette e sollevarlo leggermente per posizionarla per l'iniezione. Non è necessario tagliare il capezzolo.
- Iniettare la soluzione lentamente per ridurre al minimo i danni potenziali causati da rapido movimento fluido all'interno dei lumi duttali. La velocità di iniezione deve essere mantenuta a circa 40 microlitri / min.
4. Cura postoperatoria
- Osservare il sito di iniezione. Non ci dovrebbero essere segni di trauma alla regione capezzolo o tessuto circostante. Gonfiore nella zona che circonda il capezzolo probabilmente indica un mammaria cuscinetto adiposo piuttosto c iniezioner che un'iniezione intraduttale successo.
- Rimuovere l'animale dal cono e trasferirsi in una gabbia separata per il recupero. Posizionare la gabbia sotto una lampada di calore per prevenire l'ipotermia e assistere nel recupero. I topi sono alloggiati singolarmente e saranno monitorati attentamente fino a che riprendano conoscenza e la mobilità.
5. Analisi della ghiandola mammaria Tissue
- Al termine dello studio, i topi sono sacrificati mediante dislocazione cervicale seguente CO 2 gas compresso in una camera di isolamento. Ghiandole mammarie vengono asportati e possono essere utilizzati per tutta la preparazione mount 11, istologia, o RNA e isolamento delle proteine.
Risultati
I capezzoli possono essere facilmente localizzati utilizzando uno stereomicroscopio, una volta di capelli è stato rimosso nella zona circostante (Figura 1A). Per padroneggiare la tecnica di iniezione, si raccomanda di iniettare Evans colorante blu e monitorare l'integrità della ghiandola (Figure 1B e C). Questo approccio permette anche per la determinazione dei volumi appropriati da iniettare in ogni ghiandola come si può valutare visivamente se il colorante raggiunge l'intero sistema duttale (Figure 1C e 2A). Un'immagine del Evans blu immagine iniettato può quindi essere confrontato a tutto montato ghiandola mammaria, in cui l'intero albero duttale è macchiato con Carmine allume colorante (Figura 2B).
Si noti che la robustezza di questo metodo di iniezione è altamente dipendente dall'operatore. Ad esempio, perforando il condotto si tradurrà in una iniezione mammaria cuscinetto adiposo ed iniettare la soluzione troppo veloce potrebbe danneggiare il cel epiteliale duttaleLS e provocare una risposta infiammatoria. Iniezione intraduttale successo consente la somministrazione di farmaci localizzato alla ghiandola mammaria e riduce non specifici effetti collaterali spesso osservati diversamente.
Un'immagine esempio di una ghiandola iniettato con fluorescente etichettato siRNA rivolti cyclophilin (un gene non essenziale) è mostrato in Figura 3.
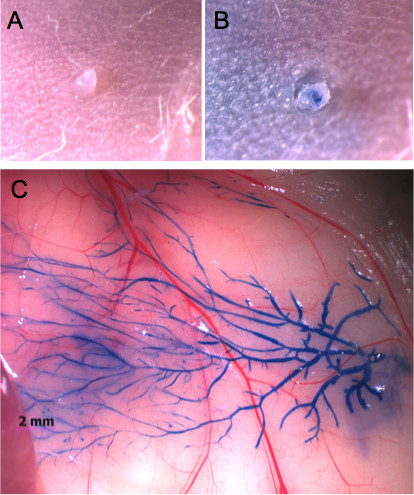
Figura 1. Una ghiandola mammaria inguinale iniettato attraverso il capezzolo con Evans colorante blu. A) Aspetto del capezzolo prima dell'iniezione e B) dopo l'iniezione con 20 microlitri Evans colorante blu. Nessun gonfiore o danni ai tessuti si osserva. C) All'apertura della pelle, il colorante permette la visualizzazione dell'intero albero duttale mammario.
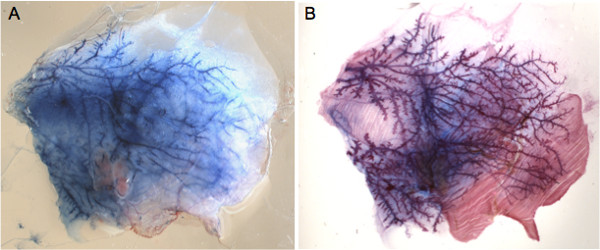
Figura 2. Whole-mount analisi di Evans blue-inghiandola proiettata. A) l'immagine rappresentativa di una ghiandola sezionato asportato dall'animale e si sviluppa su un vetrino immediatamente dopo l'iniezione. B) Tutta la montatura colorazione della stessa ghiandola con il carminio colorante dopo che il grasso era stato cancellato. Confronto con A) conferma che la soluzione iniettata riempie l'albero duttale e la ghiandola mammaria è anatomicamente intatto.
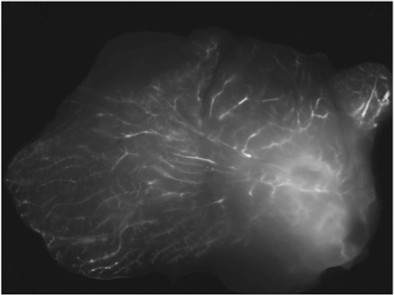
Figura 3. Consegna intraduttale di siRNA fluorescenti. Immagine rappresentativa del campione di tessuto fresco, asportato 48 ore dopo l'iniezione.
Discussione
Transgenici e topi knockout sono strumenti preziosi per studiare il ruolo in vivo dei singoli geni nel cancro al seno. Tuttavia, è costoso e di generare questi animali richiede tempo e knockdown gene è solitamente onnipresente che a volte ci impedisce di riconoscere gli effetti specifici di tale gene sulla ghiandola mammaria. Pertanto, un atterramento mirata allevierebbe questioni di non-specifici effetti collaterali e tossicità in altri organi.
L'iniezione intraduttale di siRNA qui presentata consente knockdown gene localizzato nella ghiandola mammaria mouse. Si tratta di un metodo rapido per una somministrazione di farmaci mirati e localizzato alla ghiandola mammaria non limitato alla consegna siRNA. Tale somministrazione di farmaci specifici ghiandola mammaria evita aspecifiche effetti collaterali e la tossicità verso altri organi e consente lo studio di alterazioni geniche in punti temporali specifici durante lo sviluppo della ghiandola mammaria e formazione del tumore al seno. Non c'è evidenza di SiParticelle di RNA in ghiandole non iniettati, fegato o di altri organi che forniscono ulteriore prova che questo metodo presenta un modo preferito per knockdown gene localizzato nella ghiandola mammaria. Inoltre, le iniezioni possono essere ripetute intraduttale settimanale o bisettimanale diversi mesi per permettere il monitoraggio a lungo termine degli agenti terapeutici.
Questa tecnica apre la possibilità per saggiare la consegna intraduttale di vari reagenti ai dotti mammari del mouse. Advances in erogazione localizzata in modelli murini ben caratterizzati dovrebbero accelerare l'applicazione di non invasiva, mirate strategie terapeutiche nell'uomo.
Divulgazioni
Gli autori non hanno informazioni finanziarie.
Riconoscimenti
Gli autori desiderano ringraziare Michael Goldberg per la preparazione della soluzione siRNA stabilizzato e Heather Tobin per la sua assistenza con gli animali. Questo studio è stato finanziato dal Dipartimento della Difesa Innovator Award W81XWH-08-1-0659 al DEI. La formazione post-dottorato di SK è stato sostenuto dalla Fondazione Susan G Komen (KG101329). Gli autori desiderano ringraziare Kristin Johnson per la preparazione dello schema.
Materiali
| Name | Company | Catalog Number | Comments |
| isoflurane | 2-4% | ||
| meloxicam | 5-10 mg/ml | ||
| Evans blue dye | Sigma-Aldrich | E2129-10G | 0.2% in PBS |
| hair removing cream | Veet | Choose sensitive option | |
| stereoscope | Zeiss | Stemi DV4 | |
| micro-dissecting tweezers | Roboz | rs-4976 | With a 0.10 x 0.06 mm tip made of dumostar |
| Hamilton syringe | Hamilton | 7637-01 | |
| 33-gauge needle | Hamilton | 7803-05 | point style 4, 12 degree bevel (standard) |
| siGLO cyclophilin B control siRNA | Dharmacon | D-001610-01-05 |
Riferimenti
- Dooley, W. C., et al. Ductal lavage for detection of cellular atypia in women at high risk for breast cancer. J Natl Cancer Inst. 93, 1624-1632 (2001).
- Jacobs, L., Sukumar, S., Stearns, V. Intraductal therapy for the prevention of breast cancer. Curr Opin Investig Drugs. 11, 646-652 (2011).
- King, B. L., Love, S. M. The intraductal approach to the breast: raison d'etre. Breast Cancer Res. 8, 206(2006).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Res. 66, 638-645 (2006).
- Stearns, V., et al. Preclinical and clinical evaluation of intraductally administered agents in early breast cancer. Sci Transl Med. 3, 106ra108(2011).
- Flanagan, M., Love, S., Hwang, E. S. Status of Intraductal Therapy for Ductal Carcinoma in Situ. Curr Breast Cancer Rep. 2, 75-82 (2010).
- Nguyen, D. -A., Beeman, N., Lewis, M., Schaack, J., Neville, M. C. Methods in mammary gland biology and breast cancer research. Ip, M. M., Asch, B. B. , Kluwer Academic/ Plenum Publishers. 259-270 (2000).
- Behbod, F., et al. An intraductal human-in-mouse transplantation model mimics the subtypes of ductal carcinoma in situ. Breast Cancer Res. 11, R66(2009).
- Bu, W., Xin, L., Toneff, M., Li, L., Li, Y. Lentivirus vectors for stably introducing genes into mammary epithelial cells in vivo. J Mammary Gland Biol Neoplasia. 14, 401-404 (2009).
- Reddy, J. P., Li, Y. The RCAS-TVA system for introduction of oncogenes into selected somatic mammary epithelial cells in vivo. J Mammary Gland Biol Neoplasia. 14, 405-409 (2009).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. J. Vis. Exp. , e2828(2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon