Method Article
Injeção Intraductal para localizada Drug Delivery ao Rato glândula mamária
Neste Artigo
Resumo
Um protocolo para a entrega intraductal não-invasivo de reagentes aquosas para a glândula mamaria do rato está descrito. O método aproveita injecção localizada nos mamilos das glândulas mamárias destinadas especificamente ductos mamários. Esta técnica é adaptável para uma variedade de compostos, incluindo o siRNA, agentes quimioterapêuticos e moléculas pequenas.
Resumo
Aqui nós descrevemos um protocolo para entregar vários reagentes para a glândula mamária do mouse através de injeções intraductais. Entrega da droga localizada e knock-down de genes dentro do epitélio mamário tem sido difícil de alcançar devido à falta de moléculas alvo apropriadas que são independentes da fase de desenvolvimento, tais como a gravidez ea lactação. Descrevemos uma técnica para a distribuição localizada de reagentes para a glândula mamaria, em qualquer fase na idade adulta através de injecção intraductal nos bocais de ratinhos. As injecções podem ser realizadas em ratinhos vivos, sob anestesia, e permitem uma entrega não-invasivo e localizada de drogas para a glândula mamaria. Além disso, as injeções podem ser repetidas ao longo de vários meses, sem danificar o mamilo. Corantes vitais, tais como azul de Evans são muito úteis para aprender a técnica. Após a injecção intraductal do corante azul, todo o dutal torna-se visível a olho nu. Além disso, os reagentes de marcação fluorescente permitem tambémvisualização e distribuição no interior da glândula mamaria. Esta técnica é adaptável para uma variedade de compostos, incluindo o siRNA, agentes quimioterapêuticos, e pequenas moléculas.
Introdução
A glândula mamaria do rato é composto por uma árvore ductal-alveolar complexo que converge para um tubo central, no mamilo. Em ratinhos, bem como os seres humanos, a maioria dos tumores da mama são originários das células epiteliais que revestem os ductos. Os tratamentos atuais disponíveis incluem quimioterapia intravenosa, radioterapia e cirurgia. Tratamentos intraductais localizadas foram exploradas 1-3 e oferecem vantagens significativas em termos de redução de toxicidade e contra. No entanto, vários desafios permanecem antes que estes podem ser aplicados de forma mais ampla. A capacidade de executar procedimentos comparáveis na glândula mamária do mouse facilita a caracterização de intervenções intraductais. Aqui apresentamos um método não-invasivo para a entrega de reagentes diretamente no duto mamário mouse.
Entrega Intraductal de agentes quimioterápicos em ambos os pacientes com câncer de mama e modelos de mouse tem sido mostrado previamente para ser altamente eficaz, sem evidência detoxicidade sistêmica ou histopatológico de longo prazo muda 3-6. Além disso, a injecção de células tumorais e de distribuição de vectores lentivirais de oncogenes têm sido mostrado previamente para ser possível por meio de injecção intraductal 7-10.
Em adição à entrega da droga, este processo é útil para o silenciamento de genes locais de glândulas mamárias através de injecção intraductal de siRNA. A injeção de pequenos volumes de solução de siRNA é eficaz, sem alterar a anatomia e fisiologia da glândula mamária. No nosso laboratório mostraram recentemente o silenciamento dos genes bem sucedida mediador chave em ratinhos transgénicos que desenvolvem espontaneamente tumores mamários, resultando na prevenção da progressão do tumor (Brock et al., Não publicado). Fomos capazes de repetir injecções quinzenais para os mesmos bocais até sete vezes em intervalos de 2 semanas, com nenhum dano no tecido visível ou toxicidade.
Injeções intraductais pode ser cronometrada em um rato adulto para lidar com desenvolvimentoeventos opmentally específicas relevantes para o desenvolvimento da glândula mamária durante a gestação, lactação e involução ou para atingir estágios mais avançados durante o desenvolvimento e progressão tumoral. Fêmeas virgens tão jovens quanto 8 semanas de idade foram injetados não-invasiva em nosso laboratório.
Protocolo
1. Preparação de Solução de injecção
- Prepare a 0,2% de corante azul de Evans em tampão fosfato salino (PBS) ou outra solução aquosa de interesse. Este corante vital é útil para avaliar o sucesso de injeções intraductais e é recomendado como auxiliar de visualização ao desenvolver conhecimentos na técnica.
O volume necessário dependerá do número e localização das glândulas para ser injectado. Todos os 10 glândulas mamarias de ratos fêmeas pode ser injectado, mas, devido ao menor tamanho da glândula, pares de glândulas 1 e 5 são tipicamente injectados com 10 ul de solução. Todos os outros pares mamarias foram injectados com 20 ul. Esses volumes são suficientes para preencher toda a árvore ductal.
2. Preparação pré-operatória
- Registe o peso do corpo de cada rato. Tal como acontece com todos os estudos pré-clínicos, pesos dos animais devem ser monitorizados regularmente (duas vezes por semana ou mais) para avaliar a toxicidade potencial.
- Anestesiar a mouse usando uma câmara de isoflurano e aplicar lubrificante ocular. Durante o procedimento, os ratos continuarão a ser anestesiados com inalação de concentração de 2-4% de isoflurano em oxigênio através de um cone do nariz. Acompanhar atentamente o mouse para mudanças na freqüência respiratória, ajustando o nível de isoflurano em conformidade.
- Injectar meloxicam (5-10 mg / kg) subcutaneamente antes do procedimento como analgesia.
- Aplicar um creme sobre a remoção de balcão de cabelo para a área do bocal. Espere 5 minutos e retire cuidadosamente o cabelo solto com um aplicador de algodão de ponta usando um movimento circular. Retire o creme de usar toalhas de papel úmidas molhadas com água morna. Barbear não é recomendada devido ao risco de danos aos mamilos.
- Fixe o mouse sob o estereoscópio delicadamente gravando as extremidades.
- Locais de injeção limpos com compressas com álcool.
3. Injeção Intraductal
- Localize mamilos apropriadas para ser injectado sob a estereoscópio. Use bem micro-dissecando tweezers para remover qualquer pele morta que cobre a abertura do mamilo.
- Carga de 10-20 mL de solução de injeção em uma seringa de 50 mL com um 33 G hub agulha de metal afixada. Às vezes, após a injeção, pequenas quantidades (1 mL ou menos) pode vazar para fora do mamilo após retirar a agulha. Portanto, recomenda-se a injectar 11 ou 21 ul, respectivamente, para ter em conta a perda de potencial.
- Segure o mamilo suavemente com a pinça fina e levante-o ligeiramente para posicioná-la para a injecção. Não é necessário cortar o mamilo.
- Injetar a solução lentamente para minimizar os danos potenciais causados por um fluido movendo-se rapidamente dentro dos lumens ductal. A taxa de injecção deve ser mantido a cerca de 40 mL / min.
4. Cuidados no pós-operatório
- Observe o local da injeção. Não deve haver nenhum sinal de trauma para a região do mamilo ou tecido circundante. Inchaço na área em torno do mamilo provavelmente indica uma almofada de gordura mamária injeção em vez de sinr do que uma injecção intraductal bem sucedida.
- Remover o animal do cone do nariz e se mudar para uma gaiola separada para recuperação. Coloque a gaiola, sob uma lâmpada de aquecimento para evitar a hipotermia e ajudar na recuperação. Os ratos são alojados individualmente e será acompanhada de perto, até que recuperar a consciência e mobilidade.
5. Análise da glândula mamária Tissue
- Após a conclusão do estudo, os ratinhos foram sacrificados por deslocamento cervical seguinte CO 2 de gás comprimido numa câmara de isolamento. Glândulas mamarias são excisadas e pode ser utilizado para a preparação toda suporte 11, histologia, ou RNA e isolamento da proteína.
Resultados
Os mamilos podem ser facilmente localizadas através de um microscópio estereoscópico, uma vez cabelo foi removida da área ao seu redor (Figura 1A). Para dominar a técnica de injecção, recomenda-se a injectar corante azul de Evans e controlar a integridade da glândula (Figuras 1B e C). Esta abordagem também permite a determinação de volumes adequados para ser injectada em cada glândula como se pode avaliar visualmente se o corante atinge a totalidade do sistema ductal (Figuras 1C e 2A). Uma imagem da imagem azul de Evans injectada pode então ser comparada a totalidade montado na glândula mamaria, em que toda a árvore ductal é corado com corante de carmim alúmen (Figura 2B).
Por favor note que a robustez do método de injecção é altamente dependente do operador. Por exemplo, a perfuração da conduta vai resultar em uma injecção mamaria almofada de gordura e injectando a solução demasiado rápida pode danificar o cel epitelial ductalls e provocar uma resposta inflamatória. Injecção com sucesso intraductal permite a entrega de droga localizada para a glândula mamaria e reduz os efeitos colaterais não específicos, muitas vezes observados em contrário.
Um exemplo de imagem de uma glândula injectados com fluorescentemente marcado siRNA alvejando ciclofilina (um gene não essencial) é mostrado na Figura 3.
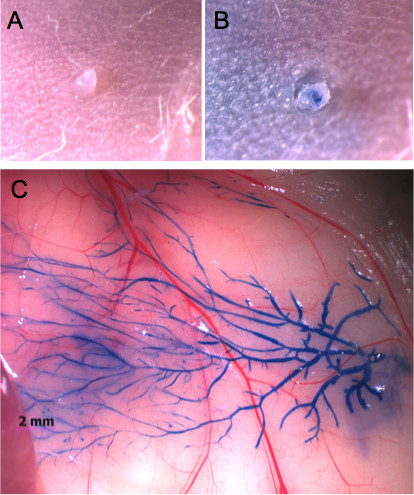
Figura 1. Uma glândula mamária inguinal injetado através do mamilo com corante azul de Evans. A) Aspecto do mamilo antes da injeção e B) após a injeção de 20 mL de corante azul de Evans. Sem inchaço ou dano tecidual é observado. C) Ao abrir a pele, o corante permite a visualização de toda a árvore ductal mamária.
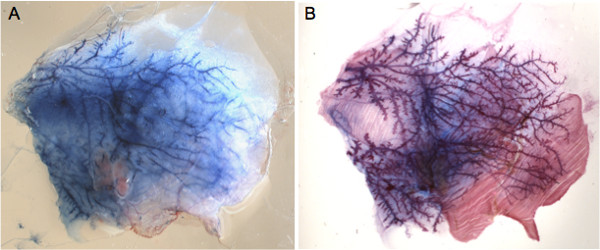
Figura 2. Análise de Evans azul-in Todo-mountglândula injetada. A) Imagem representativa de uma glândula dissecada retirado do animal e espalhar sobre uma lâmina de vidro imediatamente após a injeção. B) Total coloração monte da mesma glândula com corante carmim após gordura tinha sido apagada. Comparação com A) confirma que a solução injectada enche dutal mamaria e a glândula é anatomicamente intacto.
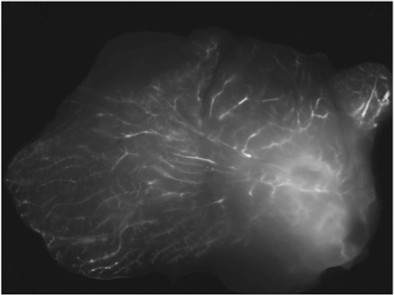
Figura 3. Entrega Intraductal de siRNA fluorescente. Imagem Representante da amostra de tecido fresco, retirado 48 horas após a injecção.
Discussão
Transgênicos e knockout camundongos são ferramentas inestimáveis para estudar o papel in vivo de genes individuais em câncer de mama. No entanto, isso é caro e para gerar estes animais demorado e o knockdown do gene é normalmente ubíquo que, por vezes, nos impede de reconhecer os efeitos específicos de gene em que a glândula mamaria. Portanto, um knockdown alvo seria aliviar problemas de efeitos colaterais não-específicos e toxicidades em outros órgãos.
A injecção intraductal de siRNA aqui apresentada permite o knockdown gene localizado na glândula mamária do rato. É um método rápido para a entrega de drogas específicas e localizada para a glândula mamaria não se limitando a entrega de siRNA. Tal entrega mamária fármaco específico da glândula evita os efeitos secundários e toxicidade não específicos para outros órgãos e permite o estudo de alterações do gene em pontos de tempo específicos durante o desenvolvimento da glândula mamaria e a formação do tumor da mama. Não há nenhuma evidência de SiPartículas de RNA em glândulas não injectados, o fígado ou outros órgãos que fornecem evidências adicionais de que este método apresenta um modo preferido para knockdown gene localizado na glândula mamária. Além disso, as injecções intraductais pode ser repetido semanalmente ou quinzenalmente ao longo de vários meses, para permitir a monitorização de longo prazo de agentes terapêuticos.
Esta técnica abre-se a possibilidade de ensaiar a entrega intraductal de vários reagentes para os ductos mamários de ratinho. Avanços na entrega localizada em modelos bem caracterizados rato deve acelerar a aplicação do não-invasiva, alvo estratégias terapêuticas em seres humanos.
Divulgações
Os autores não têm divulgações financeiras.
Agradecimentos
Os autores gostariam de agradecer a Michael Goldberg para preparar solução siRNA estabilizado e Heather Tobin por sua assistência com os animais. Este estudo foi financiado pelo Departamento de Defesa Innovator Award W81XWH-08-1-0659 para DEI. O treinamento de pós-doutorado de SK foi apoiado pela fundação Susan G Komen (KG101329). Os autores gostariam de agradecer a Kristin Johnson para a preparação do esquema.
Materiais
| Name | Company | Catalog Number | Comments |
| isoflurane | 2-4% | ||
| meloxicam | 5-10 mg/ml | ||
| Evans blue dye | Sigma-Aldrich | E2129-10G | 0.2% in PBS |
| hair removing cream | Veet | Choose sensitive option | |
| stereoscope | Zeiss | Stemi DV4 | |
| micro-dissecting tweezers | Roboz | rs-4976 | With a 0.10 x 0.06 mm tip made of dumostar |
| Hamilton syringe | Hamilton | 7637-01 | |
| 33-gauge needle | Hamilton | 7803-05 | point style 4, 12 degree bevel (standard) |
| siGLO cyclophilin B control siRNA | Dharmacon | D-001610-01-05 |
Referências
- Dooley, W. C., et al. Ductal lavage for detection of cellular atypia in women at high risk for breast cancer. J Natl Cancer Inst. 93, 1624-1632 (2001).
- Jacobs, L., Sukumar, S., Stearns, V. Intraductal therapy for the prevention of breast cancer. Curr Opin Investig Drugs. 11, 646-652 (2011).
- King, B. L., Love, S. M. The intraductal approach to the breast: raison d'etre. Breast Cancer Res. 8, 206 (2006).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Res. 66, 638-645 (2006).
- Stearns, V., et al. Preclinical and clinical evaluation of intraductally administered agents in early breast cancer. Sci Transl Med. 3, 106ra108 (2011).
- Flanagan, M., Love, S., Hwang, E. S. Status of Intraductal Therapy for Ductal Carcinoma in Situ. Curr Breast Cancer Rep. 2, 75-82 (2010).
- Nguyen, D. -. A., Beeman, N., Lewis, M., Schaack, J., Neville, M. C., Ip, M. M., Asch, B. B. . Methods in mammary gland biology and breast cancer research. , 259-270 (2000).
- Behbod, F., et al. An intraductal human-in-mouse transplantation model mimics the subtypes of ductal carcinoma in situ. Breast Cancer Res. 11, R66 (2009).
- Bu, W., Xin, L., Toneff, M., Li, L., Li, Y. Lentivirus vectors for stably introducing genes into mammary epithelial cells in vivo. J Mammary Gland Biol Neoplasia. 14, 401-404 (2009).
- Reddy, J. P., Li, Y. The RCAS-TVA system for introduction of oncogenes into selected somatic mammary epithelial cells in vivo. J Mammary Gland Biol Neoplasia. 14, 405-409 (2009).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. J. Vis. Exp. , e2828 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados