Method Article
Agroinfiltration und PVX Agroinfektion in Kartoffel und Nicotiana benthamiana
In diesem Artikel
Zusammenfassung
Agroinfiltration und PVX-Agroinfektion sind routinemäßige funktionelle Assays für die transiente ektopische Expression von Genen in Pflanzen. Diese Methoden sind effiziente Assays in Effektoromik-Strategien (schnelle Resistenz und Avirulenz-Gen-Entdeckung) und entscheidend für die moderne Forschung in der molekularen Pflanzenpathologie. Sie erfüllen die Nachfrage nach robuster Hochdurchsatz-Funktionsanalyse in Anlagen.
Zusammenfassung
Agroinfiltration und PVX-Agroinfektion sind zwei effiziente transiente Expressions-Assays zur funktionellen Analyse von Kandidatengenen in Pflanzen. Das am häufigsten verwendete Mittel für die Agroinfiltration ist Agrobacterium tumefaciens, ein Erreger vieler Dikotpflanzenarten. Dies impliziert, dass Agroinfiltration auf viele Pflanzenarten angewendet werden kann. Hier stellen wir unsere Protokolle und erwarteten Ergebnisse bei der Anwendung dieser Methoden auf die Kartoffel (Solanum tuberosum), die verwandte wilde Knollen tragende Solanum-Arten (Solanum Abschnitt Petota) und die Modellpflanze Nicotiana benthamiana. Neben der funktionellen Analyse einzelner Gene, wie Resistenz -R) oder Avirulence (Avr) Gene, ist der Agroinfiltrationstest sehr geeignet, um die R-AVR-Wechselwirkungen im Zusammenhang mit spezifischen Wirtspathogen-Wechselwirkungen zu rekapitulieren, indem r- und Avr-Transgene einfach in dieselbe Zelle geliefert werden. Einige Pflanzengenotypen können jedoch unspezifische Abwehrreaktionen auf Agrobacteriumerhöhen, wie wir beispielsweise bei mehreren Kartoffelgenotypen beobachtet haben. Im Vergleich zur Agroinfiltration ist der Nachweis der AVR-Aktivität mit PVX-Agroinfektion empfindlicher, höherer Durchsatz in Funktionsbildschirmen und weniger empfindlich gegenüber unspezifischen Abwehrreaktionen auf Agrobacterium. Es kann jedoch eine unspezifische Abwehr von PVX auftreten, und es besteht die Gefahr, Dassregungen aufgrund einer vireninduzierten extremen Resistenz zu verpassen. Trotz dieser Einschränkungen sind agroinfiltration und PVX Agroinfection unserer Erfahrung nach sowohl geeignete als auch komplementäre Assays, die gleichzeitig verwendet werden können, um die Ergebnisse des jeweils anderen zu bestätigen.
Einleitung
Effectoromics, ein hochdurchsatzfähiger funktioneller Genomik-Ansatz, hat sich vor kurzem als ein leistungsfähiges Werkzeug zur Identifizierung von Resistenzen (R) Genen in Kulturpflanzen und übereinstimmenden Avirulence -Avr) Genen von Krankheitserregern1-4herauskristallisiert. Im Gegensatz zur zeitaufwändigeren stabilen Transformation mit R-Genen basiert die Effektoromik-Strategie auf transienten Assays von Pathogengensequenzen.
Seit der Genomik-Ära wurden Genome von Pflanzenpathogenen weit erforscht. Zum Beispiel für Oomyceten, die die verheerendsten Pflanzenpathogene enthalten, wurden große Sammlungen von Sequenzen erzeugt und auf Gene analysiert, die eine Rolle bei der Interaktion mit der Pflanze5-10spielen. Eine Klasse von pathogenen Proteinen stellt Effektoren dar, die die Struktur und Funktion der Wirtszellen manipulieren, entweder um eine Infektion zu erleichtern (Virulenzfaktoren) oder um Abwehrreaktionen (Avirulenzfaktoren)auszulösen 11-13. Die Expression von Avr-Genen in Pflanzenzellen, die R-Gene enthalten, führt in der Regel zur überempfindlichen Zelltodreaktion (HR)14,15. Bei der Plantaexpression von R- und Avr-Genen kann mit transienten Expressionssystemen wie Agrobacterium tumefaciens -basierende transiente Transformation (Agroinfiltration)16erreicht werden. Diese transiente Transformation kann auch in Kombination mit viralen Expressionssystemen (Agroinfektion)17,18angewendet werden.
Für die Agroinfiltration ist das am häufigsten verwendete Mittel A . tumefaciens, ein weites Wirtsland von Dikotpflanzen. A . tumefaciens enthält ein tumorinduzierendes (Ti) Plasmid. Transfer-DNA (T-DNA) aus einem Ti-Plasmid wird in die Pflanzenzellen transloziert, nachdem die Virulenzmaschinerie des Bakteriums aktiviert wurde. Dies kann in verwundeten Pflanzenzellen ausgelöst werden, durch die freigesetzten niedermolekularen Phenolverbindungen und Monosaccharaide in einer leicht sauren Umgebung19. Das Virulenz-Gen wird nach der Infiltration von Agrobacteriumsuspensionen in Blattplatten aktiviert, die von großen Venen definiert werden. Dann werden Pflanzenzellen in den Blattpaneelen transformiert und exprimieren die Transgene, die im T-DNA-Bereich enthalten sind.
Die Agroinfektion basiert auf gewickelten Agrobacterium, das die Translokation eines Virus in Pflanzenzellen vermittelt. Das Virus breitet sich dann weiter auf benachbarte Pflanzengewebe aus, in Abwesenheit von Agrobacterium. Für die Agroinfektion können mehrere Pflanzenviren verwendet werden. RNA-Viren sind ideale Vektoren für die Genexpression, da sie sich in infizierten Pflanzen zu sehr hohen Konzentrationen vermehren können. Unter den pflanzlichen RNA-Viren ist Potato Virus X (PVX) weit verbreitet für Effektoromik-Bildschirme. Um funktionelle Tests für ein eingefügtes Gen zu erleichtern, wurden binäre Vektoren, die das PVX-Genom enthalten, flankiert vom Cauliflower-Mosaikvirus 35S-Promotor und dem Nopaline-Synthase-Terminator, in die T-DNA von A. tumefaciens20geklont. Nachdem die T-DNA in Pflanzenzellen übertragen wurde, wird das in der T-DNA enthaltene PVX-Genom vom 35S-Promotor transkribiert. Dann verbreiten sich Viruspartikel systemisch in den infizierten Pflanzen, was zur Expression des eingefügten Gens führt. Diese Methode, die sowohl auf Agrobacterium als auch auf PVX basiert, wird als PVX-Agroinfektion bezeichnet.
Hier zeigen wir Beispiele für die Agroinfiltration und PVX-Agroinfektionstests. Als Wirtspflanzen verwenden wir Kartoffelkeimplasma (Solanum-Sektion Petota), für das Effektoromik-Ansätze Pionierarbeit geleistet und sich als erfolgreich erwiesen haben3,4. Wir verwenden auch Nicotiana benthamiana, die als Modellpflanze in Solanaceous Pflanzen bekannt ist14,21,22.
Protokoll
1. Pflanzenanbau- und Prüfbedingungen
- Wachsen und pflegen Pflanzen in kontrollierten Gewächshäusern oder Klimakammern im Temperaturbereich von 18-22 °C und unter natürlichem Lichtregime oder mit einem Tag/Nacht-Regime von 16 Stunden/8 Stunden. Entfernen Sie achselige Zweige, um die Pflanzen handhabbarer zu machen.
- Für Kartoffeln In-vitro-Pflanzen in sterilen Kunststoffgläsern mit Murashige-Skoog (MS)-Medium (20 g/L Saccharose, 5 g/L MS-Salze mit Vitaminen, 8 g/L Agar, pH 5,8) unter kontrollierten Bedingungen in Klimakammern bei 18 °C mit einem Tag/Nacht-Regime von 16 Stunden/8 Stunden für zwei Wochen aufbewahren und dann in Töpfe mit sterilisiertem Boden in geregelten Gewächshäusern übertragen.
2. Agroinfiltration
- Pflanzenmaterial:
Für Nicotiana benthamiana,verwenden Sie etwa 4-5 Wochen alte Samenpflanzen. Für Kartoffeln, verwenden Sie etwa 4-5 Wochen alte Transplantationen von in vitro. Wählen Sie junge, gesunde und voll entwickelte Blätter für Infiltrationen. -
Agrobacterium-Kultur:
- Bereiten Sie das YEB-Medium im Voraus vor (Tabelle 1). Füllen Sie die 50 ml-Röhrchen mit 10 ml YEB-Medium, ergänzt mit 1 l Acetosyringon (200 mM), 100 l MES-Puffer (2-(N-Morpholino)-Ethansulfonsäure, 1 M) und den entsprechenden Antibiotika. Pipette 20 l Glycerinbestand der gewünschten Stämme (Tabelle 2) (enthält das Gen von Interesse) in die YEB. Initiieren Sie Kulturen für alle Agrobacterium-Stämme in diesem Test zur gleichen Zeit. Inkubieren Sie Zellen durch Schütteln für 1-2 Tage bei 28 °C und 200 Rpm auf eine OD600 von etwa 1,0.
- Erntezellen durch Zentrifugation bei 3.000 x g für 10 min. Den Überstand abgießen und das Pellet in frisch zubereitetem MMA-Medium (Tabelle 3) auf eine OD600 von 0,3 aussetzen. Wirbelzellen, um sie wieder zu suspendieren. Für die Koinfiltration von zwei Bakterienstämmen, mischen Sie die Kultur in einem 1:1-Verhältnis.
- Lassen Sie die Kultur auf der Bank bei Raumtemperatur für 1-6 Stunden vor infiltrationen. In der Zwischenzeit kennzeichnen Sie die zu infiltrierenden Pflanzen und das Datum des Experiments.
- Infiltrationen:
Verwenden Sie eine 1 ml nadellose Spritze, um die Agrobacterium Suspensionen zu infiltrieren. Sorgfältig und langsam injizieren Blattplatten mit den Suspensionen aus der Spritze (aus Gesundheits- und Sicherheitsgründen sollte während dieses Prozesses Augenschutz getragen werden). Infiltrieren Sie mindestens drei Pflanzen pro Sorte. Verwenden Sie drei Blätter pro Pflanze, um als Triplicate zu dienen.
Hinweis: Normalerweise könnten 1 ml Agrobacterium Suspension für 3 Pflanzen von N. benthamianaausreichen. Für Kartoffeln ist mehr Suspension erforderlich, weil die Blätter der Solanum-Arten schwieriger zu infiltrieren sind. Erforderliche Mengen an Suspensionen hängen von der Solanum-Art ab. Vermeiden Sie Kreuzkontaminationen, indem Sie Handschuhe oder Sterilisationshandschuhe mit Ethanol zwischen infiltrationen wechseln und die Pflanzen erst am Tag nach der Impfung wässern. - Scoring:
Score makroskopische Reaktionen etwa 3 Tage nach der Infiltration, wenn der Zelltod Phänotyp klar ist (Abbildung 1). Wenn der Zelltod-Phänotyp quantitativ ist, verwenden Sie die angegebenen Kriterien (Abbildung 2). Kurz gesagt, die Skalen für die makroskopische Bewertung des Zelltodes hängen hauptsächlich von den Zelltodprozentsätzen des infiltrierten Bereichs ab. Der Prozentuale Anteil des Zelltodes wird auf einer Skala von 0% (keine Symptome) bis 100% (konfluenter Zelltod) dargestellt. Die Zwischenreaktionen reichen von schwachen Reaktionen wie Chlorose bis hin zu einem anstiegen Zelltod. Auf Wunsch kann die makroskopische Bewertung auch mit modernen Foto-Imaging-Geräten quantitativ bewertet werden.
3. PVX Agroinfektion
- Pflanzenmaterial:
Für N. benthamianaverwenden Sie etwa 2-3 Wochen alte Samenpflanzen. Für Kartoffeln, verwenden Sie etwa 2-3 Wochen alte Transplantationen von in vitro. Für groß angelegte Tests verwenden Sie etwas ältere (4-5 Wochen) Pflanzen, da diese Pflanzen mehr und größere Blätter haben, um eine höhere Anzahl von Agrobacterium-Impfstellen aufzunehmen. -
Agrobacterium-Kultur:
- Bereiten Sie das YEB-Medium im Voraus vor. Füllen Sie die 10 ml Tuben mit 3 ml YEB, ergänzt mit den entsprechenden Antibiotika. Pipette 20 l Glycerinbestand der gewünschten Stämme (Tabelle 2) (enthält das Gen von Interesse) in die YEB. Initiieren Sie Kulturen für alle Agrobacterium-Stämme in diesem Test zur gleichen Zeit. Inkubieren Sie Zellen durch Schütteln für 1-2 Tage bei 28 °C und 200 Rpm auf eine OD600 von etwa 1,0.
- Pipette ca. 300 l jedes Agrobacterium-Stamms und verteilen Sie sie auf LB-Festagar-Medium-Platten, die mit den entsprechenden Antibiotika ergänzt werden, und brüten Zellen bei 28 °C für 1-2 Tage.
- Infektionen:
Verwenden Sie einen Spachtel, um die Agrobacterium-Kultur in der Platte zu sammeln. Tauchen Sie einen hölzernen Zahnstocher in der Agrobacterium-Kultur auf den Spachtel und durchbohren Sie die Blätter, um eine große Menge an Bakterien zu impfen. Ungeimpfen Sie mindestens drei Pflanzen für jede Sorte. Verwenden Sie drei Blätter pro Pflanze, um als Triplicate zu dienen. Erstellen Sie in jedem Blatt mehrere Impfstellen für jeden Stamm. - Scoring:
Score makroskopische Antworten etwa zwei Wochen nach der Impfung (Abbildung 3). Zeichnen Sie bei Bildschirmen mit hohem Durchsatz die qualitativen Antworten (ja/nein) für jeden Impfpunkt auf. Berechnen Sie dann den Prozentsatz der antwortenden Sites, und vergleichen Sie sie mit Steuerelementen.
Ergebnisse
Abbildung 1 zeigt ein repräsentatives Experiment der Agroinfiltration mit 7 verschiedenen Effektoren (E1-E7) in Kartoffeln und N. benthamiana. Der Zelltod tritt in den infiltrierten Blattplatten etwa 3 Tage nach der Infiltration auf. Das Ausmaß des Zelltod-Phänotyps muss mit den Kontrollen verglichen werden. Als Positivkontrolle wurde eine Mischung aus dem Agrobacteriumstamm AGL1(pVirG)23 mit pBINplus-R3a und pK7WG2-AVR3a als Positivkontrolle24,25verwendet, während AGL1(pVirG) als Negativkontrolle verwendet wurde. Die Abbildungen 1A und 1B zeigen gute Beispiele für die Agroinfiltration im Kartoffelgenotyp MaR8 (Mastenbroek R8)26 bzw. N. benthamiana, die für die Agroinfiltration sehr gut geeignet sind. Es gibt einen konfluenten Zelltod im Blattpanel, das mit positiver Kontrolle geprägt ist, während keine Zelltodreaktion mit Negativkontrolle oder pBINplus-R3a auftritt. In MaR8 induzieren zwei Effektoren AVR3a (E2) und AVR4 (E3) einen Zelltod, während die anderen Effektoren (E1 und E4-E7) dies nicht tun. In N. benthamiana induzieren keine der getesteten Effektoren eine Zelltodesreaktion. Die Abbildungen 1C und 1D zeigen Beispiele für die Agroinfiltration in der Wildkartoffel Solanum berthaultii 483-1 und Solanum rechei 210-5, die für die Agroinfiltrationstechnik nicht gut geeignet sind. In S. berthaultii 483-1 zeigt das Blattgewebe eine unspezifische Nekrose zu Negativen kontrollen sowie zu allen getesteten Effektoren. In S. rechei 210-5 zeigen infiltrierte Blattpaneele eine sehr schwache Zelltodreaktion auf eine positive Kontrolle.
Abbildung 2 zeigt eine Reihe von Bewertungsskalen, die verwendet werden können, um die Reaktion auf agrofiltriertes Agrobacteriumzu quantifizieren. Prozentsätze des Zelltodes werden auf einer Skala von 0-100% dargestellt. Die beobachteten Phänotypen reichen von makroskopisch nicht sichtbaren Symptomen (0%), über eine Reihe von Zwischenreaktionen, die Chlorose und steigende Zellsterblichkeitsraten zeigen, bis hin zum konfluenten Zelltod (100%).
Abbildung 3 zeigt ein repräsentatives Experiment nach der PVX-Agroinfektion in Kartoffeln. Normalerweise kann die Ausweitung des Zelltodes an den Standorten etwa zwei Wochen nach der Zahnpickungsimpfung gefunden werden. Wie in beiden Abbildungen dargestellt, ist der expandierende Zelltod an den Stellen vorhanden, die mit pGR106-CRN2 (positive Kontrolle mit dem Effektor crinkler Crn2) geimpft wurden, einem allgemeinen Zelltod, der ein Gen von P. infestans27darstellt. Abgesehen von einer geringfügigen Reaktion auf Verwundungen wird an den Stellen, die mit dem pGR106-leer (negativer Kontrolle) geimpft wurden, kein expandierender Zelltod festgestellt. In Abbildung 3A, die den Kartoffelgenotyp MaR3 (Mastenbroek R3) darstellt, haben zwei pGR106-Effektoren (E1 und E2) keinen Zelltod induziert. In Abbildung 3Bwird ein positives Ergebnis des Effektor-Screenings im wilden Solanum huancabambense 354-1 dargestellt; Die Zelltodreaktion wurde bei zwei pGR106-Effektoren (E1-E3, die Elicitinen darstellen)beobachtet 28.

Abbildung 1. Beispiele für Agroinfiltration in Kartoffeln und N. benthamiana. Pflanzen einschließlich (A) kartoffelgenotyp MaR8 (Mastenbroek R8), (B) N. benthamiana, ( C) Solanum berthaultii 483-1 und (D) Solanum rechei 210-5 wurden mit einer Mischung des Agrobacterium-Stamms AGL1(pVirG) 23 mit pBINplus-R3a und pK7WG2-AVR3a (Positivkontrolle), AGL1(pvirG) (Negativkontrolle), pBINplus-R3a, und sieben Effektoren (E1-E7). Klicken Sie hier, um ein größeres Bild anzuzeigen.
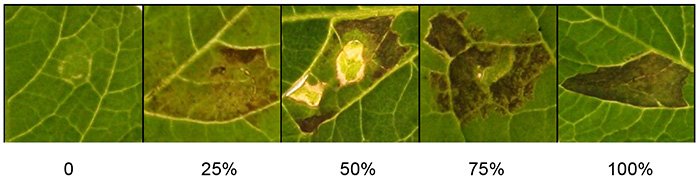
Abbildung 2. Quantifizierung der Agroinfiltrationsreaktionen. Das Foto zeigt repräsentative Bewertungsskalen für den Zelltod, die von 0% (keine Symptome) bis 100% (konfluenter Zelltod) reichen. Die Zwischenreaktionen reichen von schwachen Reaktionen wie Chlorose bis hin zu einem anstiegen Zelltod. Klicken Sie hier, um ein größeres Bild anzuzeigen.
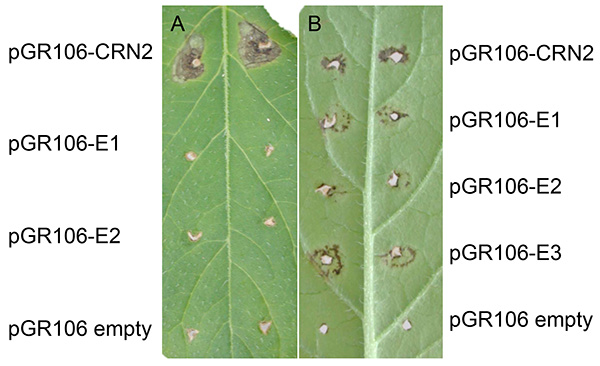
Abbildung 3. Beispiele für PVX-Agroinfektion in Kartoffeln. Kartoffelgenotyp MaR3 (Mastenbroek R3) (A) und Solanum huancabambense 354-1 (B) Zahnpickel geimpft mit pGR106-CRN2 (Positivkontrolle), pGR106-leer (Negativkontrolle) bzw. pGR106-E1-2 (Effektoren) bzw. pGR106-E1-E3. Klicken Sie hier, um ein größeres Bild anzuzeigen.
Tabelle 1. YEB mittel
| 1 L | destilliert H2O |
| 5 g | Saccharose |
| 5 g | Rindfleischextrakt |
| 5 g | bakteriologischer Pepton |
| 1 g | Hefeextrakt |
| 2 ml | MgSO4 (1 M) |
Tabelle 2. Vektoren und Stämme für die Agroinfiltration und PVX-Agroinfektion. Es können mehrere binäre Vektoren verwendet werden. Vektoren in der Liste unten erlauben eine hohe Expression der Kandidatengene und haben gut in unseren Händen funktioniert. Wir bevorzugen die Verwendung des Agrobacterium-Stamms GV3101(pMP90)29 in N. benthamiana und finden AGL130 mit dem Helfer-Plasmid pVirG (pBBR1MCS-5.virGN54D)23 besser geeignet in Kartoffel31. Weitere Stämme wurden in anderen Gruppen auf verschiedenen Modellpflanzen analysiert, einschließlich N. benthamiana, aber nicht in Kartoffel32.
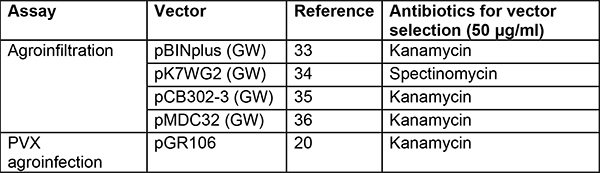
GW: Gateway Version36
Tabelle 3. MMA-Medium.
Stellen Sie den pH-Wert auf 5,6 ein.
Diskussion
Transiente Assays wie Agroinfiltration und Agroinfektion sind effiziente Methoden, die für die moderne molekulare Pflanzenpathologieforschung von entscheidender Bedeutung sind. Trotz einiger Einschränkungen erfüllen diese Methoden die Nachfrage nach einer effizienten und robusten Hochdurchsatz-Funktionsanalyse in Anlagen.
Das Agroinfiltrationssystem ist ein weit verbreiteter funktioneller Assay bei einer Reihe von Pflanzenarten. Die Agroinfiltration erleichtert die Abgabe mehrerer Transgene in dieselbe Zelle mit gleichzeitiger Expression interagierender Proteine. Dies ist vorteilhaft für die Rekapitulation von R-AVR-Beziehungen, indem Agrobacterium-Stämme koinfiltriert werden, die Avr-Gene mit Stämmen ausdrücken, die die passenden R-Gene ausdrücken. Auch für bekannte R-AVR-Paare können solche Coinfiltrationen als Positivsteuerungen verwendet werden. Die Einbeziehung solcher Kontrollen ist wichtig, da bei einigen Pflanzengenotypen die Transformationseffizienz unter dem Schwellenwert liegen kann, um Reaktionen zu erkennen. Einschließlich Negativkontrollen, z. B. ein Agrobacterium-Stamm, der einen Vektor ohne Geneinsatz enthält, ist auch wichtig, um festzustellen, ob ein bestimmter Pflanzengenotyp unspezifische Abwehrreaktionen auf das Agrobacteriumauslöst. Diese Funktion tritt bei einer bestimmten Häufigkeit im Kartoffelkeimplasma auf, und nicht alle Solanum-Arten sind für dieses Agrobacterium-basierteExpressionssystem gut geeignet. Im Allgemeinen funktioniert der Agroinfiltrationstest sehr gut in N. benthamiana und den meisten Kartoffelgenotypen. Neben der Effektoromik gibt es verschiedene weitere Anwendungsmöglichkeiten für die Agroinfiltrationstechnik, wie die Produktion von Proteinen aus Transgenen und die Proteinlokalisierung in Pflanzenzellen durch konfokale Mikroskopie.
PVX-Agroinfektion ist ein hochempfindliches Screening-System und eignet sich in der Regel besser für Hochdurchsatz-Screenings. Da das Agrobacterium nur noch lokal vorhanden ist, sind unspezifische Reaktionen auf dieses Bakterium jetzt nicht sehr beunruhigend, da das PVX-Virus die weitere Ausbreitung des Transgens übernimmt. Pflanzen können jedoch resistent gegen PVX sein oder extreme Resistenzreaktionen (ER) aufführen, und in diesem Fall ist die Agroinfektionsmethode nicht geeignet. Eine weitere Einschränkung der PVX-Agroinfektionsmethode ist die Insert-Größe des gens von Interesse. Beobachtete Phänotypen von Reaktionen können von einer intensiven schwarzen Nekrose, die die Wunde umgibt, bis hin zu schwacher Nekrose in der Nähe des Impfflecks variieren. Sowohl bei den Arten N. benthamiana als auch Solanum wird die PVX-Agroinfektion als empfindlicher als die Agroinfiltration anerkannt.
Unter Berücksichtigung der Berücksichtigung des genetischen Hintergrunds der verschiedenen getesteten Pflanzengenotypen können einige Einschränkungen (siehe oben) haben wir in der Regel ähnliche Schlussfolgerungen durch PVX-Agroinfektion und Agroinfiltration. Diese Ergebnisse sind auch vergleichbar mit anderen Tests, wie Proteininfiltrationen29 und ELISA3. Unter Berücksichtigung der Vorteile und Einschränkungen beider Systeme empfehlen wir, beide Methoden zu verwenden, um sich gegenseitig zu ergänzen oder unabhängige Ergebnisse zu bestätigen.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Die Arbeit wird teilweise durch den Wageningen University Fund (WUF), das China Scholarship Council Program for Graduate Students und ein NWO-VIDI-Stipendium 12378 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Beef extract | Sigma-Aldrich | B4888 | |
| Bacteriological peptone | Oxoid | LP0037 | |
| Yeast extract | Oxoid | LP0021 | |
| MgSO4 | Sigma-Aldrich | 208094 | |
| MS salts (without vitamins) | Duchefa Biochemie | M0221 | |
| MES | Duchefa Biochemie | M1503 | |
| LB broth powder | Sigma-Aldrich | L3022 | |
| Acetosyringone | Sigma-Aldrich | D134406 | |
| Syringe (1 ml) | BD Plastipak | 300013 | |
| Incubator | Infors HT | Multitron II | |
| Centrifuge | Heraeus | Multifuge 3S-R | |
| Spectrophotometer | Eppendorf | Biophotometer 6131 |
Referenzen
- Vleeshouwers, V. G. A. A., et al. Understanding and exploiting late blight resistance in the age of effectors. Ann. Rev. Phytopathol. 49, 507-531 (2011).
- Ellis, J. G., Rafiqi, M., Gan, P., Chakrabarti, A., Dodds, P. N. Recent progress in discovery and functional analysis of effector proteins of fungal and oomycete plant pathogens. Curr. Opin. Plant Biol. 12, 399-405 (2009).
- Vleeshouwers, V. G. A. A., et al. Effector genomics accelerates discovery and functional profiling of potato disease resistance and Phytophthora infestans avirulence genes. Plos One. 3, 1-10 (2008).
- Oh, S. K., et al. In planta expression screens of Phytophthora infestans RXLR effectors reveal diverse phenotypes, including activation of the Solanum bulbocastanum disease resistance protein Rpi-blb2. Plant Cell. 21, 2928-2947 (2009).
- Tyler, B. M., et al. Phytophthora genome sequences uncover evolutionary origins and mechanisms of pathogenesis. Science. 313, 1261-1266 (2006).
- Haas, B. J., et al. Genome sequence and analysis of the Irish potato famine pathogen Phytophthora infestans. Nature. 461, 393-398 (2009).
- Levesque, C. A., et al. Genome sequence of the necrotrophic plant pathogen Pythium ultimum reveals original pathogenicity mechanisms and effector repertoire. Genome Biol. 11, 1-22 (2010).
- Lamour, K. H., Win, J., Kamoun, S. Oomycete genomics: new insights and future directions. FEMS Microbiol. Lett. 274, 1-8 (2007).
- Stassen, J. H. M., et al. Effector identification in the lettuce downy mildew Bremia lactucae by massively parallel transcriptome sequencing. Mol. Plant Pathol. 13, 719-731 (2012).
- Kemen, E., et al. Gene gain and loss during evolution of obligate parasitism in the white rust pathogen of Arabidopsis thaliana. PLoS Biol. 9, 1-21 (2011).
- Win, J., et al. Effector biology of plant-associated organisms: concepts and perspectives. , Cold Spring Harbor. 1-13 (2012).
- Hogenhout, S. A., van der Hoorn, R. A. L., Terauchi, R., Kamoun, S. Emerging concepts in effector biology of plant-associated organisms. Mol. Plant Microbe Interact. 22, 115-122 (2009).
- Kamoun, S. A catalogue of the effector secretome of plant pathogenic oomycetes. Ann. Rev. Phytopathol. 44, 41-60 (2006).
- van der Hoorn, R. A. L., Laurent, F., Roth, R., De Wit, P. J. G. M. Agroinfiltration is a versatile tool that facilitates comparative analyses of Avr9/Cf-9-induced and Avr4/Cf-4-induced necrosis. Mol. Plant Microbe Interact. 13, 439-446 (2000).
- Dangl, J. L., Jones, J. D. G. Plant pathogens and integrated defence responses to infection. Nature. 411, 826-833 (2001).
- Kapila, J., de Rycke, R., van Montagu, M., Angenon, G. An Agrobacterium-mediated transient gene expression system for intact leaves. Plant Sci. 122, 101-108 (1997).
- Kanneganti, T. D., Huitema, E., Kamoun, S. In planta expression of oomycete and fungal genes. Methods Mol. Biol. 354, 35-43 (2007).
- Vleeshouwers, V. G. G. A., Rietman, H. In planta expression systems. Oomycete Genetics and Genomics. Diversity, Interactions, and Research Tools. Lamour, K., Kamoun, S. 23, 455-475 (2009).
- Peng, W. T., Lee, Y. W., Nester, E. W. The phenolic recognition profiles of the Agrobacterium tumefaciens VirA protein are broadened by a high level of the sugar binding protein ChvE. J. Bacteriol. 180, 5632-5638 (1998).
- Lu, R., et al. High throughput virus-induced gene silencing implicates heat shock protein 90 in plant disease resistance. EMBO J. 22, 5690-5699 (2003).
- Ma, L., Lukasik, E., Gawehns, F., Takken, F. L. W. The use of agroinfiltration for transient expression of plant resistance and fungal effector proteins in Nicotiana benthamiana leaves. Methods Mol. Biol. 835, 61-74 (2012).
- Bhaskar, P. B., Venkateshwaran, M., Wu, L., Ané, J. M., Jiang, J. Agrobacterium-mediated transient gene expression and silencing: A rapid tool for functional gene assay in potato. Plos One. 4, 1-8 (2009).
- van der Fits, L., Deakin, E. A., Hoge, J. H. C., Memelink, J. The ternary transformation system: constitutive virG on a compatible plasmid dramatically increases Agrobacterium-mediated plant transformation. Plant Mol. Biol. 43, 495-502 (2000).
- Huang, S., et al. Comparative genomics enabled the isolation of the R3a late blight resistance gene in potato. Plant J. 42, 251-261 (2005).
- Armstrong, M. R., et al. An ancestral oomycete locus contains late blight avirulence gene Avr3a, encoding a protein that is recognized in the host cytoplasm. Proc. Natl. Acad. Sci. U.S.A. 102, 7766-7771 (2005).
- Kim, H. J., et al. Broad spectrum late blight resistance in potato differential set plants MaR8 and MaR9 is conferred by multiple stacked R genes. Theor. Appl. Genet. 124, 923-935 (2012).
- Torto, T. A., et al. EST mining and functional expression assays identify extracellular effector proteins from the plant pathogen Phytophthora. Genome Res. 13, 1675-1685 (2003).
- Vleeshouwers, V. G. A. A., et al. Agroinfection-based high-throughput screening reveals specific recognition of INF elicitins in Solanum. Mol. Plant Pathol. 7, 499-510 (2006).
- Koncz, C., Schell, J. The promoter of TL-DNA gene 5 controls the tissue-specific expression of chimeric genes carried by a novel type of agrobacterium binary. Mol. Gen. Genet. 204, 383-396 (1986).
- Lazo, G. R., Stein, P. A., Ludwig, R. A. A DNA transformation-competent Arabidopsis genomic library in Agrobacterium. Bio-Technol. 9, 963-967 (1991).
- Rietman, H. Putting the Phytophthora infestans genome sequence at work; multiple novel avirulence and potato resistance gene candidates revealed [PhD thesis]. , Wageningen University. (2011).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnol. J. 3, 259-273 (2005).
- van engelen, F. A., et al. pBINPLUS - an improved plant transformation vector based on pBIN19. Transgenic Res. 4, 288-290 (1995).
- Karimi, M., Inze, D., Depicker, A. GATEWAYTM vectors for Agrobacterium-mediated plant transformation. Trends Plant Sci. 7, 193-195 (2002).
- Xiang, C. B., Han, P., Lutziger, I., Wang, K., Oliver, D. J. A mini binary vector series for plant transformation. Plant Mol. Biol. 40, 711-717 (1999).
- Curtis, M. D., Grossniklaus, U. A gateway cloning vector set for high-throughput functional analysis of genes in planta. Plant Physiol. 133, 462-469 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten