Method Article
Agroinfiltration et PVX Agroinfection dans la pomme de terre et Nicotiana benthamiana
Dans cet article
Résumé
L’agroinfiltration et l’agroinfection PVX sont des tests fonctionnels de routine pour l’expression ectopique transitoire des gènes dans les plantes. Ces méthodes sont des tests efficaces dans les stratégies effectoromiques (résistance rapide et découverte de gènes avirulence) et cruciales pour la recherche moderne en pathologie moléculaire des plantes. Ils répondent à la demande d’analyses fonctionnelles robustes à haut débit dans les usines.
Résumé
L’agroinfiltration et l’agroinfection PVX sont deux tests d’expression transitoire efficaces pour l’analyse fonctionnelle des gènes candidats dans les plantes. L’agent le plus couramment utilisé pour l’agroinfiltration est Agrobacterium tumefaciens, un agent pathogène de nombreuses espèces de plantes dicotylédones. Cela implique que l’agroinfiltration peut être appliquée à de nombreuses espèces végétales. Ici, nous présentons nos protocoles et les résultats attendus lors de l’application de ces méthodes à la pomme de terre(Solanum tuberosum),ses espèces apparentées de Solanum contenant des tubercules sauvages(Solanum section Petota)et la plante modèle Nicotiana benthamiana. En plus de l’analyse fonctionnelle de gènes uniques, tels que les gènes de résistance(R)ou d’avirulence(Avr),le test d’agroinfiltration est très approprié pour récapituler les interactions R-AVR associées à des interactions pathogènes hôtes spécifiques en délivrant simplement des transgènes R et Avr dans la même cellule. Cependant, certains génotypes végétaux peuvent susciter des réponses de défense non spécifiques à Agrobacterium, comme nous l’avons observé par exemple pour plusieurs génotypes de pommes de terre. Par rapport à l’agroinfiltration, la détection de l’activité AVR avec l’agroinfection PVX est plus sensible, plus haut débit dans les écrans fonctionnels et moins sensible aux réponses de défense non spécifiques à Agrobacterium. Cependant, une défense non spécifique contre le PVX peut se produire et il existe un risque de manquer des réponses en raison d’une résistance extrême induite par le virus. Malgré ces limites, d’après notre expérience, l’agroinfiltration et l’agroinfection PVX sont des tests appropriés et complémentaires qui peuvent être utilisés simultanément pour confirmer les résultats de l’autre.
Introduction
L’effectoromique, une approche génomique fonctionnelle à haut débit, est récemment apparue comme un outil puissant pour identifier les gènes de résistance(R)dans les plantes cultivées et les gènes d’avirulence(Avr)correspondants des agents pathogènes1-4. Contrairement à la transformation stable plus longue avec les gènes R, la stratégie effectoromique est basée sur des tests transitoires de séquences de gènes pathogènes.
Depuis l’ère de la génomique, les génomes des phytopathogènes ont été largement explorés. Par exemple, pour les oomycètes, qui comprennent les agents pathogènes des plantes les plus dévastateurs, de grandes collections de séquences ont été générées et analysées pour les gènes qui jouent un rôle lors de l’interaction avec la plante5-10. Une classe de protéines pathogènes représente les effecteurs, qui manipulent la structure et la fonction de la cellule hôte soit pour faciliter l’infection (facteurs de virulence), soit pour déclencher des réponses de défense (facteurs d’avirulence)11-13. L’expression des gènes Avr dans les cellules végétales contenant des gènes R entraîne généralement la réponse hypersensible à la mort cellulaire (HR)14,15. Dans les plantes, l’expression des gènes R et Avr peut être accomplie en utilisant des systèmes d’expression transitoire tels qu’Agrobacterium tumefaciens -transformation transitoire basée (agroinfiltration)16. Cette transformation transitoire peut également être appliquée en combinaison avec des systèmes d’expression virale (agroinfection)17,18.
Pour l’agroinfiltration, l’agent le plus couramment utilisé est A . tumefaciens, un agent pathogène de large gamme d’hôtes des plantes dicotylédones. A . tumefaciens contient un plasmide induisant une tumeur (Ti). L’ADN de transfert (ADN-T) d’un plasmide Ti se déplacera dans les cellules végétales après l’activation de la machinerie de virulence de la bactérie. Ceci peut être déclenché dans les cellules végétales blessées, par les composés phénoliques de faible poids moléculaire libérés et les monosaccharaides dans un environnement légèrement acide19. Le gène de virulence est activé après l’infiltration des suspensions d’Agrobacterium dans les panneaux foliaires définis par les principales nervures. Ensuite, les cellules végétales dans les panneaux foliaires seront transformées et exprimeront le ou les transgènes contenus dans la région de l’ADN-T.
L’agroinfection est basée sur Agrobacteriuminoculée par plaie, qui négocie la translocation d’un virus vers les cellules végétales. Le virus se propage ensuite aux tissus végétaux adjacents, en l’absence d’Agrobacterium. Pour l’agroinfection, plusieurs phytovirus peuvent être utilisés. Les virus à ARN sont des vecteurs idéaux pour l’expression des gènes car ils peuvent se multiplier à des niveaux très élevés dans les plantes infectées. Parmi les virus à ARN des plantes, le virus X de la pomme de terre (PVX) est largement utilisé pour les écrans effectoromiques. Pour faciliter les tests fonctionnels d’un gène inséré, des vecteurs binaires contenant le génome PVX flanqué du promoteur du virus de la mosaïque du chou-fleur 35S et du terminateur de la nopaline synthase, ont été clonés dans l’ADN-T de A. tumefaciens20. Une fois l’ADN-T transféré dans les cellules végétales, le génome PVX contenu dans l’ADN-T est transcrit à partir du promoteur 35S. Ensuite, les particules virales se propagent systématiquement dans les plantes infectées, entraînant l’expression du gène inséré. Cette méthode basée à la fois sur Agrobacterium et PVX est appelée agroinfection PVX.
Nous montrons ici des exemples pour les tests d’agroinfiltration et d’agroinfection PVX. En tant que plantes hôtes, nous utilisons du matériel génétique de pomme de terre (Solanum section Petota), pour lequel les approches effectoromiques ont été lancées et ont fait leurs preuves3,4. Nous utilisons également Nicotiana benthamiana, qui est réputée comme plante modèle dans les plantes solanacées 14,21,22.
Protocole
1. Conditions de croissance et d’essai des plantes
- Cultiver et entretenir les plantes dans des serres ou des chambres climatiques contrôlées dans la plage de températures de 18 à 22 °C et sous régime de lumière naturelle ou avec un régime jour/nuit de 16 h/8 h. Enlevez les branches axillaires afin de rendre les plantes plus gérables.
- Pour la pomme de terre, maintenir in vitro les plantules dans des bocaux en plastique stérile contenant du milieu Murashige-Skoog (MS) (20 g/L de saccharose, 5 g/L de sels ms contenant des vitamines, gélose de 8 g/L, pH 5,8) dans des conditions contrôlées dans des chambres climatiques à 18 °C avec un régime jour/nuit de 16 h/8 h pendant deux semaines, puis les transférer dans des pots de sol stérilisé dans des compartiments de serre réglementés.
2. Agroinfiltration
- Matériel végétal:
Pour Nicotiana benthamiana, utilisez environ 4-5 semaines de plantes cultivées en graines. Pour la pomme de terre, utilisez environ 4-5 semaines de greffes in vitro. Choisissez des feuilles jeunes, saines et pleinement développées pour les infiltrations. -
Culture d’Agrobacterium:
- Préparer le milieu YEB à l’avance (tableau 1). Remplissez les tubes de 50 ml avec un milieu YEB de 10 ml complété par 1 μl d’acétosyringone (200 mM), 100 μl de tampon MES (2-(N-morpholino)-éthane sulfonique acide, 1 M) et les antibiotiques appropriés. Pipetter 20 μl de glycérol stock des souches désirées(tableau 2)(contenant le gène d’intérêt) dans le YEB. Initier des cultures pour toutes les souches d’Agrobacterium dans ce test en même temps. Incuber les cellules en secouant pendant 1-2 jours à 28 °C et 200 rpm à une DO600 d’environ 1,0.
- Prélever les cellules par centrifugation à 3 000 x g pendant 10 min. Versez le surnageant et ressuscitez la pastille dans un milieu MMA fraîchement fabriqué(tableau 3)à une DO600 de 0,3. Vortex doucement cellules pour les ressusciter. Pour la coinfiltration de deux souches bactériennes, mélanger la culture dans un rapport de 1:1.
- Laissez la culture sur le banc à température ambiante pendant 1-6 heures avant les infiltrations. En attendant, étiquetez les plantes à infiltrer et la date de l’expérience.
- Infiltrations :
Utilisez une seringue sans aiguille de 1 ml pour infiltrer les suspensions d’Agrobacterium. Injectez soigneusement et lentement des panneaux de feuilles avec les suspensions de la seringue (pour des raisons de santé et de sécurité, une protection oculaire doit être portée pendant ce processus). Infiltrer au moins trois plantes pour chaque souche. Utilisez trois feuilles par plante pour servir de triples.
Remarque: Normalement, 1 ml de suspension d’Agrobacterium pourrait suffire pour 3 plantes de N. benthamiana. Pour la pomme de terre, plus de suspension est nécessaire car les feuilles des espèces de Solanum sont plus difficiles à infiltrer. Les volumes requis de suspensions dépendent de l’espèce Solanum. Évitez la contamination croisée en changeant les gants ou en stérilisant les gants avec de l’éthanol entre les infiltrations et en n’arrosant les plantes que le lendemain de l’inoculation. - Marquer:
Marquer les réponses macroscopiques environ 3 jours après l’infiltration lorsque le phénotype de mort cellulaire est clair (Figure 1). Si le phénotype de mort cellulaire est quantitatif, utilisez les critères donnés (Figure 2). En bref, les échelles pour la notation macroscopique de la mort cellulaire dépendent principalement des pourcentages de mort cellulaire de la zone infiltrée. Les pourcentages de mort cellulaire sont représentés sur une échelle allant de 0 % (aucun symptôme) à 100 % (mort cellulaire confluente). Les réponses intermédiaires vont de réponses faibles telles que la chlorose à l’augmentation des niveaux de mort cellulaire. Si vous le souhaitez, la notation macroscopique peut également être évaluée quantitativement à l’aide d’un équipement de photo-imagerie moderne.
3. Agroinfection PVX
- Matériel végétal:
Pour N. benthamiana,utilisez environ 2-3 semaines de plantes à graines. Pour la pomme de terre, utilisez environ 2-3 semaines de greffes in vitro. Pour les tests à grande échelle, utilisez des plantes légèrement plus anciennes (4-5 semaines), car ces plantes ont des feuilles plus nombreuses et plus grandes pour accueillir un plus grand nombre de taches d’inoculation d’Agrobacterium. -
Culture d’Agrobacterium :
- Préparez le milieu YEB à l’avance. Remplissez les tubes de 10 ml avec 3 ml de YEB complétés par les antibiotiques appropriés. Pipetter 20 μl de glycérol stock des souches désirées(tableau 2)(contenant le gène d’intérêt) dans le YEB. Initier des cultures pour toutes les souches d’Agrobacterium dans ce test en même temps. Incuber les cellules en secouant pendant 1-2 jours à 28 °C et 200 rpm à une DO600 d’environ 1,0.
- Pipetter environ 300 μl de chaque souche d’Agrobacterium et les étaler sur des plaques de milieu de gélose solide LB complétées par les antibiotiques appropriés et incuber les cellules à 28 °C pendant 1-2 jours.
- Infections:
Utilisez une spatule pour recueillir la culture Agrobacterium dans la plaque. Trempez un cure-dent en bois dans la culture Agrobacterium sur la spatule et percez les feuilles pour inoculer une grande quantité de bactéries. Inoculer au moins trois plantes pour chaque souche. Utilisez trois feuilles par plante pour servir de triples. Dans chaque feuille, faites plusieurs sites d’inoculation pour chaque souche. - Marquer:
Marquer les réponses macroscopiques environ deux semaines après l’inoculation (Figure 3). Pour les écrans à haut débit, enregistrez les réponses qualitatives (oui/non) pour chaque point d’inoculation. Calculez ensuite le pourcentage de sites répondants et comparez-les avec des contrôles.
Résultats
La figure 1 montre une expérience représentative d’agroinfiltration avec 7 effecteurs différents (E1-E7) dans la pomme de terre et N. benthamiana. La mort cellulaire apparaît dans les panneaux foliaires infiltrés environ 3 jours après l’infiltration. L’ampleur du phénotype de mort cellulaire doit être comparée aux contrôles. Un mélange de la souche AGL1(pVirG)23 d’Agrobacterium contenant pBINplus-R3a et pK7WG2-AVR3a a été utilisé comme témoin positif24,25, tandis que L’AGL1(pVirG) a été utilisé comme témoin négatif. Les figures 1A et 1B montrent de bons exemples d’agroinfiltration dans le génotype de pomme de terre MaR8 (Mastenbroek R8)26 et N. benthamiana,respectivement, qui se prêtent très bien à l’agroinfiltration. Il y a la mort cellulaire confluente dans le panneau foliaire coinfiltré avec le contrôle positif, tandis qu’aucune réponse de mort cellulaire ne se produit avec le contrôle négatif ou pBINplus-R3a. Dans MaR8, deux effecteurs AVR3a (E2) et AVR4 (E3) induisent une mort cellulaire, tandis que les autres effecteurs (E1 et E4-E7) ne le font pas. Chez N. benthamiana, aucun des effecteurs testés n’induit une réponse de mort cellulaire. Les figures 1C et 1D montrent des exemples d’agroinfiltration dans la pomme de terre sauvage Solanum berthaultii 483-1 et Solanum rechei 210-5, qui ne se préparent pas bien à la technique de l’agroinfiltration. Chez S. berthaultii 483-1, le tissu foliaire présente une nécrose non spécifique aux témoins négatifs ainsi qu’à tous les effecteurs testés. Chez S. rechei 210-5, les panneaux foliaires infiltrés montrent une très faible réponse de mort cellulaire au contrôle positif.
La figure 2 montre une gamme d’échelles de notation qui peuvent être utilisées pour quantifier la réponse à Agrobacteriumagroinfiltrée. Les pourcentages de mort cellulaire sont représentés sur une échelle de 0 à 100 %. Les phénotypes observés vont des symptômes macroscopiquement non visibles (0%), à travers une gamme de réponses intermédiaires montrant la chlorose et l’augmentation des niveaux de mort cellulaire, jusqu’à la mort cellulaire confluente (100%).
La figure 3 montre une expérience représentative après l’agroinfection du PVX dans la pomme de terre. Normalement, la mort cellulaire en expansion peut être trouvée aux emplacements environ deux semaines après l’inoculation de dent-pick. Comme le montrent les deux panneaux de la figure, la mort cellulaire en expansion est présente aux sites qui ont été inoculés avec pGR106-CRN2 (contrôle positif à l’aide du crinkler effecteur Crn2), qui est un gène induisant la mort cellulaire générale de P. infestans27. Indépendamment de la réponse mineure aux blessures, aucune mort cellulaire en expansion n’est notée aux sites qui ont été inoculés de dent-pick avec le pGR106-vide (contrôle négatif). Sur la figure 3A,représentant le génotype maR3 de la pomme de terre (Mastenbroek R3), deux effecteurs pGR106 (E1 et E2) n’ont pas induit la mort cellulaire. Sur la figure 3B,on présente un résultat positif du criblage effecteur dans le Solanum huancabambense 354-1 sauvage ; on a observé la réponse de mort cellulaire à deux pGR106-effecteurs (E1-E3, représentant des elicitins)28.

Figure 1. Examples of agroinfiltration in potato and N. benthamiana. Des plantes comprenant(A)un génotype de pomme de terre MaR8 (Mastenbroek R8), (B) N. benthamiana, (C) Solanum berthaultii 483-1 et (D) Solanum rechei 210-5 ont été infiltrées avec un mélange de la souche Agrobacterium AGL1(pVirG) 23 contenant pBINplus-R3a et pK7WG2-AVR3a (témoin positif), AGL1 (pvirG) (témoin négatif), pBINplus-R3a, et sept effecteurs (E1-E7). Cliquez ici pour agrandir l’image.
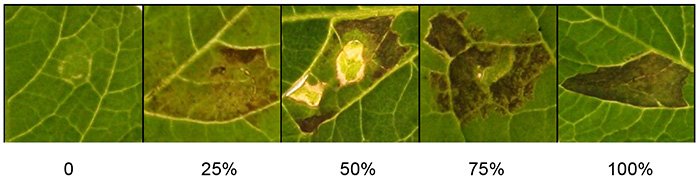
Figure 2. Quantification des réponses d’agroinfiltration. La photographie montre des échelles de notation représentatives pour la mort cellulaire, allant de 0% (aucun symptôme) à 100% (mort cellulaire confluente). Les réponses intermédiaires vont de réponses faibles telles que la chlorose à l’augmentation des niveaux de mort cellulaire. Cliquez ici pour agrandir l’image.
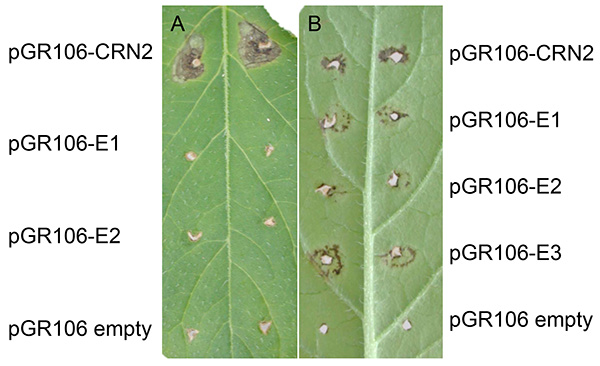
Figure 3. Exemples d’agroinfection PVX dans la pomme de terre. Génotype maR3 (Mastenbroek R3)(A)et solanum huancabambense 354-1(B)cure-dent inoculé avec pGR106-CRN2 (témoin positif), pGR106-vide (témoin négatif) et pGR106-E1-2 (effecteurs), ou pGR106-E1-E3, respectivement. Cliquez ici pour agrandir l’image.
Tableau 1. Milieu YEB
| 1 L | distilléH2O |
| 5 g | saccharose |
| 5 g | extrait de bœuf |
| 5 g | peptone bactériologique |
| 1 g | extrait de levure |
| 2 ml | MgSO4 (1 M) |
Tableau 2. Vecteurs et souches utilisés pour l’agroinfiltration et l’agroinfection PVX. Plusieurs vecteurs binaires peuvent être utilisés. Les vecteurs de la liste ci-dessous permettent une expression élevée des gènes candidats et ont bien fonctionné entre nos mains. Nous préférons utiliser la souche Agrobacterium GV3101(pMP90)29 chez N. benthamiana et trouvons AGL130 contenant le plasmide auxiliaire pVirG (pBBR1MCS-5.virGN54D)23 plus approprié dans la pomme de terre31. D’autres souches ont été analysées dans d’autres groupes sur diverses plantes modèles, y compris N. benthamiana, mais pas dans la pomme de terre32.
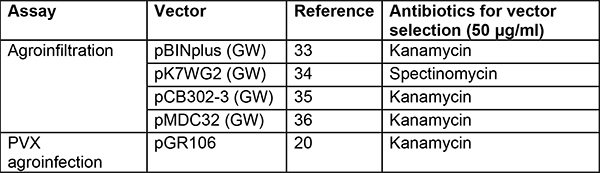
GW : passerelle version36
Tableau 3. Milieu MMA.
Régler le pH à 5,6.
Discussion
Les essais transitoires comme l’agroinfiltration et l’agroinfection sont des méthodes efficaces qui sont essentielles à la recherche moderne en phytopathologie moléculaire. Malgré certaines limites, ces méthodes répondent à la demande d’analyses fonctionnelles à haut débit efficaces et robustes dans les usines.
Le système d’agroinfiltration est un test fonctionnel largement utilisé dans une gamme d’espèces végétales. L’agroinfiltration facilite l’administration de plusieurs transgènes dans la même cellule avec l’expression simultanée de protéines en interaction. Ceci est avantageux pour récapituler les relations R-AVR, en cofiltrant les souches Agrobacterium qui expriment les gènes Avr avec des souches qui expriment les gènes R correspondants. En outre, pour les paires R-AVR connues, de telles co-infiltrations peuvent être utilisées comme contrôles positifs. Il est important d’inclure de tels contrôles, car dans certains génotypes végétaux, l’efficacité de la transformation peut être inférieure au seuil de détection des réponses. L’inclusion de contrôles négatifs, par exemple une souche Agrobacterium contenant un vecteur sans insertion de gène, est également essentielle pour déterminer si un certain génotype de plante soulève des réponses de défense non spécifiques à l’Agrobacterium. Cette caractéristique se produit à une certaine fréquence dans le matériel génétique de la pomme de terre, et toutes les espèces de Solanum ne conviennent pas bien à ce système d’expression à base d’Agrobacterium. En général, le test d’agroinfiltration fonctionne très bien chez N. benthamiana et la plupart des génotypes de pommes de terre. En plus de l’effectoromique, il existe diverses autres applications potentielles pour la technique d’agroinfiltration, telles que la production de protéines à partir de transgènes et la localisation de protéines dans les cellules végétales par microscopie confocale.
L’agroinfection PVX est un système de criblage très sensible et généralement plus adapté aux criblages à haut débit. Étant donné que l’Agrobacterium n’est plus présente que localement, les réponses non spécifiques à cette bactérie ne sont plus très inquiétantes, car le virus PVX prend le relais de la propagation du transgène. Cependant, les plantes peuvent être résistantes au PVX ou monter des réponses de résistance extrême (ER), et dans ce cas, la méthode d’agroinfection ne convient pas. Une autre limitation de la méthode d’agroinfection PVX est la taille de l’insert du gène d’intérêt. Les phénotypes observés des réponses peuvent varier d’une nécrose noire intense entourant la blessure à la nécrose faible près du point d’inoculation. Chez les espèces de N. benthamiana et de Solanum, l’agroinfection PVX est reconnue comme plus sensible que l’agroinfiltration.
En tenant compte du fait que le contexte génétique des divers génotypes de plantes testés peut avoir certaines restrictions (voir ci-dessus), nous obtenons généralement des conclusions similaires par agroinfection pvx et agroinfiltration. Ces résultats sont également comparables à ceux obtenus dans d’autres dosages, tels que les infiltrationsprotéiques 29 et ELISA3. Compte tenu des avantages et des limites des deux systèmes, nous vous recommandons d’utiliser les deux méthodes pour se compléter ou confirmer des résultats indépendants.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Le travail est partiellement soutenu par le Wageningen University Fund (WUF), le China Scholarship Council Program for Graduate Students et une subvention NWO-VIDI 12378.
matériels
| Name | Company | Catalog Number | Comments |
| Beef extract | Sigma-Aldrich | B4888 | |
| Bacteriological peptone | Oxoid | LP0037 | |
| Yeast extract | Oxoid | LP0021 | |
| MgSO4 | Sigma-Aldrich | 208094 | |
| MS salts (without vitamins) | Duchefa Biochemie | M0221 | |
| MES | Duchefa Biochemie | M1503 | |
| LB broth powder | Sigma-Aldrich | L3022 | |
| Acetosyringone | Sigma-Aldrich | D134406 | |
| Syringe (1 ml) | BD Plastipak | 300013 | |
| Incubator | Infors HT | Multitron II | |
| Centrifuge | Heraeus | Multifuge 3S-R | |
| Spectrophotometer | Eppendorf | Biophotometer 6131 |
Références
- Vleeshouwers, V. G. A. A., et al. Understanding and exploiting late blight resistance in the age of effectors. Ann. Rev. Phytopathol. 49, 507-531 (2011).
- Ellis, J. G., Rafiqi, M., Gan, P., Chakrabarti, A., Dodds, P. N. Recent progress in discovery and functional analysis of effector proteins of fungal and oomycete plant pathogens. Curr. Opin. Plant Biol. 12, 399-405 (2009).
- Vleeshouwers, V. G. A. A., et al. Effector genomics accelerates discovery and functional profiling of potato disease resistance and Phytophthora infestans avirulence genes. Plos One. 3, 1-10 (2008).
- Oh, S. K., et al. In planta expression screens of Phytophthora infestans RXLR effectors reveal diverse phenotypes, including activation of the Solanum bulbocastanum disease resistance protein Rpi-blb2. Plant Cell. 21, 2928-2947 (2009).
- Tyler, B. M., et al. Phytophthora genome sequences uncover evolutionary origins and mechanisms of pathogenesis. Science. 313, 1261-1266 (2006).
- Haas, B. J., et al. Genome sequence and analysis of the Irish potato famine pathogen Phytophthora infestans. Nature. 461, 393-398 (2009).
- Levesque, C. A., et al. Genome sequence of the necrotrophic plant pathogen Pythium ultimum reveals original pathogenicity mechanisms and effector repertoire. Genome Biol. 11, 1-22 (2010).
- Lamour, K. H., Win, J., Kamoun, S. Oomycete genomics: new insights and future directions. FEMS Microbiol. Lett. 274, 1-8 (2007).
- Stassen, J. H. M., et al. Effector identification in the lettuce downy mildew Bremia lactucae by massively parallel transcriptome sequencing. Mol. Plant Pathol. 13, 719-731 (2012).
- Kemen, E., et al. Gene gain and loss during evolution of obligate parasitism in the white rust pathogen of Arabidopsis thaliana. PLoS Biol. 9, 1-21 (2011).
- Win, J., et al. Effector biology of plant-associated organisms: concepts and perspectives. , Cold Spring Harbor. 1-13 (2012).
- Hogenhout, S. A., van der Hoorn, R. A. L., Terauchi, R., Kamoun, S. Emerging concepts in effector biology of plant-associated organisms. Mol. Plant Microbe Interact. 22, 115-122 (2009).
- Kamoun, S. A catalogue of the effector secretome of plant pathogenic oomycetes. Ann. Rev. Phytopathol. 44, 41-60 (2006).
- van der Hoorn, R. A. L., Laurent, F., Roth, R., De Wit, P. J. G. M. Agroinfiltration is a versatile tool that facilitates comparative analyses of Avr9/Cf-9-induced and Avr4/Cf-4-induced necrosis. Mol. Plant Microbe Interact. 13, 439-446 (2000).
- Dangl, J. L., Jones, J. D. G. Plant pathogens and integrated defence responses to infection. Nature. 411, 826-833 (2001).
- Kapila, J., de Rycke, R., van Montagu, M., Angenon, G. An Agrobacterium-mediated transient gene expression system for intact leaves. Plant Sci. 122, 101-108 (1997).
- Kanneganti, T. D., Huitema, E., Kamoun, S. In planta expression of oomycete and fungal genes. Methods Mol. Biol. 354, 35-43 (2007).
- Vleeshouwers, V. G. G. A., Rietman, H. In planta expression systems. Oomycete Genetics and Genomics. Diversity, Interactions, and Research Tools. Lamour, K., Kamoun, S. 23, 455-475 (2009).
- Peng, W. T., Lee, Y. W., Nester, E. W. The phenolic recognition profiles of the Agrobacterium tumefaciens VirA protein are broadened by a high level of the sugar binding protein ChvE. J. Bacteriol. 180, 5632-5638 (1998).
- Lu, R., et al. High throughput virus-induced gene silencing implicates heat shock protein 90 in plant disease resistance. EMBO J. 22, 5690-5699 (2003).
- Ma, L., Lukasik, E., Gawehns, F., Takken, F. L. W. The use of agroinfiltration for transient expression of plant resistance and fungal effector proteins in Nicotiana benthamiana leaves. Methods Mol. Biol. 835, 61-74 (2012).
- Bhaskar, P. B., Venkateshwaran, M., Wu, L., Ané, J. M., Jiang, J. Agrobacterium-mediated transient gene expression and silencing: A rapid tool for functional gene assay in potato. Plos One. 4, 1-8 (2009).
- van der Fits, L., Deakin, E. A., Hoge, J. H. C., Memelink, J. The ternary transformation system: constitutive virG on a compatible plasmid dramatically increases Agrobacterium-mediated plant transformation. Plant Mol. Biol. 43, 495-502 (2000).
- Huang, S., et al. Comparative genomics enabled the isolation of the R3a late blight resistance gene in potato. Plant J. 42, 251-261 (2005).
- Armstrong, M. R., et al. An ancestral oomycete locus contains late blight avirulence gene Avr3a, encoding a protein that is recognized in the host cytoplasm. Proc. Natl. Acad. Sci. U.S.A. 102, 7766-7771 (2005).
- Kim, H. J., et al. Broad spectrum late blight resistance in potato differential set plants MaR8 and MaR9 is conferred by multiple stacked R genes. Theor. Appl. Genet. 124, 923-935 (2012).
- Torto, T. A., et al. EST mining and functional expression assays identify extracellular effector proteins from the plant pathogen Phytophthora. Genome Res. 13, 1675-1685 (2003).
- Vleeshouwers, V. G. A. A., et al. Agroinfection-based high-throughput screening reveals specific recognition of INF elicitins in Solanum. Mol. Plant Pathol. 7, 499-510 (2006).
- Koncz, C., Schell, J. The promoter of TL-DNA gene 5 controls the tissue-specific expression of chimeric genes carried by a novel type of agrobacterium binary. Mol. Gen. Genet. 204, 383-396 (1986).
- Lazo, G. R., Stein, P. A., Ludwig, R. A. A DNA transformation-competent Arabidopsis genomic library in Agrobacterium. Bio-Technol. 9, 963-967 (1991).
- Rietman, H. Putting the Phytophthora infestans genome sequence at work; multiple novel avirulence and potato resistance gene candidates revealed [PhD thesis]. , Wageningen University. (2011).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnol. J. 3, 259-273 (2005).
- van engelen, F. A., et al. pBINPLUS - an improved plant transformation vector based on pBIN19. Transgenic Res. 4, 288-290 (1995).
- Karimi, M., Inze, D., Depicker, A. GATEWAYTM vectors for Agrobacterium-mediated plant transformation. Trends Plant Sci. 7, 193-195 (2002).
- Xiang, C. B., Han, P., Lutziger, I., Wang, K., Oliver, D. J. A mini binary vector series for plant transformation. Plant Mol. Biol. 40, 711-717 (1999).
- Curtis, M. D., Grossniklaus, U. A gateway cloning vector set for high-throughput functional analysis of genes in planta. Plant Physiol. 133, 462-469 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon