Method Article
Isolierung humaner Monozyten durch Doppel-Zentrifugation und ihre Differenzierung zu Makrophagen in Teflon-beschichteten Zellkultur-Taschen
In diesem Artikel
Zusammenfassung
Wir stellen ein einfaches und effizientes Protokoll für die Herstellung von menschlichen Makrophagen. Buffy Coats werden durch Doppel Dichtegradientenzentrifugation isoliert verarbeitet und Monozyten werden dann an Makrophagen in Teflon-beschichtete Zellkulturbeutel differenziert. Dies maximiert Makrophagen-Renditen und erleichtert die Zellernte für nachfolgende Experimente.
Zusammenfassung
Menschliches Makrophagen werden in einer Vielzahl von pathologischen Prozessen, die von Infektionskrankheiten Krebs beteiligt. So stellen sie ein wertvolles Werkzeug, um die zugrundeliegenden Mechanismen dieser Krankheiten zu verstehen. Wir haben daher für die Isolierung von humanen Monozyten aus buffy coats, gefolgt von einem Verfahren, das die Differenzierung in hohen Ausbeuten ergibt Makrophagen stellen eine einfache Protokoll. Die Technik beruht hauptsächlich auf allgemein erhältlichen Laborgeräte und stellt eine kostengünstige und zeiteffektive Art und Weise, große Mengen menschlicher Makrophagen erhalten somit. Kurz gesagt, werden buffy coats gesunder Blutspender zu einem Doppel Dichtegradientenzentrifugation unterworfen Monozyten aus dem peripheren Blut geerntet. Diese Monozyten werden dann in Fluorethylenpropylen (FEP), Teflon-beschichteten Zellkulturbeuteln in Gegenwart von Makrophagen-Kolonie-stimulierenden Faktor (M-CSF) kultiviert. Die differenzierten Makrophagen können leicht geerntet und für nachfolgende Studien und funktional eingesetzt werdensagt. Wichtigsten Methoden für die Qualitätskontrolle und Validierung der Isolierung und Differenzierung Schritte werden im Protokoll markiert. Zusammenfassend ist die hier beschriebene Protokoll ermöglicht Wissenschaftlern, humanen Makrophagen routinemäßig und reproduzierbar zu isolieren, ohne die Notwendigkeit für kostenintensive Werkzeuge. Weiterhin können Krankheitsmodellen in einem syngenen menschlichen System Umgehung der Verwendung von Maus-Makrophagen zu untersuchen.
Einleitung
Zellen aus der Monozyten-Linie und ihre terminal differenzierten Derivat - Makrophagen - zeigen eine markante Plastizität im Hinblick auf ihre biologische Funktion, was zu ihrer Beteiligung in so unterschiedlichen Prozessen wie Entwicklung, Gewebereparatur und Immunität 1. Letzteres ist aufgrund ihrer phagocytic und Antigen-präsentierenden Fähigkeit, die Makrophagen an der Kreuzung zwischen der angeborenen und adaptiven Immunantwort 2 Plätze. Allerdings ist ihre Fähigkeit, Cytokine, Chemokine, Wachstumsfaktoren und andere Signalmoleküle sezer 1 nicht nur verstärkt ihre immunmodulatorische Funktion, sondern dient auch als Grundlage für die weiteren Funktionen. Versucht, diese verschiedenen Aktivierungsschritte im Zusammenhang mit der nicht-mikrobiellen vermittelten Zuständen in der M1 und M2 die Kategorien 3 führte zu spiegeln. Während dieser Klassifizierung ist nicht vollständig, kann es für ein grundlegendes Verständnis der Biologie Makrophagen.
Aufgrund dieser vielfältigen Funktionen ist es nicht überraschend, dass Makrophagen sind mit vielen Bedingungen, die in irgendeiner Weise beteiligt Gewebeumbau oder Entzündung. Neben ihrer Grund Rolle bei der Erkennung und Beseitigung von 4-6 eindringende Krankheitserreger haben Makrophagen zunehmend in den Fokus bei der Atherosklerose, Fibrose, Fettleibigkeit und Krebs 7-10 kommen. Ein reproduzierbares Verfahren zur Erzeugung von humanen Makrophagen ist daher entscheidend für ein Verständnis dieser Erkrankungen. Hier stellen wir ein Verfahren, das auf die Isolierung von humanen Monozyten aus dem peripheren Blut gesunder Spender durch einen Doppel Dichtegradientenzentrifugation Technik, wie zuvor beschrieben 11. Zur Differenzierung zu Makrophagen zu erleichtern, werden die isolierten Monozyten in Gegenwart von niedrigen Konzentrationen von M-CSF und normalem menschlichem Serum 12 inkubiert. Zur weiteren Handhabung und Zellernte zu erleichtern, ist die Differenzierung in gasdurchlässige FEP durchgeführtTeflon-beschichtete Zellkulturbeutel mit einer hydrophoben Oberfläche 12-15. Die resultierenden ruht Makrophagen kann auf eine Vielzahl von Tests unterzogen werden, da sie in der Lage ist zu reagieren entweder in einer M1 oder M2 artig noch. Alternative Methoden der Monozyten Isolierung und nachfolgende Differenzierung wie magnetische Zellsortierung (MACS) oder Gegenstrom Zentrifugalausschlämmung (CCE) einige Einschränkungen hinsichtlich der Ausbeute, Kosten und Zeit benötigt. Das hierin beschriebene Protokoll hat den Vorteil, dass sie mit Standard-Laborausrüstung, ohne die Notwendigkeit für spezielle Reagenzien (beispielsweise MACS Magnetkügelchen) oder Geräten (zB CCE Vorrichtung) durchgeführt werden und erlaubt die Verarbeitung von großen Mengen an Zellen.
Protokoll
1. Herstellung von sterilen humanem AB-Serum
- Sammeln Sie 4-5 Beutel gefrorenes Frischplasma (FFP). Shop-Taschen bei -20 ° C bis genügend Taschen gesammelt wurden.
- Auftauen Taschen und Inkubation für 30 min bei 56 ° C in einem Wasserbad auf das Komplement zu inaktivieren und entfernen Fibrin.
- Die Außenseite der Taschen gründlich zu desinfizieren und übertragen das Plasma auf 50-ml-Röhrchen.
- Zentrifuge bei 3000 × g für 15 min bei Raumtemperatur loswerden Niederschläge und Rest Blutplättchen.
- Bündeln alle Überstände und entsorgen Sie die Pellets.
- Aliquoten Serumproben in 15-ml-Röhrchen und bei -20 ° C.
HINWEIS: Alternativ können kommerziell erhältliche hitzeinaktiviertes normales menschliches AB-Serum verwendet werden.
2. Isolierung von Monozyten
Zum Ausgleich der Zentrifuge zu erleichtern, empfiehlt es sich, zwei buffy coats parallel verarbeiten. Allerdings nehmen cawieder getrennte Materialien für jeden Spender zu verwenden und nicht, um die Zellen zu mischen. Im Fall buffy coats nicht leicht erhalten werden kann, kann mit 400 ml heparinisiertem peripheren Blut stattdessen verwendet werden.
- Sorgfältig desinfizieren Sie die Plastikbeutel mit den Buffy Coats und den Inhalt der einzelnen Buffy-Coat-Transfer zu zwei 50-ml-Röhrchen.
- Für jede Leukozytenmanschette füllen drei 50-ml-Röhrchen mit 15 ml Ficoll-Lösung (1,077 g / ml). Die Ficoll sollte bei Raumtemperatur für die Herstellung sein.
- Schicht 30-35 ml Buffy Coat Blut auf der Ficoll-Lösung für die erste Dichte-Gradienten. Seien Sie vorsichtig, dies langsam und vorsichtig, um Vermischen der beiden Schichten zu verhindern.
- Zentrifuge bei 400 × g ohne Bremse für 30 min bei Raumtemperatur.
- Für jeden Gradienten sammeln die weißen Ring von peripheren mononukleären Blutzellen (PBMCs), die zwischen den beiden Phasen mit einer Kunststoff-Pasteur-Pipette und in ein 50 ml Röhrchen befindet.
- Füllen Sie jedes Rohr mit PBS-EDTA (1 mM) auf 40 ml insgesamt.
- Zentrifuge bei 300 g für 10 min ohne Bremse bei Raumtemperatur.
- Überstand wird abgesaugt und waschen Pellet erneut mit 40 ml PBS-EDTA (1 mM).
- Für jeden Spender-Pool die Pellets in 20 ml RPMI-1640 ohne Phenolrot + 10% FCS.
- Bereiten Sie das iso-osmotischen Percoll Lösung für die zweite Dichtegradienten: Für zwei Spender mischen 23.13 ml Percoll-Lösung (Dichte: 1,131 g / ml) in einem 50-ml-Tube mit 1,87 ml 10-fach PBS. Dann Transfer 23 ml dieser Lösung in ein neues 50-ml-Tube und füge 27 ml RPMI-1640 mit Phenol rot + 10% FCS, um eine 46% iso-osmotischen Percoll-Lösung zu erhalten. Die Percoll sollte bei Raumtemperatur für die Herstellung sein.
- Für jeden Spender 25 ml der vorbereiteten Percoll-Lösung in ein 50 ml-Röhrchen und die Schicht des in 2.9 hergestellten Lösung PBMC) auf der Oberseite der Percoll-Lösung. Seien Sie vorsichtig, dies zu tun, sehr langsam eind sorgfältig, beide Schichten neigen dazu, leicht zu mischen. Wenn es richtig gemacht die beiden Phasen können aufgrund ihrer Unterschiede in Farbe unterschieden werden.
- Zentrifuge bei 550 × g ohne Bremse für 30 min bei Raumtemperatur.
- Für jeden Gradienten sammeln die weißen Ring von Monozyten, die zwischen den beiden Phasen mit einer Kunststoff-Pasteur-Pipette und in ein 50 ml Röhrchen befindet.
- Füllen Sie jedes Rohr mit PBS-EDTA (1 mM) bis zu 50 ml insgesamt.
- Zentrifuge bei 400 × g für 10 min ohne Bremse bei Raumtemperatur.
- Aspiration des Überstands und Resuspendieren des Pellets in 20 ml RPMI-1640 mit Phenolrot + 10% FCS.
3. Differenzierung von Monozyten zu Makrophagen
- Bestimmen Sie die Anzahl von isolierten Monozyten in einer Verdünnung von 1:10 in Trypanblau. Zählen nur die großen, oft unregelmäßig geformte Zellen, die Monozyten sind. Zählen Sie nicht die kleineren, runden Zellen, die Lymphozyten.
NOTE: Monozyten-Zahlen nicht haben, um zu genau bestimmt, da sie einen Hinweis darüber, wie viele und welche FEP Teflon beschichteten Beutel (klein oder groß), die für die Differenzierung der Zellen verwendet werden müssen, nur werden. - Für 1,0-1,5 x 10 8 Monozyten von einem Spender, Samen der Zellen in einem großen FEP Teflon-beschichteten Zellkulturbeutel. Für jeden Beutel bereiten den Nährboden, bestehend aus 174 ml RPMI-1640, 2% humanem AB-Serum (wie in Abschnitt 1 hergestellt), 1% Penicillin / Streptomycin und 2,5 ng / ml M-CSF (Gesamtvolumen: 180 ml).
- Für 3,0-5,0 × 10 7 Monozyten von einem Spender, Samen die Zellen in einer kleinen Teflon-beschichteten Zellkulturbeutel. Für jeden Beutel bereiten das Kulturmedium, bestehend aus 28,5 ml RPMI-1640, 2% humanem AB-Serum (wie in Abschnitt 1 hergestellt), 1% Penicillin / Streptomycin und 2,5 ng / ml M-CSF (Gesamtvolumen: 30 ml).
HINWEIS: Wenn zB 8,0 x 10 7 Monozyten erhalten werden, empfehlen wir, sie in tw Saatguto kleineren Volumen Taschen mit jeweils 4,0 x 10 7 Zellen. Anstelle von M-CSF, Monocyten kann alternativ mit Granulozyten-Makrophagen-Kolonie-stimulierenden Faktor (GM-CSF) bei der gleichen Konzentration (2,5 ng / ml) unterschieden werden.
- Für 3,0-5,0 × 10 7 Monozyten von einem Spender, Samen die Zellen in einer kleinen Teflon-beschichteten Zellkulturbeutel. Für jeden Beutel bereiten das Kulturmedium, bestehend aus 28,5 ml RPMI-1640, 2% humanem AB-Serum (wie in Abschnitt 1 hergestellt), 1% Penicillin / Streptomycin und 2,5 ng / ml M-CSF (Gesamtvolumen: 30 ml).
- Fügen der Zellsuspension (20 ml) zu dem Medium bereit und sorgfältig mischen. Wenn zwei Taschen sind aus einem Spender bereit, 20 ml RPMI-1640 zu der Zellsuspension und fügen Sie dann die Hälfte der Suspension auf jedem Medium Vorbereitung.
- Optional: Um festzustellen, ob die Monozyten Zubereitung steril geblieben ist, reißen einen Tropfen der Zellsuspension auf einer Blut-Agar-Platte und Inkubation über Nacht bei 37 ° C.
- Ziehen Sie die Hülle aus einem 50 ml Perfusor-Spritze auf den Stecker des FEP Teflon-beschichtete Zellkulturbeutel und füllen Sie es mit der vorbereiteten Zellsuspension.
- Ziehen Sie die Spritze und drücken Sie die restliche Luft aus dem Sack. Schließen Sie die Tasche mit einem Schließkegel.
- Bebrüten die Taschen für 6-7 Tage bei 3776, C mit 5% CO 2.
4. Makrophagen Ernte
- Platzieren Sie die FEP Teflon-beschichtete Zellkulturbeutel mit den differenzierten Makrophagen auf Eis für mindestens 1 Stunde, um ein Ablösen der Zellen (eine Inkubation von bis zu 3 Stunden ist möglich) zu erleichtern. Stellen Sie sicher, dass die gesamte Oberfläche des Beutels mit Eis bedeckt ist.
- Ziehen Sie den Beutel mit minimalem Druck 10x über den Rand eines Tisches / Board.
- Sorgfältig desinfizieren Sie die Außenseite der Tasche und entfernen Sie den Schließkegel.
- Ziehen Sie eine 50-ml-Spritze auf dem Stecker der Tasche, entfernen Sie die Zellsuspension, und überträgt es auf 50-ml-Röhrchen.
- Zentrifuge bei 400 × g für 10 min bei Raumtemperatur, um die Zellen zu drehen nach unten.
- Saugt den Überstand und den Pool des Pellets aus einem Beutel in 10 ml RPMI-1640 + 10% FCS insgesamt.
- Bestimmen Sie die Zellzahl in einer Zählkammer (1: 4-1: 10-Verdünnung in Trypanblau). Zählen nur die großen Rundzellen.
HINWEIS: Nach Differenzierung der Makrophagen in der FEP-Teflon-beschichteten Beutel, kann es sein, Restzellen zB Lymphozyten, abhängig von dem Donor und der Qualität der Isolierung von Monozyten. - Um die FEP Teflon beschichteten Beutel wiederverwenden, waschen Sie sie zweimal mit 70% Ethanol, um Restzellen zu entfernen. Füllen sie mit 50 ml 70% Ethanol und Inkubation über Nacht. Waschen Sie die Taschen 3x mit sterilem PBS, wickeln Sie sie in Sterilisationspapier und in einem Autoklaven sterilisieren Verwendung von Standardverfahren.
HINWEIS: Die Zellkultur-Beutel können mehrmals ohne Verlust in Makrophagen Erträge wiederverwendet werden. Allerdings haben wir uns entschieden, die Taschen zu verwerfen nach 10 verwendet, bevor sie anfangen zu lecken. - Für nachfolgende Experimente Kultur Makrophagen in RPMI-1640 + 10% FCS. Niedrigeren Serumkonzentrationen erforderlich sind, ist auch auf den Anbau in RPMI-1640 mit 1% FCS möglich. Samenzellen und Inkubation für 3-4 Stunden. Nach dieser Zeit ist zu beachten, dass Makrophagen heften sich an die Oberfläche der Zellkulturschale, währendalle verunreinigenden Zellen (dh Erythrozyten, Lymphozyten und dendritische Zellen) bleiben in der Schwebe. Waschen Zellen mindestens zweimal mit PBS auf nicht-adhärenten Zellen zu entfernen.
- Kultivierten Makrophagen aus der Zellkulturschale für weitere Experimente lösen, sorgfältig abkratzen der Oberfläche. Alternativ inkubieren Geschirr für 20 Minuten auf Eis, saugen Sie den Kulturmedium und 1 ml enzymfreie Zelldissoziationspuffer. Nach 5 min Inkubation bei 37 ° C, 4 ml PBS, und nehmen die Zellen durch Auf-und Abpipettieren für mindestens 3 min.
Ergebnisse
Die erste Dichtegradientenzentrifugation unter Verwendung von Ficoll ergibt eine weiße Interphase enthält die PBMCs (1A), also Lymphozyten und Monozyten. Dies kann durch eine May-Grünwald-Färbung (1B und C) der gesammelten Zellen, die sowohl eine hohe Kern / Zytoplasma-Verhältnis zeigt (typisch für Lymphozyten) bestätigt und Bohnen- oder ringförmige Kerne (typisch für Monozyten). Wenn diese Zellen werden dann auf eine zweite Dichte-Gradienten unter Verwendung von Percoll geladen ist, kann die Monozyten weiter getrennt von den Lymphozyten und wieder als weiße Inter (1D-F) angezeigt. Für jede Leukozytenmanschette die beschriebene Doppel Dichtegradientenzentrifugation routine ergibt 150 ± 40 x 10 6 Monozyten, die auf 70 ± 30 x 10 6 Macrophagen (Figur 2) pro Leukozytenmanschette unterschieden werden können. Die mittlere Ausbeute von Makrophagen20 unabhängige Vorbereitungen war 47 ± 14% der Gesamt isoliert Monozyten.
Nach dem Percoll-Gradienten-Zentrifugation kann es noch einige restliche nicht monozytären in der Zubereitung, die von der Blutspende sowie auf die Genauigkeit des Isolationsprozesses vorliegt Zellen sein. Nachdem jedoch die Differenzierungsphase von 6-7 Tagen wurde die Zubereitung im Wesentlichen aus reifen Makrophagen (Abbildung 3), die weiterhin aufgrund ihrer Adhärenz an Kunststoffoberflächen, einer Funktion, die nicht durch die Zufalls kontaminierenden Zellen geteilt wird (4A angereichert werden können, und B). Einmal überzogen, die Mehrheit der Makrophagen eine klassische "Spiegelei"-Morphologie zeigen, während es gibt auch Zellen mit einer gestreckten spindelförmigen Phänotyp (4C und D). Dies wird durch eine F-Actin-Verteilung im Cytoplasma und Haftung Cluster gespiegelt. Die differenzierten Zellenwerden durch die Expression von CD45, CD14, CD16, CD206 (Mannose-Rezeptor), CD11b und CD11c typische Marker für reife Makrophagen (Abbildung 5) sind gekennzeichnet. Die Anwesenheit von CD11b spricht gegen eine vorwiegend dendritischen Differenzierung, die durch die Tatsache, dass die Zellen negativ für die dendritischen Zellmarker CD209 (DC-SIGN) unterstützt wird.
Nach der Differenzierung der Zellen weiterhin funktions und etwa 5-7 Tage (Figur 6), wie es von Calcein AM-Färbung und ihre Fähigkeit, die extrazelluläre Vesikel aus Tumorzellen vergossen visualisiert werden metabolisch aktiver. Zusätzlich können die Zellen noch, wie dargestellt beispielsweise zur Stimulation mit Lipopolysaccharid (LPS), die in der Expression von verschiedenen proinflammatorischen Genen (Figur 7) ergibt aktiviert werden.

Abbildung 1. Aussehen und Zusammensetzung des PBMC- und Monozyten-Schicht nach der Doppel Dichtegradientenzentrifugation. Photographie (A) die PBMC-Band nach der Ficoll-Gradienten und (D) der Monozyten-Phase nach dem iso-osmotischen Percoll Zentrifugation. Mai-Grünwald-Färbungen von Zytospinpräparate der (B, C) PBMC-Fraktion und die restlichen (E, F) Monozyten. Maßstab = 200 um B und E, = 50 um in C und F.

Abbildung 2. Ausbeute von Monozyten und Makrophagen. Repräsentative Zellzählungen von isolierten Monozyten und Makrophagen von 20 Buffy-Coat-preparations.
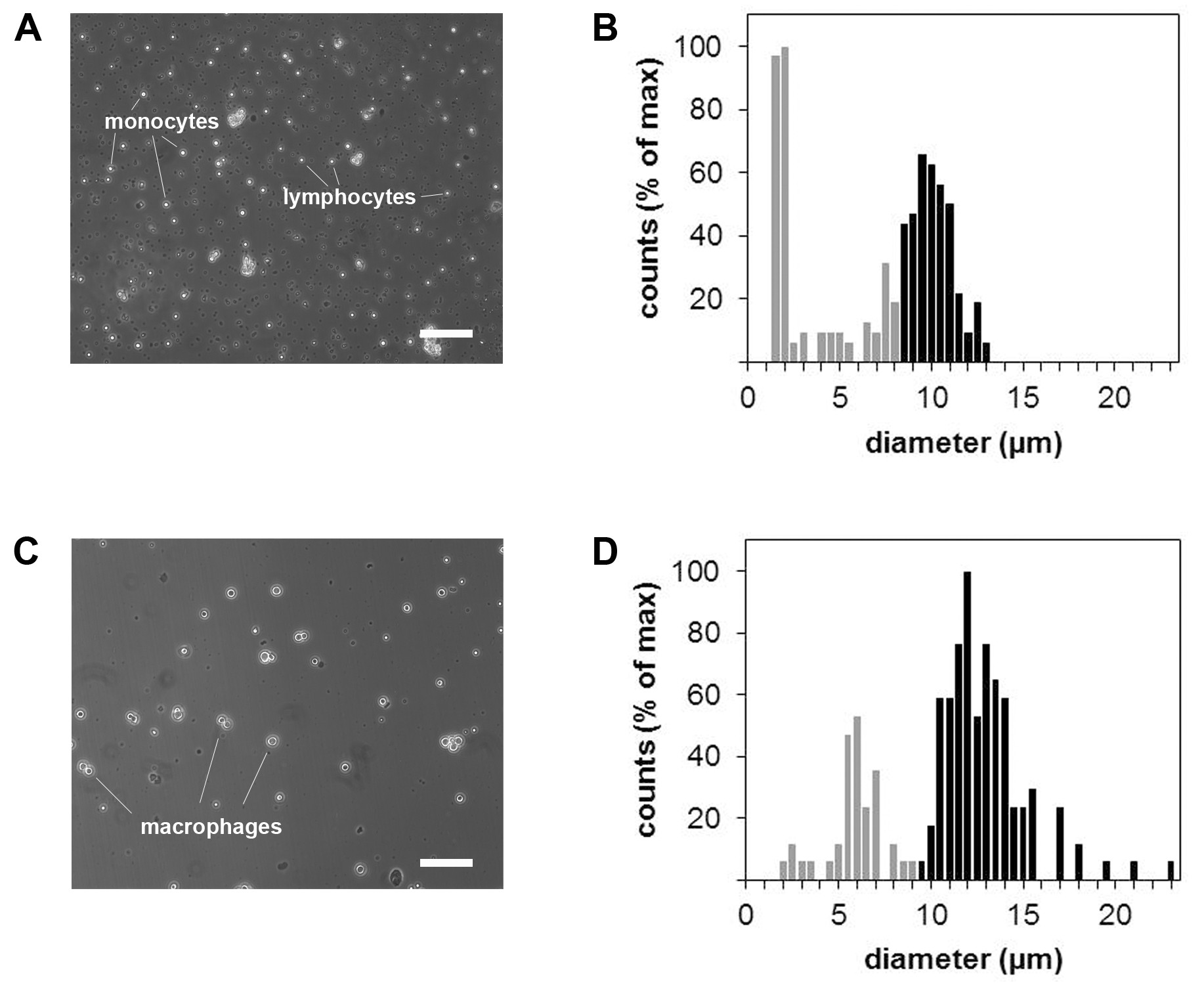
Figur 3 Schliffbilder und Zellgrößenmessungen von Monozyten und Makrophagen. Phasenkontrastmikroskopie monozytären Zellsuspension vor (A) und nach (B) Makrophagen-Differenzierung. Entsprechende Zellengröße Histogramme von Monozyten (C) und Makrophagen (D). Maßstab = 100 um.

Abbildung 4. Morphologie und Organisation des Zytoskeletts von adhärenten Makrophagen. Phasenkontrastmikroskopie von adhärenten Makrophagen vor (A) und nach (B) Entfernung von nicht-adherenT-Zellen. (C, D) Phalloidin-TRITC-Färbung von polymerem Aktin in adhärenten, nicht stimulierte Makrophagen. Maßstab = 100 um AC, 20 um D. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
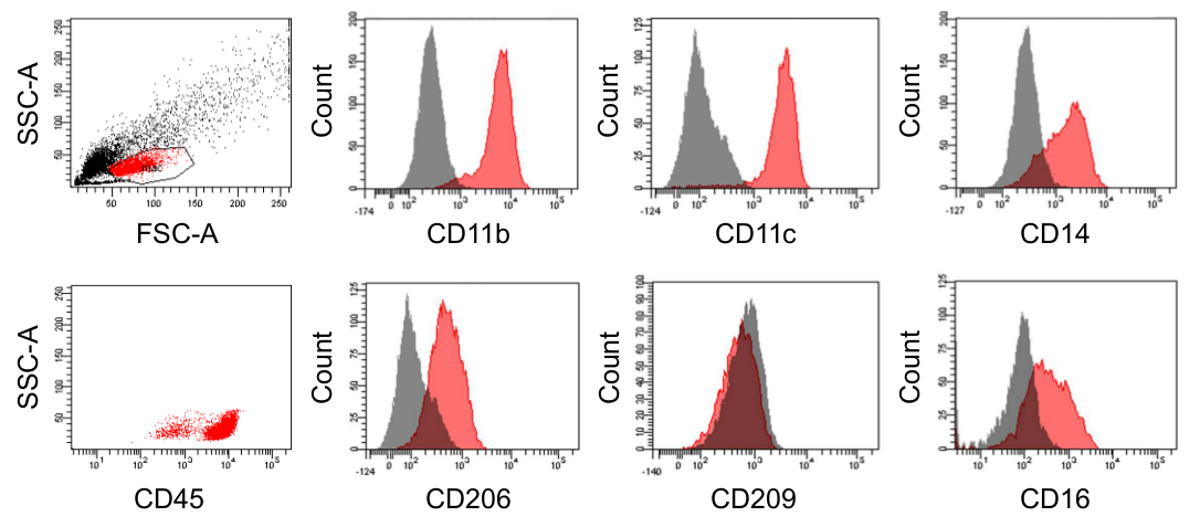
Abbildung 5. Immunophänotyp von differenzierten Makrophagen. Durchflusszytometrie-Analyse von Makrophagen nach 6 Tagen der Differenzierung in FEP Teflon-beschichtete Zellkulturbeutel (rot markiert). Die entsprechenden Isotypkontrollen sind grau dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
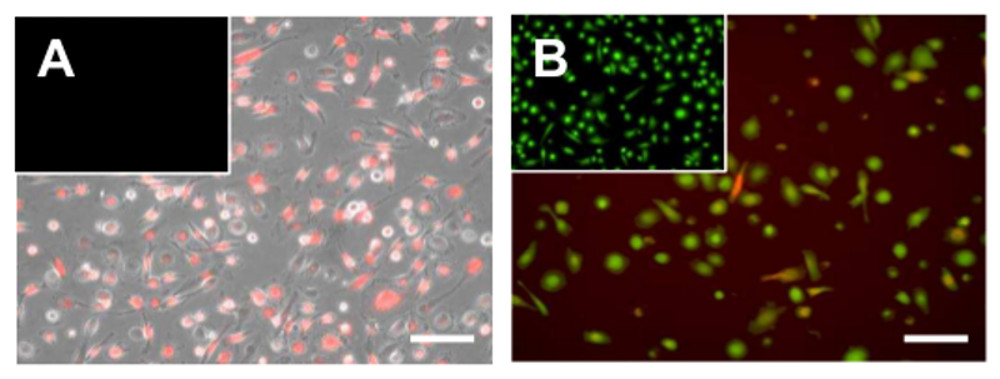
Abbildung 6. Die Aufnahme von Tumorzellen durch Makrophagen Mikrovesikeln. Mikroskopische Aufnahmen von adhärenten Makrophagen nach Exposition zu PKH26-markierten (rot fluoreszierend) Tumorzelle Mikrovesikeln. Bilder werden an den entsprechenden (A) Hell oder (B) cytosolischen Färbung mit dem Farbstoff Calcein AM Lebensfähigkeit überlagert. Maßstabsbalken = 100 um. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
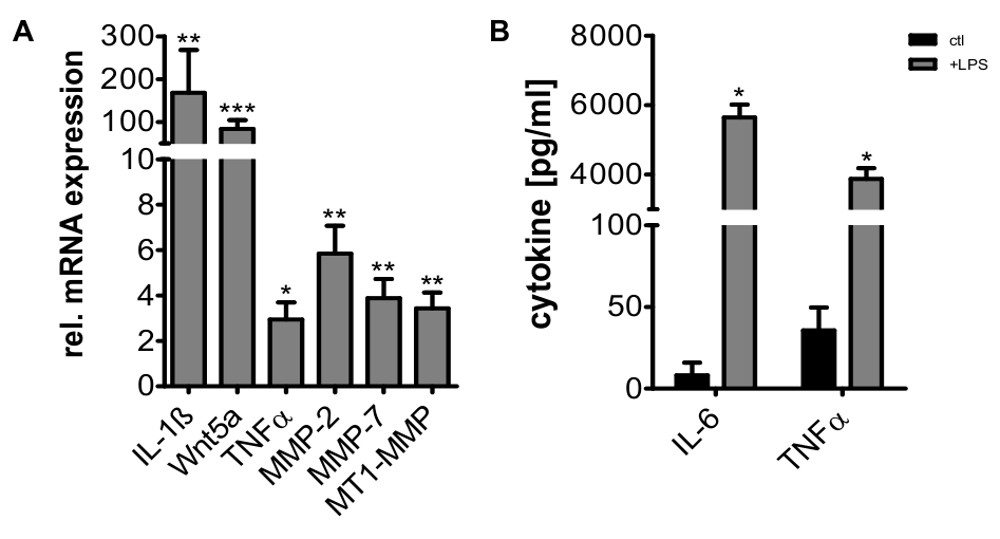
Figur 7. Eine Hochregulierung von IL-1 β, Wnt5a, TNF, IL-6, MMP-2, MMP-7 und MMP-MT1 nach Stimunung von Makrophagen mit LPS (100 ng / ml) für 24 Stunden. Genexpression wurde durch quantitative RT-PCR aus Gesamt-RNA-Proben (A) und auf HPRT1 und GNB2L1 Expression normalisiert gemessen. Die gezeigten Werte sind fachen Änderungen im Vergleich zur unbehandelten Kontrolle (Mittelwert ± SD, n = 5, * p <0,05, ** p <0,01, *** p <0,001). TNF und IL-6-Induktion nach LPS-Stimulation wurden durch ELISA (B) bestätigt (Mittel ± SD, * p <0,05).
Diskussion
Makrophagen sind wichtige Effektorzellen des angeborenen Immunsystems und zeigen wichtige Funktionen in der Immunmodulation, die Antigen-Präsentation und Gewebshomöostase. Aufgrund ihrer bemerkenswerten Plastizität, können sie auf verschiedene Reize mit Veränderungen ihres Phänotyps reagieren. Allerdings sind bisher viele Daten zu Makrophagen Polarisation im murinen System erhalten wird, obwohl es Berichte, die zeigen, dass nur etwa 50% der Makrophagen Polarisations Marker können direkt von der Maus verschoben werden, um menschliche 16. Daher stellen wir hier eine Methode zur primären humanen Makrophagen in ausreichender Anzahl und Reinheit zu erhalten, ohne die Notwendigkeit für teure Materialien, beispielsweise MACS magnetischen Kügelchen oder einem Gegen Zentrifugalausschlämmung Vorrichtung.
Unser Verfahren zur Isolierung von Monozyten aus PBMCs und ihre nachfolgende Differenzierung zu Makrophagen in FEP basierend Teflon beschichteten Zellkulturbeuteln in Gegenwart von geringen concentrations von M-CSF 11-13. Während Monozyten machen weniger als 5 bis 10% der Leukozyten des peripheren Blutes bei Menschen, bei Stimulation sie an peripheren Stellen, wo sie ansässig Gewebe Makrophagen oder dendritischen Zellen differenzieren 17 rekrutiert. Das Zytokin M-CSF ist wichtig für das Überleben von Monozyten und treibt ihre Differenzierung zu Makrophagen 18,19. Bisher waren die M-CSF-Konzentrationen, die für die Differenzierung von Monozyten ausgewählt wurden reichten bis zu 100 ng / ml, aber in unserem Protokoll sind wir in der Lage, eine ausreichende Anzahl von reifen Makrophagen mit einem M-CSF-Konzentration von nur 2,5 ng / ml 12 erhalten , 20. Darüber hinaus werden die Zellen in FEP Teflon-beschichtete Zellkulturbeutel, die die Ablösung der Makrophagen und deren anschließende Aussaat in definierten Zellzahlen erleichtern kultiviert. Da die Beutel kann mehrere Male wiederverwendet werden, dies verringert weiter die Kosten für die Isolationsprozesses.
Die durch dieses Verfahren erhaltenen Makrophagensind sehr positiv für CD45, CD14, CD11b, CD11c und zeigen die Expression des Mannose-Rezeptor CD206, die für eine Bevölkerung von reinen, reifen Makrophagen 21,22 argumentiert. Besonders hohe Expression von CD14 ist typisch für die Makrophagen in Gegenwart von M-CSF 23 differenziert. Nach dem Aussäen der Zellen, zeigen sie ein schnelles Anhaften an Kunststoffoberflächen mit einigen Zellen, die eine typische spindelförmige Morphologie, andere weisen eine Spiegelei Phänotyp. Dies ist in Übereinstimmung mit den Beobachtungen anderer Autoren 18,22,24.
Es wurde berichtet, dass Monozyten-Differenzierung in Gegenwart von M-CSF führt zu M2-polarisierten Makrophagen 16,25. Jedoch sind die Makrophagen durch unser Protokoll isoliert noch in der Lage, ein breites Spektrum von Stimuli einschließlich Exposition von Tumorzellen stamm Mikrovesikel und Co-Kultur mit Tumorzellen 26,27 oder durch Einwirkung von LPS reagiert, auf die sie mit der Induktion von pro- reagieren Entzündungsgenen, wie IL-1,# 946 ;, TNF, Wnt5a oder verschiedene Matrixmetalloproteinasen, die für M1-Makrophagen polarisiert 3,5,28 typisch angesehen werden.
Im Ergebnis ist die Isolierung von Monozyten durch doppelte Dichte-Gradienten-Zentrifugation und anschließende Differenzierung zu Makrophagen FEP Teflon-beschichteten Zellkulturbeuteln zu einer hohen Anzahl von Makrophagen, ohne die Notwendigkeit für technisch schwierig oder teure Verfahren. Die erhaltenen Makrophagen für eine nachfolgende Analyse von der klassischen Aktivierung durch LPS zu der Co-Kultur mit Tumorzellen verwendet werden.
Offenlegungen
Die Autoren haben nichts zu offenbaren, da kein Interessenkonflikt besteht.
Danksagungen
Die Autoren bedanken sich bei Frau Meike Schaffrinski für sie immer hervorragende technische Unterstützung während der letzten Jahre bedanken.
Diese Arbeit wurde durch die Deutsche Forschungsgemeinschaft (DFG) im Rahmen des Verbundforschungsgruppe 942 (FOR942) und dem Forschungsprogramm der Medizinischen Fakultät der Georg-August-Universität Göttingen finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Antibodies for immunophenotyping | Beckman Coulter | for example: CD11c-PE (IM1760), CD45-FITC (7782), IgG1-PE isotype control (A07796), IgG1-FITC isotype control (A07795) | |
| BioLegends | for example: CD14-FITC (325603), CD206-PE (321105) | ||
| Axiovert 200M microscope | Zeiss | ||
| Calcein AM | AnaSpec | 89201 | |
| Combi-stopper closing cones | Braun | 4495101 | |
| 1x PBS, w/o Ca and Mg | Pan biotech | P04-36500 | for PBS-EDTA (1 mM) add 1 ml 0.5 M EDTA per 500 ml PBS |
| 10x PBS, w/o Ca and Mg | Invitrogen | 14200-067 | |
| EDTA (Titriplex III) | Merck | 1084211000 | prepare a 0.5 M solution in H2O, use a sterile filter |
| Cell dissociation buffer (enzyme-free, PBS-based) | Gibco | 13151-014 | |
| Fetal calf serum (FCS) | Invitrogen | 10091148 | heat-inactivated |
| Ficoll (density 1.077 g/ml) | Biochrom AG | L6115 | |
| FACSCanto II | BD Biosciences | ||
| Goat anti-mouse FITC | santa cruz | sc-2010 | |
| LPS from E.coli | Sigma | L8274 | final conc: 100 ng/ml |
| Multifuge 3 L-R | Heraeus | ||
| Penicillin/streptomycin | Biochrom AG | A2213 | |
| Percoll (density 1.131 g/ml) | GE Healthcare | 17-0891-02 | |
| Perfusor syringe 50 ml | Braun | 8728844F | |
| Phalloidin-TRITC | Sigma | P1951 | resuspend in methanol (c = 0.1 mg/ml) |
| [header] | |||
| Plastic disposable Pasteur pipettes | LVL technologies | 2655181 | |
| rh M-CSF | ImmunoTools | 11343117 | Resuspend in 500 µl sterile H2O (c = 100 ng/µl), aliquot |
| RPMI-1640 with phenol red | Gibco | 21875-034 | |
| RPMI-1640 without phenol red | Gibco | 11835-063 | |
| Sterilization paper | VP group | 3KFKFS230116 | |
| Trypan blue stain (0.4% w/v) | Sigma | T8154 | |
| FEP Teflon-coated cell culture bag, small | CellGenix | 72-C | |
| FEP Teflon-coated cell culture bag, large | CellGenix | 197-C | |
Referenzen
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496, 445-455 (2013).
- Iwasaki, A., Medzhitov, R. Regulation of Adaptive Immunity by the Innate Immune System. Science. 327, 291-295 (2010).
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. J Clin Invest. 122, 787-795 (2012).
- Lionakis, M. S., et al. CX(3)CR1-dependent renal macrophage survival promotes Candida control and host survival. J Clin Invest. 123 (3), 5035-5051 (2013).
- Blumenthal, A., et al. The Wingless homolog, WNT5A and its receptor Frizzled-5 regulate inflammatory responses of human mononuclear cells induced by microbial stimulation. Blood. 108, 965-973 (2006).
- Lima, D. S., et al. Inflammasome-derived IL-1 beta production induces nitric oxide-mediated resistance to Leishmania. Nat Med. 19, 909-915 (2013).
- Pollard, J. W. Tumour-educated macrophages promote tumour progression and metastasis. Nat Rev Cancer. 4, 71-78 (2004).
- Subramanian, V., Ferrante, A. W. Jr Obesity, inflammation, and macrophages. Nestle Nutrition workshop series. Paediatric programme. 63, 151-159 (2009).
- Moore, K. J., Sheedy, F. J., Fisher, E. A. Macrophages in atherosclerosis: a dynamic balance. Nat Rev Immunol. 13, 709-721 (2013).
- Pradere, J. P., et al. Hepatic macrophages but not dendritic cells contribute to liver fibrosis by promoting the survival of activated hepatic stellate cells in mice. Hepatology. 58, 1461-1473 (2013).
- Danciger, J. S., et al. Method for large scale isolation, culture and cryopreservation of human monocytes suitable for chemotaxis, cellular adhesion assays, macrophage and dendritic cell differentiation. J Immunol Methods. 288, 123-134 (2004).
- Reiling, N., Blumenthal, A., Flad, H. D., Ernst, M., Ehlers, S. Mycobacteria-induced TNF-alpha and IL-10 formation by human macrophages is differentially regulated at the level of mitogen-activated protein kinase activity. J Immunol. 167, 3339-3345 (2001).
- Andreesen, R., Picht, J., Lohr, G. W. Primary Cultures of Human Blood-Borne Macrophages Grown on Hydrophobic Teflon Membranes. J Immunol Methods. 56, 295-304 (1983).
- van der Meer, J. W., et al. Culture of human bone marrow in the teflon culture bag: identification of the human monoblast. Journal of the Reticuloendothelial Society. 32, 355-369 (1982).
- van der Meer, J. W., et al. Characteristics of human monocytes cultured in the Teflon culture bag. Immunology. 47, 617-625 (1982).
- Martinez, F. O., Gordon, S., Locati, M., Mantovani, A. Transcriptional profiling of the human monocyte-to-macrophage differentiation and polarization: New molecules and patterns of gene expression. J Immunol. 177, 7303-7311 (2006).
- Gordon, S., Taylor, P. R. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 5, 953-964 (2005).
- Hashimoto, S., Yamada, M., Motoyoshi, K., Akagawa, K. S. Enhancement of macrophage colony-stimulating factor-induced growth and differentiation of human monocytes by interleukin-10. Blood. 89, 315-321 (1997).
- Tushinski, R. J., et al. Survival of Mononuclear Phagocytes Depends on a Lineage-Specific Growth-Factor That the Differentiated Cells Selectively Destroy. Cell. 28, 71-81 (1982).
- Rietkotter, E., et al. Zoledronic acid inhibits macrophage/microglia-assisted breast cancer cell invasion. Oncotarget. 4, 1449-1460 (2013).
- Pilling, D., Fan, T., Huang, D., Kaul, B., Gomer, R. H. Identification of Markers that Distinguish Monocyte-Derived Fibrocytes from Monocytes, Macrophages, and Fibroblasts. Plos One. 4, E7475(2009).
- Rey-Giraud, F., Hafner, M., Ries, C. H. In vitro generation of monocyte-derived macrophages under serum-free conditions improves their tumor promoting functions. Plos One. 7, e42656(2012).
- Waldo, S. W., et al. Heterogeneity of human macrophages in culture and in atherosclerotic plaques. Am J Pathol. 172, 1112-1126 (2008).
- Chernykh, E. R., et al. The generation and properties of human M2-like macrophages: potential candidates for CNS repair? Cell Ther Transplant. 2, (2010).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences of the United States of America. 101, 4560-4565 (2004).
- Pukrop, T., et al. Wnt 5a signaling is critical for macrophage-induced invasion of breast cancer cell lines. Proceedings of the National Academy of Sciences of the United States of America. 103, 5454-5459 (2006).
- Hagemann, T., et al. Macrophages induce invasiveness of epithelial cancer cells via NF-kappa B and JNK. J Immunol. 175, 1197-1205 (2005).
- Pereira, C., Schaer, D. J., Bachli, E. B., Kurrer, M. O., Schoedon, G. Wnt5A/CaMKII signaling contributes to the inflammatory response of macrophages and is a target for the antiinflammatory action of activated protein C and interleukin-10. Arterioscl Throm Vas. 28, 504-510 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten