Method Article
Isolement des monocytes humains par double centrifugation en gradient et leur différenciation en macrophages en téflon de culture cellulaire Sacs
Dans cet article
Résumé
Nous présentons un protocole simple et efficace pour la production de macrophages humains. Les couches leucocytaires sont traitées en double centrifugation en gradient de densité et les monocytes isolés sont ensuite différenciées en macrophages en culture cellulaire sacs de téflon. Ceci maximise les rendements des macrophages et facilite la récolte de cellules pour des expériences ultérieures.
Résumé
Macrophages humains sont impliqués dans une multitude de processus pathologiques allant des maladies infectieuses au cancer. Ainsi, ils constituent un outil précieux pour comprendre les mécanismes sous-jacents de ces maladies. Nous présentons donc un protocole simple pour l'isolement des monocytes humains provenant de couches leucocytaires, suivie d'une procédure de différenciation qui se traduit par des rendements élevés de macrophages. La technique repose essentiellement sur l'équipement de laboratoire couramment disponibles et fournit ainsi un moyen économique et efficace de temps pour obtenir de grandes quantités de macrophages humains. En bref, couche leuco-plaquettaire de donneurs de sang en bonne santé sont soumis à une double centrifugation en gradient de densité de récolter des monocytes du sang périphérique. Ces monocytes sont ensuite cultivées en éthylène-propylène fluoré (FEP), les sacs de culture de cellules téflon, en présence de macrophages facteur de stimulation des colonies (M-CSF). Les macrophages différenciés peuvent être facilement recueillis et utilisés pour des études ultérieures et fonctionnelledit. Méthodes importantes pour le contrôle de la qualité et de la validation des étapes d'isolement et de différenciation seront mis en évidence dans le protocole. En résumé, le protocole décrit ici permet aux scientifiques d'isoler systématiquement et de façon reproductible des macrophages humains sans le besoin d'outils de coûts intensive. En outre, les modèles de la maladie peuvent être étudiés dans un système humain syngénique contourner l'utilisation de macrophages murins.
Introduction
Les cellules de la lignée monocytaire et leurs dérivés différenciées - les macrophages - présentent une plasticité remarquable en ce qui concerne leur fonction biologique, conduisant à leur implication dans ces processus aussi divers que le développement, la réparation des tissus, et l'immunité 1. Ce dernier est en raison de leur capacité phagocytaire et présentatrice d'antigène qui place les macrophages au carrefour entre la réponse immunitaire innée et adaptative 2. Cependant, leur capacité à sécréter des cytokines, des chimiokines, des facteurs de croissance et d'autres molécules de signalisation 1, non seulement augmente leur fonction immunitaire modulateur mais également sert de base pour les fonctions supplémentaires. Les tentatives visant à refléter ces étapes d'activation divers dans le cadre de la non-microbiennes conditions médiation ont abouti à des catégories M1 et M2 3. Bien que cette classification n'est pas complète, elle permet une compréhension de base de la biologie des macrophages.
En raison de ces capacités multiples, il n'est pas surprenant que les macrophages sont associés à de nombreuses conditions qui impliquent une certaine façon le remodelage tissulaire ou une inflammation. A côté de leur rôle fondamental dans la reconnaissance et le dédouanement des agents pathogènes envahisseurs 4-6, les macrophages ont de plus en plus se préciser dans l'athérosclérose, la fibrose, l'obésité, le cancer et 7-10. Procédé pour la production reproductible de macrophages humains est donc essentiel à la compréhension de ces pathologies. Ici, nous présentons une méthode basée sur l'isolement des monocytes humains du sang périphérique de donneurs sains par une technique de double gradient de densité de centrifugation comme décrit précédemment 11. Afin de faciliter la différenciation vers les macrophages, les cellules monocytaires isolées sont incubées en présence de faibles concentrations de M-CSF et du sérum humain normal 12. Pour faciliter davantage la manipulation et la récolte des cellules, la différenciation est réalisée en gaz FEP perméableSacs de culture de cellules téflon avec une surface hydrophobe de 12 à 15. Les macrophages au repos qui en résultent peuvent être soumises à une large gamme de dosages telles qu'elles sont encore capables de répondre à un ou l'autre mode M1 ou M2 analogue. D'autres méthodes d'isolement et de différenciation des monocytes ultérieure tels que le tri cellulaire activé magnétique (MACS) ou contre-courant élutriation centrifuge (CCE) ont des limites en ce qui concerne le rendement, le coût et le temps requis. Le protocole décrit ici offre l'avantage de pouvoir être réalisée avec du matériel de laboratoire standard sans la nécessité pour les réactifs spécifiques (par exemple, les Mac billes magnétiques) ou périphériques (par exemple, appareils de CCE) et permet le traitement de grandes quantités de cellules.
Protocole
1 Préparation de stérile de sérum humain AB
- Recueillir 4-5 poches de plasma frais congelé (PFC). sacs à conserver à -20 ° C jusqu'à ce que suffisamment de sacs ont été collectés.
- Décongeler sacs et incuber pendant 30 min à 56 ° C dans un bain d'eau pour inactiver le complément et enlever la fibrine.
- Bien désinfecter l'extérieur du sac et transférer le plasma de tubes de 50 ml.
- Centrifugeuse à 3000 g pendant 15 min à température ambiante pour se débarrasser de précipités et les plaquettes résiduelles.
- Commun de toutes les surnageants et jeter les boulettes.
- des échantillons de sérum de l'aliquote en tubes de 15 ml et conserver à -20 ° C.
NOTE: En variante, disponible dans le commerce du sérum AB humain normal inactivé par la chaleur peut être utilisé.
Isolement des monocytes 2
Afin de faciliter l'équilibrage de la centrifugeuse, il est recommandé de traiter les deux couches leucocytaires en parallèle. Cependant, prendre care d'utiliser des matériaux différents pour chaque bailleur de fonds et de ne pas mélanger les cellules. Dans le cas de couches leucocytaires ne peuvent pas être obtenus facilement, 400 ml de sang périphérique héparine peuvent être utilisés à la place.
- Désinfecter soigneusement les sacs en plastique contenant les couches leuco-plaquettaires et transférer le contenu de chaque couche leuco-plaquettaire à deux tubes de 50 ml.
- Pour chaque couche leuco-plaquettaire remplir trois tubes de 50 ml avec 15 ml de solution de Ficoll (1,077 g / ml). Le Ficoll doit être à température ambiante pendant la préparation.
- La couche de 30 à 35 ml de sang de la couche leucocytaire au-dessus de la solution de Ficoll pour le premier gradient de densité. Soyez prudent de le faire lentement et avec précaution afin d'éviter de mélanger les deux couches.
- Centrifuger à 400 xg sans frein pendant 30 min à température ambiante.
- Pour chaque gradient de recueillir l'anneau blanc de cellules mononucléaires du sang périphérique (PBMC) qui est situé entre les deux phases avec une pipette Pasteur en plastique et transférer dans un tube de 50 ml.
- Remplir chaque tube avec du PBS-EDTA (1 mM) à 40 ml au total.
- Centrifuger à 300 g pendant 10 min sans frein à la température ambiante.
- Aspirer le surnageant et laver de nouveau culot avec 40 ml de PBS-EDTA (1 mM).
- Pour chaque bassin de donneurs pastilles dans 20 ml de RPMI-1640 sans rouge de phénol + 10% de FCS.
- Préparer la solution de Percoll iso-osmotique pour la deuxième gradient de densité: Pour les deux donneurs mélange 23,13 ml d'une solution de Percoll (densité: 1,131 g / ml) dans un tube de 50 ml avec 1,87 ml de PBS 10 fois. Ensuite, transférer 23 ml de cette solution dans un nouveau tube de 50 ml et ajouter 27 ml de RPMI-1640 avec du rouge de phénol + 10% de FCS pour obtenir une solution à 46% d'iso-osmotique Percoll. Le Percoll doit être à température ambiante pendant la préparation.
- Pour chaque donneur par transfert de 25 ml de la solution Percoll disposé à un tube de 50 ml et la solution de couche de PBMC préparé en 2.9) au-dessus de la solution de Percoll. Soyez prudent de le faire très lentement uneD attentivement, les deux couches ont tendance à se mélanger facilement. Si fait correctement les deux phases peuvent être distinguées en raison de leur différence de couleur.
- Centrifuger à 550 xg sans frein pendant 30 min à température ambiante.
- Pour chaque gradient de recueillir l'anneau blanc de monocytes, qui est situé entre les deux phases avec une pipette Pasteur en plastique et transférer dans un tube de 50 ml.
- Remplir chaque tube avec du PBS-EDTA (1 mM) à 50 ml au total.
- Centrifuger à 400 g pendant 10 min sans frein à la température ambiante.
- Aspirer le surnageant et remettre en suspension les culots dans 20 ml de RPMI-1640 avec du rouge de phénol + 10% de FCS.
3. différenciation des monocytes en macrophages
- Déterminer le nombre de monocytes isolés dans une dilution de 1:10 en bleu trypan. Compter que les grandes cellules, forme irrégulière, souvent, qui sont les monocytes. Ne pas compter les cellules plus petites, de forme ronde, qui sont des lymphocytes.
NOTE: nombre de monocytes n'ont pas à être déterminée avec précision en raison trop ils ne donnent une indication sur le nombre et les FEP Téflon enduit sacs (petites ou grandes) doivent être utilisés pour la différenciation des cellules. - Pour 1,0-1,5 x 10 8 monocytes d'un donateur, ensemencer les cellules dans un grand sac de culture de cellules FEP Téflon. Pour chaque sac préparer le milieu de culture constitué de 174 ml du milieu RPMI-1640, 2% de sérum AB humain (tel que préparé dans la section 1), 1% de pénicilline / streptomycine, et 2,5 ng / ml de M-CSF (volume total: 180 ml).
- Pour 3,0-5,0 x 10 7 monocytes d'un donateur, ensemencer les cellules dans un petit sac de culture cellulaire revêtu de téflon. Pour chaque sac de préparer le milieu de culture constitué de 28,5 ml de RPMI-1640, 2% de sérum AB humain (tel que préparé dans la section 1), 1% de pénicilline / streptomycine, et 2,5 ng / ml de M-CSF (volume total: 30 ml).
REMARQUE: Si, par exemple, on obtient 8,0 x 10 7 monocytes, nous vous recommandons de les semer dans two petits sacs de volume avec 4,0 x 10 7 cellules chacune. Au lieu de M-CSF, les monocytes peuvent également être différenciées des granulocytes et des macrophages colony-stimulating factor (GM-CSF) à la même concentration (2,5 ng / ml).
- Pour 3,0-5,0 x 10 7 monocytes d'un donateur, ensemencer les cellules dans un petit sac de culture cellulaire revêtu de téflon. Pour chaque sac de préparer le milieu de culture constitué de 28,5 ml de RPMI-1640, 2% de sérum AB humain (tel que préparé dans la section 1), 1% de pénicilline / streptomycine, et 2,5 ng / ml de M-CSF (volume total: 30 ml).
- Ajouter la suspension de cellules (20 ml) au milieu préparé et mélanger soigneusement. Si deux sacs sont préparés à partir d'un donneur, ajouter 20 ml de RPMI-1640 à la suspension de cellules, puis ajouter la moitié de la suspension de chaque préparation milieu.
- Facultatif: Pour déterminer si la préparation de monocytes est restée stérile, déchirer une goutte de la suspension cellulaire sur une plaque de gélose au sang et incuber pendant la nuit à 37 ° C.
- Serrer la gaine d'un perfuseur 50 ml seringue sur la fiche du sac de culture de cellules FEP revêtue de téflon et le remplir avec la suspension cellulaire préparée.
- Débranchez la seringue et pousser l'air restant dans le sac. Fermez le sac avec un cône de fermeture.
- Incuber les sacs pour 6-7 jours à 3776; C avec 5% de CO 2.
4. macrophages récolte
- Placez le Téflon FEP revêtues les sacs de culture cellulaire avec les macrophages différenciés sur la glace pendant au moins 1 heure pour faciliter le détachement des cellules (une incubation pouvant aller jusqu'à 3 est possible h). Assurez-vous que la totalité de la surface du sac est recouvert de glace.
- Tirez le sac avec une pression minimale 10x sur le bord d'un bureau / conseil.
- Désinfecter soigneusement l'extérieur du sac et retirez le cône de fermeture.
- Serrer une seringue de 50 ml sur la fiche du sac, lever la suspension cellulaire, et de le transférer à tubes de 50 ml.
- Centrifuger à 400 g pendant 10 min à température ambiante pour centrifuger les cellules.
- Aspirer le surnageant et mettre en commun les pastilles d'un sac dans 10 ml de RPMI-1640 + 10% FCS au total.
- Déterminer le nombre de cellules dans un hémocytomètre (1: 4 à 1: 10 dilution dans du bleu trypan). Compter que les grandes cellules rondes.
REMARQUE: Après la différenciation des macrophages dans des sacs en téflon FEP revêtues, il peut y avoir, par exemple les cellules résiduelles, des lymphocytes, selon le donneur et sur la qualité de l'isolement des monocytes. - Pour réutiliser les sacs FEP revêtus de Teflon, les laver deux fois avec 70% d'éthanol pour éliminer les cellules résiduelles. Remplissez-les avec 50 ml de 70% d'éthanol et incuber pendant la nuit. Lavez les sacs 3x avec du PBS stérile, les envelopper dans du papier de stérilisation, et stériliser dans un autoclave en utilisant des procédures standard.
REMARQUE: Les sacs de culture cellulaire peuvent être réutilisés plusieurs fois sans perte de rendement des macrophages. Cependant, nous avons décidé de jeter les sacs après 10 utilise avant qu'ils ne commencent à fuir. - Pour la suite des macrophages de la culture des expériences dans RPMI-1640 + 10% de FCS. Si les concentrations sériques plus faibles sont nécessaires, la culture dans un milieu RPMI-1640 avec 1% de FCS est également possible. Semences et les cellules incuber pendant 3-4 heures. Après cette période, noter que les macrophages se fixent à la surface de la culture cellulaire tout en platdes cellules contaminantes (par exemple les erythrocytes, les lymphocytes et les cellules dendritiques) restent en suspension. Laver les cellules deux fois au moins avec du PBS pour éliminer les cellules non-adhérentes.
- Pour détacher les macrophages en culture de la boîte de culture cellulaire pour d'autres expériences, grattez soigneusement les retirer de la surface. En variante, plats incuber pendant 20 minutes sur de la glace, aspirer le milieu de culture, et ajouter un tampon de dissociation cellulaire sans enzyme 1 ml. Après 5 min d'incubation à 37 ° C, ajouter 4 ml de PBS et les cellules par pipetage de haut en bas pour détacher au moins 3 min.
Résultats
La première centrifugation à gradient de densité en utilisant du Ficoll donne une interphase contenant les PBMC blanc (figure 1A) c'est à dire les lymphocytes et les monocytes. Ceci peut être confirmé par une coloration au May-Grünwald (figures 1B et C) des cellules recueillies, qui présente à la fois un noyau / cytoplasme de rapport élevé (typiquement des lymphocytes) et de haricot ou de noyaux en forme de bague (typique des monocytes). Lorsque ces cellules sont ensuite chargés sur un second gradient de densité à l'aide de Percoll, les monocytes peuvent encore être séparée des lymphocytes et apparaître à nouveau comme une interphase blanc (figures 1D-F). Pour chaque couche leuco-plaquettaire la centrifugation en gradient de densité double décrit donne régulièrement 150 ± 40 x 10 6 monocytes qui peuvent être différenciés à 70 ± 30 x 10 6 macrophages (figure 2) par couche leuco-plaquettaire. Le rendement moyen de macrophages20 préparations indépendants était de 47 ± 14% du total des monocytes isolés.
Après la centrifugation à gradient de Percoll il peut toujours y avoir des cellules monocytaires non résiduels présents dans la préparation, qui dépend de la collecte de sang, ainsi que sur la précision du procédé d'isolement. Toutefois, après la phase de différenciation de 6-7 jours, la préparation se compose principalement de macrophages matures (figure 3) qui peut être en outre enrichis en raison de leur adhérence à des surfaces en plastique, une caractéristique qui n'est pas partagée par les cellules contaminantes aléatoires (figures 4A et B). Une fois plaqué, la majorité des macrophages montrent un "oeuf sur le plat" morphologie classique bien qu'il existe également des cellules avec un phénotype broche étiré en forme (figures 4C et D). Cela se reflète par leur répartition F-actine dans le cytoplasme et adhérence grappes. Les cellules différenciéessont caractérisés par l'expression de CD45, CD14, CD16, CD206 (récepteur du mannose), CD11b et CD11c, qui sont des marqueurs typiques pour les macrophages matures (figure 5). La présence de CD11b plaide contre une différenciation dendritique qui est principalement supporté par le fait que les cellules sont négatives pour le marqueur CD209 dendritique des cellules (DC-SIGN).
Après le processus de différenciation des cellules restent fonctionnellement et métaboliquement active pendant environ 5-7 jours (figure 6), car il peut être visualisé par calcéine AM coloration et leur capacité à prendre des vésicules extracellulaires hangar de cellules tumorales. En outre, les cellules peuvent encore être activées, par exemple, comme illustré, pour la stimulation avec le lipopolysaccharide (LPS), ce qui conduit à l'expression de plusieurs gènes pro-inflammatoires (figure 7).

Figure 1: Aspect de la composition et PBMC- et monocytes-après couche double gradient de densité centrifugation. Photographie illustrant (A) de la bande de PBMC après le gradient de Ficoll et (D) la phase de monocytes après la centrifugation Percoll iso-osmotique. Colorations peut-Grünwald de préparations de cytospine de la (B, C) fraction de PBMC et le reste (E, F) monocytes. Barre d'échelle = 200 um en B et E, = 50 um dans C et F.

Figure 2: Rendement des monocytes et des macrophages. Comptages cellulaires représentatifs de monocytes et les macrophages isolés de 20 couche leucocytaire preparations.
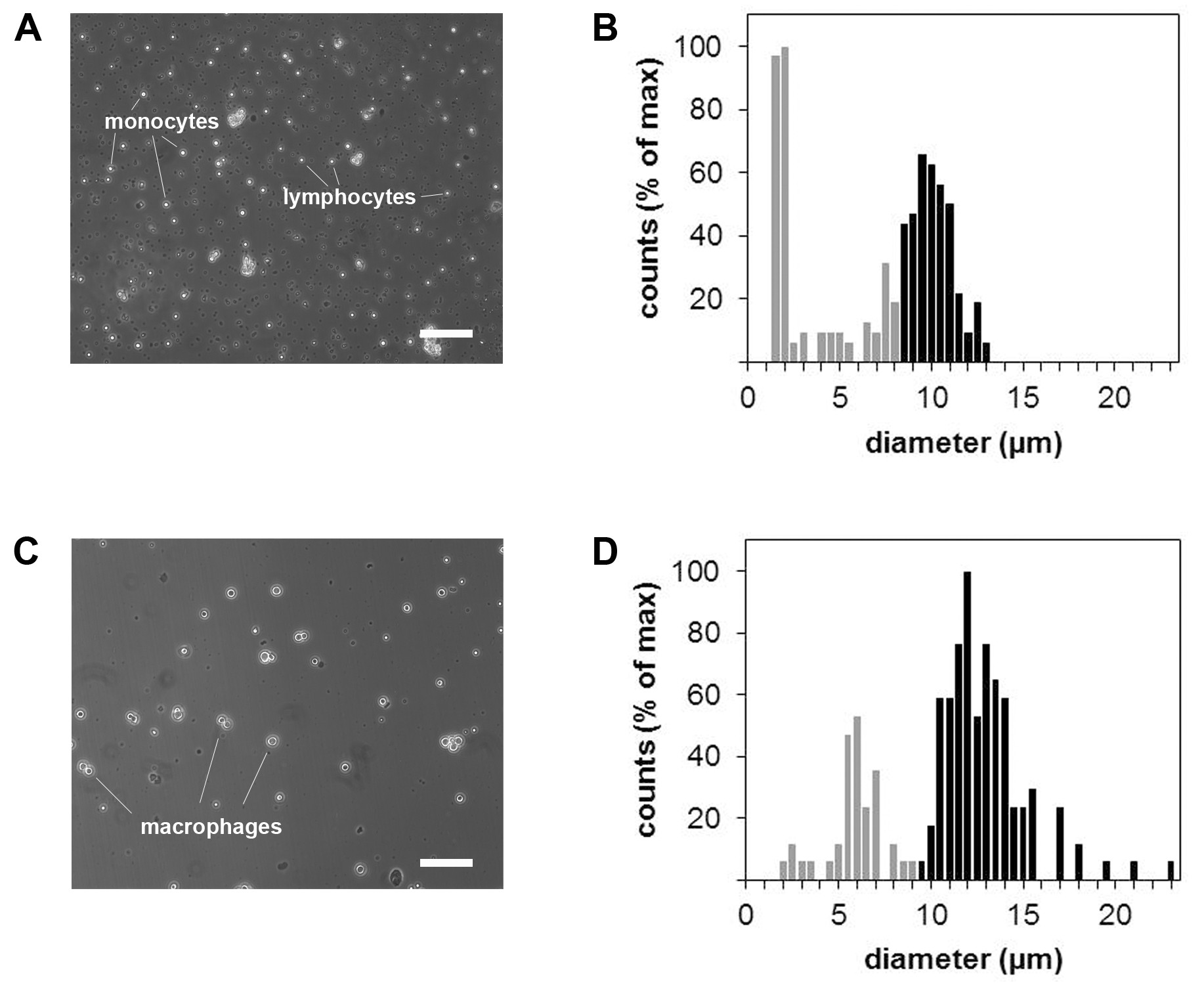
Figure 3: Micrographies et des mesures de la taille des cellules de monocytes et de macrophages. D'un microscope à contraste de phase de la suspension cellulaire monocytaire avant (A) et après (B) la différenciation des macrophages. Correspondants des histogrammes de la taille des cellules de monocytes (C) et (D) des macrophages. Barre d'échelle = 100 um.

Figure 4 La morphologie et l'organisation du cytosquelette de macrophages adhérents. Microscopie à contraste de phase de macrophages adhérents avant (A) et après (B) l'élimination des non-adherent cellules. (C, D) phalloïdine-TRITC coloration de l'actine filamenteuse dans adhérentes, des macrophages non stimulés. Barre d'échelle = 100 um dans AC, 20 pm D. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
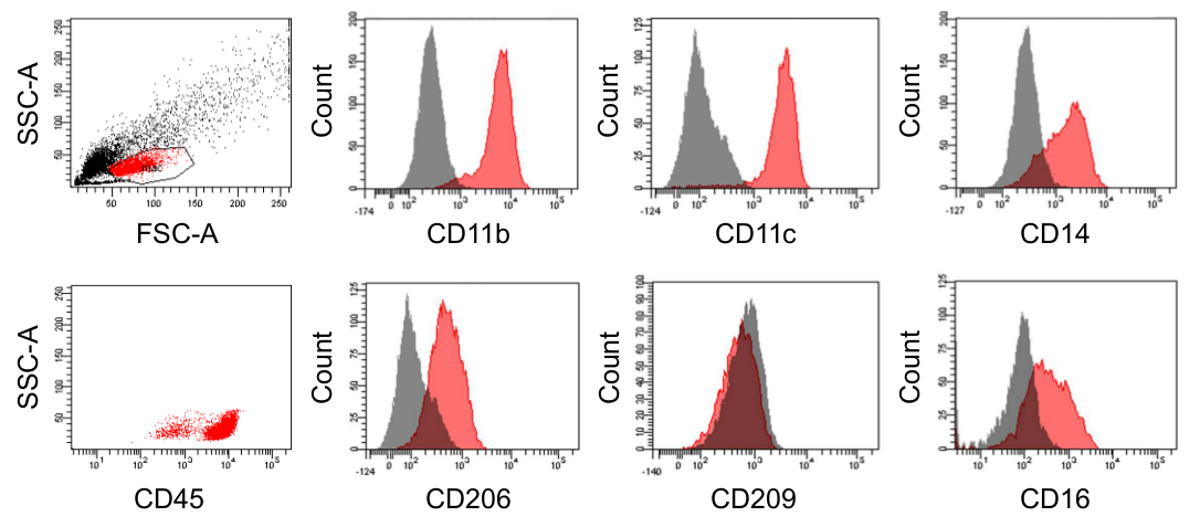
Figure 5 immunophénotype de macrophages différenciés. Analyse par cytométrie en flux de macrophages au bout de 6 jours de différenciation en Téflon FEP revêtues sacs de culture de cellules (en rouge). Les contrôles isotypiques correspondants sont affichés en gris. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
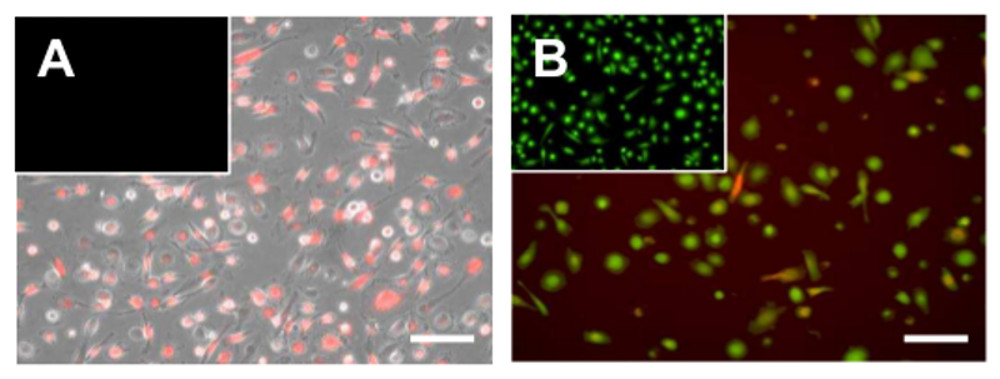
Figure 6 Absorption de microvésicules de cellules tumorales par les macrophages. Micrographies des macrophages adhérents après une exposition à des microvésicules dérivées de cellules à fluorescence (rouge) PKH26 tumorales marquées. Les images sont superposées à l'(A) fond clair correspondant ou (B) la coloration cytosolique avec la viabilité colorant calcéine AM. Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
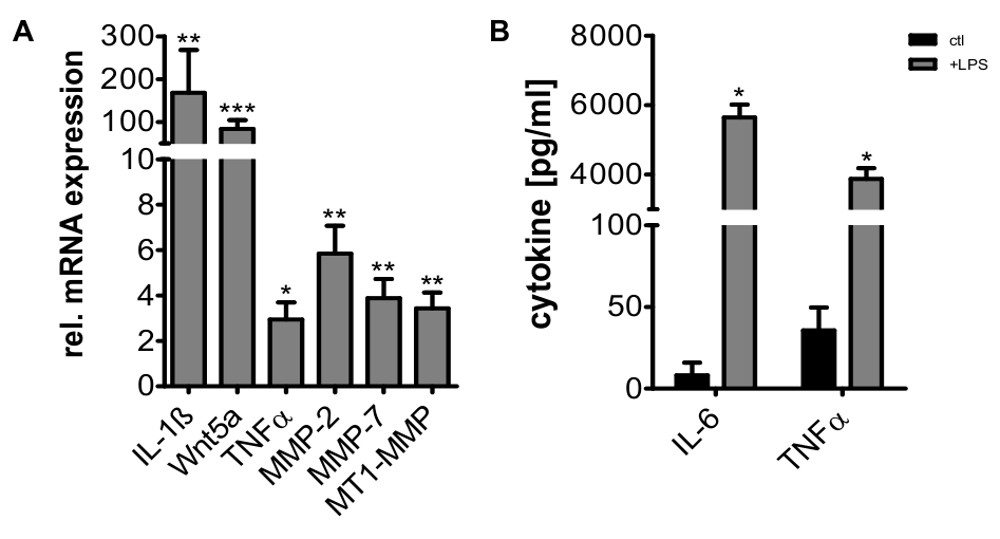
Figure 7 La régulation positive de l'IL-1 β, Wnt5a, TNFa, IL-6, la MMP-2, MMP-7, MMP-MT1 et après stimument des macrophages avec du LPS (100 ng / ml) pour l'expression de gènes 24 h. est mesurée par RT-PCR quantitative à partir des échantillons d'ARN total (A) et normalisée sur HPRT1 et GNB2L1 expression. Les valeurs indiquées sont des modifications fois par rapport au témoin non traité (moyenne ± SD, n = 5, * p <0,05, ** p <0,01, *** p <0,001). TNFa et IL-6 induction sous stimulation par le LPS ont été en outre confirmée par ELISA (B) (moyenne ± SD, * p <0,05).
Discussion
Les macrophages sont des cellules effectrices importantes du système immunitaire inné et afficher des fonctions importantes dans l'immunomodulation, présentation de l'antigène et de l'homéostasie tissulaire. En raison de leur plasticité remarquable, ils sont capables de répondre à différents stimuli et les variations de leur phénotype. Cependant, à ce jour un grand nombre de données concernant la polarisation des macrophages sont obtenus dans le système murin, bien qu'il existe des rapports indiquant que seulement environ 50% des marqueurs de macrophages de polarisation peut être directement traduite de souris à 16 humain. Par conséquent, nous présentons ici une méthode pour obtenir des macrophages humains primaires en nombre et en pureté suffisante sans avoir besoin de matériel coûteux, par exemple, des billes magnétiques MACS ou un dispositif d'élutriation centrifuge à contre-courant.
Notre procédé est basé sur l'isolement des monocytes à partir de cellules PBMC et leur différenciation en macrophages à la suite revêtu de téflon FEP sacs de culture de cellules en présence d'une faible concentrations de M-CSF 11-13. Bien que les monocytes constituent moins de 5 à 10% de leucocytes du sang périphérique chez l'homme, lors d'une stimulation de leur recrutement à des sites périphériques, où ils se différencient en macrophages tissulaires ou les cellules dendritiques résidentes 17. La cytokine M-CSF est importante pour la survie des monocytes et entraîne leur différenciation en macrophages 18,19. Jusqu'à présent, les concentrations de M-CSF qui ont été choisis pour la différenciation des monocytes allaient jusqu'à 100 ng / ml, cependant, dans notre protocole, nous sommes en mesure d'obtenir un nombre suffisant de macrophages matures avec une concentration de M-CSF de seulement 2,5 ng / ml 12 , 20. En outre, les cellules sont cultivées en Téflon FEP revêtues sacs de culture de cellules qui facilitent le décollement des macrophages et leur ensemencement subséquent du nombre de cellules définies. Etant donné que les sacs peuvent être réutilisés plusieurs fois, ce qui diminue encore les coûts pour le procédé d'isolement.
Les macrophages obtenus par cette procéduresont très positives pour CD45, CD14, CD11b, CD11c et montrer l'expression du CD206 récepteur mannose qui plaide pour une population de macrophages matures, purs 21,22. En particulier, l'expression élevée de CD14 est typique pour les macrophages différenciés en présence de M-CSF 23. Après l'ensemencement des cellules, ils présentent une adhérence rapide à des surfaces en plastique avec des cellules présentant une morphologie en forme de fuseau typique, alors que d'autres présentent un phénotype d'oeuf frit. Ceci est en accord avec les observations d'autres auteurs 18,22,24.
Il a été rapporté que la différenciation des monocytes en présence de M-CSF conduit à des macrophages M2 polarisés 16,25. Toutefois, les macrophages isolés par notre protocole sont encore en mesure de répondre à un large éventail de stimuli, y compris l'exposition à des microvésicules dérivées des cellules tumorales et la co-culture avec des cellules tumorales 26,27 exposition au LPS ou à laquelle elles réagissent avec l'induction de pro gènes inflammatoires telles que IL-1 et# 946 ;, TNFa, Wnt5a ou plusieurs métalloprotéinases matricielles qui sont considérés comme caractéristiques des macrophages M1 polarisés 3,5,28.
En conclusion, l'isolement des monocytes en double centrifugation à gradient de densité et la différenciation subséquente vers les macrophages en Téflon FEP revêtues culture cellulaire sacs résultats dans un grand nombre de macrophages sans la nécessité de procédures techniquement difficiles ou coûteux. Les macrophages obtenus peuvent être utilisés pour une analyse ultérieure allant d'activation classique à travers le LPS à la co-culture avec des cellules tumorales.
Déclarations de divulgation
Les auteurs n'ont rien à divulguer comme aucun conflit d'intérêt existe.
Remerciements
Les auteurs tiennent à remercier Mme Meike Schaffrinski pour elle toujours une excellente assistance technique au cours des dernières années.
Ce travail a été financé par le Conseil de recherches en allemand (DFG) dans le groupe de recherche conjoint 942 (FOR942) et par le Programme de recherche de la Faculté de médecine, Georg-Août-Université de Göttingen.
matériels
| Name | Company | Catalog Number | Comments |
| Antibodies for immunophenotyping | Beckman Coulter | for example: CD11c-PE (IM1760), CD45-FITC (7782), IgG1-PE isotype control (A07796), IgG1-FITC isotype control (A07795) | |
| BioLegends | for example: CD14-FITC (325603), CD206-PE (321105) | ||
| Axiovert 200M microscope | Zeiss | ||
| Calcein AM | AnaSpec | 89201 | |
| Combi-stopper closing cones | Braun | 4495101 | |
| 1x PBS, w/o Ca and Mg | Pan biotech | P04-36500 | for PBS-EDTA (1 mM) add 1 ml 0.5 M EDTA per 500 ml PBS |
| 10x PBS, w/o Ca and Mg | Invitrogen | 14200-067 | |
| EDTA (Titriplex III) | Merck | 1084211000 | prepare a 0.5 M solution in H2O, use a sterile filter |
| Cell dissociation buffer (enzyme-free, PBS-based) | Gibco | 13151-014 | |
| Fetal calf serum (FCS) | Invitrogen | 10091148 | heat-inactivated |
| Ficoll (density 1.077 g/ml) | Biochrom AG | L6115 | |
| FACSCanto II | BD Biosciences | ||
| Goat anti-mouse FITC | santa cruz | sc-2010 | |
| LPS from E.coli | Sigma | L8274 | final conc: 100 ng/ml |
| Multifuge 3 L-R | Heraeus | ||
| Penicillin/streptomycin | Biochrom AG | A2213 | |
| Percoll (density 1.131 g/ml) | GE Healthcare | 17-0891-02 | |
| Perfusor syringe 50 ml | Braun | 8728844F | |
| Phalloidin-TRITC | Sigma | P1951 | resuspend in methanol (c = 0.1 mg/ml) |
| [header] | |||
| Plastic disposable Pasteur pipettes | LVL technologies | 2655181 | |
| rh M-CSF | ImmunoTools | 11343117 | Resuspend in 500 µl sterile H2O (c = 100 ng/µl), aliquot |
| RPMI-1640 with phenol red | Gibco | 21875-034 | |
| RPMI-1640 without phenol red | Gibco | 11835-063 | |
| Sterilization paper | VP group | 3KFKFS230116 | |
| Trypan blue stain (0.4% w/v) | Sigma | T8154 | |
| FEP Teflon-coated cell culture bag, small | CellGenix | 72-C | |
| FEP Teflon-coated cell culture bag, large | CellGenix | 197-C | |
Références
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496, 445-455 (2013).
- Iwasaki, A., Medzhitov, R. Regulation of Adaptive Immunity by the Innate Immune System. Science. 327, 291-295 (2010).
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. J Clin Invest. 122, 787-795 (2012).
- Lionakis, M. S., et al. CX(3)CR1-dependent renal macrophage survival promotes Candida control and host survival. J Clin Invest. 123 (3), 5035-5051 (2013).
- Blumenthal, A., et al. The Wingless homolog, WNT5A and its receptor Frizzled-5 regulate inflammatory responses of human mononuclear cells induced by microbial stimulation. Blood. 108, 965-973 (2006).
- Lima, D. S., et al. Inflammasome-derived IL-1 beta production induces nitric oxide-mediated resistance to Leishmania. Nat Med. 19, 909-915 (2013).
- Pollard, J. W. Tumour-educated macrophages promote tumour progression and metastasis. Nat Rev Cancer. 4, 71-78 (2004).
- Subramanian, V., Ferrante, A. W. Jr Obesity, inflammation, and macrophages. Nestle Nutrition workshop series. Paediatric programme. 63, 151-159 (2009).
- Moore, K. J., Sheedy, F. J., Fisher, E. A. Macrophages in atherosclerosis: a dynamic balance. Nat Rev Immunol. 13, 709-721 (2013).
- Pradere, J. P., et al. Hepatic macrophages but not dendritic cells contribute to liver fibrosis by promoting the survival of activated hepatic stellate cells in mice. Hepatology. 58, 1461-1473 (2013).
- Danciger, J. S., et al. Method for large scale isolation, culture and cryopreservation of human monocytes suitable for chemotaxis, cellular adhesion assays, macrophage and dendritic cell differentiation. J Immunol Methods. 288, 123-134 (2004).
- Reiling, N., Blumenthal, A., Flad, H. D., Ernst, M., Ehlers, S. Mycobacteria-induced TNF-alpha and IL-10 formation by human macrophages is differentially regulated at the level of mitogen-activated protein kinase activity. J Immunol. 167, 3339-3345 (2001).
- Andreesen, R., Picht, J., Lohr, G. W. Primary Cultures of Human Blood-Borne Macrophages Grown on Hydrophobic Teflon Membranes. J Immunol Methods. 56, 295-304 (1983).
- van der Meer, J. W., et al. Culture of human bone marrow in the teflon culture bag: identification of the human monoblast. Journal of the Reticuloendothelial Society. 32, 355-369 (1982).
- van der Meer, J. W., et al. Characteristics of human monocytes cultured in the Teflon culture bag. Immunology. 47, 617-625 (1982).
- Martinez, F. O., Gordon, S., Locati, M., Mantovani, A. Transcriptional profiling of the human monocyte-to-macrophage differentiation and polarization: New molecules and patterns of gene expression. J Immunol. 177, 7303-7311 (2006).
- Gordon, S., Taylor, P. R. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 5, 953-964 (2005).
- Hashimoto, S., Yamada, M., Motoyoshi, K., Akagawa, K. S. Enhancement of macrophage colony-stimulating factor-induced growth and differentiation of human monocytes by interleukin-10. Blood. 89, 315-321 (1997).
- Tushinski, R. J., et al. Survival of Mononuclear Phagocytes Depends on a Lineage-Specific Growth-Factor That the Differentiated Cells Selectively Destroy. Cell. 28, 71-81 (1982).
- Rietkotter, E., et al. Zoledronic acid inhibits macrophage/microglia-assisted breast cancer cell invasion. Oncotarget. 4, 1449-1460 (2013).
- Pilling, D., Fan, T., Huang, D., Kaul, B., Gomer, R. H. Identification of Markers that Distinguish Monocyte-Derived Fibrocytes from Monocytes, Macrophages, and Fibroblasts. Plos One. 4, E7475(2009).
- Rey-Giraud, F., Hafner, M., Ries, C. H. In vitro generation of monocyte-derived macrophages under serum-free conditions improves their tumor promoting functions. Plos One. 7, e42656(2012).
- Waldo, S. W., et al. Heterogeneity of human macrophages in culture and in atherosclerotic plaques. Am J Pathol. 172, 1112-1126 (2008).
- Chernykh, E. R., et al. The generation and properties of human M2-like macrophages: potential candidates for CNS repair? Cell Ther Transplant. 2, (2010).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences of the United States of America. 101, 4560-4565 (2004).
- Pukrop, T., et al. Wnt 5a signaling is critical for macrophage-induced invasion of breast cancer cell lines. Proceedings of the National Academy of Sciences of the United States of America. 103, 5454-5459 (2006).
- Hagemann, T., et al. Macrophages induce invasiveness of epithelial cancer cells via NF-kappa B and JNK. J Immunol. 175, 1197-1205 (2005).
- Pereira, C., Schaer, D. J., Bachli, E. B., Kurrer, M. O., Schoedon, G. Wnt5A/CaMKII signaling contributes to the inflammatory response of macrophages and is a target for the antiinflammatory action of activated protein C and interleukin-10. Arterioscl Throm Vas. 28, 504-510 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon