Method Article
Isolamento di monociti umani con un doppio centrifugazione in gradiente e la loro differenziazione a macrofagi in coltura cellulare Borse teflonato
In questo articolo
Riepilogo
Presentiamo un protocollo semplice ed efficiente per la generazione di macrofagi umani. Buffy coats sono trattati con doppia centrifugazione in gradiente di densità e monociti isolati sono poi differenziate a macrofagi in sacchi di coltura cellulare teflonato. Questo massimizza i rendimenti macrofagi e facilita la raccolta di cellule per esperimenti successivi.
Abstract
Macrofagi umani sono coinvolti in una miriade di processi patologici che vanno dalle malattie infettive al cancro. Così essi rappresentano un valido strumento per comprendere i meccanismi alla base di queste malattie. Pertanto presentiamo un protocollo semplice per l'isolamento di monociti umani da buffy coat, seguita da una procedura di differenziazione che si traduce in rese elevate macrofagi. La tecnica si basa principalmente su apparecchiature di laboratorio comunemente disponibili e, quindi, fornisce un modo conveniente e tempo effettivo di ottenere grandi quantità di macrofagi umani. Brevemente, buffy coat di donatori di sangue sani sono sottoposti ad un doppio gradiente di densità centrifugazione per raccogliere monociti dal sangue periferico. Questi monociti sono poi coltivate in fluorurati etilene propilene (FEP) teflonato borse di colture cellulari in presenza di macrofagi fattore stimolante le colonie (M-CSF). I macrofagi differenziati possono essere facilmente raccolti e utilizzati per successivi studi e funzionaledice. Metodi importanti per il controllo della qualità e la convalida dei passi isolamento e la differenziazione verranno evidenziate all'interno del protocollo. In sintesi, il protocollo qui descritto consente agli scienziati di isolare routine e riproducibile macrofagi umani senza la necessità di utensili cost intensiva. Inoltre, modelli di malattia possono essere studiati in un sistema umano singenico eludere l'uso di macrofagi murini.
Introduzione
Le cellule del lignaggio monociti e loro terminalmente differenziate derivati - macrofagi - mostrano una plasticità sorprendente in relazione alla loro funzione biologica, che porta alla loro coinvolgimento in tali processi diversi come lo sviluppo, la riparazione dei tessuti, e l'immunità 1. Quest'ultima è dovuta alla loro fagocitosi e la capacità presentanti l'antigene che pone i macrofagi al crocevia tra la risposta immunitaria innata e adattiva 2. Tuttavia, la loro capacità di secernere citochine, chemochine, fattori di crescita e altre molecole di segnalazione 1 aumenta non solo la loro funzione immuno-modulante, ma serve anche come base per le loro funzioni aggiuntive. I tentativi di rispecchiare questi passaggi di attivazione diversi nel contesto di non-microbiche condizioni mediate hanno provocato la M1 e M2 categorie 3. Anche se questa classificazione non è completa, permette una comprensione di base di biologia dei macrofagi.
A causa di queste capacità poliedriche si tratta come nessuna sorpresa che i macrofagi sono associati a molte condizioni che in qualche modo coinvolgono rimodellamento tissutale o infiammazione. Accanto al loro ruolo fondamentale nel riconoscimento e liquidazione dei patogeni invasori 4-6, i macrofagi hanno dato ampio risalto in aterosclerosi, fibrosi, obesità, cancro e 7-10. Un metodo riproducibile per la generazione di macrofagi umani è pertanto essenziale per la comprensione di queste patologie. Presentiamo qui un metodo basato sull'isolamento di monociti umani da sangue periferico di donatori sani da una doppia tecnica di centrifugazione in gradiente di densità come descritto in precedenza 11. Per facilitare la differenziazione verso macrofagi, le cellule monociti isolati vengono incubate in presenza di basse concentrazioni di M-CSF e siero umano normale 12. Per facilitare ulteriormente la movimentazione e la raccolta delle cellule, differenziazione avviene in gas permeabile FEPBorse di coltura cellulare in teflon rivestito con una superficie idrofoba 12-15. Le risultanti macrofagi riposo possono essere sottoposti ad una vasta gamma di analisi in quanto sono ancora in grado di rispondere in maniera sia M1 o M2-like. Metodi alternativi di isolamento monociti e la successiva differenziazione quali magnetica delle cellule attivate smistamento (MACS) o controcorrente elutriazione centrifuga (CCE) hanno alcune limitazioni per quanto riguarda la resa, costi e tempi necessari. Il protocollo qui descritto offre il vantaggio di poter essere effettuata con apparecchiature di laboratorio standard senza la necessità di reagenti speciali (per esempio, MACS sfere magnetiche) o dispositivi (ad esempio, apparecchi CCE) e permette l'elaborazione di grandi quantità di cellule.
Protocollo
1 Preparazione del Sterile umano AB Serum
- Raccogliere 4-5 sacchetti di plasma fresco congelato (FFP). Conservare borse a -20 ° C fino a quando sono stati raccolti abbastanza borse.
- Scongelare borse e incubare per 30 minuti a 56 ° C in un bagno d'acqua per inattivare il complemento e rimuovere fibrina.
- Disinfettare accuratamente l'esterno dei sacchi e trasferire il plasma a provette da 50 ml.
- Centrifugare a 3000 xg per 15 minuti a temperatura ambiente per sbarazzarsi di precipitati e piastrine residue.
- Piscina tutto surnatanti e scartare il pellet.
- Campioni di siero aliquota in provette da 15 ml e conservare a -20 ° C.
NOTA: In alternativa, normale siero umano AB inattivato al calore disponibile in commercio può essere utilizzato.
2 Isolamento dei monociti
Per facilitare il bilanciamento della centrifuga, si raccomanda di elaborare due buffy coats in parallelo. Tuttavia, prendere cari di utilizzare materiali diversi per ogni donatore e non mescolare le cellule. In caso buffy coats non possono essere ottenuti facilmente, 400 ml di sangue periferico in eparina possono essere utilizzati al posto.
- Disinfettare accuratamente i sacchetti di plastica contenenti le buffy coats e trasferire il contenuto di ogni buffy coat a due tubi da 50 ml.
- Per ogni buffy coat riempire tre provette da 50 ml con 15 ml di soluzione Ficoll (1.077 g / ml). Il Ficoll deve essere a temperatura ambiente per la preparazione.
- Strato 30-35 ml di sangue buffy coat sul top della soluzione Ficoll per primo gradiente di densità. Fare attenzione a farlo lentamente e con attenzione al fine di evitare la miscelazione entrambi gli strati.
- Centrifugare a 400 xg senza freno per 30 min a temperatura ambiente.
- Per ogni sfumatura raccogliere l'anello bianco di cellule mononucleari del sangue periferico (PBMC) che si trova tra le due fasi con una pipetta Pasteur di plastica e trasferimento in un tubo da 50 ml.
- Riempire ogni tubo con PBS-EDTA (1 mM) fino a 40 ml in totale.
- Centrifugare a 300 xg per 10 min senza freno a temperatura ambiente.
- Aspirare il surnatante e lavare di nuovo pellet con 40 ml di PBS-EDTA (1 mM).
- Per ciascun pool di donatori i pellet in 20 ml di RPMI-1640 senza rosso fenolo + 10% FCS.
- Preparare la soluzione di Percoll iso-osmotica per il secondo gradiente di densità: Per due donatori mescolano 23,13 ml di soluzione di Percoll (densità 1,131 g / ml) in una provetta da 50 ml con 1,87 ml di 10 volte PBS. Poi trasferire 23 ml di questa soluzione in un tubo da 50 ml e aggiungere 27 ml di RPMI-1640 con rosso fenolo + 10% FCS per ottenere una soluzione 46% iso-osmotica Percoll. Il Percoll deve essere a temperatura ambiente per la preparazione.
- Per ogni trasferimento donatore 25 ml della soluzione preparata Percoll in una provetta da 50 ml e sovrapporre la soluzione preparata in PBMC 2.9) sulla parte superiore della soluzione Percoll. Fare attenzione a fare questo molto lentamente und attentamente, entrambi gli strati tendono a mescolare facilmente. Se fatto correttamente le due fasi possono essere distinte a causa della loro differenza di colore.
- Centrifugare a 550 xg senza freno per 30 min a temperatura ambiente.
- Per ogni sfumatura raccogliere l'anello bianco di monociti che si trova tra le due fasi con una pipetta Pasteur di plastica e trasferimento in un tubo da 50 ml.
- Riempire ogni tubo con PBS-EDTA (1 mM) fino a 50 ml in totale.
- Centrifugare a 400 xg per 10 min senza freno a temperatura ambiente.
- Aspirare il surnatante e risospendere il pellet in 20 ml di RPMI-1640 con rosso fenolo + 10% FCS.
3. differenziazione dei monociti a macrofagi
- Determinare il numero di monociti isolati in una diluizione 1:10 in blu trypan. Contare solo i grandi, cellule a forma irregolare, spesso, che sono monociti. Non contare le cellule più piccole, di forma rotonda, che sono i linfociti.
NOTA: numeri monociti non devono essere determinate con precisione anche perché solo dare un suggerimento a quanti e quali FEP rivestiti in teflon borse (piccole o grandi) devono essere utilizzati per la differenziazione delle cellule. - Per 1,0-1,5 x 10 8 monociti provenienti da un donatore, seminare le cellule in un sacchetto di coltura cellulare grande FEP rivestito di Teflon. Per ogni borsa preparare il terreno di coltura costituito da 174 ml di RPMI-1640, siero umano AB 2% (come preparato al punto 1), 1% di penicillina / streptomicina, e 2,5 ng / ml M-CSF (volume totale: 180 ml).
- Per 3,0-5,0 x 10 7 monociti provenienti da un donatore, seminare le cellule in un piccolo sacchetto di coltura cellulare rivestita in teflon. Per ogni borsa preparare il terreno di coltura costituito da 28,5 ml RPMI-1640, siero umano AB 2% (come preparato al punto 1), 1% di penicillina / streptomicina, e 2,5 ng / ml M-CSF (volume totale: 30 ml).
NOTA: Se per esempio, 8,0 x 10 7 monociti sono ottenuti, si consiglia di loro seme in two borse di volume più piccoli con 4,0 x 10 7 cellule ciascuno. Invece di M-CSF, monociti possono in alternativa essere differenziati con granulociti e macrofagi fattore stimolante le colonie (GM-CSF) alla stessa concentrazione (2,5 ng / ml).
- Per 3,0-5,0 x 10 7 monociti provenienti da un donatore, seminare le cellule in un piccolo sacchetto di coltura cellulare rivestita in teflon. Per ogni borsa preparare il terreno di coltura costituito da 28,5 ml RPMI-1640, siero umano AB 2% (come preparato al punto 1), 1% di penicillina / streptomicina, e 2,5 ng / ml M-CSF (volume totale: 30 ml).
- Aggiungere la sospensione cellulare (20 ml) al mezzo preparato e miscelare accuratamente. Se due borse sono preparati da un donatore, aggiungere 20 ml di RPMI-1640 alla sospensione cellulare e poi aggiungere metà della sospensione di ciascun preparato medie.
- Opzionale: Per determinare se la preparazione dei monociti è rimasta sterile, strappare una goccia di sospensione cellulare su una piastra di agar sangue ed incubare per tutta la notte a 37 ° C.
- Serrare il fodero di un 50 ml perfusione sul tappo della borsa coltura cellulare FEP rivestito di teflon e riempirlo con la sospensione cellulare preparata.
- Scollegare la siringa e spingere l'aria residua dal sacchetto. Chiudere il sacchetto con un cono di chiusura.
- Incubare le borse per 6-7 giorni a 3776, C con il 5% di CO 2.
4. Macrofagi Harvest
- Mettere i sacchetti di coltura cellulare FEP rivestiti in teflon con i macrofagi differenziati in ghiaccio per almeno 1 ora per facilitare il distacco delle cellule (un'incubazione fino a 3 ore è possibile). Assicurarsi che tutta la superficie del sacchetto è ricoperto di ghiaccio.
- Estrarre il sacchetto con una minima pressione 10x sopra il bordo di una scrivania / bordo.
- Disinfettare accuratamente la parte esterna del sacchetto e rimuovere il cono di chiusura.
- Serrare una siringa da 50 ml sul tappo della borsa, rimuovere la sospensione cellulare, e trasferirla a 50 mL.
- Centrifugare a 400 xg per 10 min a temperatura ambiente per centrifugare le cellule.
- Aspirare il surnatante e piscina il pellet da un sacchetto in 10 ml di RPMI-1640 + 10% FCS in totale.
- Determinare il numero di cellule in un emocitometro (1: 4-1: 10 diluizione in blu trypan). Contare Solo le cellule rotonde grandi.
NOTA: Dopo differenziare i macrofagi nei sacchi FEP rivestiti in teflon, ci possono essere cellule residue ad esempio, linfociti, a seconda del donatore e la qualità dell'isolamento monociti. - Per riutilizzare i sacchetti FEP rivestiti in teflon, lavarli due volte con etanolo al 70% per rimuovere le cellule residue. Riempire con 50 ml di etanolo al 70% e incubare una notte. Lavare le borse 3x con PBS sterile, li avvolgono in carta sterilizzazione, e sterilizzare in autoclave utilizzando procedure standard.
NOTA: Le borse di coltura cellulare possono essere riutilizzati più volte senza alcuna perdita dei rendimenti macrofagi. Tuttavia, abbiamo deciso di eliminare le borse dopo 10 utilizzi prima di iniziare a perdere. - Per le successive macrofagi cultura esperimenti in RPMI-1640 + 10% FCS. Se sono necessarie concentrazioni sieriche inferiori, coltura in RPMI-1640 con 1% FCS è anche possibile. Seed e le cellule incubare per 3-4 ore. Dopo questo periodo, si noti che i macrofagi attaccano alla superficie della coltura cellulare piatto mentreeventuali cellule contaminanti (cioè eritrociti, linfociti e cellule dendritiche) rimangono in sospensione. Lavare le cellule almeno due volte con PBS per rimuovere le cellule non aderenti.
- Per staccare macrofagi in coltura dal piatto di coltura cellulare per ulteriori esperimenti, li raschiare accuratamente dalla superficie. In alternativa, incubare piatti per 20 min in ghiaccio, aspirare il terreno di coltura, e aggiungere 1 ml di tampone di dissociazione cella-enzima. Dopo 5 minuti di incubazione a 37 ° C, aggiungere 4 ml di PBS, e staccare le cellule pipettando su e giù per almeno 3 minuti.
Risultati
La prima centrifugazione in gradiente di densità con Ficoll produce un interfase bianco contenente il PBMC (Figura 1A) cioè linfociti e monociti. Questo può essere confermato attraverso una colorazione May-Gruenwald (Figure 1B e C) delle cellule raccolte, che mostra sia un alto nucleo / citoplasma rapporto (tipici dei linfociti) e bean- o nuclei a forma di anello (tipica dei monociti). Quando queste cellule vengono poi caricati su un secondo gradiente di densità utilizzando Percoll, i monociti possono essere ulteriormente separati dai linfociti e ancora apparire come un interfase bianco (Figure 1D-F). Per ogni mano buffy l'descritta doppia densità centrifugazione in gradiente produce ordinariamente 150 ± 40 x 10 6 monociti, che possono essere differenziati a 70 ± 30 x 10 6 macrofagi (Figura 2) per buffy coat. La resa media da macrofagi20 preparazioni indipendenti era 47 ± 14% del totale dei monociti isolati.
Dopo la centrifugazione in gradiente di Percoll ci potrebbe essere ancora alcune cellule non monocitica residui presenti nel preparato che dipende il donatore di sangue, nonché sulla precisione del processo di isolamento. Tuttavia, dopo la fase di differenziazione di 6-7 giorni, la preparazione è costituito principalmente da macrofagi maturi (Figura 3) che possono essere ulteriormente arricchiti grazie alla loro aderenza alle superfici di plastica, una caratteristica che non è condivisa dalle cellule contaminanti casuali (Figure 4A e B). Una volta placcato, la maggior parte dei macrofagi mostrano un classico "uovo fritto" morfologia mentre ci sono anche cellule con un fenotipo mandrino allungato simile (Figure 4C e D). Questo si riflette nel loro distribuzione F-actina all'interno del citoplasma e adesione cluster. Le cellule differenziatesi caratterizzano per l'espressione di CD45, CD14, CD16, CD206 (recettore del mannosio), CD11b e CD11c che sono i marcatori tipici di macrofagi maturi (Figura 5). La presenza di CD11b argomenta contro una differenziazione prevalentemente dendritico che è supportato dal fatto che le cellule sono negative per il marcatore CD209 cellule dendritiche (DC-SIGN).
Dopo il processo di differenziazione le cellule rimangono funzionalmente e metabolicamente attiva per circa 5-7 giorni (Figura 6), in quanto può essere visualizzato da calceina AM colorazione e la loro capacità di prendere vescicole extracellulari versato dalle cellule tumorali. Inoltre, le cellule possono ancora essere attivati come mostrato ad esempio, per la stimolazione con lipopolisaccaride (LPS) che comporta l'espressione di diversi geni pro-infiammatori (Figura 7).

Figura 1 Aspetto e composizione del PBMC- e monociti-strato dopo gradiente di doppia densità centrifugazione. Fotografia che illustra (A) il PBMC-band dopo il gradiente Ficoll e (D) la monociti-fase dopo l'iso-osmotica Percoll centrifugazione. May-Gruenwald colorazioni di preparati cytospin di (B, C) Frazione PBMC e per il restante (E, F) monociti. Barra della scala = 200 micron di B ed E, = 50 micron di C e F.

Figura 2 Resa dei monociti e macrofagi. Conteggi cellulari rappresentativi di monociti e macrofagi isolati di 20 buffy coat preparations.
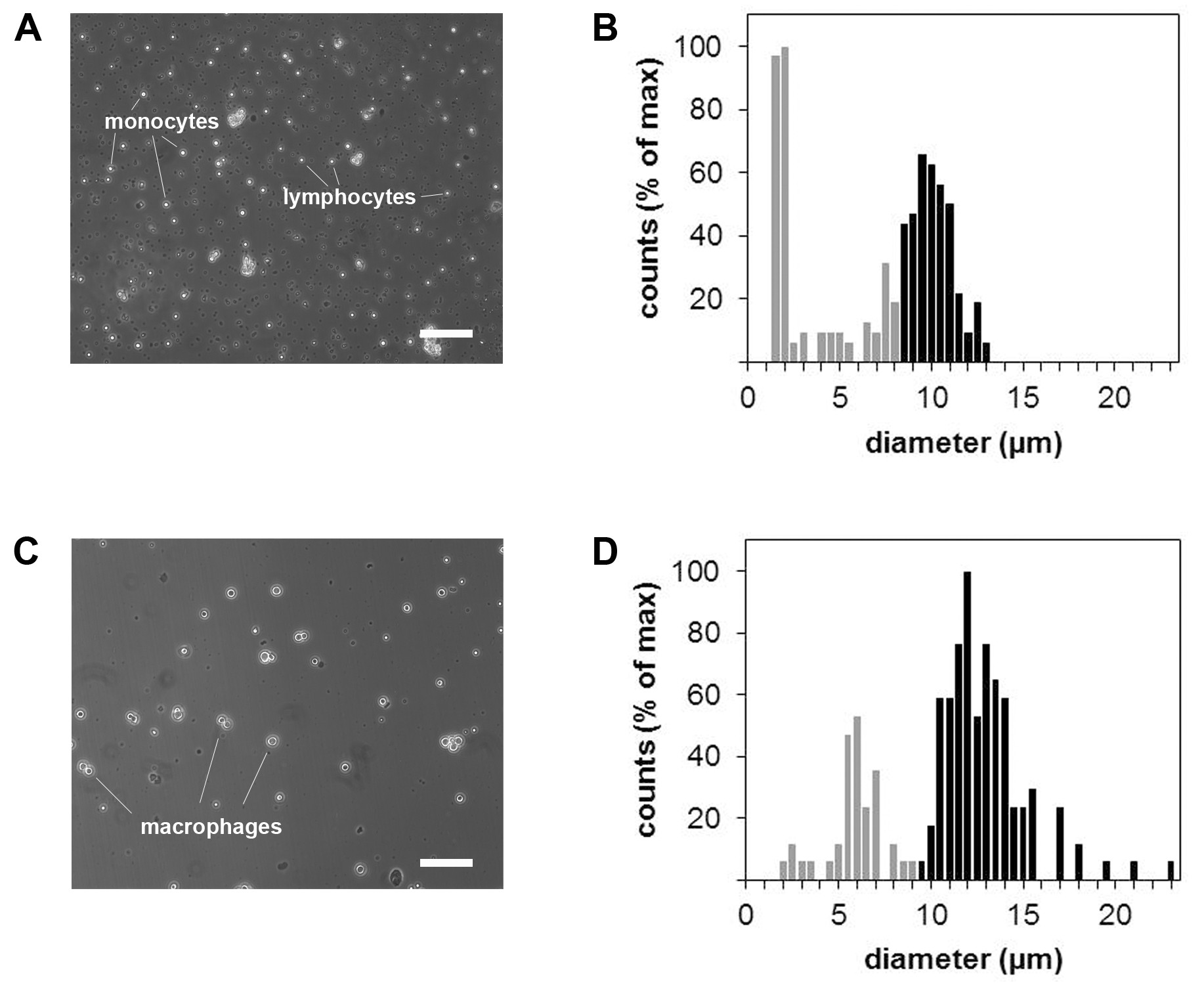
Figura 3. Micrografie e misurazione delle dimensioni delle cellule di monociti e macrofagi. Microscopio a contrasto di fase di sospensione cellulare monocitica prima (A) e dopo (B) differenziazione dei macrofagi. Corrispondenti istogrammi dimensioni delle cellule di monociti (C) e macrofagi (D). Barra della scala = 100 micron.

Figura 4 Morfologia e l'organizzazione del citoscheletro dei macrofagi aderenti. Microscopio a contrasto di fase dei macrofagi aderenti prima (A) e dopo (B) rimozione delle non-adherencellule T. (C, D) falloidina-TRITC colorazione di actina filamentosa in aderenti, macrofagi non stimolati. Barra della scala = 100 micron in AC, 20 micron di D. Si prega di cliccare qui per vedere una versione più grande di questa figura.
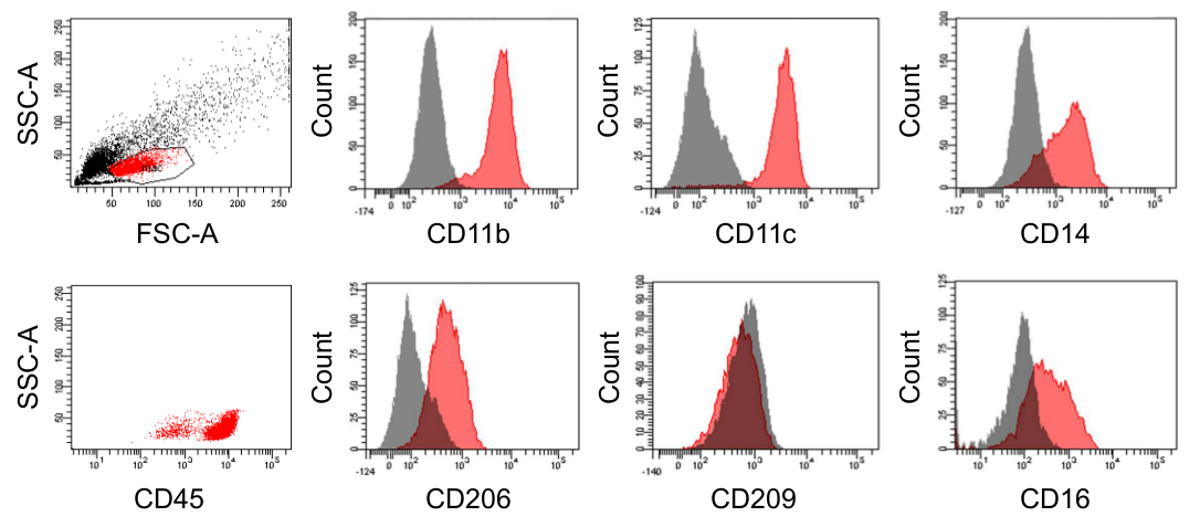
Figura 5 Immunofenotipo di macrofagi differenziati. Citometria a flusso analisi dei macrofagi dopo 6 giorni di differenziazione in FEP rivestiti in teflon sacchetti di colture cellulari (indicata in rosso). I relativi controlli isotipici sono mostrati in grigio. Cliccate qui per vedere una versione più grande di questa figura.
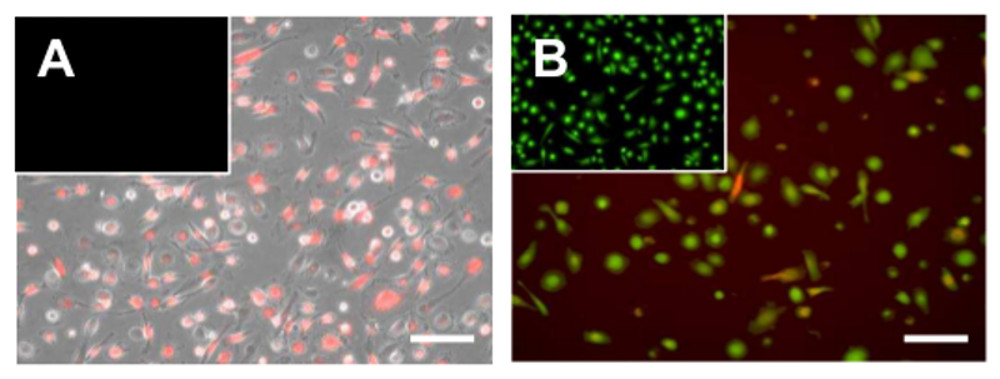
Figura 6 La diffusione delle microvescicole cellulari tumorali da parte dei macrofagi. Micrografie di macrofagi aderenti a seguito di esposizione a PKH26-etichettati microvescicole derivati dalle cellule (rosso fluorescente) tumorali. Le immagini vengono sovrapposti alla corrispondente (A) campo chiaro o (B) colorazione citoplasmatica con l'AM vitalità colorante calceina. Bar scale = 100 micron. Cliccare qui per visualizzare una versione più grande di questa figura.
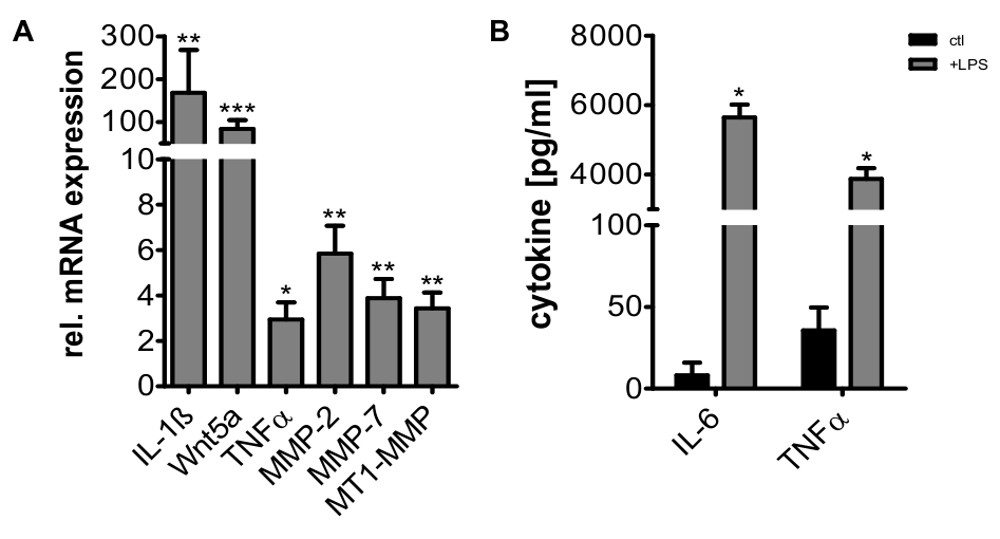
Figura 7 Upregulation di IL-1 β, Wnt5a, TNFa, IL-6, MMP-2, MMP-7, e MT1-MMP dopo stimuzione dei macrofagi con LPS (100 ng / ml) per 24 ore. L'espressione genica è stata misurata mediante RT-PCR quantitativa di campioni di RNA totale (A) e normalizzato sull'espressione HPRT1 e GNB2L1. I valori indicati sono cambiamenti volte rispetto al controllo non trattato (significa ± SD, n = 5, * p <0.05, ** p <0.01, *** p <0.001). TNFa e IL-6 induzione sotto stimolazione con LPS sono stati ulteriormente confermata mediante ELISA (B) (media ± SD, * p <0,05).
Discussione
I macrofagi sono importanti cellule effettrici del sistema immunitario innato e visualizzare funzioni importanti nel immunomodulazione, presentazione dell'antigene e l'omeostasi tissutale. Grazie alla loro notevole plasticità, sono in grado di rispondere a stimoli diversi con variazioni del loro fenotipo. Tuttavia, finora molti dati riguardanti macrofagi polarizzazione si ottengono nel sistema murino, anche se ci sono rapporti che mostrano che solo circa il 50% dei marcatori di polarizzazione dei macrofagi può essere tradotto direttamente dal mouse umana 16. Pertanto, presentiamo qui un metodo per ottenere macrofagi umani primari in numero e purezza sufficiente senza la necessità di materiali costosi, ad esempio, MACS biglie magnetiche o un dispositivo elutriazione centrifuga controcorrente.
Sacchi di coltura cellulare nostro metodo si basa sul l'isolamento di monociti da PBMC e la loro successiva differenziazione di macrofagi nel FEP teflonato in presenza di bassa concentrations di M-CSF 11-13. Mentre monociti costituiscono meno del 5 al 10% dei leucociti del sangue periferico negli esseri umani, in seguito a stimolazione vengono reclutati per siti periferici dove si differenziano a macrofagi tissutali residenti o cellule dendritiche 17. La citochina M-CSF è importante per la sopravvivenza dei monociti e guida la loro differenziazione a macrofagi 18,19. Finora, le concentrazioni M-CSF, che sono stati scelti per la differenziazione dei monociti variava fino a 100 ng / ml, però, nel nostro protocollo, siamo in grado di ottenere un numero sufficiente di macrofagi maturi con una concentrazione M-CSF di soli 2,5 ng / ml 12 , 20. Inoltre, le cellule sono coltivate in FEP rivestiti in teflon sacchi di coltura cellulare che facilitano il distacco dei macrofagi e la loro successiva semina nel numero di cellule definite. Poiché i sacchetti possono essere riutilizzati più volte, ciò riduce ulteriormente i costi per il processo di isolamento.
I macrofagi ottenuti con tale procedurasono molto positivo per CD45, CD14, CD11b, CD11c e mostra espressione del CD206 recettore del mannosio, che sostiene la necessità di una popolazione di puri, macrofagi maturi 21,22. Particolarmente elevata espressione CD14 è tipico di macrofagi differenziati in presenza di M-CSF 23. Dopo la semina delle cellule, mostrano un facile aderenza alle superfici di plastica con alcune cellule mostrano una tipica morfologia mandrino-simili, mentre altri mostrano un fenotipo uovo fritto. Ciò è in accordo con le osservazioni da altri autori 18,22,24.
E 'stato riferito che la differenziazione dei monociti in presenza di M-CSF porta a macrofagi M2-polarizzati 16,25. Tuttavia, i macrofagi isolati dal nostro protocollo sono ancora in grado di rispondere ad una vasta gamma di stimoli, tra cui l'esposizione a microvescicole derivati dalle cellule tumorali e di co-coltura con cellule tumorali 26,27 o l'esposizione a LPS a cui reagiscono con induzione di pro geni infiammatorie come IL-1 &# 946 ;, TNFa, Wnt5a, o varie metalloproteinasi della matrice che sono considerati tipici per i macrofagi M1-polarizzati 3,5,28.
In conclusione, l'isolamento di monociti di doppio gradiente di densità centrifugazione e successiva differenziazione verso macrofagi in FEP rivestiti in teflon coltura cellulare sacchetti risultati in un alto numero di macrofagi, senza la necessità di procedure tecnicamente difficile o costoso. I macrofagi ottenuti possono essere utilizzati per la successiva analisi vanno dalla classica attivazione tramite LPS alla co-coltura con cellule tumorali.
Divulgazioni
Gli autori non hanno nulla da rivelare in quanto non esiste alcun conflitto di interessi.
Riconoscimenti
Gli autori desiderano ringraziare la signora Meike Schaffrinski per lei sempre eccellente assistenza tecnica durante gli ultimi anni.
Questo lavoro è stato finanziato attraverso il Consiglio tedesco per la ricerca (DFG) all'interno del gruppo di ricerca congiunto 942 (FOR942) e dal Programma di Ricerca della Facoltà di Medicina, Georg-August-Universität Göttingen.
Materiali
| Name | Company | Catalog Number | Comments |
| Antibodies for immunophenotyping | Beckman Coulter | for example: CD11c-PE (IM1760), CD45-FITC (7782), IgG1-PE isotype control (A07796), IgG1-FITC isotype control (A07795) | |
| BioLegends | for example: CD14-FITC (325603), CD206-PE (321105) | ||
| Axiovert 200M microscope | Zeiss | ||
| Calcein AM | AnaSpec | 89201 | |
| Combi-stopper closing cones | Braun | 4495101 | |
| 1x PBS, w/o Ca and Mg | Pan biotech | P04-36500 | for PBS-EDTA (1 mM) add 1 ml 0.5 M EDTA per 500 ml PBS |
| 10x PBS, w/o Ca and Mg | Invitrogen | 14200-067 | |
| EDTA (Titriplex III) | Merck | 1084211000 | prepare a 0.5 M solution in H2O, use a sterile filter |
| Cell dissociation buffer (enzyme-free, PBS-based) | Gibco | 13151-014 | |
| Fetal calf serum (FCS) | Invitrogen | 10091148 | heat-inactivated |
| Ficoll (density 1.077 g/ml) | Biochrom AG | L6115 | |
| FACSCanto II | BD Biosciences | ||
| Goat anti-mouse FITC | santa cruz | sc-2010 | |
| LPS from E.coli | Sigma | L8274 | final conc: 100 ng/ml |
| Multifuge 3 L-R | Heraeus | ||
| Penicillin/streptomycin | Biochrom AG | A2213 | |
| Percoll (density 1.131 g/ml) | GE Healthcare | 17-0891-02 | |
| Perfusor syringe 50 ml | Braun | 8728844F | |
| Phalloidin-TRITC | Sigma | P1951 | resuspend in methanol (c = 0.1 mg/ml) |
| [header] | |||
| Plastic disposable Pasteur pipettes | LVL technologies | 2655181 | |
| rh M-CSF | ImmunoTools | 11343117 | Resuspend in 500 µl sterile H2O (c = 100 ng/µl), aliquot |
| RPMI-1640 with phenol red | Gibco | 21875-034 | |
| RPMI-1640 without phenol red | Gibco | 11835-063 | |
| Sterilization paper | VP group | 3KFKFS230116 | |
| Trypan blue stain (0.4% w/v) | Sigma | T8154 | |
| FEP Teflon-coated cell culture bag, small | CellGenix | 72-C | |
| FEP Teflon-coated cell culture bag, large | CellGenix | 197-C | |
Riferimenti
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496, 445-455 (2013).
- Iwasaki, A., Medzhitov, R. Regulation of Adaptive Immunity by the Innate Immune System. Science. 327, 291-295 (2010).
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. J Clin Invest. 122, 787-795 (2012).
- Lionakis, M. S., et al. CX(3)CR1-dependent renal macrophage survival promotes Candida control and host survival. J Clin Invest. 123 (3), 5035-5051 (2013).
- Blumenthal, A., et al. The Wingless homolog, WNT5A and its receptor Frizzled-5 regulate inflammatory responses of human mononuclear cells induced by microbial stimulation. Blood. 108, 965-973 (2006).
- Lima, D. S., et al. Inflammasome-derived IL-1 beta production induces nitric oxide-mediated resistance to Leishmania. Nat Med. 19, 909-915 (2013).
- Pollard, J. W. Tumour-educated macrophages promote tumour progression and metastasis. Nat Rev Cancer. 4, 71-78 (2004).
- Subramanian, V., Ferrante, A. W. Jr Obesity, inflammation, and macrophages. Nestle Nutrition workshop series. Paediatric programme. 63, 151-159 (2009).
- Moore, K. J., Sheedy, F. J., Fisher, E. A. Macrophages in atherosclerosis: a dynamic balance. Nat Rev Immunol. 13, 709-721 (2013).
- Pradere, J. P., et al. Hepatic macrophages but not dendritic cells contribute to liver fibrosis by promoting the survival of activated hepatic stellate cells in mice. Hepatology. 58, 1461-1473 (2013).
- Danciger, J. S., et al. Method for large scale isolation, culture and cryopreservation of human monocytes suitable for chemotaxis, cellular adhesion assays, macrophage and dendritic cell differentiation. J Immunol Methods. 288, 123-134 (2004).
- Reiling, N., Blumenthal, A., Flad, H. D., Ernst, M., Ehlers, S. Mycobacteria-induced TNF-alpha and IL-10 formation by human macrophages is differentially regulated at the level of mitogen-activated protein kinase activity. J Immunol. 167, 3339-3345 (2001).
- Andreesen, R., Picht, J., Lohr, G. W. Primary Cultures of Human Blood-Borne Macrophages Grown on Hydrophobic Teflon Membranes. J Immunol Methods. 56, 295-304 (1983).
- van der Meer, J. W., et al. Culture of human bone marrow in the teflon culture bag: identification of the human monoblast. Journal of the Reticuloendothelial Society. 32, 355-369 (1982).
- van der Meer, J. W., et al. Characteristics of human monocytes cultured in the Teflon culture bag. Immunology. 47, 617-625 (1982).
- Martinez, F. O., Gordon, S., Locati, M., Mantovani, A. Transcriptional profiling of the human monocyte-to-macrophage differentiation and polarization: New molecules and patterns of gene expression. J Immunol. 177, 7303-7311 (2006).
- Gordon, S., Taylor, P. R. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 5, 953-964 (2005).
- Hashimoto, S., Yamada, M., Motoyoshi, K., Akagawa, K. S. Enhancement of macrophage colony-stimulating factor-induced growth and differentiation of human monocytes by interleukin-10. Blood. 89, 315-321 (1997).
- Tushinski, R. J., et al. Survival of Mononuclear Phagocytes Depends on a Lineage-Specific Growth-Factor That the Differentiated Cells Selectively Destroy. Cell. 28, 71-81 (1982).
- Rietkotter, E., et al. Zoledronic acid inhibits macrophage/microglia-assisted breast cancer cell invasion. Oncotarget. 4, 1449-1460 (2013).
- Pilling, D., Fan, T., Huang, D., Kaul, B., Gomer, R. H. Identification of Markers that Distinguish Monocyte-Derived Fibrocytes from Monocytes, Macrophages, and Fibroblasts. Plos One. 4, E7475(2009).
- Rey-Giraud, F., Hafner, M., Ries, C. H. In vitro generation of monocyte-derived macrophages under serum-free conditions improves their tumor promoting functions. Plos One. 7, e42656(2012).
- Waldo, S. W., et al. Heterogeneity of human macrophages in culture and in atherosclerotic plaques. Am J Pathol. 172, 1112-1126 (2008).
- Chernykh, E. R., et al. The generation and properties of human M2-like macrophages: potential candidates for CNS repair? Cell Ther Transplant. 2, (2010).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences of the United States of America. 101, 4560-4565 (2004).
- Pukrop, T., et al. Wnt 5a signaling is critical for macrophage-induced invasion of breast cancer cell lines. Proceedings of the National Academy of Sciences of the United States of America. 103, 5454-5459 (2006).
- Hagemann, T., et al. Macrophages induce invasiveness of epithelial cancer cells via NF-kappa B and JNK. J Immunol. 175, 1197-1205 (2005).
- Pereira, C., Schaer, D. J., Bachli, E. B., Kurrer, M. O., Schoedon, G. Wnt5A/CaMKII signaling contributes to the inflammatory response of macrophages and is a target for the antiinflammatory action of activated protein C and interleukin-10. Arterioscl Throm Vas. 28, 504-510 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon