Method Article
High Yield Reinigung von
In diesem Artikel
Zusammenfassung
Mess Antikörper Funktion ist der Schlüssel zum Verständnis Immunität gegen Plasmodium falciparum Malaria. Diese Methode beschreibt die Reinigung von lebensfähigen Merozoiten und Messung der Opsonisierung-abhängigen Phagozytose mittels Durchflusszytometrie.
Zusammenfassung
Plasmodium falciparum Merozoiten-Antigene sind in der Entwicklung als potentielle Malaria-Impfstoffen. Ein Aspekt der Immunität gegen Malaria ist die Entfernung von freien Merozoiten aus dem Blut durch Fresszellen. Doch die Beurteilung der funktionellen Wirksamkeit von spezifischen merozoite opsonierende Antikörper ist eine Herausforderung aufgrund der kurzen Halbwertszeit von Merozoiten und der Variabilität der primären Fresszellen. Im Detail hierin beschrieben ist ein Verfahren zur Erzeugung lebensfähiger Merozoiten mit dem E64-Protease-Inhibitor und ein Assay von Merozoiten opsonin Phagozytose mit dem pro-Monozyten-Zelllinie THP-1. E64 verhindert Schizont Bruch, während der die Entwicklung von Merozoiten, die durch Filtration des behandelten Schizonten freigegeben werden. Ethidiumbromid markierten Merozoiten mit menschlichen Plasmaproben opsonisierten und THP-1-Zellen gegeben. Die Phagozytose wird durch eine standardisierte Hochdurchsatz-Protokoll bewertet. Lebensfähige Merozoiten sind eine wertvolle Ressource für die Beurteilung der zahlschiedenen Aspekten der P. falciparum Biologie, einschließlich der Beurteilung der Immunfunktion. Antikörperspiegel von diesem Test gemessen werden mit klinischen Immunität gegen Malaria in natürlich exponierten Personen verbunden. Der Test kann auch von Nutzen für die Bewertung Impfstoff induzierte Antikörper sein.
Einleitung
Die Bedeutung von Antikörpern zur Immunität gegen Plasmodium falciparum Malaria wurde vor 40 Jahren, als Immunglobulin von hyperimmunen Erwachsenen wurde passiv an Kinder, die an schwerer Malaria was zu Krankheit gelindert 1 übertragen gezeigt. Folglich wurden beträchtliche Anstrengungen versucht, Ziele Malariaschutzimmunität zu identifizieren, vor allem durch Messung der Antikörpertiter gegen Peptide oder bakteriell exprimierten Proteinen durch ELISA. ELISA-Serologie hat sich auch als sehr variabel zwischen Studien und keine Antikörper Funktionalität 2 zu adressieren. Viele Malaria-Antigene induzieren eine cytophilen IgG1 und IgG3 Antikörperprofil, insbesondere Merozoiten-Oberflächenantigene 3. Diese Unterklasse Bias nahe, dass Antikörper-Fc-Rezeptor (EKR) Wechselwirkungen mit Fresszellen sind wichtig für die Effektor-Funktionen von opsonisierenden antimerozoite Antikörper 4. Mehrere merozoite Antigen-Impfstoffe in der Entwicklung sind so ausgelegt,entlocken Phagozyten Effektorfunktionen 5, 6 und obwohl bedeutende Beweise für die Bedeutung der Antikörper-FcR-Wechselwirkungen in Nagetiermodellen von Malaria existiert 7-9, und einige neuere Studien die Bedeutung funktioneller Antikörper und Phagozyten Effektorfunktionen für Immunität gegen Malaria beim Menschen 10, 11, bleibt dieser Bereich nur wenig untersucht. Studie in Merozoiten spezifischen opsonierende Antikörper wurde durch zwei Faktoren begrenzt; die Schwierigkeit bei der Isolierung gute Qualität Merozoiten; und variable Phagozytose Antworten von Primärzellen.
Bis vor kurzem wurden Hochgeschwindigkeits-Zentrifugation oder Percoll Dichtegradienten verwendet, um Merozoiten aus Kulturüberständen von Kulturen Aufbrechen Schizonten zu isolieren. Diese Merozoiten waren selten lebensfähig, und oft durch Dichte-Zentrifugation manipuliert und mehrere Waschschritte 12, 11 oder Kryokonservierung vor der Verwendung in Assays. Diese proczesse möglicherweise lösen viele peripher assoziierte Proteine aus der Merozoitenoberfläche, Proteine bekannt, antigene Ziele von Malaria Immunität 13 sein. Vor kurzem hat die Cystein-Protease-Inhibitor-Epoxysuccinyl trans-L-leucylamido (4-Guanidino)-butan (E64) wurde verwendet, um lebensfähige Merozoiten erzeugen. E64 verhindert Schizonten Bruch, Erzeugen Membran eingeschlossen Merozoiten 14, der durch Filtration aufgebrochen können tragfähige Merozoiten 15, 16 freizusetzen. Diese Technik hat sich auf die räumliche Auflösung von zahlreichen Proteinen während der Erythrozyten-Invasion 15, 17-19 zu führen und hat die Bühne spezifische Wirkung von mehreren Medikamenten gegen Malaria 16, 20 geklärt. Jedoch bleibt die Erzeugung von lebensfähigen Merozoiten technisch anspruchsvoll. Um die Verbreitung dieser Technik und Anwendung auf funktionelle Assays der Immunität, ein detailliertes Protokoll für lebensfähige merozoite Reinigung und ihre Verwendung in eine Beihilfestandardisierte Funktionstest von Antikörper: Zell Zusammenarbeit in Opsonisierung und Phagozytose wird hier beschrieben.
Diese Technik zeigt einen deutlichen Fortschritt gegenüber früheren in vitro-Assays von Merozoiten Opsonisierung, wie Neutrophilen Respiratory Burst, Antikörper-abhängige zelluläre Inhibition (ADCI) und alternative merozoite Phagozytose-Assays. Diese Assays sind schlecht reproduzierbar aufgrund der Variation Parasiten Eingänge und der Aktivität der primären phagozytischen Zellen 11, 21. Kontaminierende Hämozoin kann auch tiefgreifend beeinflussen Phagozytenfunktion 22. Eine vor kurzem berichtet, robuste und reproduzierbare merozoite Phagozytosetest 23 nutzt die promonocytic Zelllinie THP-1-24. Dies ist eine ideale Zelltyp für hohen Durchsatz Durchflußzytometrie-Assays, da es nicht anhaftenden und führt insbesondere Fc-Rezeptor-vermittelte Phagozytose 25, 26. Eine zusätzliche Komplexität, während Investorentigating Phagozytose ist, dass das Ausmaß der Phagozytose ist abhängig von der Anzahl der Merozoiten in Bezug auf THP-1-Zellen und der Plasmakonzentration. Um die Reproduzierbarkeit zwischen den Experimenten zu gewährleisten, sollte Merozoiten zählt werden und eine definierte Konzentration verwendet. Aufgrund ihrer geringen Größe durchflusszytometrische Quantifizierung ist nicht erforderlich.
Das hier beschriebene Verfahren entfernt Hämozoin und erzeugt lebensfähig Merozoiten, und beschreibt eine Anwendung dieser Merozoiten für die Durchflusszytometrie Aufzählung der Merozoiten gefolgt von Opsonisierung und Phagozytose. Obwohl technisch anspruchsvoll, können die beschriebenen Techniken nützlich bei der Aufklärung der Beitrag der Merozoiten-Oberfläche spezifische Antikörperantworten auf natürlich erworbene Immunität induziert und Impfstoff beweisen.
Protokoll
Hinweis: Alle Schritte außer Zentrifugation und Durchflusszytometrie, sollte in einem Abzug mit laminarer Strömung durchgeführt werden, um die Sterilität aufrechtzuerhalten. Achten Sie darauf, die entsprechenden Vorsichtsmaßnahmen zum Umgang mit menschlichen Proben entnommen. Der Test ist sehr empfindlich für kleine Mengen von Plasma. Die zur Verfügung gestellten Verdünnungen sind optimal für die Lösung Antworten reichen von 5 bis 78% mit Plasma von semi-immunen Kinder aus Papua-Neuguinea (PNG). Die optimale Verdünnung kann mit Plasma-Geräten getestet variieren, und es wird daher empfohlen, dass Plasma titriert werden, um Versuchsbedingungen für die jeweilige Anwendung zu bestimmen. Sicherstellen, dass die Aufnahme von 2 negativen Kontrollen THP-1-Zellen mit Merozoiten in Abwesenheit von Plasma; und THP-1-Zellen mit Merozoiten opsonisiertes mit einem Pool von Plasma von Malaria naive Individuen. Dies wird Steuerung für merozoite Einhaltung THP-1-Zellen zu ermöglichen und strenge Durchflusszytometrie Gating der Phagozytose Veranstaltungen zu ermöglichen.
Die Verwendung von Plasmaproben war PNGvon der Medical Research Advisory Committee, Papua-Neuguinea Ministerium für Gesundheit, der Walter und Eliza Hall-Institut Human Research Ethics Committee (Projektnummer 04/04) zugelassen. Die schriftliche Einwilligung wurde von den Eltern / Erziehungsberechtigten der Teilnehmer erhalten.
1. THP-1-Kultur
- Aufrechterhaltung der menschlichen monozytären Zelllinie THP-1 in RPMI-1640-Medium mit 10% fötalem Kälberserum (FCS) und 55 uM 2-mercapthoethanol (THP-1-Medium) ergänzt und bei 37 ° C in einem 5% CO 2 befeuchteten Inkubator.
- Aufrechterhaltung Zellen mit einer Dichte von weniger als 5 x 10 5 Zellen / ml. HINWEIS: Überwucherung in Differenzierung in adhärenten Zellen und Down-Regulation von Fc-Rezeptoren führen. Sobald Zellen haben etwa 10 mal passagiert worden ist, tauen ein neues Fläschchen Zell-Phänotyp zu erhalten.
2. Antikörper Probenvorbereitung und Verdünnung
- Hitze inaktivieren Plasma durch Inkubation bei 56 ° getestet und Malaria-naiven Kontrollplasma, C für 30 min
- Seriell verdünnten Plasmaproben auf 1/2, 000 in THP-1 Medium.
- Speicher verdünnte Plasma bei -20 ° C
3. Kultur der Hoch Synchronisierte P. falciparum
HINWEIS: Die GFP-exprimierenden Parasiten Linie D10-PfPHG 27 wurde aufgrund seiner 48 Stunden-Lebenszyklus, die eine Synchronisation von Parasiten und die Zeitkontrolle bei E64 zusätzlich unterstützt eingesetzt. Darüber hinaus, weil diese Linie drückt GFP im Zytosol, diese Linie ermöglicht den Nachweis von Parasitämie und frei von Merozoiten durchflusszytometrischen Nachweis von GFP. Jedoch ist die GFP-Fluoreszenzintensität nicht ausreicht, um die Visualisierung in THP-1-Zellen zu schaffen, und daher werden Merozoiten mit Ethidiumbromid (EtBr) gegengefärbt. Andere Parasitenstämme können verwendet werden, vorausgesetzt, dass die enge Synchronisation erreichbar. Synchronisieren Parasiten mit einer Kombination von Sorbit Behandlung zu reifen Formen 28 und Heparin lysieren Invasion 15 hemmen .
- Pflegen P. falciparum-Parasiten in O + menschlichen Erythrozyten (RBC) in 3% Hämatokrit in RPMI-1640-Medium (pH 7,4) mit 25 mg / ml HEPES, 50 ug / ml Hypoxanthin, 10% gepooltem Humanserum, 2 mg / ml Natriumbicarbonat ergänzt, und 20 ug / ml Gentamycin (Parasite Medium). Mit 5 mg / ml Blasticidin S-Hydrochlorid zu dem Kulturmedium, das für GFP + Parasiten ausgewählt.
- Kulturen in luftdichten Boxen oder alternativ zwei verschlossenen Kulturflaschen bei 37 ° C in einer Atmosphäre von 1% O &sub2;, 4% CO 2 und 95% N 2.
- Bereiten dünne Schicht gleitet, fix in 100% Methanol für 10 sec, und Fleck mit 10% Giemsa-Lösung in 6,7 mM (pH 7,1) Phosphat-Puffer (Giemsa-Lösung) für 10 min auf Parasitämie überwachen. Nach der Färbung gründlich Folie in Wasser und an der Luft trocknen. Bewerten Parasitämie mit einem 100X-Ölimmersionsobjektiv.
- Pflegen Parasiten Kulturen bei einer Parasitämie unter 5% infizierten RBC durch die Spaltung von Kulturen und das Hinzufügen von nicht infiziertenRBC wie erforderlich.
- Um mit Heparin zu synchronisieren, mit 20 IU / ml Heparin medizinischer Qualität zu Kulturen stufigen läuten.
- Wenn die Mehrheit der Parasiten sind an der Schizontenstufe, Pellet-Zellen bei 300 g für 5 min, entfernen Heparin-haltigem Medium und resuspendieren in Parasit mittel-bis Schizont Bruch und Merozoiten-Invasion zu ermöglichen.
- Nach 4 Stunden, mit 20 IU / ml Heparin zurück zu Kulturen, Sperrung weitere merozoite Invasion. HINWEIS: Mehrere Zyklen von Sorbit und Heparin-Behandlung erforderlich, bevor Parasiten ausreichend synchronisiert werden. Um geeignete Anzahl von Merozoiten erzeugen, bereiten 150 ml Parasit Kultur bei 3-5% Parasitämie.
4. Isolierung von Late Stage P. falciparum Trophozoiten
- Sechsunddreißig Stunden nach der Rückkehr Heparin Kulturen pelle kultivierten Zellen bei 300 × g für 5 min, und das Pellet erneut in Parasiten Medium mit 25% Hämatokrit.
- Bringen Sie einen großen Magnetsäule (Matrixvolumen von 6,3ml) mit einem Magneten und ins Gleichgewicht der Säule mit Parasiten Medium, so dass alle Luftblasen entfernt werden.
- Fügen Sie den resuspendiert P. falciparum-Kultur auf die Säule und Durchflussmenge einstellen, um ein Tropfen pro Sekunde.
- Sobald Kultur hat durch die Säule geleitet, waschen Sie die Spalte mit Parasiten Medium, bis die Durchfluss klar ist.
- Parasiten eluieren von der Säule in 30 ml 37 ° C Parasiten Medium.
- Bereiten Sie eine dünne Schicht von Parasiten, fix in 100% Methanol für 10 Sekunden und färben mit Giemsa-Lösung für 3 min. Untersuchen Sie die Objektträger unter dem Mikroskop, und sicherzustellen, dass Parasiten fast füllen den roten Blutkörperchen, und scheinen in frühen Stadien Schizont sein. Wenn die Parasiten haben nicht die entsprechenden Reifestadium erreicht, kehren gereinigten Parasiten zu einer 37 ° C-Inkubator in einer Atmosphäre von 1% O 2, 4% CO 2 und 95% N 2, bis entsprechend entwickelt. HINWEIS: Reinheit größer als 90% infizierte rote Blutzellen erforderlich ist, um sicherzustellen, RBC nicht verunreinigen merozoite Zubereitungen.
- Gönnen isolierten Schizonten mit 10 uM E64 (Epoxysuccinyl-L-leucylamido (4-guanidino) Butan (E64) für 6 bis 10 Stunden. HINWEIS: Längere Inkubationszeiten mit E64 möglich sind, aber die Merozoiten produziert nicht mehr invasiv sein.
5. Isolierung von P. falciparum Merozoiten
- Nach der Inkubation mit E64, verschmieren Parasiten fixieren Zellen in 100% Methanol und Fleck mit Giemsa-Lösung, um die Bildung der Membran umschlossenen Merozoiten beurteilen. ANMERKUNG: Eine gute Ausbeute an Merozoiten werden erzielt, wenn mehr als 50% der Parasiten Membran umschlossen Merozoiten gebildet werden.
- Pellet E64-behandelten Schizonten bei 1.900 g für 8 min. Waschen mit 50 ml RT RPMI-1640-Medium (pH 7,4) mit 25 mg / ml HEPES, 50 ug / ml Hypoxanthin, 2 mg / ml Natriumbicarbonat und 20 ug / ml Gentamycin (Waschmedium) ergänzt, um die verbleibenden menschlichen Serum zu entfernen .
- Das Pellet in 2 ml Waschmedium. HINWEIS: Die Verwendung von FCS-haltigem THP-1-Medien produzieren Schaumbildung während der Filtration.
- Filtern Sie die 2 ml des resuspendierten E64-Schizonten durch ein 1,2 mm-Spritzenfilter μm/32. Das Filtrat in einem 10-ml-Tube. HINWEIS: Das Filtrat enthält Merozoiten und Hämozoin Kristalle, mit un-gebrochen Schizonten und Schmutz im Filter gesammelt.
- Bringen Sie einen kleinen magnetischen Spalte ein Magnet, und ins Gleichgewicht mit 500 ul THP-1-Medium.
- Führen Sie das Filtrat über der Magnet Spalte. Sammeln Sie die Durchströmung. HINWEIS: Hämozoin wird an die Säule, während Merozoiten wird passieren.
- Übergeben Sie die Durchfluss über die Säule zwei weitere Male zu Hämozoin entfernen, das Sammeln der durch jede Zeit.
- Mit 2 ml RT THP-1-Medium Spülen der Säule, um alle verbleibenden Merozoiten zu sammeln.
- Hinzufügen EtBr bei 10 ug / ml (Endkonzentration) und Färbung für 30 min bei RT. Vor Licht auf Photobleaching zu verhindern. Hinweis: Stellen Sie sicher, dass alle EtBr kontaminierte Flüssigkeit und plastic Abfälle werden in einer für die zytotoxische Chemikalien entsorgt. Merozoiten sind nicht mehr invasive nach dieser Inkubationszeit.
- Spin down Merozoiten bei 4.000 g für 10 min.
- Überstand verwerfen in geeignete Abfallbehälter.
- Resuspendieren merozoite Pellet in 4 ml THP-1-Medium, und drehen sich mit 4.000 × g nach unten für 10 min.
- In THP-1-Medium bis zu einem Volumen von 15 ml, und vor Licht schützen.
6. Quantifizierung Merozoite Konzentration durch Durchflusszytometrie
- Bringen Zählen Perlen auf RT.
- Vorbereitung PBS mit 0,5% BSA verdünnt Merozoiten.
- Graf Merozoiten bei 3 Verdünnungen; 1 in 100; 1 zu 50 und 1 in 25. Bereiten 3 FACS-Röhrchen mit 940, 930 und 910 &mgr; l PBS + 0,5% BSA, jeweils. Werden 10, 20 und 40 ul der gereinigten Merozoiten pro Röhrchen auf.
- Vortex Zählen Kügelchen für 30 sec, und 50 ul Perlen pro FACS-Röhrchen verdünnt Merozoiten.
- Führen Sie die drei dilausgeschüttet Merozoiten Proben auf einem Durchflusszytometer mit einem 488 nm Laser. Einem straffen Gate für Merozoiten anhand von EtBr-und GFP-Fluoreszenz duale Fluoreszenz und Gate Zählen Kügelchen durch Fluoreszenz in einem separaten Kanal. Erwerben Veranstaltungen bis 2.000 Perlen gesammelt werden. Hinweis: Diese Anleitung bezieht sich auf das Zählen GFP + Merozoiten, die mit EtBr gegengefärbt haben. Wenn nicht nutzen GFP-exprimierenden Parasiten dann merozoite Tore basierend auf Seitenstreuung und EtBr-Fluoreszenz.
- Bestimmen Sie das Verhältnis von Merozoiten: Perlen, indem die Anzahl der Merozoiten Veranstaltungen der Zählung 2000 Wulst Events, ein Verhältnis berechnen für jede Verdünnung. Verwenden Sie die Perlenzählen Batch-Spezifikationen, um die Anzahl der Perlen in den 50 ul Perlen pro Röhrchen gegeben zu bestimmen.
- Multiplizieren Sie die Anzahl der Perlen in 50 ul mit dem Verdünnungsfaktor und durch die Merozoiten: Wulst-Verhältnis für diesen Verdünnungsfaktor. Diese Anzahl entspricht der Konzentration an Merozoiten pro ml. Führen these Schritte für jede Verdünnung.
- Mittelwert der Merozoiten Konzentrationen in den drei Verdünnungen gemessen. HINWEIS: Die Standardabweichungen von über 10% für die 1 in 50 bestimmt in 100, 1-Konzentrationen und 1 in 25 Verdünnungen zeigen technische Ungenauigkeiten bei der Vorbereitung Zählen Proben.
- Resuspendieren Merozoiten bei 8 x 10 6 Merozoiten / ml in THP-1 Medium, um ein Endverhältnis von vier Merozoiten pro THP-1-Zellen zu gewährleisten. HINWEIS: Weitere merozoite zu THP-1-Verhältnisse verwendet werden können, und die Konzentrationen sollte entsprechend geändert werden.
7. Phagozytose Assay
- In 200 ul Wärme inaktiv FCS pro Vertiefung 96 und U-Bodenplatten, und lassen bei RT O / N, um Platten zu blockieren. Nach der Inkubation FCS zu entfernen und waschen Vertiefungen zweimal mit 200 ul sterilem PBS. PBS zu entfernen und zu speichern Platten bei 4 ° C bis zur Verwendung.
- Berechnung der Anzahl der THP-1-Zellen erforderlich ist, um Plasmaproben und Kontrollen zu testen, so dass drei Vertiefungen pro Probe bei 1 x 10 5 THP-1-Zellen pro Vertiefung.
- Bestimmen, THP-1-Kulturkonzentration durch Laden 10 ul Kultur auf einem Hämocytometer Folie. Die Anzahl der Zellen in 4 Sätze von 16 Plätzen der Ecke Hämocytometers unter einem Mikroskop vorhanden ist, dann ist der Mittelwert der zählt. Multiplizieren die mittlere Zählung von 10.000, um die Anzahl der Zellen pro ml zu berechnen.
- Zentrifugieren Sie die erforderliche Anzahl von THP-1-Zellen bei 500 × g für 5 min und Resuspendieren in 6,7 x 10 5 Zellen / ml in THP-1 Medium.
- Jeweils 150 ul der THP-1-Zellen in THP-1-Medium pro Vertiefung zu einer FCS-blockierten 96-Vertiefungs-U-Bodenplatte, was zu 10 5 Zellen / Vertiefung. Bereiten 3 Wells pro Probe, die getestet werden sollen. Rückplatte, bis Sie sie Merozoiten hinzufügen Inkubator.
- In 150 ul merozoite Vorbereitung auf 8 x 10 6 / ml pro Vertiefung in eine separate FCS-96 blockiert auch U-Bodenplatte. Bereiten Sie eine gut pro Probe getestet
- In 10 ul der vorbereiteten verdünnten Plasmaproben pro Vertiefung zu ter Platte, die die Merozoiten enthält, und gut mischen, um eine homogene Lösung zu gewährleisten.
- Entfernen Sie den THP-1-Platte aus dem Inkubator, und 50 ul der Merozoiten / Plasma-Lösung pro Well mit THP-1-Zellen, mit drei Wells pro Plasmaprobe.
- Gut mischen, und bei 37 ° C in 5% CO 2, befeuchteten Inkubator für 40 min. Mit Folie abdecken, um vor Licht zu schützen.
- Nach 40 min, Zentrifuge Proben für 5 min bei 500 × g bei 4 ° C vorgekühlten Zentrifuge Phagozytose zu verhaften.
- Überstand entfernen, waschen und die Zellen zweimal in eiskaltem PBS + 0,5% BSA 2 mM EDTA (FACS-Puffer). HINWEIS: EDTA wird bei der Aufrechterhaltung einer Einzelzellsuspension für die Durchflußzytometrie-Analyse zu erleichtern.
- Fix-Zellen in 90 ul von 2% Paraformaldehyd (PFA) in PBS + 0,5% BSA 2 mM EDTA (FACS Fixiermittel). Lassen Sie auf Eis, bis Erwerb, vor Licht geschützt.
8. Durchflusszytometrie
- Mit einem Durchflusszytometer ausgestattet wi Erwerben Probenth ein 488-nm-Laser und Hochdurchsatz-Plattenlese Anhang. HINWEIS: Dies wird zu 400 Plasmaproben ermöglichen bis zu von einem merozoite Vorbereitung getestet werden. Die Zellen können auch Rohre für die manuelle Probenbeladung übertragen werden.
- Tor tragfähige THP-1-Zellen durch Vor-und Seitenstreuung.
- Stellen Sie die EtBr positive Gate auf der Grundlage der "THP-1-Zellen mit Merozoiten und kein Plasma" Kontrolle.
- Erwerben Sie ein Minimum von 10.000 Ereignissen pro Probe.
9. Datenanalyse
- Analysieren von Daten mittels Durchflusszytometrie-Analyse-Software und stellen strenge Tore für EtBr positive Ereignisse.
- Der prozentuale Anteil der Phagozytose für jede Probe: Die% EtBr +-Zellen für die Probe abzüglich der% positive Zellen mit nicht-immunen Plasma.
- Durchschnittliche Ergebnisse in dreifacher Ausführung. HINWEIS: Die Standardabweichungen für eine dreifach von mehr als 10% geben an experimentellen Ungenauigkeiten. Einige Hintergrund EtBr positive Ereignisse können als Folge der merozoi beobachtet werdente Haftung auf der Oberfläche von THP-1-Zellen, sollte aber in allen Proben, die Merozoiten konsistent. Einstellen der Tor auf der Grundlage der "THP-1-Zellen mit Merozoiten und kein Plasma"-Steuerelement, und jede Subtraktion Hintergrund der "THP-1-Zellen mit nicht-immunen Plasmakontrolle wird in% Phagozytose, die die Fluoreszenz spiegelt aufgrund verinnerlicht führen / phagozytiert nur Merozoiten.
Ergebnisse
Der Reifestadium-Parasiten vor dem E64-Behandlung ist entscheidend für die Erzeugung von Membran-umschlossenen Merozoiten. 1Ai Abbildung zeigt die entsprechenden Reifestufe der Schizonten für das Hinzufügen von E64. Die Parasiten sollte groß sein und fast füllen die roten Blutkörperchen. Ein gesprenkelt Aussehen der Giemsa-Färbung zeigt Merogonie begonnen hat, und E64 sollte hinzugefügt werden, um membranumschlossenen Merozoiten (Abbildung 1Aii) zu erhalten. Wenn E64 früher hinzugefügt Stadium-Parasiten Trophozoit werden Membran umschlossen Merozoiten auch nicht nach 12 Stunden von E64 erzeugt. Statt Parasiten nehmen abnorme Morphologie wie die Erweiterung des Verdauungs Vakuole (Abbildung 1bi und 1Bii) und Merozoiten nicht gebildet werden. Wenn E64 wird später auf Schizonten hinzugefügt werden, werden membranumschlossenen Merozoiten nicht erzeugt als Schizont Bruch wird ungehemmt (Abbildung 1CI und 1Cii). Ein hohes Maß an Synchronität Parasiten gefordert wird, weitereweise eine Reihe von allen drei beschriebenen Ergebnisse werden nach E64 Behandlung gesehen werden.
Entfernung von Hämozoin ist ein weiterer wichtiger Schritt zur Reinigung von Merozoiten. Wenn Merozoiten werden nicht von Hämozoin gereinigt dann merozoite Hämozoin-Cluster zu bilden, die nicht durch Pipettieren verdrängt werden kann. Diese Aggregate werden auf dem Durchflusszytometer als Einzelveranstaltungen, wenn auch mit unterschiedlichen Vorwärtsstreu und Nebenstreueigenschaften als Einzel Merozoiten, was zu ungenauen merozoite Zählung mittels Durchflusszytometrie (Abbildung 2A). THP-1-Zellen können auch phagozytieren Hemozoin können diese Merozoiten-Hemozoin Cluster auch phagozytiert werden (Abb. 2B). Diese Aggregate sind sehr EtBr fluoreszierenden, als sie mehrere Merozoiten enthalten. Phagozytose von Aggregaten führt zu einer THP-1-EtBr-Fluoreszenzprofil entspricht, die für die Phagozytose von mehreren einzelnen Merozoiten beobachtet. Daher, wenn Hemozoin nicht entfernt wird, das EtBr-Fluoreszenz von THP-1-Zellen wird ein O seinverestimate der opsonierende Potenzial für die Plasma getestet. Hemozoin wird auch berichtet, Phagozytenfunktion signifikant. GFP positive Merozoiten Zähler mit EtBr gefärbt, um die Visualisierung von Merozoiten von THP-1-Zellen phagozytiert erhöhen. Mit den in diesem Protokoll beschriebenen Bedingungen werden alle GFP positive Merozoiten mit EtBr, die eine hellere Fluoreszenz Intensität (3A) hat gegengefärbt. Phagozytose Bewertung durch EtBr-Fluoreszenz ermöglicht überlegene Auflösung von Merozoiten Phagozytose als GFP-Fluoreszenz (Abbildung 3B).
Die Anzahl der Merozoiten dem Assay zugegeben wird den Betrag der Phagozytose beobachtet modulieren. Aus diesem Grund ist eine genaue Zählung durch Durchflusszytometrie ist kritisch. Zunehmende Verhältnisse von Merozoiten: THP-1 zu einer erhöhten Haftung der Merozoiten an THP-1-Zellen in Abwesenheit von Plasma (4A) führen. Erhöhen Merozoiten: THP-1-Verhältnissen führt auch zu erhöhten phagocytosis Antworten, wenn Merozoiten opsonisiertes (4B). A 4.01 merozoite: THP-1-Verhältnis für robuste phagocytic Antworten empfohlen. Mit diesem Verhältnis, und der Verdünnung des Plasma angegeben, ist dieser Test in der Lage, niedrigen, mittleren und hohen opsonisierenden Antikörper lösen. Zwischen 0 und 78 Prozent Phagozytose Antworten wurden mit PNG Plasmaproben und die anderen beschriebenen Bedingungen beobachtet. Solche Reaktionen sind vor kurzem gezeigt, dass mit natürlich erworbene Immunität gegen Malaria klinischen 10. Abbildung 5 zeigt Beispiele für die vier Quartile der Phagozytose Antworten von PNG Personen zuzuordnen.
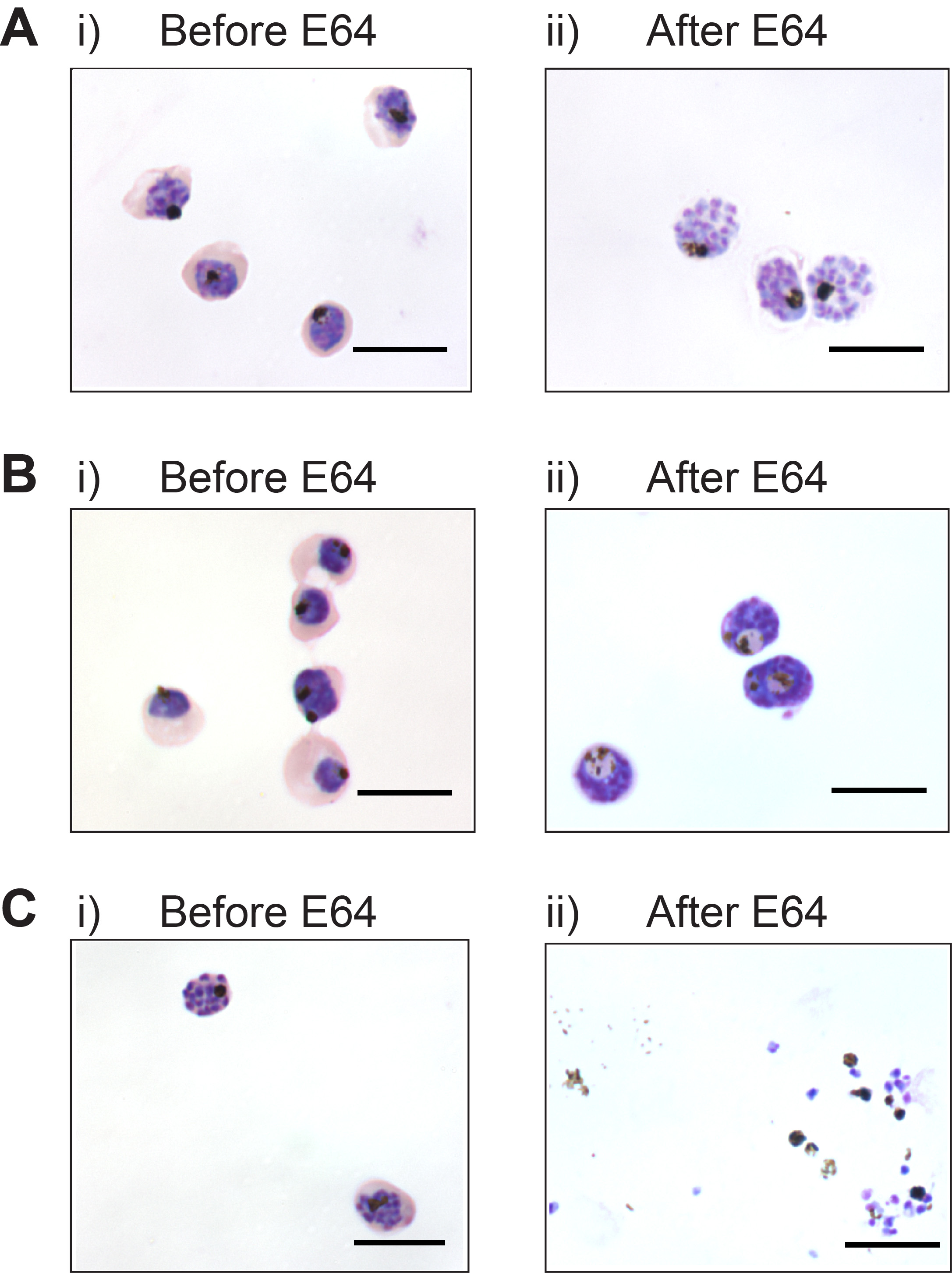
Abbildung 1. Zeitpunkt der E64 hinaus ist entscheidend für die Erzeugung von Membran-umschlossenen Merozoiten. (A) Geeignete maturatio. n Stadium der Parasiten i) vor der E64-Behandlung, und ii) nach 6 h Behandlung E64 hergestellte Membran umschlossenen Merozoiten (B) Membran umschlossen Merozoiten werden nicht erzeugt, wenn E64 ist mit unreifen Parasiten aufgenommen; i) Spätstadium Trophozoiten und ii) nach 12 h E64 (C) Schizont Bruch nicht gehemmt wird, wenn E64 wird hinzugefügt, um späten Schizonten segmentiert. i) Spätstadium Schizonten, und ii) nach 6 Stunden von E64. Maßstabsbalken entspricht 10 um.

Abbildung 2. Hämozoin Entfernung ist entscheidend, um eine Einzelzellsuspension merozoite generieren. Merozoite Hämozoin-Aggregate bilden folgende Filtration von Membran umschlossen Merozoiten, es sei denn Hämozoin wird magnetisch von Merozoiten getrennt. (A) Zukunfts Streu-und Seitenstreudiagramme von Merozoiten mit Hämozoin entferntund Hemozoin beibehalten. (B) Hämozoin-Merozoiten-Aggregate können durch THP-1-Zellen phagozytiert werden. Diff-Quick gefärbt Zyto-Spin-Dias von THP-1-Zellen mit Plasma inkubiert PNG opsonisiertes merozoite Präparate mit oder ohne Hämozoin. Maßstabsbalken entspricht 10 um.

Abbildung 3. Ethidiumbromid-Färbung ermöglicht eine hohe Auflösung von Merozoiten Phagozytose. D10-GFP gereinigten Merozoiten sind mit EtBr gegengefärbt, um die Fluoreszenzintensität zu verbessern. (A) Durchflusszytometrie Histogramm von gereinigten Merozoiten mit Gating auf GFP positive Merozoiten und eine Dot-Blot zeigt EtBr Fluoreszenz innerhalb dieser Wohn GFP positive Bevölkerung. (B) Zukunftsstreuung gegen GFP und Vorwärtsstreuung gegen EtBr von THP-1-Zellen nach Phagozytose von GFP und EtBr Dual Fluoreszenz Merozoiten. Tore wurden d rawn auf den THP-1-Zellen mit Merozoiten und ohne Plasmakontrolle.

Abbildung 4 Die Merozoiten:. THP-1-Verhältnis beeinflusst den Grad der Phagozytose beobachtet. (A) Fünf merozoite: THP-1-Verhältnisse dargestellt; 50:1, 20:1, 10:1, 4:1 1:1 liegt. Zellen, die nur Steuer zeigt die Hintergrundfluoreszenz aufgrund von THP-1-Zellen. THP-1 EtBr-Fluoreszenz für jedes Verhältnis ist für Merozoiten mit einem Pool von Plasma-oder PNG mit nicht-immunen Australian Plasma opsonisiertes angegeben (B) Mittlere Fluoreszenzintensität der THP-1-Zellen für verschiedene merozoite:. THP-1-Verhältnisse und Opsonisierung mit Pool von PNG-Plasma oder nicht-immunen Australian Plasma (Mittelwert + SEM). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5. Eine große Auswahl an opsonisierenden Antikörper gemessen werden kann. Merozoiten wurden mit Plasma von PNG Personen opsonisiertes und mit THP-1-Zellen inkubiert. Vier Vertreter Phagozytose Reaktionen gezeigt. Tore wurden auf Basis der THP-1-Zellen mit Merozoiten und keine Plasmasteuer gezogen und Zahlen geben die Phagozytose% nach Abzug der THP-1-Zellen mit nicht-immunen Plasmakontrolle. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Um merozoite Phagozytose zu messen, wird Kenntnisse in zwei Techniken erforderlich: Reinigung von Merozoiten und THP-1 Phagozytose-Assay. Die wichtigsten Schritte für die Kombination dieser beiden Techniken sind: 1) Hoch synchronisiert Parasiten; 2) Hinzufügen von E64 an der richtigen Zeit, um Membran umschlossen Merozoiten ergeben; 3) Entfernen Hämozoin zu Aggregaten zu vermeiden; 4) Genaue merozoite Zählung mittels Durchflusszytometrie; 5) die Verdünnung des Plasmas verwendet wird; und 6) die Aufrechterhaltung geringer Zelldichte und der Passagenzahl von THP-1-Zellen. Die sorgfältige Abwägung dieser Schlüsselaspekte wird dafür sorgen, robust Phagozytose Reaktionen beobachtet werden.
Obwohl hier beschrieben ist die Herstellung von Merozoiten zur Beurteilung Phagozytose, kann die Technik für eine Vielzahl von Anwendungen eingesetzt werden. Unabhängig von der Nachfolge Methodik optimal merozoite Vorbereitungen hängen korrekt Zeit E64 zusätzlich um Merozoiten generieren. Die hier beschriebene Methode ist E64 bis y gezeigtield invasive Merozoiten für den Einsatz in hochauflösende Mikroskopie der Invasion Ereignisse und Arzneimittelempfindlichkeit Assays 15-20. Während Merozoiten Fähigkeit nicht wesentlich ist für die Phagozytose wird Integrität des Merozoiten-Oberflächenbeschichtung erforderlich. Daher ist die hier beschriebene Methode ermöglicht E64 hochwertigen Merozoiten für Antikörper-Antworten auf die Beurteilung der Oberflächenlack hergestellt werden. Wie in Fig. 1 dargestellt, wenn E64 zu früh oder zu spät zugegeben Membran eingeschlossen Merozoiten nicht ausgebildet sind. Aus diesem Grund sind sehr Synchronparasitenkulturen erforderlich. Hier ist die Verwendung von Sorbit und Heparin Behandlungen klein synchronisieren D10-GFP Parasiten Kulturen zu einem Fenster von 2 Stunden beschrieben. Heparin kann gametocytogenesis Förderung in anderen Labor isoliert, und sollte daher mit Bedacht eingesetzt werden. Alternative Synchronisationsverfahren, wie Alanin können ebenfalls verwendet werden, vorausgesetzt, dass dicht synchronisierten Parasiten erzeugt 29. Wenn E64 wird, um asynchrone Parasiten hinzu, eine untere Stützeortion von Membran-umschlossenen Merozoiten produziert werden und die verbleibenden Parasiten infizierten RBC wird entweder normal oder Bruch entwickeln abnorme Morphologie. Die Anwesenheit der Parasiten, die nicht in Membran umschlossen Merozoiten entwickelt haben, in ein Verstopfen des Filters führen und reduzieren die erhaltene merozoite Ausbeute.
Bei der Filtration von Membran-umschlossenen Merozoiten ist Hämozoin befreit von der Verdauungs Vakuolen und ist als freie Kristalle in Lösung vor. Hemozoin sehr proinflammatorischen und wurde berichtet, Monozyten-und Makrophagen-Phagozytose Antworten 30, 31 zu modulieren. Zusätzlich zum Modulieren Phagozytose, wie in Fig. 2 gezeigt, kann Hemozoin Aggregaten mit Merozoiten in Lösung zu bilden. Als THP-1-Zellen können diese Aggregate phagozytieren, kann dies ein wichtiger Störfaktor für die Auflösung der Antikörper-vermittelten Phagozytose sein. Daher ist in diesem Test av Entfernen Hemozoin erforderlichenoid zusätzliche Komplexität Hämozoin auf Phagozyten Biologie. Darüber hinaus können zu einem Ausfall Hämozoin entfernen auch schädlich sein, wenn Sie diese Technik, um kostenlos Merozoiten für andere Anwendungen zu erzeugen, vor allem wenn merozoite Quantifizierung erforderlich.
Wie in Fig. 4 dargelegt, die Anzahl der Merozoiten zu dem Assay zugesetzt werden das Ausmaß der Phagozytose durch THP-1-Zellen zu beeinflussen. Obwohl Durchflusszytometrie ermöglicht Aufzählung merozoite Konzentration, sorgfältige Pipettieren und replizieren Grafen von Merozoiten sind notwendig, um die Genauigkeit zu verbessern. Dies ist besonders kritisch, wenn mehrere Parasitenlinien nebeneinander getestet werden. Es wurde bereits nachgewiesen, dass Plasma von semi-immunen Kinder von PNG deutlich verdünnt, bevor Antworten sinken 23 werden. Beschrieben wird hier die optimale Verdünnung von Plasma (1/120, 000 endgültigen Verdünnung von Plasma) für eine Kohorte von 5-12 Jahre alten Kinder, die das PNG große Auswahl an phagocyt hergestellt. in 5 beschrieben ose Antworten Dieser Bereich für die Stratifizierung der Antworten erlaubt in vier Gruppen (0 - 19%, 20-39%, 40-59% und 60-79% Phagozytose) und Regressionsanalyse ergab, dass opsonisierenden Antworten wurden im Zusammenhang mit Schutz vor klinischer Erkrankung und hoher Dichte Parasitämie 10 Für verschiedene Kohortenstudien kann es erforderlich sein, Plasmaverdünnung einzustellen, um die Phagozytose durch THP-1-Zellen ausgelassen oder unterhalb der Nachweisgrenze gesättigt.
Durchfluss-Zytometrie ermöglicht schnelle und messbare Phagozytose mit verbesserter Genauigkeit über Mikroskopie. Dieses Protokoll ist ein Hochdurchsatz-, Platten-basierte und automatisierte Übernahme von 96-Well-Platten natürlich erworbenen humoralen Immunität zu studieren. Das Verfahren erfordert Anfärbung mit Ethidiumbromid Merozoiten jedoch alternative DNA-Flecken wie SYBRGreen, DAPI und Propidiumiodid, Membranprotein Flecken oder Flecken verwendet werden könnte. Dieser Test wäre zugänglich Primary Monozyten oder Neutrophile und könnte angepasst werden, wenn Phagozyten oder FcR Biologie von Interesse war. Primärzellen oder THP-1-Zellen in vitro mit PMA unterscheiden kann zur Phagozytose in Malaria und anderen Krankheitserregern 12, 32-34 untersuchen. Doch mit Primärzellen kann eine Herausforderung sein, da diese Zellen anhaften und auch anzeigen Nicht-Antikörper-vermittelte Phagozytose 35. Außerdem Variabilität in der Reinheit, der Lebensfähigkeit und Funktionalität sind einige der wichtigsten Einschränkungen für die Verwendung von Primärfresszellen. Die Fc-Rezeptoren in Merozoiten Phagocytose beteiligt bleiben charakterisierter und damit mit blockierenden Antikörpern an spezifische Fc-Rezeptoren könnte der Beitrag jedes Fc-Rezeptor Phagozytose Merozoiten aufzuklären. THP-1 Phagozytose ist FcR abhängig, dies ermöglicht eine einfache Interpretation der beobachteten Phagozytose. Dieser Test eignet sich auch zur Adressierung der Antigenspezifität von opsonisierenden Antikörpern, die durch util erreicht werden konnteizing Knock-out-Parasiten für Merozoiten-Oberflächenantigene oder mit gereinigter menschlicher Antikörper für Oberflächenproteine Merozoiten. Darüber hinaus in der Tiefe Studien Zytokinreaktionen folgenden merozoite Phagozytose fehlen, und konnte in diesem Test erreicht werden.
Diese beiden Techniken bilden erhebliche Fortschritte auf die Untersuchung von funktionalen antimerozoite Antikörpern. Die Reinigung von hochwertigen Merozoiten ist vorteilhaft, mit kryokonservierten Merozoiten oder fluoreszierende Mikrosphären mit merozoite Antigenen beschichtet. Obwohl dieser Test wurde als ein Werkzeug für die Bewertung natürlich erworbene Immunität verwendet wurde, kann es ein wichtiges Werkzeug für die Adressierung der Erwerb von Immunität in Reaktion auf die Impfung zu beweisen. Während es wurde kürzlich gezeigt, dass die Phagozytose oder Merozoiten opsonisiert mit Schutz vor klinischer Malaria verbunden sind, ist es nicht möglich, direkte Rückschlüsse aus in vitro-THP-1-Phagozytose in vivo phagocyto zeichnensis von Merozoiten Phagozytose in diesem Test erfolgt unter statischen Bedingungen und in Abwesenheit von konkurrierenden roten Blutkörperchen. Die möglichen Anpassungen dieser Test kann somit ein vielseitiges Werkzeug für das weitere Verständnis von Malaria und merozoite Phagozytose.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren möchten sich die Kinder und Erwachsenen Plasmaspendern und das Personal an der Papua-Neuguinea-Institut für Medizinische Forschung anzuerkennen. Die Autoren bedanken sich bei Amandine B Carmagnac, Catherine Q Nie, Danny Wilson W, Ivo Müller und Diana S Hansen für ihren Beitrag zur Entwicklung dieser Technik zu danken, und ich danke den australischen Rotes Kreuz für Blut und Serum-Packs. Diese Arbeit über viktorianische Staatsregierung Operational Support der Infrastruktur und der australischen Regierung NHMRC IRIISS ermöglicht. Diese Arbeit wurde vom National Health and Medical Research Council gewährt # 1031212 und # 637406 und National Institutes of Health Zuschuss # AI089686.
Materialien
| Name | Company | Catalog Number | Comments |
| THP-1 cell line | American Type Culture Collection | TIB-202 | |
| RPMI-1640 | Gibco | 31800-089 | |
| Fetal Calf Serum (FCS) | Invitrogen | 10099-141 | |
| 2-mercapthoethanol | Sigma-Aldrich | M6250-100ML | Use in Fume Hood |
| Pen/Strep Solution (100x) | Sigma | P0781 | |
| HEPES | SAFC | 90909C | Cell culture grade |
| hypoxanthine | Calbiochem | 4010 | |
| Human Serum | Donation from Autralian Red Cross | Available commercially (i.e. Invitrogen) | |
| sodium bicarbonate (NaHCO3) | Merck | 1.06329.0500 | |
| gentamycin | Pfizer | 61022027 | Injection Quality |
| heparin Sodium BP (5000IU/mL) | Pfizer | procine origin | |
| Blasticidin S-hydrochloride | Sigma-Aldrich | 15205 | |
| D-sorbitol | Sigma-Aldrich | 50-70-4 | |
| E64 Protease Inhibitor | Sigma-Aldrich | E3132-10MG | |
| KH2PO4 | Sigma-Aldrich | 98281-100G | Use for phosphate buffer |
| Na2HPO4.2H20 | Merck | 10383.4G | Use for phosphate buffer |
| Giemsa's azur eosin methylene blue solution | Merck | 1.09204.0500 | 1:10 dilution in 6.7mN Phosphate buffer (make fresh each stain) |
| EDTA disodium salt | Merck | 10093.5V | 0.1M, pH 7.2 |
| Acrodisc Syringe Filters 1.2-μm/32-mm | Pall Life Sciences | 4656 | |
| QuadroMACS Separator (for small column) | MACS Miltenyi BioTec | 130-091-051 | Interchangeable with MidiMACS |
| VarioMACS Separator (for large columns) | MACS Miltenyi BioTec | 130-090-282 | |
| MACS MultiStand | MACS Miltenyi BioTec | 130-042-303 | |
| LS Column (small magnetic column) | MACS Miltenyi BioTec | 130-042-401 | |
| large magnetic column | MACS Miltenyi BioTec | 130-041-305 | |
| Ethidium Bromide | Bio-Rad | 1510433 | Cytotoxic |
| CountBright Absolute Counting Beads | Invitogen | C36950 | |
| BD FACSCalibur Flow Cytometer with HTS plate reader | BD Biopsciences | ||
| EDTA disodium salt | Merck | 10093.5V | 0.1M, pH 7.2 |
| FlowJo cytometry analysis software | Tree Star |
Referenzen
- Cohen, S., McGregor, I. A., Carrington, S. Gamma-globulin and acquired immunity to human malaria. Nature. 192, 733-737 (1961).
- Fowkes, F. J. I., Richards, J. S., Simpson, J. A., Beeson, J. G., Medicine, P. L. o. S. The relationship between anti-merozoite antibodies and incidence of Plasmodium falciparum malaria: A systematic review and meta-analysis. PLoS Medicine. 7, (2010).
- Bouharoun-Tayoun, H., Attanath, P., Sabchareon, A., Chongsuphajaisiddhi, T., Druilhe, P. Antibodies that protect humans against Plasmodium falciparum blood stages do not on their own inhibit parasite growth and invasion in vitro, but act in cooperation with monocytes. The Journal of experimental medicine. 172, 1633-1641 (1990).
- Jafarshad, A., et al. A novel antibody-dependent cellular cytotoxicity mechanism involved in defense against malaria requires costimulation of monocytes FcgammaRII and FcgammaRIII. Journal of immunology. 178, 3099-3106 (1950).
- Genton, B., et al. A recombinant blood-stage malaria vaccine reduces Plasmodium falciparum density and exerts selective pressure on parasite populations in a phase 1-2b trial in Papua New Guinea. The Journal of Infectious Diseases. 185, 820-827 (2002).
- Sirima, S. B., Cousens, S., Druilhe, P. Protection against malaria by MSP3 candidate vaccine. The New England journal of medicine. 365, 1062-1064 (2011).
- Llewellyn, D., et al. Assessment of antibody-dependent respiratory burst activity from mouse neutrophils on Plasmodium yoelii malaria challenge outcome. Journal of leukocyte biology. , (2013).
- McIntosh, R. S., et al. The importance of human FcgammaRI in mediating protection to malaria. PLoS pathogens. 3, 72 (2007).
- Pleass, R. J., et al. Novel antimalarial antibodies highlight the importance of the antibody Fc region in mediating protection. Blood. 102, 4424-4430 (2003).
- Hill, D. L., et al. Opsonizing Antibodies to P. falciparum Merozoites Associated with Immunity to Clinical Malaria. PLoS One. 8, (2013).
- Joos, C., et al. Clinical Protection from Falciparum Malaria Correlates with Neutrophil Respiratory Bursts Induced by Merozoites Opsonized with Human Serum Antibodies. PLoS ONE. 5, (2010).
- Kumaratilake, L. M., Ferrante, A. Opsonization and phagocytosis of Plasmodium falciparum merozoites measured by flow cytometry. Clinical and diagnostic laboratory immunology. 7, 9-13 (2000).
- Richards, J. S., et al. Identification and Prioritization of Merozoite Antigens as Targets of Protective Human Immunity to Plasmodium falciparum Malaria for Vaccine and Biomarker Development. The Journal of Immunology. , (2013).
- Salmon, B. L., Oksman, A., Goldberg, D. E. Malaria parasite exit from the host erythrocyte: a two-step process requiring extraerythrocytic proteolysis. Proceedings of the National Academy of Sciences of the United States of America. 98, 271-276 (2001).
- Boyle, M. J., et al. Isolation of viable Plasmodium falciparum merozoites to define erythrocyte invasion events and advance vaccine and drug development. Proceedings of the National Academy of Sciences. 107, 14378-14383 (2010).
- Wilson, D. W., Langer, C., Goodman, C. D., Mcfadden, G. I., Beeson, J. G. Defining the timing of action of anti-malarial drugs against Plasmodium falciparum. Antimicrobial Agents and Chemotherapy. , 1-46 (2013).
- Angrisano, F., et al. Spatial Localisation of Actin Filaments across Developmental Stages of the Malaria Parasite. PLoS ONE. 7, (2012).
- Riglar, D. T., et al. Super-resolution dissection of coordinated events during malaria parasite invasion of the human erythrocyte. Cell Host and Microbe. 9, 9-20 (2011).
- Zuccala, E. S., et al. Subcompartmentalisation of Proteins in the Rhoptries Correlates with Ordered Events of Erythrocyte Invasion by the Blood Stage Malaria Parasite. PLoS ONE. 7, (2012).
- Marapana, D. S., et al. Malaria Parasite Signal Peptide Peptidase is an ER-Resident Protease Required for Growth but not for Invasion. Traffic. 13, 1457-1465 (2012).
- Rzepczyk, C. M., Lopez, J. A., Anderson, K. L., Alpers, M. P. Investigation of the effect of monocytes with Papua New Guinea sera on Plasmodium falciparum in culture. International Journal for Parasitology. 18, 401-406 (1988).
- Schofield, L., Mueller, I. Clinical immunity to malaria. Curr Mol Med. 6, 205-221 (2006).
- Hill, D. L., et al. Efficient measurement of opsonizing antibodies to Plasmodium falciparum merozoites. PLoS ONE. 7, (2012).
- Tsuchiya, S., et al. Establishment and characterization of a human acute monocytic leukemia cell line (THP-1). International journal of cancer Journal international du cancer. 26, 171-176 (1980).
- Ackerman, M. E., et al. A robust, high-throughput assay to determine the phagocytic activity of clinical antibody samples. Journal of Immunological Methods. 366, 8-19 (2011).
- Ataíde, R., et al. Using an Improved Phagocytosis Assay to Evaluate the Effect of HIV on Specific Antibodies to Pregnancy-Associated Malaria. PLoS ONE. 5, (2010).
- Wilson, D. W., Crabb, B. S., Beeson, J. G. Development of fluorescent Plasmodium falciparum for in vitro growth inhibition assays. Malar J. 9, 152 (2010).
- Lambros, C., Vanderberg, J. P. Synchronization of Plasmodium falciparum erythrocytic stages in culture. J Parasitol. 65, 418-420 (1979).
- Braun-Breton, C., Rosenberry, T. L., da Silva, L. P. Induction of the proteolytic activity of a membrane protein in Plasmodium falciparum by phosphatidyl inositol-specific phospholipase. C. Nature. 332, 457-459 (1988).
- Jaramillo, M., Godbout, M., Olivier, M. Hemozoin induces macrophage chemokine expression through oxidative stress-dependent and -independent mechanisms. J Immunol. 174, 475-484 (2005).
- Schofield, L., Tachado, S. D. Regulation of host cell function by glycosylphosphatidylinositols of the parasitic protozoa. Immunology and cell biology. 74, 555-563 (1996).
- Khusmith, S., Druilhe, P., Gentilini, M. Enhanced Plasmodium falciparum merozoite phagocytosis by monocytes from immune individuals. Infection and immunity. 35, 874-879 (1982).
- Lunov, O., et al. Differential uptake of functionalized polystyrene nanoparticles by human macrophages and a monocytic cell line. ACS. 5, 1657-1669 (2011).
- Tebo, A. E., Kremsner, P. G., Luty, A. J. Fcgamma receptor-mediated phagocytosis of Plasmodium falciparum-infected erythrocytes in vitro. Clinical and experimental immunology. 130, 300-306 (2002).
- McGilvray, I. D., Serghides, L., Kapus, A., Rotstein, O. D., Kain, K. C. Nonopsonic monocyte/macrophage phagocytosis of Plasmodium falciparum-parasitized erythrocytes: a role for CD36 in malarial clearance. Blood. 96, 3231-3240 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten