Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Boden Lysimeter Ausgrabung Gekoppelte hydrologische, geochemische und mikrobiologische Untersuchungen
In diesem Artikel
Zusammenfassung
Diese Studie stellt eine Ausgrabung Methode zur Untersuchung von unterirdischen hydrologische, geochemische und mikrobiologische Heterogenität des Bodens Lysimeter. Die Lysimeter simuliert eine künstliche Hang, die zunächst unter homogenen Zustand war und auf etwa 5.000 mm Wasser über acht Zyklen der Bewässerung in einem Zeitraum von 18 Monaten unterzogen worden.
Zusammenfassung
Studying co-evolution of hydrological and biogeochemical processes in the subsurface of natural landscapes can enhance the understanding of coupled Earth-system processes. Such knowledge is imperative in improving predictions of hydro-biogeochemical cycles, especially under climate change scenarios. We present an experimental method, designed to capture sub-surface heterogeneity of an initially homogeneous soil system. This method is based on destructive sampling of a soil lysimeter designed to simulate a small-scale hillslope. A weighing lysimeter of one cubic meter capacity was divided into sections (voxels) and was excavated layer-by-layer, with sub samples being collected from each voxel. The excavation procedure was aimed at detecting the incipient heterogeneity of the system by focusing on the spatial assessment of hydrological, geochemical, and microbiological properties of the soil. Representative results of a few physicochemical variables tested show the development of heterogeneity. Additional work to test interactions between hydrological, geochemical, and microbiological signatures is planned to interpret the observed patterns. Our study also demonstrates the possibility of carrying out similar excavations in order to observe and quantify different aspects of soil-development under varying environmental conditions and scale.
Einleitung
Boden- und Landschaftsdynamik werden durch das komplexe Zusammenspiel von physikalischen, chemischen und biologischen Prozessen 1 geformt. Wasserdurchfluss, geochemische Verwitterung und die biologische Aktivität prägen die gesamte Entwicklung der Landschaft in ein stabiles Ökosystem 2,3. Während Oberfläche ändert sich die auffälligsten Merkmale der Landschaft 4, Verständnis kumulativen Auswirkungen von hydrologische, geochemische und mikrobiologische Prozesse in der unterirdischen Region ist entscheidend , um die zugrunde liegenden Kräfte zu verstehen , die eine Landschaft 2 zu formen. Zukünftige Klima Störungsszenarien durcheinander bringen weiter die Vorhersagbarkeit und das Muster der Landschaftsentwicklung 5. Es wird somit eine Herausforderung kleinräumige Prozesse zu ihrer großen Manifestation auf der Landschaft-Skala 6 zu verbinden. Traditionelle Kurzlauf Laborexperimente oder Experimente in Naturlandschaften mit unbekannten Anfangsbedingungen und zeitvariablen Fall zwingt kurz bei der Erfassung von the intrinsische Heterogenität der Landschaftsentwicklung. Auch aufgrund der starken nicht - lineare Kopplung ist es schwierig , biogeochemischen Veränderungen von hydrologische Modellierung in heterogenen Systemen zur Vorhersage 7. Hier beschreiben wir eine neue experimentelle Methode, um eine vollständig gesteuert und überwacht Boden Hang mit bekannten Anfangsbedingungen auszuheben. Unsere Ausgrabung und Probenahmeverfahren ist bei der Erfassung der Entwicklung Heterogenität der Hang entlang seiner Länge und Tiefe ausgerichtet, mit dem Ziel, eine umfassende Daten-Set der Bereitstellung von hydro biogeochemischen Wechselwirkungen und deren Auswirkungen auf die Bodenbildungsprozesse zu untersuchen.
Hydrologischen Systeme in der Natur zu finden sind keineswegs statisch in der Zeit zu sein, mit den Veränderungen in hydrologischen Antworten über einen weiten Bereich von räumlichen und zeitlichen Skalen 3 nehmen. Die räumliche Struktur von Strömungswegen entlang Landschaften bestimmt die Geschwindigkeit, das Ausmaß und die Verteilung von geochemischen Reaktionen und biologische Besiedlung, die fahrender Transport und die Ausfällung von gelösten Stoffen und Sedimenten und die Weiterentwicklung der Bodenstruktur Bewitterung. Somit beinhaltet Wissen aus pedology, Geophysik und Ökologie in Theorien und experimentellen Designs zu hydrologischen Prozesse zu bewerten und hydrologischen Vorhersagen zu verbessern wurde 8,9 vorgeschlagen. Landschaftsentwicklung wird auch durch unterirdische biogeochemische Prozesse in Verbindung mit Wasserdynamik, elementar Migration während der Bodenentwicklung und von minera Transformationen , die durch Reaktion von mineralischen Oberflächen mit Luft, Wasser und Mikroorganismen 10 beeinflusst. Folglich ist es wichtig, die Entwicklung von geochemischen Hotspots innerhalb einer sich entwickelnden Landschaft zu studieren. Darüber hinaus ist es wichtig, geochemische Verwitterungsmuster hydrologischen Verfahren und mikrobiologische Signaturen bei beginnender Bodenbildung zu beziehen, um die Dynamik von komplexen Landschaftsentwicklung zu verstehen. Die spezifischen Prozesse der Bodengenese regiert werdendurch den kombinierten Einfluss von Klima, biologische Eingänge, Erleichterung und Zeit auf einem bestimmten Ausgangsmaterial. Dieses Experiment wurde entworfen von hydrologischen und geochemischen Variationen erleichtert assoziiert geregelt Heterogenitäten in der Verwitterung von Ausgangsmaterial zur Adresse (einschließlich Steigung und Tiefe) und der damit verbundenen Schwankungen der mikrobiellen Aktivität , die durch Umwelt Gradienten (dh Redoxpotential) unter Bedingungen betrieben wird , in dem Ausgangsmaterial, das Klima und die Zeit konstant gehalten werden. Im Hinblick auf die mikrobielle Aktivität, sind Bodenmikroorganismen kritischen Komponenten und haben einen großen Einfluss auf die Landschaft Stabilität 11. Sie spielen eine entscheidende Rolle in der Bodenstruktur, biogeochemischen Kreislauf von Nährstoffen und Pflanzenwachstum. Daher ist es notwendig, die Bedeutung dieser Organismen als Treiber der Verwitterung, Bodengenese und Landschaftsbildungsprozesse zu verstehen, während gleichzeitig die Wechselwirkungen von hydrologischen Fließwege und geochemische wir identifizierenathering auf die mikrobielle Gemeinschaft Struktur und Vielfalt. Dies kann durch das Studium der räumlichen Heterogenität der mikrobiellen Gemeinschaft Vielfalt über eine sich entwickelnde Landschaft, deren hydrologischen und geochemischen Eigenschaften erreicht werden, auch parallel untersucht.
Hier präsentieren wir eine Ausgrabung Verfahren eines Bodens Lysimeter, operativ namens miniLEO, entworfen, um die groß angelegte nullter Ordnung Becken Modelle der Landschaftsentwicklung Observatory (LEO) in Biosphäre 2 (University of Arizona) untergebracht zu imitieren. Die miniLEO wurde entwickelt, kleine Landschaftsentwicklung Muster zu identifizieren, von kumulativen heterogenen Hydro biogeochemischen Prozesse entstehen. Es ist ein lysimeter 2-m in der Länge, 0,5 m Breite und 1 m in der Höhe und Neigung von 10 ° (Figur 1). Darüber hinaus werden die Wände der Lysimeter isoliert und mit biologisch nicht abbaubaren zweiteiligen Epoxy-Primer und einem Aggregat gefüllt aliphatischen Urethan-Mantel zu vermeiden mögliche Kontamination oder Auswaschung beschichtetvon Metallen aus der lysimeter Rahmen in den Boden. Die Lysimeter wurde mit zerstoßenem Basaltgestein gefüllt, die aus einer Anzahlung in Höhe von spätpleistozäne tephra im Zusammenhang mit Merriam-Krater im Norden von Arizona extrahiert wurde. Das beladene Basaltmaterial war identisch mit dem Material in den viel größeren LEO Experimente verwendet. Die mineralische Zusammensetzung, Korngrößenverteilung und hydraulischen Eigenschaften werden durch Pangle et al. 12 beschrieben. Die Abschussversickerungsfläche wurde mit einem perforierten Kunststoff-Bildschirm (0.002 m Durchmesser Poren, 14% Porosität) ausgekleidet. Das System ist mit Sensoren wie Wassergehalt und Temperatursensoren, zwei Arten von Wasserpotentialsensoren, Boden-Wasser-Sampler, hydraulischen Gewichtsausgleich, elektrische Leitfähigkeit Sonden ausgestattet und Drucksensoren Wasser Tischhöhe zu bestimmen. Die Lysimeter wurde für 18 Monate bewässert vor der Ausgrabung.
Die Ausgrabung war peinlich genau in seinem Ansatz und wurde bei der Beantwortung zwei große Fragen gerichtet: (1) Was hydrologische, geochemische und mikrobielle Signaturen können über die Länge und Tiefe der Steigung in Bezug auf simulierten Regen Bedingungen und (2) ob Beziehungen und Feedbacks zwischen hydro-bio-geochemischen Prozessen auftretenden auf dem Hang beobachtet werden kann, von abgeleitet werden die einzelnen Signaturen. Neben dem Versuchsaufbau und Aushubverfahren stellen wir repräsentative Daten und Vorschläge, wie ähnlich Ausgrabung Protokolle für Forscher anwenden Interesse an einem Studium gekoppelt Erde-Systemdynamik und / oder Bodenentwicklungsprozesse.
Protokoll
1. Überlegen Sie sich eine Sampling Matrix systematische und umfassende Beprobung Lysimeter zur Gewährleistung
- Teilen Sie Lysimeter in Voxel mit fester Länge, Breite und Tiefe.
- Verwenden Sie einen euklidischen Raum-Koordinatensystem und teilen sich die Gesamtstrecke entlang jeder Richtung (X, Y und Z) in einer ausreichenden Anzahl von gleichmäßigen Abständen. Betrachten wir die Erde in der Nähe der Mauern der Lysimeter verwirft Randeffekte zu vermeiden.
HINWEIS: Ein Puffer von 5 cm entlang der vier Wände ist in diesem Experiment angenommen Randeffekte zu vermeiden, während sichergestellt wird, dass das Bodenvolumen gesammelt ausreicht. - Jede Probe eine eindeutige XYZ Position zuweisen und als Voxel zu identifizieren.
HINWEIS: In dieser Ausschachtung, X die Position entlang der Breite der Steigung, bezeichnet Y Stelle entlang der Länge der Steigung, während Z Position entlang der Tiefe der Steigung bezeichnet. Die Größe der Intervalle innerhalb jeder Dimension bestimmt die Breite, Länge und Tiefe der Voxel. Fild 2 zeigt die Aufteilung des lysimeter nach Intervallen Abstand zusammen mit dem gewählten Ursprung für die XYZ - System zu bestimmen. Die Unterteilung in der aktuellen Grabungsschema hat 9 Abständen entlang der beiden Y und Z - Richtung und 4 Abständen entlang der X - Richtung, die insgesamt 324 Voxeln von 10 cm x 20 cm x 10 cm Abmessungen (Figur 3) zu erzeugen.
HINWEIS: Die Stichprobenstrategie gewählt wird sichergestellt, daß das gesamte System gleichmäßig mit minimaler Beschädigung der Sensoren abgetastet wird. Grenzen jedes Voxel (1-2 cm) werden verworfen aus dem benachbarten Voxel Kreuzkontamination zu begrenzen. Zusätzlich sorgen Voxeldimensionen dass genügend Bodenmaterial für die mikrobiologische verfügbar ist, geochemischen und hydrologische Probensammlung in jedem Voxel.
- Verwenden Sie einen euklidischen Raum-Koordinatensystem und teilen sich die Gesamtstrecke entlang jeder Richtung (X, Y und Z) in einer ausreichenden Anzahl von gleichmäßigen Abständen. Betrachten wir die Erde in der Nähe der Mauern der Lysimeter verwirft Randeffekte zu vermeiden.

Abbildung 1. Seitenansicht Lysimeter. Mit Blick auf Lysimeter aus der Versickerung face. Ebenfalls sichtbar sind drei Sensorbereiche (weiße PVC-Rohre) entlang der Neigung und Sprinkleranlage an den vier Ecken.

Abbildung 2. Stichprobenplan. Probenahmeschema Lysimeter entlang XYZ. A. Die X - Dimension teilt die Breite in 4 Abschnitte zu je 10 cm , während Y die Länge in 20 cm. B. Die Z - Dimension gibt an Tiefe und wurde aufgeteilt in neun Schichten unterteilt von 10 cm Tiefe. Eine Grenze von 5 cm entlang den Rändern der Lysimeter identifiziert wurde Entnahme von Proben zu verhindern , die möglicherweise Grenze Wirkung zeigen können. Bitte klicken Sie hier , um diese Datei herunterzuladen.
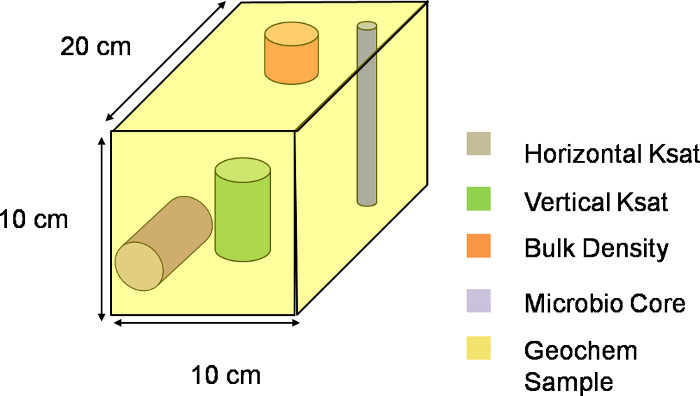
Abbildung 3. Drei-Dimensional Darstellung eines Voxel. Visuelle Schema eines Voxel entlang der XYZ - Ebene des Lysimeter. Der gesamte Hang wurde in 324 solcher Voxel aufgeteilt, wobei jedes Voxel eine einzige Abtasteinheit zeigt. Bitte hier klicken , um diese Datei herunterzuladen.
2. Fügen Sie Brilliant Blue FCF Dye to Track Wasserinfiltrations im Slope
- Bewerben strahlend blauen Farbstoff an der Oberfläche des Bodens, genug Top-105 cm von der Oberfläche entlang der Y-Richtung zu decken. Decken Sie die restlichen Boden mit Kunststoffplatten.
- Wählen Sie eine Konzentration (hier 10 g / L) Kontrast gegen schwarzen basaltischen Boden zu gewährleisten. Fügen Sie den Farbstoff zu Bewässerungstanks und verdünnt mit Wasser auf die gewünschte Konzentration.
- Entscheiden, die Dauer der Spülung auf Basis der gewünschten Tiefe der Infiltrationsfront und die Rate durch das Bewässerungssystem versorgt.
HINWEIS: Für diese Studie ein irrigation Rate von 30 mm / h für 20 min (4) vor der Grabung wird als ausreichend erachtet , um heterogene Muster der Wasserinfiltration in den ersten wenigen Zentimetern zu identifizieren. - Nach dem Farbauftrag, geben Zeit für die Infiltration zu stoppen und die Feuchtigkeitszuständen im Lysimeter äquilibrieren. Für diese Studie ist ein Zeitraum von 10 Stunden (über Nacht) zwischen Farbstoff Anwendung und Aushub war angemessen.
3. Abgrenzung von Voxel
- Befestigen entlang der Länge des Gefälles Maßband einen in-situ Referenzsystem für die Führung während Abgrenzung von Voxeln zu liefern.
- Markieren Sie die Dimension eines jeden Bodens Voxel mit Hilfe des Maßbandes. Zeichne Gitterlinien für jede Schicht unter Verwendung von Aluminium-blade Abschirmungen und Kunststoff Spachtel (Abbildung 4). Entsorgen Sie die Grenze Materialien (5 cm von jeder Wand Randeffekte zu vermeiden).

Abbildung 4. Draufsicht auf Lysimeter. Diese Ansicht zeigt die gefärbte Oberfläche der Schicht 2 (10 cm tief). Gitter auf der Bodenoberfläche gezogen Probenahme zu unterstützen sind ebenfalls sichtbar, zusammen mit Kernlöchern Regionen in jedem Voxel nach der mikrobiologischen Probensammlung.
4. Mikrobiologie Probenentnahme
- Sammeln Sie Mikrobiologie Proben aseptisch aus jedem Voxel vor der hydrologischen und geochemischen Analysen Kreuzkontamination von Proben zu verhindern. Stellen Sie sicher, dass die neuen Handschuhe von allen Mitgliedern der Baugrube Durchführung getragen werden Verunreinigungen durch menschliche Haut zu reduzieren.
- Verwenden Sie einen Bodengreifer von 1 cm Durchmesser und 20 cm Höhe und einem dünnen Spachtel für die mikrobiologische Probenentnahme. Reinigen Sie den Ausstecher und den Spatel mit destilliertem Wasser, trocknen Sie sie mit sauberen Tüchern, und spülen mit 75% Ethanol mit einer Sprühflasche. Lassen Sie corer und Spachtel an der Luft trocknen.
- Beachten Sie die collection Zeit jeder Probe. Verwenden Entkerner zum Kern zu einer Tiefe von 10 cm in jedem Voxel Ort und dem Spatel der Bodenprobe in vorsterilisierten Kunststoffbeutel (Abbildung 5) zu entleeren. Achten Sie darauf, den Beutel unmittelbar vor dem Aufbringen der Probe zu öffnen. Homogenisieren der Probenbeutel mit der Hand.
- Bewahren Sie die Probenbeutel in einem Eis-Kühler während der Probenahme, und so rasch wie möglich an der -80 ° C Gefrierschrank.

Abbildung 5. Mikrobiologie Probensammlung. Eine kleine Handheld - Ausstecher von 20 cm x 1 cm, sterile Beutel und Spachtel wird hier gezeigt bei mikrobiologischen Probenahme. Bitte hier klicken , um diese Datei herunterzuladen.
5. Geochemie und Hydrologie Probenentnahme
- Fotografisches gefärbte Bereiche in X und Y planes während des Aushubs für Tiefen, in denen der Farbstoff beobachtet wird. Verwenden Sie eine Farbkarte Referenz für die Farbe beobachtet (Abbildung 6) zu liefern. Stellen Sie sicher, die richtige natürliche Beleuchtung vorhanden ist, um richtig Farbintensität zu dokumentieren.
- Kalibrieren Sie tragbare Röntgenfluoreszenz-Spektrometer (pXRF) täglich vor den Messungen beginnen. Für die Kalibrierung und Messung Einzelheiten finden Sie den Anweisungen des Herstellers 13 (Abbildung 7). Kurz gesagt, stellen Sie das Gerät auf den Halter und direkt in die Fabrik Metallperle des Strahlfenster zeigen. Wählen Sie 'Cal' und 30 Sekunden warten die Kalibrierung abgeschlossen werden kann.
- Reinigen Sie das Strahlfenster vor jeder Messung. Messen Sie die Oberfläche jedes Voxel in dreifacher Ausführung an drei verschiedenen Stellen. Legen Sie das pXRF Instrument auf der Bodenoberfläche und warten 90 Sekunden die Messung zu ermöglichen, abgeschlossen sein.
HINWEIS: X-ray kann in der Richtung des Strahls eine große Entfernung durchdringen. Daher ensuerneut, dass nur geschultes Personal das Gerät behandelt und geeignete Sicherheitsprotokolle unterhält.
- Reinigen Sie das Strahlfenster vor jeder Messung. Messen Sie die Oberfläche jedes Voxel in dreifacher Ausführung an drei verschiedenen Stellen. Legen Sie das pXRF Instrument auf der Bodenoberfläche und warten 90 Sekunden die Messung zu ermöglichen, abgeschlossen sein.

Abbildung 6. Farbkarte zu folgen Infiltration färben. Jeder Ort mit sichtbaren Farbstoffpenetration wurde mit einer Farbkarte fotografiert , als Referenz dient. Bitte klicken Sie hier , um diese Datei herunterzuladen.

Abbildung 7. tragbare Röntgenfluoreszenz - Spektrometer. Hand pXRF positioniert auf der Oberfläche eines Voxel. Messungen wurden an drei verschiedenen Stellen auf der Oberfläche jedes Voxels aufgezeichnet und dann gemittelt.
- Saubere metallischen Kerne (height = 3 cm, Durchm. = 5,7 cm) und Polycarbonat cores (height = 6 cm, Durchm. = 5,7 cm) für Schüttdichten (BD) und hydraulische Leitfähigkeitsmessungen (Ksat) des gewünschten Voxel, bzw. (Abbildung 8).
- Vertically Metallkerne und Polycarbonat-Kerne (vertikale Ksat) in die gewünschte Voxel die Pflege Stecken Sie keine Sensoren oder Sensorkabel zu beschädigen. Tun Sie dies, indem Sie vorsichtig die Kerne in den Boden hämmern, dabei eine ebene Fläche wie Holzblock zwischen dem Kern und dem Hammer zu verwenden, um zu minimieren Störungen auf den Boden. Zusätzlich, wenn der Kern zur Hälfte in den Boden ist, einen zweiten Kern auf dem ersten Kern schalten. Platzieren Sie den Holzblock auf der Oberseite des zweiten Kerns und Hammer vorsichtig den Block, bis der erste Kern im Boden mit dem Kernrand eingebettet ist noch sichtbar.
- Legen Sie Kerne für horizontale Ksat als die Seitenfläche des Voxel mit sequentieller Ausgrabung eröffnet. Verwenden Sie den Holzblock und der zweite Kern als 5,4 in Schritt erwähnt Verdichtung zu minimieren.
- Achten Sie darauf, dass das Voxel, um sicherzustellen,wird abgetastet wird von Grenzen und den benachbarten Voxel vor geochemische Probenentnahme isoliert. Verwenden Sie Kunststoff - Spachtel für diesen Zweck, gefolgt von Hand Kellen Bodenproben um Metall oder Polypropylen Kerne in markierte geochemischen (GC) Probenbeutel zu sammeln , bis Kerne leicht entfernt werden können ( zum Beispiel 9a, b).

Abbildung 8. Die Schüttdichte und hydraulische Leitfähigkeit Kerne. Polypropylen Kerne (links) wurden für das Sammeln von vertikalen und horizontalen hydraulischen Leitfähigkeit Proben verwendet , während Metallkerne (rechts) zum Sammeln von Schüttdichte Proben verwendet wurden.

Abbildung 9. Voxel Abgrenzung. Kunststoff - Spachtel wurden (A) isolierenVoxel Grenzen vor (B) geochemische, Schüttdichte und hydraulische Leitfähigkeit Kernsammlung. Bitte hier klicken , um diese Datei herunterzuladen.
- Entfernen Sie den metallischen Kern, abbürsten überschüssige Material von den beiden Enden, und übertragen Probe von Kern zu einem markierten BD Probenbeutel. Wiegen Sie jede Probenbeutel mit Probe und notieren Sie die Gesamtgewicht.
- Entfernen Sie die Polypropylen-Kerne. Decken Sie beide Seiten mit roten Kunststoffkappen und beschriften vertikale Polypropylen-Kern als "V" und die horizontale Polypropylen-Kern als "H", gefolgt von der Proben-ID.
- Sammeln verbleibende Material aus dem Voxel in den GC-Probenbeutel, hinter ein paar Zentimeter Boden an allen vier Seiten verlassen Kreuzkontamination mit dem nächsten Voxel zu verhindern.
- Wiederholen von Schritten von 5,1 bis 5,9 für den Rest der Voxel in einer Schicht.
- Sobald alle Voxel von einer Schicht gewesenabgeschlossen ist, wiederholen Sie die Schritte 3,2-5,10 für die nachfolgende Schicht.
HINWEIS: Schritt 5.1 muss nur für die Voxel durchgeführt werden, die sichtbaren Farbstoff haben. Siehe Abbildung 10 sichtbar zu machen repräsentatives Diagramm eines Voxel markieren alle Proben von jedem Voxel gesammelt.

Abbildung 10. Repräsentative Voxel. Die rote gestrichelte Linie Kern für die Mikrobiologie Probe gesammelt zeigt an , die grüne gestrichelte Linie Kern horizontal hydraulische Leitfähigkeit zeigt, die gelbe gestrichelte Linie vertikale hydraulische Leitfähigkeit Kern zeigt, der lila gestrichelt zeigt Schüttdichte Kern, und das blaue Oval Grenze gibt an, von dem Voxel verbleibende Probe für geochemische Analyse verwendet werden. Bitte hier klicken , um diese Datei herunterzuladen.
6. Probenanalyse
- Verwenden Proben für mikrobiologische Analysen gesammelt für die molekulare (Boden mikrobielle DNA - Extraktion) 14 und kultiviert (heterotrophe Plattenzählungen) 15 Analysen. Verwenden Sie extrahierten DNA für quantitative Polymerase - Kettenreaktionen (qPCR) 16 und Hochdurchsatz - Gen - Sequenzierung Experimente 17,18.
- Anwendungsbeispiele für geochemische gesammelt analysiert eine Vielzahl von geochemischen Eigenschaften zu messen , einschließlich pH - Wert (US - EPA - Methode 150.2), elektrische Leitfähigkeit (EC) (US - EPA - Methode 120.1), Kohlenstoff und Stickstoffgehalt (US - EPA - Methode 415.3, sequentielle Extraktion von Elementen 19, und Röntgenbeugung (XRD) und erweiterte Röntgenabsorptionsfeinstruktur (EXAFS) Spektroskopie als pro Spezifikationen der Stanford Synchrotron Radiation Laboratory, an Mineral Transformationen untersuchen.
- Verwenden Kernproben für hydrologische Analysen für Laborexperimente gesammelt, wie Schüttdichte 20und hydraulische Leitfähigkeit 21.
Ergebnisse
Die Dimensionen der Voxel sichergestellt Sammlung von Proben für die hydrologische, geochemische und mikrobiologische Messungen. Die Ausgrabung Verfahren ergab 324 Kerne für die mikrobiologische Analyse, 972 pXRF Datenpunkte, 324 geochemische Probenbeutel, 180 Ksat Proben (128 vertikale und 52 horizontal) und 311 Schüttdichte Proben. Vorzugsströmungs von Brilliant Blue Farbstoff wurde auch zu einer Tiefe von 30 cm unter der Oberfläche beobachtet. Eine repräsentative Gruppe von 81 P...
Diskussion
Landschaft Evolution ist die kumulative Wirkung der hydrologische, geochemische und biologische Prozesse 12. Diese Prozesse steuern Fluss und Transport von Wasser und Elemente, und biogeochemischen Reaktionen in Landschaften entwickelt. Allerdings erfordert die Wechselwirkungen erfassen gleichzeitig exakt aufeinander abgestimmte experimentelle Design und Probenahme. Darüber hinaus ist einsetzenden Landschaftsentwicklung studiert schwierig in natürlichen Systemen, mit begrenzten Fähigkeiten "Zeitpunkt ...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We thank Ty P.A. Ferré, Till Volkman, Edwin Donker, Mauricio Vera for helping us during the excavation, and Triffon J. Tatarin, Manpreet Sahnan and Edward Hunt for their help in sample analysis. This work was carried out at Biosphere 2, University of Arizona and funded by National Science Foundation grant EAR_1344552 and Honors Research Program of Biosphere 2.
Materialien
| Name | Company | Catalog Number | Comments |
| Measuring tape | Any | Any | Preventing cross-contamination of samples is crucial. Therefore, it is helpful to have multiple putty knives to isolate voxel boundary. |
| Brilliant Blue dye | Waldeck GmBH &Co | B0770 | Rulers can be used to draw grids. The sampling strategy can be modified based on individual experiments. |
| Soil Corer | AMS | 56975 | Any commercially manufactured Brilliant Blue dye can be used. |
| 75% Ethanol | Any | Any | A Nikon D90 camera and 50 mm lens were used for photography. Any high resolution camera and lens can be used for this purpose. |
| Spray Bottle | Any | Any | Use of dye and color card is subjective to individual experiments and/or research questions. |
| Spatula | Any | Any | Gardening gloves may be used if handling of corer becomes tedious. |
| Gloves | Any | Any | Ensure microbiology samples are kept in ice during sampling and frozen as soon as possible. |
| KimWipes | KimTech Science | Any | Water can be used to wash soil corer, prior to sanitizing with ethanol. |
| Sterile Sample bags | Fisher Scientific | Whirl-Pak 4 OZ. 24 OZ | Keep buckets and dustpans handy to facilitate removal of waste soil. |
| Color Card | Any | Any | The original design of miniLEO has various sensors embedded in the lysimeter. Such sensors may or may not be necessary based on the scope of individual experimental design. |
| X-ray Fluoresce Spectrophotmeter | XRF, OLYMPUS | DS-2000 Delta XRF | |
| Polypropylene cores | Any | Any | |
| Metal cores | Any | Any | |
| Caps for polypropylene cores | Any | Any | |
| Hammer | Any | Any | |
| Plastic putty knives | Any | Any | |
| Face masks | Any | Any |
Referenzen
- Brady, N. C., Weil, R. R. . The nature and properties of soils. , (2008).
- Chorover, J., Kretzschmar, R., Garica-Pichel, F., Sparks, D. L. Soil biogeochemicial processes within the critical zone. Elements. 3, 321-326 (2007).
- Troch, P. A., et al. Catchment coevolution: A useful framework for improving predictions of hydrological change?. Water Resour. Res. 6, 1-20 (2015).
- Sharp, R. P. Landscape evolution (A Review). Proc. Natl. Acad. Sci. U. S. A. 79, 4477-4486 (1982).
- Temme, A., Montgomery, D. R., Bierman, P. R. Predicting the effect of changing climate on landscapes with computer based landscape evolution models. Key Concepts in Geomorphology. , (2013).
- Troch, P. A., et al. Dealing with Landscape Heterogeneity in Watershed Hydrology: A Review of Recent Progress toward New Hydrological Theory. Geogr. Compass. 3, 375-392 (2009).
- Wang, Y., et al. Dissecting the Hydrobiogeochemical Box. in Am. Geophys. Union Fall Meet. , (2015).
- Lin, H., et al. Hydropedology: Synergistic integration of pedology and hydrology. Water Resour. Res. 42 (5), W05301 (2006).
- Band, L. E., et al. Ecohydrological flow networks in the subsurface. Ecohydrology. 7, 1073-1078 (2014).
- Churchman, G. j., Lowe, D. . Handbook of Soil Science Properties and Process. 1, (2012).
- van der Heijden, M. G. A., Bardgett, R. D., van Straalen, N. M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol. Lett. 11 (3), 296-310 (2008).
- Pangle, L. a., et al. The Landscape Evolution Observatory: A large-scale controllable infrastructure to study coupled Earth-surface processes. Geomorphology. 244, 190-203 (2015).
- . . User Manual: Delta Famiy Handheld XRF Analyzers. , (2013).
- Valentìn-Vargas, A., Root, R. A., Neilson, J. W., Chorover, J., Maier, R. M. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings: A mesocosm experiment. Sci Total Environ. 500-501, 314-324 (2014).
- JoVE Science Education Database. . Essentials of Environmental Microbiology. Culturing and Enumerating Bacteria from Soil Samples. , (2016).
- JoVE Science Education Database. . Essentials of Environmental Microbiology: Quantifying Environmental Microorganisms and Viruses Using qPCR. , (2016).
- Sengupta, A., Dick, W. A. Bacterial community diversity in soil under two tillage practices as determined by pyrosequencing. Microb. Ecol. 70, 853-859 (2015).
- Caporaso, J. G., et al. Correspondence - QIIME allows analysis of high- throughput community sequencing data. Nat. Publ. Gr. 7, 335-336 (2010).
- Hall, G. E. M., Vaive, J. E., Beer, R., Hoashi, M. Selective leaches revisited, with emphasis on the amorphous Fe oxyhydroxide phase extraction. J. Geochemical Explor. 56, 59-78 (1996).
- Grossman, R. B., Reinsch, T. G., Dane, J. H., Topp, G. C. Bulk density and linear extensibility. Methods of Soil Analysis. Part 4-Physical Methods. , 201-228 (2002).
- Reynolds, W. D., Elrick, D. E., Youngs, E. G., Amoozegar, A., Bootlink, H. W. G., Bouma, J., Dane, J. H., Topp, G. C. Saturated and field-saturated water flow parameters. Methods of Soil Analysis, Part 4-Physical Methods. , 802-816 (2002).
- King, G. M. Contributions of atmospheric CO and hydrogen uptake to microbial dynamics on recent Hawaiian volcanic deposits. Appl. Environ. Microbiol. 69 (7), 4067-4075 (2003).
- Meyer, W. S., Barrs, H. D. Roots in irrigated clay soils: Measurement techniques and responses to rootzone conditions. Irrig. Sci. 12 (3), 125-134 (1991).
- Graham, C. B., Woods, R. A., McDonnell, J. J. Hillslope threshold response to rainfall: (1) A field based forensic approach. J. Hydrol. 393 (1-2), 65-76 (2010).
- Anderson, A. E., Weiler, M., Alila, Y., Hudson, R. O. Dye staining and excavation of a lateral preferential flow network. Hydrol. Earth Syst. Sci. Discuss. 5 (2), 1043-1065 (2008).
- Gleeson, T., Paszkowski, D. Perceptions of scale in hydrology: what do you mean by regional scale?. Hydrol. Sci. J. 00, 1-9 (2013).
- Molins, S., Trebotich, D., Steefel, C. I., Shen, C. An investigation of the effect of pore scale flow on average geochemical reaction rates using direct numerical simulation. Water Resour. Res. 48, W03527 (2012).
- Fierer, N., Lennon, J. T. The generation and maintenance of diversity in microbial communities. Am. J. Bot. 98 (3), 439-448 (2011).
- Niu, G. Y., Pasetto, D., Scudeler, C., Paniconi, C., Putti, M., Troch, P. A. Analysis of an extreme rainfall-runoff event at the Landscape Evolution Observatory by means of a three-dimensional physically-based hydrologic model. Hydrol. Earth Syst. Sci. Discuss. 10, 12615-12641 (2013).
- Marteinsson, V., et al. Microbial colonization in diverse surface soil types in Surtsey and diversity analysis of its subsurface microbiota. Biogeosciences. 12, 1191-1203 (2015).
- Orcutt, B. N., Sylvan, J. B., Rogers, D. R., Delaney, J., Lee, R. W., Girguis, P. R. Carbon fixation by basalt-hosted microbial communities. Front. Microbiol. 6, 00904 (2015).
- Wu, L., Jacobson, A. D., Chen, H. C., Hausner, M. Characterization of elemental release during microbe-basalt interactions at T=28°C. Geochim. Cosmochim. Acta. 71, 2224-2239 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten