Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Sol Lysimètre Excavation pour Coupled hydrologiques, géochimiques et microbiologiques Enquêtes
Dans cet article
Résumé
Cette étude présente une méthode d'excavation pour enquêter sur sous-sol hydrologique, géochimiques, et l'hétérogénéité microbiologique d'un lysimètre du sol. Le lysimètre simule un versant artificiel qui était initialement dans des conditions homogènes et avait été soumis à environ 5000 mm d'eau sur huit cycles d'irrigation dans une période de 18 mois.
Résumé
Studying co-evolution of hydrological and biogeochemical processes in the subsurface of natural landscapes can enhance the understanding of coupled Earth-system processes. Such knowledge is imperative in improving predictions of hydro-biogeochemical cycles, especially under climate change scenarios. We present an experimental method, designed to capture sub-surface heterogeneity of an initially homogeneous soil system. This method is based on destructive sampling of a soil lysimeter designed to simulate a small-scale hillslope. A weighing lysimeter of one cubic meter capacity was divided into sections (voxels) and was excavated layer-by-layer, with sub samples being collected from each voxel. The excavation procedure was aimed at detecting the incipient heterogeneity of the system by focusing on the spatial assessment of hydrological, geochemical, and microbiological properties of the soil. Representative results of a few physicochemical variables tested show the development of heterogeneity. Additional work to test interactions between hydrological, geochemical, and microbiological signatures is planned to interpret the observed patterns. Our study also demonstrates the possibility of carrying out similar excavations in order to observe and quantify different aspects of soil-development under varying environmental conditions and scale.
Introduction
La dynamique des sols et des paysages sont façonnés par l'interaction complexe des propriétés physiques, chimiques et biologiques 1. Le débit d'eau, l' altération géochimique, et l' activité biologique façonnent le développement global du paysage dans un écosystème stable 2,3. Bien que les changements de surface sont les caractéristiques les plus remarquables du paysage 4, les effets cumulatifs de la compréhension hydrologique, géochimiques, et les processus microbiologiques dans la région du sous - sol est cruciale pour comprendre les forces sous - jacentes qui façonnent un paysage 2. Les futurs scénarios de perturbation climatique confondent encore la prévisibilité et la structure du paysage évolution 5. Il devient donc un défi de relier les processus à petite échelle pour leur manifestation à grande échelle sur l'échelle du paysage 6. expériences traditionnelles de laboratoire à court terme ou des expériences dans des paysages naturels avec des conditions initiales inconnues et variable dans le temps de forçage chute courte dans la capture ee hétérogénéité intrinsèque de l'évolution du paysage. En outre, en raison de fort couplage non linéaire, il est difficile de prédire les changements biogéochimiques de la modélisation hydrologique dans les systèmes hétérogènes 7. Ici, nous décrivons une méthode expérimentale nouvelle pour creuser un versant du sol entièrement contrôlé et surveillé avec des conditions initiales connues. Notre excavation et l'échantillonnage procédure vise à capturer l'hétérogénéité de développement de l'hillslope le long de sa longueur et de la profondeur, dans le but de fournir un ensemble complet de données pour étudier les interactions hydro-bio-géochimiques et leur impact sur les processus de formation des sols.
Systèmes hydrologiques trouvés dans la nature sont loin d'être statique dans le temps, avec des changements dans les réponses hydrologiques qui ont lieu sur une large gamme d'échelles spatiales et temporelles 3. La structure spatiale des voies d'écoulement le long de paysages détermine le taux, l'étendue et la distribution des réactions géochimiques et la colonisation biologique qui conduisentaux intempéries, le transport et la précipitation des solutés et des sédiments, et le développement de la structure du sol. Ainsi, l' intégration des connaissances de la pédologie, de la géophysique et de l' écologie dans les théories et les modèles expérimentaux pour évaluer les processus hydrologiques et améliorer les prévisions hydrologiques a été suggéré 8,9. Évolution du paysage est également impactée par sous - sol les processus biogéochimiques en conjonction avec la dynamique de l' eau, la migration élémentaire au cours du développement du sol, et par des transformations minéralogiques provoquées par la réaction de surfaces minérales avec l' air, l' eau, et des micro - organismes 10. Par conséquent, il est important d'étudier le développement des hotspots géochimiques dans un paysage en constante évolution. En outre, il est essentiel de relier les modèles d'altération géochimique au processus hydrologiques et les signatures microbiologiques pendant la formation du sol naissante afin de comprendre la dynamique du développement du paysage complexe. Les processus spécifiques de la genèse des sols sont régiespar l'influence combinée du climat, des intrants biologiques, de secours et de temps sur un matériau parent spécifique. Cette expérience a été conçue pour répondre à des hétérogénéités dans l'altération du matériau parental régi par des variations hydrologiques et géochimiques associés à relief (y compris la pente et la profondeur) et la variabilité associée à l' activité microbienne qui est entraînée par des gradients environnementaux ( par exemple, le potentiel de redox) dans des conditions où matériau parent, le climat et le temps sont maintenus constants. En ce qui concerne l' activité microbienne, les microorganismes du sol sont des composants critiques et avoir un impact profond sur la stabilité du paysage 11. Ils jouent un rôle crucial dans la structure du sol, les cycles biogéochimiques des éléments nutritifs, et la croissance des plantes. Par conséquent, il est nécessaire de comprendre la signification de ces organismes en tant que moteurs de l'altération, la genèse des sols, et les processus de formation du paysage, tout en identifiant simultanément les effets réciproques des trajets d'écoulement hydrologiques et géochimiques nousathering sur la structure de la communauté microbienne et de la diversité. Ceci peut être réalisé par l'étude de l'hétérogénéité spatiale de la diversité de la communauté microbienne sur un paysage en évolution dont hydrologique et caractéristiques géochimiques sont également étudiés en parallèle.
Ici, nous présentons une procédure d'excavation d'un lysimètre du sol, du nom opérationnel miniLEO, conçu pour imiter les grands modèles de bassins d'ordre zéro de l'Observatoire Evolution du paysage (LEO) logé au Biosphere 2 (Université d'Arizona). Le miniLEO a été développé pour identifier les modèles d'évolution du paysage à petite échelle résultant des processus hydro-bio-géochimiques hétérogènes cumulatifs. Il est un lysimètre de 2 m de longueur, 0,5 m de largeur et 1 m en hauteur et inclinaison de 10 ° (figure 1). En outre, les parois de lysimètre sont isolés et revêtus avec des non-biodégradable en deux parties primaire époxy et une couche d'uréthane aliphatique agrégat rempli afin d'éviter la contamination ou la lixiviation potentiellede métaux à partir du cadre de lysimètre dans le sol. Le lysimètre a été rempli avec pilée roche basaltique qui a été extrait d'un gisement de fin tephra Pléistocène associée à Merriam Crater dans le nord de l'Arizona. Le matériau de basalte chargé était identique à celle du matériau utilisé dans les expériences beaucoup plus importantes en orbite basse. La composition minérale, la distribution de la taille des particules et des propriétés hydrauliques sont décrits par Pangle et al. 12. Le visage d'infiltration downslope a été doublée d'un tamis perforé en plastique (pores 0,002 m de diamètre, 14% de porosité). Le système est équipé de capteurs tels que la teneur en eau et des capteurs de température, deux types de capteurs potentiels de l'eau, des échantillonneurs sol-eau, l'équilibre de poids hydraulique, sondes de conductivité électrique, et des transducteurs de pression pour déterminer l'eau hauteur de la table. Le lysimètre a été irriguée pendant 18 mois avant l'excavation.
La fouille était méticuleux dans son approche et avait pour but de répondre à deux grandes questions: (1) ce qui hydrologique, géochimiques et signatures microbiennes peut être observé à travers la longueur et la profondeur de la pente par rapport à des conditions de précipitations simulées et (2) si les relations et rétroactions entre les processus hydro-bio-géochimiques survenant sur le versant peuvent être déduites les signatures individuelles. Parallèlement à la mise en place expérimentale et procédure d'excavation, nous présentons des données et suggestions représentatives sur la façon d'appliquer les protocoles de fouilles similaires pour les chercheurs intéressés à étudier la dynamique terre-système couplé et / ou les processus de développement du sol.
Protocole
1. Concevoir une matrice d'échantillonnage pour assurer l'échantillonnage systématique et complète de Lysimètre
- Diviser lysimeter en voxels de longueur fixe, la largeur et la profondeur.
- Utiliser un espace euclidien système de coordonnées et de diviser la distance totale le long de chaque direction (X, Y et Z) en un nombre suffisant d'intervalles équidistants. Envisager de jeter le sol près des murs de lysimètre pour éviter les effets de bord.
REMARQUE: un tampon de 5 cm le long des quatre parois est adopté dans cette expérience, afin d'éviter les effets de bord, tout en veillant à ce que le volume de sol recueilli est suffisant. - Attribuer chaque échantillon d'un emplacement unique XYZ et identifier comme un voxel.
NOTE: Dans cette excavation, X représente l'emplacement le long de la largeur de la pente, Y désigne un emplacement le long de la longueur de la pente, tandis que Z représente un emplacement le long de la profondeur de la pente. La taille des intervalles dans chaque dimension détermine la largeur, la longueur et la profondeur des voxels. Figure 2 illustre la répartition des lysimètre après la détermination des intervalles d'espacement le long de l'origine choisie pour le système XYZ. La division dans le système d'excavation actuelle a 9 intervalles le long des deux directions Y et Z et 4 intervalles le long de la direction X, produisant un total de 324 voxels de 10 cm x 20 cm x 10 cm dimensions (figure 3).
NOTE: La stratégie d'échantillonnage choisie garantit que l'ensemble du système est uniformément échantillonné avec un minimum de dommages aux capteurs. Les limites de chaque voxel (1-2 cm) sont rejetés pour limiter la contamination croisée à partir de voxels voisins. En outre, les dimensions de voxels veiller à ce que des matériaux du sol assez est disponible pour microbiologique, géochimiques et la collecte d'échantillons hydrologiques dans chaque voxel.
- Utiliser un espace euclidien système de coordonnées et de diviser la distance totale le long de chaque direction (X, Y et Z) en un nombre suffisant d'intervalles équidistants. Envisager de jeter le sol près des murs de lysimètre pour éviter les effets de bord.

Figure 1. Vue latérale du lysimètre. Vue de lysimètre de la fa infiltrationce. On distingue également les trois régions de capteurs (tubes en PVC blanc) le long du système de pente et de gicleurs dans les quatre coins.

Figure 2. Schéma d' échantillonnage. Schéma d'échantillonnage de lysimètre le long XYZ. A. La dimension X divise la largeur en 4 sections chacune de 10 cm tandis que Y divise la longueur en 20 cm. B. La Z dimension indique la profondeur et a été divisée en 9 couches de 10 cm de profondeur. Une limite de 5 cm tout le long des bords de la lysimètre a été identifié pour empêcher la collecte d'échantillons qui peuvent potentiellement exposer l' effet frontière. S'il vous plaît cliquer ici pour télécharger ce fichier.
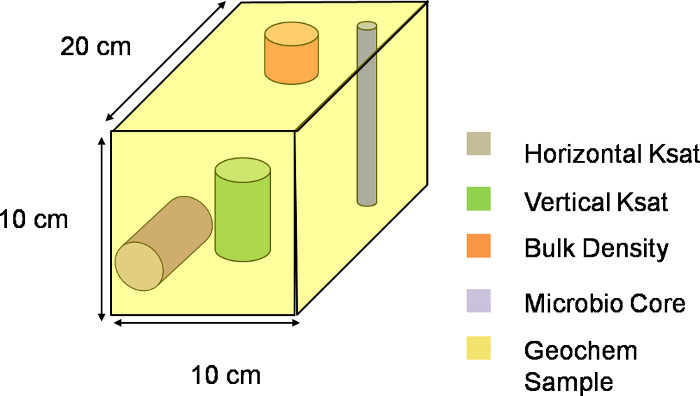
Figure 3. Trois-dreprésentation imensional d'un voxel. de schéma visuel d'un voxel le long du plan XYZ du lysimètre. L'ensemble de la pente a été divisée en 324 ces voxels, chaque voxel représentant une seule unité d'échantillonnage. S'il vous plaît , cliquez ici pour télécharger ce fichier.
2. Ajouter Brilliant Blue FCF Dye to Track Infiltration d'eau dans la pente
- Appliquer le colorant bleu brillant à la surface du sol, assez pour couvrir top 105 cm de la surface le long de la direction Y. Couvrir le sol restant avec des feuilles de plastique.
- Choisissez une concentration (ici 10 g / L) pour garantir le contraste contre le sol basaltique noir. Ajouter le colorant à des réservoirs du système d'irrigation et diluer avec de l'eau jusqu'à la concentration voulue.
- Décider de la durée de l'arrosage en fonction de la profondeur souhaitée du front d'infiltration et de la vitesse fournie par le système d'irrigation.
NOTE: Pour cette étude, un itaux de 30 mm / h pendant 20 minutes (figure 4) avant l'excavation rrigation est considérée comme suffisante pour identifier les modèles hétérogènes de l' infiltration de l' eau pendant les quelques premiers centimètres. - Après application de la teinture, donner du temps pour l'infiltration d'arrêter et les états d'humidité dans le lysimètre à équilibrer. Pour cette étude, une période de 10 heures (la nuit) entre l'application de teinture et d'excavation était appropriée.
3. Délimitation de voxels
- Attachez un ruban à mesurer le long de la longueur de la pente de fournir un système de référence in situ pour le guidage lors de la démarcation de voxels.
- Marquez la dimension de chaque voxel du sol à l'aide de la bande de mesure. Tracez des lignes de la grille pour chaque couche à l' aide de boucliers en aluminium-lames et des couteaux en plastique de mastic (figure 4). Jeter les matériaux aux limites (5 cm de chaque mur pour éviter les effets de bord).

Figure 4. Vue de dessus lysimètre. Cette vue montre la surface colorée de la couche 2 (10 cm de profondeur). Grids tirés sur la surface du sol à l'aide d'échantillonnage sont également visibles, ainsi que des trous de base des régions à chaque voxel après le prélèvement microbiologique.
4. Microbiologie Prélèvement d'échantillons
- Prélever des échantillons de microbiologie aseptique de chaque voxel avant hydrologiques et géochimiques analyses pour prévenir la contamination croisée des échantillons. Veiller à ce que de nouveaux gants sont portés par tous les membres qui effectuent les travaux d'excavation pour réduire la contamination de la peau humaine.
- Utilisez un carottier de 1 cm de diamètre et 20 cm de hauteur, et une mince spatule pour la collecte de l'échantillon microbiologique du sol. Nettoyez le carottier et la spatule avec de l'eau distillée, séchez avec des lingettes propres, et rincer à l'éthanol à 75% en utilisant un flacon pulvérisateur. Laisser carottier et la spatule à l'air sec.
- Notez le collecte temps de chaque échantillon. Utiliser le carottier à noyau jusqu'à une profondeur de 10 cm à chaque emplacement de voxel, et la spatule pour vider l'échantillon de sol dans des sacs en plastique pré-stérilisés (figure 5). Prenez soin d'ouvrir le sac juste avant le dépôt de l'échantillon. Homogénéiser les poches d'échantillons à la main.
- Conservez le sac de l'échantillon dans une glacière pendant l'échantillonnage, et de transférer le plus tôt possible à -80 ° C congélateur.

Figure 5. prélèvement d'échantillons de microbiologie. Un petit carottier de poche de 20 cm x 1 cm, sacs stériles, et spatule est montré ici lors de l' échantillonnage microbiologique. S'il vous plaît cliquer ici pour télécharger ce fichier.
5. Géochimie et Hydrologie Prélèvement d'échantillons
- régions Photograph teints en X et Y planes pendant excavation pour des profondeurs où le colorant est observée. Utilisez une carte de couleur pour fournir une référence pour la couleur observée (Figure 6). Assurer un éclairage naturel adéquat est présent pour documenter correctement l'intensité des couleurs.
- Calibrer portable spectromètre de fluorescence de rayons X (pXRF) tous les jours avant de commencer les mesures. Pour étalonnage et de mesure de détails, voir les instructions du fabricant 13 (figure 7). En bref, placer l'instrument sur le support et pointer directement la fenêtre de faisceau vers le bourrelet de métal de l'usine. Sélectionnez 'Cal' et attendre 30 secondes pour permettre l'étalonnage soit terminé.
- Nettoyez la fenêtre de faisceau avant de prendre chaque mesure. Mesurer la surface de chaque voxel en triple exemplaire à trois endroits différents. Placer l'instrument pXRF sur la surface du sol et attendre 90 secondes pour permettre la mesure à effectuer.
REMARQUE: Les rayons X peuvent pénétrer à travers une longue distance dans la direction du faisceau. Par conséquent, ensure que seul un personnel qualifié gère l'équipement et maintient des protocoles de sécurité appropriées.
- Nettoyez la fenêtre de faisceau avant de prendre chaque mesure. Mesurer la surface de chaque voxel en triple exemplaire à trois endroits différents. Placer l'instrument pXRF sur la surface du sol et attendre 90 secondes pour permettre la mesure à effectuer.

Figure 6. Carte couleur à suivre colorant infiltration. Chaque emplacement avec une pénétration de colorant visible a été photographié avec une carte de couleur servant de référence. S'il vous plaît cliquer ici pour télécharger ce fichier.

Figure 7. Portable-ray de X Fluorescence Spectrometer. Handheld pXRF positionné sur la surface d'un voxel. Les mesures ont été enregistrées à trois endroits différents sur la surface de chaque voxel et ensuite moyennées.
- noyaux Clean métalliques (hauteur = 3 cm, dia. = 5,7 cm) et polycarbonate cores (hauteur = 6 cm, dia. = 5,7 cm) pour des densités en vrac (BD) et des mesures de conductivité hydraulique (Ksat) de voxels souhaités, respectivement (figure 8).
- insérer Verticalement noyaux métalliques et des noyaux en polycarbonate (Ksat vertical) en voxels désirées en prenant soin de ne pas endommager les capteurs ou les fils du capteur. Pour ce faire, en martelant doucement les carottes dans le sol, en prenant soin d'utiliser une surface plane comme un bloc de bois entre le noyau et le marteau afin de minimiser les perturbations du sol. En outre, une fois que le noyau est à mi-chemin dans le sol, placer une seconde âme au-dessus du premier noyau. Placer le bloc en bois sur le dessus du deuxième noyau et le marteau doucement le bloc jusqu'à ce que le premier noyau est noyée dans le sol avec le rebord encore visible du noyau.
- Insérez des noyaux pour Ksat horizontal que la face latérale du voxel ouvre avec excavation séquentielle. Utilisez le bloc de bois et deuxième noyau comme mentionné à l'étape 5.4 pour minimiser le compactage.
- Prenez soin de veiller à ce que le voxeléchantillonné est isolé de voxels voisins limites et avant le prélèvement des échantillons géochimiques. Utilisez les couteaux à mastic en plastique à cet effet, suivie par truelles à main pour recueillir des échantillons de sol autour de métal ou de polypropylène noyaux dans géochimiques (GC) échantillons des sacs étiquetés jusqu'à noyaux peuvent être facilement enlevés (par exemple, la figure 9a, b).

Figure 8. Densité en vrac et des noyaux de conductivité hydraulique. Noyaux de polypropylène ( à gauche) ont été utilisés pour prélever des échantillons de conductivité hydraulique verticale et horizontale tandis que les noyaux métalliques ( à droite) ont été utilisés pour prélever des échantillons de densité apparente.

Figure 9. Voxel démarcation. Couteaux à mastic en plastique ont été utilisés pour (A) isolerlimites de voxels avant (B) géochimique, la densité apparente, et la collecte hydraulique de base de conductivité. S'il vous plaît cliquer ici pour télécharger ce fichier.
- Retirez le noyau métallique, brosser excès de matériau à partir des deux extrémités, et le transfert de l'échantillon de base à un sac de prélèvement BD marqué. Peser chaque sac de prélèvement avec l'échantillon et enregistrer le poids total.
- Retirez les noyaux de polypropylène. Couvrir les deux côtés avec des bouchons en plastique rouge et étiqueter vertical noyau de polypropylène comme "V" et le noyau de polypropylène horizontale "H" suivi de l'ID de l'échantillon.
- Recueillir la matière restante du voxel dans le sac de l'échantillon de GC, laissant derrière quelques centimètres du sol à tous les quatre côtés pour éviter la contamination croisée avec la prochaine voxel.
- Répétez des étapes 5.9 à 5.1 le reste des voxels en une seule couche.
- Une fois que tous les voxels d'une couche ont ététerminé, répétez les étapes 3,2 à 5,10 pour la couche suivante.
REMARQUE: L'étape 5.1 doit être effectuée uniquement pour les voxels qui ont colorant visible. Reportez - vous à la figure 10 pour visualiser schéma représentatif d'un voxel mettant en évidence tous les échantillons prélevés dans chaque voxel.

Ligne Figure 10. voxel représentant. La ligne pointillée rouge coeur indique recueilli pour l' échantillon de la microbiologie, le vert en pointillés indique noyau de la conductivité hydraulique horizontale, la ligne de bord jaune indique noyau de conductivité hydraulique verticale, la violette en pointillés indique noyau de densité apparente, et la limite ovale bleu indique l' échantillon du voxel restant étant utilisé pour l' analyse géochimique. S'il vous plaît cliquer ici pour télécharger ce fichier.
Analyse 6. Sample
- Utiliser des échantillons prélevés pour des analyses microbiologiques pour moléculaire (extraction d'ADN microbienne du sol) 14 et de culture (chiffres de plaques hétérotrophes) 15 analyses. Utiliser l' ADN extrait pour des réactions quantitatives en chaîne par polymérase (qPCR) 16, et à haut débit séquençage des gènes expériences 17,18.
- Utiliser des échantillons prélevés pour analyses géochimiques pour mesurer une multitude de propriétés géochimiques , y compris le pH (méthode US EPA 150.2), la conductivité électrique (CE) (US méthode EPA 120.1), le carbone et la teneur en azote (US méthode EPA 415.3, extraction séquentielle des éléments 19, et diffraction des rayons X (XRD) et exafs (EXAFS) spectroscopie selon les spécifications de Stanford synchrotron Radiation Laboratory, pour enquêter sur les transformations minérales.
- Utiliser des échantillons de base recueillies pour les analyses hydrologiques pour des expériences de laboratoire tels que la densité apparente 20et la conductivité hydraulique 21.
Résultats
Les dimensions de voxels assuré la collecte d'échantillons pour hydrologiques, géochimiques et des mesures microbiologiques. La procédure de fouille a abouti à 324 noyaux pour l'analyse microbiologique, 972 pXRF points de données, 324 sacs d'échantillons géochimiques, 180 échantillons Ksat (128 verticale et horizontale 52), et 311 échantillons de densité apparente. L'écoulement préférentiel de colorant bleu brillant a également été observée à une profon...
Discussion
Évolution du paysage est l'effet cumulatif de hydrologiques, géochimiques et biologiques 12. Ces processus contrôlent le flux et le transport de l'eau et des éléments, et les réactions biogéochimiques dans l'évolution des paysages. Cependant, la capture des interactions nécessite simultanément la conception expérimentale précisément coordonnée et d'échantillonnage. En outre, l'étude naissante évolution du paysage est difficile dans les systèmes naturels, avec des capacit?...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We thank Ty P.A. Ferré, Till Volkman, Edwin Donker, Mauricio Vera for helping us during the excavation, and Triffon J. Tatarin, Manpreet Sahnan and Edward Hunt for their help in sample analysis. This work was carried out at Biosphere 2, University of Arizona and funded by National Science Foundation grant EAR_1344552 and Honors Research Program of Biosphere 2.
matériels
| Name | Company | Catalog Number | Comments |
| Measuring tape | Any | Any | Preventing cross-contamination of samples is crucial. Therefore, it is helpful to have multiple putty knives to isolate voxel boundary. |
| Brilliant Blue dye | Waldeck GmBH &Co | B0770 | Rulers can be used to draw grids. The sampling strategy can be modified based on individual experiments. |
| Soil Corer | AMS | 56975 | Any commercially manufactured Brilliant Blue dye can be used. |
| 75% Ethanol | Any | Any | A Nikon D90 camera and 50 mm lens were used for photography. Any high resolution camera and lens can be used for this purpose. |
| Spray Bottle | Any | Any | Use of dye and color card is subjective to individual experiments and/or research questions. |
| Spatula | Any | Any | Gardening gloves may be used if handling of corer becomes tedious. |
| Gloves | Any | Any | Ensure microbiology samples are kept in ice during sampling and frozen as soon as possible. |
| KimWipes | KimTech Science | Any | Water can be used to wash soil corer, prior to sanitizing with ethanol. |
| Sterile Sample bags | Fisher Scientific | Whirl-Pak 4 OZ. 24 OZ | Keep buckets and dustpans handy to facilitate removal of waste soil. |
| Color Card | Any | Any | The original design of miniLEO has various sensors embedded in the lysimeter. Such sensors may or may not be necessary based on the scope of individual experimental design. |
| X-ray Fluoresce Spectrophotmeter | XRF, OLYMPUS | DS-2000 Delta XRF | |
| Polypropylene cores | Any | Any | |
| Metal cores | Any | Any | |
| Caps for polypropylene cores | Any | Any | |
| Hammer | Any | Any | |
| Plastic putty knives | Any | Any | |
| Face masks | Any | Any |
Références
- Brady, N. C., Weil, R. R. . The nature and properties of soils. , (2008).
- Chorover, J., Kretzschmar, R., Garica-Pichel, F., Sparks, D. L. Soil biogeochemicial processes within the critical zone. Elements. 3, 321-326 (2007).
- Troch, P. A., et al. Catchment coevolution: A useful framework for improving predictions of hydrological change?. Water Resour. Res. 6, 1-20 (2015).
- Sharp, R. P. Landscape evolution (A Review). Proc. Natl. Acad. Sci. U. S. A. 79, 4477-4486 (1982).
- Temme, A., Montgomery, D. R., Bierman, P. R. Predicting the effect of changing climate on landscapes with computer based landscape evolution models. Key Concepts in Geomorphology. , (2013).
- Troch, P. A., et al. Dealing with Landscape Heterogeneity in Watershed Hydrology: A Review of Recent Progress toward New Hydrological Theory. Geogr. Compass. 3, 375-392 (2009).
- Wang, Y., et al. Dissecting the Hydrobiogeochemical Box. in Am. Geophys. Union Fall Meet. , (2015).
- Lin, H., et al. Hydropedology: Synergistic integration of pedology and hydrology. Water Resour. Res. 42 (5), W05301 (2006).
- Band, L. E., et al. Ecohydrological flow networks in the subsurface. Ecohydrology. 7, 1073-1078 (2014).
- Churchman, G. j., Lowe, D. . Handbook of Soil Science Properties and Process. 1, (2012).
- van der Heijden, M. G. A., Bardgett, R. D., van Straalen, N. M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol. Lett. 11 (3), 296-310 (2008).
- Pangle, L. a., et al. The Landscape Evolution Observatory: A large-scale controllable infrastructure to study coupled Earth-surface processes. Geomorphology. 244, 190-203 (2015).
- . . User Manual: Delta Famiy Handheld XRF Analyzers. , (2013).
- Valentìn-Vargas, A., Root, R. A., Neilson, J. W., Chorover, J., Maier, R. M. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings: A mesocosm experiment. Sci Total Environ. 500-501, 314-324 (2014).
- JoVE Science Education Database. . Essentials of Environmental Microbiology. Culturing and Enumerating Bacteria from Soil Samples. , (2016).
- JoVE Science Education Database. . Essentials of Environmental Microbiology: Quantifying Environmental Microorganisms and Viruses Using qPCR. , (2016).
- Sengupta, A., Dick, W. A. Bacterial community diversity in soil under two tillage practices as determined by pyrosequencing. Microb. Ecol. 70, 853-859 (2015).
- Caporaso, J. G., et al. Correspondence - QIIME allows analysis of high- throughput community sequencing data. Nat. Publ. Gr. 7, 335-336 (2010).
- Hall, G. E. M., Vaive, J. E., Beer, R., Hoashi, M. Selective leaches revisited, with emphasis on the amorphous Fe oxyhydroxide phase extraction. J. Geochemical Explor. 56, 59-78 (1996).
- Grossman, R. B., Reinsch, T. G., Dane, J. H., Topp, G. C. Bulk density and linear extensibility. Methods of Soil Analysis. Part 4-Physical Methods. , 201-228 (2002).
- Reynolds, W. D., Elrick, D. E., Youngs, E. G., Amoozegar, A., Bootlink, H. W. G., Bouma, J., Dane, J. H., Topp, G. C. Saturated and field-saturated water flow parameters. Methods of Soil Analysis, Part 4-Physical Methods. , 802-816 (2002).
- King, G. M. Contributions of atmospheric CO and hydrogen uptake to microbial dynamics on recent Hawaiian volcanic deposits. Appl. Environ. Microbiol. 69 (7), 4067-4075 (2003).
- Meyer, W. S., Barrs, H. D. Roots in irrigated clay soils: Measurement techniques and responses to rootzone conditions. Irrig. Sci. 12 (3), 125-134 (1991).
- Graham, C. B., Woods, R. A., McDonnell, J. J. Hillslope threshold response to rainfall: (1) A field based forensic approach. J. Hydrol. 393 (1-2), 65-76 (2010).
- Anderson, A. E., Weiler, M., Alila, Y., Hudson, R. O. Dye staining and excavation of a lateral preferential flow network. Hydrol. Earth Syst. Sci. Discuss. 5 (2), 1043-1065 (2008).
- Gleeson, T., Paszkowski, D. Perceptions of scale in hydrology: what do you mean by regional scale?. Hydrol. Sci. J. 00, 1-9 (2013).
- Molins, S., Trebotich, D., Steefel, C. I., Shen, C. An investigation of the effect of pore scale flow on average geochemical reaction rates using direct numerical simulation. Water Resour. Res. 48, W03527 (2012).
- Fierer, N., Lennon, J. T. The generation and maintenance of diversity in microbial communities. Am. J. Bot. 98 (3), 439-448 (2011).
- Niu, G. Y., Pasetto, D., Scudeler, C., Paniconi, C., Putti, M., Troch, P. A. Analysis of an extreme rainfall-runoff event at the Landscape Evolution Observatory by means of a three-dimensional physically-based hydrologic model. Hydrol. Earth Syst. Sci. Discuss. 10, 12615-12641 (2013).
- Marteinsson, V., et al. Microbial colonization in diverse surface soil types in Surtsey and diversity analysis of its subsurface microbiota. Biogeosciences. 12, 1191-1203 (2015).
- Orcutt, B. N., Sylvan, J. B., Rogers, D. R., Delaney, J., Lee, R. W., Girguis, P. R. Carbon fixation by basalt-hosted microbial communities. Front. Microbiol. 6, 00904 (2015).
- Wu, L., Jacobson, A. D., Chen, H. C., Hausner, M. Characterization of elemental release during microbe-basalt interactions at T=28°C. Geochim. Cosmochim. Acta. 71, 2224-2239 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon