È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Terreno lisimetro scavo per accoppiate idrologici, geochimiche e microbiologiche Investigations
In questo articolo
Riepilogo
Questo studio presenta un metodo di scavo per indagare idrogeologico del sottosuolo, geochimica, ed eterogeneità microbiologica di un lisimetro terreno. Il lisimetro simula un versante artificiale che inizialmente era in condizioni omogenee ed era stato sottoposto a circa 5.000 mm di acqua in otto cicli di irrigazione in un periodo di 18 mesi.
Abstract
Studying co-evolution of hydrological and biogeochemical processes in the subsurface of natural landscapes can enhance the understanding of coupled Earth-system processes. Such knowledge is imperative in improving predictions of hydro-biogeochemical cycles, especially under climate change scenarios. We present an experimental method, designed to capture sub-surface heterogeneity of an initially homogeneous soil system. This method is based on destructive sampling of a soil lysimeter designed to simulate a small-scale hillslope. A weighing lysimeter of one cubic meter capacity was divided into sections (voxels) and was excavated layer-by-layer, with sub samples being collected from each voxel. The excavation procedure was aimed at detecting the incipient heterogeneity of the system by focusing on the spatial assessment of hydrological, geochemical, and microbiological properties of the soil. Representative results of a few physicochemical variables tested show the development of heterogeneity. Additional work to test interactions between hydrological, geochemical, and microbiological signatures is planned to interpret the observed patterns. Our study also demonstrates the possibility of carrying out similar excavations in order to observe and quantify different aspects of soil-development under varying environmental conditions and scale.
Introduzione
Suoli e del paesaggio dinamiche sono modellati dalla complessa interazione di fisici, chimici e processi biologici 1. Il flusso di acqua, agenti atmosferici geochimica, e l'attività biologica forma lo sviluppo complessivo del paesaggio in un ecosistema stabile 2,3. Mentre i cambiamenti di superficie sono le caratteristiche più evidenti del paesaggio 4, effetti cumulativi comprensione di idrologica, geochimica e processi microbiologici nella regione sottosuolo è fondamentale per comprendere le forze sottostanti che formano un paesaggio 2. I futuri scenari di perturbazione del clima confondono ulteriormente la prevedibilità e il modello di evoluzione del paesaggio 5. Si diventa così una sfida per collegare i processi su piccola scala per la loro manifestazione su larga scala sul paesaggio scala 6. esperimenti di laboratorio di breve periodo tradizionali o esperimenti in paesaggi naturali, con condizioni iniziali sconosciute e variabile nel tempo costringendo inferiori a catturare °e l'eterogeneità intrinseca di evoluzione del paesaggio. Inoltre, a causa della forte accoppiamento non lineare, è difficile prevedere i cambiamenti biogeochimici dalla modellazione idrologica in sistemi eterogenei 7. Qui, descriviamo un metodo sperimentale romanzo per scavare un versante terreno completamente controllato e monitorato con condizioni iniziali note. La nostra procedura di scavo e di campionamento ha lo scopo di catturare l'eterogeneità sviluppo del versante lungo la sua lunghezza e la profondità, con l'obiettivo di fornire un set di dati completo per studiare le interazioni idro-bio-geochimici e il loro impatto sui processi di formazione del suolo.
Sistemi idrologici si trovano in natura sono ben lungi dall'essere statica nel tempo, con i cambiamenti nelle risposte idrologici che si svolgono in un ampio intervallo di scale spaziali e temporali 3. La struttura spaziale di percorsi di flusso lungo paesaggi determina la velocità, portata e distribuzione di reazioni geochimiche e la colonizzazione biologica che guidanoatmosferici, il trasporto e la precipitazione di soluti e sedimenti, e l'ulteriore sviluppo della struttura del suolo. Così, incorporando la conoscenza da pedologia, la geofisica, e l'ecologia in teorie e progetti sperimentali per valutare i processi idrologici e migliorare le previsioni idrologiche è stato suggerito 8,9. Evoluzione del paesaggio è anche influenzato da processi biogeochimici del sottosuolo in concomitanza con le dinamiche d'acqua, la migrazione degli elementi durante lo sviluppo del suolo, e da trasformazioni mineralogiche apportati dalla reazione di superfici minerali con l'aria, l'acqua, e microrganismi 10. Di conseguenza, è importante studiare sviluppo di hotspot geochimica all'interno di un paesaggio in evoluzione. Inoltre, è fondamentale mettere in relazione i modelli atmosferici geochimici al processo idrologico e le firme microbiologici durante la formazione del suolo incipiente al fine di comprendere le dinamiche di sviluppo del paesaggio complesso. I processi specifici della genesi dei suoli sono regolatidall'influenza combinata di clima, ingressi biologiche, di rilievo e il tempo su un materiale di appartenenza specifico. Questo esperimento è stato progettato per affrontare eterogeneità nella atmosferici di materiale madre sia soggetta variazioni idrologiche e geochimici associati a rilievo (tra cui pendenza e profondità) e la variabilità associata in attività microbica che è guidato da gradienti ambientali (ad esempio, potenziale redox) in condizioni in cui materiale parentale, il clima e il tempo sono mantenuti costanti. Per quanto riguarda l'attività microbica, microrganismi del suolo sono componenti critici e avere un profondo impatto sulla stabilità del paesaggio 11. Essi svolgono un ruolo cruciale nella struttura del terreno, cicli biogeochimici delle sostanze nutritive e la crescita delle piante. Pertanto, è necessario capire il significato di questi organismi come driver di agenti atmosferici, genesi dei suoli, e processi di formazione del paesaggio, individuando allo stesso tempo gli effetti reciproci di idrologici portate percorsi e geochimica noiathering sulla struttura delle comunità microbiche e la diversità. Ciò può essere ottenuto studiando eterogeneità spaziale della diversità comunità microbica su un paesaggio evoluzione cui idrologica e caratteristiche geochimiche vengono anche studiato in parallelo.
Qui, vi presentiamo una procedura di scavo di un lisimetro terreno, operativamente nome miniLEO, progettato per imitare i grandi modelli dei bacini di ordine zero della Evolution Osservatorio del Paesaggio (LEO) ospitato presso Biosphere 2 (University of Arizona). Il miniLEO è stato sviluppato per identificare i piccoli modelli di evoluzione del paesaggio derivanti dai processi cumulativi eterogenei idro-bio-geochimici. Si tratta di un lisimetro 2 m di lunghezza, 0,5 m di larghezza e 1-m di altezza, e la pendenza di 10 ° (figura 1). Inoltre, le pareti del lisimetro sono isolati e rivestiti con non biodegradabili due parti primer epossidico e un aggregato riempito cappotto uretano alifatico per evitare la contaminazione potenziale o lisciviazionedi metalli dal telaio lisimetro nel terreno. Il lisimetro è stato riempito con pietrisco basaltico che è stato estratto da un deposito di tardo Pleistocene tephra associata a Merriam Crater in Arizona del Nord. Il materiale di basalto caricata era identico al materiale utilizzato negli esperimenti LEO molto più grandi. La composizione minerale, granulometria e proprietà idrauliche sono descritte da Pangle et al. 12. La faccia infiltrazioni discendente è stato rivestito con uno schermo perforato plastica (pori del diametro di 0.002-m, il 14% porosità). Il sistema è dotato di sensori come contenuto d'acqua e sensori di temperatura, due tipi di acqua potenziali sensori, campionatori suolo-acqua, il bilanciamento del peso idraulico, sonde di conducibilità elettrica, e trasduttori di pressione per determinare l'altezza di falda. Il lisimetro è stato irrigato per 18 mesi prima di scavo.
Lo scavo è stata meticolosa nel suo approccio e mirava a rispondere a due domande principali: (1) quello idrologico, geochimica, e le firme microbica può essere osservato in tutta la lunghezza e la profondità della pendenza rispetto alle condizioni di pioggia simulati e (2) se le relazioni e feedback tra processi idro-bio-geochimici che si verificano sul versante possono essere dedotte da le singole firme. Accanto al setup sperimentale e procedura di scavo, presentiamo dati rappresentativi e suggerimenti su come applicare i protocolli di scavo simili per i ricercatori interessati a studiare le dinamiche terra-sistema accoppiato e / o processi di sviluppo del suolo.
Protocollo
1. Elaborare una matrice di campionamento per garantire la sistematica e completa di campionamento di lisimetro
- Dividere lisimetro in voxel di lunghezza, larghezza e profondità fissa.
- Utilizzare uno spazio euclideo sistema di coordinate e dividere la distanza totale lungo ogni direzione (X, Y e Z) in un numero adeguato di intervalli equidistanti. Considerate scartando il terreno nei pressi delle mura della lisimetro per evitare effetti di bordo.
NOTA: Un buffer di 5 cm lungo le quattro pareti è adottato in questo esperimento per evitare effetti di bordo, accertando che il volume di terreno raccolto è sufficiente. - Assegnare ad ogni campione di una posizione unica XYZ e identificare come un voxel.
NOTA: In questo scavo, X indica la posizione lungo la larghezza della pista, Y denota posizione lungo la lunghezza della falda, mentre Z indica posizione lungo la profondità del pendio. La dimensione degli intervalli all'interno di ogni dimensione determina la larghezza, la lunghezza e la profondità dei voxel. FIGURA 2 mostra la divisione del lisimetro dopo aver determinato intervalli della spaziatura insieme con l'origine scelto per il sistema XYZ. La divisione in regime scavo corrente ha 9 intervalli lungo entrambe le direzioni Y e Z e 4 intervalli lungo la direzione X, producendo un totale di 324 voxel di 10 cm x 20 cm x 10 cm Dimensioni (Figura 3).
NOTA: La strategia di campionamento prescelto assicura che l'intero sistema è uniformemente campionati con minimo danno ai sensori. I confini di ogni voxel (1-2 cm) vengono scartate per limitare la contaminazione incrociata da voxel limitrofi. Inoltre, le dimensioni voxel garantire che il materiale abbastanza suolo è disponibile per microbiologica, geochimica, e la raccolta del campione idrologica in ogni voxel.
- Utilizzare uno spazio euclideo sistema di coordinate e dividere la distanza totale lungo ogni direzione (X, Y e Z) in un numero adeguato di intervalli equidistanti. Considerate scartando il terreno nei pressi delle mura della lisimetro per evitare effetti di bordo.

Figura 1. Side-view di lisimetro. Vista del lisimetro dalla Fa infiltrazioniCE. visibile sono anche tre regioni del sensore (tubi in PVC bianco) lungo il sistema di pendenza e di irrigazione ai quattro angoli.

Figura 2. Schema di campionamento. Schema di campionamento di lungo lisimetro XYZ. Dimensione A. La X divide la larghezza in 4 sezioni, ciascuna di 10 cm, mentre Y divide la lunghezza in 20 cm. Dimensione B. La Z indica la profondità ed è stato diviso in 9 strati di 10 cm di profondità. Un confine di 5 cm lungo tutta i bordi del lisimetro è stato identificato per prevenire la raccolta di campioni che possono potenzialmente esporre effetto di confine. Clicca qui per scaricare questo file.
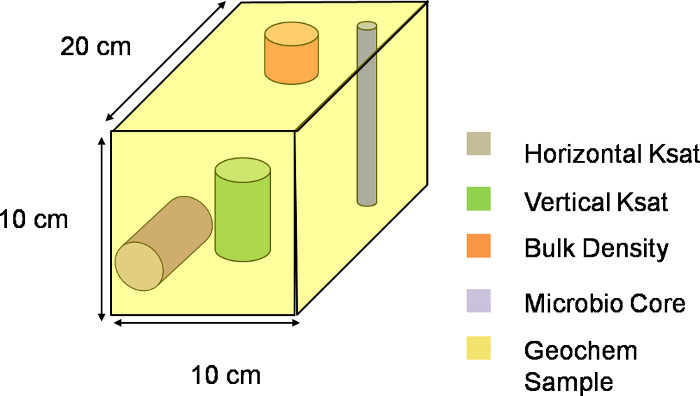
Figura 3. Tre-dRappresentazione imensional di un voxel. visivo schematica di una voxel lungo il piano XYZ del lisimetro. L'intero versante è stato diviso in 324 tali voxel, con ogni voxel che descrive una singola unità di campionamento. Clicca qui per scaricare questo file.
2. Aggiungere blu brillante FCF Dye alla pista infiltrazioni d'acqua nel Slope
- Applicare brillante colorante blu alla superficie del suolo, sufficiente a coprire top 105 cm dalla superficie lungo la direzione Y. Coprire il terreno restante con teli di plastica.
- Scegli una concentrazione (qui 10 g / L) per garantire il contrasto contro il suolo basaltico nero. Aggiungere il colorante serbatoi di sistema di irrigazione e diluire con acqua alla concentrazione desiderata.
- Stabilire la durata dell'irrigazione in base alla profondità desiderata del fronte infiltrazione e il tasso fornita dal sistema di irrigazione.
NOTA: Per questo studio, un itasso rrigation di 30 mm / h per 20 min (Figura 4) prima di scavo è considerata sufficiente per identificare i modelli eterogenei di infiltrazioni d'acqua durante i primi pochi centimetri. - Dopo l'applicazione della tintura, dare il tempo per l'infiltrazione di fermarsi e gli stati di umidità all'interno del lisimetro equilibrare. Per questo studio, un periodo di 10 ore (durante la notte) tra l'applicazione della tintura e lo scavo è stato adeguato.
3. Delimitazione delle Voxels
- Applicare nastro di misura lungo la lunghezza della falda di fornire un sistema di riferimento in situ per la guida durante delimitazione di voxel.
- Segnare la dimensione di ciascun voxel terreno con l'aiuto del nastro di misurazione. Tracciare le linee della griglia per ogni livello usando scudi in alluminio-lame e coltelli di plastica mastice (Figura 4). Eliminare i materiali di confine (5 cm da ogni parete per evitare effetti di bordo).

Figura 4. Vista dall'alto di lisimetro. Questa visualizzazione mostra la superficie tinta di livello 2 (10 cm di profondità). Griglie disegnate sulla superficie del suolo per aiutare campionamento sono visibili anche, insieme con le regioni fori core per ogni voxel dal prelievo microbiologico.
4. Raccolta del campione Microbiologia
- Raccogliere campioni di microbiologia asetticamente da ogni voxel prima idrogeologico e geochimico analisi per evitare la contaminazione incrociata dei campioni. Garantire che i nuovi guanti sono indossati da tutti i membri che effettuano lo scavo per ridurre la contaminazione da pelle umana.
- Utilizzare uno scavino terreno da 1 cm di diametro e 20 cm di altezza, e una spatola sottile per la raccolta dei campioni microbiologici. Pulire il carotiere e la spatola con acqua distillata, asciugare con salviette pulite, e risciacquare con il 75% di etanolo utilizzando uno spray. Consentire corer e spatola asciugare all'aria.
- Si noti la ctempo ollection di ogni campione. Utilizzare il corer al core ad una profondità di 10 cm in ogni sede voxel, e la spatola per svuotare il campione di terreno in sacchetti di plastica pre-sterilizzati (Figura 5). Fare attenzione ad aprire la borsa poco prima di depositare il campione. Omogeneizzare i sacchetti del campione a mano.
- Conservare il sacchetto di campionamento in un refrigerante durante il campionamento, e trasferire il più presto possibile al -80 ° C freezer.

Figura 5. raccolta dei campioni di microbiologia. Un piccolo corer palmare di 20 cm x 1 cm, borse sterili, e spatola è mostrato qui durante il campionamento microbiologico. Cliccate qui per scaricare questo file.
5. Geochimica e Idrologia Collection Campione
- regioni fotografia tinti in X e Y plAnes durante lo scavo per la profondità in cui si osserva il colorante. Utilizzare una carta di colore per fornire un riferimento per il colore osservato (Figura 6). Garantire la corretta illuminazione naturale è presente per documentare correttamente l'intensità del colore.
- Calibrare portatile a raggi X spettrometro di fluorescenza (pXRF) al giorno prima di iniziare le misurazioni. Per la calibrazione e misura i dettagli, consultare le istruzioni del produttore 13 (Figura 7). In breve, posizionare lo strumento sul supporto e puntare la finestra fascio direttamente al tallone fabbrica di metallo. Seleziona 'Cal' e attendere 30 secondi per permettere la taratura per essere completato.
- Pulire la finestra trave prima di ogni misurazione. Misurare la superficie di ogni voxel in triplicato in tre sedi diverse. Posizionare lo strumento pXRF sulla superficie del terreno e attendere 90 secondi per consentire la misura sia completata.
NOTA: X-ray può penetrare attraverso una lunga distanza nella direzione del fascio. Pertanto, ensure che solo personale addestrato gestisce le attrezzature e mantiene i protocolli di sicurezza adeguate.
- Pulire la finestra trave prima di ogni misurazione. Misurare la superficie di ogni voxel in triplicato in tre sedi diverse. Posizionare lo strumento pXRF sulla superficie del terreno e attendere 90 secondi per consentire la misura sia completata.

Figura 6. Carta di colore da seguire tingere infiltrazione. Ogni posizione con penetrazione del colorante visibile è stata fotografata con una scheda di colore che servono come riferimento. Cliccate qui per scaricare questo file.

Figura 7. portatile X-ray Fluorescence Spectrometer. PXRF palmare posizionato sulla superficie di un voxel. Le misurazioni sono state registrate in tre diverse posizioni sulla superficie di ciascun voxel e poi la media.
- nuclei pulito metallici (altezza = 3 cm, diametro. = 5,7 cm) e policarbonato cores (altezza = 6 cm, diametro. = 5,7 cm) per densità apparente (BD) e misure di conducibilità idraulica (KSAT) di voxel desiderati, rispettivamente (Figura 8).
- inserire verticalmente anime metalliche e anime in policarbonato (verticale) KSAT in voxel desiderati facendo attenzione a non danneggiare i sensori o fili del sensore. A tale scopo, martellare delicatamente le anime nel terreno, avendo cura di utilizzare una superficie piana come blocco di legno tra il nucleo e il martello per minimizzare il disturbo al terreno. Inoltre, una volta che il nucleo è a metà strada nel terreno, collocare un secondo core sulla parte superiore del primo nucleo. Posizionare il blocco di legno sulla parte superiore del secondo nucleo e martello delicatamente il blocco fino al primo nucleo è incorporato nel terreno con il bordo nucleo ancora visibile.
- Inserire nuclei per KSAT orizzontale della faccia laterale del voxel si apre con scavo sequenziale. Utilizzare il blocco di legno e il secondo nucleo di cui al punto 5.4 per ridurre al minimo il compattamento.
- Fare attenzione a garantire che il voxelin fase di campionato è isolato da confini e voxel vicini prima della raccolta del campione geochimica. Usare spatole di plastica per questo scopo, seguiti da spatole palmari per raccogliere campioni di terreno intorno di metallo o polipropilene nuclei in geochimica sacchetti (GC) campione etichetta fino a quando core possono essere facilmente rimossi (ad esempio, figura 9a, b).

Figura 8. densità apparente e nuclei conducibilità idraulica. Nuclei di polipropilene (a sinistra) sono stati utilizzati per la raccolta di campioni di conducibilità idraulica verticale e orizzontale, mentre anime metalliche (a destra) sono stati utilizzati per la raccolta di campioni di densità di massa.

Figura 9. Voxel demarcazione. Spatole di plastica sono stati usati per (A) isolareconfini voxel prima della (B) geochimica, densità apparente, e la raccolta nucleo conduttività idraulica. Cliccate qui per scaricare questo file.
- Rimuovere l'anima metallica, spazzolare il materiale in eccesso da entrambe le estremità, e trasferire campione dal nucleo per un sacchetto di campionamento BD etichettato. Pesare ogni sacchetto campione con il campione e registrare il peso totale.
- Rimuovere i nuclei in polipropilene. Coprire entrambi i lati con tappi di plastica etichetta rossa e nucleo in polipropilene verticale come "V" e nucleo in polipropilene orizzontale "H" seguito dal ID del campione.
- Raccogliere il materiale rimanente dalla voxel nel sacchetto di campionamento GC, lasciando dietro di sé un paio di centimetri di terreno in tutti e quattro i lati per evitare la contaminazione incrociata con la prossima voxel.
- Ripetere da passaggi 5.1 al 5.9 il resto dei voxel in uno strato.
- Una volta che tutti i voxel da un livello sono staticompletato, ripetere i passaggi 3,2-5,10 per lo strato successivo.
NOTA: Passo 5.1 deve essere eseguita solo per i voxel che hanno colorante visibile. Fare riferimento alla figura 10 di visualizzare schema rappresentativo di un voxel evidenziando tutti i campioni raccolti da ogni voxel.

Linea Figura 10. Rappresentante voxel. La linea rossa tratteggiata indica nucleo raccolte per il campione microbiologia, il verde tratteggiata indica nucleo conducibilità idraulica orizzontale, la linea tratteggiata gialla indica nucleo conducibilità idraulica verticale, la tratteggiata viola indica nucleo densità di massa, e il confine ovale blu indica campione dal voxel restante viene utilizzato per l'analisi geochimiche. clicca qui per scaricare questo file.
Analisi 6. Campione
- Utilizzare i campioni raccolti per gli esami microbiologici per molecolare (suolo estrazione del DNA microbico) 14 e coltivate (conta su piastra eterotrofi) 15 analisi. Utilizzare DNA estratto per le reazioni a catena della polimerasi quantitativa (qPCR) 16, e high-throughput esperimenti di sequenziamento del gene 17,18.
- Utilizzare i campioni raccolti per geochimica analisi per misurare un gran numero di proprietà geochimiche tra cui pH (metodo US EPA 150.2), conducibilità elettrica (CE) (US metodo EPA 120.1), contenuto di carbonio e di azoto (US metodo EPA 415.3, l'estrazione sequenziale degli elementi 19, e diffrazione a raggi X (XRD) e la spettroscopia esteso assorbimento di raggi X struttura fine (EXAFS) secondo le specifiche di Stanford Synchrotron Radiation Laboratory, per indagare le trasformazioni minerali.
- Utilizzare carotaggi prelevati per le analisi idrologiche per esperimenti di laboratorio come la densità apparente 20e conducibilità idraulica 21.
Risultati
Le dimensioni dei voxel garantita la raccolta di campioni per idrologico, geochimica, e le misure microbiologici. La procedura di scavo ha prodotto 324 core per l'analisi microbiologica, 972 pXRF punti di dati, 324 borse di campioni geochimici, 180 campioni KSAT (128 verticale e orizzontale 52), e 311 campioni di densità di massa. flusso preferenziale di colorante blu brillante è stata osservata anche ad una profondità di 30 cm dalla superficie. Un insieme rappresentativo di 81 ca...
Discussione
Evoluzione del paesaggio è l'effetto cumulativo di idrologica, geochimici e processi biologici 12. Questi processi di controllo del flusso e trasporto di acqua e di elementi, e le reazioni biogeochimici in continua evoluzione dei paesaggi. Tuttavia, catturando le interazioni richiede contemporaneamente disegno sperimentale con precisione coordinata e campionamento. Inoltre, studiando l'evoluzione del paesaggio incipiente è difficile in sistemi naturali, con limitate capacità di individuare "te...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
We thank Ty P.A. Ferré, Till Volkman, Edwin Donker, Mauricio Vera for helping us during the excavation, and Triffon J. Tatarin, Manpreet Sahnan and Edward Hunt for their help in sample analysis. This work was carried out at Biosphere 2, University of Arizona and funded by National Science Foundation grant EAR_1344552 and Honors Research Program of Biosphere 2.
Materiali
| Name | Company | Catalog Number | Comments |
| Measuring tape | Any | Any | Preventing cross-contamination of samples is crucial. Therefore, it is helpful to have multiple putty knives to isolate voxel boundary. |
| Brilliant Blue dye | Waldeck GmBH &Co | B0770 | Rulers can be used to draw grids. The sampling strategy can be modified based on individual experiments. |
| Soil Corer | AMS | 56975 | Any commercially manufactured Brilliant Blue dye can be used. |
| 75% Ethanol | Any | Any | A Nikon D90 camera and 50 mm lens were used for photography. Any high resolution camera and lens can be used for this purpose. |
| Spray Bottle | Any | Any | Use of dye and color card is subjective to individual experiments and/or research questions. |
| Spatula | Any | Any | Gardening gloves may be used if handling of corer becomes tedious. |
| Gloves | Any | Any | Ensure microbiology samples are kept in ice during sampling and frozen as soon as possible. |
| KimWipes | KimTech Science | Any | Water can be used to wash soil corer, prior to sanitizing with ethanol. |
| Sterile Sample bags | Fisher Scientific | Whirl-Pak 4 OZ. 24 OZ | Keep buckets and dustpans handy to facilitate removal of waste soil. |
| Color Card | Any | Any | The original design of miniLEO has various sensors embedded in the lysimeter. Such sensors may or may not be necessary based on the scope of individual experimental design. |
| X-ray Fluoresce Spectrophotmeter | XRF, OLYMPUS | DS-2000 Delta XRF | |
| Polypropylene cores | Any | Any | |
| Metal cores | Any | Any | |
| Caps for polypropylene cores | Any | Any | |
| Hammer | Any | Any | |
| Plastic putty knives | Any | Any | |
| Face masks | Any | Any |
Riferimenti
- Brady, N. C., Weil, R. R. . The nature and properties of soils. , (2008).
- Chorover, J., Kretzschmar, R., Garica-Pichel, F., Sparks, D. L. Soil biogeochemicial processes within the critical zone. Elements. 3, 321-326 (2007).
- Troch, P. A., et al. Catchment coevolution: A useful framework for improving predictions of hydrological change?. Water Resour. Res. 6, 1-20 (2015).
- Sharp, R. P. Landscape evolution (A Review). Proc. Natl. Acad. Sci. U. S. A. 79, 4477-4486 (1982).
- Temme, A., Montgomery, D. R., Bierman, P. R. Predicting the effect of changing climate on landscapes with computer based landscape evolution models. Key Concepts in Geomorphology. , (2013).
- Troch, P. A., et al. Dealing with Landscape Heterogeneity in Watershed Hydrology: A Review of Recent Progress toward New Hydrological Theory. Geogr. Compass. 3, 375-392 (2009).
- Wang, Y., et al. Dissecting the Hydrobiogeochemical Box. in Am. Geophys. Union Fall Meet. , (2015).
- Lin, H., et al. Hydropedology: Synergistic integration of pedology and hydrology. Water Resour. Res. 42 (5), W05301 (2006).
- Band, L. E., et al. Ecohydrological flow networks in the subsurface. Ecohydrology. 7, 1073-1078 (2014).
- Churchman, G. j., Lowe, D. . Handbook of Soil Science Properties and Process. 1, (2012).
- van der Heijden, M. G. A., Bardgett, R. D., van Straalen, N. M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol. Lett. 11 (3), 296-310 (2008).
- Pangle, L. a., et al. The Landscape Evolution Observatory: A large-scale controllable infrastructure to study coupled Earth-surface processes. Geomorphology. 244, 190-203 (2015).
- . . User Manual: Delta Famiy Handheld XRF Analyzers. , (2013).
- Valentìn-Vargas, A., Root, R. A., Neilson, J. W., Chorover, J., Maier, R. M. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings: A mesocosm experiment. Sci Total Environ. 500-501, 314-324 (2014).
- JoVE Science Education Database. . Essentials of Environmental Microbiology. Culturing and Enumerating Bacteria from Soil Samples. , (2016).
- JoVE Science Education Database. . Essentials of Environmental Microbiology: Quantifying Environmental Microorganisms and Viruses Using qPCR. , (2016).
- Sengupta, A., Dick, W. A. Bacterial community diversity in soil under two tillage practices as determined by pyrosequencing. Microb. Ecol. 70, 853-859 (2015).
- Caporaso, J. G., et al. Correspondence - QIIME allows analysis of high- throughput community sequencing data. Nat. Publ. Gr. 7, 335-336 (2010).
- Hall, G. E. M., Vaive, J. E., Beer, R., Hoashi, M. Selective leaches revisited, with emphasis on the amorphous Fe oxyhydroxide phase extraction. J. Geochemical Explor. 56, 59-78 (1996).
- Grossman, R. B., Reinsch, T. G., Dane, J. H., Topp, G. C. Bulk density and linear extensibility. Methods of Soil Analysis. Part 4-Physical Methods. , 201-228 (2002).
- Reynolds, W. D., Elrick, D. E., Youngs, E. G., Amoozegar, A., Bootlink, H. W. G., Bouma, J., Dane, J. H., Topp, G. C. Saturated and field-saturated water flow parameters. Methods of Soil Analysis, Part 4-Physical Methods. , 802-816 (2002).
- King, G. M. Contributions of atmospheric CO and hydrogen uptake to microbial dynamics on recent Hawaiian volcanic deposits. Appl. Environ. Microbiol. 69 (7), 4067-4075 (2003).
- Meyer, W. S., Barrs, H. D. Roots in irrigated clay soils: Measurement techniques and responses to rootzone conditions. Irrig. Sci. 12 (3), 125-134 (1991).
- Graham, C. B., Woods, R. A., McDonnell, J. J. Hillslope threshold response to rainfall: (1) A field based forensic approach. J. Hydrol. 393 (1-2), 65-76 (2010).
- Anderson, A. E., Weiler, M., Alila, Y., Hudson, R. O. Dye staining and excavation of a lateral preferential flow network. Hydrol. Earth Syst. Sci. Discuss. 5 (2), 1043-1065 (2008).
- Gleeson, T., Paszkowski, D. Perceptions of scale in hydrology: what do you mean by regional scale?. Hydrol. Sci. J. 00, 1-9 (2013).
- Molins, S., Trebotich, D., Steefel, C. I., Shen, C. An investigation of the effect of pore scale flow on average geochemical reaction rates using direct numerical simulation. Water Resour. Res. 48, W03527 (2012).
- Fierer, N., Lennon, J. T. The generation and maintenance of diversity in microbial communities. Am. J. Bot. 98 (3), 439-448 (2011).
- Niu, G. Y., Pasetto, D., Scudeler, C., Paniconi, C., Putti, M., Troch, P. A. Analysis of an extreme rainfall-runoff event at the Landscape Evolution Observatory by means of a three-dimensional physically-based hydrologic model. Hydrol. Earth Syst. Sci. Discuss. 10, 12615-12641 (2013).
- Marteinsson, V., et al. Microbial colonization in diverse surface soil types in Surtsey and diversity analysis of its subsurface microbiota. Biogeosciences. 12, 1191-1203 (2015).
- Orcutt, B. N., Sylvan, J. B., Rogers, D. R., Delaney, J., Lee, R. W., Girguis, P. R. Carbon fixation by basalt-hosted microbial communities. Front. Microbiol. 6, 00904 (2015).
- Wu, L., Jacobson, A. D., Chen, H. C., Hausner, M. Characterization of elemental release during microbe-basalt interactions at T=28°C. Geochim. Cosmochim. Acta. 71, 2224-2239 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon