Method Article
Eine Standardmethodik, vor-Ort-Mutagenität als Funktion der Punktmutation Reparatur katalysiert durch CRISPR/Cas9 und SsODN in den menschlichen Zellen zu untersuchen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt den Workflow eines CRISPR/Cas9-basierte Gens editing-System für die Reparatur von Punktmutationen in Säugetierzellen. Hier verwenden wir einen kombinatorischen Ansatz zur gen Bearbeitung mit einer detaillierten Follow-on experimentelle Strategie zur Messung von Indel Bildung an die Ziel-Site-Analyse im Wesentlichen vor-Ort-Mutagenese.
Zusammenfassung
Kombinatorische gen Bearbeitung CRISPR/Cas9 mit einsträngiger Oligonukleotide ist eine wirksame Strategie für die Korrektur von Single-Base Punktmutationen, die oft für eine Vielzahl von menschlichen Erbkrankheiten verantwortlich sind. Mit einer etablierten zellbasierte Modellsystem, wurde die Punktmutation eines mutierten eGFP Single Copy-Gens integriert HCT116 Zellen repariert mit diesem kombinatorische Ansatz. Die Analyse der Zellen korrigiert und unkorrigiert zeigt die Präzision des Gens zu bearbeiten und die Entwicklung der genetischen Veränderungen, wenn Indels unkorrigierte Zellen in der DNA-Sequenz, die rund um die Ziel-Site erstellt werden. Hier ist die spezifische Methodik dieser kombinatorische Ansatz für die gen-Bearbeitung von einer Punktmutation, gepaart mit einer detaillierten experimentelle Strategie zur Messung Indel Bildung an die Ziel-Site zu analysieren skizziert. Dieses Protokoll beschreibt einen grundlegenden Ansatz und Workflow für Untersuchungen zur Entwicklung von CRISPR/Cas9-basierte gen Bearbeitung für menschliche Therapie. Der Abschluss dieser Arbeit ist, dass dieser vor-Ort-Mutagenese während des Prozesses der Punktmutation Reparatur infolge CRISPR/Cas9 Aktivität stattfindet. Diese Arbeit richtet eine standardisierte Methodik, um den Grad der Mutagenese, zu identifizieren, die einen wichtigen und entscheidenden Aspekt jeder Ansatz für die klinische Umsetzung bestimmt werden sollte.
Einleitung
Wegweisende Studien von Mandecki (1986) zeigten dauerhafte Änderungen in der Plasmid-DNA mit Oligonukleotiden Bakterien1, während Walder umgewandelt und Walder (1986) ähnliche Studien in Hefe2durchgeführt. Kurz darauf veröffentlichte Sherman und Kollegen eine Reihe von Dokumenten, bei denen einzelsträngige Oligonukleotide in Hefezellen vererbbare Gene3Änderungen eingebracht wurden. Aufbauend auf der bahnbrechenden Arbeit in mikrobiellen Zellen, begann Kmiec und Kollegen einzigartige Single-Agent-Oligonukleotide zu entwickeln, die einzelne base Instandsetzung in Säugerzellen4gerichtet. Dieses Konzept basierte auf biochemische Daten, die zeigten, dass mehr fest an den Zielstandort als die völlig bestehend aus DNA-Basen mit RNA Moleküle binden. Zwar gab es zahlreiche Berichte von gen-Bearbeitung Erfolg mit Chimären Oligonukleotiden5,6,7, blieb die Bearbeitung Ebenen sehr variabel zwischen Experimenten und über verschiedene Zielzelle Kombinationen.
Einsträngige Spender DNA ist vorgezogen, Spender doppelsträngige DNA, weil es weniger wahrscheinlich, nach dem Zufallsprinzip Websites innerhalb der Genom-8zu integrieren ist. Exogen eingeführten einsträngige Oligonukleotide sind jedoch anfällig für schnelle Abbau von zellulären Nukleasen. Verschiedene Strategien, die Termini der Oligonukleotide vor Abbau zu schützen sind eingesetzt worden. Eine Exonuclease geschützt, einzelsträngigen DNA mit der gewünschten Reihenfolge war ausreichend, um erhalten eine Bearbeitung Effizienz in 0,1-1 % Bereich6. Verbessert und konsequentere Transfection Techniken, gepaart mit phänotypischen Auslesen erlaubt für konsistentere Bearbeitung durch mehrere Forschung Gruppen8,9,10,11, 12,13.
In den letzten 10 Jahren gab es erhebliche Anstrengungen zu Zielzellen besser geeignet, um gen zu bearbeiten. Eine Strategie beschäftigt die Modulation des Zellzyklus14,15,16. Während Bearbeitung Frequenzen unter normalen Reaktionsbedingungen mit einsträngiger Oligonukleotide (SsODNs) eingeführt schwebte kultivierte Säugerzellen zwischen 0,1 % und 1 %, die Frequenzen des Gens erhöhte 3 bis 5 fache bei Bearbeitung der Oligonukleotide in Zellen worden beim Übergang durch die S-Phase eingeführt. In eine separate Reihe von Experimenten demonstriert Brachman und Kmiec (2005), dass relativ hohe präzise gen bearbeiten (3-5 %) erzielt wurden, wenn in den Zellen für 24 h vor der Zugabe des Oligonukleotids17 2'3 ' Dideoxycytosine (DdC) inkubiert wurde . DdC reduziert die Rate der DNA-Replikation Gabel Bewegung, was darauf hindeutet, dass gen Bearbeitung von SsODNs in die Zellen wahrscheinlich Replikation die Einbeziehung von ODNs in Regionen aktive Replikation11,18 beinhaltet. Zusammen genommen, diese Studien führten zu dem Konzept, dass eine wachsende Wiederholunggabel als Bestandteil der wahre Wirkmechanismus von gen bearbeiten, Spender-DNA eingebaut wird unabhängig von ob eine doppelsträngige Pause vorhanden ist oder nicht19. Somit erfolgt die Korrektur einer Punktmutation oder den Ersatz eines Segments von DNA in das Chromosom über eine DNA-Paarung und Einzel-Strang Assimilation Weg.
Induzierende zufällige doppelsträngigen DNA-Brüchen in wachsenden Zellen mit kleinen Molekül-Agenten schafft ein Umfeld, in dem DNA-Replikationsereignisse ins Stocken geraten sind als die Zelle versucht, den Schaden20,21zu reparieren. Diese vorübergehende Verlangsamung der Replikation Gabeln ermöglicht eine effizientere Durchdringung der Chromatinstruktur durch einsträngige Bearbeitung Oligonukleotide, Ziel Barrierefreiheit15zu verbessern. Die Schaffung von Double-Stranded DNA bricht durch Medikamente wie VP16, Bleomycin, oder Camptothecin22,23, hat gezeigt, dass gen Bearbeiten von Ebenen durch fast 10-fache stimulieren bis zu 6-8 %. Allerdings sind zufällige doppelsträngigen DNA-Brüchen in einer therapeutischen Einstellung unerwünscht.
Gen, die Bearbeitung mit programmierbaren Nukleasen und Oligonukleotide wird auch angeregt während der Zellteilung24,25. Wenn Nukleinsäure-basierte Lieferung verwendet wurde, um unter der Regie von Homologie Reparatur in synchronisierten HCT-116 Zellen durchzuführen, Rivera-Torres und Kollegen zeigte die gleiche Erhöhung bei der Ausrichtung der Tätigkeit bei der Transkription Aktivator-ähnliche Effektor Nukleasen (TALENs) Beschäftigte mit einsträngiger Oligonukleotiden, beide in einem reproduzierenden Zelle Bevölkerung26,27 eingeführt. In jüngerer Zeit, Bialk und Kollegen zeigten, dass die Reparatur der einzelnen base Mutationen mit einsträngiger Oligonukleotide und eine Reihe von regelmäßig dazwischen kurze palindromische Wiederholungen Cas9 gruppierten (CRISPR/Cas9) Moleküle erfolgt mit höheren Wirksamkeit Wann ist die Zellpopulation S Phase28durchqueren. Das CRISPR-Molekül besteht aus RNA und Funktionen, um die Region innerhalb des Ziels DNA-Sequenz zu identifizieren, die für Dekolleté bezeichnet wird. Cas9 ist eine bakterielle Enzym, dessen Aufgabe ist es, doppelsträngige DNA in einer Nucleolytic-Austausch-Reaktion zu Spalten. So CRISPR Positionen des Komplexes auf der genomischen Ziel und Cas9 Nuklease führt der Doppelstrang-Pause. Lin Et al. (2014) zeigt auch die Bedeutung des Zellzyklus zur Erreichung der hohen Frequenzen des Gens bearbeiten, mit einem modifizierten CRISPR/Cas9 Ribonulceoprotien (RNP) Komplex-vermittelte Lieferung System in primären neonatale Fibroblasten, humane embryonale Stammzellen, und andere Zelle Linien24. So ist die Beziehung zwischen gen bearbeiten und Zellzyklus Progression für die Bearbeitung von Single-Agent-gen für kombinatorische gen mit programmierbaren Nukleasen und Spender DNA-Vorlagen bearbeiten. Während der kombinatorische Ansatz zur Bearbeitung von gen eine Vielzahl von Partnern mit der Spender-DNA-Vorlage zusammengebracht hat, verwenden die meisten Mitarbeiter im Außendienst CRISPR/Cas9, die Doppelstrang-Pause Funktion. Diese Entscheidung gründet sich auf die Benutzerfreundlichkeit dieses bestimmten genetischen Tools und die Flexibilität, mit der es Genfunktion zu deaktivieren oder eine ausländische Stück DNA in einem bestimmten Standort einzuführen eingesetzt werden kann. Die Generation von einem Knockout ist technisch einfacher gen Ersatz, im Vergleich zu wo die Einbeziehung der "richtige" oder normale Kopien eines Gens in der Krankheit-Website mit Präzision durchgeführt werden muss. Eine Reihe von Forschern identifizieren und untersuchen den Einsatz von bestimmten Medikamenten und Reagenzien, die es die Korrektur der mutierten Basen und die Einfügung von normalen genetischen Sequenzen in der richtigen Position um erhöhte Frequenzen29 ermöglichen.
Vor kurzem, Rivera-Torres Et al. 30 verwendet kombinatorische gen bearbeiten, unter Ausnutzung der Doppelstrang-Pause Aktivität eines speziell entwickelten CRISPR/Cas9-Systems und der genetischen Information zur Verfügung gestellt durch eine einsträngige Oligonukleotid Spender DNA-Vorlage zu reparieren ein Punktmutation in einemeinzelne Kopie des Gens verbesserte grün fluoreszierendes Protein (eGFP) in HCT116 Zellen integriert. Die Autoren nutzten diese gut charakterisierten Modell Zelllinie, die Spezifität der Spaltung, die rund um die Ziel-Site zu bewerten. Die Daten zeigen, dass Heterogenität an der Ziel-Site, vor allem in den Zellen vorhanden ist, die keine korrigierten Punktmutation enthalten. In dieser Handschrift die, wir ausführlich und konzentrieren sich auf die Methodik dieser Arbeitnehmer um zu prüfen, vor-Ort-mutagenen Heterogenität von CRISPR/Cas9 gen Bearbeitung erstellt.
Protokoll
das folgende Protokoll schließt die Arbeit mit Säugerzellen; Vertrautheit mit steriler Technik/Zellkultur erwartet.
1. Zellinie und Kulturbedingungen
- machen 500 mL Medium für die Kultur von HCT-116 Zellen: McCoy ' s 5A geändert Medium ergänzt mit 10 % fetalen bovine Serum (FBS), 2 mM L-Glutamin und 1 % Penicillin (Dies ist abgeschlossen Medium).
Hinweis: Wachsen Sie HCT 116-19 Zellen in einem T-75 oder T-175 Kolben vor der Beschichtung. Wenn 90 % Zusammenfluss, jedem T-75 Kolben ergibt 8,4 x 10 6 Zellen, etwa fünf 10-cm-Platten, und jeder T-175 ergibt 18,4 x 10 6 Zellen, etwa fünfzehn 10-cm-Platten.
2. Ernte der Zellen aus der Flasche
- Aspirieren entfernt das Medium, mit Dulbecco waschen ' s Phosphate-Buffered Kochsalzlösung ohne Kalzium und Magniesium (PBS) (10 mL für T-75 oder 25 mL für T-175) und Auwäldchen.
- Add Trypsin tropfenweise in den Kolben mit einer 2-mL-Pipette (2 mL, für T-175 oder 1 mL für T-75). Legen Sie die Flasche in einem Inkubator bei 37 ° C und 5 % CO 2 für 5 min damit die Zellen trennen.
- Tippen Sie auf die Flasche um sicherzustellen, dass alle Zellen verdrängt werden und dann mit kompletten Medium zu stillen, indem es über die gesamte Fläche des Kolbens (8 mL für T-175 oder 4 mL T-75) Dispergieren.
- Pipette nach oben und unten mehrmals Zelle Klumpen aufzubrechen und übertragen die Zellen eine 15 mL konische Röhrchen
- Vor dem Spinnen der Zellen nach unten, nehmen 10 µL aus der 15 mL konische und kombinieren Sie es mit 10 µL Trypan blau, die Zellen zu zählen. Pellet-Zellen durch Spinnen für 5 min bei 125 x g und 16 ° c
3. Zählen der Zellen
- Transfer 10 µL der Zellen gemischt mit Trypan blau, um die Hemocytometer. Zählen Sie die 4 Gitter an der Außenseite (jedes Raster enthält 16 Quadrate).
- Nehmen die durchschnittlichen Zellzahl aus jedem Satz von sechzehn Eckquadrate.
- Mit 10.000 multipliziert (10 4).
- Multiplizieren das Gesamtvolumen des Mediums zur Ernte der Zellen für die Verdünnung von Trypan blau Zusatz korrigieren.
Hinweis: Die Gleichung Format das Volumen um die Zellen zu Aufschwemmen berechnen folgt:
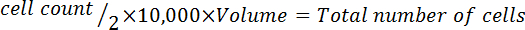
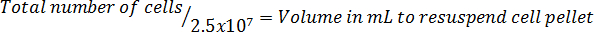
4. Beschichtung der Zellen
- für jede 10 cm Platte von Zellen synchronisiert werden soll, fügen Sie 5 mL des kompletten Medium und 6 µM Aphidicholin (12 µL einer 2,5 mM-Aktie im 200-Nachweis Äthanol).
- Transfer 100 µL neu suspendierten Zelle Pellets, 2,5 x 10 6 Zellen, jede 10 cm Platte und Wirbel sanft zu mischen.
- Inkubieren Sie die Platten bei 37 ° C und 5 % CO 2 für 16-24 h, Zellen an der G1/S-Grenze zu synchronisieren.
5. Freigabe der Zellen von der Aphidicolin Synchronisierung
- 4 h vor targeting, aspirieren Sie das Medium, waschen mit PBS, Aspirieren der PBS und 5 mL des kompletten Medium
- platzieren Sie es wieder in den Inkubator bei 37 ° C und 5 % CO 2 für 4 h
6. RNA Komplexbildner
- Enter die mutierten eGFP Gensequenz ins Labor Zhang ' s Online-Generator 25 (http:// crispr.mit.edu/) und wählen Sie die CRISPR-Anleitung Sequenzen, die mit unmittelbarer Nähe an den Zielstandort binden. Einholen der CRISPR-Guide Sequenzen eine kommerzielle Quelle.
- Speichern die CRISPR RNA (CrRNA), Trans-Aktivierung CrRNA (TracrRNA) und Cas9 Protein bei 20 ° C und laut Hersteller Anregungen verwenden.
- Mix der RNA in äquimolaren Konzentrationen an 45 µM. hinzufügen 6,75 µL 200 µM Lager CrRNA und 6,75 µL einer 200 µM-Aktie von TracrRNA in einer Zentrifuge 1,5 mL Tube. Fügen Sie 16,50 µL TE-Puffer zu einem Endvolumen von 30 µL.
- Hitze bei 95 ° C für 5 min in einem Heizblock oder PCR-Maschine.
Vorsicht: Heiß! - Auf Raumtemperatur abkühlen lassen.
Hinweis: Wenn eine PCR-Maschine verwenden, legen Sie die Kühlung auf 0,2 ° C/s. - Führen Sie die folgenden Schritte für jede Probe.
- Verdünnen 2.22 µL CrRNA:tracrRNA Komplex in 2.78 µL TE-Puffer (10 mM Tris, pH 8.0 und 0,1 mM EDTA; pH 8.0) zu einem Endvolumen von 5 µL.
- Verdünnen 1,67 µL des Cas9-Proteins aus einem Bestand von 60 µM in 3.33 µL Medium Low-Serum zu Endvolumen von 5 µL.
- Mix 5 µL des Cas9 Proteins mit 5 µL komplexiert RNA
7. Ernte der Zellen für Targeting
- Aspirat Medium, waschen mit 5 mL PBS, Aspirieren der PBS, und 1 mL vorgewärmten Trypsin auf jede 10-cm-Platte. Setzen Sie die Platten im Inkubator bei 37 ° C und 5 % CO 2 für 5 min.
- Tippen Sie auf die 10-cm-Platte um sicherzustellen, dass alle Zellen verdrängt werden und dann mit 4 mL des kompletten Medium durch Dispergieren es über die gesamte Oberfläche der Platte zu stillen.
- Pipette nach oben und unten mehrmals Zelle Klumpen aufzubrechen und die Zellen auf eine 15 mL konische Rohr übertragen.
- Vor dem Spinnen der Zellen nach unten, nehmen 10 µL aus dem 15 mL konische Röhrchen und kombinieren Sie es mit 10 µL Trypan blau, die Zellen zu zählen. Die Zellen von Spinnerei für 5 min bei 125 x g und Raumtemperatur Pellet.
- Aspirieren Sie das Medium und mit 5 mL PBS waschen. Die Zellen von Spinnen bei 125 X g für 5 min bei Raumtemperatur Pellet.
8. Zählen der Zellen
- Transfer 10 µL der Zellen gemischt mit Trypan blau, um die Hemocytometer. Zählen Sie die 4 Gitter an der Außenseite (jedes Raster enthält sechzehn Plätzen).
- Nehmen die durchschnittlichen Zellzahl aus jedem Satz von sechzehn Eckquadrate.
- Mit 10.000 multipliziert (10 4).
- Multiplizieren das Gesamtvolumen des Mediums zur Ernte der Zellen für die Verdünnung von Trypan blau Zusatz korrigieren.
Hinweis: Es folgt die Gleichung-Format, die Lautstärke, um die Zellen erneut zu berechnen. Die erforderliche Anzahl von Zellen in serumfreien McCoy wieder auszusetzen ' s 5A geändert Medium.
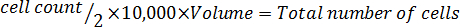
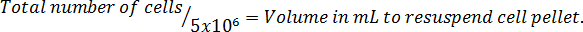
9. gezielt Proben
- 100 übertragen µL Zellsuspension (5 x 10 5 Zellen) von Step 8.1 zu jeder Elektroporation Abstand von 4-mm-Küvette. Fügen Sie 10 µL RNP Komplex aus Schritt 6,7 bis 100 µL Zellen auf einem 5 x 10 5 Zelldichte. Fügen Sie ODN (2 µM) zu jeder Probe.
Hinweis: Für eine Positivkontrolle fügen Sie 1 µL eGFP bei 1 µg/µL Plasmid- Ausdruck nehmen das Rack eine Elektroporation Maschine hinzu, leicht wechseln Sie jede Probe, und legen Sie sie in die Kammer. Electroporate bei 250 V, LV; 2 Impulse, 1 s; 13 ms; unipolare Pulse.
- Rack zurück zu der Haube zu übertragen. Jede Probe auf einem gut mit 2 mL des kompletten Medium übertragen ichn 6-Well-Platte. Inkubation bei 37 ° C und 5 % CO 2 für 72 h vor dem Einchecken für Korrekturstufen.
10. Analyse der Gene bearbeitet Zellen und Transfektion Effizienz
- aspirieren Sie das Medium und die Zellen mit 2 mL PBS waschen. Aspirieren der PBS und geben 500 µL vorgewärmten Trypsin in jeder der 6-Well-Platte. Setzen Sie die Platten im Inkubator bei 37 ° C und 5 % CO 2 für 5 min.
- Die Platte um sicherzustellen, dass alle Zellen verdrängt werden und dann mit 1 mL der kompletten Medium durch Dispergieren es über die gesamte Oberfläche des Brunnens zu stillen antippen.
- Der Zellen in einem 1,5 mL Zentrifugenröhrchen und Pelletöfen bei 5.000 x g für 5 min bei Raumtemperatur übergehen.
- Aspirieren Sie das Medium. Wieder aussetzen der Zelle Pellet in 500 µL Puffer FACS (0,5 % BSA, 2 mM EDTA und 2 µg/mL Propidium Jodid mit PBS-Puffer).
- Messen die Zelle Fluoreszenz (eGFP +) durch Durchflusszytometrie.
- Die Korrektur Effizienz als Prozentsatz der gesamten lebenden eGFP-positiven Zellen über die Gesamtzahl der lebenden Zellen in jeder Probe zu berechnen, wie beschrieben in Rivera Torres Et Al 30.
11. DNA-Sequenzanalyse
- Electroporate synchronisiert und veröffentlichten HKT 116-19 Zellen in einer Konzentration von 5 x 10 5 Zellen/100 µL mit RNP-Komplex an 100 Pmols und 72NT ODN auf 2,0 µM.
- Die Zellen 6-Well Platten übertragen und es ihnen ermöglichen, für 72 h zu erholen
- Sortieren die Zellen einzeln in 96-Well-Platten mit einen FACS-Sorter mit 488 nm (100 Mw) Laser für eGFP + /-, wie beschrieben in Rivera-Torres Et Al 30.
Hinweis: Nicht alle Brunnen werden erfolgreich wachsen. - Erweitern die Zellen über 6 Wochen und Ernten wie in Schritt 7 beschrieben.
- Aus den Vertiefungen, die Wachstum, zelluläre gDNA mit einer handelsüblichen DNA Isolation isolieren kit (siehe die Tabelle der Materialien) und verstärken die Region rund um das Ziel über PCR Basis (718 bp; forward Primer 5 '- ATGGTGAGCAAGGGCGAGGA-3 ' und reverse Primer 5 ' - ACTTGTACAGCTCGTCCATGC - 3 ').
- Führen DNA-Sequenzierung Analyse Proben.
Ergebnisse
Wir haben ein Modellsystem zur Untersuchung gen Bearbeitung in Säugerzellen, die auf die Korrektur einer Punktmutation, eingebettet in das eGFP gen integriert als eine einzelne Kopie in den HCT116 Zellen beruht eingesetzt. Es ist wichtig zu beachten, dass dies ein Single Copy gen; Somit kann ein unkomplizierter Blick auf DNA-Veränderungen oder Mutagenese erfolgen. Abbildung 1A zeigt die mutierten eGFP Gensequenz mit der gezielten Basis der dritten Base des Stopp-Codon TAG, rot hervorgehoben. 72-Base-Oligonukleotid, das teilweise komplementär zu den nicht transkribiert Strang des Gens eGFP (72NT) und wurde entwickelt, um die Base Exchange aus einem G zu einer C induzieren, wird auch dargestellt. Darüber hinaus ist eine CRISPR als 2 C, mit der angegebenen Protospacer-Sequenz in eine 5' 3' Orientierung, auch in Figur 1Adargestellt. Zur Durchführung dieser gen-Bearbeitung Reaktion verwendet wir ein Ribonucleoprotein (RNP) bestehend aus der CRISPR (Cr) RNA und gekoppelt an gereinigtes Cas9 Protein (Abbildung 1 b), Tracr (tr)-RNA anstelle von einem Säugetier Expressionsvektor bestehend aus dem Cas9 gen und die entsprechende spezifische Anleitung RNA-Sequenz.
Wenn das speziell RNP Partikel mit einsträngiger Oligonukleotid in HCT116 Zellen durch Elektroporation, gen bearbeiten, geliefert wird belegt durch die Reparatur der einzelnen base Mutation in eGFP, wird nach 72 h Inkubation mit einem Flow beobachtet CYTOMETER. Funktionale Reparatur ist zu beobachten, durch die Entstehung der grünen Fluoreszenz in gezielten Zellen, Zellen, die auch von der gesamten Bevölkerung getrennt werden können, wegen dieser Fluoreszenz sortieren. Wie in Abbildung 2gezeigt, kann eine allmähliche Dosis-Wirkungs als koordinierte Ebenen RNP und 72NT angesehen werden. Die molekularen Verhältnis, Picomoles von RNP und mikromolaren Konzentration der 72NT wie in der Abbildung dargestellt basieren auf optimalen Dosierungen verwendet in gen-Bearbeitung Reaktionen, die auf die Einführung von Cas9 und spezifische Anleitung RNA aus transfizierten Ausdruck angewiesen sind Vektoren. Der Einschub in Abbildung 2 zeigt eine gen-Bearbeitung Reaktion bei fehlender RNP Partikel durchgeführt. Hier werden ca. 1 % der gezielten Zellen korrigiert, wenn eine 10-divisibel höhere Konzentration von 72NT Oligonukleotid in der Single-Agent gen bearbeiten Reaktion verwendet wird.
Um festzustellen, ob genetische Heterogenität an der Ziel-Website-die so genannten vor-Ort-Mutagenese-Effekt vorhanden ist-wir beschlossen, das Ergebnis des Gens Bearbeitung Aktivität in einzelnen Zellen zu untersuchen. Während viel mühsamer als Prüfung der Gesamtbevölkerung, eine wahre Maßstab für genetische Spuren oder Läsionen festgestellt werden kann, wenn das Genom des klonal erweiterte Zellen untersucht wird. Wir wiederholten das Experiment in Abbildung 2, diesmal nur mit 100 Pmol RNP komplex und 2.0 µmol des Oligonukleotids 72NT beschrieben. Als wurden oben, HCT-116 Zellen für 24 h mit Aphidicholine synchronisiert und an der G1/S-Grenze verhaftet. 4 h später, die Zellen wurden freigelassen und die gen-editing-Tools wurden durch Elektroporation eingeführt. 72 h später, die Zellen wurden analysiert mit FACS und einzeln in 96-Well-Platten (der experimentelle Prozess ist in Abbildung 3dargestellt) sortiert. Anzeige grün fluoreszieren Zellen wurden in einzelnen Vertiefungen einer 96-Well-Platte für klonale Expansion Durchflusszytometrie sortiert. Wichtig ist, wurden Zellen eGFP Ausdruck fehlt auch isoliert und sortiert in ähnlicher Weise für die Expansion unter den gleichen Bedingungen.
Nach 14 Tagen des Wachstums hatten die meisten einzelnen Klone ausreichend erweitert, dass DNA-Isolierung. Als solche 16 Klone von eGFP-positiven Proben wurden ausgewählt, und die genetische Integrität rund um die Ziel-Site wurde durch DNA-Sequenzierung analysiert. Informationen rund um die DNA-Sequenz der Allele in der Bevölkerung wurde generiert Sanger-Sequenzierung, konfektioniert mit Sequenz-Visualisierungs-Software, um die Reihenfolge der ein Wildtyp-Allel (Abb. 4A) zu vergleichen. Geschnittenen Ortsbild des RNP-Komplex wird durch einen schwarzen Pfeil befindet sich auf dem Green bar (2 C CrRNA) angezeigt. Wie auch in Abbildung 4Adargestellt enthalten alle 16 eGFP-positiven Zellen die vorhergesagten Nukleotid Exchange an die Ziel-Site. Der umgebaute C-Rückstand wird rot hervorgehoben, und das Peak-Profil spiegelt die genaue Änderung erfolgt unterhalb der eGFP-positiv-Sequenz. In ähnlicher Weise isoliert 15 nicht-grüne klonalen ausreichend erweitert, dass DNA-Extraktion und Sequenzierung, für Heterogenität an der Ziel-Site analysiert wurden. Wie vorhergesagt, in etwa die Hälfte der Proben wurde kein DNA-Base Exchange beobachtet. Dies spiegelt sich in der Wartung der G-Rückstände an der Ziel-Site, wie in Abbildung 4 bdargestellt. Der Rest der klonalen Expansionen in diesen Experimenten untersucht angezeigt eine heterogene Bevölkerung Löschung Mutationen, daher entfallen die mangelnde grün fluoreszieren. Die Löschung Größe reichten von einer Basisstation zu 19 Basen. Es ist wichtig zu beachten, dass wir haben nur 15 Proben der eGFP-positiven Zellen untersucht, und obwohl wir glauben, dass dies durchaus repräsentativ für die Art der genetischen Veränderungen hinterlassen CRISPR/Cas9 Aktivität ist, besteht die Möglichkeit, dass andere Arten oder Formen der indels könnte in der gezielten Bevölkerung vorhanden sein.
Zusammengenommen, bestätigen die Ergebnisse in Abbildung 4 dargestellt das phänotypische Auslesen in das Zielsystem eGFP. Umstellung des G auf C Nukleotid ermöglicht die Entstehung der grünen Fluoreszenz in den korrigierten HCT116 Zellen. Keine Basis Substitution rund um die Ziel-Website wurde in die Klone für dieses Experiment isoliert oder in früheren Experimenten27,28beobachtet. Die Daten zeigen auch, dass Zellen nicht gen Bearbeitung via Punktmutation Reparatur unterziehen unkorrigiert, aber in einigen Fällen nicht unverändert, mit einer Reihe von genetischen Heterogenität, die rund um die Ziel-Website bleiben.
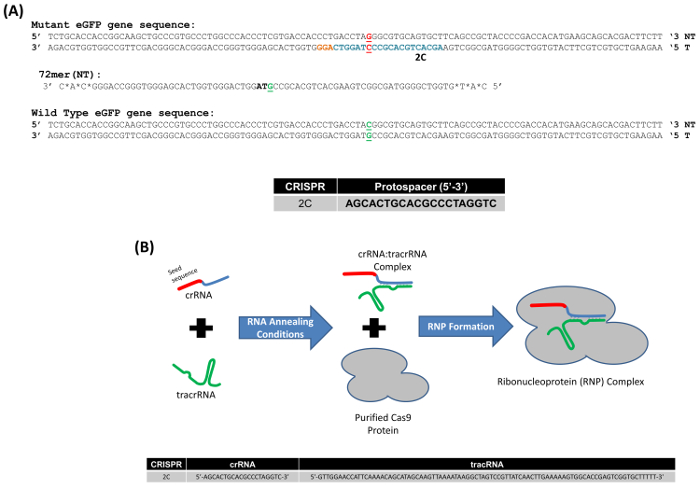
Abbildung 1: (A) Modellsystem für die gen-Bearbeitung des Gens mutierten eGFP. Die entsprechenden Segmente der Wildtyp und mutierte eGFP-Gens mit der gezielten Codon, befindet sich in der Mitte der Sequenz, erscheinen in grün und rot. Der gezielte Austausch Nukleotid ist Fett und unterstrichen. Die markierten Basen blau 2C CRISPR Protospacer Sequenz, und orangenen Basen markieren die PAM-Website. Die in diesen Experimenten verwendeten Oligonukleotid ist 72 Basen in der Länge, mit Phosphorothioat modifiziert Verbindungen an den drei terminalen Basen; 72-Mer zielt nicht transkribiert (NT) Strang (72NT). (B) CRISPR/Cas9Ribonucleoprotein Montage Reaktion. CrRNA bietet Ziel Spezifität (20 Basen, roten Abschnitt) entsprechend der 2C-Protospacer-Sequenz und einer Interaktion-Domäne (blau) mit TracrRNA (grün). CrRNA und TracrRNA sind in äquimolaren Konzentrationen geglüht. Cas9 Protein (grau) wird hinzugefügt, um die RNP Assembly zu vervollständigen. Guide-RNAs (gRNAs) direkt und aktivieren die Cas9 Endonuklease, die Spalten dann die Ziel DNA. Untere Teil der Abbildung zeigt die 2C-Samen-Sequenz und der TracrRNA-Sequenz. Diese Zahl wurde von Rivera-Torres, N. Et Al. modifiziert. (2017). Bitte klicken Sie hier für eine größere Version dieser Figur.
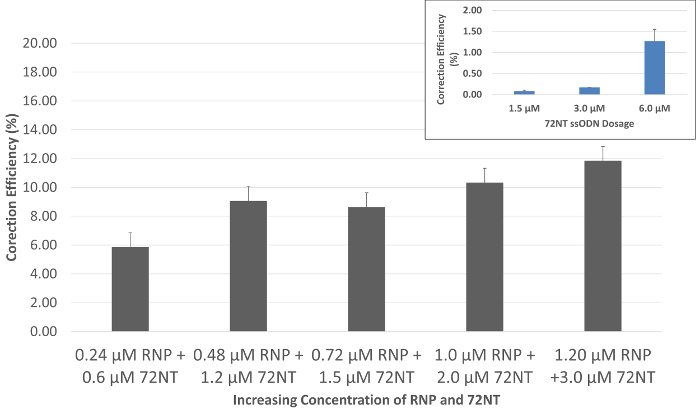
Abbildung 2: Gen, die Bearbeitung ist dosisabhängig bei der Regie die RNP und die SsODN. Synchronisiert und veröffentlicht HCT 116-19 Zellen wurden elektroporiert mit 24-120 Pmol von CRISPR/Cas9 RNP und 0,6 bis 3,0 µM von 72mer. Nach einer Erholungszeit von 72-h wurde Bearbeiten von Gen Aktivität gemessen mit einem Durchflusszytometer. Gen bearbeiten erscheint als die Korrektur Wirkungsgrad (%), abhängig von der Anzahl der lebensfähigen eGFP-positiven Zellen geteilt durch die Gesamtzahl der lebensfähigen Zellen in der Bevölkerung. Fehlerbalken entstehen aus drei Datenpunkte über drei separate Experimente mit grundlegenden Berechnungen der Standard-Fehler generiert. Einschub: Single-Agent gen bearbeiten. Gen-Bearbeitung Aktivität unter der Regie von einzelsträngiger Oligonukleotid (72NT) in Ermangelung der RNP Komplex unter identischen Bedingungen präsentiert sich als eine Funktion der Konzentration. Diese Zahl wurde von Rivera-Torres, N. Et Al. modifiziert. (2017). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3. Experimentelle Strategie für die Isolierung von einzelligen Klone. Zellen, die ausstellenden eGFP Ausdruck erzielt wurden als positiv und sortierte mit einem Durchflusszytometer als Einzelzellen in einzelnen Vertiefungen für klonale Expansion. Zellen fehlt eGFP Ausdruck wurden isoliert und in ähnlicher Weise sortiert und unter den gleichen Voraussetzungen erweitert. Die DNA wurde dann isoliert und das Gen eGFP wurde verstärkt und Sanger ausgesetzt Sequenzierung, die gen-Bearbeitung Aktivität rund um die Ziel-Site zu analysieren. Diese Zahl wurde von Rivera-Torres, N. Et Al. modifiziert. (2017). Bitte klicken Sie hier für eine größere Version dieser Figur.
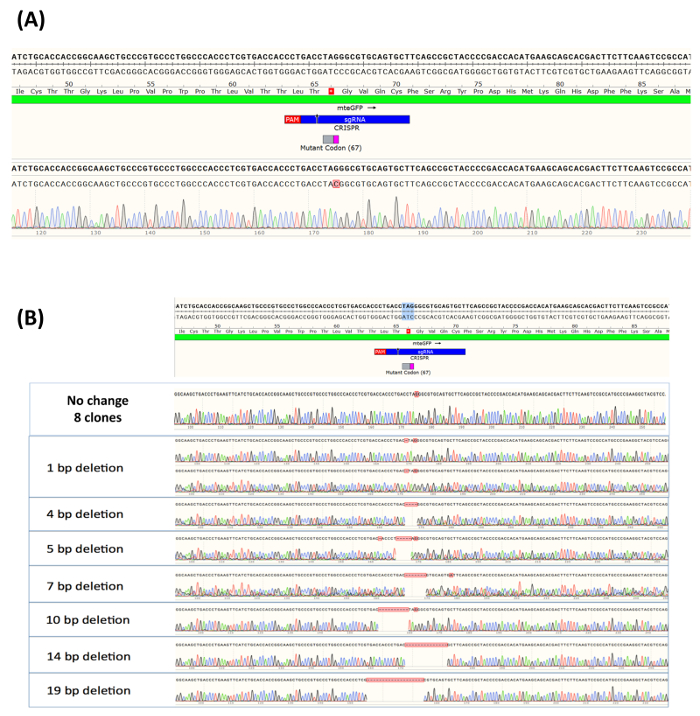
Abbildung 4. (A) allelische Analyse eGFP-positiven Zellen erweitert als klonale Population. Klonal isoliert und erweiterte eGFP-positiven Proben (16 Klone) wurden auf dem Gelände rund um die gezielte Basis und DNA voneinander analysiert, geerntet, gereinigt, verstärkt und sequenziert. Allele Analyse erfolgte nach Sanger-Sequenzierung, konfektioniert mit Sequenz-Visualisierungs-Software und im Vergleich zu der Sequenz ein Wildtyp-Allel, die am oberen Rand der Abbildung dargestellt ist. Geschnittenen Ortsbild des RNP-Komplex ist als ein kleiner schwarzer Pfeil befindet sich auf dem Green bar (2 C CrRNA) angegeben. (B) Allele Analyse eGFP-negativen Zellen erweitert als klonale Population. Fünfzehn einzelne Samples von Klone aus der unkorrigierte Bevölkerung erweitert wurden nach dem Zufallsprinzip ausgewählt und analysiert für Indel Bildung auf dem Gelände rund um den Ziel-Nukleotid. Wie oben, allelische Analyse erfolgte nach Sanger-Sequenzierung und konfektioniert mit einer Sequenz-Visualisierungs-Software. Wieder einmal werden die Reihenfolge der Wildtyp-Allel am oberen Rand der Figur zusammen mit der geschnittenen Website von RNP, vorgestellt. Diese Zahl wurde von Rivera-Torres, N. Et Al. modifiziert. (2017). Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Gen, die Bearbeitung entstanden als Mainstream-wissenschaftliche Disziplin vor allem wegen der Entstehung der CRISPR/Cas9-System. Dieser bemerkenswerten Weg, die Adoptiveltern Immunität in Bakterienzellen erleichtert, hat als molekulare Werkzeug zur genomischen Veränderung im menschlichen Chromosomen ermöglichen zweckentfremdet worden. Die natürliche Funktion der CRISPR/Cas9 ist, virale DNA zu deaktivieren, durch die Einführung von doppelsträngigen DNA-Brüchen führt zu Fragmentierung30,31. Diese Aktivität führt zur Zerstörung des eindringenden exogenen DNS und führt zu prokaryotischen Immunität, die nachfolgende Infektion durch die gleichen Viruspartikel unterdrückt. Erstaunlich, weist dieses System Lungenpest Verhalten auf, dass es bestimmte CRISPR gRNA erstellt durch vorherige Infektionsereignisse zu reaktivieren.
Die Effizienz und Genauigkeit des Gens Störung katalysiert durch CRISPR/Cas9 wird in zahlreichen eukaryotischen genetischen Systeme wo war das Ziel, ein funktionierendes gen32,33zu deaktivieren. Wenn auf der basalen Ebene reduziert, besteht der Prozess aus zwei grundlegende Schritte. Die erste ist eine doppelsträngige zu brechen, während die zweite stützt sich auf die inhärenten Prozess der nicht-homologe Ende verbinden (NHEJ) zur Vervollständigung den Knockout. In den meisten Fällen die Doppelstrang-Pause-Ergebnisse bei der Erstellung von Blunt beendet, ausgekuppelten chromosomalen Segmente und an NHEJ beteiligten Enzyme der chromosomalen Pause reagieren und handeln, um den gebrochenen Enden verbinden. Dieser Prozess kann manchmal den Verlust einzelner Nukleotide auf dem abgetrennten Gelände beinhalten. Der Verlust sogar ein paar Grundlagen kann dazu führen, dass eine Frameshift und funktionaler Ausdruck hört auf. Die Verwendung von CRISPR/Cas9 um genetische Ko zu erstellen, durch die Gewinnung des natürlichen Prozess der NHEJ revolutioniert eukaryotischen Genetik; der Verlust der DNA an der Ziel-Site ist vorhersehbar und erwarteten.
Im Gegensatz zu gen Knockout wurden eine Reihe von Forschern bei dem Versuch, umleiten und Wiederverwendung von CRISPR/Cas9 Aktivität auf den Prozess der Homologie gerichtete Reparatur beauftragt. Ziel der Studien ist gen-Korrektur. Bei dieser Strategie wird CRISPR/Cas9 mit einer Spender-DNA-Vorlage kombiniert, die die genetische Information, einen angeborene Fehler zu reparieren oder gesunde Gene Mutationen einfügen bereitstellt. Frühe Berichte, die die bemerkenswerte Fähigkeit der CRISPR/Cas9, unter der Regie von Homologie Reparatur katalysieren Hervorhebung angezeigt (direkt oder indirekt), dass der Prozess in eine hochpräzise Mode24,34aufgetreten. Unser Labor hat unter der Regie von Homologie Reparatur oder gen-Korrektur mit einsträngiger Oligonukleotide in einem Versuch um zu definieren, den Mechanismus und die regulatorischen Schaltung, die es umgibt,15,17,18 studiert ,23. Wir konzentrierten sich in erster Linie auf das Gen einzelne Punktmutationen, bearbeiten, da dies die grundlegende genetische Mutation bekannt für viele Erbkrankheiten verantwortlich ist. Unsere grundlegende Kenntnisse der gen Bearbeitung führte uns die Präzision der CRISPR/Cas9 Aktivität in diesen Reaktionen seit der CRISPR/Cas9 Funktion in gen Knockout führt zur Bildung der Indels in Frage zu stellen. Wir verwendet eine wohldefinierte Modellsystem, anstatt ein Gen nicht auswählbar, aber klinisch relevant, um vor-Ort-Mutagenese in eine dezidiert reduktionistischen Mode zu studieren. Mithilfe einer einfachen Zielgen, auf welche gen Korrektur auf die genotypischen und phänotypischen Ebenen gemessen werden kann begründete wir, dass Heterogenität auftreten an der Ziel-Site in eine zuverlässige und robuste Art und Weise identifiziert werden konnten.
Unsere Daten bestätigen, dass die etablierten gen editing-System, bestehend aus einem mutierten eGFP gen integriert HCT116 Zellen können liefern grundlegende Informationen in Bezug auf die Erzeugung von genetischen Veränderungen und der Prozess der vor-Ort-Mutagenese. CRISPR/Cas9 und einsträngige Oligonukleotid Spender DNA-Moleküle im Tandem arbeiten können auf die genaue Reparatur die Punktmutation im gen eGFP führen. Wir schlagen ein neues Modell für die Reparatur von Punktmutationen, einen molekularen Weg, in denen die Spender-DNA fungiert als Kopiervorlage Replikation für die Reparatur der mutierten Basis, einen Prozess haben wir exakt30bezeichnet. Die gezielte Bevölkerung nicht ausstellen des korrigierten Phänotyps zeigt eine Vielzahl von Zellen enthält heterogene und weit reichende DNA Indels rund um die Ziel-Site. In etwa die Hälfte die Klone isoliert aus der unkorrigierte Bevölkerung wurde an der Ziel-Site Löschung Mutagenese beobachtet. Da keine vorherigen Bericht angegeben hat, dass einsträngige Oligonukleotide als Single-Agent-gen-editing-Tools Indels an die Ziel-Site induzieren können, wir schließen, dass CRISPR/Cas9 Aktivität für diese Mutationen verantwortlich ist.
In diesem Manuskript bieten wir eine detaillierte Methode, so dass genetische Heterogenität an der Ziel-Site in eine zuverlässige und robuste Art und Weise gemessen werden kann. Während der Analyse eine enorme Menge an Aufmerksamkeit geschenkt und Kartierung von Off-Site-Mutagenese, es wahrscheinlich ist, dass eine heterogene Mutation an die Ziel-Site erstellt haben einen größeren Einfluss auf den Erfolg oder Misserfolg des Gens im klinischen Bereich bearbeiten. Zusätzliche Technologien oder modifizierte Cas9 Proteine möglicherweise erforderlich, um die Genauigkeit der Homologie gerichtete Reparatur von angeborenen Fehlern in Säugerzellen35zu verbessern. Einige dieser Technologien umfassen die Verwendung von Hilfs Oligonukleotide als eine Brücke, die chromosomalen enden zusammenzuhalten und die Vermeidung von der zerstörerischen Wirkung des NHEJ handeln. Definieren den Grad der Heterogenität an der Ziel-Site durch Bearbeiten von Gen-Aktivität ist und ein wichtiger Bestandteil jedes Protokoll für eine therapeutische Intervention entwickelt werden muss.
Offenlegungen
Die Autoren nichts preisgeben.
Danksagungen
Die Autoren haben keine Bestätigungen.
Materialien
| Name | Company | Catalog Number | Comments |
| McCoy’s 5A Modified medium | ATCC | 30-2007 | |
| Fetal Bovine Serum (FBS) | ATCC | 30-2020 | |
| L-glutamine | ATCC | 30-2214 | |
| Penicillin-Streptomycin Solution | ATCC | 30-2300 | |
| Dulbecco's Phosphate Buffered Saline | ATCC | 30-2200 | No Calcium or magnesium |
| Trypsin EDTA Solution | ATCC | 30-2101 | |
| Aphidicolin 1mg | Thermo Fisher | AC611970010 | |
| Alt-R CRISPR crRNA, 10 nmol | IDT | No catalog number since its made to your specific gene target. | |
| CRISPR-Cas9 tracrRNA, 20 nmol | IDT | 1072533 | |
| S.p. Cas9 Nuclease 3NLS, 500 µg | IDT | 1074182 | |
| IDTE Buffer | IDT | 11-01-03-01 | |
| Zeus Electroporation Cuvettes 0.4 Cm | VWR | 10497-474 | |
| Gene Pulser Xcell Electroporation Systems | BioRad | 1652660 | |
| Bovine serum albumin lyophilized powder, crystallized, ≥98.0% (GE) | Sigma | 05470-1G | |
| EDTA (0.5 M), pH 8.0 | ThermoFisher Scientific | AM9260G | |
| Propidium Iodide - 1.0 mg/mL Solution in Water | ThermoFisher Scientific | P3566 | |
| DNeasy Blood & Tissue Kit (250) | Qiagen | 69581 | |
| 6-well Standard Line Multiwell Cell Culture Plates | VWR | 10062-892 | |
| Petri Dishes | Fisher | 12-565-90 | |
| Conical Tubes (15 mL) (racked) | Thermo Fisher | AM12500 | |
| Trypan Blue Solution, 0.4% | Thermo Fisher | 15250061 | |
| Reduced Serum Medium | Thermo Fisher | 31985062 |
Referenzen
- Mandecki, W. Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis. Proc Natl Acad Sci. 83 (19), 7177-7181 (1986).
- Walder, R. Y., Walder, J. A. Oligodeoxynucleotide-directed mutagenesis using the yeast transformation system. Gene. 42 (2), 133-139 (1986).
- Moerschell, R. P., Tsunasawa, S., Sherman, F. Transformation of yeast with synthetic oligonucleotides. Proc Natl Acad Sci. 85 (2), 524-528 (1988).
- Yoon, K., Cole-Strauss, A., Kmiec, E. B. Targeted gene correction of episomal DNA in mammalian cells mediated by a chimeric RNADNA oligonucleotide. Genetics. 93, 2071-2076 (1996).
- Beetham, P. R., Kipp, P. B., Sawycky, X. L., Arntzen, C. J., May, G. D. A tool for functional plant genomics: chimeric RNA/DNA oligonucleotides cause in vivo gene-specific mutations. Proc Natl Acad Sci U S A. 96 (15), 8774-8778 (1999).
- Bertoni, C., Morris, G. E., Rando, T. A. Strand bias in oligonucleotide-mediated dystrophin gene editing. Hum Mol Gen. 14 (2), 221-233 (2004).
- Alexeev, V., Yoon, K. Stable and inheritable changes in genotype and phenotype of albino melanocytes induced by an RNA-DNA oligonucleotide. Nat Biotechnol. 16 (13), 1343-1346 (1998).
- Zorin, B., Hegemann, P., Sizova, I. Nuclear-gene targeting by using single-stranded DNA avoids illegitimate DNA integration in Chlamydomonas reinhardtii. Eukaryot Cell. 4 (7), 1264-1272 (2005).
- Brachman, E. E., Kmiec, E. B. DNA replication and transcription direct a DNA strand bias in the process of targeted gene repair in mammalian cells. J Cell Sci. 117 (Pt 17), 3867-3874 (2004).
- Pierce, E. A., et al. Oligonucleotide-directed single-base DNA alterations in mouse embryonic stem cells. Gene Ther. 10 (1), 24-33 (2003).
- Radecke, S., Radecke, F., Peter, I., Schwarz, K. Physical incorporation of a single-stranded oligodeoxynucleotide during targeted repair of a human chromosomal locus. J Gene Med. 8 (2), 217-228 (2006).
- Bertoni, C., Rustagi, A., Rando, T. A. Enhanced gene repair mediated by methyl-CpG-modified single-stranded oligonucleotides. Nucleic Acids Res. 37 (22), 7468-7482 (2009).
- Andrieu-Soler, C., et al. Stable transmission of targeted gene modification using single-stranded oligonucleotides with flanking LNAs. Nucleic Acids Res. 33 (12), 3733-3742 (2005).
- Olsen, P. A., Randol, M., Krauss, S. Implications of cell cycle progression on functional sequence correction by short single-stranded DNA oligonucleotides. Gene Ther. 12 (6), 546-551 (2005).
- Engstrom, J. U., Kmiec, E. B. DNA replication, cell cycle progression and the targeted gene repair reaction. Cell Cycle. 7 (10), 1402-1414 (2008).
- Aarts, M., te Riele, H. Parameters of oligonucleotide-mediated gene modification in mouse ES cells. J Cell Mol Med. 14 (6b), 1657-1667 (2010).
- Brachman, E. E., Kmiec, E. B. Gene repair in mammalian cells is stimulated by the elongation of S phase and transient stalling of replication forks. DNA Repair. 4 (4), 445-457 (2005).
- Engstrom, J. U., Suzuki, T., Kmiec, E. B. Regulation of targeted gene repair by intrinsic cellular processes. BioEssays. 31 (2), 159-168 (2009).
- Parekh-Olmedo, H., Ferrara, L., Brachman, E., Kmiec, E. B. Gene therapy progress and prospects: targeted gene repair. Gene Ther. 12 (8), 639-646 (2005).
- Olsen, P. A., Randol, M., Luna, L., Brown, T., Krauss, S. Genomic sequence correction by single-stranded DNA oligonucleotides: role of DNA synthesis and chemical modifications of the oligonucleotide ends. J Gene Med. 7 (12), 1534-1544 (2005).
- Wang, Z., Zhou, Z. -. J., Liu, D. -. P., Huang, J. -. D. Double-stranded break can be repaired by single-stranded oligonucleotides via the ATM/ATR pathway in mammalian cells. Oligonucleotides. 18 (1), 21-32 (2008).
- Ferrara, L., Kmiec, E. B. Camptothecin enhances the frequency of oligonucleotide-directed gene repair in mammalian cells by inducing DNA damage and activating homologous recombination. Nucleic Acids Res. 32 (17), 5239-5248 (2004).
- Ferrara, L., Parekh-Olmedo, H., Kmiec, E. B. Enhanced oligonucleotide-directed gene targeting in mammalian cells following treatment with DNA damaging agents. Exp Cell Res. 300 (1), 170-179 (2004).
- Lin, S., Staahl, B., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. eLife. 3, 04766 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnol. 31 (9), 827-832 (2013).
- Rivera-Torres, N., et al. The position of DNA cleavage by TALENs and cell synchronization influences the frequency of gene editing directed by single-stranded oligonucleotides. PLoS One. 9 (5), (2014).
- Strouse, B., Bialk, P., Niamat, R. a., Rivera-Torres, N., Kmiec, E. B. Combinatorial gene editing in mammalian cells using ssODNs and TALENs. Sci Rep. 4 (ii), 3791 (2014).
- Bialk, P., Rivera-Torres, N., Strouse, B., Kmiec, E. B. Regulation of Gene Editing Activity Directed by Single-Stranded Oligonucleotides and CRISPR/Cas9 Systems. PloS One. 10 (6), e0129308 (2015).
- Yu, C., et al. Small Molecules Enhance CRISPR Genome Editing in Pluripotent Stem Cells. Cell Stem Cell. 16 (2), 142-147 (2015).
- Rivera-Torres, N., Banas, K., Bialk, P., Bloh, K. M., Kmiec, E. B. Insertional Mutagenesis by CRISPR/Cas9 Ribonucleoprotein Gene Editing in Cells Targeted for Point Mutation Repair Directed by Short Single-Stranded DNA Oligonucleotides. PLoS One. 12 (1), e0169350 (2017).
- Mali, P., et al. CAS9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering. Nat Biotechnol. 31 (9), 833-838 (2013).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nature Biotechnol. 34 (3), 339-344 (2016).
- Slaymaker, I. M., Gao, L., Zetsche, B., Scott, D. A., Yan, W. X., Zhang, F. Rationally engineered Cas9 nucleases with improved specificity. Science. 351 (6268), 84-88 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten