Method Article
Una metodologia Standard per esaminare in loco mutagenicità in funzione della mutazione di punto riparazione catalizzata da CRISPR/Cas9 e SsODN in cellule umane
In questo articolo
Riepilogo
Questo protocollo descrive il flusso di lavoro di un gene basate su CRISPR/Cas9 modifica del sistema per la riparazione delle mutazioni puntiformi in cellule di mammifero. Qui, usiamo un approccio combinatorio di gene editing con una dettagliata strategia sperimentale proseguimento per misurare indel formazione nel sito di destinazione — in sostanza, l'analisi in loco mutagenesi.
Abstract
Combinatoria gene editing utilizzando CRISPR/Cas9 e oligonucleotidi a singolo filamento è una strategia efficace per la correzione delle mutazioni puntiformi di singolo-base, che sono spesso responsabili di una varietà di malattie ereditarie umane. Utilizza un sistema di modello basati su cellule ben consolidata, la mutazione di punto di un gene mutante eGFP copia singola integrato in cellule HCT116 è stata riparata utilizzando questo approccio combinatorio. L'analisi delle cellule non rivedute e corrette rivela sia la precisione del gene editing e lo sviluppo di lesioni genetiche, quando indels vengono creati in cellule non corrette nella sequenza del DNA che circondano il sito di destinazione. Qui, la metodologia specifica utilizzata per analizzare questo approccio combinatorio alla modifica del gene di una mutazione di punto, accoppiata con una dettagliata strategia sperimentale alla misurazione indel formazione presso il sito di destinazione, è descritto. Questo protocollo delinea un approccio fondamentale e il flusso di lavoro per le indagini intese a sviluppare gene CRISPR/Cas9-base di editing per la terapia umana. La conclusione di questo lavoro è che quella mutagenesi in loco avviene a seguito di attività CRISPR/Cas9 durante il processo di riparazione di mutazione di punto. Questo lavoro mette in atto una metodologia standardizzata per identificare il grado di mutagenesi, che dovrebbe essere un aspetto importante e critico di qualsiasi approccio destinato per implementazione clinica.
Introduzione
Pionieristici studi di Mandecki (1986) ha dimostrato i cambiamenti permanenti nel DNA del plasmide utilizzando oligonucleotidi trasformati in batteri1, mentre Walder e Walder (1986) ha effettuato studi simili in lievito2. Poco dopo, Sherman e colleghi pubblicato una serie di documenti in cui oligonucleotidi a singolo filamento sono stati introdotti nelle cellule di lievito per apportare modifiche ereditabili in geni3. Basandosi sul lavoro seminale in cellule microbiche, Kmiec e colleghi ha cominciato a sviluppare unico del singolo-agente oligonucleotidi che diretto singola riparazione della soletta in cellule di mammifero4. Questo concetto è stato basato su dati biochimici che hanno mostrato che molecole RNA del cuscinetto si legano più strettamente al sito di destinazione rispetto a quelli composto interamente di basi del DNA. Anche se ci sono state numerose segnalazioni di modifica del gene successo utilizzando oligonucleotidi chimerico5,6,7, i livelli di editing è rimasto altamente variabili tra esperimenti e attraverso diverso/cellula bersaglio combinazioni.
DNA a filamento singolo donatore è preferito al donatore di double-stranded DNA perché è meno probabile integrare in modo casuale siti all'interno del genoma8. Tuttavia, esogenicamente introdotti singolo filamento oligonucleotidi sono soggetti a degradazione rapida dall'azione delle nucleasi cellulari. Sono state impiegate diverse strategie per proteggere le estremità dei oligonucleotides dal degrado. Un exonuclease-protetto, single-stranded DNA contenente la sequenza desiderata era sufficiente per ottenere un'efficienza di editing in 0,1-1% gamma6. Migliorato e più coerente tecniche di transfezione, accoppiati con le letture fenotipiche, permesso per più coerente di editing di più ricerca gruppi di8,10,9,11, 12,13.
Negli ultimi 10 anni, c'è stato un notevole sforzo per rendere più suscettibili di modifica genica cellule bersaglio. Una strategia impiega la modulazione del ciclo cellulare14,15,16. Mentre modifica frequenze condizioni di reazione normale con oligonucleotidi a singolo filamento (ssODNs) introdotto in cellule di mammiferi coltivate aleggiava tra 0,1% e 1%, le frequenze del gene editing aumentato 3 - 5 volte quando gli oligonucleotidi sono stati introdotti nelle cellule durante il passaggio attraverso la fase S. In una serie separata di esperimenti, Brachman e Kmiec (2005) hanno dimostrato che livelli relativamente alti di gene preciso montaggio (3-5%) sono stati ottenuti quando 2'3 ' dideoxycytosine (ddC) è stato incubato in cellule per 24 h prima dell'aggiunta dell'oligonucleotide17 . ddC riduce il tasso di movimento della forcella replica del DNA, suggerendo che gene editing da ssODNs nella replica cellule probabilmente coinvolge l'incorporazione di ODN in regioni di replica di active11,18. Presi insieme, questi studi hanno portati al concetto che DNA donatore diventa incorporato in una crescente forcella replica come parte del vero meccanismo d'azione di gene editing, indipendentemente se è presente una rottura del doppio filamento o non19. Così, la correzione di una mutazione di punto o la sostituzione di un segmento di DNA all'interno del cromosoma avviene attraverso un accoppiamento di DNA e via di assimilazione di single-strand.
Indurre interruzioni casuali nel DNA double-stranded in crescita delle cellule con gli agenti della piccolo-molecola crea un ambiente in cui gli eventi di replica del DNA sono bloccati perché la cellula tenta di riparare il danno20,21. Questo rallentamento transitorio delle forcelle replica consente una penetrazione più efficiente della struttura della cromatina di oligonucleotidi editing singolo filamento, migliorando l'accessibilità di destinazione15. La creazione di DNA double-stranded si rompe da farmaci come VP16, bleomicina, o camptotecine22,23, è stato indicato per stimolare il gene modifica dei livelli di quasi 10 volte, fino a 6-8%. Tuttavia, interruzioni casuali nel DNA double-stranded sono indesiderabili in un setting terapeutico.
Gene editing con oligonucleotidi e nucleasi programmabile è anche stimolato durante la divisione cellulare24,25. Quando consegna basati su acido nucleico è stato utilizzato per effettuare riparazione omologia-diretto in cellule HCT 116 sincronizzate, Rivera-Torres e colleghi hanno dimostrato lo stesso aumento nell'attività di targeting quando nucleasi di trascrizione attivatore-come effettore (TALENs) sono stati impiegati con oligonucleotidi a singolo filamento, entrambi introdotti in una replica cella popolazione26,27 . Più recentemente, Bialk e colleghi hanno mostrato che la riparazione di singole mutazioni base con oligonucleotidi a singolo filamento e una matrice di cluster regolarmente interspaziati breve palindromi ripetizioni Cas9 (CRISPR/Cas9) molecole avviene con maggiore efficacia Quando la popolazione delle cellule sta attraversando la fase S28. La molecola CRISPR è composto da RNA e funzioni per identificare l'area all'interno della sequenza di DNA che viene designato per la scissione di destinazione. Cas9 è un enzima batterico cui funzione è di fendere il DNA double-stranded in una reazione di scambio nucleolitico. Così, CRISPR posiziona il complesso sul target genomici e nucleasi Cas9 esegue la rottura del doppio filamento. Lin et al. (2014) inoltre ha dimostrato l'importanza del ciclo cellulare per il raggiungimento di alte frequenze del gene editing, utilizzando un CRISPR/Cas9 ribonulceoprotien (RNP) complesso-mediata consegna sistema modificato in primari neonatali fibroblasti, cellule staminali embrionali umane, e altre linee cellulari24. Così, il rapporto instaurato tra gene editing e progressione del ciclo cellulare per singolo agente gene editing è applicabile al gene combinatoria di editing con nucleasi programmabile e modelli di DNA del donatore. Mentre l'approccio combinatorio di gene editing ha riunito una serie di partner con il modello di DNA del donatore, maggior parte dei lavoratori nel campo utilizzare CRISPR/Cas9 per fornire la funzione di interruzione doppio filamento. Questa scelta si basa sulla facilità di utilizzo di questo particolare strumento genetico e la flessibilità con cui può essere utilizzato per disattivare la funzione del gene o per introdurre un straniero pezzo di DNA in un sito specifico. La generazione di un knockout è tecnicamente più facile rispetto ad un rimontaggio di gene, dove l'incorporazione di "corrette" o normale copie di un gene il sito di malattia deve essere effettuata con precisione. Un numero di ricercatori è identificando e studiando l'uso di specifici farmaci e reagenti che permettono la correzione delle basi mutante e l'inserimento di sequenze genetiche normale nella posizione adeguata alle frequenze elevate29.
Recentemente, Rivera-Torres et al. 30 usata combinatoria gene editing, approfittando dell'attività double-stranded pausa di un sistema CRISPR/Cas9 specificamente progettato e l'informazione genetica fornita da un modello di DNA del donatore singolo-incagliato oligonucleotide, per riparare un mutazione puntiforme in unsingola copia del gene della proteina fluorescente verde avanzata (eGFP) integrato in cellule HCT116. Gli autori hanno approfittato di questa linea cellulare modello ben caratterizzati per valutare la specificità di fenditura che circondano il sito di destinazione. I dati rivelano che la eterogeneità nel sito di destinazione esiste, soprattutto nelle celle che non contengono una mutazione di punto corretta. In questo manoscritto, abbiamo dettaglio e concentrarsi sulla metodologia utilizzata da questi lavoratori per esaminare in loco eterogeneità mutazionale creato modificando gene CRISPR/Cas9.
Protocollo
il seguente protocollo coinvolge funzionare con cellule di mammifero; familiarità con coltura sterile tecnica/cellulare è previsto.
1. linea cellulare e condizioni di coltura
- fare 500 mL di terreno per la coltura delle cellule HCT 116: McCoy ' s 5A per volta supplementato con 10% siero bovino fetale (FBS), 2 mM L-Glutammina e 1% di penicillina (questo è completo Medium).
Nota: Crescere HCT 116-19 cellule in un fiasco di T-75 o T-175 prima della placcatura. Quando 90% confluenti, ciascuna beuta T-75 produrrà 8,4 x 10 6 celle, circa cinque piatti di 10 cm, e ogni T-175 produrrà 18,4 x 10 6 celle, circa quindici piatti 10-cm.
2. Raccolta delle cellule dal pallone
- aspirare via il mezzo, lavare con Dulbecco ' s Phosphate-Buffered salina senza calcio e magniesium (PBS) (10 mL per T-75 o 25 mL per T-175) e aspirato.
- Aggiungi tripsina goccia a goccia al pallone usando una pipetta a 2 mL (2 mL per T-175 o 1 mL per T-75). Collocare la beuta in un incubatore a 37 ° C e 5% di CO 2 per 5 min consentire alle cellule di scollegare.
- Tocca il pallone per assicurarsi che tutte le celle sono sloggiate e poi placare con terreno completo disperdendo e su tutta la superficie del pallone (8 mL per T-175 o 4 mL T-75).
- Pipetta su e giù più volte per rompere i grumi di cellule e trasferire le cellule in una provetta conica 15 mL
- Prima le cellule di filatura in giù, prendere 10 µ l dal conico da 15 mL e combinarlo con 10 µ l di trypan blu per contare le celle. Appallottolare le celle di filatura per 5 min a 125 x g e 16 ° C.
3. Contando le cellule
- trasferire 10 µ l delle cellule mescolato con trypan blu per l'emocitometro. Contare le 4 griglie intorno alla parte esterna (ogni griglia contiene 16 quadrati).
- Prendere il conteggio delle cellule medio da ciascuna serie di sedici caselle d'angolo.
- Moltiplicare per 10.000 (10 4).
- Moltiplicare per il volume totale del mezzo usato per raccogliere le cellule per correggere per la diluizione dall'aggiunta di blu di trypan.
Nota: Il formato di equazione per calcolare il volume per risospendere le cellule segue:
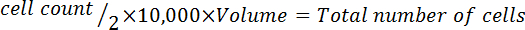
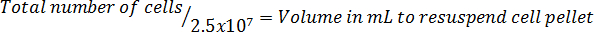
4. Le cellule di placcatura
- per ogni piatto di 10 cm di cellule da sincronizzare, aggiungere 5 mL di terreno completo e 6 µM di aphidicholin (12 µ l di uno stock di 2,5 mM in 200 a prova di etanolo).
- Trasferire 100 µ l di ri-sospensione cellulare a pellet, 2.5 x 10 6 celle, per ogni 10 cm piatto e ricciolo delicatamente per mescolare.
- Incubare le piastre a 37 ° C e 5% di CO 2 per 16-24 h sincronizzare celle al bordo di G1/S.
5. Rilasciando le cellule dalla sincronizzazione di Aphidicolin
- 4h prima del targeting, aspirare il mezzo, lavare con PBS, aspirare il PBS e aggiungere 5 mL di terreno completo
- posizionarlo torna nell'incubatore a 37 ° C e 5% CO 2 per 4 h
6. Complessanti RNA
- invio la sequenza del gene mutante eGFP in laboratorio Zhang ' s generatore online 25 (http:// crispr.mit.edu/) e scegliere la guida CRISPR sequenze che si legano con la vicinanza al sito di destinazione. Ottenere la guida CRISPR sequenze da una fonte commerciale.
- Memorizzare il RNA CRISPR (crRNA), crRNA trans-attivazione (tracrRNA) e la proteina di Cas9 a 20 ° C e utilizzare secondo i suggerimenti del produttore.
Tubo
- Mix il RNA in concentrazioni equimolari di 45 µM. aggiungere 6.75 µ l di uno stock di 200 µM di crRNA e 6,75 µ l di uno stock di 200 µM di tracrRNA ad una centrifuga da 1,5 mL. 16.50 µ l di Buffer di TE per rendere un volume finale di 30 µ l.
- Calore a 95 ° C per 5 min in un blocco di calore o macchina PCR.
Attenzione: Caldo! - Lasciarli raffreddare a temperatura ambiente.
Nota: Se si utilizza una macchina PCR, impostare il raffreddamento a 0,2 ° C/s. - Procedere come segue per ciascun campione.
- µ L di diluire 2.22 del complesso a 2,78 µ l di tampone di TE (10 mM Tris, pH 8.0 e 0,1 mM EDTA; pH 8.0) ad un volume finale di 5 µ l di crRNA:tracrRNA.
- 1.67 diluire µ l di proteina Cas9 da uno stock di 60 µM a 3,33 µ l di siero basso-medio a volume finale di 5 µ l.
- Mix 5 µ l di proteina Cas9 con 5 µ l di RNA complessato
7. Raccolta delle cellule per Targeting
- aspirato il mezzo, lavare con 5 mL di PBS, aspirare il PBS e aggiungere 1 mL di tripsina pre-riscaldata per ogni piatto di 10cm. Mettere le piastre nell'incubatore a 37 ° C e 5% CO 2 per 5 min.
- Toccare sulla piastra per assicurarsi che tutte le celle sono sloggiate e poi placare con 4 mL di terreno completo disperdendo e su tutta la superficie della piastra di 10 cm.
- Pipetta su e giù più volte per rompere i grumi di cellule e trasferire le cellule in una provetta conica 15 mL.
- Prima le cellule di filatura in giù, prendere 10 µ l dalla provetta conica 15 mL e combinarlo con 10 µ l di trypan blu per contare le celle. Appallottolare le celle di filatura per 5 min a 125 x g e a temperatura ambiente.
- Il mezzo di aspirare e lavare con 5 mL di PBS. Appallottolare le celle di filatura a 125 x g per 5 min a temperatura ambiente.
8. Contando le cellule
- trasferire 10 µ l delle cellule mescolato con trypan blu per l'emocitometro. Contare le 4 griglie intorno alla parte esterna (ogni griglia contiene sedici quadrati).
- Prendere il conteggio delle cellule medio da ciascuna serie di sedici caselle d'angolo.
- Moltiplicare per 10.000 (10 4).
- Moltiplicare per il volume totale del mezzo usato per raccogliere le cellule per correggere per la diluizione dall'aggiunta di blu di trypan.
Nota: Di seguito è riportato il formato di equazione per calcolare il volume per risospendere le cellule. Risospendere il numero necessario di cellule in McCoy privo di siero ' s 5A per volta media.
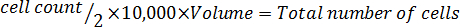
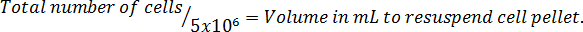
9. campioni di targeting
- trasferire 100 µ L di sospensione cellulare (5 x 10 5 cellule) dal punto 8.1 per ogni provetta di gap di 4 mm di elettroporazione. Aggiungere 10 µ l di RNP complesso da passo 6.7 a 100 µ l di cellule con una densità di cella di 5 x 10 5. Aggiungere ODN (2 µM) per ogni campione.
Nota: Per un controllo positivo, aggiungere 1 µ l di eGFP a 1 µ g / µ l, esprimendo plasmide- prendere la cremagliera per una macchina di elettroporazione, leggermente flick ogni campione e metterli nella camera. Electroporate a 250 V, LV; 2 impulsi, 1 s; 13 ms; impulso unipolare.
- Trasferimento rack torna alla cappa. Trasferire ciascun campione di una piastra contenente 2 mL di terreno completo ion una piastra a 6 pozzetti. Incubare a 37 ° C e 5% di CO 2 per 72 h prima della ricerca di livelli di correzione.
10. Analisi del Gene modificato cellule ed efficienza di trasfezione
- il mezzo di aspirare e lavare le cellule con 2 mL di PBS. Aspirare il PBS e aggiungere 500 µ l di tripsina preriscaldata in ciascun pozzetto della piastra 6 pozzetti. Mettere le piastre nell'incubatore a 37 ° C e 5% CO 2 per 5 min.
- Toccare la piastra per assicurarsi che tutte le celle sono sloggiate e poi placare con 1 mL di terreno completo disperdendo e su tutta la superficie del pozzo.
- Passare le cellule in una provetta da centrifuga da 1,5 mL e pellet a 5.000 x g per 5 min a temperatura ambiente.
- Aspirare il mezzo. Risospendere il pellet cellulare in 500 µ l di tampone di FACS (0,5% BSA, 2 mM EDTA e 2 µ g/mL di ioduro di propidio in PBS).
- Misurare la fluorescenza delle cellule (eGFP +) tramite flusso cytometry.
- Calcolare l'efficienza di correzione come la percentuale delle cellule totali dal vivo eGFP-positive rispetto al numero totale di cellule vive in ogni campione, come descritto in Rivera Torres et al 30.
11. Analisi di sequenza del DNA
- Electroporate l'HCT sincronizzato e rilasciato 116-19 cellule ad una concentrazione di 5 x 10 5 cellule/100 µ l, con RNP complesso a 100 pmols e 72NT ODN a 2,0 µM.
- Trasferire le cellule per piastre da 6 pozzetti e consentire loro di recuperare per 72 h.
- Ordinare le celle singolarmente in piastre da 96 pozzetti utilizzando un sorter FACS con un laser di 488 nm (100 mw) per eGFP + /-, come descritto in Rivera-Torres et al 30.
Nota: Non tutti i pozzetti con successo crescerà. - Espandere le cellule oltre 6 settimane e raccolto come descritto nel passaggio 7.
- Dai pozzi che hanno crescita, isolare gDNA cellulare utilizzando un isolamento di DNA disponibile in commercio kit (vedere la Tabella materiali) e amplificare la regione che circonda l'obiettivo base tramite PCR (718 bp; forward primer 5 '- ATGGTGAGCAAGGGCGAGGA-3 ' e reverse primer 5 ' - ACTTGTACAGCTCGTCCATGC - 3 ').
- Analisi di sequenziamento del DNA di eseguire sui campioni.
Risultati
Abbiamo usato un sistema modello per studiare il gene editing in cellule di mammifero, che si basa sulla correzione di una mutazione di punto incorporata all'interno del gene eGFP integrato come una singola copia in cellule HCT116. È importante notare che questo è un gene di singola copia; così, una vista meno complicata di alterazioni del DNA o mutagenesi possa essere fatte. Figura 1A Visualizza la sequenza del gene eGFP mutante con la base mirata, la terza base del codone di arresto TAG, evidenziato in rosso. Il oligonucleotide 72-base, che è parzialmente complementari al filamento non trascritto del gene eGFP (72NT) ed è progettato per indurre lo scambio di base da un campo a una C, inoltre è illustrato. Inoltre, un CRISPR, designato come 2C, con la sequenza indicata protospacer in 5' a 3' orientamento, è anche raffigurata in Figura 1A. Per eseguire questa reazione gene-editing, abbiamo usato una ribonucleoproteina (RNP) composto da CRISPR RNA (cr) e il RNA tracr (tr) accoppiato a proteina purificata Cas9 (Figura 1B), invece di utilizzare un vettore di espressione dei mammiferi che consiste del gene Cas9 e la guida specifica appropriata sequenza di RNA.
Quando la particella RNP specificamente progettata viene consegnata con il singolo-incagliato oligonucleotide in cellule HCT116 mediante elettroporazione, gene editing, testimoniano la riparazione della singola mutazione base in eGFP, è osservata dopo 72 h di incubazione utilizzando un flusso di citometro. Riparazione funzionale è osservabile dall'emergere di fluorescenza verde in cellule mirate, che possono anche essere separate da tutta la popolazione di ordinamento a causa di questa fluorescenza. Come illustrato nella Figura 2, una risposta graduale della dose può essere visto come i livelli coordinati di aumento RNP e 72NT. Il rapporto molecolare, picomoli di RNP e concentrazione micromolar di 72NT come visualizzato nella figura, si basano su dosaggi ottimali usati nelle reazioni di modifica del gene che dipendono l'introduzione della Guida specifico RNA da espressione trasfettate e Cas9 vettori. L'inserto nella Figura 2 Visualizza una reazione gene-editing effettuata in assenza della particella RNP. Qui, circa l'1% delle cellule mirate sono corretti quando una concentrazione 10 volte maggiore dell'oligonucleotide 72NT viene utilizzata nella reazione del singolo-agente gene-editing.
Al fine di determinare l'esistenza di eterogeneità genetica presso l'effetto del sito-il cosiddetto mutagenesi in loco destinazione-abbiamo deciso di esaminare il risultato del gene modifica attività in singole celle. Mentre molto più laborioso rispetto esaminando la popolazione complessiva, una vera misura di impronte genetiche o lesioni può essere accertata quando viene esaminato il genoma delle cellule clonally ampliate. Abbiamo ripetuto l'esperimento descritto in Figura 2, questa volta utilizzando solo 100 pmol di RNP complesse e 2,0 µmol dell'oligonucleotide 72NT. Come sopra, cellule HCT 116 sono state sincronizzate per 24 h con aphidicholine e arrestate al bordo di G1/S. 4 h in seguito, le cellule sono state rilasciate e gli strumenti di modifica del gene sono stati introdotti dall'elettroporazione. 72 ore dopo, le cellule sono state analizzate mediante FACS e ordinare singolarmente in piastre da 96 pozzetti (il processo sperimentale è illustrato nella Figura 3). Le cellule visualizzati da fluorescenza verde sono state ordinate tramite flusso cytometry in singoli pozzetti di una piastra a 96 pozzetti per espansione clonale. D'importanza, le cellule che mancano di espressione di eGFP erano anche isolate e ordinate in modo simile per espansione alle stesse condizioni.
Dopo 14 giorni di crescita, la maggior parte dei singoli cloni aveva ampliato sufficientemente per consentire l'isolamento del DNA. Come tale, 16 cloni dei campioni eGFP-positivi sono stati selezionati, e l'integrità genetica che circondano il sito di destinazione è stato analizzato mediante sequenziamento. Informazioni che circonda la sequenza del DNA degli alleli all'interno della popolazione è stati generati utilizzando Sanger sequenziamento, assemblati con software di visualizzazione sequenza per confrontare la sequenza di un allele di wildtype (Figura 4A). Il sito di taglio del complesso RNP è indicato da una freccia nera, che si trova sul green bar (2C crRNA). Come anche indicato nella Figura 4A, 16 eGFP-positive tutte le celle contengono lo scambio di nucleotide previsto presso il sito di destinazione. Il residuo di C convertito viene evidenziato in rosso, e il profilo di picco che riflette tale modifica precisa viene fornito sotto la sequenza di eGFP-positivi. In modo simile, 15 non-verde clonale isolati, sufficientemente ampliato per consentire l'estrazione del DNA e la sequenziazione, sono stati analizzati per eterogeneità nel sito di destinazione. Come previsto, in circa metà dei campioni, nessun cambio di base del DNA è stata osservata. Questo si riflette nel mantenimento del residuo G presso il sito di destinazione, come mostrato in Figura 4B. Il resto delle espansioni clonali esaminato in questi esperimenti visualizzato una popolazione eterogenea di mutazioni di omissione, rappresentando quindi la mancanza di fluorescenza verde. La dimensione di eliminazione variata da una base a 19 basi. È importante notare che abbiamo solo esaminato 15 campioni delle cellule eGFP-positive, e mentre noi crediamo che questo è abbastanza rappresentativa del tipo di lesioni genetiche lasciati da CRISPR/Cas9 attività, c'è la possibilità che altri tipi o forme di indels potrebbe essere presente nella popolazione mirata.
Presi insieme, i risultati visualizzati nella Figura 4 confermano la lettura fenotipica in eGFP sistema di targeting. Conversione di G a nucleotide C consente l'emergere di fluorescenza verde in cellule HCT116 corrette. Nessuna sostituzione bassa che circondano il sito di destinazione è stato osservato in cloni isolati per questo esperimento, o in precedenti esperimenti27,28. I dati inoltre dimostrano che le cellule non riuscendo a subire gene editing tramite riparazione di mutazione di punto rimangono non corretta ma, in alcuni casi, non inalterati, con una gamma di eterogeneità genetica che circondano il sito di destinazione.
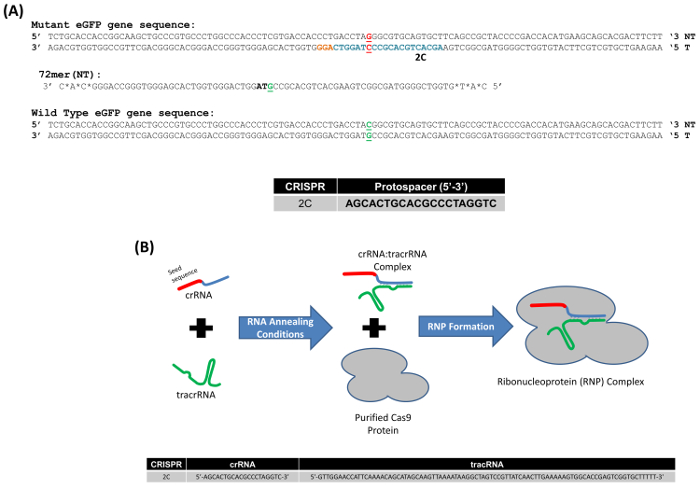
Figura 1. (A) modello di sistema per l'editing del gene del gene mutante eGFP. Segmenti adatti del wildtype e gene eGFP mutato con il codone mirato, situato nel centro della sequenza, vengono visualizzati in verde e rosso, rispettivamente. Il nucleotide mirato per exchange è in grassetto e sottolineato. Basi l'evidenziata in blu rappresentano la sequenza di protospacer CRISPR 2C, e le basi arancione evidenziare il sito di PAM. Il oligonucleotide utilizzato in questi esperimenti è 72 basi di lunghezza, cuscinetto fosforotioato per volta collegamenti alle tre basi terminali; 72-mer destinato a filo del non-trascritto (NT) (72NT). (B) CRISPR/Cas9reazione di assemblaggio della ribonucleoproteina. crRNA fornisce la specificità di bersaglio (sezione 20 basi, rosso) corrispondente per la sequenza di protospacer 2C e un dominio di interazione (blu) con la tracrRNA (verde). crRNA e tracrRNA vengono ricotti in concentrazioni equimolari. Proteina Cas9 (grigio) è aggiunto per completare il montaggio RNP. Guida RNAs (gRNAs) diretto e attivare l'endonucleasi Cas9, che poi fendere il DNA dell'obiettivo. La sezione inferiore della figura mostra la sequenza di seme 2C e la tracrRNA. Questa figura è stata modificata da Rivera-Torres, N. et al. (2017). Clicca qui per visualizzare una versione più grande di questa figura.
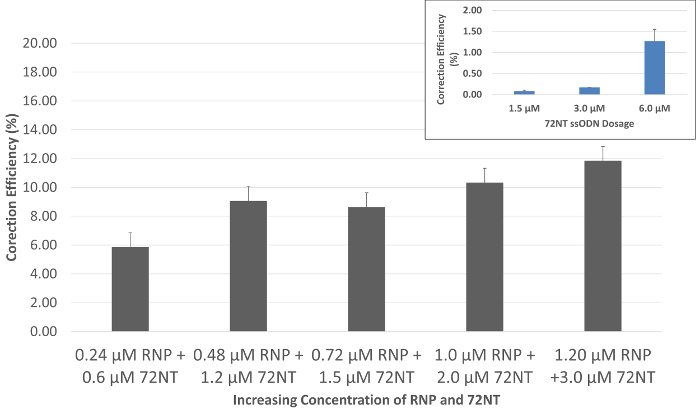
Figura 2. Gene di editing è dose-dipendente quando regia RNP e il ssODN. Sincronizzato e rilasciato HCT 116-19 cellule erano elettroporate con 24-120 pmol di CRISPR/Cas9 RNP e 0.6-3.0 µM di 72mer. Dopo un periodo di recupero di 72 h, attività di modifica del gene è stata misurata utilizzando un citometro a flusso. Gene editing viene visualizzato come l'efficienza di correzione (%), determinato dal numero di cellule vitali di eGFP-positivo diviso per il numero totale di cellule vitali della popolazione. Barre di errore sono prodotte da tre set di punti di dati generati nel corso di tre esperimenti separati utilizzando calcoli di base di errore standard. Inset: agente singolo gene editing. Modifica del gene attività regia di singolo-incagliato oligonucleotide (72NT) in assenza di RNP complesse condizioni identiche è presentata come una funzione di concentrazione crescente. Questa figura è stata modificata da Rivera-Torres, N. et al. (2017). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3. Strategia sperimentale per l'isolamento dei cloni unicellulari. Cellule che esibiscono eGFP espressione sono state segnate come positivo e ordinato utilizzando un citometro a flusso come celluli nei singoli pozzetti per espansione clonale. Le cellule che mancano di espressione di eGFP erano isolate e ordinate in modo simile e ampliate alle stesse condizioni. Il DNA è stato poi isolato e il gene eGFP è stato amplificato e sottoposti a Sanger sequenziamento ad analizzare l'attività di modifica del gene che circondano il sito di destinazione. Questa figura è stata modificata da Rivera-Torres, N. et al. (2017). Clicca qui per visualizzare una versione più grande di questa figura.
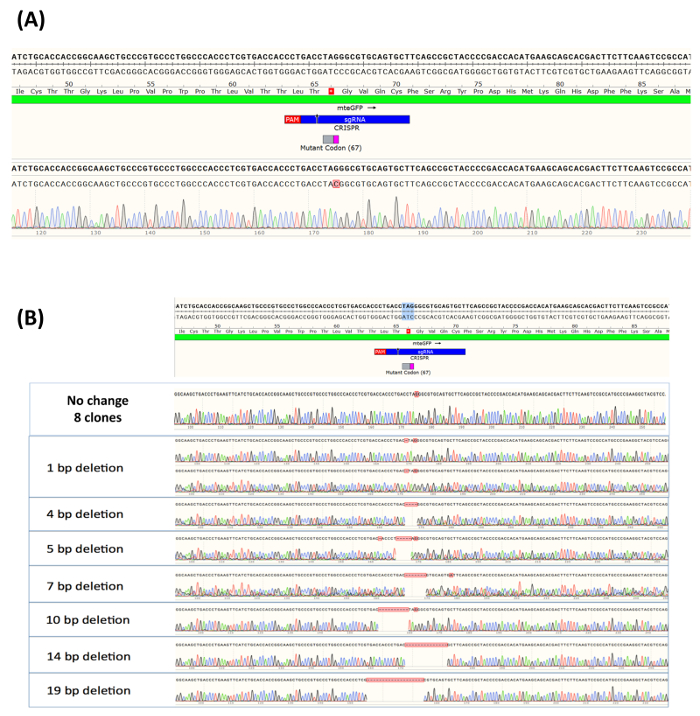
Figura 4. (A) allelic analisi delle cellule positive-eGFP espanso come una popolazione clonale. Clonally isolato ed espanso i campioni positivi eGFP (sedici cloni) sono stati analizzati presso il sito che circonda la base mirati e DNA da ciascuno, raccolto, purificati, amplificati ed ordinati. Allelica analisi è stata effettuata utilizzando Sanger sequenziamento, assemblati con software di visualizzazione sequenza e rispetto alla sequenza di un allele di wildtype, che è illustrata nella parte superiore della figura. Il sito di taglio del complesso RNP è indicato come una piccola freccia nera che si trova sul green bar (2C crRNA). (B) Analisi allelic di eGFP-negativo cellule espanse come una popolazione clonale. Quindici singoli campioni, ampliati da cloni provenienti dalla popolazione non riveduta, casualmente sono stati selezionati e analizzati per formazione di indel nei siti che circondano il nucleotide di destinazione. Come sopra, allelica analisi è stata effettuata utilizzando Sanger sequenziamento e assemblato utilizzando un software di visualizzazione sequenza. Ancora una volta, la sequenza di un allele di wildtype nella parte superiore della figura, assieme al taglio di RNP, sono presentati. Questa figura è stata modificata da Rivera-Torres, N. et al. (2017). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Gene di editing è emerso come disciplina scientifica mainstream soprattutto a causa l'emersione del sistema CRISPR/Cas9. Questa via di notevole, che facilita l'immunità adottiva in cellule batteriche, è stata reimpiegata come strumento molecolare per abilitare alterazione genomica nei cromosomi umani. La funzione naturale di CRISPR/Cas9 consiste nel disattivare il DNA virale introducendo rotture del DNA double-stranded che conduce a frammentazione30,31. Questa attività provoca la distruzione di invadere DNA esogeno e conduce all'immunità procariote che sopprime l'infezione successiva dalla stessa particella virale. Sorprendentemente, questo sistema presenta un comportamento polmonare, in quanto esso può riattivare specifico gRNA CRISPR creato da precedenti eventi di infezione.
L'efficienza e la precisione di rottura del gene catalizzata da CRISPR/Cas9 è stato utilizzato in numerosi sistemi genetici eucariotici dove l'obiettivo era di disabilitare un funzionamento gene32,33. Quando ridotto al suo livello basale, il processo è costituito da due passaggi fondamentali. Il primo è una rottura del doppio filamento, mentre il secondo si basa sul processo inerente del non-omologo end unendo (NHEJ) per completare l'eliminazione diretta. Nella maggior parte dei casi, i risultati di double-stranded pausa nella creazione di smussato-conclusa, disimpegnati segmenti cromosomici e gli enzimi coinvolti in NHEJ reagiscono alla rottura cromosomica e agiscono per congiungere le estremità rotte. Questo processo a volte può comportare la perdita di singoli nucleotidi nel sito mozzata. La perdita delle basi anche alcuni possa causare un frameshift ed espressione funzionale cessa. L'uso di CRISPR/Cas9 per creare genetica knockout impegnandosi il naturale processo di NHEJ ha rivoluzionato eucariotica genetica; la perdita di DNA presso il sito di destinazione è sia prevedibile e previsto.
A differenza di knockout del gene, un numero di ricercatori è impegnato nel tentativo di reindirizzare e reimpiegare CRISPR/Cas9 attività verso il processo di riparazione di omologia-diretto. L'obiettivo degli studi è correzione genica. In questa strategia, CRISPR/Cas9 è combinato con un modello di DNA del donatore che fornisce le informazioni genetiche per riparare un errore innato o per inserire le mutazioni in geni sani. Rapporti iniziali, evidenziando la capacità notevole di CRISPR/Cas9 per catalizzare omologia-regia di riparazione hanno indicato (direttamente o indirettamente) che il processo si è verificato in una moda altamente preciso24,34. Il nostro laboratorio ha studiato regia di omologia riparazione o correzione genica utilizzando oligonucleotidi a singolo filamento nel tentativo di definire il meccanismo e la circuiteria di regolamentazione che lo circondano15,17,18 ,23. Ci siamo concentrati principalmente sul gene modifica singole mutazioni puntiformi, poiché questa è la mutazione genetica più elementare, conosciuta per essere responsabile per molti disordini ereditati. Nostra conoscenza fondamentale di gene editing ci ha portato a mettere in dubbio la precisione dell'attività CRISPR/Cas9 in queste reazioni, poiché la funzione CRISPR/Cas9 nei risultati di knockout del gene nella formazione di indels. Abbiamo usato un sistema di modello ben definito, piuttosto che un gene non selezionabile ancora clinicamente rilevante, per lo studio di mutagenesi in loco in modo decisamente riduzionista. Utilizzando un gene bersaglio semplice, su quale gene correzione può essere misurata a livello genotipico e fenotipico, abbiamo ragionato che eterogeneità che si verificano nel sito di destinazione potrebbe essere identificato in modo affidabile e robusto.
I nostri dati confermano che il gene consolidato sistema di editing, gene integrato in cellule HCT116, costituito da un mutante eGFP può fornire informazioni fondamentali per quanto riguarda la generazione di lesioni genetiche e il processo di mutagenesi in loco. Molecole di DNA del donatore CRISPR/Cas9 e singolo-incagliato oligonucleotide lavorando in tandem possono condurre alla riparazione precisa la mutazione puntiforme del gene eGFP. Vi proponiamo un nuovo modello per la riparazione delle mutazioni puntiformi, una via molecolare in cui il DNA del donatore agisce come un modello di replica per la riparazione della base del mutante, un processo che abbiamo chiamato ExACT30. La popolazione mirata, non esporre il fenotipo corretto, consente di visualizzare una varietà di cellule contenenti eterogenei e ampiamente che vanno indels DNA che circondano il sito di destinazione. In circa la metà i cloni isolati dalla popolazione non riveduta, mutagenesi di eliminazione è stata osservata nel sito di destinazione. Poiché nessun rapporto precedente ha indicato che oligonucleotidi a singolo filamento che agisce come agente singolo gene-editing strumenti possono indurre indels presso il sito di destinazione, possiamo concludere che l'attività CRISPR/Cas9 è responsabile di queste mutazioni.
In questo manoscritto, forniamo una metodologia dettagliata in modo che l'eterogeneità genetica presso il sito di destinazione può essere misurata in modo affidabile e robusto. Mentre una quantità enorme di attenzione è stata pagata per l'analisi e mappatura di mutagenesi off-site, è probabile che una mutazione eterogenea creato presso il sito di destinazione avrà un effetto maggiore sul successo o al fallimento del gene editing in ambito clinico. Tecnologie aggiuntive o proteine modificate Cas9 possono essere richiesti per migliorare la precisione della riparazione di difetti congeniti in cellule di mammifero35omologia-diretto. Alcune di queste tecnologie includono l'uso di oligonucleotidi ausiliari di agire come un ponte, tenendo insieme le estremità cromosomiche ed evitando l'azione distruttiva di NHEJ. Definire il grado di eterogeneità nel sito di destinazione a seguito di attività di modifica del gene è e deve essere una parte importante di qualsiasi protocollo progettato per intervento terapeutico.
Divulgazioni
Gli autori non avendo nulla di divulgare.
Riconoscimenti
Gli autori non hanno nessun ringraziamenti.
Materiali
| Name | Company | Catalog Number | Comments |
| McCoy’s 5A Modified medium | ATCC | 30-2007 | |
| Fetal Bovine Serum (FBS) | ATCC | 30-2020 | |
| L-glutamine | ATCC | 30-2214 | |
| Penicillin-Streptomycin Solution | ATCC | 30-2300 | |
| Dulbecco's Phosphate Buffered Saline | ATCC | 30-2200 | No Calcium or magnesium |
| Trypsin EDTA Solution | ATCC | 30-2101 | |
| Aphidicolin 1mg | Thermo Fisher | AC611970010 | |
| Alt-R CRISPR crRNA, 10 nmol | IDT | No catalog number since its made to your specific gene target. | |
| CRISPR-Cas9 tracrRNA, 20 nmol | IDT | 1072533 | |
| S.p. Cas9 Nuclease 3NLS, 500 µg | IDT | 1074182 | |
| IDTE Buffer | IDT | 11-01-03-01 | |
| Zeus Electroporation Cuvettes 0.4 Cm | VWR | 10497-474 | |
| Gene Pulser Xcell Electroporation Systems | BioRad | 1652660 | |
| Bovine serum albumin lyophilized powder, crystallized, ≥98.0% (GE) | Sigma | 05470-1G | |
| EDTA (0.5 M), pH 8.0 | ThermoFisher Scientific | AM9260G | |
| Propidium Iodide - 1.0 mg/mL Solution in Water | ThermoFisher Scientific | P3566 | |
| DNeasy Blood & Tissue Kit (250) | Qiagen | 69581 | |
| 6-well Standard Line Multiwell Cell Culture Plates | VWR | 10062-892 | |
| Petri Dishes | Fisher | 12-565-90 | |
| Conical Tubes (15 mL) (racked) | Thermo Fisher | AM12500 | |
| Trypan Blue Solution, 0.4% | Thermo Fisher | 15250061 | |
| Reduced Serum Medium | Thermo Fisher | 31985062 |
Riferimenti
- Mandecki, W. Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis. Proc Natl Acad Sci. 83 (19), 7177-7181 (1986).
- Walder, R. Y., Walder, J. A. Oligodeoxynucleotide-directed mutagenesis using the yeast transformation system. Gene. 42 (2), 133-139 (1986).
- Moerschell, R. P., Tsunasawa, S., Sherman, F. Transformation of yeast with synthetic oligonucleotides. Proc Natl Acad Sci. 85 (2), 524-528 (1988).
- Yoon, K., Cole-Strauss, A., Kmiec, E. B. Targeted gene correction of episomal DNA in mammalian cells mediated by a chimeric RNADNA oligonucleotide. Genetics. 93, 2071-2076 (1996).
- Beetham, P. R., Kipp, P. B., Sawycky, X. L., Arntzen, C. J., May, G. D. A tool for functional plant genomics: chimeric RNA/DNA oligonucleotides cause in vivo gene-specific mutations. Proc Natl Acad Sci U S A. 96 (15), 8774-8778 (1999).
- Bertoni, C., Morris, G. E., Rando, T. A. Strand bias in oligonucleotide-mediated dystrophin gene editing. Hum Mol Gen. 14 (2), 221-233 (2004).
- Alexeev, V., Yoon, K. Stable and inheritable changes in genotype and phenotype of albino melanocytes induced by an RNA-DNA oligonucleotide. Nat Biotechnol. 16 (13), 1343-1346 (1998).
- Zorin, B., Hegemann, P., Sizova, I. Nuclear-gene targeting by using single-stranded DNA avoids illegitimate DNA integration in Chlamydomonas reinhardtii. Eukaryot Cell. 4 (7), 1264-1272 (2005).
- Brachman, E. E., Kmiec, E. B. DNA replication and transcription direct a DNA strand bias in the process of targeted gene repair in mammalian cells. J Cell Sci. 117 (Pt 17), 3867-3874 (2004).
- Pierce, E. A., et al. Oligonucleotide-directed single-base DNA alterations in mouse embryonic stem cells. Gene Ther. 10 (1), 24-33 (2003).
- Radecke, S., Radecke, F., Peter, I., Schwarz, K. Physical incorporation of a single-stranded oligodeoxynucleotide during targeted repair of a human chromosomal locus. J Gene Med. 8 (2), 217-228 (2006).
- Bertoni, C., Rustagi, A., Rando, T. A. Enhanced gene repair mediated by methyl-CpG-modified single-stranded oligonucleotides. Nucleic Acids Res. 37 (22), 7468-7482 (2009).
- Andrieu-Soler, C., et al. Stable transmission of targeted gene modification using single-stranded oligonucleotides with flanking LNAs. Nucleic Acids Res. 33 (12), 3733-3742 (2005).
- Olsen, P. A., Randol, M., Krauss, S. Implications of cell cycle progression on functional sequence correction by short single-stranded DNA oligonucleotides. Gene Ther. 12 (6), 546-551 (2005).
- Engstrom, J. U., Kmiec, E. B. DNA replication, cell cycle progression and the targeted gene repair reaction. Cell Cycle. 7 (10), 1402-1414 (2008).
- Aarts, M., te Riele, H. Parameters of oligonucleotide-mediated gene modification in mouse ES cells. J Cell Mol Med. 14 (6b), 1657-1667 (2010).
- Brachman, E. E., Kmiec, E. B. Gene repair in mammalian cells is stimulated by the elongation of S phase and transient stalling of replication forks. DNA Repair. 4 (4), 445-457 (2005).
- Engstrom, J. U., Suzuki, T., Kmiec, E. B. Regulation of targeted gene repair by intrinsic cellular processes. BioEssays. 31 (2), 159-168 (2009).
- Parekh-Olmedo, H., Ferrara, L., Brachman, E., Kmiec, E. B. Gene therapy progress and prospects: targeted gene repair. Gene Ther. 12 (8), 639-646 (2005).
- Olsen, P. A., Randol, M., Luna, L., Brown, T., Krauss, S. Genomic sequence correction by single-stranded DNA oligonucleotides: role of DNA synthesis and chemical modifications of the oligonucleotide ends. J Gene Med. 7 (12), 1534-1544 (2005).
- Wang, Z., Zhou, Z. -. J., Liu, D. -. P., Huang, J. -. D. Double-stranded break can be repaired by single-stranded oligonucleotides via the ATM/ATR pathway in mammalian cells. Oligonucleotides. 18 (1), 21-32 (2008).
- Ferrara, L., Kmiec, E. B. Camptothecin enhances the frequency of oligonucleotide-directed gene repair in mammalian cells by inducing DNA damage and activating homologous recombination. Nucleic Acids Res. 32 (17), 5239-5248 (2004).
- Ferrara, L., Parekh-Olmedo, H., Kmiec, E. B. Enhanced oligonucleotide-directed gene targeting in mammalian cells following treatment with DNA damaging agents. Exp Cell Res. 300 (1), 170-179 (2004).
- Lin, S., Staahl, B., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. eLife. 3, 04766 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnol. 31 (9), 827-832 (2013).
- Rivera-Torres, N., et al. The position of DNA cleavage by TALENs and cell synchronization influences the frequency of gene editing directed by single-stranded oligonucleotides. PLoS One. 9 (5), (2014).
- Strouse, B., Bialk, P., Niamat, R. a., Rivera-Torres, N., Kmiec, E. B. Combinatorial gene editing in mammalian cells using ssODNs and TALENs. Sci Rep. 4 (ii), 3791 (2014).
- Bialk, P., Rivera-Torres, N., Strouse, B., Kmiec, E. B. Regulation of Gene Editing Activity Directed by Single-Stranded Oligonucleotides and CRISPR/Cas9 Systems. PloS One. 10 (6), e0129308 (2015).
- Yu, C., et al. Small Molecules Enhance CRISPR Genome Editing in Pluripotent Stem Cells. Cell Stem Cell. 16 (2), 142-147 (2015).
- Rivera-Torres, N., Banas, K., Bialk, P., Bloh, K. M., Kmiec, E. B. Insertional Mutagenesis by CRISPR/Cas9 Ribonucleoprotein Gene Editing in Cells Targeted for Point Mutation Repair Directed by Short Single-Stranded DNA Oligonucleotides. PLoS One. 12 (1), e0169350 (2017).
- Mali, P., et al. CAS9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering. Nat Biotechnol. 31 (9), 833-838 (2013).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nature Biotechnol. 34 (3), 339-344 (2016).
- Slaymaker, I. M., Gao, L., Zetsche, B., Scott, D. A., Yan, W. X., Zhang, F. Rationally engineered Cas9 nucleases with improved specificity. Science. 351 (6268), 84-88 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon