Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrofluidische trocken-Spinnen und Charakterisierung von regenerierten Seide Fibroin Fasern
In diesem Artikel
Zusammenfassung
Ein Protokoll für die mikrofluidischen Spinning und Charakterisierung der Mikrostruktur regenerierten Seide Fibroin Monofilament wird vorgestellt.
Zusammenfassung
Das Protokoll zeigt eine Methode für die Nachahmung des Spinnprozess der Seidenraupe. In der nativen Spinnverfahren ermöglicht der Auftraggeber Spinnen-Kanal Seidenproteine kompakt und bestellten durch Scheren und Dehnung Kräfte sein. Hier wurde ein biomimetische mikrofluidischen Kanal entwickelt, um die spezifische Geometrie der Spinnerei Rohrleitung der Seidenraupe zu imitieren. Regenerierte Seide Fibroin (RSF) Spinnen dotiert mit hoher Konzentration wurde durch die Microchannel, trocken-Spin Fasern bei Umgebungstemperatur und Druck extrudiert. Dabei nachbehandelt wurden als gesponnen Fasern gezogen und in Ethanol wässriger Lösung gespeichert. Synchrotronstrahlung Weitwinkel Röntgenbeugung (SR-WAXD) Technologie wurde verwendet, um die Mikrostruktur des RSF Einzelfasern, zu untersuchen, die einen Probenhalter mit die RSF-Faser-Achse senkrecht zur Microbeam der Röntgenröhre befestigt waren. Die Kristallinität, Kristallit Größe und kristallinen Ausrichtung der Faser wurden aus den WAXD Daten berechnet. Die Beugung Bögen nahe dem Äquator des Musters zweidimensionale WAXD zeigen, dass die nachbehandelt RSF-Faser eine hohe Orientierung verfügt.
Einleitung
Spinne und Seidenraupen produzieren hervorragende Seidenfaser aus wässrigen Proteinlösung bei Umgebungstemperatur und Druck. Scheren und extensionalen Strömung kann die Bildung von Flüssigkristall-Textur in der Spinndrüse1auslösen. In den letzten Jahren gab es ein großes Interesse an imitiert den Spinnprozess der Spinne um künstliche Fasern hoher Festigkeit zu produzieren. Jedoch können nicht große Mengen von Spinne Seide Protein effizient und wirtschaftlich produziert werden durch den Anbau von Spinnen durch Kannibalismus. Erhebliche Mengen der Seidenraupe Seide können leicht durch Landwirtschaft gewonnen werden. Ansonsten haben die Seidenraupe und Spinne eine ähnliche Spinnerei Prozess- und Aminosäure-Zusammensetzung. Daher wird Seidenraupe Seide Fibroin als Ersatz gewählt, tierische Kunstseide spin von vielen Forschern.
Spinne und Seidenraupe Extrudieren Proteinlösung durch ihre Spinnen Luftschacht in Faser in Luft. Hoher Belastung Kräfte entlang der Spinnerei-Kanal am ehesten erstrecken sich die Seide Fibroin Moleküle zu einem ausgedehnteren Konformation2. Kunstseide, die Fasern gesponnen worden, mit herkömmlichen nass Spinnerei und trocken-Spinnerei Prozesse3,4, die nicht berücksichtigen Konto Fluid Kräfte in der Spinnerei-Kanal.
Zunächst dienten mikrofluidischen Ansätze zu untersuchen, die Montage von Seidenprotein5,6. Dann wurde mikrofluidischen Herstellung von RSF untersucht, über die Modellierung der Scheren und extensionalen Kräfte7,8. Youngs Modulus und Durchmesser von RSF Fasern von mikrofluidischen nass Spinnerei abgestimmt werden können, aber die Zugfestigkeit des gezogenen Faser war weniger als 100 MPa-7. Zu guter Letzt hochfesten RSF Fasern wurden erfolgreich vorbereitet mit der mikrofluidischen trocken-Spinnen-Methode, aber der Durchmesser der Faser beträgt nur 2 µm8. Mikrofluidischen nass Spinnerei wurde vor kurzem erfolgreich bei der Herstellung von hochfesten rekombinante Spinne Seide verwendet. Die Post-Spinnerei Zeichnung in Luft verbessert die Oberfläche und interne Defekte Kunstfaser9.
In dieser Studie wird die verbesserte mikrofluidischen Spinnen Prozess für RSF Faser eingeführt. Es zielt darauf ab, den Spinnprozess Seidenraupe Seide, einschließlich die Spinnerei Schmiere, Scheren, Kräfte und trocken-Spinnverfahren zu imitieren. Diese Spinnen-Methode nicht nur hohe Festigkeit künstliche Seide produzieren kann, sondern auch den Durchmesser der Faser anpassen kann. Erstens war die RSF Spinnen Schmiere geschert und länglich in einem Biomimic Kanal mit einer zweiten Bestellung exponentiellen Zerfall. Zweitens wurden die Einflüsse der relativen Luftfeuchtigkeit (RH) auf die Faser Morphologie und Eigenschaften in mikrofluidischen trocken-Spinnerei Prozess10untersucht. Im Vergleich zu herkömmlichen Spinnerei Spinndüse, unser mikrofluidischen System ist höchst biomimetische und kann zur Herstellung von hochfesten Faser von Lösungen bei Umgebungstemperatur von trockenen oder nass Spinnerei Methode verwendet werden.
Durch den hochauflösenden Hochhelligkeit und energiereiche von Synchrotronstrahlung Mikrofokus Röntgen kann es verwendet werden, zur Charakterisierung der Mikrostruktur einer einzelnen Faser mit einem Durchmesser von mehreren Mikrometern4,11 , 12 , 13 , 14. hier, SR-WAXD Technik wurde verwendet, um die Kristallinität, Kristallit Größe und kristallinen Orientierung der RSF Fasern zu berechnen.
Protokoll
Vorsicht: konsultieren Sie bitte alle relevanten Sicherheitsdatenblätter vor Gebrauch. Einige der bei der Vorbereitung des Formteils verwendeten Chemikalien sind akut toxisch. Bitte verwenden Sie persönlichen Schutzausrüstung (Schutzbrille, Handschuhe, Kittel, voller Länge Hosen und geschlossene Schuhe).
1. mikrofluidischen Spinning von RSF wässriger Lösung
- Vorbereitung der RSF wässrigen Spinnen Schmiere 4 , 15 , 16
- Degumming der Seidenraupe Kokon
- Degum Bombyx Mori zweimal in Na 2 CO 3 wässrigen Lösungen (0,5 Gew.-% in Wasser Kokons) bei 100 ° C für 30 min und dann waschen Sie die Seide mit entionisiertem Wasser zu entfernen, die Sericin.
- Auflösend degummed Seidenraupe Cocoon
- degummed Kokon Seide in Luft trocknen; dann auflösen der degummed Kokon Seide in 9,0 M LiBr wässriger Lösung mit einem Verhältnis von 01:10 (w/V) bei 40 ° C für 2 h. Beispielsweise fügen Sie 10 mL LiBr pro 1 Gramm Seide ( Abbildung 1a).
- Centrifuging und Filterung
- die RSF-Lösung das 1,5-fache von entionisiertem Wasser verdünnen. Zentrifuge und Filter, um Verunreinigungen zu entfernen. Zentrifuge die RSF-Lösung in 250 mL Flaschen bei 4 ° C für 10 min bei 1,234.8 x g. filtern die RSF-Lösung mit einer 20 µm-Filter und einer Vakuumpumpe. Doppelte Filterpapier Bett empfiehlt sich angesichts des Experimente Effekts.
- Dialyzing
- Dialyse die RSF-Lösung in entionisiertem Wasser bei 5 ° C für 3 Tage mit einer halbdurchlässigen Membran Zellulose (MWCO: 14.000 ± 2.000). Das Gesamtvolumen der RSF Lösung beträgt etwa 1 L, in 4 Dialysebeutel geladen. Legen Sie diese Dialysebeutel in den Eimer, die gefüllt ist mit 10 L Umkehrosmose (RO) deionisiertes Wasser.
Hinweis: Der pH-Wert des deionisiertes Wasser sollte höher als 6 Gelierung während der Konzentrationsprozess zu vermeiden. Der pH-Wert des deionisiertes Wasser erforderte keine Anpassung für dieses Protokoll.
- Dialyse die RSF-Lösung in entionisiertem Wasser bei 5 ° C für 3 Tage mit einer halbdurchlässigen Membran Zellulose (MWCO: 14.000 ± 2.000). Das Gesamtvolumen der RSF Lösung beträgt etwa 1 L, in 4 Dialysebeutel geladen. Legen Sie diese Dialysebeutel in den Eimer, die gefüllt ist mit 10 L Umkehrosmose (RO) deionisiertes Wasser.
- Konzentration
- kondensieren die RSF wässrige Lösung bis 20 Gew.-% durch erzwungene Luftzirkulation bei 5 ° C. hinzufügen 3 M CaCl 2 wässrigen Lösung in die RSF-Lösung bis 1,0 Mmol/g Ca 2 + Endkonzentration; dann konzentrieren durch Umluft Fluss, 38-47 WT%.
- Wiegen RSF Lösung einen Tropfen auf einen Objektträger und trocknen Sie es dann für 2 h im Ofen bei 105 ° c
Hinweis: Die Gewichtsprozent der verbleibenden festen im Vergleich zu dem Gewicht des Tropfens vor Trocknung die Gesamtkonzentration an Protein und CaCl 2 ist. Die RSF-Konzentration wird nach Abzug der Masse des CaCl 2 abgeleitet. Mindestens vier wiederholte Messungen durchgeführt wurden. Unsere früheren Studien zeigten, dass die Konzentration von Ca 2 + stark die rheologischen Eigenschaften und die Spinnbarkeit der RSF wässrigen Lösungen betroffen. Unterdessen aufgefordert die Zugabe von Ca 2 + die begrenzte Bildung von β-Blatt und die Aggregation von RSF 17. In einer einheimischen Spinnen Schmiere gilt CaCl 2 eine wichtige Rolle bei der Lagerung von Schmiere zur Vermeidung von Gelierung vor dem Spinnen spinnen. 18
- Degumming der Seidenraupe Kokon
- Vorbereitung der Mikrofluidik-Chip 8 , 19
- Vorbereitung Fotomaske
- Design den Mikro-Kanal in einem CAD-Programm. Drucken Sie die CAD-Datei um eine hochauflösende Transparenz 19 produzieren.
- Vorbereitung der Formwerkzeugs
- Reinigung der Glas-Folie
- In einer chemischen Kapuze, kochen die Objektträger in der gemischten Lösung von konzentrierter Schwefelsäure und 30 Vol % Wasserstoffperoxid-Lösung (10:1) für 20 min auf einer heißen Platte.
Achtung: Schwefelsäure und Wasserstoffperoxid Dämpfe sind extrem giftig.
- In einer chemischen Kapuze, kochen die Objektträger in der gemischten Lösung von konzentrierter Schwefelsäure und 30 Vol % Wasserstoffperoxid-Lösung (10:1) für 20 min auf einer heißen Platte.
- Waschen die Objektträger
- der Objektträger mit entionisiertem Wasser waschen und Fönen mit hochreinen Stickstoff.
- Schichtsfilm
- SU-8 Photoresist auf Glasobjektträger durch einen speziell angefertigten Streichvorrichtung mit einem Abstand von 100 µm zwischen der unteren Oberfläche der Beschichtung Bar und der oberen Oberfläche des Glases beschichten.
- Spin-Beschichtung
- verbreiten den Fotolack auf den Objektträger zu bilden einen einheitlichen Film mit einem Spin Coater auf 40,3 x g für 30 s. Die Dicke des einheitlichen Films beträgt etwa 85 µm.
- Erstarrung
- Photolack in einem Ofen mit einer Temperatur Steuerung Programm zu festigen. Erhöhen Sie die Temperatur von Raumtemperatur bis 65 ° C bei 2 ° C/min und halten bei 65 ° C für 2 min. weiter Hitze von 65 ° C bis 95° C und halten bei 95 ° C für 15 min. Drehen aus dem Ofen nehmen und abkühlen, natürlich um Zimmer Temperatur im Ofen.
- UV Licht Exposition
- setzen die Seite des Glases mit den Fotolack mit UV-Licht für 12 schieben s mit der Transparenz als einer Fotomaske durch Photolithographie 19.
Hinweis: Die Wellenzahl von UV-Licht ist 365 nm und die Exposition Energie ist 273.6 mJ/cm 2.
: Vorsicht richtige Sicherheitsmaßnahme beim Arbeiten mit UV-Licht und Ofen.
- setzen die Seite des Glases mit den Fotolack mit UV-Licht für 12 schieben s mit der Transparenz als einer Fotomaske durch Photolithographie 19.
- Den Fotolack zu festigen, wie unter Schritt 1.2.2.5.
- Entwicklung
- reinigen den Fotolack Ultraschall in Entwicklerlösung für 30 S. Waschen der Objektträger mit Isopropanol und Entwickler, abwechselnd zwischen den beiden, bis es kein Niederschlag auf den Objektträger ist.
- Den Fotolack in einem Ofen mit einer Temperatur Steuerung Programm zu festigen. Erhöhen Sie die Temperatur von Raumtemperatur bis 170 ° C bei 2 ° C/min und bei 170 ° C für 30 min. Drehen aus dem Ofen nehmen und abkühlen halten Sie natürlich auf Raumtemperatur in den Ofen.
- Reinigung der Glas-Folie
- Weichen Lithographie
- Schimmel und Heilung für 30 min bei 65 ° C 8,8 g flüssigen Polydimethylsiloxan (PDMS) Pre-Polymer übergießen und 15 min bei 80 ° c flüssig PDMS Pre-Polymer besteht aus PDMS und Härtemittel (in der Regel bei 10:1 (w/w)).
- Lochen
- Punch ein Loch durch das PDMS-Replikat am Anfang des Kanals durch Bohren. Der Durchmesser des Bohrers beträgt 1,2 mm.
- Abdichtung
- versiegeln die PDMS-Replik mit dem Kanal zu einem flachen PDMS-Layer ohne Muster durch eine Plasmabehandlung Sauerstoff auf den Oberflächen der beiden Schichten PDMS.
Hinweis: Der Gesamtprozess der Erstellung des Chips dauert etwa 72 h.
- versiegeln die PDMS-Replik mit dem Kanal zu einem flachen PDMS-Layer ohne Muster durch eine Plasmabehandlung Sauerstoff auf den Oberflächen der beiden Schichten PDMS.
- Vorbereitung Fotomaske
- Herstellung von RSF Faser
- Injektion von Spinnen Schmiere
- injizieren der RSF Spinnen Schmiere in der Mikrokanal mit 2 µL/min durch eine Spritzenpumpe.
- Umwelt-Verordnung
- passen Sie die Relative Luftfeuchtigkeit 40 ± 5 % RH oder 50 ± 5 RH % Einsatz eines Befeuchters. Bei 40 ± 5 RH %, als-gesponnene Faser verfestigt schneller als 50 ± 5 % RH.
- Produktion von RSF Faser
- berühren die RSF-Drop von einer Nadelspitze am Ausgang des Kanals mikrofluidischen, RSF-Faser in Luft zu zeichnen und dann Rollen Sie es auf eine Walze durch eine 10 cm Luftspalt mit einer Geschwindigkeit von 3 cm/s ( Abbildung 1 b ).
- Speichern die RSF-Fasern in einem versiegelten Exsikkator für 24 h.
- Faser Nachbehandlung
- zeichnen die als gesponnen Fasern 4 Mal bei 0,9 mm s -1 in 80 Vol % ethanol-Lösung durch eine maßgeschneiderte Maschine, und halten Sie die gezeichneten Faser fixiert und tauchen die Fasern in die Lösung für 1 h. Wegen dieser Behandlung die Länge der Faser änderte sich von ursprünglich 15 mm bis 60 mm.
- Vorbereitung der Probe zur Charakterisierung
- Post-behandelten Fasern mit einer Länge von 10mm Spurweite auf einem Papier Rahmen zu beheben. Mindestens 20 Fasern sind notwendig für die Messung, namentlich im Zugversuch, SEM, FTIR und WAXS. Die Durchmesser der Post-gezogenen Fasern reichen von 5 bis 10 µm. Abbildung 1 zeigt die schematische Darstellung der Faserproduktion und WAXD Charakterisierung. Die mechanischen Eigenschaften der RSF Fasern wurden von einem materiellen Testsystem bei (25 ± 2) ° C und (45 ± 5) % relativer Luftfeuchte untersucht. Die Erweiterung bewerten und Länge zu messen, wurden jeweils 2 mm/min und 1 cm.
- Injektion von Spinnen Schmiere
2. Synchrotronstrahlung Charakterisierung der kristallinen Struktur des RSF Fiber
- Synchrotronstrahlung Charakterisierung 4 , 13 , 17
- Anpassungder
- Strahlrohr anpassen bzw. die Wellenlänge der Röntgenstrahlen und Punktgröße zu 0,07746 nm und 3 x 2 µm 2.
Hinweis: Das Protokoll erfolgt über das BL15U1-Strahlrohr in der Shanghai Synchrotron Radiation Facility.
- Strahlrohr anpassen bzw. die Wellenlänge der Röntgenstrahlen und Punktgröße zu 0,07746 nm und 3 x 2 µm 2.
- Lage des Röntgen-Spot
- Suchen Sie den Speicherort des x-ray Spots.
Hinweis: Die Position des Röntgen-Spots wird eingestellt, indem die Labortechniker in der Synchrotron Radiation Facility.
- Suchen Sie den Speicherort des x-ray Spots.
- Prüfung der Standardprobe: Ceriumdioxid (CeO 2)
- Standardprobe CeO 2 Pulver zu testen. Der CeO 2 Pulver zeichnete sich um die Mitte des Kreises und die Entfernung von der Probe zum Detektor zu berechnen.
- Probenaufbereitung
- fixieren die RSF-Filamente parallel zu einander auf dem Papier-Rahmen mit einer Länge von 10 mm Spurweite. Die Testphase der Papier-Rahmen aufkleben.
Hinweis: Halten Sie die Faser horizontal.
- fixieren die RSF-Filamente parallel zu einander auf dem Papier-Rahmen mit einer Länge von 10 mm Spurweite. Die Testphase der Papier-Rahmen aufkleben.
- SR-WAXD Tests
- Öffnen Sie den Verschluss
- Schließen Sie die Tür der Station Strahlrohr, nachdem Sie sichergestellt haben, dass es keine Personen im Raum. Öffnen Sie den Auslöser von x-ray Strahlquelle.
- Focusing
- bewegen die Faser leicht bis im Fokus. Ändern Sie die Position der Faser entlang der X, y, Z-Richtung aus der Ferne über eine Software ( Abbildung 1 c).
- Probe Exposition
- die Faser hoch und runter bewegen aus der Ferne über eine Software, bis es auf x-ray vor Ort. Drücken Sie die Schaltfläche "Start" auf die Software, die Fiber-to-x-ray Strahlrohr für 20 verfügbar zu machen ( Abbildung 1 c) s.
- Hintergrund Beugung
- die Beugung des Luft-Hintergrund mit der Belichtungszeit von 20 S. bewegen die Faser von der Röntgen-Markierung aus der Ferne über eine Software zu testen. Drücken Sie die " Start "-Taste auf die Software, um das x-ray Strahlrohr zu entlarven " Luft Medium " für 20 s.
- Öffnen Sie den Verschluss
- Anpassungder
- SR-WAXD Datenverarbeitung 13
- Software Kalibrierung
- WAXD Daten mit FIT2D (V12.077). Kalibrieren Sie die Mitte des Kreises und der Abstand der Probe zum Detektor anhand der Beugung Daten des CeO 2 Pulvers.
- 2-D Beugungsmuster
- subtrahieren Luft Hintergrund aus der Faser Beugungsmuster mit FIT2D (V12.077).
- Kristallinität und Kristallit Größe
- die Beugung Intensität als Funktion der Streuung Winkel 2θ zu integrieren. Durchführen Sie Entfaltung der Intensität Integration durch automatisierte Peak Trennung Software (Version 4.12) 12. Der Grad der Kristallinität, x c, wurde aus der Beziehung geschätzt:
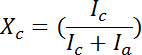
, wo ich c ist die Summe der integrierten Intensitäten der kristallinen Gipfel und ich eine ist die integrierte Intensität der amorphe Halo 4 , 11. Die Integration der WAXD Muster zeigte die breite Spitze [200], [020], [002] Reflexionen. Die FWHM dieser Gipfel wurden verwendet, um die Kristallit-Größe entlang zu bestimmen die a, b und C-Achsen mit Scherrer ' s Formel 4.
- die Beugung Intensität als Funktion der Streuung Winkel 2θ zu integrieren. Durchführen Sie Entfaltung der Intensität Integration durch automatisierte Peak Trennung Software (Version 4.12) 12. Der Grad der Kristallinität, x c, wurde aus der Beziehung geschätzt:
- Bestimmung der Kristallit Orientierungen
- berechnen die Ausrichtungen der Kristallit und amorphe nach azimutaler Integrationen (020) und (210) Gipfeln 11. Die kristalline Ausrichtung kann quantitativ berechnet werden, nach Herman ' s Ausrichtung. Hier, beide (020) und (210) Gipfel wurden mit zwei Gaußschen Funktionen ausgestattet. Der schmalere ist für kristalline Orientierung und breitere derjenige ist für orientierte amorphen Material 13. Hier wurden der Kristallit-Ausrichtung der RSF Fasern verglichen, über die volle Breite am halben Maximum (FWHM) von azimutalen Integrationen (002) Gipfeln.
- Software Kalibrierung
Ergebnisse
Hohe Festigkeit RSF Fasern wurden erfolgreich mithilfe der mikrofluidischen spinning Methode hergestellt. Die Spannungs-Dehnungs-Kurven und SEM Bilder der gestreckten RSF Fasern C44R40 sind in Abbildung 2dargestellt. Mindestens 10 Fasern wurden im Zugversuch gemessen. Spannungs-Dehnungs-Kurven wurden entsprechend dem durchschnittlichen Wert der Bruch Belastung und Beanspruchung der Fasern gewählt. Die WAXD Daten der Fasern sind in Abbild...
Diskussion
Während der Dialyse der RSF-Lösung ist der pH-Wert für die folgenden Konzentrationsprozess von entscheidender Bedeutung. Wenn der pH-Wert des deionisiertes Wasser kleiner als 6 ist, wird die RSF-Lösung einfacher während der Konzentrationsprozess Gel. Zur Vermeidung von Gelierung ist CaCl2 RSF-Projektmappe hinzugefügt. Es ist die Konzentration von CaCl2 1 Mmol pro Gewicht der RSF.
Unsere bisherige Arbeit demonstriert die Möglichkeit der mikrofluidischen trocken-Spin...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wird gesponsort von der National Natural Science Foundation of China (21674018), National Key Research und Development Program of China (2016YFA0201702 /2016YFA0201700) und unterstützt durch Shanghai Bildungsentwicklung "Shuguang-Programm" Stiftung und Shanghai Municipal Education Commission (15SG30), unterschieden DHU junge Professor Programm (A201302), die Grundlagenforschung Mittel für den Central-Universitäten und 111-Projekt (No.111-2-04).
Materialien
| Name | Company | Catalog Number | Comments |
| B. mori Cocoons | Farmer in Tongxiang, Zhejiang Province, China | ||
| Sodium carbonate, anhydrous, 99.8% | Shanghai Lingfeng Chemical Reagent Co., Ltd., China | Analytically Pure | |
| Lithium bromide, 99.1% | Shanghai China Lithium Industrial Co., Ltd., China | Analytically Pure | |
| Calcium chloride, anhydrous, 96.0% | Shanghai Lingfeng Chemical Reagent Co., Ltd., China | Analytically Pure | |
| Ethanol, anhydrous, 99.7% | Sinopharm Group Chemical Reagent Co.,Ltd., China | 10009218 | Analytically Pure |
| SU-8 photoresist | MicroChem Corp., USA | ||
| Developing solution | MicroChem Corp., USA | ||
| Sylgard 184 | Dow Corning, USA | ||
| Isopropanol | Shanghai Lingfeng Chemical Reagent Co., Ltd., China | Analytically Pure | |
| Concentrated sulfuric acid | Pinghu Chemical Reagent Factory, China | Analytically Pure | |
| 30 vol% hydrogen peroxide | Shanghai Jinlu Chemical reagent Co., Ltd., China | Analytically Pure | |
| Acetone | Shanghai Zhengxing Chemical Reagent Factory, China | Analytically Pure | |
| Oxygen plasma treatment | DT-01, Suzhou Omega Machinery Electronic Technology Co., Ltd., China | ||
| Syringe pump | KD Scientific, USA | KDS 200P | |
| Humidifier | SEN electric | ||
| Driller | Hangzhou Bo Yang Machinery Co., Ltd., China | bench drilling machine Z406c | |
| Material testing system | Instron, USA | Model: 5565 | |
| PeakFit | Systat Software, Inc., USA | Version 4.12 |
Referenzen
- Asakura, T., et al. Some observations on the structure and function of the spinning apparatus in the silkworm Bombyx mori. Biomacromolecules. 8 (1), 175-181 (2007).
- Vollrath, F., Knight, D. P. Liquid crystalline spinning of spider silk. Nature. 410 (6828), 541-548 (2001).
- Zhou, G. Q., Shao, Z. Z., Knight, D. P., Yan, J. P., Chen, X. Silk Fibers Extruded Artificially from Aqueous Solutions of Regenerated Bombyx mori Silk Fibroin are Tougher than their Natural Counterparts. Adv Mater. 21 (3), 366-370 (2009).
- Sun, M. J., Zhang, Y. P., Zhao, Y. M., Shao, H. L., Hu, X. C. The structure-property relationships of artificial silk fabricated by dry-spinning process. J Mater Chem. 22 (35), 18372-18379 (2012).
- Martel, A., et al. Silk Fiber Assembly Studied by Synchrotron Radiation SAXS/WAXS and Raman Spectroscopy. J Am Chem Soc. 130 (50), 17070-17074 (2008).
- Rammensee, S., Slotta, U., Scheibel, T., Bausch, A. R. Assembly mechanism of recombinant spider silk proteins. P Natl Acad Sci USA. 105 (18), 6590-6595 (2008).
- Kinahan, M. E., et al. Tunable silk: using microfluidics to fabricate silk fibers with controllable properties. Biomacromolecules. 12 (5), 1504-1511 (2011).
- Luo, J., et al. Tough silk fibers prepared in air using a biomimetic microfluidic chip. Int J Biol Macromol. 66, 319-324 (2014).
- Peng, Q. F., et al. Recombinant spider silk from aqueous solutions via a bio-inspired microfluidic chip. Sci Rep. 6, (2016).
- Peng, Q. F., Shao, H. L., Hu, X. C., Zhang, Y. P. Role of humidity on the structures and properties of regenerated silk fibers. Prog Nat Sci-Matter. 25 (5), 430-436 (2015).
- Sampath, S., et al. X-ray diffraction study of nanocrystalline and amorphous structure within major and minor ampullate dragline spider silks. Soft Matter. 8 (25), 6713-6722 (2012).
- Martel, A., Burghammer, M., Davies, R. J., Riekel, C. Thermal Behavior of Bombyx mori silk: Evolution of crystalline parameters, molecular structure, and mechanical properties. Biomacromolecules. 8 (11), 3548-3556 (2007).
- Pan, H., et al. Nanoconfined crystallites toughen artificial silk. J Matter Chem B. 2 (10), 1408-1414 (2014).
- Zhang, C., et al. Microstructural evolution of regenerated silk fibroin/graphene oxide hybrid fibers under tensile deformation. Rsc Adv. 7 (6), 3108-3116 (2017).
- Wei, W., et al. Bio-inspired capillary dry spinning of regenerated silk fibroin aqueous solution. Mat Sci Eng C-Mater. 31 (7), 1602-1608 (2011).
- Jin, Y., Zhang, Y. P., Hang, Y. C., Shao, H. L., Hu, X. C. A simple process for dry spinning of regenerated silk fibroin aqueous solution. J Mater Res. 28 (20), 2897-2902 (2013).
- Jin, Y., Hang, Y. C., Zhang, Y. P., Shao, H. L., Hu, X. C. Role of Ca2+ on structures and properties of regenerated silk fibroin aqueous solutions and fibres. Mater Res Innov. 18, 113-116 (2014).
- Koh, L. D., et al. Structures, mechanical properties and applications of silk fibroin materials. Prog Polym Sci. 46, 86-110 (2015).
- McDonald, J. C., Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Accounts Chem Res. 35 (7), 491-499 (2002).
- Knight, D. P., Vollrath, F. Liquid crystals and flow elongation in a spider's silk production line. P Roy Soc B-Biol Sci. 266 (1418), 519-523 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten