Method Article
Mikrofluidische Chips für In Situ Crystal-Röntgenbeugung und In Situ dynamische Lichtstreuung für serielle Kristallographie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt im Detail wie fabrizieren und mikrofluidischen Geräte zur Röntgenbeugung Datenerfassung bei Raumtemperatur betrieben. Darüber hinaus beschreibt die Kristallisation von Proteinen durch dynamische Lichtstreuung zu überwachen und Informationen zum Verarbeiten und analysieren erhalten Beugung Daten.
Zusammenfassung
Dieses Protokoll beschreibt Herstellung mikrofluidischen Geräte mit niedrigen röntgenhintergrund optimiert für Goniometer feste Vorgabe serielle Kristallographie basiert. Die Geräte sind aus Epoxy-Kleber mit weichen Lithographie gemustert und eignen sich für in Situ Röntgenbeugung Experimente bei Raumtemperatur. Die Probe-Brunnen sind auf beiden Seiten mit Polymeren Polyimid-Folie Windows Lidern, die Beugung Datenerfassung mit niedrigen röntgenhintergrund ermöglichen. Dieses Herstellungsverfahren ist anspruchslos und preiswert. Nach der Beschaffung eines SU-8 master Wafers kann alle außerhalb ein Reinraum in einer typischen Research Lab-Umgebung abgeschlossen werden. Das Chip-Design und Fertigung-Protokoll nutzen Kapillare Ventiltechnik, Microfluidically eine wässrige Reaktion in definierten Nanoliter große Tröpfchen aufgeteilt. Diese Lademechanismus vermeidet Probenverlust aus Kanal tot-Volumen und kann leicht manuell ohne Verwendung von Pumpen oder andere Ausrüstung für flüssige Betätigung durchgeführt werden. Wir beschreiben, wie isolierte Nanoliter Größe Tropfen Proteinlösung überwachten in Situ durch dynamisches Licht Kontrolle Protein Crystal Kernbildung und Wachstum Streuung kann. Nach geeigneten Kristalle gezüchtet werden, können komplette x-ray Diffraction Datasets mit Goniometer basiert in Situ korrigiert Ziel serielle Röntgenkristallographie bei Raumtemperatur gesammelt werden. Das Protokoll enthält benutzerdefinierte Skripts um Beugung Datasets mit einer Suite von Software-Tools zu lösen und verfeinern die Proteinstruktur Kristall zu verarbeiten. Dieser Ansatz vermeidet die Artefakte, die möglicherweise während der Kryokonservierung oder manuelle Handhabung in konventionellen Kristallographie Experimente Kristall induziert. Wir zeigen und vergleichen Sie drei Proteinstrukturen, die gelöst wurden mit kleinen Kristallen mit Abmessungen von ca. 10-20 µm in Chip gewachsen. Durch Kristallisation und interferenzgitters in Situ, Handling und somit mechanische Störungen des fragilen Kristalle wird minimiert. Das Protokoll beschreibt, wie Sie einen benutzerdefinierten Röntgen transparent mikrofluidischen Chip geeignet für in Situ serielle Kristallographie zu fabrizieren. Da fast jeder Kristall zur Beugung Datenerfassung eingesetzt werden kann, sind diese mikrofluidischen Chips eine sehr effiziente Kristall Übermittlungsmethode.
Einleitung
Zu wissen, die 3D-Struktur eines Proteins ist wichtig zu verstehen, seine Funktionalität. In der Nähe von atomarer Auflösung Strukturen ergeben sich bisher am häufigsten durch Röntgen-Kristallographie. Diese Technik setzt Proteinkristallen, Röntgenstrahlung und die daraus resultierende Beugungsmuster werden dann für die Strukturaufklärung und Verfeinerung analysiert. In herkömmlichen Röntgen-Kristallographie wird eine vollständige Beugung Dataset aus einem einzigen, im Idealfall großen Kristall bei kryogenen Temperaturen aufgezeichnet. Solche Kristalle sind jedoch meist nicht trivial zu wachsen, und geeignete Kryokonservierung Bedingungen identifizieren zu können werden selbst anspruchsvolle und kann manchmal auch dazu führen, dass Abweichungen von der native Protein-Struktur-5.
Jüngsten technologischen Fortschritte in der Röntgen-freie-Elektronen-Laser (FEL) und Synchrotron Beamlines konnten Strukturen aus kleinere Kristalle zu lösen, als neue Mikro-Fokussierung Beamlines, erhöhte Röntgen Strahlen Brillanz und verbesserte Röntgendetektoren wurde verfügbar6,7. Kleine Kristalle sind in der Regel einfacher zu wachsen als große und freie Kristalle8,9defekt. Allerdings leiden kleine Kristalle von x-ray Strahlenschäden viel schneller als große Kristalle. Dies liegt daran, im Vergleich zu einem großen Kristall, eine höhere Strahlendosis muss in ein kleineres Kristall-Volumen zu beugen, vergleichbare Auflösung projiziert werden. Deshalb sogar kryogenen Schutz oft nicht ausreichend, um eine vollständige Beugung Datensatz aus einem einzigen weiteren aufnehmen.
Um diese Hürde zu überwinden, ist die serielle Kristallographie geworden die Methode der Wahl zum Sammeln und Zusammenführen von Beugungsmuster aus vielen zufällig orientierte Mikrokristalle, ein komplettes Dataset zu erhalten. Strahlung induzierte Kristall Schaden minimiert wird durch die Verbreitung der gesamten Strahlendosis verwendet, um eine Protein-Struktur über eine hohe Anzahl von Kristallen5,10zu lösen. In einem "beugen zuvor zerstören" FEL experimentieren, jeder Kristall wird nur für eine Belichtung mit Femto-Sekunden-röntgenpulse verwendet. Mikro-Fokus Beamlines an Dritte Generation Synchrotron Quellen können wiederum serielle Kristallographie mit ein paar Millisekunden kurzen Röntgen Aufnahmen11,12,13,14durchführen. Ohne eine Kristall-Oszillation oder Drehung während der Datenerfassung, jedoch nur teilweise Bragg Reflexionen können aufgezeichnet werden und damit Zehntausende oder mehr Beugungsmuster sind in der Regel für die Bestimmung der Struktur15erforderlich. Bisher wurde für serielle Kristallographie, eine vielfältige Reihe von Beispielmethoden Lieferung als vor kurzem überprüft14,16,17,18,19. Unter denen Basis mehrere feste Ziel musterlieferung, die Strategien erfolgreich mit Kristall Drehung während der Röntgen-Aufnahmen kombiniert wurden, so dass deutlich weniger Beugungsmuster ebenso komplette Datensätze bereitstellen können, und auch verbrauchen weniger Probe im Vergleich zu klassischen seriellen Kristallographie aufgezeichnet Experimente wo Standbilder sind7,16,20,21,22,23 , 24.
Wir präsentieren Ihnen ein Protokoll zur mikrofluidischen Geräte mit niedrigen röntgenhintergrund fabrizieren. Die Geräte sind aus 5-min Epoxy-Kleber mit weichen Lithographie gemustert und eignen sich für in-Situ- Röntgenbeugung Experimente bei Raumtemperatur, die von der Integration der Probenvorbereitung direkt in die Röntgen-Einrichtung, wie des Fall mit profitieren Zeitaufgelöste Untersuchungen, die mischen-induzierte Kinetik18,19folgen. Mikrofluidische Kanäle sind auf beiden Seiten mit Polymeren Polyimid-Folie, was x-ray Windows mit einer kombinierten Dicke von etwa 16 µm, die niedrige Röntgenbildgebung Hintergrund ermöglichen Lidern. Alle verwendete Materialien bieten gute Lösemittelbeständigkeit. Dieses Herstellungsverfahren ist vergleichsweise einfach und kostengünstig. Nach der Beschaffung von SU-8 master Wafer kann alle Herstellung außerhalb ein Reinraum Labor inmitten der typischen Forschung abgeschlossen werden.
Ein Anwendungsbeispiel beschreibt Chips für Goniometer feste Vorgabe serielle Kristallographie basiert. Erstens sind die Konstruktion und Fertigung Überlegungen für die Verwendung von Kapillar Ventiltechnik, Microfluidically aufteilen eine wässrige Reaktion in eine ausgewählte Anzahl von Nanoliter große Tröpfchen diskutiert. Diese Lademechanismus vermeidet Probenverlust von Toten-Lautstärke des Kanals und Aufteilung kann leicht manuell durchgeführt werden ohne Verwendung von Pumpen oder andere Ausrüstung für flüssige Betätigung. Solche isolierten Nanoliter Größe Tropfen Proteinlösung sind überwachte in Situ mit dynamische Lichtstreuung (DLS) zur Kontrolle Protein Crystal Kernbildung und Wachstum. Es wurde bereits nachgewiesen, dass in mikrofluidischen Geräte bestehend aus einem Polydimethylsiloxan (PDMS) Struktur gebunden an ein Glas Folie25,26DLS Messungen durchgeführt werden können. Denn die polyimidschicht eine hohe Transmission für Wellenlängen mehr als 550 hat nm, der Ansatz kann auf verlängert werden Messungen in x-ray transparente Chips als auch bei der Verwendung einer geeigneten Laser Wellenlänge27,28. Basierend auf den Ergebnissen der DLS, anfängliche Keimbildung kann beobachtet werden, und weitere Tropfen verdampfen kann gestoppt werden, um weniger, aber größeren Proteinkristallen zu erhalten.
Nachdem genügend Kristalle gezüchtet werden, können komplette x-ray Diffraction Datasets dann mit Goniometer basiert in Situ korrigiert Ziel serielle Röntgenkristallographie bei Raumtemperatur gesammelt werden. Beugung Datasets werden mit einer Suite von Software-Tools und Skripte um zu lösen die Proteinstruktur Kristall verarbeitet. Diese Technik vermeidet Artefakte oft induzierte während der Kryokonservierung in konventionellen Kristallographie Experimente verwendet.
Wir vergleichen drei Protein Zielstrukturen, die gelöst wurden mit etwa 10-20 µm kleinen Kristalle im Chip besser als 2 Å Auflösung gewachsen. Durch Kristallisation und interferenzgitters in Situ, Handling und somit mechanische Störungen des fragilen Kristalle wird minimiert. Dieses Protokoll kann für Proteinkristallen die beugen auf hoher Auflösung als auch niedriger Auflösung (1.7 Å bis 3.0 Å) angewendet werden. Wie fast jeder Kristall für Beugung verwendet werden kann, wird wenig Probe verschwendet, so dass dies eine sehr effiziente Kristall Übermittlungsmethode.
Dieses Protokoll enthält eine detaillierte Anleitung zum Röntgen transparent mikrofluidischen Chips für in Situ Protein Kristallisation und Beugung Datenerfassung vorbereiten. Das Verfahren wurde sorgfältig von mikrofluidischen Präzision profitieren ohne hoch entwickelte Ausrüstung im Labor entwickelt. Auch kann Datenerhebung auf das Synchrotron-Strahlrohr durchgeführt werden ohne spezielle Goniometer oder Luftbefeuchter zu erleichtern, die Ergebnisse zu reproduzieren von nicht-Experten. Die vorgestellte Technik kann serielle Millisekunde Kristallographie Datenerhebung bei Raumtemperatur unter Beibehaltung der Strahlenschäden minimal und ohne Stress zu den Kristallen nach Wachstum Cryo-Schutz oder Kristall Behandlung beantragt werden. Daher eignet sich das beschriebene Verfahren für jedes Protein-Kristallisation-Projekt.
Protokoll
(1) chip-Design und Fertigung Master
- Maskendesign
- Gewünschten Kanal Geometrien mit einem geeigneten CAD-Zeichnung-Programm zu skizzieren. Bereiten Sie für jede Photolack-Schicht eine individuelle Maske. Alle Designs, die in diesem Protokoll verwendeten werden ausführlich im Abschnitt Ergebnisse diskutiert und stehen als AutoCad ". DWG-Datei "Format in die zusätzliche Datei 1.
Hinweis: Für alle-PDMS-Geräte zu bauen, das Kanal-Höhe-Breite-Seitenverhältnis sollte nicht überschreiten 01:10 um Kanal Zusammenbruch zu verhindern. Polyimid-Folie und ausgehärtete Epoxidharz sind stabiler und im Prinzip auch höhere Seitenverhältnisse ermöglichen. Jedoch wir absichtlich nicht überschreiten die 01:10-Verhältnis, so dass das erste Entwürfe Prototyp als traditionelle PDMS-Geräte sein könnte. - Übersetzen Sie CAD-Dateien in Emulsion Film Photomasks. Verwenden Sie 64 k DPI nominalauflösung erlauben genaue Funktionen bis auf ca. 5 µm Größe.
Hinweis: Dies kann durch eine kommerzielle Dienstleistung erfolgen. Imaging-Services bevorzugen unterschiedliche Zeichnung Konventionen, Datei-Konvertierung für die Maske Bildgebung zu rationalisieren. Bitte informieren Sie sich über die bevorzugte Zeichnung Konventionen im voraus, mühsame Fehlersuche während der Konvertierung zu vermeiden. Masken mit transparenten Eigenschaften auf schwarzem Hintergrund werden SU8 Photoresist Funktionen auf den Wafer funktionale PDMS Mikrokanäle während Replik Formteil Ausbeute Muster. Im Gegenzug sind schwarz Features auf transparenten Hintergrund Masken Bedarf, um PDMS Formen geeignet für Röntgen-Chip-Fertigung vorzubereiten. Wir empfehlen die Bestellung beide Polaritäten der Maske, um frühe Prototypen und Design Validierung PDMS Geräte herzustellen, bevor Sie das Design in Röntgen-Chips übersetzen zu ermöglichen.
- Gewünschten Kanal Geometrien mit einem geeigneten CAD-Zeichnung-Programm zu skizzieren. Bereiten Sie für jede Photolack-Schicht eine individuelle Maske. Alle Designs, die in diesem Protokoll verwendeten werden ausführlich im Abschnitt Ergebnisse diskutiert und stehen als AutoCad ". DWG-Datei "Format in die zusätzliche Datei 1.
- SU8 Meister Fertigung
Hinweis: Dies ist der einzige Prozess, der in einem Reinraum durchgeführt werden muss. Wenn kritische Reinraum Ausstattung nicht verfügbar ist, kann der vollständige Schritt in MEMS Foundry Service-Gesellschaften ausgelagert werden, die bereit gemusterten SU8 Meister liefern. Prozess-SU8 entsprechend die Daten Sheet Anweisung. 1.2.1-1.2.4 Schritte zusammenfassen den allgemeinen SU8 Meister Fertigung Workflow mit den kompletten Parametern für die Dreischicht-Röntgen-Chip-Design in Tabelle 1aufgeführten. Eine Einführung in die multi-Layer-SU8 Ausrichtung wurde veröffentlichten früher29.- Gießen Sie etwa 1 mL SU8 widerstehen auf dem 3-Zoll-Wafer und Spin Mantel SU8 bis die gewünschte Dicke mit entsprechenden Schleuderdrehzahl und Zeit gemäß Tabelle 1 (Abbildung 1, Schritt 1). Backen Sie für ein paar Minuten es den Fotolack nach der Schichtdicke bei 65 ° C und 95 ° C vor. Führen Sie die Pre-Backen um SU8, es festhalten an der Fotomaske zu verhindern und Verbesserung der Resist Haftung auf dem Untergrund (Abbildung 1, Schritt 2) zu festigen.
- Setzen Sie den Fotolack, UV-Licht gemäß Tabelle 1 gefolgt von einer post-exposure-backen bei 95 ° C katalytisch die Photoreaktion abschließen, die während der Belichtung (Abbildung 1, Schritt 3) initiiert wird.
- Wiederholen Sie diese Schritte für jede nachfolgende Schicht. Richten Sie dann die Photomasks die nachfolgende Schicht mit dem Meister mit einem Mask Aligner und Vernier Bremssattel Ausrichtung Marken29.
- Wäscht alle unbelichteten SU8 widerstehen durch die Entwicklung des Wafers in Propylenglykol Methyl Äther Acetat (PGMEA) bis Isopropanol spülen nicht mehr milchig Niederschlag (Abbildung 1, Schritt 4) zeigt. Trocknen des Wafers mit unter Druck stehenden Stickstoff.
Hinweis: Isopropanol ist ein schlechtes Lösungsmittel für SU8 und seinen Niederschlag zeigt verbleibende ausgehärtete Reste.
- PDMS-Schimmel-Fertigung
- Legen Sie ein Stück Aluminiumfolie (15 × 15 cm) in eine Petrischale (10 cm) und legen Sie die SU8 Meister auf der Aluminiumfolie in der Petrischale zur einfachen Entnahme des Meisters nach dem Aushärten PDMS.
- Mischen Sie Silikonbasis mit Heilung von Agent (10:1), was einem Gesamtbetrag von 25 g, kräftig mit einem Spatel in einem Glas oder einem mechanischen Mixer. Ein 3-Zoll-Wafer in einer Petrischale (10 cm) verbraucht ca. 25 g des PDMS eine 5 mm Dicke Platte zur Folge.
- Gießen Sie vorgemischten PDMS auf der SU8-Master (Abbildung 1, Schritt 5) bis zu einer Höhe von 4 mm. Desiccate PDMS für 5 min um Luftblasen zu entfernen, bis keine oder nur wenige Luftblasen auf die PDMS Oberfläche bleiben.
- Die PDMS in einem Ofen bei 70 ° C für 1 h zu heilen. Dann die ausgehärtete PDMS mit einem Skalpell ausgeschnitten und vorsichtig Schälen der PDMS-Form vom SU8 Master (Abbildung 1, Schritt 6). Schneiden Sie bis hin zum Master PDMS Risse bei Peeling zu verhindern.
- Optional: Bereiten Sie Cross-Sectional Scheiben der PDMS Formen zu bestätigen, dass alle SU8-Schichten auf dem Master die gewünschte Dicke (Abbildung 1). Frühe mikrofluidischen Kanal Layout testen kann in alle PDMS Chips erfolgen.
Hinweis: Eine Replik-geformten PDMS kann direkt auf einem Glassubstrat nach Access-Ports (Schritt 3.3) in der PDMS durch O2 plasmaaktivierung mit 20 Stanzen verklebt werden s, 0,4 Mbar O2, 50 W, 13,56 MHz. Wie bereits in Abschnitt 1.2., dies erfordert gegenüber Polarität zu verschleiern und somit wafer-Gliederung für Röntgen-Chip-Fertigung.
2. in Situ Röntgen-Chip-Fertigung
- Verdünnen Sie beide Epoxy-Harz-Vorstufen in Ethanol zu einem endgültigen ethanolkonzentration von 40 Gew.-%. Eine Gesamtmasse von 0,25 g jedes Epoxy-Harz-Vorstufe in Ethanol ist ausreichend für ein 1 cm-2 -Chip.
Hinweis: Dies verringert die Viskosität des daraus resultierenden 5 min-Epoxy, blasenfreies mischen und Replikat-Mold Casting zu vereinfachen und die Dicke der finalen ausgehärteten Epoxy-Schicht zu minimieren. Das Äthanol verdunstet durch die PDMS während der Aushärtung Schritt. - Entgasen der PDMS-Form in einem Vakuum Exsikkator für 30 min, so dass es kleine Luftblasen aus dem Epoxidharz im Guß Schritt aufnehmen kann.
- Schneiden Sie die Polyimid-Folie ca. 70 × 70 mm und Spanne sie herum ein 75 × 50 mm Glas Folie mit Klebeband, um eine flache und starre Oberfläche mit dem Klebeband auf der Rückseite zu erhalten. Plasma aktivieren Sie die Folie mit 50 W, 13,56 MHz, 0,4 Mbar O2 Plasma für 20 s, dann die komplette Folie-Folie in einer wässrigen Lösung von 1 Vol % (3-Aminopropyl) Trimethoxysilane (APTS) oder (3-Glycidyloxypropyl) Trimethoxysilane (GPTS) für 5 min bei 20 ° c inkubieren
- Mischen Sie beide Äthanol verdünnt Epoxy Vorläufer Lösungen um optimale Aushärtung Verhalten sicherzustellen. PDMS-Formen aus der Vakuumkammer abrufen und auf eine flache Oberfläche legen. Dann schnell ein Tröpfchen von gemischten Harz auf jeder Mikrostruktur auf dem Schimmel mit einer Mikropipette (ca. 10 µL pro 1 cm2 von Mikrostrukturen) verzichten (Abbildung 1, Schritt 7a).
- Polyimid-Folie-Folie-Sandwich aus dem wässrigen Silan (APTS oder GTPS) Lösung abrufen. Trocknen Sie die Folie mit Druckluft oder Stickstoff.
- Legen Sie bereit Polyimid-Folie-Glas-Folie Sandwich auf die hinterlegten Epoxidharz (Abbildung 1, Schritt 7 b). Drücken Sie fest auf den Objektträger befestigt an der Polyimid-Folie gegen die PDMS-Form. Legen Sie ein Blech auf den Objektträger und dann Kaution Gewichte bis zu 1,4 N/cm2 Druck für 1 h, während die Epoxy Harz härtet bei Raumtemperatur.
Hinweis: Im Idealfall bleibt kein Harz auf die Folie in den Bereichen, wo die Strukturen in der Form die maximale Höhe haben. Diese entsprechen der Kristallisation-Brunnen, wo die Kristallisation danach stattfindet.- Optional: Wenn genaue Ausformung der kleinen Features ist von entscheidender Bedeutung, PDMS-Schimmel mit einem Aluminiumrahmen gestärkt werden kann, während das Formteil Schritt31.
- Entfernen Sie den Objektträger mit Polyimid-Folie und das gemusterte Epoxidharz aus der PDMS-Form (Abbildung 1 , Schritt 8) abziehen. Plasma aktivieren die gemusterten Epoxy-Seite mit 50 W, 13,56 MHz, 0,4 Mbar O2 Plasma für 20 s.
- Brüten Sie nach dem Entfernen der Polyimid-Folie aus der Plasmakammer die Epoxy-gemusterten Folie in 1 Vol % wässrige APTS (bzw. GPTS) Lösung für 5 min bei 20 ° C. In ähnlicher Weise bereiten Sie eine zweite UN-gemusterten Polyimid-Folie mit ergänzenden 1 Vol % GPTS (APTS) Silan Aktivierung. Trocknen Sie nach der Inkubation strukturierter und unstrukturierter Folie mit Druckluft.
- Positionieren Sie das Epoxid Seite nach oben auf eine flache Oberfläche, über die Oberflächenspannung der Wassertropfen unter als Vermittler, Eisstockschießen der Folie zu verhindern und gewährleisten maximale Ebenheit. Legen Sie die zweite aktivierten Polyimid-Folie auf der Oberseite und sanft Strich mit dem Finger von einer Ecke, das Gegenteil zu machen, binden und Blasenbildung zu vermeiden.
(3) Access-Ports für flüssige Lieferung
- Bereiten Sie 4 mm Dicke PDMS-Platten in einer Petrischale nach Schritte 1.3.1 bis 1.3.3 ohne Verwendung des SU8-Masters. Schneiden Sie die Platte in PDMS Blöcke der entsprechenden Größe um alle Einlass-Ports auf dem Chip zu decken, ohne die einzelnen Kristallisation Fächer des Chips.
- Plasma aktivieren Sie beide, den Chip und die PDMS-block in 50 W, 13,56 MHz, 0,4 Mbar O2 Plasma für 20 s. Für chemische Bindung dann Brüten Sie jedes Teil in einer 1 Vol % wässrige APTS oder GPTS Lösung für 5 min bei 20 ° C. Trocknen Sie jedes Teil mit Druckluft und drücken Sie die PDMS-Platte auf die Folie-Chip.
- Um die Bindung zu verbessern, platzieren Sie den Chip auf eine flache PDMS-Tafel, und bedecken Sie ihn mit einer Plastikfolie, gefolgt von einem sauberen Objektträger und einem Metallblock. Schließlich Zahlen Sie Gewichte, um bis zu 1,4 N/cm2 Druck für ca. 1 h.
- Lochen der Zugang mit einem 0,75 mm Biopsie-Punch an jeder Stelle wo Einlass und Auslass Ports zeichnen sich in der Chip-Design und die Rückseite mit Klebeband versiegeln. Der Chip ist jetzt mit einem Aussendurchmesser der Durchmesser der Bohrung (wie in Schritt 4.2) passend für alle Schläuche zugänglich.
(4) Oberflächenbehandlung
- Bereiten Sie eine 01:20 Verdünnung von 9 wt % Fluorpolymer-Lager in Fluoro-Lösungsmittel, eine Endkonzentration von 0,45 Gew.-%. Speichern der Stammlösungen und Verdünnungen in einem Kühlschrank im Dunkeln bei 4 ° C.
- Laden Sie die 01:20 Fluorpolymer-Verdünnung in eine Spritze 1 mL Luer-Lock. Befestigen Sie ein 27 × 5/8" Nadel der Spritze und dann eine PTFE-Schläuche zur Nadel.
- Schließen Sie den Schlauch an der Röntgen-Chip an und Spritzen Sie die Fluorpolymer-Arbeitslösung in Schritt 4.1 vorbereitet, bis alle Kanäle gefüllt sind.
- Platzieren Sie den Chip mit der flachen Seite nach unten auf einer Herdplatte 190 ° C für 5 min zu verdampfen alle Lösungsmittel um den Fluorpolymer auf einer Dünnschicht-Beschichtung einzuzahlen.
Hinweis: Wenn Sie eine neue Geometrie verwenden, überprüfen Sie, ob Kanäle mit Fluorpolymer während dieses Beschichtungsverfahren verstopft waren. Wenn ja, weiter Verdünnen der Stammlösung.
(5) Protein-Vorbereitung
- Wiegen Sie lyophilisierter Thaumatin und lösen Sie es in einer Pufferlösung, die das entsprechende Volumen zu einer endgültigen Proteinkonzentration von 40 mg mL-1in Tabelle 2 aufgeführt.
- Dialyse Glucose Isomerase gegen den Puffer nach dem Hersteller-Protokoll in Tabelle 2 aufgeführt.
- Bereiten Sie das Protein Thioredoxin vor, wie zuvor beschrieben von Schubert et. al. 30.
- Überprüfen Sie die endgültige proteinkonzentrationen Leuchtern mit Aussterben Koeffizienten in Tabelle 2berechnet, indem die Software ProtParam32zusammengefasst.
- Bereiten Sie alle Lösungen mit Reinstwasser und Filtern sie mit einem 0,2 µm-Filter.
- Proteinlösungen bei 20 ° C für 15 min bei 16100 X g zentrifugiert und den überstand für Kristallisation Experimente nehmen.
(6) Protein Kristallisation in Röntgen-Chip
- Um Proteine in mikrofluidischen Chips kristallisieren, mischen Sie gleiche Mengen von Protein und Fällungsmittel Lösung. Proteinkonzentration, Puffer Zusammensetzung und Fällungsmittel Zusammensetzung sind in Tabelle 2zusammengefasst. Bereiten Sie ein Gesamtvolumen von rund 20 µL, einen Mikrofluidik-Chip zu füllen.
- Sofort nach dem Mischen, injizieren die Lösung in der Ansaugöffnung des Chips über eine Spritze, eingekoppelt, 27 × 5/8" Nadel und PTFE-Schläuche mit 0,75 mm Außendurchmesser (siehe Schritt 4.2).
Hinweis: Die Befüllung für das serielle Layout erfordert eine vorherige Grundierung des Chips mit fluorierten Öl, was ist am einfachsten durch Laden der fluorierten Öl aus der Auslassöffnung vor der Injektion der Kristallisation Lösung durch die Einlassöffnung. Alle laden Schritte sollten überwacht werden, unter Verwendung eines Mikroskops, um angewandte Spritze Druck und der entsprechende Volumenstrom zu kontrollieren." - Nachdem der Chip gefüllt ist, trennen Sie die einzelnen Kristallisation Fächer durch Einspritzen von fluorierten Öl in der Ansaugöffnung des Chips. Den Chip durch blockieren alle Einlass und Auslass-Ports des Chips zu versiegeln. Dies kann durch Einfügen einer Büroklammer.
Hinweis: Weil die Kristallisation Fächer von Protein/Fällungsmittel Lösung gefüllt sind, füllt das fluorierte Öl nur Einlasskanal des Chips, ohne die Lösung in den Abteilen der Kristallisation. - Um Dampf Diffusion Kristallisation Kinetik zu imitieren, platzieren Sie den versiegelten Chip bei Umgebungstemperatur und Normalatmosphäre erlauben das Tröpfchen in die Kristallisation Fach durch das verdunsten des Wassers durch die Polyimid-Folie schrumpft.
- Nach Kristall ist Bildung durch ein Mikroskop beobachtet oder DLS-Messungen (Schritt 7), übertragen die komplette Mikrofluidik-Chip in die entsprechenden fällungsmittels Lösung, die weitere Verdunstung aus der Kristallisation Brunnen bis x-ray Diffraction verhindern Experiment wird durchgeführt.
7. dynamische Licht Streuung Messungen in Kristallisation Brunnen in Chip
Hinweis: DLS Messungen wurden mit einer Laserleistung von 100 mW, eine Wellenlänge von 660 nm und das Streulicht auf einem Streuwinkel von 142° erkannt wurde. Weil alle untersuchten Beispiellösungen wässrigen waren der Brechungsindex von Wasser (n = 1,33) wurde in allen Berechnungen verwendet.
- Ort der Mikrofluidik-chip in die im SBS-Format Plattenhalter des DLS Instruments durch die Verwendung des Adapters im Schritt 8.1 beschrieben. Stecken Sie den Adapter in das Gerät.
- Passen Sie Laserfokus in einem Fach der Mikrofluidik-Chip sorgfältig mithilfe der motorisierten X, y, Z-Stufe an. Da der Mikrofluidik-Chip sehr dünn ist, Anpassen der Z-Ebene durch kleines Inkrement Schritte anwenden.
Hinweis: Eine korrekte Einstellung ist durch eine hohe abfangen und eine glatte Tail der daraus resultierenden Autokorrelationsfunktion der DLS-Messung bestätigt. Eine Kalibrierung Datei kann erstellt werden, um die Position jedes einzelnen Kristallisation in der Mikrofluidik-Chip ermöglicht automatisierte DLS-Messungen in mehrere Fächer im Laufe der Zeit zu entsprechen. - Führen Sie jede DLS-Messung bei 293 K für 30 s und wiederholen Sie die Messung alle 5 min. bis zum Ende des Experiments Kristallisation.
Hinweis: Initial Keimbildung kann durch die Verteilung der Radius der DLS-Messungen im Laufe der Zeit verfolgt werden und erfolgreiche Kristallbildung kann parallel durch die eingebaute Lupe der DLS Platte Leser verfolgt werden.
(8) Beugung Datenerfassung
- Adapter für Strahlrohr Goniometer
- Drucken Sie die Adapter für die Platte Goniometer zu positionieren und drehen die Röntgen-Chips während der kristallographischen Datenerfassung.
- Fertigen Sie die Adapter für die Basis Goniometer auf einem Hobby-Klasse 3D Drucker mit Standard-Parameter-Einstellungen, wie vom Hersteller empfohlen.
Hinweis: Die Adapter wurden mit einem 3D-CAD-System entworfen und die Koordinatendateien der Adapter befestigt sind, ". STL'-Dateiformat in der Beilage. - Befestigen Sie die Röntgen-Chips an den Adapter mit doppelseitigem Klebeband.
-
in Situ Röntgen-Kristallographie
- Datensammlung von Beugung mit, dass ein strahlgröße von 10 × 5 µm (FWHM "glockenförmig" Profil) 296 K. Verwendung Röntgenstrahlen mit einer Energie von 12,8 keV und einem Fluss von 2,2 · 1011 Photonen · s-1 in die abgeschwächte Strahl und Rekord Beugungsmuster mit einem Pilatus 6 M Hybrid-Pixel-Detektor.
Hinweis: Mikrofluidischen Geräten mit Thaumatin, Glucose-Isomerase oder Thioredoxin-Kristalle in Situ Röntgen kristallographischen Experimente am EMBL Strahlrohr P14 von PETRA III Synchrotron dienen. Zur Verfügung strahlgröße Fokus und Flussmittel können bei anderen Röntgenquellen abweichen. Die Anzahl der exponierten Proteinkristallen, die Anzahl der Beugungsmuster von jeder Kristall, der Oszillation Winkelbereich pro Exposition und die Belichtungszeit aufgenommen werden in Tabelle 3zusammengefasst. - Prozesses Sätze von zwei aufeinander folgenden Beugungsmuster individuell mit dem Programm XDS33. Verwenden Sie das Bash-Skript "xds.sh" in der Beilage gefunden.
- HKL-Dateien für jedes Dataset aus alle Kristalle erstellen und mit Hilfe der Software XSCALE33skalieren. Verwenden Sie das Bash-Skript "xscale.sh" in der Beilage, erstelle ich eine Eingabedatei für XSCALE.
Hinweis: Nur Datasets von Kristallen, die Korrelationskoeffizienten größer als 90 %, die ein hohes Maß an Isomorphismus zeigt, sollte skaliert werden. Die konservative Kriterium ‹ich/σ (I) › (> 2) sollte verwendet werden, um die höchste Auflösung Shell zu bestimmen. Molekularen Austausch mit dem Programm MOLREP34 aus der CCP4 Suite35 kann verwendet werden, um für weitere Modellbau mithilfe die 3D-Koordinaten der Protein Data Bank (PDB) in Tabelle 3dargestellten Phasen zu erhalten. - Alle Strukturen isotopischer mit Refmac535,36 verfeinern und BLÄSSHUHN37 zur visuellen Kontrolle des fertigen Modells zu verwenden.
Hinweis: Lösungsmittel Moleküle sollte automatisch hinzugefügt werden, während die Verfeinerung und müssen überprüft werden, um chemisch vernünftigen Positionen zu bestätigen. Alle Modelle müssen überprüft werden, um Ramachandran Ausreißer zu identifizieren.
- Datensammlung von Beugung mit, dass ein strahlgröße von 10 × 5 µm (FWHM "glockenförmig" Profil) 296 K. Verwendung Röntgenstrahlen mit einer Energie von 12,8 keV und einem Fluss von 2,2 · 1011 Photonen · s-1 in die abgeschwächte Strahl und Rekord Beugungsmuster mit einem Pilatus 6 M Hybrid-Pixel-Detektor.
9. die Datenauswertung
- Strahlenschäden
- Analysieren Sie den Verfall der Beugung macht im Laufe der Zeit mit einer Methode, die von Owen Et al.38beschrieben. Dafür berechnen Sie die Summe der I/σ(I) (bereitgestellt von XDS33) alle indizierten Reflexionen von jedem ausgewerteten Beugung Dataset (2 aufeinander folgende Beugungsmuster), als Referenzwert verwenden. Verwenden Sie das Bash-Skript "ISigma.sh" aus der Beilage.
- Die Beugung macht jedes Dataset für die mittlere Beugung Macht des ersten Datensatzes zu normalisieren.
- Die Änderung der Rmeas Werte im Laufe der Zeit zu analysieren, indem man die Rmeas Werte aus den Correct.LP -Dateien von XDS33 (Bash-Skript "Rmeas.sh" aus der Beilage) erhalten.
- Kristallorientierung
- Die Euler-Winkeln auf Auskunft über die Verteilung der Kristallgitter Orientierungen in Bezug auf das Labor-Koordinatensystem zu bestimmen. Berechnen Sie die Euler-Winkeln aus der XDS-Orientierung-Matrix in die Ausgabedatei XPARM39 mit Hilfe der Software Matlab gegeben. Verwenden Sie das Bash-Skript "rotation_matrix.sh", um die Rotationsmatrix aus jeder Kristall aus der XPARM-Datei zu extrahieren. Verwenden Sie die Ausgabe-Datei als Eingabe in Matlab, um die Euler-Winkel mit der Matlab-Funktion rotro2eu.m (ergänzende Datei) berechnen.
Hinweis: Eine ausführliche Beschreibung der Berechnung wurde durch Zarrine-Afsar Et Al40veröffentlicht. - Konvertieren Sie die erhaltenen Euler-Winkel von Bogenmaß in Grad. Gruppieren Sie die erhaltenen Euler-Winkel für alle drei Drehung Flugzeuge (Xy, Xz und Zy) in Klassen von 10° und Plotten sie mithilfe der Software Origin9.
- Die Euler-Winkeln auf Auskunft über die Verteilung der Kristallgitter Orientierungen in Bezug auf das Labor-Koordinatensystem zu bestimmen. Berechnen Sie die Euler-Winkeln aus der XDS-Orientierung-Matrix in die Ausgabedatei XPARM39 mit Hilfe der Software Matlab gegeben. Verwenden Sie das Bash-Skript "rotation_matrix.sh", um die Rotationsmatrix aus jeder Kristall aus der XPARM-Datei zu extrahieren. Verwenden Sie die Ausgabe-Datei als Eingabe in Matlab, um die Euler-Winkel mit der Matlab-Funktion rotro2eu.m (ergänzende Datei) berechnen.
Ergebnisse
Epoxy ist eine ausgezeichnete Füllmaterial für Röntgen-Chip-Fertigung. Es ist billig, einfach und robust zu verarbeiten ohne Spezialwerkzeuge (Abbildung 1). Verringerung der Epoxy Viskosität durch Verdünnen es mit 40 wt % Ethanol erleichtert das Entfernen überschüssiges Harz über die Kristallisation Brunnen, was zu definierten Röntgen-Fenster. Höhere Ethanol-Verdünnungen ergab Mängel in das ausgehärtete Harz. Durch die Analyse von Röntgen-Chip Querschnitte, haben wir festgestellt das total Fensterdicke beider Seiten, ca. 19 µm dick, werden die sehr nahe an die Nenndicke der verwendeten Polyimid-Folien von 2 × 7,5 µm (Abbildung 2) ist
Kristallisation Studien wurden in mehreren Nanoliter Größe Reaktion Fächer jeweils isoliert mit einer Kapillare Ventilmechanismus bereits41beschrieben. Dieser "Speicher-dahin-create" Laden-Technik vermeidet Probenverlust aus Kanal tot-Volumen und kann leicht manuell durchgeführt werden, entfällt die Notwendigkeit, Pumpen oder andere Ausrüstung für flüssige Betätigung42verwenden. Der Chip wird mit fluorierten Öl vor dem Laden der wässrigen Probe grundiert. Die Oberflächenspannung an der Öl-Wasser-Grenzfläche zwischen Grundierung Öl und wässrigen Probenergebnisse eine Druckdifferenz über die Schnittstelle. Diese Laplace-Druck ist abhängig von der Krümmungsradius und der Oberflächenspannung der Schnittstelle. Um seine Energie zu minimieren, muss die Schnittstelle ihrer Oberfläche minimieren die Maximierung seiner wichtigsten Krümmungsradien bei konstantem Volumen entspricht. Eine geringe Krümmung-Schnittstelle in einem breiten Kanal hat einen niedrigeren Druck Laplace dann ein starker Krümmung Schnittstelle in einem engen Kanal-Segment. Daher bevorzugt betritt der Probe-Stecker und fließt durch die weite bypass-Kanal statt fließt durch die enge Kapillare Ventil Einschränkungen. Zu guter Letzt folgt der Probe-Stecker fluorierten Öl, die Probe-Brunnen in unabhängigen Tröpfchen zu trennen.
Robuste und zuverlässige laden erzielte mit Durchflussraten von bis zu 1 mL/h in eine Seriennummer und ein gut Parallelanordnung (Abbildung 3). In der "seriellen" Layout sind gut ein- und Kapillare Ventil Verengungen nacheinander durch einen Bypass-Kanal31verbunden. Im Gegensatz dazu im "parallel" Layout, zwei separate Hauptkanäle verbinden alle gut Buchten oder Kapillare Ventile nur43. Beide Konzepte Anordnung wurden zuvor mit Formulierung Steuerelement Bildzusammenstellung, kombiniert ist ein nützlicher Aspekt in Protein Kristallisation43,44. Das serielle Design hat nur zwei materialöffnungen, einen ein- und einen Ausgang. Es hat weniger flüssige Anschlüsse, und aus diesem Grund ist einfacher zu bauen und zu betreiben. Das parallele Layout hat 4 materialöffnungen, 2 für den wichtigsten Kanal verbindet die Brunnen und 2 für die Verknüpfung der Kapillare Ventile, Luft oder überschüssiges Öl entweichen zu lassen. Beladung kann daher beidseitig Hauptkanal gehen. Dieses Layout hat insgesamt niedriger Strömungswiderstand für eine gleiche Anzahl von Brunnen aufgrund ihrer kürzeren Bypass. Es eignet sich daher besser für Up-skaliert Geräte mit einer hohen Anzahl von Brunnen. Auch die Probe-Brunnen sind näher zusammen orientiert, bietet Vorteile für automatisierte imaging.
Vollständiges Beispiel gut geladen wurde für beide Layouts beobachtet, wenn entweder als ein zwei-Höhe oder ein drei-Höhe-Design gebaut. In einem zwei-Höhe-Design sind der probenvertiefung und der Bypass-Kanäle von gleicher Höhe. Das drei-Höhe-Design erfordert eine dritte Maske, einen zusätzlichen SU8 und eine Ausrichtung Schritt weiter sicherstellen, dass die Probe Brunnen höher als die vorhergehende bypass Kanäle. Dieser Höhenunterschied fördert die Eingabe der Probenflüssigkeit in den Brunnen durch die gleichen Kapillare Ventiltechnik Grundsatz, dass die Strömung an den Einschnürungen stoppt. Die höhere gut Obergrenze entspricht hier einem niedrigeren, die Laplace-Druck der vorrückenden Meniskus und Informationsfluss entlang der Umgehungsstraße Richtung nur begünstigt wird, nach dem Brunnen vollständig ausgefüllt haben, so dass Ventil Verengungen weiter fließen blockieren und sich der Bypass umleiten. Erfolgreiche Laden erfordert nicht streng jedoch die Brunnen höher als der Bypass als geeignete Kapillare Ventiltechnik auch erreicht werden kann, indem Sie Kanal breiten entsprechend anpassen. Dennoch, nach unserer Erfahrung die höheren Brunnen durchgeführt deutlich robuster und Defekt kostenlos laden wurde auf bis zu zehn Mal höhere Durchflussraten bei allen drei-Höhe-Designs um ihre zwei-Höhe-äquivalente im Vergleich beobachtet. Dieser Effekt wurde in das parallele Layout stärker ausgeprägt.
Um Dampf Diffusion Kristallisation Kinetik zu imitieren, war die endliche Durchlässigkeit der Polyimid-Folie ausgenutzt, um die Wasserverdunstung im Laufe der Zeit zu kontrollieren. Experimentelle Verdunstungsraten wurden durch die Überwachung der Änderung des Volumens Tröpfchen im Laufe der Zeit durch die Gleichsetzung von Drop-Oberfläche und gut Höhe (Abbildung 4) quantifiziert. Die Verdunstung von Kristallisation Brunnen in der Röntgen-Chip wird nicht in einer linearen Weise als einer schrumpfenden Fläche des Tropfens zeitgleich mit zunehmender gelöste Konzentration führt zu einer geringeren Verdunstungsrate über Zeit45fortgesetzt. Die anfängliche Verdunstung folgte eine ungefähr lineare Rate von über 0,5 nL h-1 in Vertiefungen der seriellen Layout-Geometrie.
Zum besseren Verständnis der Kristallisation Kinetik wurden in den Vertiefungen der Kristallisation der Mikrofluidik-Chip DLS Messungen durchgeführt. Für erste DLS Messungen wurde ein PDMS-Chip verklebt auf einen Glasobjektträger zur besseren optischen Eigenschaften für die Lichtstreuung Experiment zur Verfügung zu stellen. Dieser Chip hatte auch dieselben Abmessungen wie die x-ray-Chip. PDMS hat eine höhere Wasserdampfdurchlässigkeit als Polyimid Polyimid-Fenster in der Röntgen-Chip-45. Da Flussmittel linear mit der Entfernung skaliert, die Verdunstung Flugbahn ein Polyimid Fenstermodus kann gut mit einem entsprechenden PDMS-Fenster der entsprechenden Dicke aufeinander abgestimmt.
DLS-Ergebnisse zeigen, dass die Radius-Verteilung ändert sich im Laufe der Zeit (Abbildung 4A-B), zeigen, dass die DLS-Messungen erlauben, um die ersten Keimbildung zu erkennen, bevor erste kristalline Partikel beobachtet werden. Diese Information kann zur Keimbildung und wachsen einzelne Kristalle pro Bohrloch durch extern einstellen die Verdunstungsrate und damit Übersättigung Ebenen in einem frühen Stadium der Keimbildung46.
Die Röntgen-Chip wurde auf einem 3D gedruckte Adapter für SBS kompatibel Platte goniometers an das EMBL Strahlrohr der Synchrotron P14 bei PETRA III (Abb. 5A) behoben. Alternativ kann ein kleiner 3D gedruckte Rahmen Mount Röntgen-Chips auf standard Strahlrohr Goniometer21verwendet werden. Thaumatin Kristalle haben eine Größe von 10-20 µm (Abb. 5 b) und beugen bis zu einer Auflösung von 2.0 Å (Abbildung 5). Wie erwartet, der Röntgen-Hintergrund-Beitrag der zwei dünne Polyimid-Folien-Fenster aus dem x-ray-Chip beschränkt sich auf Polyimid Polymer Streuung Ringe um 11 Å (2θ ~ 5°) und 33 Å (2θ ~ 1,7 °) für die x-ray Wellenlänge von 0,97 Å. Diese beiden Ringe stören Datenverarbeitung nicht. Ein total Dataset mit 83 Thaumatin Kristalle gesammelt wurde und 10 Beugungsmuster aus jeder Kristall mit einem 1°-Drehung bei jedem Frame aufgezeichnet wurden. Datenverarbeitung und Verfeinerung Parameter sowie die Statistiken des Thaumatin-Datasets sind aufgeführt und im Vergleich mit zwei Datasets von Glucose Isomerase und Thioredoxin, die auch gesammelt in Situ finden Sie in Tabelle 3 und Tabelle 4.
Die Intensität Verfall der normalisierten Beugung macht im Laufe der Zeit wurde durch die Aufspaltung der Thaumatin Dataset in fünf Sub-Datasets untersucht (zwei Beugungsmuster dienten pro Teilmenge, komplette Datensätze beizubehalten). Wie in Abbildung 6dargestellt, die Beugung macht begonnen, nach dem ersten Sub-Dataset zu verringern und lag unter 50 % im vierten Sub-Dataset. Dadurch steigen die Rmeas Werte der Sub-Datasets auch im Laufe der Zeit, Angabe Röntgen-Strahlungsschäden während der Datenerfassung. Wir vermuten, dass freie Radikale erzeugt während der Röntgenaufnahme schnell benachbarte Kristalle in dasselbe Fach Reaktion beeinträchtigen. Solchen Folgeschäden Röntgen war beispielsweise weniger ausgeprägt in einen damit verbundenen experimentellen Ansatz, wo Kristalle wurde verteilt über eine deutlich größere Fläche in einer Polyimid-Sandwich-21. Zur Minimierung von x-ray Gesamtschaden sollten bei Raumtemperatur nur eine kleine Anzahl von Beugungsmuster aus einem bestimmten Kristall erhoben werden. Darüber hinaus sollte nur ein einziges Protein Crystal pro Abteil der Mikrofluidik-Chip ausgesetzt werden. Dennoch, alle Modelle Struktur verfeinert mit den verarbeiteten Datensätzen sehr gute Stereochemie und geeignete Statistiken (Tabelle 4). Darüber hinaus wurden alle letzte Elektron-Dichte-Karten von sehr guter Qualität.
In früheren Kristallographie Ansätze auf Röntgen-transparente Chips wurde die Ausrichtung und Anordnung der Kristalle musste absichtlich manipuliert werden, um eine zufällige Verteilung von Crystal Orientierungen40 zu erhalten oder durch Kristall Bewegungen innerhalb der Flüssigkeitsschicht21. Um die Kristallorientierung in den x-ray transparent mikrofluidischen Chips beschrieben in diesem Protokoll zu bewerten, wurde die Einheit Zelle Ausrichtung aller sichtbaren Kristalle in Bezug auf die Labor-Koordinatensystem bestimmt. Für die Bipyramidal Thaumatin Kristalle wurde eine leichte Präferenz (Abb. 7A) beobachtet, während wir eine breite Verteilung für Glucose Isomerase Kristalle (Abb. 7 b) erhalten. Wir begründete, dass die meisten Materialien auf der Nanometerskala bedeutende Rauheit aufweisen. Infolgedessen konnte Kristalle spontan auf der Oberfläche deutlich weniger voreingenommen Orientierungen spontan Keimbildung. Solch ein kleinen Kristall-Kern kann in eine Orientierung, während Sie auf passende Größe ohne Neuausrichtung im Vergleich zu den normalen der Fläche wachsen weiterhin gesperrt. In der Tat ist Oberfläche vermittelten Kristall Keimbildung seit langem ein Ärgernis für Kristallographen versuchen, einen angehängten Kristall von der Oberfläche Schleife ohne Beschädigung des Kristalls in den Prozess. Hier können wir solche Kristalle zur Beugung Datenerfassung direkt nutzen. Allerdings gibt es bestimmte Systemeinschränkungen, die Thioredoxin zeigte eine starke Präferenz für bestimmte Ausrichtungen in Xy, Xz und Yz-Ebenen (Abbildung 7). Die Beispiele zeigten zeigen, dass die Verteilung nicht nur auf die Wachstums-Umwelt, sondern auch auf die Kristallform abhängt. Die Thioredoxin-Kristalle haben Formen länglich, die dazu neigen, in bevorzugte Ausrichtung zu wachsen, während die tetragonal Bipyramidal Thaumatin Kristalle oder die orthorhombic Glucose-Isomerase-Kristalle nicht dieses Verhalten zeigen. Allerdings untersucht in allen Fällen, auch bei bevorzugte Orientierungen, die ausreichend gute Abdeckung des reziproken Raum und somit vollständige Datensätze für alle zugänglichen Bereich von Kristall-Rotationen führte Proteine. So mussten keine zusätzlichen Maßnahmen getroffen werden, bei der Auswahl von Kristallen für Xray-Exposition.

Abbildung 1 : Schema der mikrofluidischen Röntgen-Chip Fabrication. (1) SU-8 entfällt auf einem Silizium-Substrat und Spin beschichtet, um die gewünschte Schichtdicke zu erhalten. (2) Fotolack ist durch eine Maske UV-Bestrahlung ausgesetzt. (3) unbelichtete Fotolack wird dann weg von hintereinander waschen mit PGMEA und Isopropanol entwickelt, was zu (4) ein SU-8 Master für weitere casting Schritte. (5) PDMS ist auf, gegossen und (6) nach dem Aushärten der PDMS-Form aus dem SU-8 Master geschält wird. (7a) Epoxy-Kleber entfällt auf dem PDMS-Schimmel (7 b) eine aktivierten Polyimid-Folie ist chemisch gebunden an das Epoxidharz. (8) nach dem Aushärten wird die Polyimid-Folie mit dem gemusterten dünnen Epoxy-Film aus dem PDMS-Werkzeug abgeschält. (9) in einem letzten Schritt wird das Gerät mit einer zweiten Polyimid-Folie zu einem geschlossenen gering Röntgen Hintergrund mikrofluidischen Chip Lidern. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Foto (links) und Mikroskopie-Bildern der Querschnitte der letzten Chips. Eine repräsentative Kanal-Segment (Mitte) und eine Kristallisation gut (rechts) aus zwei separaten Chips werden angezeigt. Pfeile zeigen die gemessene Abständen. Alle Abmessungen sind in µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Schaltpläne der Kristallisation entwirft nun mit [A] parallelen oder seriellen Layout [B], von oben und von der Seite mit den Maßen in µm angegeben gesehen. Typische Kanal Höhen waren: 50 µm umgehen, 50-60 µm Kristallisation gut, 5-10 µm Kapillare Ventil, entsprechende Mengen von ca. 2,5 gut nL (parallele Layout) und 8 nL (serielle Layout). Vertreter gut laden Verhalten wird mit Lebensmittelfarben angezeigt. Der Chip wurde grundiert mit 12 Gew.-% 1H, 1 H, 2H, 2H-Perfluoro-1-Octanol in FC-43, bevor Lebensmittelfarbe in die Speicher-Brunnen injiziert wurde. Weiße Pfeile zeigen die Richtung des Flusses. Übersichtsbilder des geladenen Geräten zeigen alle Brunnen geladen defekt frei, zur Veranschaulichung robuste Probenaufnahme. Das parallele Layout ist als ein drei-Höhe-Design, mit Kristallisation Brunnen höher als der Bypass dargestellt, während die serielle Layout wird dargestellt als ein zwei-Höhe-Design mit Brunnen und umgehen mit gleicher Höhe. Typische Strömungsgeschwindigkeiten wurden rund 150 µL/h während des Ladens, aber Defekt kostenlos laden für Flussraten von bis zu 1 mL/h in drei Höhe-Design beobachtet wurde. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 : In Situ dynamische Lichtstreuung eine Kristallisation über Zeit. [A] mikroskopisch kleinen Bilderserie der Kristallisation gut. Der gespeicherte Tropfen kontinuierlich schrumpft als Wasserdampf im Laufe der Zeit verdunstet. Ersten Thaumatin Mikrokristalle kann nach 4 Std. [B] entsprechende hydrodynamischen Radius Verteilung der Thaumatin Partikel gemessen von DLS während der gleichen Kristallisation fotografiert in [A] beobachtet werden. Die Bildung der Bruchteil einer Sekunde Radius angibt, dass anfängliche Keimbildung Ereignisse nach ca. 1-2 h. [C] repräsentative Band gesehen werden können Abnahme der zweibändigen Referenz Tröpfchen durch Verdunstungskühlung Wasserverlust im Laufe der Zeit. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5 : in Situ Beugung Datenerfassung. [A] einzelne mikrofluidischen Chips sind durch einen 3D gedruckte Adapter, die auf eine Platte Goniometer (blau) montiert. [B] Thaumatin Kristalle in der Mikrofluidik-chip während Strahlenbelastung wie abgebildet durch die Inline-Mikroskop am Strahlrohr P14. [C] Beugung Thaumatin Kristalle verzeichnete eine Auflösung von 2.0 Å, mit einem verschwindend geringen Hintergrund. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6 : Datenauswertung von Beugung Daten aus Thaumatin Kristalle in der Mikrofluidik-Chip, aufgenommen bei der Zimmertemperatur. [A] Elektronendichte des raffinierten Thaumatin-Modells mit dem Rahmen nur 1-2 Dataset (blaue Konturen bei 1,5 σ). [B] Intensität Zerfall von Thaumatin Kristalle als Funktion der Strahlendosis. [C] Entwicklung des Rmeas-Wertes über Strahlendosis. Die Box-plots in [B] und [C] mit Quartile (oberen Werte 75 %, mittlere Werte 50 %, niedrigere Werte 25 % und Mittelwert) und Schnurrhaare mit 95 % Konfidenzintervall repräsentieren den Verfall der Beugung Intensität und Rmeas alle sichtbaren Kristalle (n = 83). Bitte klicken Sie hier für eine größere Version dieser Figur.
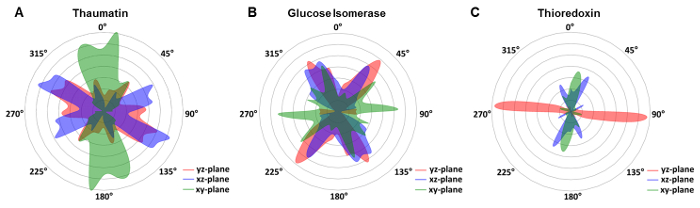
Abbildung 7 : Verteilung der Einheit Zelle Orientierungen in der Mikrofluidik-Chip-Folie in Bezug auf die Labor-Koordinatensystem. [A] Bipyramidal Thaumatin Kristalle zeigte eine breite Verteilung der Orientierungen für fast 180° in die Xy - (blau), Xz-Ebene (grün) und yz-(red) Ebene. [B] Glucose Isomerase zeigt auch eine weitreichende Verbreitung, während [C] Thioredoxin eine starke Präferenz für bestimmte Ausrichtungen zeigte. Bitte klicken Sie hier für eine größere Version dieser Figur.
| SU8-Schicht | Spin-Mantel | Pre-bake | Expose | Nach dem Backen |
| [65 / 95 ° C] | [65 / 95 ° C] | |||
| 1St Layer: Brunnen | 1000 U/MIN | 0 / 10 min | 200 mJ/cm2 | 1 / 4 min |
| 15 µm SU8-3010 | ||||
| 2Nd Layer: Bypass | 2000 U/MIN | 0 / 16 min. | 220 mJ / cm2 | 1 / 5 min |
| 35 µm SU8-3025 | ||||
| 3rd -Schicht: Ventile | 3000 U/MIN | 0 / 3 min | 150 mJ / cm2 | 1 / 2 min. |
| 5 µm SU8-3005 |
Tabelle 1: SU8 Prozess Beispiel für Dreischicht-parallele Röntgen-Chip-Design. Diese Layer-Reihenfolge wird für casting eine PDMS-Form für Röntgen-Chip-Fertigung ermöglichen. Um direkt ein PDMS während Prototyping Schimmel, kehren Sie die Schicht während der Meister Fertigung, von der 3rd Anfang bis Ende mit dem 1St Layer stattdessen bestellen.
| Protein | Proteinkonzentration | Protein-Puffer | Fällungsmittel | Raumgruppe, PDB-Eintrag | Vom Aussterben bedroht-Koeffizient [M-1 cm-1] |
| Thaumatin (Thaumatococcus Daniellii) | 40 mg mL-1 | 50 mM Bis-Tris, pH 6,5 | 1.1 M-Natrium-Tartrat, 50 mM Tris, pH 6,8 | I4222, 1LR2 | 29420 |
| Glucose-Isomerase (Streptomyces Rubiginosus) | 25 mg mL-1 | 10 mM HEPES, 1 mM MgCl2, pH 7,0 | 100 mM Bis-Tris, 2,7 M Ammoniumsulfat, pH 5,7 | I222, 4ZB2 | 46410 |
| Thioredoxin (Wuchereria Bancrofti) | 34 mg mL-1 | 20 mM Tris-HCl, 5 mM EDTA, 150 mM NaCl, pH 8,0 | 27,5 % PEG1500, 100 mM SPG Puffer, pH-Wert von 6,3 | P41212, 4FYU | 24075 |
Tabelle 2: Kristallisation Bedingungen und Raum Gruppen von Proteinkristallen vorbereitet, einschließlich des vom Aussterben bedroht-Koeffizient und Pdb-Codes.
| Protein | Anzahl der sichtbaren Kristalle | Nummer des beugungsmusters pro Kristall | Oszillation Palette pro Exposition [°] | Belichtungszeit [ms] | PDB-Eintrag für Herr |
| Thaumatin (Thaumatococcus Daniellii) | 103 | 10 | 1 | 40 | 1LR2 |
| Glucose-Isomerase (Streptomyces Rubiginosus) | 69 | 100 | 0.1 | 80 | 4ZB2 |
| Thioredoxin (Wuchereria Bancrofti) | 68 | 10 | 1 | 40 | 4FYU |
Tabelle 3: x-ray Diffraction Data Collection-Parameter.
| Daten Sammlung Statistikenein | Thaumatin (Bild 1-20) | Glucose-Isomerase (Frame 1-100) | Thioredoxin (Bild 1-10) |
| Strahlrohr | P14 | ||
| Wellenlänge [Å] | 0.96863 | ||
| Raumgruppe | P41212 | I222 | P42212 |
| Parameter Einheit Zelle: ein = b, C [Å] | 58.62, 151.48 | 93.91, 99,60, 103.04 | 58,45, 151.59 |
| Anzahl der Kristalle | 101 | 41 | 34 |
| Insgesamt Schwingung [°] | 10 | 10 | 10 |
| Auflösung [Å] | 30.1.1989 (1,95 – 1,89) | 30.1.1975 (1,80-1,75) | 30.3.2000 (3.20 – 3.00) |
| Temperatur [K] | 296 | 296 | 296 |
| R p.i.m.b | 7.5 (25,5) | 8.8 (28,0) | 9.1 (33,2) |
| Gemessenen Reflexionen | 1553200 | 690000 | 1111196 |
| Einzigartige Reflexionen | 21850 | 48942 | 44449 |
| Durchschnittliche I/σ(I) | 6.07 (1,78) | 5,85 (1,66) | 4.08 (1,47) |
| MN(I) halb-Satz Korrelation CC(1/2) | 96,2 (72,2) | 95,8 (68.2) | 97,9 (75,3) |
| Vollständigkeit [%] | 99,8 (100,0) | 100,0 (99,9) | 99,9 (100,0) |
| Redundanz | 71,1 | 14.1 | 25 |
| Raffinesse-Statistik | |||
| Auflösungsbereich [Å] | 30.01.1989 | 30.01.1975 | 30.03.2000 |
| R / Rfrei [%] | 18.8/23.9 | 18.1/20.5 | 18.9/23.1 |
| Protein-Atome | 1550 | 3045 | 1129 |
| Wasser-Moleküle | 51 | 111 | 164 |
| Liganden Moleküle | 20 | 0 | 0 |
| RMS-Abweichung | |||
| Bindungslänge [Å] | 0.02 | 0,026 | 0,01 |
| Bond Winkel [°] | 2.04 | 2.22 | 1,43 |
| B-Faktor [Å2] | |||
| Protein | 22.6 | 20 | 50 |
| Wasser | 25.1 | 27.1 | 29.7 |
| Liganden | 20.4 | ||
| Ramachandran Plot Analyse | |||
| Beliebtesten Regionen [%] | 97.67 | 95.32 | 96.13 |
| Zulässige Regionen [%] | 2.44 | 4.16 | 3,64 |
| Großzügig erlaubt Regionen [%] | 0.49 | 0,52 | 0,23 |
| a: Werte in Klammern beziehen sich auf die höchste Auflösung Shell. | |||
b: ( ), wo ich (Hkl) ist die mittlere Intensität der Reflexe Hkl, Σhkl die Summe über alle Reflexionen ist und Σi die Summe über i ist Messungen der Reflexion Hkl. ), wo ich (Hkl) ist die mittlere Intensität der Reflexe Hkl, Σhkl die Summe über alle Reflexionen ist und Σi die Summe über i ist Messungen der Reflexion Hkl. | |||
Tabelle 4: Daten Sammlung Statistiken des Datasets von Thioredoxin, Thaumatin und Glucose-Isomerase.
Supplementry-Datei 1: chip_geometry.dwg. CAD-Datei der Chip Geometrien verwendet. Bitte klicken Sie hier, um diese Datei herunterladen.
Supplementry-File 2: goniometer_adapter.stl. STL-Datei angeben des Röntgen-Chip Goniometer Adapters. Bitte klicken Sie hier, um diese Datei herunterladen.
Supplementry-Datei 3: xds.sh. Bash-Skript zum Erstellen von Eingabedateien um Keile Beugung Daten durch XDS zu verarbeiten. Bitte klicken Sie hier, um diese Datei herunterladen.
Supplementry-Datei 4: xscale.sh. Bash-Skript um Beugung Daten aus Teilmengen zusammenführen und eine HKL-Datei erstellen. Bitte klicken Sie hier, um diese Datei herunterladen.
5-Supplementry-Datei: ISigma.sh. Bash-Skript um die ISigma Werte von allen einzelnen Teilmengen zu extrahieren. Bitte klicken Sie hier, um diese Datei herunterladen.
6-Supplementry-Datei: Rmeas.sh. Bash-Skript um Rmeas Werte aus allen einzelnen Teilmengen zu extrahieren. Bitte klicken Sie hier, um diese Datei herunterladen.
Supplementry-Datei 7: rotation_matrix.sh. Bash-Skript um die Eingabedatei für Matlab die Euler-Winkeln von der Drehmatrix berechnen vorzubereiten. Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Wir fertigen mikrofluidischen Geräten für in Situ Röntgenbeugung von Epoxidharz als Füllung Material und Polyimid-Folie als Fenstermaterial Musterung. Unser Verfahren optimiert verschiedene Schritte von der Fertigung über früheren Röntgen-Chip-Designs16,21. Wir reduziert die Fensterdicke und damit gleichzeitig auch Herstellung Streuung Hintergrund so weniger Prozessschritte erforderlich sind. in Situ Kristallisation über das beschriebene Protokoll hat erhebliche Vorteile. Es ermöglicht die Beugung Datenerhebung bei Raumtemperatur und damit schließt die Notwendigkeit der Cryo-Schutz, die in einigen Fällen das Risiko der Einschleppung von Artefakten in der Proteinstruktur enthält. Darüber hinaus unterliegen die Kristalle nicht körperliche Belastung, weil die Übertragung der Kristalle aus ihrer natürlichen Umgebung vermieden werden kann. Durch dieses Verfahren die Kristalle behalten ihre höchste Qualität und eine Behandlung nicht leiden.
Nach unserer Erfahrung umkreisen die kritischsten Schritte innerhalb des Protokolls der Kristallisation zu kontrollieren. Die Parameter x-ray geeignet Kristalle mit entsprechenden Dimensionen zu erhalten müssen empirisch ermittelt werden und können nicht auf einer Dampf-Diffusion-Experimente direkt entnommen werden. Mit identischen Konzentrationen des Proteins und Fällungsmittel ergaben nicht immer Kristalle in verschiedenen Chips, oder zeitweise in verschiedenen Brunnen innerhalb der gleichen Chip. Dies bedeutet, dass alle Faktoren, die die Kristall Keimbildung und Wachstum sorgfältig, wie Mutter Alkohol Zusammensetzung oder Kristallisation Kinetik (durch die Verdunstung Flugbahn) berücksichtigt werden sollte. Da größere Kristalle zu höheren Auflösung beugen, sind entsprechend große Kristalle im Idealfall gewachsen. Der Prozess der Kristall Kernbildung und Wachstum kann mit DLS Messungen folgen. Anpassung der Laserfokus innerhalb der ~ 50 µm dünnen Kristallisation Fächer des Chips können eine Herausforderung sein und erfordern sorgfältige manuelle Ausrichtung. Mithilfe von Brunnen tiefer als 100 µm war Laserausrichtung Auto machbar und verlässlich, so dass mehrere Brunnen durch automatisierte Übernahme Systeme überwacht werden können.
Polyimid-basierte x-ray Chips produzieren nur einen geringe Hintergrund und wir zeigen die Eignung dieser Geräte für Routine-x-ray Diffraction Datenerhebung durch das Lösen von Strukturen für drei Modell-Proteine. Die beste Auflösung erzielt in Chip unterschieden, im Vergleich zu vorher erreichten Auflösungen von deutlich größeren Proteinkristallen und konventionelle Röntgen-Datenerfassung. Dies kann durch mehrere Faktoren bedingt sein und weitere Kristallisation Zustand Optimierung kann weiter verbessern die Beugung. Es war möglich, Daten in Situ Beugung bis zu 1,8 Å Auflösung Anwendung Kristall mit Abmessungen kleiner als 30 µm. Die detaillierte Analyse der Thaumatin Beugung Daten lieferte Einblicke über Strahlenschäden. Um das Ausmaß der Schäden zu begrenzen, sollte nur ein einziger Kristall pro Fach in das Gerät mikrofluidischen ausgesetzt werden, da die Diffusion von radikalen und in benachbarten Kristalle auftreten kann. Um die Geschwindigkeit der Datenerfassung zu verbessern, sollte dies in Zukunft automatisiert werden.
Kristall-Morphologie kann in einigen Fällen eine bevorzugte Ausrichtung auftreten. Dies war z. B. der Fall mit dem Dataset Thioredoxin wo hatte die Kristalle eine stark bevorzugte Ausrichtung bezogen auf die Chip-Fenster. Auch hier konnten wir eine vollständige Beugung Dataset sammeln. Wenn Kristalle eine bevorzugte Orientierung im Chip weisen und vor allem wenn die entsprechende Raumgruppe auch eine niedrige Symmetrie hat, dann die Vollständigkeit des Datasets werden während der Sammlung überwacht sollten so dass genügend Beugung Muster Zuckerrohr gesammelt.
Zeitaufgelöste Untersuchungen mit diesen Chips sind direkt möglich, wenn mit Hilfe von Licht Reaktionen mit einem Pumpe-Sonde-Ansatz induzierten. Polyimid-Folie-Lichtdurchlässigkeit für die Pumpe Laser muss aufgeklärt werden und alternativ optisch klar Polyimid oder COC genutzt werden. Die aktuellen mikrofluidischen Geometrien erlauben keine Substrat mischen Experimente, nachdem die Kristalle gewachsen sind. Wir erwarten jedoch, dass die beschriebenen Röntgen Chip Herstellung Protokoll auch für solche Entwürfe für beide Zeitaufgelöste Röntgenbeugung mischen sowie Streuung Ansätze19geeignet.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde unterstützt vom PIER Seed Fonds PIF-2015-46, das BMBF gewährt, 05K16GUA und 05K12GU3 und des Exzellenzclusters "The Hamburg Zentrum für ultraschnelle Imaging – Struktur, Dynamik und Kontrolle der Materie auf atomarer Skala" der deutschen Forschungsgemeinschaft (DFG). Die Arbeit der Autoren verbunden mit dem Center for Free-Electron Laser Science wurde von der Helmholtz-Gemeinschaft durch orientierte Fördermittel finanziert. Die Synchrotron MX Daten wurden am Strahlrohr P14 betrieben von EMBL Hamburg bei PETRA III-Speicherring (DESY, Hamburg, Deutschland).
Materialien
| Name | Company | Catalog Number | Comments |
| SU-8 3000 Series | MicroChem Corp. | SU-8 3000 | Photoresist |
| PGMEA | Sigma-Aldrich | 484431 | Developer |
| Isopropyl alcohol | Solvent | ||
| Ethanol | Solvent | ||
| Epoxy glue | UHU | Plus Schnellfest 5 min | Epoxy glue |
| PDMS | Dow Corning | Sylgard 184 | Silicone |
| Kapton foil | Dupont/ American Durafilm | HN grade, gauge 30 (7.5 μm) | polyimide foil |
| APTS | Sigma-Aldrich | 440140 | Chemical |
| GPTS | Sigma-Aldrich | 440167 | Chemical |
| Cytop CTX-109AE | Asahi Glass Co. Ltd | Cytop CTX-109AE | Cytop fluoropolymer coating |
| CT-Solv 100E | Asahi Glass Co. Ltd | CT-Solv 100E | Cytop fluoro-solvent |
| HFE-7500 | 3M | Novec 7500 | Fluorinated oil |
| AutoCAD | AutoDesk Inc. | AutoCAD | CAD Software |
| Biopsy Punch | Harris | Uni-core 0.75 mm | |
| Photo mask | JD Photo Data | ||
| 3 inch wafer | University Wafer | Silicon wafer | |
| Mask aligner | SÜSS MicroTec | MJB4 | Mask aligner |
| PDMS mixer | Thinky | ARE-250 | |
| Plasma machine | Diener electronic | Zepto | |
| Thaumatin | Sigma Aldrich | T7638 | Protein |
| Glucose Isomerase | Hamton Research | HR7-102 | Protein |
| Bis-Tris | Sigma Aldrich | B9754 | Chemical |
| Sodium Tartrate | Merck | 106664 | Chemical |
| Tris-HCl | Sigma Aldrich | 10812846001 | Chemical |
| HEPES | Carl Roth | 6763.2 | Chemical |
| Magnesium Chloride | Sigma Aldrich | 208337 | Chemical |
| Ammonium Sulfate | Sigma Aldrich | A4418 | Chemical |
| EDTA | Sigma Aldrich | E6758 | Chemical |
| Sodium Chloride | Sigma Aldrich | 1064060250 | Chemical |
| PEG1500 | Molecular Dimensions | MD2-100-6 | Chemical |
| SPG buffer | Jena Bioscience | CSS-389 | Chemical |
| SpectroLight600 | XtalConcepts | DLS Instrument | |
| Nanodrop | Thermo Scientific | Spectrophotometer | |
| Zentrifuge | Eppendorf | ||
| Ultimaker2 | Ultimaker | 3D printer | |
| Form2 | Formlabs | 3D printer | |
| Amicon Filter | Sartorius Stedim | 0.2 µm filter | |
| Tubing | Adtech Polymer Engineering Ltd | Bioblock/05 | PTFE tubing 0.3 mm Inner Diameter x 0.76 mm Outer Diameter |
| Syringes | BD | 309628 | 1ml Luer-Lock Tip |
| Needle | Terumo Agani Needle | AN*2716R1 | 27Gx5/8" |
Referenzen
- Rasmussen, B. F., Stock, A. M., Ringe, D., Petsko, G. A. Crystalline ribonuclease A loses function below the dynamical transition at 220 K. Nature. 357 (6377), 423-424 (1992).
- Tilton, R. F. J. R., Dewan, J. C., Petsko, G. A. Effects of temperature on protein structure and dynamics: X-ray crystallographic studies of the protein ribonuclease-A at nine different temperatures from 98 to 320 K. Biochemistry. 31 (9), 2469-2481 (1992).
- Fraser, J. S., Clarkson, M. W., Degnan, S. C., Erion, R., Kern, D., Alber, T. Hidden alternative structures of proline isomerase essential for catalysis. Nature. 462 (7273), 669-673 (2009).
- Juers, D. H., Matthews, B. W. The role of solvent transport in cryo-annealing of macromolecular crystals. Acta Crystallogr. D. 60 (Pt 3), 412-421 (2004).
- Huang, C. Y., et al. In meso in situ serial X-ray crystallography of soluble and membrane proteins. Acta Crystallogr. D. 71 (Pt 6), 1238-1256 (2015).
- Gati, C., et al. Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser. P. Natl. Acad. Sci. USA. 114 (9), 2247-2252 (2017).
- Gati, C., et al. Serial crystallography on in vivo grown microcrystals using synchrotron radiation. IUCrJ. 1 (Pt 2), 87-94 (2014).
- von Dreele, R. B. Multipattern Rietveld refinement of protein powder data. J. Appl. Crystallogr. 40 (1), 133-143 (2007).
- Cherezov, V. Lipidic cubic phase technologies for membrane protein structural studies. Curr. Opin. Struct. Biol. 21 (4), 559-566 (2011).
- Gati, C. Data processing and analysis in serial crystallography at advanced X-ray sources. , Dissertation, Hamburg (2015).
- Stellato, F., et al. Room-temperature macromolecular serial crystallography using synchrotron radiation. IUCrJ. 1 (Pt 4), 204-212 (2014).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallogr. D. 71 (Pt 2), 387-397 (2015).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (Pt 2), 168-176 (2015).
- Martin-Garcia, J. M., Conrad, C. E., Coe, J., Roy-Chowdhury, S., Fromme, P. Review: Serial femtosecond crystallography: A revolution in structural biology. Arch. Biochem. Biophys. 602, 32-47 (2016).
- White, T. A., et al. CrystFEL: A software suite for snapshot serial crystallography. J Appl Crystallogr. 45 (2), 335-341 (2012).
- Perry, S. L., et al. A microfluidic approach for protein structure determination at room temperature via on-chip anomalous diffraction. Lab Chip. 13 (16), 3183-3187 (2013).
- Schlichting, I. Serial femtosecond crystallography: the first five years. IUCrJ. 2 (Pt 2), 246-255 (2015).
- Sui, S., Perry, S. L. Microfluidics: From crystallization to serial time-resolved crystallography. Struct. Dynam.-US. 4 (3), (2017).
- Ghazal, A., Lafleur, J. P., Mortensen, K., Kutter, J. P., Arleth, L., Jensen, G. V. Recent advances in X-ray compatible microfluidics for applications in soft materials and life sciences. Lab Chip. 16 (22), 4263-4295 (2016).
- Heymann, M., et al. Room-temperature serial crystallography using a kinetically optimized microfluidic device for protein crystallization and on-chip X-ray diffraction. IUCrJ. 1 (Pt 5), 349-360 (2014).
- Schubert, R., et al. A multicrystal diffraction data-collection approach for studying structural dynamics with millisecond temporal resolution. IUCrJ. 3 (Pt 6), 393-401 (2016).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nat. Commun. 5, 3309(2014).
- Conrad, C. E., et al. A novel inert crystal delivery medium for serial femtosecond crystallography. IUCrJ. 2 (Pt 4), 421-430 (2015).
- Cohen, A. E., et al. Goniometer-based femtosecond crystallography with X-ray free electron lasers. P. Natl. Acad. Sci. USA. 111 (48), 17122-17127 (2014).
- Erskine, D., YU, P. Y., Freilich, S. C. High-Pressure Visible Spectroscopy of Polyimide Film. J. Polym. Sci. Pol. Lett. 26 (11), 465-468 (1988).
- Tsai, C. -L., Yen, H. -J., Chen, W. -C., Liou, G. -S. Novel solution-processable optically isotropic colorless polyimidothioethers-TiO2 hybrids with tunable refractive index. J. Mater. Chem. 22 (33), 17236-17244 (2012).
- Destremaut, F., Salmon, J. -B., Qi, L., Chapel, J. -P. Microfluidics with on-line dynamic light scattering for size measurements. Lab Chip. 9 (22), 3289-3296 (2009).
- Chastek, T. Q., Iida, K., Amis, E. J., Fasolka, M. J., Beers, K. L. A microfluidic platform for integrated synthesis and dynamic light scattering measurement of block copolymer micelles. Lab Chip. 8 (6), 950-957 (2008).
- Heymann, M., Fraden, S., Kim, D. Multi-Height Precision Alignment With Selectively Developed Alignment Marks. J. Microelectromech. S. 23 (2), 424-427 (2014).
- Schubert, R., et al. Reliably distinguishing protein nanocrystals from amorphous precipitate by means of depolarized dynamic light scattering. J Appl Crystallogr. 48 (5), 1476-1484 (2015).
- Aghvami, S. A., et al. Rapid prototyping of cyclic olefin copolymer (COC) microfluidic devices. Sensor Actuat. B-Chem. 247, 940-949 (2017).
- Walker, J. M. The Proteomics Protocols Handbook. , Humana Press Inc. Totowa, NJ. (2005).
- Kabsch, W. XDS. Acta Crystallogr D. 66 (Pt 2), 125-132 (2010).
- Vagin, A., Teplyakov, A. Molecular replacement with MOLREP. Acta Crystallogr. D. 66 (Pt 1), 22-25 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallogr. D. 67, 235-242 (2011).
- Murshudov, G. N., et al. REFMAC5 for the refinement of macromolecular crystal structures. Acta Crystallogr. D. 67 (Pt 4), 355-367 (2011).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallogr. D. 66 (Pt 4), 486-501 (2010).
- Owen, R. L., et al. Exploiting fast detectors to enter a new dimension in room-temperature crystallography. Acta Crystallogr. D. 70 (Pt 5), 1248-1256 (2014).
- Kabsch, W. Automatic-Indexing of Rotation Diffraction Patterns. J. Appl. Crystallogr. 21, 67-71 (1988).
- Zarrine-Afsar, A., et al. Crystallography on a chip. Acta Crystallogr. D. 68 (Pt 3), 321-323 (2012).
- Boukellal, H., Selimović, S., Jia, Y., Cristobal, G., Fraden, S. Simple, robust storage of drops and fluids in a microfluidic device. Lab Chip. 9 (2), 331-338 (2009).
- Aghvami, S. A., et al. Rapid prototyping of cyclic olefin copolymer (COC) microfluidic devices. Sens. Actuator B Chem. 247, 940-949 (2017).
- Shemesh, J., et al. Stationary nanoliter droplet array with a substrate of choice for single adherent/nonadherent cell incubation and analysis. Proc. Natl. Acad. Sci. USA. 111 (31), 11293-11298 (2014).
- Sun, M., Bithi, S. S., Vanapalli, S. A. Microfluidic static droplet arrays with tuneable gradients in material composition. Lab Chip. 11 (23), 3949-3952 (2011).
- Shim, J. -U., et al. Control and measurement of the phase behavior of aqueous solutions using microfluidics. J. Am. Chem. Soc. 129 (28), 8825-8835 (2007).
- Schubert, R., Meyer, A., Baitan, D., Dierks, K., Perbandt, M., Betzel, C. Real-Time Observation of Protein Dense Liquid Cluster Evolution during Nucleation in Protein Crystallization. Cryst. Growth Des. 17 (6), 3579(2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten