Method Article
Chips microfluídicos por difração de raio x de cristal In Situ e In Situ Difusão dinâmica da luz de cristalografia de Serial
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve em detalhes como fabricar e operar dispositivos microfluídicos para coleta de dados de difração de raios x em temperatura ambiente. Além disso, descreve como monitorar a cristalização de proteínas por difusão dinâmica da luz e como processar e analisar obtidos dados de difração.
Resumo
Este protocolo descreve a fabricação dispositivos microfluídicos com baixo fundo de raio-x, otimizado para goniômetro baseado cristalografia serial alvo fixo. Os dispositivos são padronizados de cola epóxi usando litografia macia e são adequados para em situ experimentos de difração de raios x em temperatura ambiente. Os poços da amostra são pálpebras de ambos os lados com janelas de folha de poliimida poliméricos que permitem a coleta de dados de difração com baixo fundo de raio-x. Este método de fabricação é pouco exigente e barato. Após a aquisição de um wafer de mestre SU-8, todos de fabricação pode ser concluída fora de uma sala limpa em um ambiente de laboratório de pesquisa típico. O protocolo de projeto e fabricação de chip utilizam válvulas capilar para dividir uma reação aquosa em gotículas de nanolitros definido tamanho de microfluidically. Este mecanismo de carregamento evita a perda de amostra de mortos-volume do canal e pode facilmente ser executado manualmente sem o uso de bombas ou outros equipamentos para atuação de fluido. Descrevemos como isolado de nanolitros de tamanho de gotas de solução de proteína pode ser monitorado em situ pela luz dinâmica dispersando a nucleação de cristais de proteína de controle e crescimento. Depois de cristais apropriados são cultivadas, conjuntos de dados de difração de raio-x completo podem ser coletados usando goniômetro baseado em situ fixada alvo serial cristalografia de raios x em temperatura ambiente. O protocolo fornece scripts personalizados para processar difração de conjuntos de dados utilizando um conjunto de ferramentas de software para resolver e refinar a estrutura de cristal da proteína. Essa abordagem evita os artefatos possivelmente induzidos durante a crio-preservação ou cristal manual em experimentos de cristalografia convencional de manipulação. Apresentar e comparar três estruturas de proteína que foram resolvidas usando pequenos cristais com dimensões de aproximadamente 10-20 µm crescido no chip. Por cristalização e diffracting em situ, manuseio e, portanto, mecânica distúrbios de cristais frágil é minimizado. O protocolo detalha como fabricar um chip personalizado radiografia microfluidic transparente adequado para em situ serial cristalografia. Como quase todos os cristais podem ser usados para coleta de dados de difração, esses chips microfluídicos são um método de entrega de cristal muito eficiente.
Introdução
Conhecer a estrutura 3D de uma proteína é essencial para compreender a sua funcionalidade. Estruturas de resolução atômica perto até agora são mais comumente obtidas por cristalografia de raios x. Esta técnica apresenta cristais de proteína à radiação de raios-x e os padrões de difração resultantes são então analisados para refinamento e determinação da estrutura. No tradicional cristalografia de raios x, um conjunto de dados completo de difração é gravado de um cristal único, idealmente grande, em temperaturas criogênicas. Tais cristais, no entanto, em sua maioria não são triviais para crescer, e identificar as condições de crio-preservação adequada pode se tornar um desafio em si mesmo e às vezes também pode causar desvios da estrutura nativa da proteína5.
Recentes avanços tecnológicos em laser de elétrons livres de raio-x (FEL) e de luz síncroton síncrotron permitiram resolver estruturas de cristais menores, como de luz síncroton novos microfoco, brilho do feixe maior raio-x e detectores de raio x melhorados tornou-se disponível6,7. Normalmente, pequenos cristais são mais fáceis de crescer do que grande e cristais livre8,9de defeitos. No entanto, pequenos cristais sofrem danos de radiação de raios-x muito mais rápido do que grandes cristais. Isto é porque em comparação com um grande cristal, uma dose maior de raios-x deve ser projectada em um menor volume de cristal para difração a resolução comparável. Portanto, proteção até criogênica muitas vezes não é suficiente para gravar um conjunto de dados de difração completa de um único microcrystal.
Para superar este obstáculo, cristalografia serial tornou-se o método de escolha para coletar e mesclar os padrões de difração de muitos microcristais aleatoriamente orientados para obter um conjunto de dados completo. Radiação dano induzido cristal é minimizado, espalhando a dose total de raio-x usado para resolver uma estrutura de proteína sobre um elevado número de cristais5,10. Em um ' difração antes que destruam ' FEL experimento, cada cristal é usado apenas para uma exposição usando pulsos de raio-x da femto segundos. Beamlines microfoco em fontes de síncrotron terceiros geração, por sua vez, pode executar serial cristalografia com alguns milissegundos curto raio x exposições11,12,13,14. Sem uma oscilação do cristal ou rotação durante a coleta de dados, no entanto, apenas reflexões de Bragg parciais podem ser gravados e, portanto, dezenas de milhares ou mais padrões de difração são normalmente necessários para a determinação de estrutura15. Até à data, foi desenvolvido um conjunto diversificado de métodos de entrega da amostra para cristalografia serial, como recentemente revisto14,16,17,18,19. Entre aqueles, vários fixo-alvo com base em entrega de amostra estratégias com êxito foram combinadas com rotação de cristal durante exposições de raios-x, tal que significativamente menos padrões de difração podem fornecer igualmente datasets completa enquanto também consome menos amostra em relação a cristalografia série clássica experimentos onde imagens ainda são gravadas7,16,20,21,22,23 , 24.
Apresentamos um protocolo para fabricar dispositivos microfluídicos com baixo fundo de raio-x. Os dispositivos são padronizados de cola epóxi 5-min usando litografia macia e são adequados para experimentos de difração de raios x in situ à temperatura que se beneficiam de integrar a preparação da amostra diretamente a afinação de raio-x, conforme o caso, com estudos de tempo-resolvido que seguem induzida pela mistura cinética18,19. Canais microfluídicos são pálpebras de ambos os lados com folha de poliimida poliméricos, resultando em windows de raio-x com uma espessura combinada de cerca de 16 µm que permitem a baixa imagem de plano de fundo do raio x. Todos os materiais utilizados proporcionam boa resistência solvente. Este método de fabricação é comparativamente simples e barato. Após a aquisição de um wafer de mestre SU-8, todos de fabricação pode ser concluída fora de uma sala limpa em uma configuração de laboratório de pesquisa típico.
Um exemplo de aplicativo, descrevemos fichas para goniômetro baseado cristalografia serial alvo fixo. Em primeiro lugar, as considerações de design e fabricação para usando válvulas capilar para microfluidically dividir uma reação aquosa em um número selecionado de nanolitros tamanho gotículas são discutidas. Este mecanismo de carregamento evita a perda de amostra de mortos-volume do canal e divisão pode facilmente ser executada manualmente sem o uso de bombas ou outros equipamentos para atuação de fluido. Tais nanolitros isolado tamanho gotas de solução de proteína são monitorados em situ usando Difusão dinâmica da luz (DLS) para controle da proteína cristal nucleação e crescimento. Anteriormente foi demonstrado que as medições de DLS podem ser executadas em dispositivos microfluídicos, consistindo de uma estrutura de polidimetilsiloxano (PDMS) ligada a um slide de vidro25,26. Porque a camada de poliimida tem uma transmissão elevada para comprimentos de onda mais de 550 nm, a abordagem pode ser estendida para medições em fichas transparentes de raio-x, bem como, quando usando um comprimento de onda de laser apropriado27,28. Baseado nos resultados DLS, nucleação inicial pode ser observada, e mais evaporação de gotículas pode ser interrompida para obter cristais de proteína menos, mas maior.
Depois de suficientes cristais são cultivadas, conjuntos de dados de difração de raio-x completo então podem ser coletados utilizando goniômetro baseado em situ fixada alvo serial cristalografia de raios x em temperatura ambiente. Conjuntos de dados de difração são processados usando um conjunto de ferramentas de software e scripts personalizados para resolver a estrutura de cristal da proteína. Esta técnica evita artefatos frequentemente induzidos durante a crio-preservação usado em experimentos de cristalografia convencional.
Comparamos três estruturas de destino de proteína que foram resolvidas usando aproximadamente 10-20 µm pequenos cristais crescidos no chip para melhor então 2 resolução Å. Por cristalização e diffracting em situ, manuseio e, portanto, mecânica distúrbios de cristais frágil é minimizado. Este protocolo pode ser aplicado para cristais de proteína que difração de alta resolução, bem como de baixa resolução (1,7 Å de 3.0 Å). Como quase todos os cristais podem ser usados para difração, pequena amostra é desperdiçada, tornando este um método de entrega de cristal muito eficiente.
Este protocolo fornece um guia detalhado sobre como preparar chips microfluídicos transparente de raio-x em situ proteína cristalização e difração de recolha de dados. O procedimento foi cuidadosamente projetado para beneficiar microfluidic precisão sem a necessidade de equipamentos sofisticados no laboratório. Também, coleta de dados para a trajetória de síncrotron pode ser realizada sem a necessidade de um goniômetro especializado ou umidificador para facilitar a reprodução dos resultados por não-especialistas. A técnica apresentada pode ser aplicada para serial milissegundo cristalografia coleção de dados em temperatura mantendo os danos de radiação mínima e sem a introdução de estresse para os cristais após crescimento por manipulação de cryo-proteção ou cristal. Portanto, o método descrito é adequado para qualquer projeto de cristalização de proteínas.
Protocolo
1. chip Design e fabricação de mestre
- Desenho de máscara
- Esboço de geometrias de canal desejado usando um adequado programa de desenho CAD. Para cada camada de fotorresiste, prepare uma máscara individual. Todos os projetos usados no presente protocolo são discutidos em detalhes na seção de resultados e estão disponíveis como AutoCad '. DWG' formato do arquivo complementar 1.
Nota: Para a construção de dispositivos de todos-PDMS, a proporção de altura e largura de canal não deve exceder 01:10 para evitar o colapso do canal. Tanto folha de poliamida e resina epóxi curadas são mais resistentes e em princípio devem permitir também maiores proporções. No entanto, nós propositadamente não fosse superior a 01:10 proporção, então que inicial de projetos poderia ser como dispositivos tradicionais de PDMS protótipo. - Traduza arquivos CAD em emulsão filme máscaras. Use a resolução nominal 64 k DPI para permitir que recursos precisos até cerca de 5 µm de tamanho.
Nota: Isto pode ser feito através de um serviço comercial. Serviços de imagem pode preferir diferentes convenções de desenho para simplificar a conversão de arquivos para a imagem latente de máscara. Por favor, inquira sobre as convenções de desenho preferidas adiantado para evitar laboriosa de problemas durante a conversão. Máscaras com características transparentes no fundo preto serão padrão SU8 fotorresiste recursos para a bolacha de rendimento funcional PDMS microcanais durante a moldagem de réplica. Por sua vez, características pretas em máscaras de fundo transparente são necessários para preparar moldes PDMS apropriado para fabricação de chip de raio-x. Recomendamos encomendar as duas polaridades de máscara para permitir a validação precoce de prototipagem e projeto fabricar dispositivos PDMS antes traduzindo o projeto em fichas de raio-x.
- Esboço de geometrias de canal desejado usando um adequado programa de desenho CAD. Para cada camada de fotorresiste, prepare uma máscara individual. Todos os projetos usados no presente protocolo são discutidos em detalhes na seção de resultados e estão disponíveis como AutoCad '. DWG' formato do arquivo complementar 1.
- SU8 fabricação de mestre
Nota: Este é o único processo que precisa ser executada em uma sala limpa. Se equipamento crítico cleanroom não estiver disponível, o passo completo pode ser terceirizado para empresas de serviços de fundição de MEMS que entregam pronto modelado SU8 mestres. SU8 processo de acordo com a instrução de folha de dados. Etapas 1.2.1 a 1.2.4 resumem o geral SU8 mestre fabricação de fluxo de trabalho, com os parâmetros completos para o projeto de microplaqueta de raio-x da três-camada listados na tabela 1. Uma introdução às várias camadas SU8 alinhamento tem sido publicadas anteriormente29.- Despeje cerca de 1 mL de SU8 resistir, para o casaco de bolacha e rotação de 3 polegadas, o SU8 até a espessura desejada, usando a velocidade de centrifugação adequado e tempo conforme especificado na tabela 1 (Figura 1, etapa 1). Pré-Asse o fotorresiste de acordo com a espessura de camada a 65 ° C e 95 ° C por alguns minutos cada. Execute o pre-Asse para solidificar a SU8 para impedir que ele degola para a Fotomáscara e para melhorar a aderência de resistir ao substrato (Figura 1, passo 2).
- Expor o fotorresiste à luz UV, conforme especificado na tabela 1 seguido de um pós-exposição-asse a 95 ° C para completar cataliticamente a é que é iniciada durante a exposição (Figura 1, etapa 3).
- Repita essas etapas para cada camada subsequente. Então, alinhe as máscaras de camada subsequente com o mestre usando um alinhador de máscara e de marcas de alinhamento de compasso de calibre Vernier29.
- Lave todos os SU8 não expostos resistir desenvolvendo a hóstia em propileno glicol acetato de éter metílico (PGMEA), até o isopropanol lavagem já não revela precipitação leitosa (Figura 1, etapa 4). Seque a bolacha com nitrogênio pressurizado.
Nota: Isopropanol é um solvente pobre para SU8 e sua precipitação indica residual permanece não polimerizado.
- Fabricação do molde PDMS
- Coloque um pedaço de papel alumínio (15 × 15 cm) em uma placa de Petri (10 cm) e o mestre de SU8 para a folha de alumínio para o prato de Petri para facilitar a remoção do mestre após a cura de PDMS.
- Misturar a base de silicone com agente (10:1), resultando em um total de 25 g, vigorosamente com uma espátula em uma jarra ou um misturador mecânico de cura. Uma bolacha de 3 polegadas em uma placa de Petri (10 cm) consome cerca de 25 g de PDMS para resultar em uma laje de espessura de 5 mm.
- Despeje o PDMS pré-mistura para o SU8-mestre (Figura 1, etapa 5) para uma altura de 4 mm. Desiccate o PDMS por 5 min para remover bolhas de ar até que não, ou somente algumas bolhas permanecem na superfície do PDMS.
- Cure o PDMS em estufa a 70 ° C durante 1 h. Então corte o PDMS curado com um bisturi e descasque delicadamente o molde PDMS com o mestre SU8 (Figura 1, etapa 6). Corte todo o caminho até o mestre para impedir PDMS rachaduras durante o descascamento.
- Opcional: Prepare fatias transversais dos moldes PDMS confirmar que todas as SU8-camadas no mestre a espessura desejada (Figura 1). Início microfluidic canal layout teste pode ser executado em todas as fichas PDMS.
Nota: Uma réplica-moldados PDMS pode ser ligado diretamente a um substrato de vidro depois perfurando portas de acesso (passo 3.3) no PDMS através da ativação de plasma2 O usando 20 s, 0,4 mbar O2, 50 W, 13,56 MHz. Conforme observado na seção 1.2., isso requer oposta polaridade de máscara e wafer, portanto, estrutura de tópicos para fabricação de chip de raio-x.
2. in Situ fabricação de Chip de raio-x
- Dilua ambos precursores de resina epóxi em etanol a uma concentração final de etanol de 40% em peso. Uma massa total de 0,25 g de cada precursor de resina epóxi em etanol é suficiente para um único chip de 1 cm2 .
Nota: Isto reduz a viscosidade resultante resina epoxi 5 min para simplificar sem bolhas de mistura e réplica-molde fundição e para minimizar a espessura da camada final de epóxi curado de. O etanol evapora através do PDMS durante a etapa de polimerização. - Desgaseifica o molde PDMS num exsicador de vácuo por 30 min, para que ele possa absorver pequenas bolhas partir da resina de cola epoxy durante a etapa de moldagem.
- Corte a folha de poliimida para cerca de 70 × 70 mm e extensão ao redor de um 75 x 50 milímetros de vidro slide usando a fita para obter uma superfície plana e rígida com a fita na parte de trás. Plasma ativar a folha com 50 W, 13,56 MHz, 0,4 mbar O2 plasma por 20 s, então Incubar o folha completo-slide em uma solução aquosa de 1 vol % (3-aminopropil) trimethoxysilane (APTS) ou trimethoxysilane (3-glycidyloxypropyl) (GPTS) por 5 min a 20 ° C.
- Misture as duas soluções de precursor de epóxi etanol diluído para garantir o comportamento ideal de curando. Recuperar o PDMS-moldes da câmara de vácuo e colocá-los em uma superfície plana. Em seguida, rapidamente dispensar uma gota de resina mista em cada microestrutura sobre o molde usando uma micropipeta (cerca de 10 µ l por 1 cm2 de microestruturas) (Figura 1, 7a etapa).
- Recupere o sanduíche de folha-slide de poliimida da solução aquosa de silano (APTS ou GTPS). Seca a folha com ar comprimido ou nitrogênio.
- Coloque o sanduíche de folha-lâminas de poliimida preparado para a resina epóxi depositado (Figura 1, etapa 7b). Pressione firmemente a lâmina de vidro anexada para a folha de poliimida contra o molde PDMS. Coloque uma folha de metal para a lâmina de vidro e então depósito pesos a pressão até 1,4 N/cm2 para 1 h, enquanto as curas de resina epóxi em temperatura ambiente.
Nota: Idealmente, sem resina permanece sobre a folha nas áreas onde as estruturas no molde têm a altura máxima. Elas correspondem aos poços de cristalização, onde a cristalização ocorre depois.- Opcional: Se molde exato das características pequenas é crítico, o molde PDMS pode ser reforçado com um frame de alumínio durante a moldagem passo31.
- Remova a lâmina de vidro com película de poliimida e o epóxi modelado por descascá-la do molde PDMS (Figura 1 passo 8). Plasma ativar ao lado de epóxi estampados com 50 W, 13,56 MHz, 0,4 mbar O2 plasma por 20 s.
- Após a remoção da película de poliimida da câmara de plasma, incubar a película epóxi-modelados em vol. 1% aquosa APTS (ou GPTS) solução por 5 min a 20 ° C. Da mesma forma, prepare uma segunda folha de poliimida un-estampados com complementares 1 vol % GPTS (ou aptos) silano ativação. Após a incubação, seco da folha estruturada e com ar pressurizado.
- Posicione a face lateral epóxi para cima sobre uma superfície plana, usando a tensão de superfície de uma gota de água por baixo como um mediador para evitar ondulação da película e para garantir a máxima planicidade. Em seguida, coloque a segunda folha de poliimida registrados na parte superior e suavemente raia com o dedo de um canto para o oposto para torná-los a criar laços e evitar a formação de bolhas.
3. acesso portas para entrega fluida
- Prepare 4 mm espessura lajes PDMS em uma placa de Petri de acordo com passos 1.3.1 a 1.3.3 sem usar o SU8-mestre. Corte a laje em blocos de PDMS de tamanho adequado para cobrir todas as portas de entrada no chip, sem cobrir os compartimentos individuais de cristalização do chip.
- Plasma ativar ambos, o chip e o PDMS bloco em 50 W, 13,56 MHz, 0,4 mbar O2 plasma por 20 s. Para ligação química, então incubar cada parte em 1 vol % APTS ou GPTS solução aquosa por 5 min a 20 ° C. Secar cada parte com ar pressurizado e pressione a laje PDMS para o chip da folha.
- Para melhorar a ligação, coloque o chip em uma laje plana de PDMS e cubra com uma folha de plástico, seguida por uma lâmina de vidro limpa e um bloco de metal. Finalmente, depósito de pesos para pressionar até 1,4 N/cm2 para cerca de 1 h.
- Buracos de acesso com um soco de biópsia de 0,75 mm em cada posição onde portas de entrada e saída são marcadas no design do chip e Selem a volta com a fita. O chip agora é acessível para qualquer tubo com um diâmetro exterior igual o diâmetro do furo (conforme detalhado na etapa 4.2).
4. tratamento de superfície
- Preparar um 01:20 diluição de 9 wt % fluoropolímero das ações fluoro-solvente para uma concentração final de 0,45% em peso. Armazenar as soluções padrão e diluições em um frigorífico no escuro a 4 ° C.
- Carregar as 01:20 fluoropolímero diluição em uma seringa de 1 mL Luer-lock. Anexar um 27 × 5/8" a agulha da seringa e, em seguida, um tubo de PTFE para a agulha.
- Ligar o tubo à saída da microplaqueta de raio-x e injetar a solução fluoropolímero preparada no passo 4.1 até que todos os canais são preenchidos.
- Coloque o chip com o lado liso para baixo em um prato quente de 190 ° C por 5 min evaporar o solvente todas para depositar o fluoropolímero em um revestimento de película fina.
Nota: Ao usar uma nova geometria, verifique se os canais estavam entupidas com fluoropolímero durante este processo de revestimento. Se assim for, mais Dilua a solução-mãe.
5. preparação de proteína
- Pesar a Taumatina liofilizada e dissolvê-lo em uma solução tampão listada na tabela 2 , para o volume adequado para obter uma concentração final de proteínas de 40 mg mL-1.
- Dialize glicose isomerase contra o buffer listado na tabela 2 , de acordo com o protocolo do fabricante.
- Prepare a proteína tioredoxina conforme descrito anteriormente por Schubert et. al. 30.
- Verifique se as concentrações de proteína final por fotometria utilizando os coeficientes de extinção resumidos na tabela 2, calculados pelo software ProtParam32.
- Preparar todas as soluções usando água ultrapura e filtrá-los com um filtro de 0,2 µm.
- Centrifugar as soluções de proteína a 20 ° C por 15 min a 16100 x g e levar o sobrenadante para experimentos de cristalização.
6. a proteína cristalização no Chip de raio-x
- Para cristalizar proteínas em chips microfluídicos, Misture quantidades iguais de solução de proteína e solução precipitant. Concentração de proteína, a composição do tampão e a composição precipitant estão resumidos na tabela 2. Prepare um volume total de cerca de 20 µ l para preencher um chip microfluidic.
- Imediatamente após a mistura, injetar a solução na porta de entrada do chip através de uma seringa, acoplado a um 27 × 5/8" agulha e tubo de PTFE com 0,75 mm de diâmetro exterior (detalhada na etapa 4.2).
Nota: O procedimento de enchimento para o layout serial requer uma preparação prévia do chip com óleo fluorado, que é mais fácil feito por carregar o óleo fluorado da porta de saída antes de injectar a solução de cristalização através da porta de entrada. Todas as etapas de carregamento devem ser monitoradas usando um microscópio para controlar a pressão aplicada a seringa e a taxa de fluxo correspondente." - Depois que o chip está cheio, separe os compartimentos individuais cristalização injetando óleo fluorado na porta de entrada do chip. Sele o chip, bloqueando todas as portas de entrada e saída do chip. Isso pode ser feito através da inserção de um clipe de papel.
Nota: Porque os compartimentos de cristalização são preenchidos pela solução de proteína/dessensibilizador, o óleo fluorado apenas preenche o canal de entrada do chip, sem afetar a solução em compartimentos a cristalização. - Para simular a cinética de cristalização de difusão de vapor, coloque o chip lacrado em temperatura ambiente e atmosfera normal para permitir que a gota no compartimento de cristalização para encolher por evaporação de água através da folha de poliimida.
- Depois de cristal formação é observada através de um microscópio ou medições DLS (passo 7), transferir o chip microfluidic completa para a solução de precipitant apropriada, para parar mais evaporação dos poços de cristalização até a difração de raios x experiência é realizada.
7. dinâmica espalhamento luz medições em poços de cristalização em Chip
Nota: DLS medições foram feitas com uma potência de saída do laser de 100 mW, comprimento de onda de 660 nm e a luz espalhada foi detectado em um ângulo de dispersão de 142°. Porque todas as soluções de amostra investigada foram aquosas o índice de refração da água (n = 1,33) foi usado em todos os cálculos.
- Lugar do microfluidic o chip no suporte de placa de formato SBS do instrumento usando o adaptador descrito no passo 8.1 DLS. Insira o adaptador do dispositivo.
- Cuidadosamente, ajuste o foco de laser no interior de um compartimento do chip microfluidic usando o motorizado x, y, z-estágio. Porque o chip microfluídicos é muito fino, ajuste o nível de z aplicando passos num pequeno incremento.
Nota: Um ajuste correto é confirmado por uma interceptação de alta e uma cauda suave da função de autocorrelação resultante da medição DLS. Um arquivo de calibração pode ser criado para coincidir com a posição de cada individual cristalização bem no chip microfluídicos, permitindo medições de DLS automatizadas em diversos compartimentos ao longo do tempo. - Realizar cada medição DLS a 293 K por 30 s e repetir a cada 5min até ao final do experimento cristalização de medição.
Nota: A nucleação inicial pode ser seguida pela distribuição de raio das medições DLS ao longo do tempo e formação de cristal bem sucedida pode em paralelo seja seguida o microscópio embutido do leitor placa DLS.
8. difração coleta de dados
- Adaptadores para beamline goniómetro
- Imprima os adaptadores para o goniômetro de placa para posicionar e girar os chips de raio-x durante a coleta de dados cristalográficos.
- Fabrica os adaptadores para o goniômetro base em uma impressora 3D da passatempo-classe usando as configurações de parâmetro padrão, conforme recomendado pelo fabricante.
Nota: Os adaptadores foram projetados usando um sistema 3D-CAD e os arquivos coordenados dos adaptadores são anexados em '. STL'-formato de arquivo no suplemento. - Corrigi as fichas de raio-x para o adaptador usando fita dupla face.
-
Cristalografia de raios x em situ
- Coletar dados de difração usando um tamanho de feixe de 10 × 5 µm (FWHM do perfil gaussiano) em 296 K. usar raios-x com uma energia de 12,8 keV e um fluxo de 2,2 · 1011 fótons · s-1 no feixe atenuado e padrões de difração registro usando um detector de pixel de híbrido de 6m de Pilatus.
Nota: Microfluidic dispositivos contendo Taumatina, cristais de glicose isomerase ou tioredoxina são utilizados para em situ raio x cristalográficos experimentos na trajetória do EMBL P14 de sincrotrão a PETRA III. Fluxo e tamanho do foco feixe disponíveis podem ser diferentes em outras fontes de raios-x. O número de cristais de proteína expostos, o número de padrões de difração, gravado a partir de cada cristal, a escala de ângulo de oscilação por exposição e o tempo de exposição está resumido na tabela 3. - Processo de conjuntos de dois padrão de difração consecutivos individualmente, usando o programa XDS33. Use o script bash "xds.sh" encontrado no suplemento.
- Criar arquivos HKL para cada conjunto de dados de todos os cristais e dimensioná-los usando o software XSCALE33. Use o script bash "xscale.sh" no suplemento para criar um arquivo de entrada para XSCALE.
Nota: Apenas os conjuntos de dados de cristais que têm coeficientes de correlação superiores a 90%, o que indica um alto grau de isomorfismo, devem ser escalados. O critério conservador ‹I/σ (I) › (> 2) deve ser usado para determinar o shell de resolução mais alta. Substituição molecular usando o programa MOLREP34 o CCP4 suíte35 pode ser usada para obter as fases para mais modelo de construção usando as coordenadas 3D de banco de dados da proteína (PDB) mostrado na tabela 3. - Refinar todas as estruturas desvendar usando Refmac535,36 e usar COOT37 para inspeção visual do modelo final.
Nota: As moléculas de solventes devem ser adicionadas automaticamente durante o processo de refinamento e precisam ser verificados para confirmar posições quimicamente razoáveis. Todos os modelos devem ser inspecionados para identificar valores atípicos de robalo.
- Coletar dados de difração usando um tamanho de feixe de 10 × 5 µm (FWHM do perfil gaussiano) em 296 K. usar raios-x com uma energia de 12,8 keV e um fluxo de 2,2 · 1011 fótons · s-1 no feixe atenuado e padrões de difração registro usando um detector de pixel de híbrido de 6m de Pilatus.
9. dados avaliação
- Danos de radiação
- Analise a decadência do poder de difração ao longo do tempo usando um método descrito por Owen et al.38. Para isso, calcule o montante total de I/σ(I) (fornecido pelo XDS33) de todas as reflexões indexadas de cada conjunto de dados de difração avaliados (2 padrão de difração consecutivos), para usar como um valor de referência. Use o script bash "ISigma.sh" do suplemento.
- Normalize o poder de difração de cada conjunto de dados para o poder de difração média do primeiro conjunto de dados.
- Analise a alteração dos valores de Rmeas ao longo do tempo, tendo os valores de Rmeas de Correct.LP arquivos obtidos de XDS33 (script bash "Rmeas.sh" do suplemento).
- Orientação de cristal
- Determine os ângulos de Euler para obter informações sobre a distribuição das orientações em relação ao sistema de coordenadas de laboratório lattice de cristal. Calcule os ângulos de Euler da matriz de orientação XDS dado no arquivo de saída XPARM39 , utilizando o software Matlab. Use o script bash "rotation_matrix.sh" para extrair a matriz de rotação de cada cristal do arquivo XPARM. Use o arquivo de saída como entrada em Matlab para calcular os ângulos de Euler, usando o Matlab função rotro2eu.m (arquivo complementar).
Nota: Uma descrição detalhada do cálculo foi publicada pela Zarrine-Joseildo et al.40. - Converta os ângulos de Euler obtidos de radianos em graus. Os ângulos de Euler obtidos para todos os planos de rotação de três (xy, xz e zy) em classes de 10° de grupo e parcela-las usando o software Origin9.
- Determine os ângulos de Euler para obter informações sobre a distribuição das orientações em relação ao sistema de coordenadas de laboratório lattice de cristal. Calcule os ângulos de Euler da matriz de orientação XDS dado no arquivo de saída XPARM39 , utilizando o software Matlab. Use o script bash "rotation_matrix.sh" para extrair a matriz de rotação de cada cristal do arquivo XPARM. Use o arquivo de saída como entrada em Matlab para calcular os ângulos de Euler, usando o Matlab função rotro2eu.m (arquivo complementar).
Resultados
Epóxi é um material de enchimento excelente para fabricação de chip de raio-x. É barato, simples e robusto para o processo, sem a necessidade de ferramentas especializadas (Figura 1). Reduzir a viscosidade da cola epoxy diluindo-a com 40 wt % de etanol facilitou a remoção do excesso de resina acima do poço de cristalização, resultando em windows definidos de raio-x. Diluições de etanol superiores resultaram em defeitos na resina curada. Através da análise de secções transversais de microplaqueta do raio-x, determinamos a espessura total da janela de ambos os lados para ser aproximadamente 19 µm de espessura, que é muito próximo a espessura nominal das películas de poliimida usado de 2 × 7,5 µm (Figura 2)
Ensaios de cristalização foram isolados em vários nanolitros tamanho reação compartimentos cada, usando um mecanismo de válvula capilar, conforme descrito anteriormente,41. Esta técnica de carregamento 'loja-então-criar' evita a perda de amostra de mortos-volume do canal e pode facilmente ser executada manualmente, eliminando a necessidade de usar bombas ou outros equipamentos para atuação fluido42. O chip é preparado com óleo fluorado antes de carregar a amostra aquosa. A tensão superficial na interface entre óleo de escorva e amostra aquosa resulta em uma diferença de pressão através da interface óleo-água. Esta pressão de Laplace depende tanto o raio de curvatura e a tensão superficial da interface. Para minimizar sua energia, a interface deve minimizar a sua superfície, que é equivalente a maximizar seus principais raios de curvatura no volume constante. Uma interface de curvatura baixo em um canal de largura tem uma pressão mais baixa de Laplace, em seguida, uma interface de curvatura alta em um segmento de canal estreito. Portanto, a tomada de amostra preferencialmente entra e flui através de toda a ignorar o canal ao invés de fluir através de restrições a estreita válvula capilar. Finalmente, a tomada de amostra é seguida por óleo fluorado para separar os poços da amostra em gotículas independentes.
Robusto e confiável de carregamento foi alcançado com vazões de até 1 mL/h em ambos, uma série e um arranjo bem paralelo (Figura 3). No layout 'serial', bem constrições de válvula de admissão e capilar são sequencialmente conectadas através de um canal de desvio de31. Em contraste, no layout 'paralelo', dois canais separados de principais conectar todas as entradas bem ou capilar válvulas apenas43. Ambos os conceitos de arranjo tem sido previamente combinados com controle de formulação para a composição da tela, que é um aspecto útil na proteína cristalização43,44. O projeto de série tem apenas duas portas fluidas, uma entrada e uma saída. Tem menos líquidos portos e devido a isso, é mais simples de construir e operar. O layout paralelo tem 4 portas fluidas, 2 para o canal principal conectando os poços e 2 para interligar as válvulas capilares para deixar o ar ou fuga de óleo em excesso. Carga possa prosseguir, portanto, de ambos os lados do canal principal. Este layout em geral tem menor resistência de fluxo para um número igual de poços, devido ao seu menor desvio. Portanto, melhor é adequado para dispositivos dimensionado para cima com um elevado número de poços. Além disso, os poços de amostra são orientados mais perto junto, que oferece vantagens para automatizada de imagem.
Exemplo completo bem a carregar foi observado para ambos os layouts, se também construído como uma dois-altura ou um design de três de altura. Em um projeto de dois-altura, ambos bem a amostra e os canais de desvio são da altura igual. O design de três de altura requer uma terceira máscara, uma camada adicional de SU8 e um passo de alinhamento para continuar a garantir que os poços da amostra se tornar maiores do que o anterior desvio de canais. Este diferencial de altura promove entrando de fluido de amostra do poço através do capilar mesmo princípio que impede o fluxo para as constrições de válvulas. Aqui, o teto bem mais elevado corresponde a uma menor pressão de Laplace do avanço do menisco e fluxo ao longo da direção de desvio é favorecida somente depois de poços têm preenchido completamente tal que as constrições de válvula bloqueiam mais fluxo e desviá-lo para baixo o bypass. No entanto, carregamento bem sucedido não requer estritamente os poços mais elevados do que o bypass como válvulas capilar apropriado também podem ser alcançado ajustando larguras de canal em conformidade. No entanto, em nossa experiência, poços de maior realizada significativamente mais robusto e carregamento gratuito de defeito foi observado em até dez vezes caudais mais elevados em todos os designs de três de altura em comparação com seus equivalentes do dois-altura. Este efeito foi mais pronunciado no layout paralelo.
Para simular a cinética de cristalização de difusão de vapor, a permeabilidade finita da película de poliimida foi explorada para controlar a evaporação da água ao longo do tempo. Taxas de evaporação experimental foram quantificadas através do monitoramento a mudança do volume da gota ao longo do tempo, igualando a área de superfície de gota e altura bem (Figura 4). A evaporação dos poços de cristalização no chip de raio-x não proceder de forma linear, como uma área de superfície de encolhimento da gota coincidindo com o aumento de resultados de concentração de soluto em uma taxa de evaporação reduzida ao longo do tempo,45. A evaporação inicial seguiu-se uma taxa de aproximadamente linear de sobre 0,5 nL h-1 em poços da geometria do layout serial.
Para entender melhor a cinética de cristalização, foram realizadas medidas de DLS em poços de cristalização do chip microfluidic. Para medições de DLS iniciais, um chip PDMS colado sobre uma lâmina de vidro foi usado para fornecer melhor propriedades ópticas para o experimento de espalhamento de luz. Este chip tinha as mesmas dimensões bem como a troca de raio-x. PDMS tem uma maior permeabilidade do vapor de água do que a poliamida das janelas poliimida nos raios-x chip45. Desde que o fluxo escala linearmente com a distância, a trajetória de evaporação de uma poliimida em janelas bem pode ser combinada com uma janela PDMS correspondente de espessura apropriada.
DLS resultados mostram que a distribuição de raio muda ao longo do tempo (Figura 4A-B), demonstrando que as medições de DLS permitem para detectar a nucleação inicial antes de primeiras partículas cristalinas são observadas. Esta informação pode ser usada para nucleate e crescer cristais por alvéolo, externamente, ajustando a taxa de evaporação e, portanto, níveis de supersaturação na fase inicial da nucleação46.
O chip de raio-x foi fixado em um adaptador 3D impresso para o goniômetro de placa compatível SBS na trajetória EMBL do síncrotron P14 em PETRA III (Figura 5A). Alternativamente, um menor quadro impresso 3D pode ser usado para fichas de raio-x do monte a trajetória padrão goniómetro21. Taumatina cristais têm um tamanho de 10-20 µm (Figura 5B) e difração até uma resolução de 2.0 Å (Figura 5). Como esperado, a contribuição do fundo de raio-x das duas janelas folhas finas poliimida do chip raio-x é limitada para anéis de dispersão de polímero de poliamida 11 Å (2 θ ~ 5°) e 33 Å (2 θ ~ 1,7 °) para o comprimento de onda de raio-x de 0,97 Å. Estes dois anéis não perturbe o processamento de dados. Foi coletado um total dataset com 83 Taumatina cristais e 10 padrões de difração foram registrados de cada cristal com uma rotação de 1° durante cada quadro. Processamento de dados e parâmetros de refinamento, bem como as estatísticas da Taumatina dataset são listadas e comparadas com dois outros conjuntos de dados de isomerase de glicose e tioredoxina também foram coletados em situ estão listados na tabela 3 e Tabela 4.
O decaimento de intensidade do poder de difração normalizado ao longo do tempo foi investigado por separar o dataset Taumatina em cinco conjuntos de dados sub (dois padrões de difração foram usados por subconjunto para manter conjuntos de dados completos). Como mostrado na Figura 6B, o poder de difração começou a diminuir após o primeiro conjunto de dados sub e estava abaixo de 50% no quarto sub dataset. Como resultado, os valores de Rmeas de sub conjuntos de dados também estão aumentando ao longo do tempo, indicando os danos de radiação de raio-x durante a coleta de dados. Nós hypothesize que os radicais livres gerados durante a exposição de raios-x rapidamente degradam cristais vizinhos no mesmo compartimento reação. Por exemplo, tais danos secundários de raio-x foram que menos pronunciada em uma abordagem experimental relacionada, onde cristais foram distribuídos sobre uma área significativamente maior em um sanduíche de poliimida21. Para minimizar os danos de raios-x gerais, apenas um pequeno número de padrões de difração de um cristal específico deverão ser recolhido à temperatura ambiente. Além disso, apenas um cristal único de proteína deve ser exposto por compartimento do chip microfluidic. No entanto, todos os modelos de estrutura refinados usando os conjuntos de dados processados mostram muito bom estereoquímica e estatísticas adequadas (tabela 4). Além disso, todos os mapas de densidade de elétrons final foram de muito boa qualidade.
Em abordagens anteriores de cristalografia em chips transparentes de raio-x, a orientação e o arranjo dos cristais tinha que ser manipulado deliberadamente para obter uma distribuição aleatória de cristal orientações40 ou foi obtido por movimentos de cristal dentro da camada líquida de21. Para avaliar a orientação de cristal nos chips microfluídicos transparente raio x descrito neste protocolo, determinou-se a orientação de célula de unidade de todos os cristais expostos em relação ao sistema de coordenadas de laboratório. Os cristais de Taumatina dihexagonal, uma ligeira preferência foi observada (Figura 7A), enquanto que obtivemos uma ampla distribuição de cristais de glicose isomerase (Figura 7B). Nós raciocinou que na escala de nanômetros, a maioria dos materiais apresentam aspereza significativa. Daí, cristais espontaneamente poderiam nucleada na superfície em significativamente menos tendenciosas orientações espontaneamente. Tal um núcleo de cristal pequeno pode ser bloqueado em uma orientação, continuando a crescer para o tamanho adequado sem reorientação em relação a normal da superfície. Na verdade, nucleação de cristal mediada por superfície tem sido um incômodo para tentar um cristal anexado a superfície de um loop sem danificar o cristal no processo de crystallographers. Aqui, nós podemos utilizar diretamente tais cristais para coleta de dados de difração. No entanto, existem limitações específicas do sistema, como a tioredoxina revelou uma forte preferência por determinadas orientações no xy, xz e yz-aviões (Figura 7). Os exemplos que mostrou demonstram que a distribuição de orientação não depende apenas do ambiente de crescimento, mas também na forma de cristal. Os cristais de tioredoxina tem alongado formas que tendem a crescer na orientação preferencial, enquanto os cristais de Taumatina dihexagonal tetragonal ou cristais ortorrômbico glicose isomerase não mostram esse comportamento. No entanto, em todos os casos, mesmo com orientações preferenciais que a gama acessível de rotações de cristal resultou em suficientemente boa cobertura de espaço recíproco e, portanto, completa de conjuntos de dados para todos os investigados proteínas. Assim, sem medidas adicionais tinham que ser levado ao selecionar os cristais para a exposição de raio-x.

Figura 1 : Regime de microfluidic fabricação de chip de raio-x. (1) SU-8 é dispensado em um substrato de silício e spin revestido para obter a espessura desejada. (2) fotorresiste é exposta à radiação UV através de uma máscara. (3) unexposed fotorresiste é então desenvolvido fora lavando consecutivamente com PGMEA e isopropanol, resultando em (4) um mestre de SU-8 para lançar ainda mais passos. (5) PDMS é derramado sobre, e (6) após o molde PDMS, cura é descascado do mestre SU-8. cola de epóxi (7a) é dispensada sobre o molde PDMS e (7b) é de uma folha de poliimida ativado quimicamente ligado à resina epóxi. (8) após a cura, a folha de poliimida com o filme de cola epoxy fina padronizada é descascada do molde PDMS. (9) em uma etapa final, o dispositivo é pálpebras com uma segunda folha de poliimida para produzir um chip fechado em baixa raio x microfluidic de fundo. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Fotografia (à esquerda) e imagens de microscopia de seções transversais dos chips finais. Um segmento de canal representativo (médio) e um poco de cristalização (à direita) de dois chips separados são mostrados. As setas indicam a medida de distâncias. Todas as dimensões estão em µm. clique aqui para ver uma versão maior desta figura.

Figura 3 : Planta da cristalização bem projeta com [A] paralelo ou serial layout de [B], visto de cima e do lado, com as dimensões indicadas em µm. Alturas de canal típico foram: bypass de 50 µm, 50-60 µm cristalização bem, 5-10 µm válvula capilar, correspondente ao bem volumes de cerca de 2,5 nL (disposição paralela) e 8 nL (layout de serial). Representante bem carregando o comportamento é mostrado usando corantes alimentares. O chip foi aprontado com 12 wt % 1H, 1 H, 2H, 2H-perfluoro-1-octanol no FC-43, antes de corante de comida foi injetado em poços de armazenamento. As setas brancas indicam a direção do fluxo. Imagens de visão do show de dispositivos carregados todos os poços carregados de defeitos carregamento livre, ilustrando amostra robusta. O layout paralelo é ilustrado como um projeto de três de altura, com poços de cristalização mais elevados do que o bypass, enquanto o layout serial é retratado como um projeto de dois-altura com poços e ignorar ter altura igual. Taxas de fluxo típico foram cerca de 150 µ l/h durante o carregamento, mas defeito carregamento gratuito foi observado para vazões de até 1 mL/h em uma altura de três-design. Clique aqui para ver uma versão maior desta figura.

Figura 4 : In situ Difusão dinâmica da luz de uma cristalização bem ao longo do tempo. [A] microscópico imagem série de bem a cristalização. A gota armazenada contínua encolhe como vapor de água que evapora ao longo do tempo. Primeiro Taumatina microcristais podem ser observados após a distribuição de raio hidrodinâmico 4 h. [B] correspondentes das partículas Taumatina medido por DLS durante o processo de cristalização mesmo fotografado em [A]. A formação de uma segunda fração do raio, indicando eventos de nucleação inicial podem ser vistos depois de aproximadamente volume representativo de 1-2 h.. [C] redução de dois volumes de gotículas de referência devido à perda de água por evaporação ao longo do tempo. Clique aqui para ver uma versão maior desta figura.

Figura 5 : coleta de dados em situ difração. [A] individuais microfluidic fichas são montadas por um adaptador 3D impresso (azul) em um goniômetro de placa. [B] Taumatina cristais no microfluidic chip durante a exposição de raios-x como descoberto pelo microscópio em linha na trajetória P14. [C] difração de Taumatina cristais foi gravada para uma resolução de 2.0 Å, com um insignificante baixo fundo. Clique aqui para ver uma versão maior desta figura.

Figura 6 : Avaliação de dados de dados de difração de cristais de Taumatina no chip microfluídicos, gravado na sala-temperatura. [A] densidade do elétron do modelo Taumatina refinado usando o quadro 1-2 conjunto de dados apenas (contornos azuis no 1.5 σ). [B] decaimento de a intensidade dos cristais Taumatina em função da dose de raios-x. [C] evolução do valor Rmeas sobre dose de raios-x. A caixa de terrenos em [B] e [C] com quartis (valores superior 75%, valores medianos 50%, mais baixos valores 25% e média) e bigodes com 95% intervalos de confiança representam a decadência da intensidade da difração e Rmeas de todos os cristais expostos (n = 83). Clique aqui para ver uma versão maior desta figura.
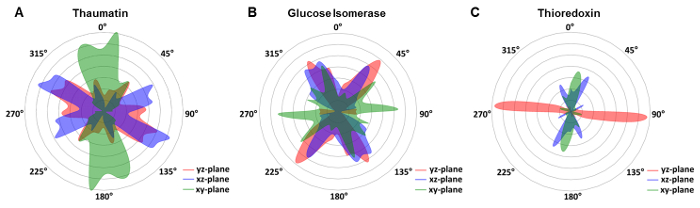
Figura 7 : Distribuição de orientações de célula unidade na folha de microplaqueta microfluidic em relação ao sistema de coordenadas laboratório. [A] dihexagonal Taumatina cristais mostrou uma ampla distribuição de orientações cobrindo quase 180° no xy - (azul), plano xz (verde) e plano de yz-(red). [B] isomerase glucose também mostra uma distribuição ampla, enquanto [C] tioredoxina mostrou uma forte preferência por determinadas orientações. Clique aqui para ver uma versão maior desta figura.
| SU8-camada | Casaco de rotação | Pré-cozer | Expor | Pós-coza |
| [65 / 95 ° C] | [65 / 95 ° C] | |||
| 1 camada dest : poços | 1000 RPM | 0 / 10 min | 200 mJ/cm2 | 1 / 4 min |
| SU8 de 15 µm-3010 | ||||
| camada 2nd : Bypass | 2000RPM | 0 / 16 min | 220 mJ / cm2 | 1 / 5 min |
| SU8 de 35 µm-3025 | ||||
| 3 camada derd : válvulas | 3000 RPM | 0 / 3 min | 150 mJ / cm2 | 1 / 2 min |
| 5 µm SU8-3005 |
Tabela 1: exemplo de processo de SU8 para o projeto de microplaqueta de raio-x paralelo da três-camada. Essa camada ordem permitirá para fundição de um molde PDMS para a fabricação de chip de raio-x. Para moldar diretamente um PDMS durante prototipagem, inverta a camada ordenando durante a fabricação do mestre para iniciar a partir do 3rd para terminar com ast 1 camada em vez disso.
| Proteína | Concentração de proteína | Tampão de proteína | precipitantes | Grupo de espaço, entrada do PDB | Coeficiente de extinção [M-1 cm-1] |
| Taumatina (Thaumatococcus daniellii) | 40 mg mL-1 | 50 mM Tris-Bis, pH 6.5 | 1.1 tartarato de sódio e M, 50 mM Tris, pH 6,8 | I4222, 1LR2 | 29420 |
| Isomerase de glicose (Streptomyces rubiginosus) | 25 mg mL-1 | 10 mM HEPES, 1 mM MgCl2, pH 7.0 | 100 mM Tris-Bis, sulfato de amônio de 2,7 M, pH 5,7 | I222, 4ZB2 | 46410 |
| Tioredoxina (Wuchereria bancrofti) | 34 mg mL-1 | 20 mM, 5 mM EDTA, 150 mM NaCl, Tris-HCl, pH 8,0 | 27,5% PEG1500, 100mm SPG buffer, pH 6.3 | P41212, 4FYU | 24075 |
Tabela 2: Condições de cristalização e espaço grupos de cristais de proteína preparados, incluindo o código de coeficiente e pdb de extinção.
| Proteína | Número de cristais expostos | Número de padrão de difração por cristal | Intervalo de oscilação por exposição [°] | Tempo de exposição [ms] | Entrada PDB para senhor |
| Taumatina (Thaumatococcus daniellii) | 103 | 10 | 1 | 40 | 1LR2 |
| Isomerase de glicose (Streptomyces rubiginosus) | 69 | 100 | 0.1 | 80 | 4ZB2 |
| Tioredoxina (Wuchereria bancrofti) | 68 | 10 | 1 | 40 | 4FYU |
Tabela 3: difração de raios x parâmetro de coleta de dados.
| Dados coleção estatísticasum | Taumatina (Quadro 1-20) | isomerase de glicose (quadro 1-100) | tioredoxina (Quadro 1-10) |
| Beamline | P14 | ||
| Comprimento de onda [Å] | 0.96863 | ||
| Grupo de espaço | P41212 | I222 | P42212 |
| Parâmetros de célula unidade: a = b, c [Å] | 58.62, 151.48 | 93.91, 99.60, 103.04 | 58.45, 151.59 |
| Número de cristais | 101 | 41 | 34 |
| Oscilação total [°] | 10 | 10 | 10 |
| Resolução [Å] | 30.1.1989 (1,95 – 1.89) | 30.1.1975 (1,80 – 1,75) | 30.3.2000 (3.20-3,00) |
| Temperatura [K] | 296 | 296 | 296 |
| R p.i.m.b | 7.5 (25,5) | 8.8 (28.0) | 9.1 (33.2) |
| Reflexões medidos | 1553200 | 690000 | 1111196 |
| Reflexões exclusivos | 21850 | 48942 | 44449 |
| I/σ(I) média | 6,07 (1.78) | 5.85 (1.66) | 4,08 (1.47) |
| MN(I) meia-conjunto correlação CC(1/2) | 96.2 (72,2) | 95.8 (68,2) | 97.9 (75,3) |
| Completude [%] | 99.8 (100.0) | 100.0 (99,9) | 99,9 (100.0) |
| Redundância | 71,1 | 14.1 | 25 |
| Estatísticas de refinamento | |||
| Gama de resolução [Å] | 30/01/1989 | 30/01/1975 | 30/03/2000 |
| R / Rlivre [%] | 18.8/23.9 | 18.1/20.5 | 18.9/23.1 |
| Átomos da proteína | 1550 | 3045 | 1129 |
| Moléculas de água | 51 | 111 | 56° |
| Moléculas de ligante | 20 | 0 | 0 |
| Desvio RMS | |||
| Bond-comprimento [Å] | 0.02 | 0,026 | 0.01 |
| Ângulo de ligação [°] | 2,04 | 2.22 | 1,43 |
| Fator B [Å2] | |||
| Proteína | 22.6 | 20 | 50 |
| Água | 25,1 | 27.1 | 29,7 |
| Ligante | 20,4 | ||
| Análise do enredo de robalo | |||
| Regiões mais favorecidas [%] | 97.67 | 95.32 | 96.13 |
| Regiões permitidas [%] | 2,44 | 4.16 | 3,64 |
| Generosamente permitiu regiões [%] | 0,49 | 0,52 | 0.23 |
| r: os valores entre parênteses são para o shell de resolução mais alta. | |||
b: ( ), onde eu (hkl) é a intensidade média da hkl reflexões, Σhkl é a soma sobre todas as reflexões e Σi é a soma mais eu medições de reflexão hkl. ), onde eu (hkl) é a intensidade média da hkl reflexões, Σhkl é a soma sobre todas as reflexões e Σi é a soma mais eu medições de reflexão hkl. | |||
Tabela 4: Estatísticas de coleta de dados de conjuntos de dados de Taumatina, isomerase de glicose e tioredoxina.
Complementar-arquivo 1: chip_geometry.dwg. CAD-arquivo das geometrias chip usado. Clique aqui para baixar este arquivo.
Complementar-arquivo 2: goniometer_adapter.stl. STL-arquivo especificando o adaptador de goniômetro de microplaqueta de raio-x. Clique aqui para baixar este arquivo.
3 complementar-arquivo: xds.sh. Bash script para criar arquivos de entrada para processar cunhas de dados de difração por XDS. Clique aqui para baixar este arquivo.
4 complementar-arquivo: xscale.sh. Bash script para mesclar dados de difração de subconjuntos e criar um arquivo HKL. Clique aqui para baixar este arquivo.
Complementar-arquivo 5: ISigma.sh. Bash script para extrair os valores de ISigma de todos os subconjuntos individuais. Clique aqui para baixar este arquivo.
Complementar-arquivo 6: Rmeas.sh. Bash script para extrair valores de Rmeas de todos os subconjuntos individuais. Clique aqui para baixar este arquivo.
7 complementar-arquivo: rotation_matrix.sh. Bash script para preparar o arquivo de entrada para Matlab calcular os ângulos de Euler da matriz de rotação. Clique aqui para baixar este arquivo.
Discussão
Podemos fabricar dispositivos microfluídicos por difração de raios x em situ pela padronização de resina epóxi como preenchimento da folha de material e poliimida como material de janela. Nosso procedimento otimizado várias etapas do processo de fabricação mais raio-x anterior microplaqueta projetos16,21. Nós reduzimos a espessura de janela e, assim, o fundo dispersando enquanto também facilitando a fabricação menos etapas do processo são necessárias. cristalização em situ usando o protocolo descrito tem benefícios substanciais. Permite que coleta de dados de difração na temperatura e, assim, exclui a necessidade de proteção da cryo, que, em alguns casos, contém o risco de introdução de artefatos na estrutura da proteína. Além disso, os cristais não são sujeitos a estresse físico, porque a transferência dos cristais de seu ambiente nativo pode ser evitada. Através deste procedimento, os cristais de mantêm sua alta qualidade e não sofrem de qualquer tratamento.
Em nossa experiência, os passos mais críticos dentro do protocolo giram em torno de controlar o processo de cristalização. Os parâmetros para obter cristais adequados de raio-x com dimensões apropriadas precisam ser identificado empiricamente e não podem ser levados diretamente a partir de experiências de difusão de vapor. Usar idênticas concentrações de proteína e dessensibilizador não sempre resultou em cristais em fichas diferentes, ou às vezes em poços diferentes dentro do mesmo chip. Isto indica que todos os fatores que influenciam o crescimento e a nucleação de cristal devem ser considerados com cuidado, como mãe licor composição ou cristalização cinética (através da trajetória de evaporação). Como cristais maiores difração de maior resolução, devidamente grandes cristais são idealmente cultivados. O processo de nucleação de cristais e crescimento pode ser seguido com medições de DLS. Ajustar o foco do laser dentro do ~ 50 µm compartimentos de cristalização fina do chip podem ser desafiadoras e podem exigir cuidado alinhamento manual. Por meio de poços mais profundos do que 100 µm, laser autoalinhamento era viável e confiável, tal que vários poços podem ser monitorados através de sistemas automatizados de aquisição.
Os chips de raio-x de poliimida com base em produzem apenas um baixo fundo e demonstramos a adequação desses dispositivos para a rotina de coleta de dados de difração de raios-x através da resolução de estruturas para três proteínas do modelo. A melhor resolução obtida em chip diferem, em comparação com resoluções anteriormente alcançadas, de cristais de proteína significativamente maiores e coleta de dados de raio-x convencional. Isto pode ser devido a vários fatores, e ainda mais a otimização de condição de cristalização pode melhorar ainda mais a difração. Foi possível coletar dados em situ de difração em resoluções de até 1,8 Å aplicando cristal com dimensões menores que 30 µm. A análise detalhada dos dados de difração Taumatina forneceu insights sobre danos de radiação. Para limitar a extensão dos danos de radiação, apenas um único cristal deve ser exposto por compartimento no dispositivo microfluidic, como a difusão de radicais e em cristais vizinhos pode ocorrer. Para melhorar a velocidade de coleta de dados, isso deve ser automatizado no futuro.
Devido à morfologia do cristal, em alguns casos pode ocorrer uma orientação preferencial. Foi por exemplo o caso com o dataset tioredoxina, onde os cristais tinham uma orientação fortemente preferencial em relação ao windows chip. Até aqui, nós poderia coletar um conjunto de dados completo de difração. Se os cristais apresentam uma orientação preferencial no chip, e em particular se o correspondente grupo de espaço também tem uma baixa simetria, então a integralidade do conjunto de dados deve ser monitorada durante a coleta de tal que seja suficiente cana de padrões de difração coletados.
Estudos de tempo-resolvido utilizando esses chips são diretamente possíveis quando usar luz induziu reações com uma abordagem de bomba-sonda. A transmissão de luz de folha de poliimida para o laser da bomba precisa ser elucidado e Alternativamente, opticamente clara poliimida ou COC poderia ser usado. As geometrias microfluidic atual não permite substrato misturando experiências após os cristais são cultivados. No entanto, esperamos que o protocolo de fabricação de chip raio x descrito também ser adequado para tal mistura desenhos para ambos difração de raios x tempo-resolvido bem como espalhamento abordagens19.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pelo fundo de semente PIER PIF-2015-46, o BMBF concede 05K16GUA e 05K12GU3 e o cluster de excelência 'The centro de Hamburgo para Ultrafast Imaging – estrutura, dinâmica e controle da matéria na escala atômica' do Deutsche Forschungsgemeinschaft (DFG). O trabalho dos autores afiliado com o centro para a ciência do Laser de elétrons livres foi financiado pela Associação Helmholtz, através de fundos do programa orientado. Os dados de MX síncrotron foi coletados na trajetória P14 operado pelo EMBL de Hamburgo no anel de armazenamento de PETRA III (DESY, Hamburgo, Alemanha).
Materiais
| Name | Company | Catalog Number | Comments |
| SU-8 3000 Series | MicroChem Corp. | SU-8 3000 | Photoresist |
| PGMEA | Sigma-Aldrich | 484431 | Developer |
| Isopropyl alcohol | Solvent | ||
| Ethanol | Solvent | ||
| Epoxy glue | UHU | Plus Schnellfest 5 min | Epoxy glue |
| PDMS | Dow Corning | Sylgard 184 | Silicone |
| Kapton foil | Dupont/ American Durafilm | HN grade, gauge 30 (7.5 μm) | polyimide foil |
| APTS | Sigma-Aldrich | 440140 | Chemical |
| GPTS | Sigma-Aldrich | 440167 | Chemical |
| Cytop CTX-109AE | Asahi Glass Co. Ltd | Cytop CTX-109AE | Cytop fluoropolymer coating |
| CT-Solv 100E | Asahi Glass Co. Ltd | CT-Solv 100E | Cytop fluoro-solvent |
| HFE-7500 | 3M | Novec 7500 | Fluorinated oil |
| AutoCAD | AutoDesk Inc. | AutoCAD | CAD Software |
| Biopsy Punch | Harris | Uni-core 0.75 mm | |
| Photo mask | JD Photo Data | ||
| 3 inch wafer | University Wafer | Silicon wafer | |
| Mask aligner | SÜSS MicroTec | MJB4 | Mask aligner |
| PDMS mixer | Thinky | ARE-250 | |
| Plasma machine | Diener electronic | Zepto | |
| Thaumatin | Sigma Aldrich | T7638 | Protein |
| Glucose Isomerase | Hamton Research | HR7-102 | Protein |
| Bis-Tris | Sigma Aldrich | B9754 | Chemical |
| Sodium Tartrate | Merck | 106664 | Chemical |
| Tris-HCl | Sigma Aldrich | 10812846001 | Chemical |
| HEPES | Carl Roth | 6763.2 | Chemical |
| Magnesium Chloride | Sigma Aldrich | 208337 | Chemical |
| Ammonium Sulfate | Sigma Aldrich | A4418 | Chemical |
| EDTA | Sigma Aldrich | E6758 | Chemical |
| Sodium Chloride | Sigma Aldrich | 1064060250 | Chemical |
| PEG1500 | Molecular Dimensions | MD2-100-6 | Chemical |
| SPG buffer | Jena Bioscience | CSS-389 | Chemical |
| SpectroLight600 | XtalConcepts | DLS Instrument | |
| Nanodrop | Thermo Scientific | Spectrophotometer | |
| Zentrifuge | Eppendorf | ||
| Ultimaker2 | Ultimaker | 3D printer | |
| Form2 | Formlabs | 3D printer | |
| Amicon Filter | Sartorius Stedim | 0.2 µm filter | |
| Tubing | Adtech Polymer Engineering Ltd | Bioblock/05 | PTFE tubing 0.3 mm Inner Diameter x 0.76 mm Outer Diameter |
| Syringes | BD | 309628 | 1ml Luer-Lock Tip |
| Needle | Terumo Agani Needle | AN*2716R1 | 27Gx5/8" |
Referências
- Rasmussen, B. F., Stock, A. M., Ringe, D., Petsko, G. A. Crystalline ribonuclease A loses function below the dynamical transition at 220 K. Nature. 357 (6377), 423-424 (1992).
- Tilton, R. F. J. R., Dewan, J. C., Petsko, G. A. Effects of temperature on protein structure and dynamics: X-ray crystallographic studies of the protein ribonuclease-A at nine different temperatures from 98 to 320 K. Biochemistry. 31 (9), 2469-2481 (1992).
- Fraser, J. S., Clarkson, M. W., Degnan, S. C., Erion, R., Kern, D., Alber, T. Hidden alternative structures of proline isomerase essential for catalysis. Nature. 462 (7273), 669-673 (2009).
- Juers, D. H., Matthews, B. W. The role of solvent transport in cryo-annealing of macromolecular crystals. Acta Crystallogr. D. 60 (Pt 3), 412-421 (2004).
- Huang, C. Y., et al. In meso in situ serial X-ray crystallography of soluble and membrane proteins. Acta Crystallogr. D. 71 (Pt 6), 1238-1256 (2015).
- Gati, C., et al. Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser. P. Natl. Acad. Sci. USA. 114 (9), 2247-2252 (2017).
- Gati, C., et al. Serial crystallography on in vivo grown microcrystals using synchrotron radiation. IUCrJ. 1 (Pt 2), 87-94 (2014).
- von Dreele, R. B. Multipattern Rietveld refinement of protein powder data. J. Appl. Crystallogr. 40 (1), 133-143 (2007).
- Cherezov, V. Lipidic cubic phase technologies for membrane protein structural studies. Curr. Opin. Struct. Biol. 21 (4), 559-566 (2011).
- Gati, C. Data processing and analysis in serial crystallography at advanced X-ray sources. , Dissertation, Hamburg (2015).
- Stellato, F., et al. Room-temperature macromolecular serial crystallography using synchrotron radiation. IUCrJ. 1 (Pt 4), 204-212 (2014).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallogr. D. 71 (Pt 2), 387-397 (2015).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (Pt 2), 168-176 (2015).
- Martin-Garcia, J. M., Conrad, C. E., Coe, J., Roy-Chowdhury, S., Fromme, P. Review: Serial femtosecond crystallography: A revolution in structural biology. Arch. Biochem. Biophys. 602, 32-47 (2016).
- White, T. A., et al. CrystFEL: A software suite for snapshot serial crystallography. J Appl Crystallogr. 45 (2), 335-341 (2012).
- Perry, S. L., et al. A microfluidic approach for protein structure determination at room temperature via on-chip anomalous diffraction. Lab Chip. 13 (16), 3183-3187 (2013).
- Schlichting, I. Serial femtosecond crystallography: the first five years. IUCrJ. 2 (Pt 2), 246-255 (2015).
- Sui, S., Perry, S. L. Microfluidics: From crystallization to serial time-resolved crystallography. Struct. Dynam.-US. 4 (3), (2017).
- Ghazal, A., Lafleur, J. P., Mortensen, K., Kutter, J. P., Arleth, L., Jensen, G. V. Recent advances in X-ray compatible microfluidics for applications in soft materials and life sciences. Lab Chip. 16 (22), 4263-4295 (2016).
- Heymann, M., et al. Room-temperature serial crystallography using a kinetically optimized microfluidic device for protein crystallization and on-chip X-ray diffraction. IUCrJ. 1 (Pt 5), 349-360 (2014).
- Schubert, R., et al. A multicrystal diffraction data-collection approach for studying structural dynamics with millisecond temporal resolution. IUCrJ. 3 (Pt 6), 393-401 (2016).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nat. Commun. 5, 3309(2014).
- Conrad, C. E., et al. A novel inert crystal delivery medium for serial femtosecond crystallography. IUCrJ. 2 (Pt 4), 421-430 (2015).
- Cohen, A. E., et al. Goniometer-based femtosecond crystallography with X-ray free electron lasers. P. Natl. Acad. Sci. USA. 111 (48), 17122-17127 (2014).
- Erskine, D., YU, P. Y., Freilich, S. C. High-Pressure Visible Spectroscopy of Polyimide Film. J. Polym. Sci. Pol. Lett. 26 (11), 465-468 (1988).
- Tsai, C. -L., Yen, H. -J., Chen, W. -C., Liou, G. -S. Novel solution-processable optically isotropic colorless polyimidothioethers-TiO2 hybrids with tunable refractive index. J. Mater. Chem. 22 (33), 17236-17244 (2012).
- Destremaut, F., Salmon, J. -B., Qi, L., Chapel, J. -P. Microfluidics with on-line dynamic light scattering for size measurements. Lab Chip. 9 (22), 3289-3296 (2009).
- Chastek, T. Q., Iida, K., Amis, E. J., Fasolka, M. J., Beers, K. L. A microfluidic platform for integrated synthesis and dynamic light scattering measurement of block copolymer micelles. Lab Chip. 8 (6), 950-957 (2008).
- Heymann, M., Fraden, S., Kim, D. Multi-Height Precision Alignment With Selectively Developed Alignment Marks. J. Microelectromech. S. 23 (2), 424-427 (2014).
- Schubert, R., et al. Reliably distinguishing protein nanocrystals from amorphous precipitate by means of depolarized dynamic light scattering. J Appl Crystallogr. 48 (5), 1476-1484 (2015).
- Aghvami, S. A., et al. Rapid prototyping of cyclic olefin copolymer (COC) microfluidic devices. Sensor Actuat. B-Chem. 247, 940-949 (2017).
- Walker, J. M. The Proteomics Protocols Handbook. , Humana Press Inc. Totowa, NJ. (2005).
- Kabsch, W. XDS. Acta Crystallogr D. 66 (Pt 2), 125-132 (2010).
- Vagin, A., Teplyakov, A. Molecular replacement with MOLREP. Acta Crystallogr. D. 66 (Pt 1), 22-25 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallogr. D. 67, 235-242 (2011).
- Murshudov, G. N., et al. REFMAC5 for the refinement of macromolecular crystal structures. Acta Crystallogr. D. 67 (Pt 4), 355-367 (2011).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallogr. D. 66 (Pt 4), 486-501 (2010).
- Owen, R. L., et al. Exploiting fast detectors to enter a new dimension in room-temperature crystallography. Acta Crystallogr. D. 70 (Pt 5), 1248-1256 (2014).
- Kabsch, W. Automatic-Indexing of Rotation Diffraction Patterns. J. Appl. Crystallogr. 21, 67-71 (1988).
- Zarrine-Afsar, A., et al. Crystallography on a chip. Acta Crystallogr. D. 68 (Pt 3), 321-323 (2012).
- Boukellal, H., Selimović, S., Jia, Y., Cristobal, G., Fraden, S. Simple, robust storage of drops and fluids in a microfluidic device. Lab Chip. 9 (2), 331-338 (2009).
- Aghvami, S. A., et al. Rapid prototyping of cyclic olefin copolymer (COC) microfluidic devices. Sens. Actuator B Chem. 247, 940-949 (2017).
- Shemesh, J., et al. Stationary nanoliter droplet array with a substrate of choice for single adherent/nonadherent cell incubation and analysis. Proc. Natl. Acad. Sci. USA. 111 (31), 11293-11298 (2014).
- Sun, M., Bithi, S. S., Vanapalli, S. A. Microfluidic static droplet arrays with tuneable gradients in material composition. Lab Chip. 11 (23), 3949-3952 (2011).
- Shim, J. -U., et al. Control and measurement of the phase behavior of aqueous solutions using microfluidics. J. Am. Chem. Soc. 129 (28), 8825-8835 (2007).
- Schubert, R., Meyer, A., Baitan, D., Dierks, K., Perbandt, M., Betzel, C. Real-Time Observation of Protein Dense Liquid Cluster Evolution during Nucleation in Protein Crystallization. Cryst. Growth Des. 17 (6), 3579(2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados