Method Article
Ökosystem-Herstellung (EcoFAB)-Protokolle für den Bau von Labor Ökosysteme entwickelt, um die Pflanze-Mikroben Interaktionen zu untersuchen
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt ausführliche Protokolle für die Ökosystem-Herstellung von Geräten (EcoFABs), die das Studium der Pflanzen und Pflanzen-Mikroben-Interaktionen in hohem Grade kontrollierten Laborbedingungen ermöglichen.
Zusammenfassung
Wohltuende Pflanze-Mikroben-Interaktionen bieten eine nachhaltige biologische Lösung mit dem Potenzial, Low-Input-Essen und Bioenergie-Produktion zu steigern. Ein besseres mechanistisches Verständnis dieser komplexen Pflanze-Mikroben-Interaktionen werden entscheidend für die Pflanzenproduktion zu verbessern, wie auch leistungsstarke grundlegende ökologische untersuchende Pflanze-Boden-Mikroben-Interaktionen Studien. Hier ist eine ausführliche Beschreibung zum Ökosystem Herstellung präsentiert mit allgemein verfügbaren 3D Drucktechnologien, um kontrollierten Labor Lebensräume (EcoFABs) für mechanistische Studien der Pflanze-Mikroben-Interaktionen innerhalb der spezifischen Umwelt zu schaffen, Bedingungen. Zwei Größen der EcoFABs werden beschrieben, die für die Untersuchung der mikrobielle Wechselwirkungen mit verschiedenen Pflanzenarten, darunter Arabidopsis Thaliana, Brachypodium Distachyonund Panicum Virgatumgeeignet sind. Diese durchströmten Geräte zulassen für kontrollierte Manipulation und Beprobung von Stamm mikrobiome, Stamm Chemie sowie Bildgebung des Wurzel-Morphologie und mikrobielle Lokalisierung. Dieses Protokoll enthält die Details für die Aufrechterhaltung der steriler Bedingungen in EcoFABs und Montage unabhängige LED-Lichtsysteme auf EcoFABs. Detaillierte Methoden zur Ergänzung der verschiedenen Formen von Medien, einschließlich Böden, sand, und flüssige Wachstumsmedien gekoppelt bis hin zur Charakterisierung dieser Systeme mittels Bildgebung und Metabolomics werden beschrieben. Diese Systeme ermöglichen dynamische und detaillierte Untersuchung der Pflanze und Pflanze-mikrobielle Konsortien einschließlich der Manipulation des Mikrobiom Komposition (einschließlich Mutanten), die Überwachung von Pflanzenwachstum, Wurzel Morphologie, Exsudat Zusammensetzung, und mikrobielle Lokalisierung unter kontrollierten Umweltbedingungen. Wir erwarten, dass diese detaillierte Protokolle für andere Forscher, im Idealfall hilft standardisierte experimentelle Systeme für die Untersuchung von Pflanze-Mikroben-Interaktionen zu erstellen als ein wichtiger Ausgangspunkt dienen soll.
Einleitung
Die Anwendung der positiven Pflanze-Mikroben in der Landwirtschaft bietet großes Potenzial für nachhaltige Ernährung und Biokraftstoff-Produktion für eine wachsende Bevölkerung1,2,3,4zu erhöhen. Eine erhebliche Menge an Arbeit unterstützt die Bedeutung der Pflanze-mikrobiome Pflanze Nährstoffaufnahme, Toleranz zu Spannungen und Widerstand gegen Krankheit5,6,7,8. Es ist jedoch schwierig, diese Mechanismen der Pflanze-Mikroben-Interaktionen im Bereich Ökosysteme aufgrund der Komplexität und damit verbundenen Unreproduzierbarkeit und Unfähigkeit zur Kontrolle genau Microbiome Zusammensetzung und Genetik zu untersuchen (zB. mit mikrobielle Mutanten)4,9,10.
Eine Strategie besteht darin, vereinfachtes Modell Ökosysteme ermöglichen konstruieren gesteuert, replizierte Laborversuchen untersucht Pflanze-Mikroben-Interaktionen um Erkenntnisse zu generieren, die weiter in den Bereich10,11getestet werden können, 12. Dieses Konzept baut auf traditionellen Ansätzen, die Verwendung von Pflanzen in Erde gefüllten Töpfe oder auf Agar-Platten in Gewächshäusern oder Inkubatoren13. Obwohl diese wahrscheinlich bleibt die am weitesten verbreitete Ansätze, ihnen fehlt die Fähigkeit, genau zu überwachen und manipulieren Pflanze Wachstum Umgebungen. Zu diesem Zweck Rhizoboxes und Rhizotrons stellen eine wesentliche Verbesserung in der Fähigkeit, unterirdische Prozesse14,15studieren und erste Protokolle wurden für die Analyse der Rhizosphäre Metaboliten im Boden16veröffentlicht. In jüngerer Zeit, um Hochdurchsatz-Analyse zu ermöglichen, wurden erweiterte mikrofluidischen Geräten13,17 wie Pflanze Chip18,19, RootArray20und RootChip21, entwickelt als effiziente Werkzeuge für die Pflanze Phänotypisierung mit Mikrometer-Skala räumliche Auflösung die frühen Entwicklungsstadien von der kleinen Modellpflanze Arabidopsis Thaliana in flüssigem Fördermedium zu überwachen. Vor kurzem wurde eine Zweischicht-Image Plattform beschrieben, die Wurzelhaare Bildgebung von Arabidopsis Thaliana im Keimlingsstadium mit einem mikrofluidischen Plattform22ermöglicht.
Hier sind detaillierte Protokolle für den Bau von kontrollierten Laborgeräte (EcoFABs) zur Verfügung gestellt, für das Studium der Pflanze-Mikroben-Interaktionen und zeigen, dass sie verwendet werden können, um diverse studieren Pflanzen einschließlich Arabidopsis Thaliana, Brachypodium Distachyon23, die ökologisch wichtigen Wildhafer Avena Barbata und die Bioenergie-Ernte Panicum Virgatum (Rutenhirse). EcoFAB ist eine sterile Pflanzen-Wachstum-Plattform, die zwei Hauptkomponenten umfasst: das EcoFAB Gerät und sterile Pflanze Mittlere durchsichtigen Behälter. Das EcoFAB, das Gerät ist aus einer Fertigung Prozess, bei dem Casting PDMS, Polydimethylsiloxan (PDMS) Schichten aus einem 3D bedruckte Kunststoff-Formenbau und Verklebung PDMS Schichten auf Objektträger mit Methoden zuvor berichtet,24,25 . Die Modalitäten der EcoFAB-Workflow, wie Gerät Fertigung, Sterilisation, Samenkeimung, Sämling Transplantation, Mikrobe Impfung/Cocultivation, Probenvorbereitung und Analyse, werden in diesem Protokoll (Abbildung 1) beschrieben. Weitere Modifikationen des grundlegenden Workflows werden beschrieben, einschließlich der Installation von Computer gesteuerten LED Grow Lights und die Nutzung von festen Substraten. Die Nutzung der bildgebenden Verfahren untersuchen Wurzel Morphologie ändert, mikrobielle Besiedlung der Wurzeln, und Masse spectroscopic Imaging Wurzelausscheidungen werden beschrieben. Wir erwarten, dass das einfache, kostengünstige Design basierend auf leicht verfügbaren Materialien, sowie die detaillierte Protokolle hier vorgestellte Gemeinschaft Ressource, die EcoFAB-Plattform wird Standardisierung Pflanze Microbiome Laborstudien.
Protokoll
Achtung: Dieses Protokoll beinhaltet die Verwendung von gefährlichen Chemikalien, scharfe Gegenstände, Elektrogeräte, heißen Gegenständen und anderen Gefahren, die zu Verletzungen führen können. Persönliche Schutzausrüstung (PSA, zB., chemisch beständige Handschuhe, Schutzbrille, Kittel, lange Kleidung, geschlossene Schuhe, etc..) sollten getragen werden, und die entsprechenden Sicherheitsvorkehrungen (Sicherheitstraining, Verwendung von einem Abzug ( usw.). sollten befolgt werden.
1. EcoFAB Gerät Fertigung: Casting PDMS Schichten (Abbildung 2 und Abbildung 3)
- Konstruieren der EcoFAB Formen mit 3D-Drucktechniken (Design-Dateien sind verfügbar. Jede Form besteht aus drei Teilen: einem Guss-Rahmen, eine empfohlene formenaufbau und Beilage, wie in Abbildung 2dargestellt. Drucken des formenaufbaus und Einfügen aus starren opaken Photopolymeren mit einem 3D-Drucker aus Kunststoff. Ein Minimum von 100 µm Auflösung nutzen, und die Casting-Frame mit Acrylnitril-Butadien-Styrol (ABS) drucken.
- Mischen Sie 40 mL Basis Siloxan Elastomer mit Härtemittel in eine Einweg-1 L-Container. Je nach der gewünschten Experiment (Schritte 2.1 und 2.2) verwenden Sie unterschiedliche Verhältnisse (V/V) von Elastomer-Basis/Härtemittel (5:1, 15:1 oder 30: 1). Fahren Sie mit den Schritten 1,3 bis 1,8 für alle Arten von Gemischen.
Achtung: Tragen Sie chemisch beständige Handschuhe, Schutzbrille und andere PPEs. - Stellen Sie den Behälter in einer Vakuumkammer für mindestens 30 min um Luftblasen aus der Elastomer-Mischung zu entfernen.
- Den Teig in die montierten 3D bedruckte Kunststoff-Formenbau (Abbildung 3A) und halten Sie die Form auf einem Heizblock bei 85 ° C für 4 h (Abb. 3 b).
Achtung: Tragen Sie PSA um Verbrennungen zu vermeiden. - Lassen Sie die Form für 5 min abkühlen. Die Einlage aus der Form vorsichtig herausziehen (Abbildung 3), und fügen Sie dann langsam ein Gebrauchsmesser zwischen dem Gießen und PDMS (erstarrten Elastomer-Gemisch) zu trennen (Abb. 2D).
- Drücken Sie die Form aus dem Casting-Rahmen (Abbildung 3E) mit PDMS auf Basis. Verwenden Sie ein Messer oder andere Tools, um sanft PDMS-Schicht von der formenaufbau an den Rändern (Abbildung 3F) zu trennen, und dann ziehen Sie langsam es weg von der Oberfläche der Form (Abbildung 3).
- Erstellen Sie Einlass und Auslass-Kanäle auf die PDMS-Schichten von ~1.6 mm Löcher für den Einlass und Auslass Häfen mit 15 gauge stumpfen Nadel (Abbildung 3 H, I).
Hinweis: Die standard Form hat einen Einlass und Auslass Anschluss, während die Wide-Steckdose Form nur die Einlassöffnung (Abbildung 3 H, I braucht). - Mit einer Schere schneiden Sie die Kanten des PDMS Schichten.
Hinweis: Die getrimmten PDMS-Schichten ≥76 mm x 51 mm Rechtecke für Kleingeräte EcoFAB und ≥102 mm x 83 mm Rechtecke für Großgeräte EcoFAB sollte.
2. EcoFAB Gerät Fertigung: chemisch anbringen PDMS "Layers" auf Objektträger (Abbildung 3 und Abbildung 4)
- Dauerhaft kleben die PDMS-Schichten auf Objektträger
- Spülen die Verklebung Seite die PDMS Schicht (aus einem 15:1 Elastomer Basis zur Heilung Agent Mischung) und 7,6 × 5 cm Mikroskop mit Methanol schieben und dann Schlag trocken mit komprimierter Luft oder einem hochreinen Stickstoff-Pistole.
Achtung: Methanol ist giftig. Arbeiten in einer Dampfhaube und tragen Sie schützende Auge abdecken, Handschuhe und andere PPEs. - Platzieren der Objektträger und PDMS-Schicht in ein Plasma Reiniger mit ihrer Bindung Seiten nach oben (Abbildung 3J). Wenn ein Plasma Reiniger nicht verfügbar ist, fahren Sie mit Schritt 2.2.
- Schließen Sie die Kammer und das Gas Entlüftungsventil des Plasmas sauberer, und schalten Sie das Vakuum und Abpumpen der Kammer für 1 min.
- Schalten Sie den plasmagenerator, und wechseln Sie die Radiofrequenz (RF)-Ebene auf "HI" für 1 min.
- Schalten Sie die Vakuumpumpe und die plasmaleistung und Entlüften der Kammer zur Atmosphäre.
- Nehmen Sie den Objektträger und PDMS-Schicht aus der Plasmakammer, und drücken Sie schnell alle vier Kanten der PDMS-Schicht auf der Folie mit gleichmäßigem Druck (Abbildung 3 L). Stellen Sie sicher, dass der ovale Mittelbereich der PDMS-Schicht (die Wurzel Kammer) die Folie nicht berührt.
- Platzieren Sie das versiegelte EcoFAB Gerät auf einem 120 ° C heizen Block 20 min um die dauerhafte Verklebung zwischen der PDMS-Schicht und der Objektträger weiter zu sichern.
- Lassen Sie das Gerät abkühlen lassen für 5 min. trimmen Sie die zusätzliche Kanten der PDMS-Schicht mit einem Messer.
- Spülen die Verklebung Seite die PDMS Schicht (aus einem 15:1 Elastomer Basis zur Heilung Agent Mischung) und 7,6 × 5 cm Mikroskop mit Methanol schieben und dann Schlag trocken mit komprimierter Luft oder einem hochreinen Stickstoff-Pistole.
- Reversible physikalische Abdichtung der PDMS-Schichten auf Objektträger
- Die Reversible Dichttechnik nutzt eine Reihe von benutzerdefinierten Klemmen (entweder gedruckt von einem 3D-Drucker aus Kunststoff oder bearbeiteten in Metall, die Zeichnungen sind in Abbildung 4dargestellt).
- Legen Sie den Objektträger in den Ausschnitt auf der Bodenplatte Klemme, und richten Sie die PDMS-Schicht (aus einem 5:1-Elastomer-Basis zur Heilung Agent Mischung) auf der Oberseite der Folie.
- Legen Sie die obere Klemmplatte über die PDMS-Schicht. Befestigen Sie die oberen und unteren Platten zusammen mit vier hex Kopfschrauben, die Schrauben zu orientieren, so dass die Muttern von der Spitze der Klammer am Gewinde sind.
- Anhaftenden PDMS direkt auf Objektträger
- Positionieren Sie die PDMS-Schicht (aus einer 30,1-Elastomer-Basis zur Heilung Agent Mischung) auf einen Objektträger.
- Drücken Sie die PDMS-Schicht auf die Folie. Die weichen, stark anhaftende PDMS-Schicht (30,1) sollte die Folie erstellen eine wasserdichte Dichtung ohne die permanente chemische Bindung oder physischen Presse aus einer Klemme (Abbildung 3 L) einhalten.
- Die Reversible Dichttechnik nutzt eine Reihe von benutzerdefinierten Klemmen (entweder gedruckt von einem 3D-Drucker aus Kunststoff oder bearbeiteten in Metall, die Zeichnungen sind in Abbildung 4dargestellt).
3. EcoFABs Sterilisation
- Spülen Sie EcoFAB Geräte mit Reinstwasser.
- Legen Sie ein EcoFAB-Gerät in einem EcoFAB Behälter, und fügen Sie 70 % Ethanol, bis das Gerät unter Wasser befindet. Schließen Sie den Behälterdeckel und schütteln Sie Sie leicht um alle Oberflächen im Inneren mit Ethanol zu nass. Stellen Sie sicher die Wurzel Wachstum Kammer des EcoFAB Gerätes ist gefüllt mit Ethanol, mit sehr wenige oder keine Luftblasen.
- Gießen Sie nach 30 min Inkubation bei Raumtemperatur 70 % Ethanol, und wiederholen Sie die Inkubation mit 100 % igem Ethanol für 5 min.
- Entwässern aus Ethanol und inkubieren Sie die sterilisierten EcoFAB für 16 h in einer Laminar-Flow-Haube um es vollständig trocknen. Falls verfügbar, Sterilisieren Sie das System durch Drehen auf das UV-Licht innerhalb der Haube für 1 h.
Achtung: Tragen Sie geeignete PSA bei der Arbeit mit UV-Licht. - Speichern Sie die sterilisierten EcoFABs in eine sterile Kapuze oder autoklaviert Taschen für die spätere Verwendung.
4. EcoFABs mit LED wachsen Lichter (Abbildung 5)
- Befestigung der LED Streifen auf EcoFAB Container
- Markieren Sie die Positionen auf der EcoFAB-Container für 9 LED Clips. Beginnen Sie mit dem ersten Clip 120 mm nach oben von der Unterseite des Behälters entlang einer Kante (Abb. 5A), und fahren Sie mit jedem nächsten Clip fallen 10 mm Clip-Standorte in einer Spirale um den Container zu markieren. Eine Spirale von 9 Clips, die einen 1 m LED Strip zweimal um den Container zu wickeln kann.
- Heißkleber markiert ein Clip LED für jeden Standpunkt durch Hinzufügen von zwei Farbtupfern Heißkleber auf den Behälter mit der Position der Befestigungslöcher für die Clips ausgerichtet. Drücken Sie die Clip-Löcher in diesen zwei Tupfer Klebstoff, dann fügen Sie ein weiteres Klecks Leim auf die Löcher. Wiederholen Sie den Vorgang für alle Clips, bis 9 Clips eine Spirale (Abb. 5 b bilden).
Achtung: Tragen Sie Handschuhe und andere PSA bei der Arbeit mit Heißkleber um Verbrennungen zu vermeiden. - Fädeln Sie die LED-Streifen durch die Clips in eine Spiralform mit LEDs mit Blick in den Behälter. Der Streifen sollte zweimal umkreisen (Abbildung 5).
- Anschluss LED Streifen an die Stromversorgung mit einem Controller (Abbildung 5 zeigt eine EcoFAB Kammer mit beleuchteten Lichter, die Programmierung des Controllers im Schritt 4.3 beschrieben wird).
Achtung: Stromschlag-Gefahr: Stellen Sie sicher, das Netzteil ist unplugged, wenn Drähte anschließen.- Schließen Sie die positiven und negativen Terminals des Netzteils an die "INPUT: V +" und "INPUT: V-" Klemmen des Reglers mit 2-Draht-Leitung (5E Abbildung zeigt eine schematische Zeichnung des Controller-Setup an).
- Verbinden Sie die Minusleitung das abisolierte Ende eines nackten weiblichen Kabels mit einem "Ausgangskanal" auf dem Controller.
Hinweis: Es gibt fünf Kanäle des Controllers, die in diesem Protokoll verwendet wird, so dass es bis zu fünf 1 m LED Streifen unterstützen kann. - Schließen Sie alle positiven führt der Kabel an eine kompakte Spleißen Connector (wenn mehrere Kanäle benötigt werden), und verknüpfen Sie dann diesen Connector zum Terminal "OUTPUT V +" des Controllers.
- Stecken Sie jede LED-Streifen die Buchse der Kabel, so hat jede LED einen eigenen Kanal gesteuert werden. Falls gewünscht, verwenden Sie Frau-zu-Mann-Kabel, um die Reichweite zu erhöhen.
- Programmieren des Controllers für eine gewünschte lichtzyklus gemäß Anweisungen des Herstellers,
5. Anbau von Pflanzen in EcoFABs
- Sterilisation von Samen und Keimen
Hinweis: Die Saatgut-Sterilisation und alle folgenden Schritte mit Setzlingen müssen unter sterilen Bedingungen durchgeführt werden. Das Sterilisationsverfahren siehe unten eignet sich für die Samen von Arabidopsis Thaliana, Avena Barbata, Brachypodium Distachyon, und Panicum Virgatum. Panicum Virgatum Samen in 60 % Schwefelsäure 1 h vor dem Sterilisationsprozess ausgesetzt werden sollte. Es ist ratsam, 1-2 Samen pro EcoFAB Gerät vorbereiten, unter Berücksichtigung der Keimrate und die Homogenität der Keimung.- Die Samen in 70 % igem Ethanol für 2 min einweichen.
- Entfernen Sie Ethanol mit einer Pipette und spülen Sie die Samen mit sterilem Wasser dreimal.
- Lassen Sie die Samen in 10 % Bleichmittel-Lösung für 5 Minuten.
- Entfernen Sie das Bleichmittel-Lösung, und waschen Sie die Samen mit sterilem Wasser dreimal gründlich zu.
- Die Samen steriles Wasser hinzu, und 7 Tage inkubieren Sie die Microcentrifuge Schlauch im Kühlschrank 4 ° C.
- Gleichmäßig verteilt die Samen auf 0,5 Murashige & Skoog (MS) Medium mit 0,6 % Phytagel und die Platten mit Zusammenarbeit Klebeband verschließen.
- Wachsen Sie die Pflanzen auf eine Wurzellänge von ca. 5 mm für Transfer zum EcoFABs (Abb. 6A). Für die Experimente präsentiert hier gelten ein 16 h Licht/8 h dunkel Beleuchtung Regime in einer Kammer 22 ° C Wachstum und inkubieren Sie die Pflanzen 2 bis 7 d vor Übergabe an EcoFAB (2 Tage für Avena Barbata und Brachypodium Distachyon, 7 Tage für Arabidopsis Thaliana und Panicum Virgatum).
- Übertragung von Sämlingen in EcoFABs mit flüssigen Medium (Abbildung 6)
- Eine sterile Spritze oder mikropipette, spülen Sie die Wurzel Kammer des ein EcoFAB Gerät mit sterilem Wasser dreimal, und dann das Wachstumsmedium von Interesse, z. B. 0,5 MS Medium (Abb. 6 b, Schritt 5.1.6) füllen Sie die Wurzel Kammer ein.
- Einen einzelnen Sämling vorsichtig in die Pflanze-Reservoir des EcoFAB Gerätes (Abbildung 6) einsetzen.
Hinweis: Die Wurzel sollte in der Wurzel Kammer mit dem Shooting ragte aus dem Reservoir vollständig untergetaucht werden. - Fügen Sie 3 mL steriles Wasser in den Behälter, das EcoFAB Gerät zu vermeiden. Dies erhöht die Luftfeuchtigkeit und reduzieren die Verdunstung des Mediums aus der Wurzel Kammer.
- Schließen Sie den Container, und verschließen Sie den Deckel mit Klebeband Zusammenarbeit (Abbildung 6).
- Legen Sie die EcoFAB in eine Pflanze Inkubator, oder nutzen Sie das EcoFAB Beleuchtungssystem in einer kontrollierten Temperatur Umgebung für das Wachstum der jeweiligen Anlage (Schritt 4) geeignet. Für diese Studie soll die Kammer 24 ° C.
- Überprüfen Sie regelmäßig die EcoFAB um Wachstumsmedien innerhalb der Wurzel Wachstum Kammer füllen und füllen Wasser in den Behälter. Führen Sie alle Schritte unter sterilen Bedingungen.
Hinweis: Für frühen Entwicklungsstadien der Pflanze ist Nachfüllen der Wurzel Wachstum Kammer notwendig alle 5-7 Tage. Für späteren Entwicklungsstadien ist ein Nachfüllen notwendig alle 2 bis 3 Tage. Falls gewünscht, verwenden Sie eine Spritze oder Pipette Wurzel Exsudat Lösung aus der Wurzel Klimakammern in einem Microcentrifuge Schlauch sammeln und bewahren Sie es an einem-80 ° C Gefrierschrank; auch die Morphologie der Wurzel mit einem Gel Imager oder Mikroskop Bild.
- Sämlinge in EcoFABs mit festen Substraten zu übertragen
- Verwenden Sie die Wurzel-Kammern mit einem 5:1-Gemisch aus Elastomer Basis zum Härtemittel hergestellt, wenn eine Reihe von benutzerdefinierten Klemmen zu verwenden, fügen Sie es auf einen Objektträger (Abbildung 3 K, Abbildung 4); oder wählen Sie eine PDMS-Schicht von 30: 1 Basis gemacht zur Heilung Agent Mischung Wenn PDMS Schichten auf Folien direkt (wie in Schritt 2.2 beschrieben) einhalten.
- Sterilisieren Sie die Kammern EcoFAB, wie in Schritt 3 beschrieben.
- Sorgfältig sterilisierte Erde/Sand in die Wurzel Kammer hinzufügen, umdrehen des PDMS-Layers und fügen Sie das Substrat an der Wurzel-Kammer. Vermeiden Sie keine Partikel fallen auf das Gebiet, das in Kontakt mit der Mikroskop-Objektträger werden, da diese Haftung reduziert wird.
- Die Mikroskop-Objektträger auf die PDMS-Schicht legen und die Ränder andrücken. Drehen Sie vorsichtig das EcoFAB Gerät, so dass kein Boden/Sand aus dem Behälter öffnen fällt.
Hinweis: Für EcoFAB Geräte aus einem 5:1 Basis zur Heilung von Agent Mischung, verwenden Sie eine benutzerdefinierte Klammer um das Siegel zu sichern. - Fließen Sie flüssige Mittel "oder" Wasser durch den ein- oder Auslass Kanal des Geräts EcoFAB, und übertragen Sie einen Sämling in seinem Werk Reservoir zu, wie unter Punkt 3.3 beschrieben.
- Hinzufügen von Mikroben in EcoFABs
- Übergehen Sie eine mikrobielle Kolonie auf eine Inkubation Rohr mit 8 mL LB Brühe, und wachsen sie zu OD 0,5 (ca. 12 h).
- Übertragen Sie der Kulturlösung in ein Zentrifugenröhrchen 15 mL, und bei Raumtemperatur für 5 min bei 3000 X g, pellet-Mikroben Zentrifugieren.
- Entfernen Sie den überstand zu, und 8 mL Pflanze Wachstumsmedium verwendet in das Ziel EcoFAB. Aussetzen Sie der Pellets von Mikroben, und Zentrifugieren Sie das Rohr bei Raumtemperatur für 5 min bei 3000 X g.
- Wiederholen Sie Schritt 5.4.3. zweimal, LB Nährstoffen Spuren vollständig zu entfernen.
- Die gewaschenen Mikrobe Pellet Anlage Wachstumsmedium hinzufügen, bis seine optische Dichte etwa 0,5 bei 600 ist nm.
- 20 µL der Mikrobe-Lösung in die Wurzel Kammer durch den Auslass des EcoFAB hinzufügen. Die Stämme, die in dieser Publikation verwendeten gereist, um innerhalb von 2-3 Tagen und begonnene Kolonisation Wurzeloberflächen Pflanzenwurzeln.
- Für Chemilumineszenz entwickelt, stellen Sie sicher, den Induktor (1 mM IPTG) im Werk Wachstumsmedium Luciferase Ausdruck zu induzieren.
(6) Metabolit Profilierung der Wurzelausscheidungen von EcoFABs
- Probenvorbereitung für die LC/MS basierte Metabolomik Analyse
- Setzen Sie die Mikrozentrifugenröhrchen mit Wurzelausscheidungen von EcoFABs in ein Gefriertrockner gesammelt, und schalten Sie ein Gefriertrockner, das Wasser aus den Rohren zu entfernen.
- 300 µL der LC-MS Grade Methanol in jedem Röhrchen einfügen und für 30 min beschallen.
Achtung: Tragen Sie PSA beim Arbeiten mit Methanol. - Legen Sie die Rohre in einer Zentrifuge, und Zentrifugieren Sie ihnen bei 3000 X g für 5 min.
- Übertragen Sie die überstehenden Lösungen in neue Mikrozentrifugenröhrchen und verdunsten Sie Methanol in einem Vakuum Konzentrator.
- 150 µL von Methanol mit 1 mM LC-MS interne Standards in jedem Röhrchen einfügen und die Röhrchen im Kühlschrank für 12 h 4 ° C inkubieren.
- Die Röhrchen bei 3000 X g für 5 min zentrifugieren, und übertragen des Überstands in 0,22 µm Filterschläuche.
- Zentrifugieren Sie der Filterschläuche, und übertragen Sie die gefilterte Lösungen in 2,0 mL-LC/MS-Fläschchen mit 200 µL der Einsätze.
- Legen Sie die Fläschchen in einer LC/MS-Rack, und laden Sie das Rack innerhalb der LC/MS-Auto-Sampler.
- Datenanalyse
- Erhalten Sie einen Zugang der Metabolit Atlas und benutzerdefinierte Python Skripte26 oder verwenden Sie andere Daten-Analyse-Software zu.
- Identifizieren von Metaboliten basierend auf m /Z -Werte, Verweilzeit und zusammengesetzte Fragmentierung Muster mit einer Bibliothek von Metaboliten Standards. 27
7. Masse Spectroscopic Imaging von Pflanzenwurzeln in EcoFABs (Abbildung 7)
Hinweis: EcoFAB Geräte aus einem 5:1-Elastomer Basis zur Härtung Agent Mischung mit benutzerdefinierten Klemmen (Abb. 7A) dienen zur Wurzel Stempeln auf Nanostruktur-Initiator Massenspektrometrie (NIMS) Chips,28,29,30 da PDMS Schichten umgekehrt auf die Oberflächen der NIMS Chips verklebt werden können.
- Eine NIMS-Chip-Oberfläche mit UV-Licht für 1 h zu sterilisieren.
- Wählen Sie eine EcoFAB mit einer wachsenden Pflanze aus dem Inkubator, und legen Sie sie in eine sterile Kapuze.
- Öffnen Sie den EcoFAB-Container, und entfernen Sie die obere Platte der Schelle.
- Anheben der PDMS-Schicht zusammen mit dem Werk im Inneren, und befestigen Sie vorsichtig die PDMS-Schicht mit der Anlage auf einem Chip NIMS (Abb. 7 bD, E).
Hinweis: Sobald die Wurzel der NIMS-Chip-Oberfläche berührt, sollte es nicht verschoben werden. Dies verhindert, dass "Schmieren" der Wurzel Metaboliten. - Drücken Sie vorsichtig nach unten an den Wurzeln durch die PDMS-Schicht bis die Wurzeln vollständig die NIMS Kontaktfläche. Lassen Sie die Wurzeln an der NIMS Oberfläche für 20 Minuten.
- Heben Sie die PDMS-Ebene einschließlich der Pflanze aus der NIMS Chip, wieder zu vermeiden, die Wurzel über die NIMS Oberfläche bewegen. Die Anlage an die Klammer zurück, falls gewünscht.
- Befestigen Sie die NIMS-Chip auf einem benutzerdefinierten MALDI-Teller und legen Sie die Platte in ein MALDI-Spektrometer für Masse imaging (Abbildung 7).
- Verwenden Sie OpenMSI Programm zum Generieren der NIMS Bild der Wurzel Metaboliten (Abbildung 7-G)31.
Ergebnisse
Jedes EcoFAB System beinhaltet eine EcoFAB-Gerät und eine Pflanze großen transparenten Kunststoffbehälter. Ein EcoFAB Gerät hat eine Pflanze Reservoir, eine Wurzel-Wachstums-Kammer eine 1,6 mm Fluss Bucht und einen 1,6 mm Anschluss für standard-EcoFAB-Gerät (Abb. 2D & Abbildung 3 H) oder ein 10 mm Auslass für Wide-Steckdose EcoFAB Gerät (Abb. 2F & Abbildung 3I ). Die Pflanze Reservoir dient in eine Trapezform, das eine obere Öffnung 6 mm und 3 mm untere Öffnung, und dieses Design verringert die Wahrscheinlichkeit von fließen durchsickern während Flüssigkeitseinspritzung und sorgt auch für genügend Platz für das Pflanzenwachstum. Die Wurzel-Wachstum-Kammer nimmt eine ovale Form mit 2 mm Tiefe, viele Modellpflanzen Wurzelsysteme, passen, wie in Abbildung 2 und Egezeigt. Einlass und Auslass-Kanäle von einem standard EcoFAB-Gerät können mit PTFE Schläuche angeschlossen werden, so Nährlösungen in die Wurzel-Wachstums-Kammer fließen können, ohne den EcoFAB-Container zu öffnen. Wide-Steckdose EcoFAB Gerät reduziert den Strömungswiderstand der Steckdose, und dient vorzugsweise beim Anbau von Pflanzen mit dicken Wurzel-Systeme oder in regelmäßigen Abständen sammeln Wurzelausscheidungen nach komplexen Wurzelsysteme aus Pflanzen stammen.
Die Gussformen für die Herstellung von PDMS Schichten der EcoFAB Geräte werden in einem Design-Software erstellt, und dann 3D gedruckt in starren opaken Photopolymeren, wie in Abbildung 2 und Abbildung 3dargestellt. Pflanzen im Inneren EcoFABs können direkt beobachtet werden, mit einem Mikroskop mit einer langen Entfernung, sicherzustellen, dass die sterile Umgebung (Abbildung 8A, Ergänzende Datei 1) wachsen. EcoFAB Geräte mit Pflanzen passen auch auf einem hochauflösenden Mikroskop-Bühne, die höhere Auflösung Bildgebung der Pflanze-Mikroben-Interaktionen (Abbildung 8 b, Ergänzende Datei 2) ermöglicht. Sterilität ist nicht in diesem Umfeld gepflegt, und hochauflösende Bildgebung eignet sich daher nur für Endpunkt Messungen.
EcoFABs sollen systematische Untersuchungen von Pflanzen, wie ihre Morphologie, Stoffwechsel und mikrobieller Gemeinschaften in ihren verschiedenen Entwicklungsstadien über deren gesamten Lebenszyklus hinweg zu ermöglichen. Hier wurden EcoFABs als eine allgemeine Plattform für eine Vielzahl von Pflanzenarten zu studieren. Abbildung 8 -E zeigen 7 - Tage alten Arabidopsis Thaliana, Brachypodium Distachyonund Panicum Virgatum wächst in EcoFABs. Alle drei Pflanzen befanden sich gut in die EcoFAB über einen Monat lang wachsen. Sowohl der Dicot, Arabidopsis Thaliana und die Monocot, Brachypodium Distachyon erwiesen sich als zu ihrer Reproduktion Stadien in der EcoFABs gerecht zu werden.
Die Reversible Dichtungssystem ermöglicht die Verwendung von festen Substraten (zB., Boden) innerhalb der EcoFABs (Schritt 2.2). Diese Reversible Abdichtung Ansatz ermöglicht Laden der festen Substrate in Klimakammern Wurzel, und auch Probenentnahme aus bestimmten Regionen der Wurzel rhizosphären. Abbildung 8F -H zeigt eine Gruppe von 14 - Tage alten Brachypodium Distachyon wachsen in Hydrokultur Medium, sowie Sand und Erde mit Hydrokultur Medium (Sand) und Wasser (Boden) ergänzt. Die dünne feste Substratschicht in Klimakammern Wurzel lässt Licht durchdringen für mikroskopische Bildgebung des Wurzelsystems.
Root-Morphologie ist definiert als räumliche Konfiguration und Verteilung der ein Wurzelsystem der Pflanze und als wesentliche Physiologie Reaktion auf diverse Wachstum Umgebungen, wie Nährstoff oder Wasser Verfügbarkeit32,33genehmigt wurde, 34. EcoFABs bieten eine bequeme Herangehensweise Pflanze Morphologie zu studieren, im Laufe der Zeit oder unter verschiedenen Nährstoffverhältnisse. Abbildung 9A-F zeigen ein Beispiel für die Verwendung EcoFABs, um Wurzel Morphologien der Brachypodium Distachyon in den ersten drei Wochen zu verfolgen. Brachypodium Distachyon Sämling wurde in das EcoFAB-Gerät übertragen, und die Wurzelstruktur wurde von einer Kamera in einem BIO-RAD Gel Imager aufgenommen. Bildbearbeitungsprogramm, wie Bild J, Python und Matlab, kann weiter angewendet werden, um die Veränderungen der Wurzel Morphologien im Laufe der Zeit oder bei verschiedenen mittleren Umgebungen zu quantifizieren. Die Quantifizierung der gesamten Wurzelraum im Laufe von drei Wochen zeigten eine schrittweise Erhöhung der im frühen Stadium (< 1 Woche) gefolgt von einem linearen Wachstumstrend bis zum Ende der drei Wochen, wie in Abbildung 9dargestellt.
Eine primäre Motivation für den Bau der EcoFAB ist, Pflanze-Mikroben-Interaktionen zu untersuchen. Wie unter Punkt 5.4 beschrieben, werden Mikroorganismen in Klimakammern Wurzel von EcoFAB Geräten durch den Einlasskanal übertragen. Abbildung 10 zeigt, ein EcoFAB mit Pseudomonas Simea (ehemalsFluorescens) WCS417 (WCS417), ein Pflanzenwachstum fördern standarddüngung mit Chemilumineszenz Etiketten wurde hinzugefügt, in der Pflanze-Wurzel-Systeme mit einer Konzentration von 106 Zellen pro Pflanze. Das WCS417 Signal wurde mit einem Gel-Imager, entdeckt eine ausgeprägte räumliche Verteilung der WCS417 Mikroben in Klimakammern Wurzel angegeben. In beiden MS flüssigen Medium mit und ohne Sand festen Substrat kolonisiert WCS417 Mikroben die Oberflächen der gesamten Wurzelsysteme mit Mikroben konzentriert sich rund um die Wurzel-Tipp-Bereiche möglicherweise aufgrund der aktiven Nährstoffen Produktion von Wurzelspitzen (Abbildung 10 & H)35. Auf der anderen Seite die WCS417 Mikroben im Boden Substrat gesammelt rund um die Pflanze Reservoir Region anstelle von Wurzelspitzen (Abbildung 10ich). Wie die Mikroben durch den Auslasskanal hinzugefügt wurden, die Mikroben konnten auch im Boden Substrat bewegen, aber nicht auf die Wurzel ansammeln, wie im flüssigen Medium mit oder ohne Sand beobachtet. Dies könnte darauf hinweisen, dass der Boden eine ausreichende Nährstoff-Quelle ist, und die Mikroben auf die Pflanze Reservoir für optimale Atmung Bedingungen migriert.
Zu studieren, Metabolit Profilierung der Pflanze Wurzelausscheidungen sowie Metabolit Aufnahme und Entlassung aus der Pflanze-Mikroben-Interaktionen, wurde die Exsudat Lösungen aus der Wurzel Klimakammern in verschiedenen Wachstumsstadien der Pflanzen in EcoFABs gesammelt. Wie in Schritt 6 beschrieben, sind Exsudat Proben für LC-MS-Analyse dann extrahiert. Mit dieser Methode eine Reihe von Metaboliten ausgeschieden durch die Pflanze und von den Mikroben verbraucht wurde erkannt, und die damit verbundenen Metabolit Profilierung der Wurzelausscheidungen mit und ohne Mikroben Kolonisation wird derzeit untersucht.
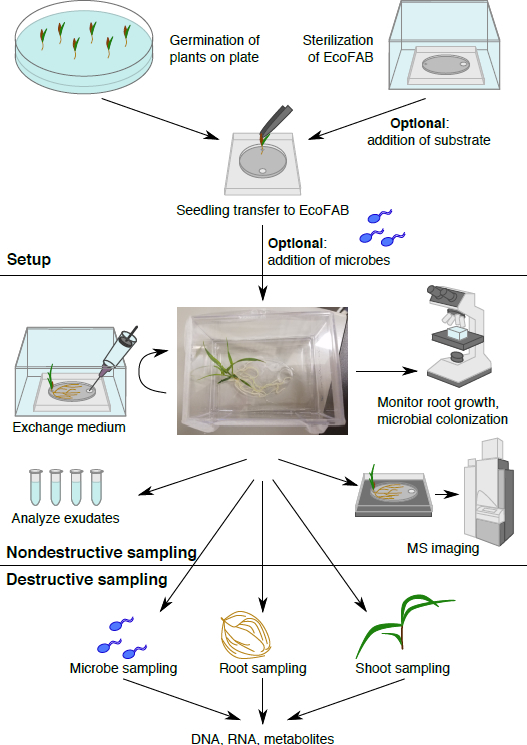
Abbildung 1: The EcoFAB Workflow. Pflanzen sind auf Platte gekeimt und übertragen die sterilisierten EcoFAB Mikroben können hinzugefügt werden. Zerstörungsfreien Probenahme: Wurzelausscheidungen abgetastet und abgebildet werden können, und Wurzel Morphologie visualisiert werden. Destruktive Probenahme ermöglicht die Analyse der Mikrobe, Wurzel und schießen Parameter im Detail.
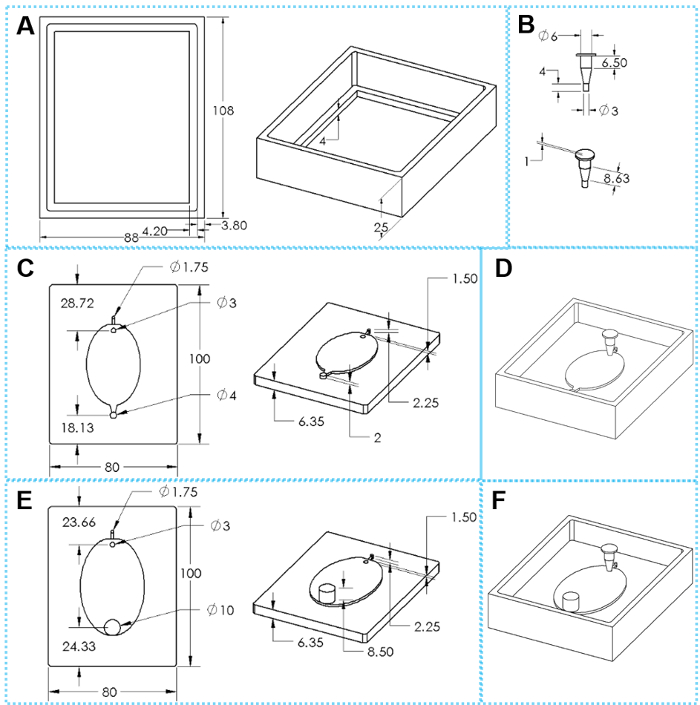
Abbildung 2: die Komponenten des 3D gedruckt Formen für EcoFAB Gerät Fabrikation. (A) Draufsicht und schräge Ansicht aus einem Guss-Rahmen. (B) top und schräge Ansichten eines Einsatzes. (C) oben und geneigten Blick auf einen standard formenaufbau. (E) oben und geneigten Blick auf einen weiten Auslauf formenaufbau. (D, F) Zusammengesetzte Formen für die Herstellung von Standard- und Wide-Steckdose EcoFAB Geräte, bzw.. Die ovalen Abmessungen sind 51 x 34 mm für kleine EcoFAB Form und 76 mm x 62 mm für große EcoFAB Form. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: EcoFAB Gerät Fabrikation. (A) Gießen die Mischung aus Elastomer-Basis und Aushärtung Agent in die Form. (B) heizen den Schimmel mit Mischung bei 85 ° C für 4 Std. (C) die Einlage aus der Form entfernen. (D) trennt die PDMS aus dem Casting-Rahmen. (E) drücken die Form Basis aus dem Casting-Rahmen. (F) mit einem Messer teilen, um die PDMS von Schimmel an den Rändern zu trennen. (G) Schälen der PDMS-Schicht langsam aus den formenaufbau. (H) Poking Löcher für Einlass und Auslass-Kanäle von der Standardebene PDMS. (I) stossen ein Loch für den Einlasskanal des Wide-Steckdose PDMS-Layers. (J) die PDMS Schicht (aus einem 15:1 Elastomer Basis zur Heilung Agent Mischung) und einen Objektträger sind gespült und übertragen in ein Plasma Reiniger für die Verklebung. (K) mit Klammern um die PDMS-Schicht (aus einem 5:1-Elastomer-Basis zur Heilung Agent Mischung) auf einen Objektträger zu halten. (L) drücken die PDMS-Schicht (aus einer 30,1-Elastomer-Basis zur Heilung Agent Mischung) direkt auf einen Objektträger. Bitte klicken Sie hier für eine größere Version dieser Figur.
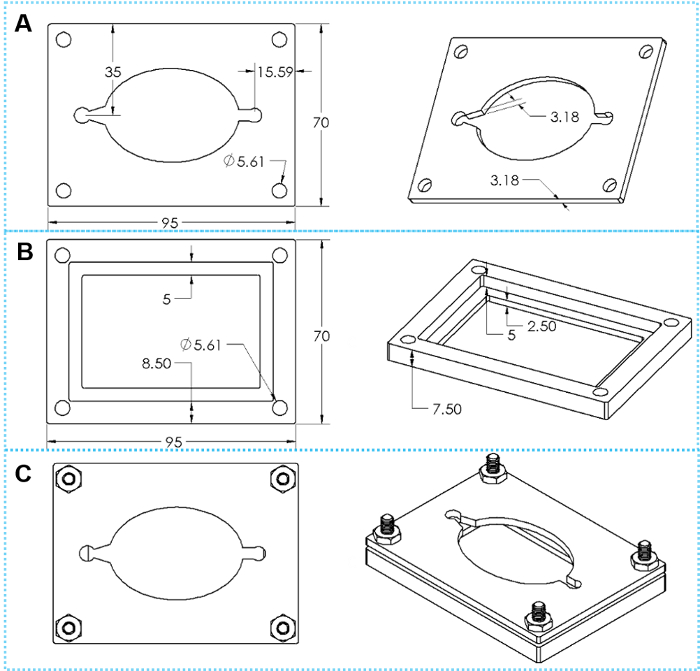
Abbildung 4: das Design von benutzerdefinierten Schellen. (A) Draufsicht und schräge Ansicht eines Top Klemmen Platte. (B) Draufsicht und schräge Ansicht von unten spannen Platte. (C) oben und geneigten Blick auf montierte Schelle mit vier Gruppen von hex Kopfschrauben. Bitte klicken Sie hier für eine größere Version dieser Figur.
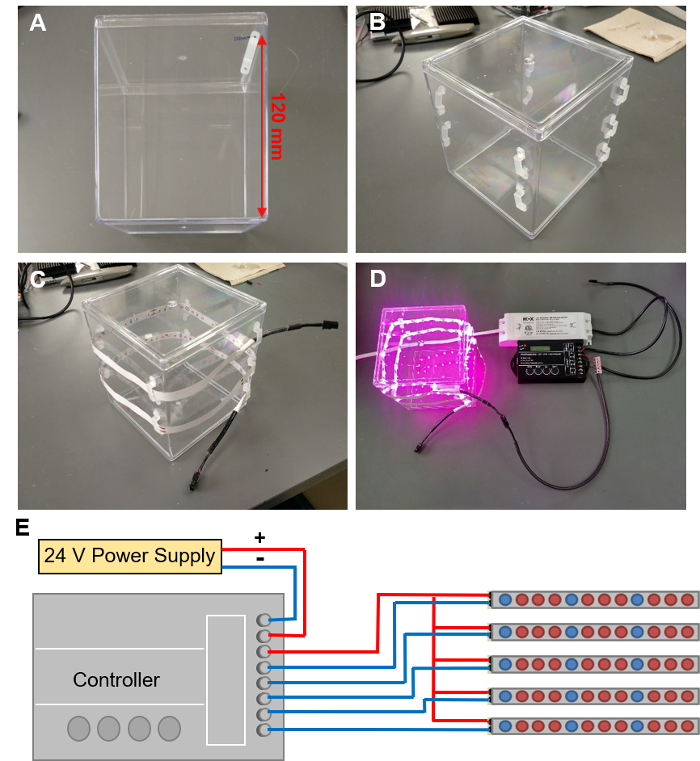
Abbildung 5: Installation von LED wachsen Lichter. (A) markieren Sie die Standorte für 9 LED Clips in einer Spirale um den EcoFAB-Container. (B) LED-Clips mit dem EcoFAB Behälter befestigt. (C) Einfädeln eines LED-Streifens durch diese Clips. (D) verbinden die LED-Leiste an einen Controller mit einem 24V Netzteil verdrahtet. (E) schematische Darstellung der Drahtverbindungen an den Controller. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6: Übertragung von Sämlingen in EcoFABs. (A) Brachypodium Distachyon Pflanzen für 2 Tage auf einem Teller 0,5 MS. (B) einfüllen die Wurzel Kammer Pflanze Wachstumsmedium. (C) mit Hilfe einer Pinzette sorgfältig die Wurzel der Pflanze Reservoir einzufügen. (D) Abdichtung des EcoFAB Behälters mit Zusammenarbeit Band, nach Zugabe von 3 mL Wasser auf den Boden des Behälters. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 7: NIMS Bildgebung der Pflanze Wurzeln in EcoFABs. (A) eine Brachypodium Distachyon wachsen in einem sterilen EcoFAB. (B) Befestigung der PDMS-Schicht mit der Anlage auf einem NIMS-Chip für 20 min. (C) Using Kupfer Band den NIMS-Chip auf eine benutzerdefinierte MALDI-Platte befestigen und laden in einem MALDI-Massenspektrometer. (D-G) eine 7 - Tage alten und ein 20 - Tage alten Brachypodium Distachyon Anlage zur NIMS imaging (D, E) und die entsprechenden Bilder der NIMS (F, G). Die vorherrschenden Ionen wurden in rot, grün und blau hervorgehoben. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 8: die allgemeine Anwendungen der EcoFABs. (A) direkt erfassen Wurzelwachstum der Brachypodium Distachyon in eine EcoFAB mit einem langen Distanz Mikroskop Setup. (B) direkt beobachten Wurzel-Mikroben-Interaktionen mit einem hochauflösenden Mikroskop-Setup. (C-E) 7 - Tage alten Arabidopsis Thaliana (C), Brachypodium Distachyon (D) und Panicum Virgatum (E) in Hydrokultur Medium 0,5 MS (F-H) 14 - Tage alten Brachypodium Distachyon gewachsen in 0,5 MS Hydrokultur (F), in Sand (G) und Erde (H) Substrat mit 0,5 MS Medium und Wasser, bzw. versorgt. Bitte klicken Sie hier für eine größere Version dieser Figur.
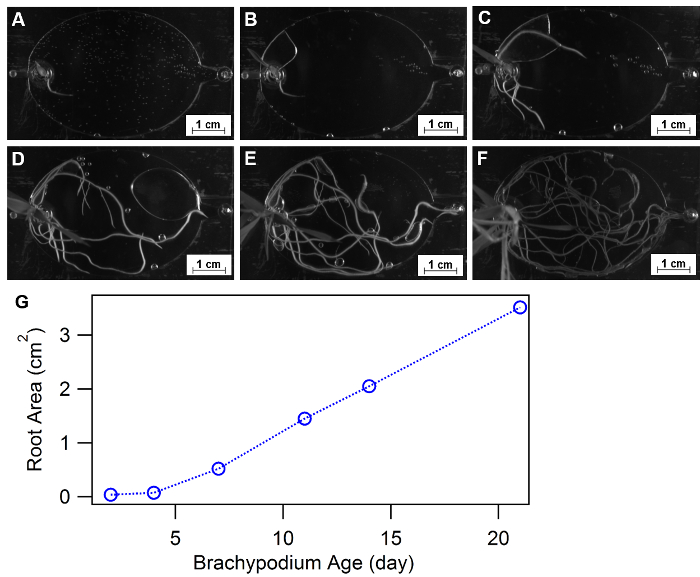
Abbildung 9: mit EcoFABs, um Wurzel Morphologie zu studieren. (A-F) WURZELENTWICKLUNG der Brachypodium Distachyon wachsen in EcoFABs gefüllt mit 0,5 MS Medium während der ersten drei Wochen: (A) 2 Tage, (B) 4 Tage, (C) 7 Tage, (D) 11, (E) 14 Tage, (F) 21 Tage des Wachstums. (G) gemittelte Wurzel Flächen wurden von ImageJ Software geschätzt. Bitte klicken Sie hier für eine größere Version dieser Figur.
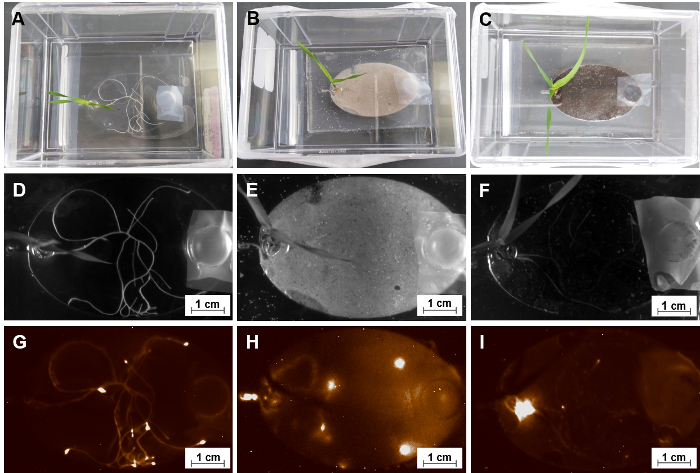
Abbildung 10: mit EcoFABs, um Wurzel-Mikroben-Interaktionen zu studieren. (A, B, C) Eine Gruppe von 15 - Tage alten Brachypodium Distachyon besiedeln mit Pseudomonas Fluorescens WCS417 in verschiedenen Formen von Medien-MS flüssige Lösung, Sand und Erde Substraten. (D, E, F) Hellfeld-Bilder von ihr Wurzelsystem. (G, H, ICH) Die entsprechenden Chemolumineszenz Bilder von dieser Wurzel-Systeme nach 14 Tagen Co-Kultur. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergänzende Datei 1. Mit EcoFAB um Wurzelwachstum. Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Datei 2. Mit EcoFAB, um Wurzel-Mikroben Interaktionen zu erfassen. Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Die Protokolle erzielte hier mit Ökosystem Fertigung um zu schaffen EcoFABs bietet Community-Ressourcen für systematische Anlage Studium der Biologie in hohem Grade kontrollierten Laborbedingungen. Fortschritte in der 3D-Druck bieten allgemein zugängliche Technologien für den Bau und iterativ verfeinern EcoFAB Entwürfe. Die Wurzel Kammer hier vorgestellten festgestellt wird, gut geeignet für imaging-Mikroskopie und Aufrechterhaltung der Sterilität, ermöglicht kontrollierte Zugabe von Mikroben, Pflanze-Mikroben-Interaktionen zu untersuchen. Die EcoFAB-Plattform ist kompatibel mit verschiedenen Pflanzenarten. Es ist wichtig zu erkennen, physiologische Wirkungen von Pflanzen innerhalb der schmalen Wurzel Kammer, so dass zusätzliche Experimente benötigt werden, um Erkenntnisse zu Pflanzen, die in natürlichen Umgebungen zu verallgemeinern.
Die Verwendung von sterilen Kammern und LED Grow Licht ermöglicht die Untersuchung der Auswirkungen der verschiedenen Lichtverhältnissen, einschließlich Wellenlänge, Intensität und Dauer auf Pflanzenwachstum und physiologische Parameter parallel. Reversible Bindung Wurzel Kammern ermöglichen die Verwendung von festen Substraten als auch räumlich feste Proben für Biochemische und genetische Analyse sammeln. Die Anwendungen von festen Substraten, wie Böden, Sand und Quarz Perlen, bieten die Möglichkeiten der Verwendung von EcoFABs, um ökologisch relevanten Labor Ökosysteme zu konstruieren. Jedoch verfeinern alle Systeme, die hier vorgestellten Verwendung werden gesättigte Flüssigkeit (hydroponischen Kulturen), die kein genaues Bild von den meisten Böden und es sind wichtig, weiter diese Entwürfe Lufteinschlüsse im Boden zu halten, so dass sie besser vertreten Naturböden.
Die Verwendung von einfachen Kameras und Mikroskope ist auf Bild Wurzelsystem Morphologie Entwicklung auf beide Massen auf zellulärer Ebene beschrieben. Diese Eignung für Überwachung Wurzel Morphologie Bildgebung und Quantifizierung werden wahrscheinlich hilfreich für das Verständnis der regulatorischen Mechanismen der Pflanze physiologischen und molekularen Signale ausgelöst durch Anlage genotypischen Anpassungen an Wachstumsbedingungen. Eine Einschränkung für das Studium der physiologischen WURZELENTWICKLUNG ist jedoch die aktuelle horizontale Platzierung des EcoFAB Gerätes. In natürlichen Umgebungen führt die Wurzeln gravitropischer Antwort auf eine überwiegend vertikale Entwicklung des Wurzelsystems. So, das horizontale System wahrscheinlich hier vorgestellten unterscheidet sich in einigen Faktoren aus einer natürlichen Umgebung, und die Herstellung von EcoFAB Systemen mit vertikalen Positionierung der Wurzel Kammer ist ein erstrebenswertes Ziel für zukünftige Versionen der EcoFAB. Obwohl die aktuelle EcoFAB Geräte horizontal platziert werden, ist die Analyse der Root-Morphologie-Parameter unter verschiedenen Bedingungen oder als Reaktion auf Mikroben, möglich. Hochauflösende Bildgebung kann angewendet werden, um Wurzel Kolonisation Dynamik der einzelnen Isolate oder Gemeinschaften, Bereitstellung von Informationen über die Pflanze Teile in verschiedenen ausreichend und mangelhaft Nährstoffverhältnisse kolonisiert sind zu erfassen. Es wird davon ausgegangen, dass solche Studien liefern wichtige neue Erkenntnisse wie Pflanze mikrobiome montiert und wie diese Dynamik im Laufe der Zeit ändern, zum Beispiel als die Wurzeln entwickeln.
Mikrofluidische Geräte ermöglichen Bildgebung von sehr jungen Pflanzen, und die Menge an Metaboliten gesammelt reicht in der Regel nicht für LCMS Analyse. Boden-basierten Systemen, wie z. B. Rhizotrons, ermöglichen die Darstellung der Morphologie der Wurzel, wenn entweder die Pflanzen mit Chemilumineszenz Konstrukt (Glo-Wurzel) oder NMR-basierte Methoden33,34umgewandelt werden. Metabolit Extraktionen aus diesen Systemen sind zeitaufwendig durch großvolumige Proben. EcoFABs sind eine Kombination aus beidem: die Herstellung ist vergleichbar mit mikrofluidischen Geräten. EcoFABs wurden entwickelt, um einfach und kostengünstig zu reproduzieren, sondern die Größe der Kammer kann angepasst werden, um Pflanzen mit kleinen oder großen Wurzelsysteme, bis zu der reproduktiven Phase wachsen. Gleichzeitigen Beobachtungen der Wurzel Morphologie Änderungen und Wurzel Exsudation sind möglich. Das System ist steril, ermöglicht kontrollierte Zugabe von bestimmten Mikroben.
EcoFABs sollen kontrollierte Einführung und Probenahme von Mikroben und Metaboliten zu ermöglichen. Insbesondere finden Sie Proben von Wurzel Klimakammern für Masse spektroskopische Metabolit Profilierung ausreichend. Die Integration der Massenspektrometrie Bildgebung (zB., NIMS Technik hier vorgestellten) bietet einen nicht-destruktive Ansatz Metabolit räumliche Verteilungen des Wurzelsystems zu studieren. Diese Technik wird wahrscheinlich hilfreich in Zukunft stabiler Isotope Ablaufverfolgung Experimente und mikrobielle Lokalisierung Zuordnung zu bestimmten Metaboliten36sein. Während dieses Protokoll auf einzelne Isolate konzentriert hat, kann das gleiche Design sicherlich für komplexere Gemeinden verwendet werden. Das Probenvolumen und Biomasse innerhalb der EcoFABs sind wahrscheinlich mehr als ausreichend für eine weitere Integration mit DNA-Sequenzierung Technologien, die zur Charakterisierung und Überwachung von mikrobiellen Gemeinschaft Struktur und Gen Ausdruck wichtig sein wird.
Zusammenfassend, dieses Protokoll beschreibt die Herstellung von Labor Ökosysteme entwickelt, für die Untersuchung der Pflanze-Mikroben-Interaktionen, mit Schwerpunkt auf einfachen und verständlichen Methoden, die leicht umgesetzt und von den Forschern um erweitert werden kann die Welt. Aktuelle Bemühungen richten sich an die Reproduzierbarkeit von Labors und die Integration einer Temperatur-Steuerung demonstrieren, so dass jeder EcoFAB unabhängig Licht und Temperatur gesteuert haben. Eine Weiterentwicklung des Systems werden die Integration von automatisierten Probenahme und Nachfüllen der EcoFAB Wurzel Kammern und die Entwicklung der reproduzierbaren Protokolle für die Festlegung der entsprechenden Pflanze mikrobiome in EcoFABs.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde unterstützt Labor leitete Forschung und Entwicklung (LDRD) Programm des Lawrence Berkeley National Laboratory unterstützt durch das Office of Science des US Department of Energy unter Vertragsnr. DE-AC02-05CH11231 und eine Auszeichnung DE-SC0014079 die US Abteilung von Energie Office of Science an der UC Berkeley. Arbeit in der molekularen Gießerei wurde unter US Abteilung von Energie Vertragsnr. unterstützt. DE-AC02-05CH11231. Wir danken auch Katherine Louie, Suzanne M. Kosina, Benjamin P. Bowen und Benjamin J. Cole am Lawrence Berkeley National Laboratory für all ihre Hilfe.
Materialien
| Name | Company | Catalog Number | Comments |
| 3D printed custom mold | LBNL | STL files available here www.eco-fab.org; The EcoFABs molds described here were printed by FATHOM: http://studiofathom.com | |
| Dow sylgard 184 silicone elastomer clear kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| Air duster spray | VWR | 75780-350 | any compressed gas duster should work |
| 15 gauge blunt needle | VWR | 89166-240 | |
| 5 mL syringe with Luer-Lok Tip | VWR | BD309646 | |
| 3”x2” microscope glass slide | VWR | 48382-179 | |
| 1.75" x 2.56" x 3.56" EcoFAB box | Amazon | B005GAQ25Q | |
| 4” x 3 ¼” microscope glass slide | Ted Pella | 260231 | |
| 4.87" x 4.87" x 5.50" EcoFAB box | Amazon | B00P9QVOS2 | |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| 3D printed custom clamp | LBNL | STL files available from Trent Northen's lab | |
| Sterile hood | AirClean Systems | AC600 Series PCR Workstations | |
| PTFE syringe tubing | Sigma-Aldrich | Z117315-1EA | |
| Ethanol | VWR | 89125-172 | |
| Bleach | |||
| Murashige and Skoog (MS) Macronutrient Salt Base | Phytotechnologies Laboratories | M502 | |
| Murashige and Skoog (MS) Micronutrient Salt Base | Phytotechnologies Laboratories | M554 | |
| Soil | Hummert International | Pro-Mix PGX | |
| Phytagel | Sigma-Aldrich | 71010-52-1 | |
| Arabidopsis thaliana | Lehle Seeds | WT-24 Col-4 Columbia wild type | |
| Brachypodium distachyon | LBNL | Standard Bd-21 line | Available from John Vogel's lab |
| Panicum virgatum | The Samuel Roberts Noble Foundation | Alamo switchgrass | |
| Micropore tape | VWR | 56222-182 | |
| LC-MS grade methanol | VWR | JT9830-3 | |
| Lyophilizer | LABCONCO | FreeZone 2.5 Plus | |
| SpeedVAC concentrator | Thermo Scientific | Savant™ SPD111 SpeedVac | |
| Ultrafree-MC GV Centrifugal Filter-0.22 µm | Millipore | UFC30GV00 | |
| Liquid chromotography system | Agilent | Agilent 1290 LC system | |
| Q Exactive mass spectrometer | Thermo Scientific | Q Exactive™ Hybrid Quadrupole-Orbitrap MS | |
| NIMS chip and custom MALDI plate | LBNL | For detailed protocol see: doi:10.1038/nprot.2008.110 | |
| MALDI mass spectrometer | AB Sciex | TOF/TOF 5800 MALDI MS | |
| Nano-coated LED grow light strip | LED World Lighting | HH-SRB60F010-2835 | |
| Power supply | LED World Lighting | MD45W24VA, LV100-24N-UNV-J | |
| TC420 controller | Amazon | B0197U7R8Q | |
| Silicone LED clips | Amazon | B00N9X1GI0 | |
| Hot glue gun | Amazon | B006IY359K | |
| Female-to-bare LED connector cable | LED World Lighting | HH-F05 | |
| Female-to-male LED connector extension cable | LED World Lighting | HH-MF1 | |
| 20AWG 2-wire cable | LED World Lighting | 6102051TFT4 | |
| WAGO 221-415 Splicing Connector | LED World Lighting | 221-415 |
Referenzen
- Morrissey, J. P., Dow, J. M., Mark, G. L., O'Gara, F. Are microbes at the root of a solution to world food production. EMBO Rep. 5 (10), 922-926 (2004).
- Farrar, K., Bryant, D., Cope-Selby, N. Understanding and engineering beneficial plant-microbe interactions: plant growth promotion in energy crops. Plant Biotechnol J. 12 (9), 1193-1206 (2014).
- Singh, J. S., Abhilash, P. C., Gupta, V. K. Agriculturally Important Microbes in Sustainable Food Production. Trends Biotechnol. 34 (10), 773-775 (2016).
- Dubey, R. K., Tripathi, V., Dubey, P. K., Singh, H. B., Abhilash, P. C. Exploring rhizospheric interactions for agricultural sustainability: the need of integrative research on multi-trophic interactions. J Clean Prod. 115, 362-365 (2016).
- Hunter, P. Plant microbiomes and sustainable agriculture. EMBO Rep. 17 (12), 1696-1699 (2016).
- van der Heijden, M. G. A., Hartmann, M. Networking in the Plant Microbiome. PLoS Biol. 14 (2), e1002378(2016).
- Vessey, J. K. Plant growth promoting rhizobacteria as biofertilizers. Plant Soil. 255 (2), 571-586 (2003).
- Yang, J., Kloepper, J. W., Ryu, C. -M. Rhizosphere bacteria help plants tolerate abiotic stress. Trends Plant Sci. 14 (1), 1-4 (2009).
- Reynolds, H. L., Packer, A., Bever, J. D., Clay, K. GRASSROOTS ECOLOGY: PLANT-MICROBE-SOIL INTERACTIONS AS DRIVERS OF PLANT COMMUNITY STRUCTURE AND DYNAMICS. Ecology. 84 (9), 2281-2291 (2003).
- Finkel, O. M., Castrillo, G., Herrera Paredes, S., Salas González, I., Dangl, J. L. Understanding and exploiting plant beneficial microbes. Curr Opin Plant Biol. 38, 155-163 (2017).
- Northen, T. R., Zhang, Z., Gao, J., Swenson, T., Yoshikuni, Y. Advancing Our Understanding of the Chemistry of Soil Microbiomes. National Academies of Sciences, Engineering, and Medicine. 2017. The Chemistry of Microbiomes: Proceedings of a Seminar Series. , The National Academies Press. Washington, DC. (2017).
- Busby, P. E., et al. Research priorities for harnessing plant microbiomes in sustainable agriculture. PLOS Biology. 15 (3), e2001793(2017).
- Sanati Nezhad, A. Microfluidic platforms for plant cells studies. Lab Chip. 14 (17), 3262-3274 (2014).
- Oburger, E., et al. Evaluation of a novel tool for sampling root exudates from soil-grown plants compared to conventional techniques. Environ Exp Bot. 87, 235-247 (2013).
- Van Der Krift, T. A. J., Berendse, F. Root life spans of four grass species from habitats differing in nutrient availability. Funct Ecol. 16 (2), 198-203 (2002).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. P Natl. Acad. Sci. USA. 114 (17), 4549-4554 (2017).
- Sanati Nezhad, A., Naghavi, M., Packirisamy, M., Bhat, R., Geitmann, A. Quantification of cellular penetrative forces using lab-on-a-chip technology and finite element modeling. P Natl. Acad. Sci. USA. 110 (20), 8093-8098 (2013).
- Jiang, H., Xu, Z., Aluru, M. R., Dong, L. Plant chip for high-throughput phenotyping of Arabidopsis. Lab Chip. 14 (7), 1281-1293 (2014).
- Parashar, A., Pandey, S. Plant-in-chip: Microfluidic system for studying root growth and pathogenic interactions in Arabidopsis. Appl. Phys. Lett. 98 (26), 263703(2011).
- Busch, W., et al. A microfluidic device and computational platform for high-throughput live imaging of gene expression. Nat Methods. 9 (11), 1101-1106 (2012).
- Grossmann, G., et al. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23 (12), 4234-4240 (2011).
- Aufrecht, J. A., Ryan, J. M., Hasim, S., Allison, D. P., Nebenführ, A., Doktycz, M. J., Retterer, S. T. Imaging the Root Hair Morphology of Arabidopsis Seedlings in a Two-layer Microfluidic Platform. J. Vis. Exp. (126), (2017).
- Garvin, D. F., et al. Development of Genetic and Genomic Research Resources for Brachypodium distachyon, a New Model System for Grass Crop Research. Crop Sci. 48 (Supplement_1), S69-S84 (2008).
- Lisensky, G. C., et al. Replication and Compression of Surface Structures with Polydimethylsiloxane Elastomer. J. Chem. Educ. 76 (4), 537(1999).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502(2010).
- Yao, Y., et al. Analysis of Metabolomics Datasets with High-Performance Computing and Metabolite Atlases. Metabolites. 5 (3), 431-442 (2015).
- Sumner, L. W., et al. Proposed minimum reporting standards for chemical analysis Chemical Analysis Working Group (CAWG) Metabolomics Standards Initiative (MSI). Metabolomics. 3 (3), 211-221 (2007).
- Gao, J., de Raad, M., Bowen, B. P., Zuckermann, R. N., Northen, T. R. Application of Black Silicon for Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 88 (3), 1625-1630 (2016).
- Gao, J., et al. Morphology-Driven Control of Metabolite Selectivity Using Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 89 (12), 6521-6526 (2017).
- Woo, H. -K., Northen, T. R., Yanes, O., Siuzdak, G. Nanostructure-initiator mass spectrometry: a protocol for preparing and applying NIMS surfaces for high-sensitivity mass analysis. Nat. Protoc. 3 (8), 1341-1349 (2008).
- Rübel, O., et al. OpenMSI: A High-Performance Web-Based Platform for Mass Spectrometry Imaging. Anal. Chem. 85 (21), 10354-10361 (2013).
- López-Bucio, J., Cruz-Ramı́rez, A., Herrera-Estrella, L. The role of nutrient availability in regulating root architecture. Curr Opin Plant Biol. 6 (3), 280-287 (2003).
- Lynch, J. P. Steep, cheap and deep: an ideotype to optimize water and N acquisition by maize root systems. Ann. Bot. 112 (2), 347-357 (2013).
- Rellán-Álvarez, R., et al. GLO-Roots: an imaging platform enabling multidimensional characterization of soil-grown root systems. eLife. 4, e07597(2015).
- Kamilova, F., Validov, S., Azarova, T., Mulders, I., Lugtenberg, B. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria. Environ. Microbiol. 7 (11), 1809-1817 (2005).
- Klitgaard, A., Nielsen, J. B., Frandsen, R. J. N., Andersen, M. R., Nielsen, K. F. Combining Stable Isotope Labeling and Molecular Networking for Biosynthetic Pathway Characterization. Anal. Chem. 87 (13), 6520-6526 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten