Method Article
Écosystème des protocoles de Fabrication (EcoFAB) pour la Construction des écosystèmes de laboratoire destiné à étudier les Interactions plantes-microorganismes
Dans cet article
Résumé
Cet article décrit les protocoles détaillés pour la fabrication de l’écosystème des appareils (EcoFABs) qui permettent l’étude des plantes et les interactions plantes-microorganismes dans des conditions très contrôlées en laboratoire.
Résumé
Interactions plantes-microorganismes bénéfiques offrent une solution biologique durable susceptibles de stimuler la production alimentaire et de la bioénergie de faibles consommations. Une meilleure compréhension mécaniste de ces interactions plantes-microorganismes complexes seront cruciale pour améliorer la production végétale comme écologique bien plus performante basic étudie les interactions sol-plante-microbe chargée de l’enquête. Ici, une description détaillée pour la fabrication de l’écosystème est présentée, à l’utilisation largement disponibles technologies d’impression 3D, pour créer des habitats contrôlées en laboratoire (EcoFABs) pour études mécanistes des interactions plantes-microorganismes dans spécifique environnementale conditions. Deux tailles de EcoFABs sont décrits qui conviennent pour l’étude des interactions microbiennes avec diverses espèces de plantes, y compris l’Arabidopsis thaliana, Brachypodium distachyonet Panicum virgatum. Ces dispositifs intermédiaires permettant de contrôlé manipulation et échantillonnage de racine microbiomes, chimie de la racine ainsi que l’imagerie de la morphologie de la racine et localisation microbienne. Ce protocole comprend les détails pour le maintien des conditions stériles à l’intérieur de EcoFABs et montage indépendants systèmes de lumière LED sur EcoFABs. Méthodes détaillées pour l’ajout de différentes formes de médias, y compris les sols, sable et milieux de culture liquide couplée à la caractérisation de ces systèmes à l’aide de l’imagerie et métabolomique est décrites. Ensemble, ces systèmes permettent l’enquête détaillée et dynamique de la plante et plante-microbienne consortiums dont la manipulation de microbiome composition (y compris mutants), la surveillance de la croissance des plantes, la morphologie racinaire, composition de l’exsudat, et localisation microbienne dans des conditions environnementales contrôlées. Nous prévoyons que ces protocoles détaillés servira de point de départ important pour les autres chercheurs, idéalement aidant à créer normalisés systèmes expérimentaux pour l’étude des interactions plantes-microorganismes.
Introduction
L’application des microbes bénéfiques de plantes dans l’agriculture offre un grand potentiel d’augmenter l’alimentation durable et la production de biocarburants à fournir pour une population croissante1,2,3,4. Une quantité importante de travail confirment l’importance des plantes microbiomes dans l’absorption des éléments nutritifs végétaux, tolérance aux stress et résistance à la maladie5,6,7,8. Toutefois, il est difficile d’étudier ces mécanismes des interactions plantes-microorganismes dans les écosystèmes de champ en raison de la complexité et la reproducibilité associée et l’incapacité de contrôler avec précision la composition microbiome et génétique (p. ex.., en utilisant les mutants microbienne)4,9,10.
Une stratégie consiste à construire des écosystèmes modèle simplifié pour permettre contrôlée, des expériences de laboratoire répliqué étudie les interactions plantes-microorganismes pour générer des idées pouvant être testé plus loin dans la zone10,11, 12. Ce concept s’appuie sur des approches traditionnelles à l’aide de plantes cultivées dans des pots remplis de terre ou sur plaques de gélose dans les serres ou pépinières d’entreprises13. Même si elles resteront probablement le plus largement utilisé des approches, ils n’ont pas la capacité de précisément contrôler et manipuler des milieux de croissance végétale. À ces fins, rhizoboxes et rhizotrons représentent une amélioration majeure dans la possibilité d’étudier les processus sous terre14,15et, premiers protocoles ont été publiés pour l’analyse des métabolites de la rhizosphère en sol16. Plus récemment, pour permettre l’analyse à haut débit, microfluidique avancé dispositifs13,17 comme plante puce18,19, RootArray20et21de RootChip, ont été mis au point des outils efficaces pour le phénotypage d’usine avec une résolution spatiale-l’échelle du micromètre pour surveiller les premiers stades de croissance de la plante de petit modèle Arabidopsis thaliana en liquide fluide véhiculé. Récemment, une plate-forme d’imagerie de la bicouche a été décrite qui permet l’imagerie poils absorbants d’Arabidopsis thaliana au stade plantule avec une plate-forme de microfluidique22.
Ici, les protocoles détaillés pour la construction d’appareils de laboratoire (EcoFABs) sont fournies, pour étudier les interactions plantes microorganismes et montrent qu’ils peuvent servir à étudier diverses plantes y compris Arabidopsis thaliana, Brachypodium distachyon23, l’écologiquement importante folle avoine Avena barbata et la récolte de bioénergie Panicum virgatum (Panic raide). EcoFAB est une plateforme de croissance végétale stérile qui comprend deux composants principaux : le dispositif EcoFAB et récipient transparent taille plante stérile. La EcoFAB périphérique est issu d’un polydiméthylsiloxane (PDMS), procédé qui consiste à coulée PDMS de fabrication des couches d’un moule en plastique imprimé 3D et collage des couches PDMS sur lames de microscope à l’aide des méthodes précédemment rapporté24,25 . Les procédures détaillées de workflow EcoFAB, telles que la fabrication de dispositifs, stérilisation, la germination des graines, transplantation des semis, microbe inoculation/la co-culture, préparation des échantillons et l’analyse, sont décrits dans le présent protocole (Figure 1). Autres modifications du flux de base sont décrites, y compris l’installation de l’ordinateur contrôlaient LED grow lights et l’utilisation des substrats solides. L’utilisation de techniques pour étudier la morphologie racinaire d’imagerie change, colonisation microbienne des racines, et l’Imagerie spectroscopique masse d’exsudats racinaires sont décrites. Nous prévoyons que le design simple et peu coûteux, issu des matériaux facilement disponibles, ainsi que les protocoles détaillés présentés ici, deviendra la plate-forme EcoFAB une ressource communautaire, normaliser les études en laboratoire usine-microbiome.
Protocole
ATTENTION : Ce protocole prévoit l’utilisation de produits chimiques dangereux, des objets tranchants, appareils électriques, des objets chauds et autres dangers qui peuvent causer des blessures. Équipement de protection individuelle approprié (PPE, par exemple., gants résistant aux produits chimiques, des lunettes de sécurité, blouse de laboratoire, vêtements longs, des chaussures à bout fermé, etc..) doivent être portés et les procédures de sécurité appropriées (formation à la sécurité, l’utilisation d’une hotte aspirante, etc..) Il faut suivre.
1. EcoFAB appareil Fabrication : moulage des couches PDMS (Figure 2 et Figure 3)
- Construire les moules EcoFAB utilisant des techniques d’impression 3D (les fichiers de conception sont disponibles au. Chaque moule comprend trois parties : un châssis de moulage, une base de moule recommandés et un insert, tel qu’illustré à la Figure 2. Imprimer la base de moule et insérer hors des photopolymères opaques rigides à l’aide d’une imprimante 3D en plastique. Utiliser un résolution minimum de 100 µm et imprimer le cadre bâti avec l’acrylonitrile butadiène styrène (ABS).
- Mélanger 40 mL d’élastomère de siloxane base avec polymérisation agent dans un contenant jetable de 1 L. En fonction de l’expérience souhaitée (points 2.1 et 2.2), utiliser différents rapports (v/v), avoir une base/polymérisation agent (5:1, 15:1, ou 30 : 1). Passez aux étapes de 1,3 à 1,8 pour toutes sortes de mélanges.
ATTENTION : Porter des gants résistant aux produits chimiques, des lunettes de sécurité et autres EPI. - Placer le récipient dans une chambre à vide pendant au moins 30 min enlever les bulles d’air du mélange élastomère.
- Versez le mélange dans le moule en plastique imprimé 3D assemblé (Figure 3 a) et garder le moule sur un bloc de chauffage à 85 ° C pendant 4 h (Figure 3 b).
ATTENTION : Porter des EPI pour éviter les brûlures. - Laisser le moule refroidir pendant 5 min. Puis tirez sur l’insert du moule doucement (Figure 3), puis lentement Insérez un couteau entre le cadre bâti et le PDMS (le mélange élastomère solidifiée) pour les séparer (Figure 2D).
- Appuyez sur le moule base avec PDMS vers le haut hors du cadre bâti (Figure 3E). Utilisez un couteau ou autres outils pour séparer délicatement la couche PDMS de la base de la moisissure sur les bords (Figure 3F) et ensuite lentement décoller de la surface du moule (Figure 3).
- Créer d’entrée et les canaux de sortie sur les couches PDMS en faisant des trous pour les ports d’entrée et de sortie avec un 15 mm de ~1.6 jauge aiguille émoussée (Figure 3, H, I).
Remarque : Le moule standard dispose d’un port d’entrée et de sortie, alors que le moule de la sortie d’échelle n’a besoin que l’orifice d’entrée (Figure 3, H, I). - Utiliser des ciseaux pour couper les bords des couches PDMS.
Remarque : Les couches PDMS taillées doivent être ≥76 mm x rectangles de 51 mm pour les petits appareils EcoFAB et ≥102 mm x rectangles de 83 mm pour les gros appareils EcoFAB.
2. Fabrication de dispositifs EcoFAB : attacher chimiquement PDMS couches sur lames de Microscope (Figure 3 et Figure 4)
- Collage en permanence les couches PDMS à lames de microscope
- Rinçage du côté de la liaison de la couche PDMS (constituée d’un élastomère de 15:1 base de mélange d’agent de polymérisation) et 7,6 microscope de cm × 5 glissez avec du méthanol et puis souffle à sec avec l’air comprimé ou un pistolet ultra pure d’azote.
ATTENTION : Le méthanol est toxique. Travailler sous une hotte et porter la bâche de protection, gants et autres EPI. - Placez la lame de microscope et de la couche PDMS dans un plasma cleaner avec leurs côtés de liaison vers le haut (Figure 3J). Si un plasma cleaner n’est pas disponible, passez à l’étape 2.2.
- Fermer la chambre et la soupape de dégagement de gaz du plasma est plus propre et sur le vide et la pompe vers le bas de la chambre pendant 1 min.
- Mettre en marche le générateur de plasma et passer le niveau de radiofréquences (RF) à « HI » pendant 1 min.
- Mettez hors tension la pompe à vide et la puissance du plasma et aérer la chambre à air.
- Sortir la lame de microscope et de la couche PDMS de la chambre de plasma et appuyez rapidement sur les quatre bords de la couche PDMS sur le toboggan avec une pression uniforme (Figure 3 L). Assurez-vous que la région de centre ovale de la couche PDMS (la chambre de racine) ne touche pas la lame.
- Placez l’appareil EcoFAB scellé sur un 120 ° C chauffage bloc pendant 20 min de sécuriser davantage la liaison permanente entre la couche PDMS et la lame de microscope.
- Laissez l’appareil refroidir pendant 5 min. de garniture sur les bords supplémentaires de la couche PDMS avec un couteau.
- Rinçage du côté de la liaison de la couche PDMS (constituée d’un élastomère de 15:1 base de mélange d’agent de polymérisation) et 7,6 microscope de cm × 5 glissez avec du méthanol et puis souffle à sec avec l’air comprimé ou un pistolet ultra pure d’azote.
- Scellage physique réversible des couches PDMS à lames de microscope
- Le réversible technique d’étanchéité utilise une série de colliers personnalisés (soit imprimé par une imprimante 3D en plastique ou métal usiné dans, les dessins sont montrées à la Figure 4).
- Placer la lame de microscope dans la découpe sur la plaque de fixation du bas et puis aligner le calque PDMS (fait d’une base d’élastomère de 5:1 pour mélange agent de polymérisation) sur le dessus de la diapositive.
- Placer la plaque de bride supérieure au-dessus de la couche PDMS. Fixez les plaques supérieure et inférieure, ensemble à l’aide de quatre vis à tête hexagonales, orientant les vis afin que les écrous sont enfilées sur du haut de la pince.
- PDMS adhérant directement à lames de microscope
- La position de la couche PDMS (faite d’une base d’élastomère de 30 : 1 au mélange d’agent de polymérisation) au sommet d’une lame de microscope.
- Appuyez sur la couche PDMS à la diapositive. La couche PDMS douce et très adhésive (30 : 1) devrait s’en tenir à la diapositive, créant un joint imperméable à l’eau sans la liaison chimique permanente ou presse physique d’un collier de serrage (Figure 3 L).
- Le réversible technique d’étanchéité utilise une série de colliers personnalisés (soit imprimé par une imprimante 3D en plastique ou métal usiné dans, les dessins sont montrées à la Figure 4).
3. EcoFABs stérilisation
- Rincer les dispositifs EcoFAB avec de l’eau ultrapure.
- Mettre un appareil de EcoFAB dans un conteneur EcoFAB et ajouter de l’éthanol à 70 % jusqu'à ce que l’appareil est immergé. Fermer le couvercle du récipient et secouer doucement pour mouiller toutes les surfaces à l’intérieur avec de l’éthanol. Veillez à ce que la chambre de croissance racinaire du dispositif EcoFAB est remplie avec de l’éthanol, avec très peu ou aucun flux d’air des bulles.
- Après incubation de 30 min à température ambiante, verser au large de l’éthanol à 70 % et répétez l’incubation avec l’éthanol à 100 % pendant 5 min.
- L’éthanol s’écouler et incuber la EcoFAB stérilisé pendant 16 h sous une hotte à flux laminaire pour sécher complètement. Le cas échéant, stériliser le système en tournant sur le UV lumière au sein de la hotte pendant 1 h.
ATTENTION : Porter les EPI approprié lorsque vous travaillez avec des lampes UV. - Stocker le EcoFABs stérilisé dans une hotte stérile ou sacs stérilisés à l’autoclave pour une utilisation future.
4. EcoFABs avec LED Grow Lights (Figure 5)
- Fixation des LED bandes dans des réservoirs EcoFAB
- Marquer les emplacements sur le conteneur EcoFAB pour 9 clips LED. Commencer par le premier clip de 120 mm vers le haut depuis le fond du récipient, le long du bord (Figure 5 a) et continuer à marquer les emplacements de clip en spirale autour du récipient, avec chaque prochain clip tomber 10 mm. Une spirale de 9 clips qui permet à une bande de LED de 1 m à enrouler deux fois autour du récipient.
- Colle chaude un clip LED à chacun marqué position en ajoutant deux plots de colle chaude sur le contenant, aligné avec la position des trous de fixation des clips. Pressez les trous de l’attache dans ces deux plots de colle, puis ajouter un peu de colle sur le dessus les trous. Répétez l’opération pour tous les clips jusqu'à 9 clips forment une spirale (Figure 5 b).
ATTENTION : Porter des gants et autre EPI lorsque vous travaillez avec de la colle chaude pour éviter les brûlures. - Introduire la bande de LED dans les clips en forme de spirale, avec LEDs vers l’intérieur du conteneur. La bande devrait cercle autour deux fois (Figure 5).
- Raccordement LED bandes à l’alimentation avec un contrôleur (Figure 5 affiche une chambre EcoFAB avec voyants lumineux, la programmation du contrôleur est décrit à l’étape 4.3).
ATTENTION : Risque de choc électrique : Assurez-vous que l’alimentation est débranchée lors du branchement des fils.- Raccorder les bornes positive et négative de l’alimentation aux bornes « entrée : V + » et « INPUT : V- » du contrôleur à l’aide de câble à 2 fils (Figure 5E affiche un schéma de l’installation du contrôleur).
- Raccordez le fil négatif du bout dénudé d’un câble femelle-à-nu à un canal de « Sortie » sur le contrôleur.
Remarque : Il y a cinq chaînes sur le contrôleur qui est utilisé dans le présent protocole, donc il peut prendre en charge jusqu'à cinq bandes de 1 m LED. - Connectez les fils positifs tous des câbles à un compact épissage connecteur (si plusieurs canaux est nécessaires) et puis lier ce connecteur à la borne « sortie V + » du contrôleur.
- Branchez chaque bande LED dans l’extrémité femelle des câbles, pour chaque LED possède sa propre chaîne soit contrôlée. Si vous le souhaitez, utilisez des câbles de femmes-hommes pour étendre la portée.
- Programmer le contrôleur pour un cycle de lumière désiré selon les instructions du fabricant,
5. la culture de plantes en EcoFABs
- La germination et la stérilisation des semences
Remarque : La stérilisation des semences et toutes les étapes suivantes avec les semis doivent être exécutés dans des conditions stériles. Le procédé de stérilisation ci-dessous convient aux graines d’Arabidopsis thaliana, Avena barbata, Brachypodium distachyonet Panicum virgatum. Panicum virgatum graines devraient être suspendues dans l’acide sulfurique 60 % pendant 1 h avant que le processus de stérilisation. Il est conseillé de préparer 1-2 graines par EcoFAB périphérique, considérant le taux de germination et de l’homogénéité de germination.- Tremper les graines dans l’éthanol à 70 % pendant 2 min.
- Retirez l’éthanol avec une pipette et rincez les graines à l’eau stérile trois fois.
- Laissez les graines dans une solution de 10 % eau de Javel pendant 5 min.
- Enlever la solution de l’eau de Javel et laver soigneusement les graines à l’aide de l’eau stérile trois fois.
- Ajouter de l’eau stérile pour les graines et incuber le tube de microcentrifuge dans un réfrigérateur à 4 ° C pendant 7 jours.
- Uniformément répartis les graines sur le milieu de Murashige et Skoog (MS) 0,5 avec 0,6 % phytagel et sceller les plaques avec du ruban adhésif micropore.
- Les plantes atteignent une longueur de racine d’environ 5 mm pour le transfert à EcoFABs (Figure 6 a). Pour les expériences présentées ici s’appliquent un régime 16 h de lumière/8 h éclairage sombre dans une chambre de culture de 22 ° C et incuber les plantes 2-7D avant transfert à EcoFAB (2jours pour Avena barbata et Brachypodium distachyon, 7 jours pour Arabidopsis thaliana et Panicum virgatum).
- Transfert de plantules dans EcoFABs avec le milieu liquide (Figure 6)
- À l’aide d’une seringue stérile ou une micropipette, rincer la chambre de la racine d’un dispositif EcoFAB avec de l’eau stérile pendant trois fois et ensuite remplir la chambre de racine avec le milieu de croissance d’intérêt, par exemple 0,5 MS moyen (Figure 6 b, point 5.1.6).
- Insérez avec précaution une seule plantule dans le réservoir de l’usine du dispositif EcoFAB (Figure 6).
Remarque : La racine doit être complètement submergée à l’intérieur de la chambre de la racine, avec la tige qui sort du réservoir. - Ajouter 3 mL d’eau stérile dans le récipient, en évitant le périphérique EcoFAB. Cela augmentera l’humidité et réduire l’évaporation du milieu de la chambre de la racine.
- Fermer le récipient et sceller le couvercle avec du ruban micropore (Figure 6).
- Placez la EcoFAB dans un incubateur de l’usine, ou d’utiliser le système d’éclairage EcoFAB dans un environnement à température contrôlée adapté pour la croissance de la plante respectif (étape 4). Pour cette étude, la valeur la chambre 24 ° C.
- Vérifier périodiquement la EcoFAB pour remplir des milieux de culture à l’intérieur de la chambre de croissance des racines et ajouter l’eau dans le récipient. Effectuez toutes les opérations dans des conditions stériles.
Remarque : Pour les premiers stades de croissance végétale, remplissage de la chambre de croissance racinaire est nécessaire tous les 5 à 7 jours. Pour les stades de croissance, un remplissage est nécessaire tous les 2 à 3 jours. Si vous le souhaitez, utiliser une seringue ou une pipette pour recueillir solution exsudat racinaire des chambres de croissance racinaire dans un tube de microcentrifuge et stockez-la dans un congélateur à-80 ° C ; en outre, l’image la morphologie de la racine avec un imageur de gel ou le microscope.
- Transfert de plantules dans EcoFABs avec des substrats solides
- Utiliser les racine chambres fabriqués avec un mélange de 5:1 avoir une base à salaison si vous utilisez un jeu de brides personnalisées pour l’attacher à une lame de microscope (Figure 3 K, Figure 4) ; ou choisissez qu'une couche PDMS constituée de 30 : 1 base de mélange d’agent de polymérisation si adhérant couches PDMS à diapositives directement (comme décrit à l’étape 2.2).
- Stériliser les chambres EcoFAB, tel que décrit à l’étape 3.
- Ajouter avec précaution sol/sable stérilisé dans la chambre de racine, retournez la couche PDMS et versez le substrat dans le compartiment de la racine. Éviter toute chute de particules sur la zone qui sera en contact avec la lame de microscope, car cela va réduire l’adhérence.
- Placez la lame de microscope sur le dessus de la couche PDMS et appuyez fermement sur tous les bords. Soigneusement faire basculer l’appareil EcoFAB afin qu’aucune terre/sable ne tombe hors du réservoir d’ouverture.
Remarque : Pour les appareils EcoFAB constituées d’un 5:1 base de mélange d’agent de polymérisation, utilisez un collier personnalisé pour garantir l’étanchéité. - Flux de liquide ou l’eau par la voie d’entrée ou de sortie du dispositif EcoFAB et transférer un semis dans son réservoir de l’usine, comme indiqué au point 3.3.
- L’ajout de microbes dans EcoFABs
- Transférer une colonie microbienne dans un tube d’incubation avec 8 mL de bouillon LB et développez-le à OD 0,5 (environ 12 h).
- Transvaser la solution de culture dans un tube à centrifuger 15 mL et il centrifuger à température ambiante pendant 5 min à 3000 x g pour granuler les microbes.
- Retirez le surnageant et ajoutez 8 mL de milieu de croissance de plantes utilisée dans la cible EcoFAB. Suspendre le culot de microbes et centrifuger le tube à température ambiante pendant 5 min à 3000 x g.
- Répétez l’étape 5.4.3. deux fois pour enlever toute trace de nutriments LB.
- Ajouter substrat de croissance de plantes au culot microbe lavés jusqu'à ce que sa densité optique est d’environ 0,5 à 600 nm.
- Ajouter 20 µL de la solution de microbe dans la chambre de la racine par la sortie EcoFAB. Les souches utilisées dans la présente publication s’est rendu aux racines des plantes dans 2-3 jours et a commencé la surface des racines colonisatrice.
- Car conçu par chimiluminescence, veillez à inclure l’inducteur (1 mM IPTG) dans le milieu de croissance végétale pour induire l’expression de la luciférase.
6. metabolite Profiling d’exsudats racinaires de EcoFABs
- Préparation des échantillons pour LC/MS base analyse de la métabolomique
- Mettre les tubes de microcentrifuge avec les exsudats racinaires prélevés dans EcoFABs en un lyophilisateur et allumez le lyophilisateur pour retirer toute l’eau des tubes.
- Ajouter 300 µL de méthanol de SM-grade dans chaque tube et laisser agir pendant 30 min.
ATTENTION : Porter des EPI lorsque vous travaillez avec du méthanol. - Placer les tubes dans une centrifugeuse et eux centrifuger à 3000 g pendant 5 min.
- Transférer les solutions surnageantes dans nouveaux tubes de microcentrifuge et évaporer le méthanol dans un concentrateur sous vide.
- Ajouter 150 µL de méthanol aux normes internes de 1 mM LC-MS dans chaque tube et incuber les tubes dans un réfrigérateur de 4 ° C pendant 12 h.
- Centrifuger les tubes à 3000 g pendant 5 min et transvaser le surnageant dans tubes de filtre 0,22 µm.
- Centrifuger les tubes de filtre et transférer les solutions filtrées dans les flacons de LC/MS 2,0 mL avec 200 µL d’inserts.
- Placer les flacons dans un rack de LC/MS et charger le panier à l’intérieur de la LC/MS échantillonneur automatique.
- Analyse des données
- Obtenir un accès de métabolite Atlas et personnalisé de scripts Python26 ou utiliser d’autres logiciels d’analyse de données.
- Identifier des métabolites issus de m /z des valeurs, des temps de rétention et des patrons de fragmentation composés en utilisant une bibliothèque de normes de métabolite. 27
7. Imagerie spectroscopique masse de racines des plantes en EcoFABs (Figure 7)
NOTE : EcoFAB dispositifs constituées d’un élastomère de 5:1 base de mélange d’agent de polymérisation avec des colliers personnalisés (Figure 7 a) sont utilisés pour racine l’estampage sur nanostructure-initiateur copeaux de spectrométrie de masse (NIMS),28,29,30 étant donné que les couches PDMS peuvent se greffer à l’inverse aux surfaces des copeaux de NIMS.
- Stériliser une surface de puce NIMS avec lumière UV pendant 1 h.
- Choisissez un EcoFAB avec une plante de plus en plus de l’incubateur et placez-le dans une hotte stérile.
- Ouvrez le conteneur EcoFAB et enlever la plaque supérieure de la bride.
- Soulevez la couche PDMS ainsi que de la plante à l’intérieur et attacher soigneusement la couche PDMS avec la plante sur une puce de NIMS (Figure 7 bD, E).
Remarque : Une fois la racine touche la surface de puce NIMS, il ne doit pas être déplacé. Cela empêche les « bavures » des métabolites racine. - Appuyez doucement sur les racines à travers la couche PDMS jusqu'à ce que les racines touchent entièrement la surface NIMS. Laisser les racines à la surface de NIMS pendant 20 min.
- Enlever la couche PDMS comportant l’installation de la puce de NIMS, évitant encore déplacer la racine sur toute la surface de NIMS. Retourner la plante à la pince si vous le souhaitez.
- Attacher la puce NIMS sur une plaque personnalisée de MALDI et charger la plaque dans un spectromètre MALDI pour masse d’imagerie (Figure 7).
- Programme OpenMSI permet de générer l’image NIMS de racine métabolites (Figure 7-G)31.
Résultats
Chaque système EcoFAB muni d’un dispositif EcoFAB et une usine de taille de récipient en plastique transparent. Un seul appareil EcoFAB a un réservoir de l’usine, une chambre de croissance des racines, une entrée de débit de 1,6 mm et une prise de 1,6 mm pour appareil EcoFAB standard (Figure 2D & Figure 3 H) ou à une prise de 10 mm pour dispositif de EcoFAB wide-prise (Figure 2F & Figure 3I ). Le réservoir de l’usine est conçu en forme de trapèze qui possède une ouverture supérieure de 6 mm et 3 mm ouverture en bas, et cette conception réduit le risque de fuite de flux pendant l’injection de liquide et s’assure également de suffisamment d’espace pour la croissance des plantes. La chambre de croissance racinaire adopte une forme ovale avec une profondeur de 2 mm pour s’adapter à des systèmes racinaires des plantes beaucoup de modèles, comme le montre la Figure 2 et E. Canaux d’entrée et de sortie d’un dispositif de EcoFAB standard peuvent être connectés avec la tuyauterie de PTFE afin de solutions nutritives peuvent circuler dans la chambre de croissance racinaire, sans ouvrir le conteneur EcoFAB. Le dispositif de EcoFAB wide-prise grandement réduit la résistance à l’écoulement de la prise et est de préférence utilisé dans la culture des plantes à racines épaisses ou recueillir périodiquement des exsudats racinaires après que des systèmes racinaires complexes sont dérivés de plantes.
Les moules de coulée pour la fabrication de couches PDMS de EcoFAB dispositifs sont créés dans un logiciel de conception, et ensuite 3D imprimées en photopolymères opaque rigide, comme illustré à la Figure 2 et Figure 3. Plantes à l’intérieur de la EcoFABs peuvent être directement observés au microscope à l’aide d’une long travail distance, assurant que la stérile croître environnement (Figure 8 a, Dossier complémentaire 1). EcoFAB dispositifs avec des plantes peuvent également s’adapter sur une scène de microscopie à haute résolution, ce qui permet l’imagerie de résolution plus élevée des interactions plantes-microorganismes (Figure 8 b, Fichier supplémentaire 2). La stérilité n’est pas maintenue dans cet environnement, et l’imagerie haute résolution convienne donc uniquement pour les mesures de point de terminaison.
EcoFABs sont conçus pour permettre des études systématiques des plantes, telles que leur morphologie et métabolismes des communautés microbiennes à leurs stades de développement différents dans l’ensemble de leur cycle de vie. Ici, les EcoFABs ont été examinés comme une plate-forme générale d’étudier une variété d’espèces végétales. Figure 8 -E montrent 7 - jour vieux Arabidopsis thaliana, Brachypodium distachyonet Panicum virgatum poussant dans EcoFABs. Tous trois ont été trouvés pour bien se développer dans la EcoFAB pendant plus d’un mois. Les dicotylédones, Arabidopsis thaliana tant les monocotylédones, Brachypodium distachyon trouvées s’acquittent de leurs stades de reproduction dans le EcoFABs.
Le réversible système d’étanchéité permet l’utilisation de substrats solides (p. ex.., sol) au sein de la EcoFABs (étape 2.2). Ce réversible approche d’étanchéité permet un chargement des substrats solides dans les chambres de croissance racinaire et permet également le prélèvement d’échantillons provenant de régions spécifiques de rhizosphères de racine. Figure 8F -H afficher un groupe âgé de 14 jour Brachypodium distachyon croissante en milieu hydroponique, ainsi que de sable et de terre additionnée de milieu hydroponique (sable) et d’eau (sol). La couche mince substrat solide en chambre de croissance racinaire permet à la lumière de pénétrer à travers pour imagerie microscopique des systèmes racinaires.
Morphologie de la racine est définie comme la configuration spatiale et de la distribution d’un système de racine de plante et a été approuvée comme une réponse de physiologie indispensables aux milieux de croissance variés, tels que des éléments nutritifs ou l’eau disponibilité32,33, 34. EcoFABs fournissent une approche commode d’étudier la morphologie végétale dans le temps ou dans des conditions différentes en éléments nutritifs. Figure 9 a-F montrent un exemple d’utilisation de EcoFABs pour suivre les morphologies de racine de Brachypodium distachyon dans les trois premières semaines. Un semis de Brachypodium distachyon a été transféré dans le dispositif EcoFAB et sa structure de racine a été enregistré par une caméra à l’intérieur d’un imageur de gel de BIO-RAD. Programme de traitement des images, comme Image J, python et matlab, peut être appliquée plus loin afin de quantifier les changements de morphologie de la racine dans le temps ou à des environnements différents moyens. La quantification de la surface des racines total au cours des trois semaines ont montré une augmentation progressive au stade précoce (< 1 semaine) suivie d’une tendance de croissance linéaire jusqu’au bout de trois semaines, comme le montre la Figure 9.
Une première motivation pour construire la EcoFAB est d’étudier les interactions plantes-microorganismes. Comme indiqué au point 5.4, les micro-organismes sont transférés dans la chambres de croissance racinaire de EcoFAB périphériques via le canal d’admission. La figure 10 illustre, un EcoFAB contenant Pseudomonas simea (anciennementfluorescens) WCS417 (WCS417), une croissance des plantes rhizobactéries avec des étiquettes de chimiluminescence, a été ajouté dans les systèmes de racine de plante avec une concentration de 106 cellules par plante. Le signal de WCS417 a été détecté avec un imageur de gel, ce qui indiquait une répartition spatiale distincte des microbes WCS417 en chambre de croissance racinaire. Dans les deux MS un milieu liquide avec et sans le sable substrat solid, microbes WCS417 a colonisé les surfaces du système racinaire entier avec microbes concentrés autour des zones de bout de racine, probablement à cause de la production de nutriments actif de radicelles (Figure 10 & H)35. En revanche, les microbes WCS417 dans un substrat de sol accumulent autour de la région de réservoir centrale au lieu de radicelles (Figure 10j’ai). Les microbes ont été ajoutés par le canal de sortie, les microbes étaient également capables de se déplacer dans le substrat du sol, mais n’ont pas accumulé dans la racine, comme observé dans un milieu liquide avec ou sans sable. Cela pourrait indiquer que le sol est une source suffisante de nutriments, et les microbes ont migré vers le réservoir de l’usine pour des conditions optimales de la respiration.
Pour étudier le métabolite profilage des exsudats racinaires de plante ainsi que l’absorption métabolite et libérer des interactions plantes-microorganismes, les solutions de l’exsudat des chambres de croissance racinaire ont été recueillies à travers différentes étapes de la croissance des plantes en EcoFABs. Tel que décrit à l’étape 6, exsudat échantillons sont ensuite extraits pour l’analyse de LC-MS. En utilisant cette méthode, une variété de métabolites exsudé par la plante et consommée par les microbes a été détectée, et le profilage de métabolite connexe d’exsudats racinaires avec et sans colonisation microbes est actuellement sous enquête.
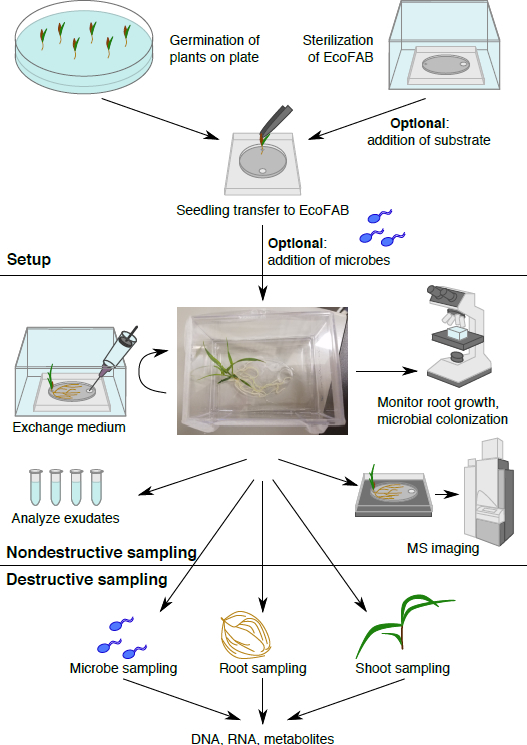
Figure 1 : EcoFAB le flux de travail. Plantes sont mises à germer sur la plaque et transférés à la EcoFAB stérilisé, microbes peuvent être ajoutés. Échantillonnage non destructif : exsudats racinaires peuvent être échantillonnés et imagés, et la morphologie racinaire peut être visualisée. Échantillonnage destructeur permet l’analyse de microbe, racine et paramètres de shoot en détail.
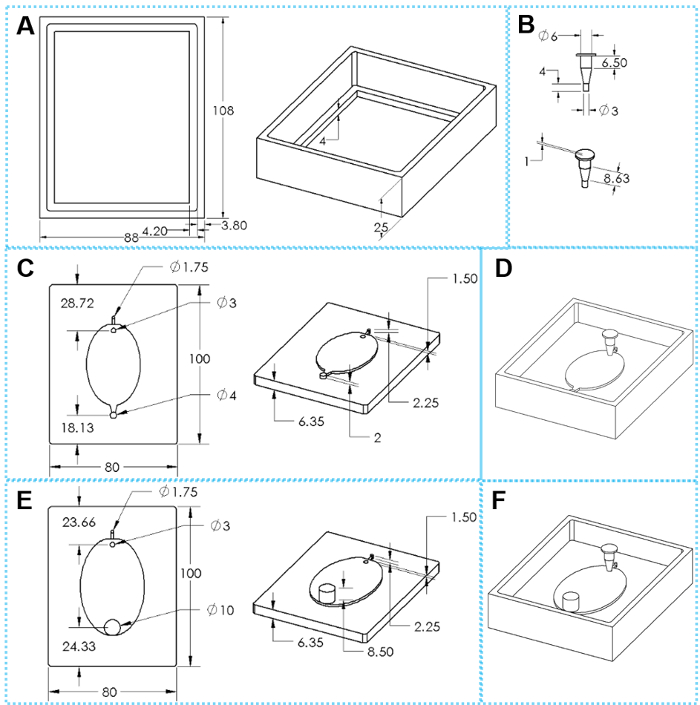
Figure 2 : les composantes de la 3D imprimés de moules pour la fabrication de dispositifs EcoFAB. (A) vues haut et inclinés d’un châssis de moulage. (B) haut et inclinés vues d’une insertion. (C) haut et inclinés vues d’une base de moule standard. (E) haut et inclinés vues d’une base de sortie d’échelle du moule. (D, F) Assemblé de moules pour la fabrication de dispositifs de EcoFAB standards et sortie d’échelle, respectivement. Les dimensions ovales sont 51 x 34 mm pour le petit moule EcoFAB et 76 x 62 mm pour le grand moule EcoFAB. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : fabrication de dispositifs EcoFAB. (A) verser le mélange d’élastomère base et polymérisation d’agent dans le moule. (B) le moule avec le mélange à 85 ° C pendant 4 h. (C), retirer le moule de l’insert de chauffage. (D) qui sépare le PDMS du cadre bâti. (E) en poussant le moule base hors du cadre bâti. (F) à l’aide d’un couteau pour séparer le PDMS de la moisissure sur les bords. (G) la couche PDMS lentement à sortir de la base de la moisissure s’écailler. Trous de piquer (H) pour les canaux d’entrée et de sortie de la couche PDMS standard. (I) piquer un trou pour le canal d’aspiration de la couche PDMS de large-sortie. Couche (J) le PDMS (constituée d’un élastomère de 15:1 base de mélange d’agent de polymérisation) et une lame de microscope sont rincés et transférés dans un plasma de nettoyeur pour le collage. (K) à l’aide pinces pour tenir la couche PDMS (faite d’une base d’élastomère de 5:1 pour mélange agent de polymérisation) sur une lame de microscope. (L) en appuyant sur la couche PDMS (faite d’une base d’élastomère de 30 : 1 au mélange d’agent de polymérisation) directement sur une lame de microscope. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
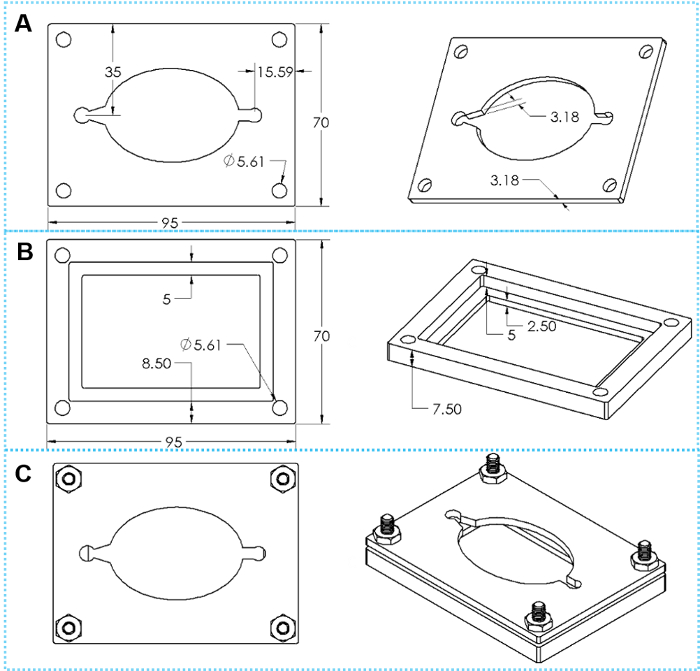
Figure 4 : la conception des colliers personnalisés. (A) vues haut et inclinés d’un haut collier plaque. (B) haut et inclinés vues du fond pince plaque. (C) haut et inclinés vues de pince assemblé avec quatre ensembles de vis d’assemblage. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
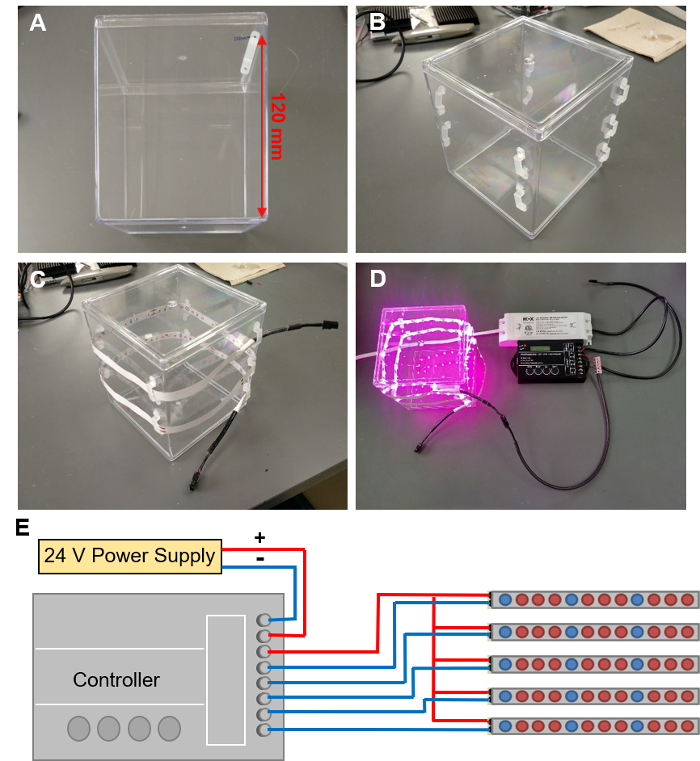
Figure 5 : installation LED grow lights. (A) marquage sur les emplacements pour les 9 clips LED dans une spirale autour du récipient EcoFAB. (B) LED pinces fixées au conteneur EcoFAB. (C) une bande de LED dans ces clips de thread. (D) reliant la bande de LED à un contrôleur filaire avec une alimentation de 24V. (E) le schéma de connexions des fils au contrôleur. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : transfert de plantules dans EcoFABs. (A) Brachypodium distachyon plantes cultivées pendant 2 jours sur une plaque de 0,5 MS. (B) remplir la chambre de racine avec substrat de croissance des plantes. (C) à l’aide d’une pince à insérer délicatement la racine dans le réservoir de l’usine. (D) d’étanchéité le conteneur EcoFAB avec ruban micropore, après l’ajout de 3 mL d’eau au fond du récipient. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 7 : NIMS imagerie de plante des racines dans EcoFABs. (A) un croissant dans un stérile EcoFAB Brachypodium distachyon . B fixer la couche PDMS avec la plante sur une puce de NIMS pour 20 min. (C) Using cuivre ruban pour attacher la puce NIMS sur une plaque personnalisée de MALDI et chargeant dans un spectromètre de masse MALDI. (D-G) un 7 - jour vieux et un 20 vieux jour Brachypodium distachyon plante utilisée pour NIMS imaging (D, E) et les images correspondantes de NIMS (F, G). Les ions prédominantes ont été soulignées en rouge, vert et bleu. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 8 : les applications générales de EcoFABs. (A) directement saisir la croissance racinaire de Brachypodium distachyon dans un EcoFAB avec une configuration de microscope travail longue distance. (B) directement observer les interactions de racine-microbe avec une configuration de microscope haute résolution. Panicum virgatum (E) dans un milieu hydroponique 0,5 MS, âgé de 14 jour (F-H) Brachypodium distachyon cultivées en hydroponie 0,5 MS (F), sable (G) et du sol (H), Brachypodium distachyon (D) et (C-E) 7 - jour vieux Arabidopsis thaliana (C) substrat livré avec moyen de 0,5 MS et eau, respectivement. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
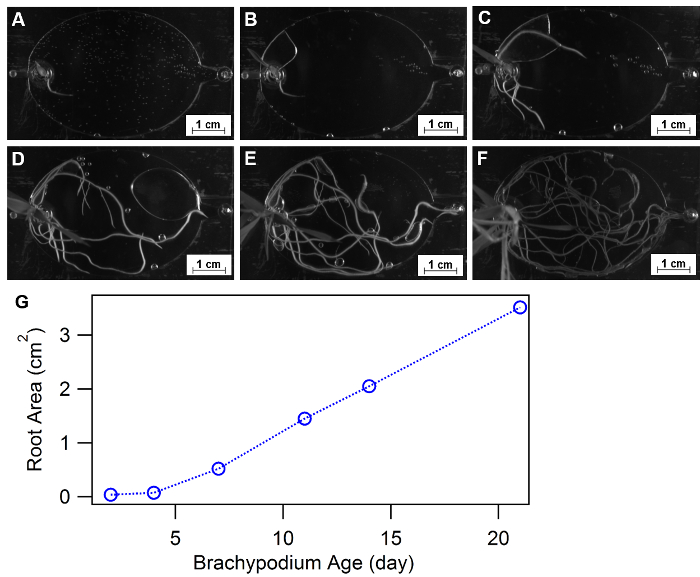
Figure 9 : pour étudier la morphologie de la racine à l’aide de EcoFABs. (A-F) Développement racinaire de Brachypodium distachyon gagne en EcoFABs rempli de 0,5 MS moyen au cours des trois premières semaines : (A) 2 jours, (B) 4 jours, (C) 7 jours, (D) 11 jours, e 14, (F) 21 jours de croissance. (G) surfaces de racine en moyenne ont été estimées en logiciels ImageJ. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
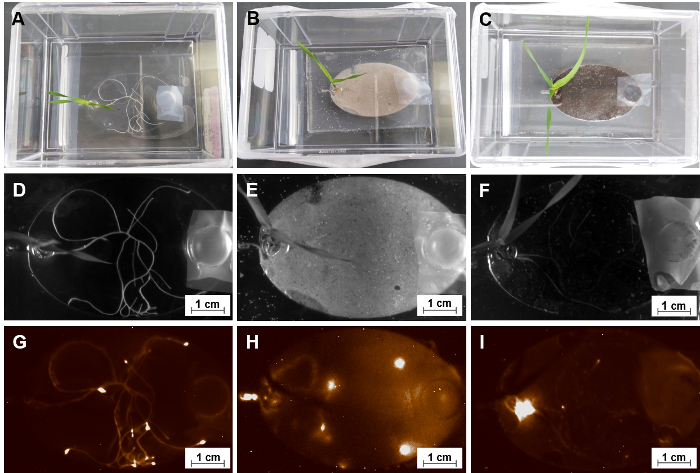
Figure 10 : l’utilisation de EcoFABs pour étudier les racines-microbe interactions. (A, B, C) Un groupe d’âge de 15 jour Brachypodium distachyon colonisatrices avec Pseudomonas fluorescens WCS417 sous différentes formes de médias-MS substrats de solution, de sable et de terre liquides. (D, E, F) Photos de champ lumineux de leur système racinaire. (G, H, I) Les images de chimiluminescence correspondantes de ces systèmes racinaires après co-culture de 14 jours. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Fichier complémentaire 1. À l’aide de EcoFAB pour capturer la croissance racinaire. S’il vous plaît cliquez ici pour télécharger ce fichier.
Fichier complémentaire 2. À l’aide de EcoFAB pour capturer les interactions de racine-microbes. S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Les protocoles présentés ici pour l’utilisation de fabrication de l’écosystème pour créer Qu'ecofabs fournit des ressources communautaires pour la systématique des plantes dans des conditions très contrôlées en laboratoire des études de biologie. Avances dans l’impression 3D fournissent des technologies largement accessibles pour la construction et de manière itérative raffinage EcoFAB dessins. La chambre de racine, présentée ici s’avère bien adapté pour la microscopie par imagerie et maintien de la stérilité, permettant l’addition contrôlée de microbes pour étudier les interactions plantes-microorganismes. La plate-forme EcoFAB est compatible avec diverses espèces végétales. Il est important de reconnaître les effets physiologiques de plus en plus les plantes dans la chambre de racine étroite telle que des expériences supplémentaires devront avoir généraliser les conclusions aux plantes qui poussent dans des milieux naturels.
L’utilisation des chambres stériles et élèvent la lumière LED permet l’étude des effets des diverses conditions de lumière, y compris la longueur d’onde, intensité et durée, sur la croissance des plantes et des paramètres physiologiques associés en parallèle. Chambres de racine de liaison réversible permettent l’utilisation de substrats solides ainsi qu’à recueillir des échantillons solides pour les analyses biochimiques et génétiques dans l’espace. Les applications des substrats solides, tels que des sols, du sable et des perles de quartz, d’offrir la possibilité d’utiliser EcoFABs pour construire des écosystèmes de laboratoire plus écologiques pertinentes. Cependant, tous les systèmes présentés ici utilisation liquide saturé (cultures hydroponiques) qui ne sont pas un reflet exact de la plupart des sols et il faudra encore peaufiner ces dessins pour maintenir les poches d’air dans le sol tels qu’elles représentent mieux sols naturels.
L’utilisation de caméras simples et microscopes est décrite d’image système racinaire morphologie développement sur les deux en vrac aux niveaux cellulaires. Cette aptitude à l’imagerie de morphologie racine surveillance et quantification sera probablement utile pour comprendre les mécanismes de régulation de signaux physiologiques et moléculaires de plante déclenchées par adaptations génotypique plante à des conditions de croissance. Toutefois, une limitation pour étudier le développement racinaire physiologique est la position horizontale actuelle de l’appareil EcoFAB. En milieu naturel, la réponse gravitropique de racines conduit à un développement principalement vertical du système racinaire. Ainsi, le système horizontal présenté ici probablement diffère en certains facteurs du milieu naturel et la fabrication de systèmes EcoFAB avec placement vertical de la chambre de la racine est un objectif souhaitable pour les futures versions de EcoFAB. Bien que les dispositifs actuels de EcoFAB sont placées horizontalement, l’analyse des paramètres de morphologie de racine dans diverses conditions, ou en réponse aux microbes, est possible. Imagerie à haute résolution peut être appliqué pour saisir la dynamique de colonisation des racines des isolats unique ou des communautés, fournissant des informations sur quelle plante pièces sont colonisés dans diverses conditions suffisantes et déficientes en éléments nutritifs. Il est prévu que ces études fourniront des importantes nouvelles perspectives comment plante microbiomes sont assemblés, et comment ces dynamiques changent avec le temps, pour exemple que les racines se développent.
Dispositifs microfluidiques permettent d’imagerie de très jeunes plants, et généralement la quantité de métabolites collectées n’est pas suffisante pour l’analyse LCMS. Les systèmes axés sur les sols, tels que rhizotrons, permettent l’imagerie de la morphologie de la racine quand les deux plantes sont transformés par chimiluminescence construction (Glo-racine) ou avec des méthodes axées sur le NMR33,34. Les extractions de métabolite de ces systèmes demandent beaucoup de temps en raison du volume important d’échantillons. EcoFABs sont une combinaison des deux : la fabrication est similaire aux dispositifs microfluidiques. EcoFABs ont été conçus pour être simple et peu coûteux à reproduire, mais la taille de la chambre peut être ajustée pour faire pousser des plantes avec leur système racinaire petites ou grandes, jusqu'à des stades de reproduction. Des observations simultanées des changements de morphologie de racine et exsudation racinaire sont possibles. Le système est stérile, ce qui permet l’addition contrôlée de microbes spécifiques.
EcoFABs sont conçus pour permettre l’introduction contrôlée et échantillonnage des microbes et des métabolites. Spécifiquement, échantillons prélevés dans les chambres de croissance racinaire sont jugées suffisantes pour profiler le métabolite masse spectroscopique. L’intégration de l’imagerie de la spectrométrie de masse (p. ex.., NIMS technique présentée ici) propose une approche non destructifs d’étudier la distribution spatiale de métabolite des systèmes racinaires. Cette technique sera probablement utile dans un avenir stable isotope traçage expériences et localisation microbienne de cartographie aux métabolites spécifiques36. Alors que ce protocole a mis l’accent sur des isolats unique, la conception même certainement peut être utilisée que pour des collectivités plus complexes. Le volume des échantillons et la biomasse au sein de la EcoFABs sont probables plus que suffisant pour la poursuite de l’intégration avec les technologies de séquençage de l’ADN, qui sera important pour caractériser et surveiller la communauté microbienne structure et l’expression génique.
En conclusion, ce protocole détaille la fabrication des écosystèmes de laboratoire conçu pour l’étude des interactions plantes-microorganismes, en mettant l’accent sur des méthodes simples et accessibles qui peut facilement être implémentée et étendu par les chercheurs autour de la monde. Les efforts actuels visent à démontrer la reproductibilité entre les laboratoires et l’intégration d’un système de contrôle de température telle que chaque EcoFAB sera ont commandé indépendamment de lumière et température. Une progression supplémentaire du système sera l’intégration de l’échantillonnage automatique et le remplissage des chambres racine EcoFAB et de l’élaboration de protocoles reproductibles pour établir les microbiomes phytosanitaires pertinentes au sein de la EcoFABs.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le programme de recherche réalisé en laboratoire et développement (LDRD) du Lawrence Berkeley National Laboratory, soutenu par le Bureau de la Science, de l’US Department of Energy, sous le contrat no. DE-AC02-05CH11231 et le prix DE-SC0014079 de l’US Département de Energy Office of Science à l’Université de Berkeley. Travail à la fonderie moléculaire a été soutenu au titre US Département d’énergie contrat no DE-AC02-05CH11231. Nous remercions également Benjamin J. Cole au Lawrence Berkeley National Laboratory, Katherine Louie, Benjamin P. Bowen et Suzanne M. Kosina pour leur aide.
matériels
| Name | Company | Catalog Number | Comments |
| 3D printed custom mold | LBNL | STL files available here www.eco-fab.org; The EcoFABs molds described here were printed by FATHOM: http://studiofathom.com | |
| Dow sylgard 184 silicone elastomer clear kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| Air duster spray | VWR | 75780-350 | any compressed gas duster should work |
| 15 gauge blunt needle | VWR | 89166-240 | |
| 5 mL syringe with Luer-Lok Tip | VWR | BD309646 | |
| 3”x2” microscope glass slide | VWR | 48382-179 | |
| 1.75" x 2.56" x 3.56" EcoFAB box | Amazon | B005GAQ25Q | |
| 4” x 3 ¼” microscope glass slide | Ted Pella | 260231 | |
| 4.87" x 4.87" x 5.50" EcoFAB box | Amazon | B00P9QVOS2 | |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| 3D printed custom clamp | LBNL | STL files available from Trent Northen's lab | |
| Sterile hood | AirClean Systems | AC600 Series PCR Workstations | |
| PTFE syringe tubing | Sigma-Aldrich | Z117315-1EA | |
| Ethanol | VWR | 89125-172 | |
| Bleach | |||
| Murashige and Skoog (MS) Macronutrient Salt Base | Phytotechnologies Laboratories | M502 | |
| Murashige and Skoog (MS) Micronutrient Salt Base | Phytotechnologies Laboratories | M554 | |
| Soil | Hummert International | Pro-Mix PGX | |
| Phytagel | Sigma-Aldrich | 71010-52-1 | |
| Arabidopsis thaliana | Lehle Seeds | WT-24 Col-4 Columbia wild type | |
| Brachypodium distachyon | LBNL | Standard Bd-21 line | Available from John Vogel's lab |
| Panicum virgatum | The Samuel Roberts Noble Foundation | Alamo switchgrass | |
| Micropore tape | VWR | 56222-182 | |
| LC-MS grade methanol | VWR | JT9830-3 | |
| Lyophilizer | LABCONCO | FreeZone 2.5 Plus | |
| SpeedVAC concentrator | Thermo Scientific | Savant™ SPD111 SpeedVac | |
| Ultrafree-MC GV Centrifugal Filter-0.22 µm | Millipore | UFC30GV00 | |
| Liquid chromotography system | Agilent | Agilent 1290 LC system | |
| Q Exactive mass spectrometer | Thermo Scientific | Q Exactive™ Hybrid Quadrupole-Orbitrap MS | |
| NIMS chip and custom MALDI plate | LBNL | For detailed protocol see: doi:10.1038/nprot.2008.110 | |
| MALDI mass spectrometer | AB Sciex | TOF/TOF 5800 MALDI MS | |
| Nano-coated LED grow light strip | LED World Lighting | HH-SRB60F010-2835 | |
| Power supply | LED World Lighting | MD45W24VA, LV100-24N-UNV-J | |
| TC420 controller | Amazon | B0197U7R8Q | |
| Silicone LED clips | Amazon | B00N9X1GI0 | |
| Hot glue gun | Amazon | B006IY359K | |
| Female-to-bare LED connector cable | LED World Lighting | HH-F05 | |
| Female-to-male LED connector extension cable | LED World Lighting | HH-MF1 | |
| 20AWG 2-wire cable | LED World Lighting | 6102051TFT4 | |
| WAGO 221-415 Splicing Connector | LED World Lighting | 221-415 |
Références
- Morrissey, J. P., Dow, J. M., Mark, G. L., O'Gara, F. Are microbes at the root of a solution to world food production. EMBO Rep. 5 (10), 922-926 (2004).
- Farrar, K., Bryant, D., Cope-Selby, N. Understanding and engineering beneficial plant-microbe interactions: plant growth promotion in energy crops. Plant Biotechnol J. 12 (9), 1193-1206 (2014).
- Singh, J. S., Abhilash, P. C., Gupta, V. K. Agriculturally Important Microbes in Sustainable Food Production. Trends Biotechnol. 34 (10), 773-775 (2016).
- Dubey, R. K., Tripathi, V., Dubey, P. K., Singh, H. B., Abhilash, P. C. Exploring rhizospheric interactions for agricultural sustainability: the need of integrative research on multi-trophic interactions. J Clean Prod. 115, 362-365 (2016).
- Hunter, P. Plant microbiomes and sustainable agriculture. EMBO Rep. 17 (12), 1696-1699 (2016).
- van der Heijden, M. G. A., Hartmann, M. Networking in the Plant Microbiome. PLoS Biol. 14 (2), e1002378(2016).
- Vessey, J. K. Plant growth promoting rhizobacteria as biofertilizers. Plant Soil. 255 (2), 571-586 (2003).
- Yang, J., Kloepper, J. W., Ryu, C. -M. Rhizosphere bacteria help plants tolerate abiotic stress. Trends Plant Sci. 14 (1), 1-4 (2009).
- Reynolds, H. L., Packer, A., Bever, J. D., Clay, K. GRASSROOTS ECOLOGY: PLANT-MICROBE-SOIL INTERACTIONS AS DRIVERS OF PLANT COMMUNITY STRUCTURE AND DYNAMICS. Ecology. 84 (9), 2281-2291 (2003).
- Finkel, O. M., Castrillo, G., Herrera Paredes, S., Salas González, I., Dangl, J. L. Understanding and exploiting plant beneficial microbes. Curr Opin Plant Biol. 38, 155-163 (2017).
- Northen, T. R., Zhang, Z., Gao, J., Swenson, T., Yoshikuni, Y. Advancing Our Understanding of the Chemistry of Soil Microbiomes. National Academies of Sciences, Engineering, and Medicine. 2017. The Chemistry of Microbiomes: Proceedings of a Seminar Series. , The National Academies Press. Washington, DC. (2017).
- Busby, P. E., et al. Research priorities for harnessing plant microbiomes in sustainable agriculture. PLOS Biology. 15 (3), e2001793(2017).
- Sanati Nezhad, A. Microfluidic platforms for plant cells studies. Lab Chip. 14 (17), 3262-3274 (2014).
- Oburger, E., et al. Evaluation of a novel tool for sampling root exudates from soil-grown plants compared to conventional techniques. Environ Exp Bot. 87, 235-247 (2013).
- Van Der Krift, T. A. J., Berendse, F. Root life spans of four grass species from habitats differing in nutrient availability. Funct Ecol. 16 (2), 198-203 (2002).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. P Natl. Acad. Sci. USA. 114 (17), 4549-4554 (2017).
- Sanati Nezhad, A., Naghavi, M., Packirisamy, M., Bhat, R., Geitmann, A. Quantification of cellular penetrative forces using lab-on-a-chip technology and finite element modeling. P Natl. Acad. Sci. USA. 110 (20), 8093-8098 (2013).
- Jiang, H., Xu, Z., Aluru, M. R., Dong, L. Plant chip for high-throughput phenotyping of Arabidopsis. Lab Chip. 14 (7), 1281-1293 (2014).
- Parashar, A., Pandey, S. Plant-in-chip: Microfluidic system for studying root growth and pathogenic interactions in Arabidopsis. Appl. Phys. Lett. 98 (26), 263703(2011).
- Busch, W., et al. A microfluidic device and computational platform for high-throughput live imaging of gene expression. Nat Methods. 9 (11), 1101-1106 (2012).
- Grossmann, G., et al. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23 (12), 4234-4240 (2011).
- Aufrecht, J. A., Ryan, J. M., Hasim, S., Allison, D. P., Nebenführ, A., Doktycz, M. J., Retterer, S. T. Imaging the Root Hair Morphology of Arabidopsis Seedlings in a Two-layer Microfluidic Platform. J. Vis. Exp. (126), (2017).
- Garvin, D. F., et al. Development of Genetic and Genomic Research Resources for Brachypodium distachyon, a New Model System for Grass Crop Research. Crop Sci. 48 (Supplement_1), S69-S84 (2008).
- Lisensky, G. C., et al. Replication and Compression of Surface Structures with Polydimethylsiloxane Elastomer. J. Chem. Educ. 76 (4), 537(1999).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502(2010).
- Yao, Y., et al. Analysis of Metabolomics Datasets with High-Performance Computing and Metabolite Atlases. Metabolites. 5 (3), 431-442 (2015).
- Sumner, L. W., et al. Proposed minimum reporting standards for chemical analysis Chemical Analysis Working Group (CAWG) Metabolomics Standards Initiative (MSI). Metabolomics. 3 (3), 211-221 (2007).
- Gao, J., de Raad, M., Bowen, B. P., Zuckermann, R. N., Northen, T. R. Application of Black Silicon for Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 88 (3), 1625-1630 (2016).
- Gao, J., et al. Morphology-Driven Control of Metabolite Selectivity Using Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 89 (12), 6521-6526 (2017).
- Woo, H. -K., Northen, T. R., Yanes, O., Siuzdak, G. Nanostructure-initiator mass spectrometry: a protocol for preparing and applying NIMS surfaces for high-sensitivity mass analysis. Nat. Protoc. 3 (8), 1341-1349 (2008).
- Rübel, O., et al. OpenMSI: A High-Performance Web-Based Platform for Mass Spectrometry Imaging. Anal. Chem. 85 (21), 10354-10361 (2013).
- López-Bucio, J., Cruz-Ramı́rez, A., Herrera-Estrella, L. The role of nutrient availability in regulating root architecture. Curr Opin Plant Biol. 6 (3), 280-287 (2003).
- Lynch, J. P. Steep, cheap and deep: an ideotype to optimize water and N acquisition by maize root systems. Ann. Bot. 112 (2), 347-357 (2013).
- Rellán-Álvarez, R., et al. GLO-Roots: an imaging platform enabling multidimensional characterization of soil-grown root systems. eLife. 4, e07597(2015).
- Kamilova, F., Validov, S., Azarova, T., Mulders, I., Lugtenberg, B. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria. Environ. Microbiol. 7 (11), 1809-1817 (2005).
- Klitgaard, A., Nielsen, J. B., Frandsen, R. J. N., Andersen, M. R., Nielsen, K. F. Combining Stable Isotope Labeling and Molecular Networking for Biosynthetic Pathway Characterization. Anal. Chem. 87 (13), 6520-6526 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon