Method Article
Protocolos de fabricação (EcoFAB) ecossistema para a construção de ecossistemas de laboratório projetado para estudar interações planta-micróbio
Neste Artigo
Resumo
Este artigo descreve protocolos detalhados para fabricação de ecossistema de dispositivos (EcoFABs) que permitem que os estudos de plantas e as interações planta-micróbio em condições de laboratório altamente controlado.
Resumo
Interações planta-micróbio benéfico para oferecer uma solução biológica sustentável com o potencial para impulsionar a produção de alimentos e bioenergia de baixo-entrada. Uma melhor compreensão mecanicista dessas interações planta-micróbio complexo será crucial para melhorar a produção vegetal, bem como realizando basic ecológica estuda investigar interações planta-solo-micróbio. Aqui, uma descrição detalhada para fabricação de ecossistema é apresentada, usando tecnologias de impressão 3D amplamente disponíveis, para criar habitats laboratório controlado (EcoFABs) para estudos mecanicistas de interações planta-micróbio dentro específicos ambientais condições. Dois tamanhos de EcoFABs que são adequados para a investigação das interações microbianas com várias espécies de plantas, incluindo Arabidopsis thaliana, Brachypodium distachyone Panicum virgatumdescritos. Estes dispositivos de passagem permitem controlados manipulação e amostragem de raiz microbiomes, química de raiz, bem como a imagem da raiz morfologia e localização microbiana. Este protocolo inclui os detalhes para a manutenção de condições estéreis dentro EcoFABs e montagem de sistemas de iluminação LED independentes para EcoFABs. Métodos detalhados para adição de diferentes formas de mídia, incluindo os solos, areia e mídia de crescimento líquido acoplado para a caracterização desses sistemas utilizando imagens e metabolomics são descritos. Juntos, estes sistemas permitem a investigação detalhada e dinâmica da planta e planta-microbiana consórcios, incluindo a manipulação de microbiome composição (incluindo mutantes), o acompanhamento do crescimento da planta, morfologia de raiz, composição de exsudato, e Localização de microbiana sob condições ambientais controladas. Nós antecipamos que estes protocolos detalhados servirá como um importante ponto de partida para outros pesquisadores, idealmente, ajudando a criar sistemas experimentais padronizados para investigar interações planta-micróbio.
Introdução
A aplicação de micróbios benéficos planta na agricultura oferece grande potencial para aumentar a alimentação sustentável e produção de biocombustíveis para fornecer para uma crescente população1,2,3,4. Uma quantidade significativa de trabalho suporta a importância da planta microbiomes na captação de nutrientes de planta, tolerância a estresses e resistência à doença5,6,7,8. No entanto, é difícil investigar esses mecanismos de interações planta-micróbio em ecossistemas do campo devido à complexidade e reprodutibilidade associada e incapacidade de controlar com precisão a composição microbiome e genética (EG., utilizando microbiana mutantes)4,9,10.
Uma estratégia é construir ecossistemas modelo simplificado para permitir controlada, experimentos de laboratório replicada investigando interações planta-micróbio para gerar ideias que podem ser mais testadas no campo10,11, 12. Este conceito baseia-se em abordagens tradicionais usando plantas cultivadas em vasos com solo cheio ou em placas de ágar dentro de estufas ou incubadoras13. Embora estas provavelmente continuará a ser o mais amplamente utilizado abordagens, falta-lhes a capacidade de precisamente monitorar e manipular os ambientes de crescimento de planta. Para esses fins, rhizoboxes e rhizotrons representam uma grande melhoria na capacidade de estudar processos abaixo do solo14,15, e, primeiros protocolos foram publicados para a análise de metabólitos de rizosfera em solo16. Mais recentemente, para permitir a análise de alto throughput, microfluidic avançados dispositivos13,17 como planta Chip18,19, RootArray20e RootChip21, foram desenvolvido como ferramentas eficientes para fenotipagem de planta com resolução espacial de micrômetro-escala para monitorar os estágios iniciais de crescimento da planta pequena modelo Arabidopsis thaliana no meio de vazão de líquidos. Recentemente, uma plataforma de imagem da dois-camada foi descrita que permite que a raiz do cabelo imaging de Arabidopsis thaliana na fase de plântula com uma plataforma de microfluidic22.
Aqui, protocolos detalhados para a construção de dispositivos controlados de laboratório (EcoFABs) são fornecidos, para estudar as interações micróbio de planta e mostrar que eles podem ser usados para estudar diversas plantas incluindo Arabidopsis thaliana, Brachypodium distachyon23, a aveia selvagem ecologicamente importante Avena barbata e a colheita de bioenergia Panicum virgatum (switchgrass). EcoFAB é uma plataforma de crescimento de planta estéril que inclui dois componentes principais: o dispositivo EcoFAB e recipiente transparente tamanho planta estéril. O dispositivo é feito de um polidimetilsiloxano (PDMS), processo que envolve a carcaça PDMS de fabricação EcoFAB camadas de um molde de plástico impresso 3D e ligação de camadas PDMS para corrediças do microscópio usando métodos anteriormente relatados24,25 . Os procedimentos detalhados de EcoFAB fluxo de trabalho, tais como fabricação de dispositivo, esterilização, germinação de sementes, transplante de mudas, micróbio inoculação/cocultivation, preparação de amostras e análise, são descritos no presente protocolo (Figura 1). Outras modificações de fluxo de trabalho básico são descritas, incluindo a instalação do computador controlado luzes LED crescer e a utilização de substratos sólidos. A utilização de técnicas para investigar a morfologia da raiz de imagem muda, colonização microbiana das raízes, e imagem de massa espectroscópica de exsudados radiculares são descritos. Antecipamos que o design simples, barato, com base em materiais prontamente disponíveis, bem como os protocolos detalhados apresentados aqui, vai transformar a plataforma EcoFAB um recurso da Comunidade, a padronização de estudos de planta-microbiome de laboratório.
Protocolo
Atenção: Este protocolo inclui o uso de produtos químicos perigosos, objetos cortantes, dispositivos elétricos, objectos quentes e outros perigos que possam resultar em lesões. Adequado de equipamentos de proteção individual (EPI, por exemplo., luvas quimicamente resistentes, óculos de segurança, jaleco, roupas longas, sapatos fechados, etc.) devem ser usados e os procedimentos de segurança adequados (treinamento de segurança, o uso de uma coifa, etc.) devem ser seguidas.
1. EcoFAB dispositivo fabricação: fundição camadas PDMS (Figura 2 e Figura 3)
- Construir os moldes EcoFAB usando técnicas de impressão 3D (os arquivos de projeto estão disponíveis em. Cada molde inclui três partes: um quadro de fundição, uma base de molde indicados e uma inserção, como mostrado na Figura 2. Imprimir a base de molde e inserir fora rígidos fotopolímeros opacos usando uma impressora 3D de plástico. Utilizar um mínimo de 100 µm de resolução e imprimir o quadro de fundição com acrilonitrila-butadieno-estireno (ABS).
- Misture 40ml de elastômero de siloxano base com agente em um recipiente de 1 L descartável de cura. Dependendo da experiência desejada (passos 2.1 e 2.2), use diferentes proporções (v/v) de elastômero base/agente (5:1, 1:15, ou 30: 1) de cura. Proceda às etapas de 1,3 a 1,8 para todos os tipos de misturas.
Atenção: Use luvas quimicamente resistentes, óculos de segurança e outros EPIs. - Coloque o recipiente em uma câmara de vácuo pelo menos 30 min remover as bolhas de ar da mistura de elastômero.
- Despeje a mistura na montada 3D impresso plástico molde (Figura 3A) e manter o molde em um bloco de aquecimento a 85 ° C por 4 h (Figura 3B).
Atenção: Usar EPI para evitar queimaduras. - Deixe o molde arrefecer por 5 min. Em seguida, puxe suavemente a inserção do molde (Figura 3) e em seguida, insira lentamente uma faca de serviço público entre a carcaça e o PDMS (mistura de elastômero solidificado) para separá-los (Figura 2D).
- Pressione o molde base com PDMS acima fora do quadro da carcaça (Figura 3E). Use uma faca ou outras ferramentas para separar a camada PDMS suavemente a base de molde nas bordas (Figura 3F) e então lentamente descascá-lo da superfície do molde (Figura 3).
- Criar entrada e canais de saída sobre as camadas PDMS fazendo furos para as portas de entrada e saída com 15 mm de ~1.6 medidor de agulha (Figura 3 H, I).
Nota: O molde padrão tem uma porta de entrada e saída, enquanto o molde do largo-tomada precisa somente a porta de entrada (Figura 3 H, I). - Use uma tesoura para aparar as arestas de camadas PDMS.
Nota: As camadas PDMS aparadas devem ser ≥76 milímetros x retângulos de 51 mm para dispositivos pequenos EcoFAB e ≥102 x retângulos de 83 mm para aparelhos EcoFAB grandes.
2. EcoFAB dispositivo fabricação: anexar quimicamente PDMS camadas em corrediças do microscópio (Figura 3 e Figura 4)
- Ligação permanentemente as camadas PDMS para corrediças do microscópio
- Enxágue o lado de ligação da camada de PDMS (feitas de um elastômero de 15:1 base para mistura de agente de cura) e microscópio de cm × 5 7.6 Deslize com metanol e assoprar secar com ar comprimido ou uma arma de nitrogênio ultra pura.
Atenção: O metanol é tóxico. Trabalho em uma coifa e usar a cobertura protetora do olho, luvas e outros EPIs. - Coloque a lâmina de microscópio e camada PDMS em um plasma mais limpo com seus lados de ligação virada para cima (Figura 3J). Se um plasma líquido de limpeza não estiver disponível, vá para a etapa 2.2.
- Feche a câmara e a válvula de ventilação de gás de plasma mais limpo e ligue o vácuo e a bomba para baixo a câmara por 1 min.
- Ligue a alimentação do gerador de plasma e mudar o nível de rádio frequência (RF) para "HI" por 1 min.
- Desligue a bomba de vácuo e o poder de plasma e a ventilação da câmara para a atmosfera.
- Retire a lâmina de microscópio e camada PDMS da câmara de plasma e rapidamente pressione todas as quatro bordas da camada de PDMS para o slide com pressão uniforme (Figura 3 L). Certifique-se de que região centro oval da camada de PDMS (câmara de raiz) não toca no slide.
- Coloque o dispositivo de EcoFAB selado em um 120 ° C aquecimento bloco por 20 min garantir ainda mais a ligação permanente entre a camada PDMS e a lâmina de microscópio.
- Deixe o aparelho esfriar por 5 min. guarnição fora as bordas extras da camada com uma faca de PDMS.
- Enxágue o lado de ligação da camada de PDMS (feitas de um elastômero de 15:1 base para mistura de agente de cura) e microscópio de cm × 5 7.6 Deslize com metanol e assoprar secar com ar comprimido ou uma arma de nitrogênio ultra pura.
- Selagem de física reversível das camadas PDMS para corrediças do microscópio
- A técnica de vedação reversível utiliza um conjunto de pinças personalizadas (também impresso por uma impressora 3D de plástico ou usinados em metal, os desenhos são mostrados na Figura 4).
- Coloque a lâmina de microscópio para o recorte sobre a chapa de fixação inferior e em seguida, alinhe a camada PDMS (feita de uma base de elastômero de 5:1 a mistura do agente de cura) em cima do slide.
- Coloque a braçadeira superior sobre a camada PDMS. Fixe as placas superior e inferior, usando quatro parafusos hexadecimais, orientando os parafusos para que as porcas são rosqueadas da parte superior do grampo.
- PDMS aderindo diretamente para corrediças do microscópio
- Posicione a camada PDMS (feita de uma base de elastômero de 30: 1 a mistura do agente de cura) em cima de uma lâmina de microscópio.
- Pressione a camada PDMS para o slide. A camada PDMS macia, muito adesiva (30: 1) deve ficar para o slide, criando um selo à prova d'água sem a permanente ligação química ou física imprensa de uma pinça (Figura 3 L).
- A técnica de vedação reversível utiliza um conjunto de pinças personalizadas (também impresso por uma impressora 3D de plástico ou usinados em metal, os desenhos são mostrados na Figura 4).
3. EcoFABs esterilização
- Enxágue EcoFAB dispositivos com água ultrapura.
- Coloque um dispositivo EcoFAB num recipiente EcoFAB e adicionar etanol a 70% até que o dispositivo está submersa. Feche a tampa do recipiente e agite para molhar todas as superfícies dentro com etanol. Certifica-se de que a câmara de crescimento de raiz do dispositivo EcoFAB é preenchida com etanol, com poucas ou nenhuma ar bolhas.
- Após a incubação 30 min à temperatura ambiente, decantar em etanol a 70% e repetir a incubação com 100% de etanol por 5 min.
- Escorrer o etanol e incubar a EcoFAB esterilizado para 16 h em uma capa de fluxo laminar para secá-lo completamente. Se disponível, esterilize o sistema rodando sobre o UV luz dentro de capa por 1h.
Atenção: Usar EPI apropriado quando se trabalha com luzes UV. - Armazene o EcoFABs esterilizado em um capuz estéreis ou sacos autoclavados para uso futuro.
4. EcoFABs com LED crescer luzes (Figura 5)
- Anexar LED tiras em reservatórios EcoFAB
- Marca os locais no recipiente EcoFAB para 9 clipes de LED. Comece com o primeiro clipe 120 mm acima do fundo do recipiente ao longo de uma borda (Figura 5A) e prosseguir para marcar locais de clip em espiral em torno do recipiente, com cada clipe vem caindo de 10 mm. Uma espiral de 9 clipes que permite uma faixa de LED de 1m embrulhar em torno do recipiente duas vezes.
- Cola quente um clip LED para cada um marcado posição adicionando duas pinceladas de cola quente para o recipiente, alinhado com a posição dos furos de montagem dos clipes. Pressione os furos clip para estas duas pinceladas de cola e, em seguida, adicionar outra pincelada de cola em cima dos buracos. Repita o procedimento para todos os clipes até 9 clipes formam uma espiral (Figura 5B).
Cuidado: Use luvas e outro EPI quando trabalhar com cola quente para evitar queimaduras. - Thread através os clipes em forma de espiral, faixa de LED com LEDs virado para dentro do recipiente. A tira deve círculo em torno de duas vezes (Figura 5).
- Tiras de LED de ligação para fonte de alimentação com um controlador (Figura 5 exibe uma câmara EcoFAB com luzes iluminadas, a programação do controlador é descrita na etapa 4.3).
Cuidado: Risco de choque elétrico: Certifique-se de fonte de alimentação está desligado ao conectar os fios.- Conecte os terminais positivos e negativos da fonte de alimentação para as "entrada: V +" e "entrada: V-" terminais do controlador usando cabo de fio 2 (Figura 5E exibe um desenho esquemático do configuração do controlador).
- Conecte o cabo negativo da extremidade desencapada do fêmea-à-bare cabo para um canal de "Saída" no controlador.
Nota: Existem cinco canais do controlador que é utilizado no presente protocolo, assim que pode suportar até cinco tiras de LED de 1m. - Conecte todas as pistas positivas dos cabos para um compacto emenda conector (se são necessários canais de mais de um) e então vincular este conector ao terminal "saída V +" do controlador.
- Conecte cada LED strip feminino final dos cabos, então cada LED tem seu próprio canal para ser controlado. Se desejar, use os cabos do sexo feminino-para-homem para estender o alcance.
- Programar o controlador para um ciclo de luz desejado, de acordo com as instruções do fabricante,
5. cultivo de plantas em EcoFABs
- Esterilização de sementes e germinação
Nota: A esterilização de sementes e todas as etapas seguintes com mudas devem ser realizadas em condições estéreis. O processo de esterilização, discutido abaixo é apropriado para as sementes de Arabidopsis thaliana, Avena barbata, Brachypodium distachyone Panicum virgatum. Panicum virgatum sementes devem ser suspenso em 60% ácido sulfúrico para 1 h antes do processo de esterilização. É aconselhável preparar 1-2 sementes por EcoFAB dispositivo, considerando a taxa de germinação e a homogeneidade de germinação.- Embeba as sementes em etanol a 70% por 2 min.
- Remova o etanol com uma pipeta e lave as sementes com água estéril três vezes.
- Deixe as sementes em solução 10% por 5 min.
- Remover a solução de lixívia e lavar bem as sementes com água estéril três vezes.
- Adicionar água estéril para as sementes e incubar o tubo microcentrifuga em um frigorífico de 4 ° C por 7 dias.
- Uniformemente, espalhar as sementes em 0,5 meio de Murashige & Skoog (MS) com 0,6% phytagel e selar as placas com fita adesiva micropore.
- Crescem as plantas para um comprimento de raiz de cerca de 5 mm para transferência de EcoFABs (figura 6A). Para os experimentos apresentados aqui, aplicar um regime de luz/8 h iluminação escura 16 h em uma câmara de crescimento de 22 ° C e incube as plantas 2-7 d antes da transferência para EcoFAB (2 dias para Avena barbata e Brachypodium distachyon, 7 dias por Arabidopsis thaliana e Panicum virgatum).
- Transferência de mudas para EcoFABs com o meio líquido (Figura 6)
- Usando uma seringa estéril ou micropipeta, lave a câmara de raiz de um dispositivo EcoFAB com água esterilizada por três vezes e em seguida, encha a câmara de raiz com o meio de crescimento de interesse, por exemplo, 0,5 MS médio (Figura 6B, passo 5.1.6).
- Insira com cuidado uma única plântula no reservatório de planta do dispositivo EcoFAB (Figura 6).
Nota: A raiz deve ser totalmente submerso dentro da câmara de raiz, com as fotografias, saindo do reservatório. - Adicione 3 mL de água estéril dentro do recipiente, evitando o dispositivo EcoFAB. Isto irá aumentar a umidade e reduzir a evaporação do meio da câmara de raiz.
- Fechar o recipiente e sele a tampa com fita micropore (Figura 6).
- Coloque o EcoFAB em uma incubadora de planta, ou utilizar o sistema de iluminação EcoFAB em um ambiente de temperatura controlada, apropriado para o crescimento da planta respectiva (passo 4). Para este estudo, definir a câmara para 24 ° C.
- Verificar periodicamente o EcoFAB para reencher a mídia de crescimento dentro da câmara de crescimento de raiz e adicione água ao recipiente. Execute todas as etapas em condições estéreis.
Nota: Para os primeiros estágios de crescimento de planta, enchimento da câmara de crescimento de raiz é necessário a cada 5 a 7 dias. Para posteriores fases de crescimento, uma recarga é necessário a cada 2 a 3 dias. Se desejar, use uma seringa ou uma pipeta para coletar solução de exsudato de raiz das câmaras de crescimento de raiz em um tubo de microcentrifugadora e armazená-lo em um freezer-80 ° C; Além disso, a imagem a morfologia da raiz com um gel de tonalizador ou microscópio.
- Transferência de mudas para EcoFABs com substratos sólidos
- Usar as câmaras de raiz fabricadas com uma mistura de 5:1 do elastômero base para agente de cura, se usando um conjunto de pinças personalizados para anexá-lo a um slide de microscópio (Figura 3 K, Figura 4); ou escolha que uma camada PDMS feita de 30: 1 base para mistura de agente de cura, se aderindo a camadas PDMS para slides diretamente (como descrito no passo 2.2).
- Esterilize as câmaras EcoFAB, conforme descrito na etapa 3.
- Cuidadosamente adicionar solo/areia esterilizada para a câmara de raiz, revirar a camada PDMS e adicionar o substrato para a câmara de raiz. Evite qualquer queda de partículas na área que estará em contato com a lâmina de microscópio, já que isto irá reduzir a adesão.
- Coloque a lâmina de microscópio em cima da camada PDMS e todas as bordas, pressione firmemente. Vire cuidadosamente o dispositivo EcoFAB para que nenhum solo/areia cai fora o reservatório abrindo.
Nota: Para EcoFAB dispositivos feitos de um 5:1 base para mistura de agente de cura, use uma pinça personalizada para fixar o selo. - Fluxo de água através do canal de entrada ou saída do dispositivo EcoFAB ou meio líquido e transferir uma muda em seu reservatório de planta, conforme descrito na etapa 3.3.
- Adição de micróbios em EcoFABs
- Transferir uma colônia microbiana para um tubo de incubação com 8 mL de caldo LB e cultivá-la para OD 0.5 (aproximadamente 12 h).
- Transferir a solução de cultura para um tubo de centrífuga de 15 mL e centrifugá-lo à temperatura ambiente durante 5 min à 3000 x g de micróbios de Pelotas.
- Remover o sobrenadante e adicionar 8 mL do meio de crescimento de planta usado no destino EcoFAB. Suspender o sedimento de micróbios e centrifugar o tubo em temperatura ambiente por 5 min a 3000 x g.
- Repita o passo 5.4.3. duas vezes para remover completamente qualquer vestígios de nutrientes LB.
- Adicionar o meio de crescimento de planta ao pellet lavado micróbio até que sua densidade óptica é cerca de 0.5 em 600 nm.
- Adicione 20 µ l da solução de micróbio dentro da câmara de raiz através da saída de EcoFAB. As estirpes utilizadas nesta publicação viajaram para plantar raízes dentro de 2-3 dias e começou a colonizar superfícies de raiz.
- Para engenharia quimioluminescente, certifique-se de incluir o indutor (1 mM IPTG) no meio de crescimento de planta para induzir a expressão de luciferase.
6. o metabólito perfilação de exsudados de raiz de EcoFABs
- Preparação da amostra para LC/MS com base em análise metabolomics
- Colocar os tubos microcentrifuga com exsudados radiculares coletados de EcoFABs em um Liofilizador e ligue o liofilizador para remover toda a água dos tubos.
- Adicionar 300 µ l de metanol de grau de LC-MS em cada tubo e proceda à sonicação durante 30 min.
Atenção: Usar EPI quando se trabalha com metanol. - Coloque os tubos em uma centrífuga e centrifugá-los a 3000 x g durante 5 min.
- Transferir as sobrenadante soluções para novos tubos de microcentrifuga e evaporar o metanol em um concentrador a vácuo.
- Adicionar 150 µ l de metanol com padrões internos de LC-MS de 1 mM a cada tubo e incubar os tubos em um frigorífico de 4 ° C durante 12h.
- Centrifugar os tubos a 3000 x g por 5 min e transferir o sobrenadante para 0,22 µm tubos de filtro.
- Centrifugar os tubos do filtro e transferir as filtrado soluções em frascos de LC/MS 2,0 mL com 200 µ l de inserções.
- Coloque os frascos dentro de um rack de LC/MS e carregar o cesto dentro do autoamostrador de LC/MS.
- Análise de dados
- Obter um acesso de metabólito Atlas e personalizada de scripts Python26 ou usar outro software de análise de dados.
- Identificar metabólitos baseados em m /z valores, tempo de retenção e padrões de fragmentação composto usando uma biblioteca de padrões metabólito. 27
7. massa espectroscópica imagens de raízes de plantas em EcoFABs (Figura 7)
Nota: Dispositivos EcoFAB feitos de um elastômero de 5:1 base para mistura de agente de cura com braçadeiras personalizadas (Figura 7A) são utilizados para raiz carimbo para chips de espectrometria de massa (NIMS) nanostructure-iniciador,,28,2930 desde camadas PDMS podem ser inversamente ligadas às superfícies de chips NIMS.
- Esterilize uma superfície de microplaqueta NIMS com luz UV por 1h.
- Escolher um EcoFAB com uma planta crescente da incubadora e colocá-lo em uma capa de estéril.
- Abra o recipiente EcoFAB e remover a placa superior da mordaça.
- Levante a camada PDMS juntamente com a planta dentro e anexar com cuidado a camada PDMS com a planta em uma microplaqueta NIMS (Figura 7BD, E).
Nota: Uma vez que a raiz toca a superfície do chip NIMS, isso não deve ser movido. Isso impede que a "mancha" dos metabolitos raiz. - Pressione suavemente para baixo sobre as raízes através da camada PDMS até as raízes totalmente entre em contato com a superfície do NIMS. Deixe as raízes na superfície NIMS por 20 min.
- Retire a camada PDMS, incluindo a planta do chip NIMS, novamente, evitando a raiz movendo-se através da superfície do NIMS. Retorne a planta para a braçadeira se desejado.
- Colocar o chip de NIMS em uma placa personalizada de MALDI e carregar a placa em um espectrômetro MALDI para massa de imagem (Figura 7).
- Use o programa OpenMSI para gerar a imagem NIMS de raiz metabolitos (Figura 7-G)31.
Resultados
Cada sistema EcoFAB inclui um dispositivo EcoFAB e uma planta de tamanho de recipiente de plástico transparente. Um dispositivo EcoFAB tem um reservatório de planta, uma câmara de crescimento de raiz, uma entrada de fluxo de 1,6 mm e uma saída de 1,6 mm para dispositivo EcoFAB padrão (Figura 2D & Figura 3 H) ou uma tomada de 10 mm para dispositivo de EcoFAB largo de corrente (Figura 2F & Figura 3I ). O reservatório da usina é projetado em forma de trapézio que possui uma abertura superior de 6 mm e abertura de fundo de 3 mm, e este projeto reduz a possibilidade de vazamento de fluxo durante a injeção de líquido e também garante o espaço suficiente para o crescimento das plantas. A câmara de crescimento de raiz adota uma forma oval com 2 mm de profundidade para caber os sistemas da raiz de muitas plantas de modelo, como mostrado na Figura 2 e E. Canais de entrada e de saída de um dispositivo EcoFAB padrão podem ser conectados com tubo de PTFE para que soluções de nutrientes podem fluir na câmara de crescimento de raiz sem abrir o recipiente EcoFAB. O dispositivo de EcoFAB largo-tomada grandemente reduz a resistência ao fluxo de saída e é usado de preferência quando o cultivo de plantas com sistemas de raiz grossos ou periodicamente coleta exsudados de raiz depois de sistemas complexos de raiz são derivados de plantas.
Os moldes de fundição para a fabricação de camadas PDMS de dispositivos EcoFAB são criados em um software de design e 3D impresso em fotopolímeros opacos rígidos, como mostrado na Figura 2 e Figura 3. Plantas dentro de EcoFABs podem ser diretamente observadas com um microscópio usando uma distância de trabalho longa, garantindo que o estéril cresce ambiente (Figura 8A, Arquivo complementar 1). EcoFAB dispositivos com plantas também podem caber em um palco de microscópio de alta resolução, que permite que imagens de resolução mais elevada de interações planta-micróbio (Figura 8B, Arquivo complementar 2). Esterilidade não é mantida neste ambiente, e imagens de alta resolução, portanto, só é adequada para medições de ponto de extremidade.
EcoFABs são projetados para permitir estudos de sistemática de plantas, tais como a sua morfologia, metabolismo e comunidades microbianas em seus estágios de crescimento diferentes em seus ciclos de vida. Aqui, EcoFABs foram examinados como uma plataforma geral para estudar uma variedade de espécies de plantas. Figura 8 -E mostrar 7 - dias velho Arabidopsis thaliana, Brachypodium distachyone Panicum virgatum crescendo em EcoFABs. Todas as três plantas foram encontradas crescer bem no EcoFAB para mais de um mês. Tanto a dicot, Arabidopsis thaliana e a botânica, Brachypodium distachyon foram encontrados à altura de seus estágios de reprodução na EcoFABs.
O sistema de vedação reversível permite o uso de substratos sólidos (ex., solo) dentro do EcoFABs (passo 2.2). Este reversível da selagem abordagem permite um carregamento de substratos sólidos em câmaras de crescimento de raiz e também permite a coleta de amostra de regiões específicas de rhizospheres de raiz. Figura 8F -H mostra um grupo de 14 dias de idade Brachypodium distachyon crescendo no meio hydroponic, bem como a areia e solo suplementado com meio hydroponic (areia) e água (solo). A camada fina de substrato sólido em câmaras de crescimento de raiz permite que a luz penetrar para geração de imagens microscópica de sistemas da raiz.
Morfologia da raiz é definida como configuração espacial e a distribuição de um sistema de raiz da planta e foi aprovada como uma resposta de Fisiologia essencial para ambientes de crescimento diversas, tais como nutriente ou água disponibilidade32,33, 34. EcoFABs fornecem uma abordagem conveniente estudar a morfologia vegetal ao longo do tempo ou em diferentes condições de nutrientes. Figura 9A-F mostram um exemplo de usando EcoFABs para acompanhar as morfologias de raiz de Brachypodium distachyon nas primeiras três semanas. Uma muda de Brachypodium distachyon foi transferida para o dispositivo EcoFAB, e sua estrutura de raiz foi gravada por uma câmera dentro de um sistema de imagem de gel BIO-RAD. Programa de processamento de imagem, como imagem J, python e matlab, pode ser mais aplicado para quantificar as alterações de morfologias raiz ao longo do tempo ou em diferentes ambientes de médio. A quantificação da área total da raiz ao longo de três semanas, mostrou um aumento gradual da fase inicial (< 1 semana) seguido por uma tendência de crescimento linear ao fim de três semanas, como mostrado na Figura 9.
A principal motivação para construir o EcoFAB é investigar interações planta-micróbio. Conforme descrito na etapa 5.4, microorganismos são transferidos para câmaras de crescimento de raiz da EcoFAB dispositivos através do canal de entrada. A Figura 10 mostra, um EcoFAB contendo simea Pseudomonas (anteriormentefluorescens) WCS417 (WCS417), um crescimento de planta promovendo rizobactérias com rótulos quimioluminescente, foi adicionado para os sistemas de raiz da planta com uma concentração de 106 células por planta. O sinal de WCS417 foi detectado com um Imageador de gel, que indicou uma distribuição espacial distinta dos micróbios WCS417 em câmaras de crescimento de raiz. Em ambos os MS meio líquido com e sem o substrato sólido areia, WCS417 micróbios colonizaram as superfícies dos sistemas da raiz inteiras com micróbios concentrados-se em torno das áreas de ponta de raiz, possivelmente devido à produção de nutriente ativa de dicas de raiz (Figura 10 & H)35. Por outro lado, os micróbios WCS417 em substrato de solo acumularam em torno da região do reservatório de planta em vez de dicas de raiz (Figura 10eu). Como os micróbios foram adicionados através do canal de saída, os micróbios também foram capazes de mover-se ao substrato de solo, mas não se acumulam na raiz, como observado em meio líquido, com ou sem areia. Isso pode indicar que o solo é uma fonte de nutrientes suficiente, e os micróbios migraram para o reservatório de planta para as condições de respiração ideal.
Para estudar metabólito perfilação de exsudados de raiz da planta, bem como a captação de metabólito e liberte das interações planta-micróbio, as soluções de exsudato das câmaras de crescimento de raiz foi coletada através de vários estágios de crescimento das plantas em EcoFABs. Conforme descrito na etapa 6, amostras do exsudato então são extraídas para a análise de LC-MS. Usando este método, uma variedade de metabólitos exalava pela planta e consumido pelos micróbios foi detectada, e o perfil de metabólito relacionado de exsudados radiculares com e sem colonização micróbios é atualmente sob investigação.
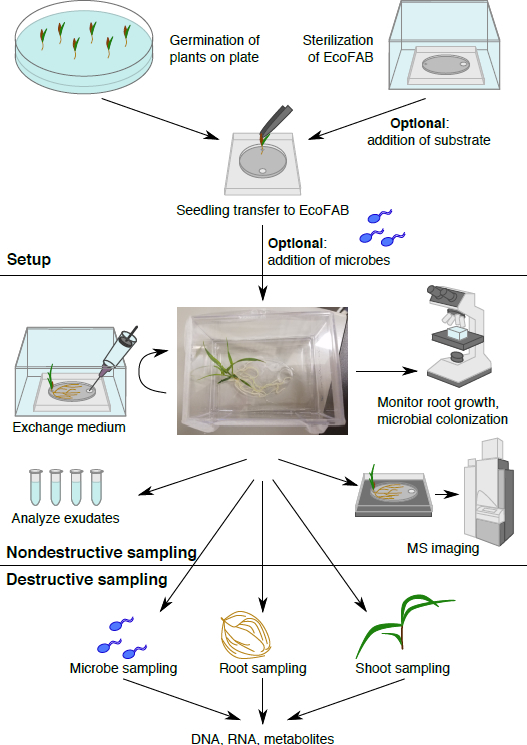
Figura 1: fluxo de trabalho The EcoFAB. Plantas são germinadas na placa e transferidas para o EcoFAB esterilizado, os micróbios podem ser adicionados. Amostragem não-destrutiva: exsudados de raiz podem ser amostrados e fotografados, e morfologia da raiz pode ser visualizada. Amostragem destrutiva permite a análise de micróbio, raiz e atirar parâmetros em detalhe.
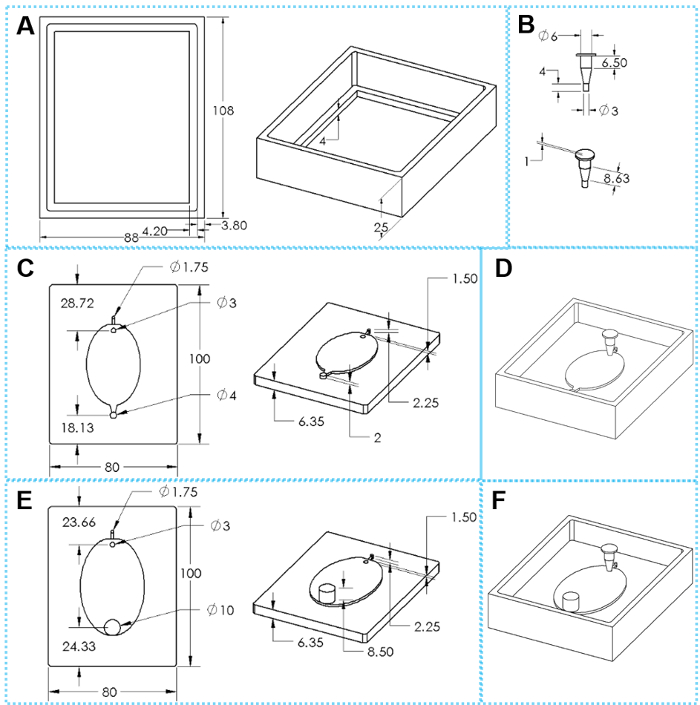
Figura 2: componentes do 3D impresso moldes para a fabricação de dispositivo EcoFAB. (A) superiores e inclinadas vistas de um quadro de fundição. (B) superiores e inclinadas vistas de uma inserção. (C) superior e vistas inclinadas sobre uma base de molde padrão. (E) superiores e inclinadas vistas de uma base de tomada de todo o molde. (D, F) Moldes montados para fabricar dispositivos de EcoFAB padrão e a escala de corrente, respectivamente. As dimensões ovais são 51 x 34 mm para o pequeno EcoFAB molde e 76 mm x 62 mm para grandes EcoFAB molde. Clique aqui para ver uma versão maior desta figura.

Figura 3: fabricação de dispositivo EcoFAB. (A) despejar a mistura do agente de cura e base de elastômero no molde. (B) aquecimento do molde com uma mistura a 85 ° C por 4 h. (C) remover a inserção do molde. (D) separando o PDMS da armação da carcaça. (E) empurrando o molde base fora do quadro de fundição. (F) usando uma faca para separar o molde ao longo das bordas do PDMS. (G) a camada PDMS lentamente fora da base de molde a descascar. Buracos de Poking (H) para os canais de entrada e a saída da camada padrão de PDMS. (I) cutucando um buraco para o canal de entrada da camada de PDMS largo-tomada. Camada (J) o PDMS (feitas de um elastômero de 15:1 base para mistura de agente de cura) e uma lâmina de microscópio são lavadas e transferidas para um plasma líquido de limpeza para colagem. (K) usando os grampos para prender a camada PDMS (feita de uma base de elastômero de 5:1 a mistura do agente de cura) numa lâmina de microscópio. (L) pressionando a camada PDMS (feita de uma base de elastômero de 30: 1 a mistura do agente de cura) diretamente para uma lâmina de microscópio. Clique aqui para ver uma versão maior desta figura.
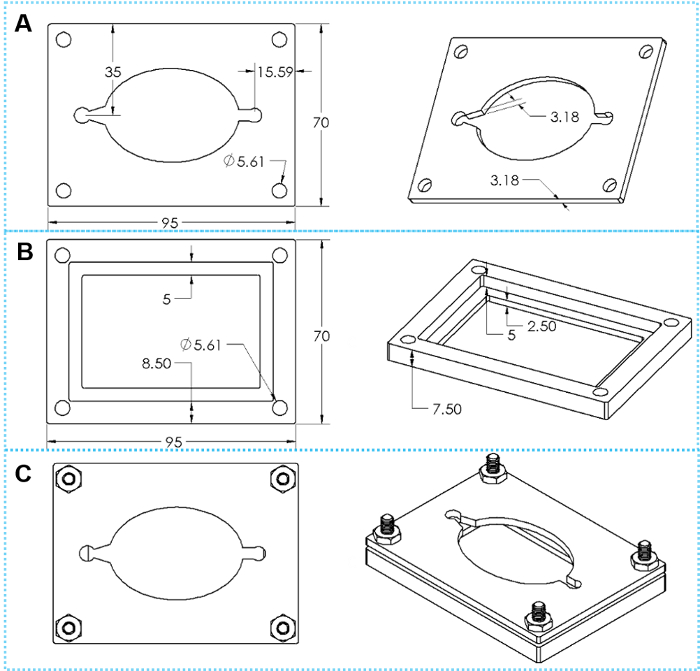
Figura 4: O design de braçadeiras personalizados. (A) superiores e inclinadas vistas do topo de uma braçadeira placa. (B) superiores e inclinadas vistas sobre um fundo fixar placa. (C) superior e inclinadas vistas do grampo montado com quatro conjuntos de parafusos hexagonais. Clique aqui para ver uma versão maior desta figura.
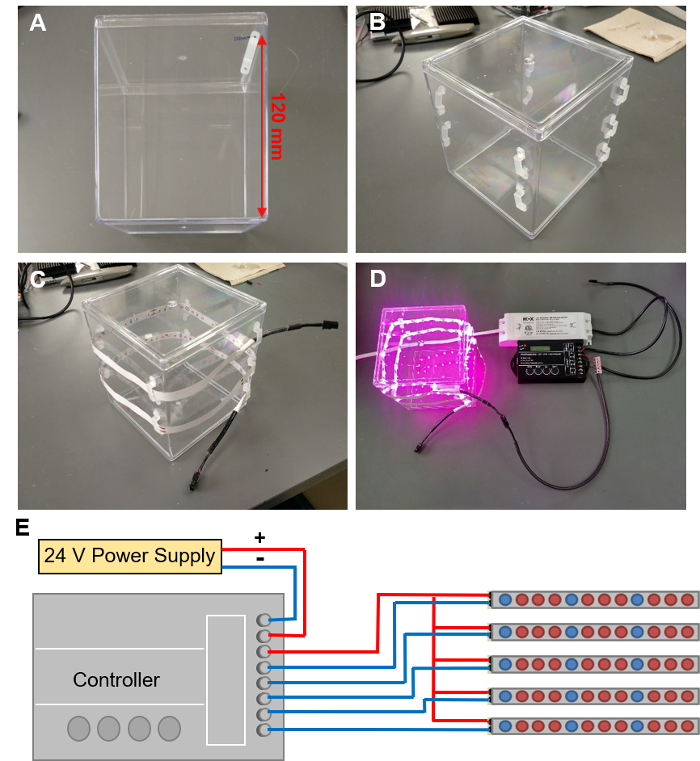
Figura 5: instalar LED crescer luzes. (A) marcação fora os locais para 9 clipes de LED em uma espiral em torno do recipiente EcoFAB. (B) LED clipes anexado ao contêiner EcoFAB. (C) threading uma tira de LED por esses clipes. (D) regueta o LED a um controlador com fio com uma fonte de alimentação de 24V. (E) o esquema de ligações dos fios para o controlador. Clique aqui para ver uma versão maior desta figura.

Figura 6: transferência de mudas para EcoFABs. (A) Brachypodium distachyon plantas cultivadas há 2 dias em um prato de 0,5 MS. (B) enchendo a câmara de raiz com média de crescimento de planta. (C) usando uma pinça para inserir a raiz cuidadosamente o reservatório da usina. (D) selar o recipiente EcoFAB com fita micropore, depois de adicionar 3 mL de água para o fundo do recipiente. Clique aqui para ver uma versão maior desta figura.

Figura 7: imagem NIMS da planta raízes no EcoFABs. (A) um Brachypodium distachyon crescendo em um EcoFAB estéril. (B) anexar a camada PDMS com a planta em uma microplaqueta NIMS por 20 min. (C) usando cobre fita colocar o chip de NIMS em uma placa personalizada de MALDI e carregá-los em um espectrômetro de massa MALDI. (D-G) um 7 - velho dia e um 20 dia de idade Brachypodium distachyon planta usada para NIMS imaging (D, E) e as imagens correspondentes do NIMS (F, G). Os íons predominantes foram destacados em vermelho, verde e azul. Clique aqui para ver uma versão maior desta figura.

Figura 8: as aplicações gerais de EcoFABs. (A) diretamente capturando o crescimento da raiz de Brachypodium distachyon em um EcoFAB com uma configuração de microscópio de distância longa do trabalho. (B) diretamente, observando interações micróbio de raiz com uma configuração de alta resolução do microscópio. (C-E) 7 - dias velho Arabidopsis thaliana (C), Brachypodium distachyon (D) e Panicum virgatum (E) no meio hydroponic 0,5 MS, 14 dias de idade (F-H) Brachypodium distachyon cultivadas em hidroponia 0,5 MS (F), em areia (G) e solo (H) substrato fornecido com média de 0,5 MS e água, respectivamente. Clique aqui para ver uma versão maior desta figura.
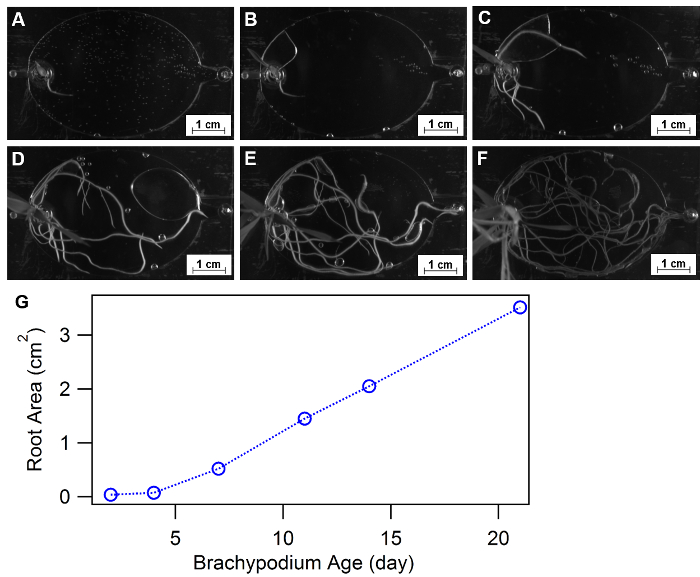
Figura 9: usando EcoFABs para estudar a morfologia da raiz. (A-F) Desenvolvimento de raiz de Brachypodium distachyon crescendo em EcoFABs preenchido com média de 0,5 MS durante as primeiras três semanas: (A) há 2 dias, (B) 4, (C) 7 dias, (D) 11, e 14 dias, (F) 21 dias de crescimento. (G) áreas de superfície de raiz em média foram estimadas pelo software ImageJ. Clique aqui para ver uma versão maior desta figura.
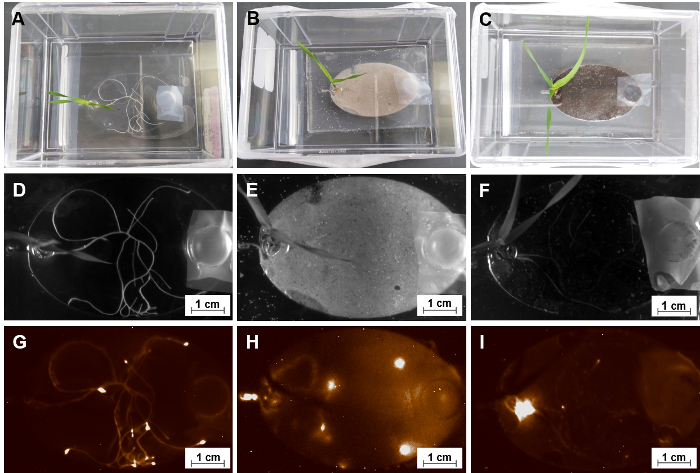
Figura 10: usando EcoFABs para estudar interações de raiz-micróbio. (A, B, C) Um grupo de 15 dias de idade Brachypodium distachyon colonizar com Pseudomonas fluorescens WCS417 em diferentes formas de mídia-MS líquidos substratos de solução, areia e solo. (D, E, F) Fotos de campo brilhante de seus sistemas da raiz. (G, H, EU) As correspondentes imagens quimioluminescente destes sistemas de raiz após cultivo co 14 dias. Clique aqui para ver uma versão maior desta figura.
Complementar arquivo 1. Usando EcoFAB para capturar o crescimento da raiz. Clique aqui para baixar este arquivo.
Complementar arquivo 2. Usando EcoFAB para capturar as interações de raiz-micróbios. Clique aqui para baixar este arquivo.
Discussão
Os protocolos aqui relataram para o uso de fabricação do ecossistema para criar que ecofabs fornece recursos comunitários para planta sistemática estudos de biologia em condições de laboratório altamente controlado. Avanços na impressão 3D fornecem tecnologias amplamente acessíveis para construir e refinar iterativamente EcoFAB projetos. A câmara de raiz aqui apresentada é encontrada para ser adequados para a microscopia de imagem e manter a esterilidade, permitindo a adição controlada de micróbios para investigar interações planta-micróbio. A plataforma EcoFAB é compatível com várias espécies de plantas. É importante reconhecer os efeitos fisiológicos de crescer as plantas dentro da câmara de raiz estreita tal que experimentos adicionais deverão generalizar conclusões para plantas que crescem em ambientes naturais.
O uso de câmaras estéril e cresce a luz LED possibilita a investigação dos efeitos das diversas condições de luz, incluindo o comprimento de onda, intensidade e duração, no crescimento das plantas e parâmetros fisiológicos relacionados em paralelo. Câmaras de raiz de ligação reversível permitam a utilização de substratos sólidos também quanto espacialmente coletar amostras sólidas para análise bioquímica e genética. As aplicações de substratos sólidos, como solos, areia e grânulos de quartzo, oferecem as possibilidades do uso EcoFABs construir ecossistemas de laboratório mais ecologicamente relevantes. No entanto, todos os sistemas aqui apresentados ainda mais uso líquido saturado (culturas hidropónicas) que não são um reflexo preciso da maioria dos solos e isso será importante para refinam estes projetos para manter os bolsos de ar dentro do solo, tal que melhor representam solos naturais.
O uso de câmeras simples e microscópios é descrito para o desenvolvimento de morfologia de raiz sistema de imagem em ambos em massa aos níveis celulares. Esta aptidão para monitoramento de imagem de morfologia de raiz e quantificação provavelmente será útil para compreender os mecanismos de regulação dos sinais fisiológicos e moleculares planta desencadeados por adaptações genotípica de planta para as condições de crescimento. No entanto, uma limitação para estudar o desenvolvimento fisiológico da raiz é o atual posicionamento horizontal do dispositivo EcoFAB. Em ambientes naturais, a resposta de gravitropic raízes leva a um desenvolvimento predominantemente vertical do sistema radicular. Assim, o sistema horizontal apresentado aqui provavelmente difere em alguns fatores de um ambiente natural, e a fabricação de sistemas EcoFAB com posicionamento vertical da câmara de raiz é um objetivo desejável para as futuras versões EcoFAB. Embora os dispositivos EcoFAB atuais são colocados horizontalmente, a análise de parâmetros de morfologia de raiz em várias condições, ou em resposta aos micróbios, é possível. Imagem de alta resolução pode ser aplicada para capturar a dinâmica de colonização de raiz de único isolados ou comunidades, fornecendo informações sobre qual planta peças são colonizadas em várias condições suficientes e deficientes de nutrientes. Prevê-se que tais estudos fornecerá importantes novos insights sobre como planta microbiomes são montados, e como essas dinâmicas mudam ao longo do tempo, por exemplo, como as raízes desenvolver.
Dispositivos microfluídicos permitem imagens de plantas muito jovens, e geralmente a quantidade de metabolitos recolhidos não é suficiente para análise LCMS. Sistemas baseados em solo, tais como rhizotrons, permitem a geração de imagens da morfologia da raiz quando as plantas também são transformadas com construção quimioluminescente (Glo-raiz) ou com métodos baseados em NMR33,34. Extrações de metabólito destes sistemas são demoradas por causa do grande volume de amostras. EcoFABs são uma combinação de ambos: a fabricação é similar aos dispositivos microfluídicos. EcoFABs foi projetados para ser simples e barata para reproduzir, mas o tamanho da câmara pode ser ajustado para crescer plantas com pequenas ou grandes sistemas de raiz, até seus estágios reprodutivos. Observações simultâneas de alterações de morfologia de raiz e exsudação de raiz são possíveis. O sistema é estéril, permitindo a adição controlada de micróbios específicos.
EcoFABs são projetados para permitir a introdução controlada e amostragem de micróbios e seus metabolitos. Especificamente, amostras colhidas em câmaras de crescimento de raiz são encontradas para ser suficiente para massa espectroscópico metabólito profiling. A integração de imagens de espectrometria de massa (ex., NIMS técnica apresentada aqui) fornece uma abordagem não-destrutiva de estudar distribuições espaciais de metabólito de sistemas da raiz. Esta técnica provavelmente será útil no futuro isótopos rastreamento experimentos e localização microbiana de mapeamento de metabolitos específicos36. Enquanto este protocolo centrou-se na único isolados, o mesmo projeto certamente pode ser usado para as comunidades mais complexas. Os volumes de amostra e biomassa dentro do EcoFABs são provavelmente mais do que suficiente para uma maior integração com tecnologias de sequenciamento de DNA, que será importante para caracterizar e monitorar a expressão de gene e estrutura de comunidade microbiana.
Em conclusão, este protocolo detalha a fabricação dos ecossistemas de laboratório projetado para a investigação de interações planta-micróbio, com ênfase em métodos simples e acessíveis que pode ser facilmente implementado e estendido por pesquisadores em todo o mundo. Os actuais esforços visam demonstrar a reprodutibilidade entre laboratórios e a integração de um sistema de controle de temperatura, tal que cada EcoFAB vai ter controlados independentemente luz e temperatura. Um avanço adicional do sistema será a integração de amostragem automatizada e o reenchimento de câmaras de raiz EcoFAB e o desenvolvimento de protocolos podem ser reproduzidos para estabelecer microbiomes de planta relevantes dentro de EcoFABs.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pelo programa de laboratório dirigido a investigação e desenvolvimento (LDRD), do Lawrence Berkeley National Laboratory suportado pelo escritório da ciência, do departamento de energia dos EUA, sob contrato n º DE-AC02-05CH11231 e um prêmio DE-SC0014079 do Estados Unidos Departamento de energia escritório da ciência para UC Berkeley. Trabalho na fundição Molecular foi apoiado sob E.U. departamento da energia contrato n º DE-AC02-05CH11231. Agradecemos também Suzanne M. Kosina, Katherine Louie, Benjamin P. Bowen e Benjamin J. Cole no Lawrence Berkeley National Laboratory por toda sua ajuda.
Materiais
| Name | Company | Catalog Number | Comments |
| 3D printed custom mold | LBNL | STL files available here www.eco-fab.org; The EcoFABs molds described here were printed by FATHOM: http://studiofathom.com | |
| Dow sylgard 184 silicone elastomer clear kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| Air duster spray | VWR | 75780-350 | any compressed gas duster should work |
| 15 gauge blunt needle | VWR | 89166-240 | |
| 5 mL syringe with Luer-Lok Tip | VWR | BD309646 | |
| 3”x2” microscope glass slide | VWR | 48382-179 | |
| 1.75" x 2.56" x 3.56" EcoFAB box | Amazon | B005GAQ25Q | |
| 4” x 3 ¼” microscope glass slide | Ted Pella | 260231 | |
| 4.87" x 4.87" x 5.50" EcoFAB box | Amazon | B00P9QVOS2 | |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| 3D printed custom clamp | LBNL | STL files available from Trent Northen's lab | |
| Sterile hood | AirClean Systems | AC600 Series PCR Workstations | |
| PTFE syringe tubing | Sigma-Aldrich | Z117315-1EA | |
| Ethanol | VWR | 89125-172 | |
| Bleach | |||
| Murashige and Skoog (MS) Macronutrient Salt Base | Phytotechnologies Laboratories | M502 | |
| Murashige and Skoog (MS) Micronutrient Salt Base | Phytotechnologies Laboratories | M554 | |
| Soil | Hummert International | Pro-Mix PGX | |
| Phytagel | Sigma-Aldrich | 71010-52-1 | |
| Arabidopsis thaliana | Lehle Seeds | WT-24 Col-4 Columbia wild type | |
| Brachypodium distachyon | LBNL | Standard Bd-21 line | Available from John Vogel's lab |
| Panicum virgatum | The Samuel Roberts Noble Foundation | Alamo switchgrass | |
| Micropore tape | VWR | 56222-182 | |
| LC-MS grade methanol | VWR | JT9830-3 | |
| Lyophilizer | LABCONCO | FreeZone 2.5 Plus | |
| SpeedVAC concentrator | Thermo Scientific | Savant™ SPD111 SpeedVac | |
| Ultrafree-MC GV Centrifugal Filter-0.22 µm | Millipore | UFC30GV00 | |
| Liquid chromotography system | Agilent | Agilent 1290 LC system | |
| Q Exactive mass spectrometer | Thermo Scientific | Q Exactive™ Hybrid Quadrupole-Orbitrap MS | |
| NIMS chip and custom MALDI plate | LBNL | For detailed protocol see: doi:10.1038/nprot.2008.110 | |
| MALDI mass spectrometer | AB Sciex | TOF/TOF 5800 MALDI MS | |
| Nano-coated LED grow light strip | LED World Lighting | HH-SRB60F010-2835 | |
| Power supply | LED World Lighting | MD45W24VA, LV100-24N-UNV-J | |
| TC420 controller | Amazon | B0197U7R8Q | |
| Silicone LED clips | Amazon | B00N9X1GI0 | |
| Hot glue gun | Amazon | B006IY359K | |
| Female-to-bare LED connector cable | LED World Lighting | HH-F05 | |
| Female-to-male LED connector extension cable | LED World Lighting | HH-MF1 | |
| 20AWG 2-wire cable | LED World Lighting | 6102051TFT4 | |
| WAGO 221-415 Splicing Connector | LED World Lighting | 221-415 |
Referências
- Morrissey, J. P., Dow, J. M., Mark, G. L., O'Gara, F. Are microbes at the root of a solution to world food production. EMBO Rep. 5 (10), 922-926 (2004).
- Farrar, K., Bryant, D., Cope-Selby, N. Understanding and engineering beneficial plant-microbe interactions: plant growth promotion in energy crops. Plant Biotechnol J. 12 (9), 1193-1206 (2014).
- Singh, J. S., Abhilash, P. C., Gupta, V. K. Agriculturally Important Microbes in Sustainable Food Production. Trends Biotechnol. 34 (10), 773-775 (2016).
- Dubey, R. K., Tripathi, V., Dubey, P. K., Singh, H. B., Abhilash, P. C. Exploring rhizospheric interactions for agricultural sustainability: the need of integrative research on multi-trophic interactions. J Clean Prod. 115, 362-365 (2016).
- Hunter, P. Plant microbiomes and sustainable agriculture. EMBO Rep. 17 (12), 1696-1699 (2016).
- van der Heijden, M. G. A., Hartmann, M. Networking in the Plant Microbiome. PLoS Biol. 14 (2), e1002378(2016).
- Vessey, J. K. Plant growth promoting rhizobacteria as biofertilizers. Plant Soil. 255 (2), 571-586 (2003).
- Yang, J., Kloepper, J. W., Ryu, C. -M. Rhizosphere bacteria help plants tolerate abiotic stress. Trends Plant Sci. 14 (1), 1-4 (2009).
- Reynolds, H. L., Packer, A., Bever, J. D., Clay, K. GRASSROOTS ECOLOGY: PLANT-MICROBE-SOIL INTERACTIONS AS DRIVERS OF PLANT COMMUNITY STRUCTURE AND DYNAMICS. Ecology. 84 (9), 2281-2291 (2003).
- Finkel, O. M., Castrillo, G., Herrera Paredes, S., Salas González, I., Dangl, J. L. Understanding and exploiting plant beneficial microbes. Curr Opin Plant Biol. 38, 155-163 (2017).
- Northen, T. R., Zhang, Z., Gao, J., Swenson, T., Yoshikuni, Y. Advancing Our Understanding of the Chemistry of Soil Microbiomes. National Academies of Sciences, Engineering, and Medicine. 2017. The Chemistry of Microbiomes: Proceedings of a Seminar Series. , The National Academies Press. Washington, DC. (2017).
- Busby, P. E., et al. Research priorities for harnessing plant microbiomes in sustainable agriculture. PLOS Biology. 15 (3), e2001793(2017).
- Sanati Nezhad, A. Microfluidic platforms for plant cells studies. Lab Chip. 14 (17), 3262-3274 (2014).
- Oburger, E., et al. Evaluation of a novel tool for sampling root exudates from soil-grown plants compared to conventional techniques. Environ Exp Bot. 87, 235-247 (2013).
- Van Der Krift, T. A. J., Berendse, F. Root life spans of four grass species from habitats differing in nutrient availability. Funct Ecol. 16 (2), 198-203 (2002).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. P Natl. Acad. Sci. USA. 114 (17), 4549-4554 (2017).
- Sanati Nezhad, A., Naghavi, M., Packirisamy, M., Bhat, R., Geitmann, A. Quantification of cellular penetrative forces using lab-on-a-chip technology and finite element modeling. P Natl. Acad. Sci. USA. 110 (20), 8093-8098 (2013).
- Jiang, H., Xu, Z., Aluru, M. R., Dong, L. Plant chip for high-throughput phenotyping of Arabidopsis. Lab Chip. 14 (7), 1281-1293 (2014).
- Parashar, A., Pandey, S. Plant-in-chip: Microfluidic system for studying root growth and pathogenic interactions in Arabidopsis. Appl. Phys. Lett. 98 (26), 263703(2011).
- Busch, W., et al. A microfluidic device and computational platform for high-throughput live imaging of gene expression. Nat Methods. 9 (11), 1101-1106 (2012).
- Grossmann, G., et al. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23 (12), 4234-4240 (2011).
- Aufrecht, J. A., Ryan, J. M., Hasim, S., Allison, D. P., Nebenführ, A., Doktycz, M. J., Retterer, S. T. Imaging the Root Hair Morphology of Arabidopsis Seedlings in a Two-layer Microfluidic Platform. J. Vis. Exp. (126), (2017).
- Garvin, D. F., et al. Development of Genetic and Genomic Research Resources for Brachypodium distachyon, a New Model System for Grass Crop Research. Crop Sci. 48 (Supplement_1), S69-S84 (2008).
- Lisensky, G. C., et al. Replication and Compression of Surface Structures with Polydimethylsiloxane Elastomer. J. Chem. Educ. 76 (4), 537(1999).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502(2010).
- Yao, Y., et al. Analysis of Metabolomics Datasets with High-Performance Computing and Metabolite Atlases. Metabolites. 5 (3), 431-442 (2015).
- Sumner, L. W., et al. Proposed minimum reporting standards for chemical analysis Chemical Analysis Working Group (CAWG) Metabolomics Standards Initiative (MSI). Metabolomics. 3 (3), 211-221 (2007).
- Gao, J., de Raad, M., Bowen, B. P., Zuckermann, R. N., Northen, T. R. Application of Black Silicon for Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 88 (3), 1625-1630 (2016).
- Gao, J., et al. Morphology-Driven Control of Metabolite Selectivity Using Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 89 (12), 6521-6526 (2017).
- Woo, H. -K., Northen, T. R., Yanes, O., Siuzdak, G. Nanostructure-initiator mass spectrometry: a protocol for preparing and applying NIMS surfaces for high-sensitivity mass analysis. Nat. Protoc. 3 (8), 1341-1349 (2008).
- Rübel, O., et al. OpenMSI: A High-Performance Web-Based Platform for Mass Spectrometry Imaging. Anal. Chem. 85 (21), 10354-10361 (2013).
- López-Bucio, J., Cruz-Ramı́rez, A., Herrera-Estrella, L. The role of nutrient availability in regulating root architecture. Curr Opin Plant Biol. 6 (3), 280-287 (2003).
- Lynch, J. P. Steep, cheap and deep: an ideotype to optimize water and N acquisition by maize root systems. Ann. Bot. 112 (2), 347-357 (2013).
- Rellán-Álvarez, R., et al. GLO-Roots: an imaging platform enabling multidimensional characterization of soil-grown root systems. eLife. 4, e07597(2015).
- Kamilova, F., Validov, S., Azarova, T., Mulders, I., Lugtenberg, B. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria. Environ. Microbiol. 7 (11), 1809-1817 (2005).
- Klitgaard, A., Nielsen, J. B., Frandsen, R. J. N., Andersen, M. R., Nielsen, K. F. Combining Stable Isotope Labeling and Molecular Networking for Biosynthetic Pathway Characterization. Anal. Chem. 87 (13), 6520-6526 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados