Method Article
Protocolli di fabbricazione (EcoFAB) di ecosistema per la costruzione degli ecosistemi di laboratorio progettato per studiare le interazioni piante-microrganismi
In questo articolo
Riepilogo
Questo articolo descrive protocolli dettagliati per la fabbricazione di ecosistema di dispositivi (EcoFABs) che permettono studi di piante e interazioni piante-microrganismi in condizioni di laboratorio altamente controllate.
Abstract
Interazioni piante-microrganismi benefici offrono una soluzione biologica sostenibile con il potenziale per incrementare la produzione alimentare e bioenergia basso input. Una migliore comprensione meccanicistica di queste interazioni piante-microrganismi complessi sarà cruciale per migliorare la produzione vegetale come ben più performante basic ecologico studi investigativi interazioni pianta-suolo-microbo. Qui, viene visualizzata una descrizione dettagliata per la fabbricazione di ecosistema, utilizzando ampiamente disponibili tecnologie di stampa 3D, per creare habitat controllati del laboratorio (EcoFABs) per studi meccanicistici di interazioni piante-microrganismi all'interno di specifiche ambientali condizioni. Due dimensioni di EcoFABs sono descritti che sono adatti per l'indagine sulle interazioni microbiche con varie specie di piante, tra cui Arabidopsis thaliana, Brachypodium distachyone Panicum virgatum. Questi dispositivi di scorrimento consentono controllata manipolazione e campionamento di radice microbiomi, chimica di radice nonché di imaging della morfologia della radice e della localizzazione microbica. Questo protocollo include i dettagli per mantenere condizioni di sterilità all'interno EcoFABs e montaggio di sistemi di illuminazione LED indipendente sul EcoFABs. Metodi dettagliati per l'aggiunta di diverse forme di media, compresi i suoli, sabbia e mezzi liquidi di sviluppo accoppiato alla caratterizzazione di questi sistemi usando la formazione immagine e metabolomica è descritti. Insieme, questi sistemi consentono indagini dinamico e dettagliato della pianta e pianta-microbica consorzi tra cui la manipolazione del microbioma composizione (tra cui mutanti), il monitoraggio della crescita delle piante, morfologia della radice, composizione di essudato, e localizzazione microbica in condizioni ambientali controllate. Ci aspettiamo che questi protocolli dettagliati servirà come punto di partenza importante per altri ricercatori, idealmente contribuendo a creare sistemi standardizzati sperimentale per lo studio di interazioni piante-microrganismi.
Introduzione
L'applicazione di microbi benefici pianta in agricoltura offre un grande potenziale per aumentare la produzione di biocarburanti per fornire per una crescente popolazione1,2,3,4e alimentare sostenibile. Una quantità significativa di lavoro sostiene l'importanza della pianta microbiomi nell'assorbimento dei nutrienti della pianta, tolleranza agli stress e resistenza alla malattia5,6,7,8. Tuttavia, è difficile indagare questi meccanismi delle interazioni piante-microrganismi negli ecosistemi di campo dovute alla complessità e irriproducibilità associato e incapacità di controllare con precisione la composizione microbiome e genetica (ad es., usando microbica mutanti)4,9,10.
Una strategia consiste nel costruire gli ecosistemi di modello semplificato per consentire controllato, esperimenti di laboratorio replicate indagare interazioni piante-microrganismi per generare intuizioni che possono essere ulteriormente testati nel campo10,11, 12. Questo concetto si basa su approcci tradizionali utilizzando piante coltivate in vasi riempiti di terreno o su lastre di agar all'interno di serre o incubatori13. Anche se queste probabilmente rimarrà il più ampiamente utilizzati approcci, essi mancano della capacità di precisamente monitorare e gestire ambienti di crescita della pianta. A tal fine, rizobox e rhizotrons rappresentano un importante miglioramento nella capacità di studiare i processi sotto-terra14,15, e protocolli prime sono stati pubblicati per l'analisi dei metaboliti della rizosfera nel suolo16. Più recentemente, per consentire analisi di rendimento elevato, microfluidici avanzati dispositivi13,17 come pianta Chip18,19, RootArray20e RootChip21, sono stati sviluppato come strumenti efficaci per fenotipizzazione di pianta con risoluzione spaziale di scala micrometrica per monitorare le prime fasi di crescita della pianta piccolo modello Arabidopsis thaliana in medium liquido di flusso. Recentemente, una piattaforma di formazione immagine di due-strato è stata descritta che permette l'imaging dei capelli di radice di Arabidopsis thaliana nella fase del semenzale con una piattaforma di microfluidica22.
Qui, protocolli dettagliati per la costruzione di dispositivi controllati del laboratorio (EcoFABs) sono forniti, per lo studio delle interazioni pianta microbo e spettacolo che può essere utilizzati per studiare varie piante tra cui Arabidopsis thaliana, Brachypodium distachyon23, l'avena Avena barbata, ecologicamente importante e il raccolto di bioenergia Panicum virgatum (switchgrass). EcoFAB è una piattaforma di crescita di pianta sterile che include due componenti principali: il dispositivo EcoFAB e contenitore trasparente dimensioni impianto sterile. EcoFAB dispositivo è costituito da un polidimetilsilossano (PDMS) produzione processo che coinvolge colata PDMS strati da uno stampo di plastica stampato 3D e incollaggio di strati PDMS sui vetrini microscopio utilizzando metodi precedentemente segnalato24,25 . Le procedure dettagliate di EcoFAB del flusso di lavoro, come la fabbricazione di dispositivi, sterilizzazione, germinazione del seme, trapianto di piantine, microbo inoculazione/cocultivation, preparazione del campione e l'analisi, sono descritte in questo protocollo (Figura 1). Ulteriori modifiche del flusso di lavoro base sono descritte, compreso l'installazione del computer controllato luci a LED grow e l'utilizzo di substrati solidi. L'utilizzo di tecniche per studiare la morfologia della radice di imaging cambia, colonizzazione microbica delle radici, e imaging massa spettroscopico di essudati radicali sono descritti. Possiamo anticipare che il design semplice, poco costoso, basato su materiali facilmente reperibili, nonché i protocolli dettagliati qui presentati, si trasformerà la piattaforma EcoFAB in una risorsa di comunità, standardizzando le ricerche di laboratorio pianta-microbiome.
Protocollo
Attenzione: Questo protocollo comprende l'uso di sostanze chimiche pericolose, oggetti appuntiti, dispositivi elettrici, oggetti caldi e altri pericoli che possono provocare lesioni. Appropriati dispositivi di protezione individuale (PPE, ad es., chimicamente resistenti guanti, occhiali protettivi, camice da laboratorio, vestiti lunghi, scarpe a punta chiusa, ecc.) deve essere indossato e le procedure di sicurezza appropriate (formazione sulla sicurezza, l'uso di una cappa aspirante, ecc.) devono essere seguite.
1. fabbricazione di dispositivi EcoFAB: Casting PDMS strati (Figura 2 e Figura 3)
- Costruire gli stampi EcoFAB utilizzando tecniche di stampa 3D (i file di disegno sono disponibili presso. Ogni stampo comprende tre parti: una cornice di colata, una base di stampo consigliati e un'operazione di inserimento, come mostrato nella Figura 2. Stampare la base dello stampo e inserire fuori fotopolimeri opaco rigido utilizzando una stampante 3D in plastica. Utilizzare una risoluzione minima di 100 µm e stampare il frame di colata con acrilonitrile butadiene stirene (ABS).
- Mescolare 40 mL di base in elastomero di silossano con induritore in un contenitore usa e getta di 1L. A seconda dell'esperimento desiderata (punti 2.1 e 2.2), utilizzare diversi rapporti (v/v) di elastomero base/catalizzatore (5:1, 15:1, o 30: 1). Procedere alle fasi 1.3-1.8 per tutti i tipi di miscele.
Attenzione: Indossare guanti resistenti agli agenti chimici, occhiali di sicurezza e altri PPEs. - Posizionare il contenitore in una camera a vuoto per almeno 30 min rimuovere le bolle d'aria dalla miscela di elastomero.
- Versare il composto nello stampo plastica stampato 3D assemblato (Figura 3A) e mantenere la muffa su un blocco di riscaldamento a 85 ° C per 4 h (Figura 3B).
Attenzione: Indossare PPE per evitare scottature. - Lasciare lo stampo raffreddare per 5 min. Quindi estrarre l'inserto dallo stampo delicatamente (Figura 3) e quindi inserire lentamente un taglierino tra il telaio di colata e PDMS (la miscela di elastomero solidificata) per separarli (Figura 2D).
- Premere lo stampo base con PDMS fino dall'intelaiatura della colata (Figura 3E). Utilizzare un coltello o altri strumenti per separare delicatamente il livello PDMS dalla base dello stampo ai bordi (Figura 3F) e poi lentamente staccare dalla superficie dello stampo (Figura 3).
- Creare ingresso e canali di presa sugli strati PDMS praticando fori mm ~1.6 per le porte di ingresso e di uscita con un 15 gauge ago smussato (Figura 3 H, I).
Nota: Lo stampo standard ha una porta di ingresso e di uscita, mentre lo stampo di wide-presa ha bisogno solo la porta di ingresso (Figura 3 H, I). - Usare le forbici per tagliare i bordi degli strati PDMS.
Nota: Gli strati profilati di PDMS dovrebbero essere ≥76 x rettangoli di 51 mm per dispositivi di piccole dimensioni EcoFAB e ≥102 x rettangoli di 83 mm per dispositivi EcoFAB di grandi dimensioni.
2. fabbricazione di dispositivi EcoFAB: chimicamente allegando PDMS strati su vetrini da microscopio (Figura 3 e Figura 4)
- Incollaggio definitivamente gli strati PDMS per vetrini da microscopio
- Sciacquare il lato di incollaggio di 7,6 × 5 cm microscopio e lo strato PDMS (costituito da un elastomero di 15:1 base di miscela di agente di polimerizzazione) far scorrere con metanolo e poi soffia asciugare con aria compressa o di una pistola di azoto ultra-puro.
Attenzione: Il metanolo è tossico. Lavorare in una cappa aspirante e indossare copertura occhiali protettivi, guanti e altri PPEs. - Inserire il vetrino da microscopio e PDMS strato un plasma più pulito con loro lati di incollaggio rivolto verso l'alto (Figura 3J). Se un plasma cleaner non è disponibile, andare al passaggio 2.2.
- Chiudere la camera e la valvola di sfogo del gas del plasma cleaner e attivare il vuoto e la pompa verso il basso della camera per 1 min.
- Accendere il potere del generatore al plasma e passare il livello di frequenza radio (RF) a "HI" per 1 min.
- Spegnere la pompa del vuoto e il potere del plasma e sfiatare la camera ad atmosfera.
- Estrarre il vetrino da microscopio e PDMS strato dalla camera al plasma e rapidamente premere tutti e quattro i bordi dello strato PDMS sulla diapositiva con pressione uniforme (Figura 3 L). Assicurarsi che il centro ovale regione dello strato PDMS (la camera di root) non tocca la diapositiva.
- Collocare il dispositivo EcoFAB sigillato su a 120 ° C Riscaldamento blocco per 20 min proteggere ulteriormente il legame permanente tra il livello PDMS e il vetrino da microscopio.
- Lasciare che il dispositivo raffreddare per 5 min, Trim i bordi supplementari dello strato PDMS con un coltello.
- Sciacquare il lato di incollaggio di 7,6 × 5 cm microscopio e lo strato PDMS (costituito da un elastomero di 15:1 base di miscela di agente di polimerizzazione) far scorrere con metanolo e poi soffia asciugare con aria compressa o di una pistola di azoto ultra-puro.
- Reversibile tenuta fisica degli strati PDMS per vetrini da microscopio
- La tenuta tecnica reversibile utilizza un set di morsetti personalizzati (o stampati da una stampante 3D in plastica o lavorati in metallo, i disegni sono mostrati in Figura 4).
- Porre il vetrino del microscopio nel foro sulla piastra morsetto inferiore e quindi allineare lo strato PDMS (in una base di 5:1 in elastomero per miscela agente di polimerizzazione) sulla parte superiore della diapositiva.
- Posizionare la piastra di bloccaggio superiore sopra lo strato PDMS. Fissare le piastre superiore e inferiore insieme utilizzando quattro viti esagonali, orientando le viti in modo che i dadi sono filettati dalla parte superiore del morsetto.
- PDMS aderente direttamente per vetrini da microscopio
- Posizionare lo strato PDMS (in una base di elastomero di 30: 1 a miscela agente di polimerizzazione) sulla cima di un vetrino da microscopio.
- Premere lo strato PDMS alla diapositiva. Lo strato morbido, molto adesivo di PDMS (30: 1) dovrebbe attenersi alla diapositiva creando una tenuta impermeabile senza il legame chimico permanente o pressione fisica da un morsetto (Figura 3 L).
- La tenuta tecnica reversibile utilizza un set di morsetti personalizzati (o stampati da una stampante 3D in plastica o lavorati in metallo, i disegni sono mostrati in Figura 4).
3. EcoFABs sterilizzazione
- Sciacquare EcoFAB dispositivi con acqua ultrapura.
- Collocare un dispositivo di EcoFAB in un contenitore EcoFAB e aggiungere etanolo al 70%, fino a quando il dispositivo è sommerso. Chiudere il coperchio del contenitore e agitare delicatamente per bagnare tutte le superfici interne con etanolo. Assicurarsi che la camera di crescita di radice del dispositivo EcoFAB è riempito con etanolo, con pochissimi o nessun aria bolle.
- Dopo un'incubazione di 30 min a temperatura ambiente, versare fuori etanolo al 70% e ripetere l'incubazione con etanolo al 100% per 5 min.
- Defluire etanolo e incubare la EcoFAB sterilizzato per 16 h in cappa a flusso laminare per asciugarla completamente. Se disponibile, è possibile sterilizzare il sistema attivando l'UV luce all'interno della cappa per 1 h.
Attenzione: Indossare PPE appropriato quando si lavora con luci UV. - Conservare il EcoFABs sterilizzato in una cappa sterile o in autoclave borse per uso futuro.
4. EcoFABs con LED coltiva le luci (Figura 5)
- Collegamento LED strisce su EcoFAB contenitori
- Contrassegnare le posizioni sul contenitore EcoFAB per 9 clip LED. Iniziare con la prima clip 120mm fino dalla parte inferiore del contenitore lungo un bordo (Figura 5A) e procedere per tracciare percorsi di clip a spirale intorno al contenitore, con ogni clip successiva eliminazione di 10 mm. Una spirale di 9 clip che permette una striscia di LED 1M avvolgere il contenitore due volte.
- Colla a caldo un clip LED a ciascuno contrassegnato posizione aggiungendo due tocchi di colla a caldo sul contenitore, allineato con la posizione dei fori di montaggio della clip. Premere i fori clip in questi due tocchi di colla, quindi aggiungere un'altra piccola quantità di colla sopra i fori. Ripetere la procedura per tutti i clip fino a 9 clip formano una spirale (figura 5B).
Attenzione: Indossare guanti e altri PPE quando si lavora con colla a caldo per evitare ustioni. - Infilare la striscia di LED attraverso i fermagli a forma di spirale, con LED che si affacciava verso il contenitore. La striscia dovrebbe cerchio intorno due volte (Figura 5).
- Elementi di collegamento LED per l'alimentazione con un controller (Figura 5 consente di visualizzare una camera EcoFAB con luci illuminate, la programmazione del controllore è descritto al punto 4.3).
Attenzione: Pericolo di scosse elettriche: assicurarsi che il cavo di alimentazione è scollegato quando collegare i fili.- Collegare i terminali positivo e negativi dell'alimentazione ai morsetti "INPUT: V +" e "INPUT: V-" del controllore con cavo a 2 conduttori (Figura 5E consente di visualizzare un disegno schematico dell'installazione del controller).
- Collegare il cavo negativo l'estremità nuda di un cavo femmina-a-bare a un canale di "Uscita" sul controller.
Nota: Ci sono cinque canali sul controller che è utilizzato nel presente protocollo, quindi può supportare fino a cinque 1m LED strisce. - Collegare i cavi tutti positivi dei cavi a una compatta splicing connettore (se sono necessari più canali) e quindi collegare questo connettore al terminale "uscita V +" del controller.
- Collegare l'estremità femmina dei cavi, ogni striscia di LED così ogni LED ha un proprio canale per essere controllato. Se lo si desidera, è possibile utilizzare cavi femmina--maschio per estendere la portata.
- Programmare il controller per un ciclo di luce desiderato secondo le istruzioni del produttore,
5. coltivazione di piante in EcoFABs
- Germinazione e sterilizzazione di seme
Nota: La sterilizzazione di seme e tutte le seguenti operazioni con i semenzali devono essere eseguite in condizioni sterili. Il processo di sterilizzazione discusso di seguito è adatto ai semi di Arabidopsis thaliana, Avena barbata, Brachypodium distachyone Panicum virgatum. Panicum virgatum semi dovrebbero essere sospesi in 60% di acido solforico per 1 h prima del processo di sterilizzazione. Si consiglia di preparare 1-2 semi per ogni dispositivo EcoFAB, considerando il tasso di germinazione e l'omogeneità di germinazione.- Immergere i semi in etanolo al 70% per 2 min.
- Eliminare l'etanolo con una pipetta e sciacquare i semi con acqua sterile tre volte.
- Lasciare i semi nella soluzione di candeggina al 10% per 5 min.
- Rimuovere la soluzione di candeggina e lavare accuratamente i semi con acqua sterile tre volte.
- Aggiungere acqua sterile ai semi e incubare la provetta per microcentrifuga in un frigorifero a 4 ° C per 7 giorni.
- Uniformemente distribuite i semi su supporto di Murashige e Skoog (MS) 0,5 con 0,6% phytagel e sigillare le piastre con nastro microforato.
- Coltivare le piante per una lunghezza di radice di circa 5 mm per trasferimento a EcoFABs (Figura 6A). Per gli esperimenti presentati qui, applicare un regime di luce/8 illuminazione scuro h 16 h in una camera di crescita di 22 ° C ed incubare le piante 2-7 gg prima del trasferimento a EcoFAB (2 giorni per Avena barbata e Brachypodium distachyon, 7 giorni per Arabidopsis thaliana e Panicum virgatum).
- Trasferimento di piantine in EcoFABs con mezzo liquido (Figura 6)
- Utilizzando una siringa sterile o micropipetta, lavare la camera di root di un dispositivo di EcoFAB con acqua sterile per tre volte e quindi riempire la camera di radice con il mezzo di crescita di interesse, ad esempio 0,5 MS Media (Figura 6B, passo 5.1.6).
- Inserire con cura un singolo semenzale nel serbatoio dell'impianto del dispositivo EcoFAB (Figura 6).
Nota: La radice deve essere completamente immersa all'interno della camera principale, con le riprese spuntava il serbatoio. - Aggiungere 3 mL di acqua sterile nel contenitore, evitando il dispositivo EcoFAB. Ciò aumenterà l'umidità e ridurre l'evaporazione del fluido dalla camera principale.
- Chiudere il contenitore e sigillare il coperchio con nastro microforato (Figura 6).
- Inserire la EcoFAB in un incubatore di pianta, o utilizzare il sistema di illuminazione EcoFAB in un ambiente a temperatura controllata adatto per la crescita della pianta del rispettiva (passaggio 4). Per questo studio, è necessario impostare la camera a 24 ° C.
- Controllare periodicamente la EcoFAB per riempire la media di crescita all'interno della camera di crescita di radice e aggiungere acqua al contenitore. Eseguire tutti i passaggi in condizioni sterili.
Nota: Per le prime fasi di crescita di pianta, riempimento della camera di crescita di radice è necessaria ogni 5-7 giorni. Per le successive fasi di crescita, una ricarica è necessaria ogni 2 o 3 giorni. Se lo si desidera, utilizzare una siringa o una pipetta per raccogliere soluzione essudato radice dalle camere di crescita di radice in una microcentrifuga e memorizzarlo in un congelatore a-80 ° C; Inoltre, la morfologia della radice con un gel imager o microscopio di immagine.
- Trasferimento di piantine in EcoFABs con substrati solidi
- Utilizzare gli alloggiamenti di radice fabbricati con una miscela di 5:1 di elastomero a base di agente indurente se utilizzando un set di pinze personalizzate per fissarlo a un vetrino da microscopio (Figura 3 K, Figura 4); o scegliere che un livello PDMS fatta di 30: 1 base per curare la miscela di agente se aderendo strati PDMS alle diapositive direttamente (come descritto al punto 2.2).
- Sterilizzare gli alloggiamenti di EcoFAB, come descritto nel passaggio 3.
- Con attenzione aggiungere terreno sterilizzato/sabbia nella camera principale, capovolgere lo strato PDMS e aggiungere il substrato per la camera di root. Evitare qualsiasi caduta del particolato sulla zona che sarà a contatto con il vetrino da microscopio, dal momento che questo ridurrà adesione.
- Porre il vetrino del microscopio sopra lo strato di PDMS e premere fermamente tutti i bordi. Capovolgere con attenzione il dispositivo EcoFAB affinché nessun terreno/sabbia cade il serbatoio dell'apertura.
Nota: Per i dispositivi EcoFAB costituiti da un 5:1 base di miscela di agente di polimerizzazione, utilizzare una fascetta personalizzata per garantire la tenuta. - Flusso di liquido o acqua attraverso il canale di ingresso o l'uscita del dispositivo EcoFAB e trasferire un semenzale nel suo serbatoio di impianto, come descritto al punto 3.3.
- Aggiunta di microbi in EcoFABs
- Trasferire una colonia microbica in una provetta di incubazione con 8 mL di libbra di brodo e crescere al OD 0,5 (circa 12 h).
- Trasferire la soluzione di coltura in una provetta da centrifuga da 15 mL e centrifugare e a temperatura ambiente per 5 min a 3000 x g per agglomerare i microbi.
- Rimuovere il surnatante e aggiungere 8 mL di mezzo di sviluppo di pianta utilizzata nella destinazione EcoFAB. Sospendere il pellet di microbi e centrifugare la provetta a temperatura ambiente per 5 min a 3000 x g.
- Ripetere il punto 5.4.3. due volte per rimuovere completamente eventuali tracce di nutrienti LB.
- Aggiungere mezzo di sviluppo di pianta al pellet di microbo lavato fino a quando la sua densità ottica è circa 0,5 a 600 nm.
- Aggiungere 20 µ l della soluzione microbo nella camera di radice attraverso la presa di EcoFAB. I ceppi utilizzati nella presente pubblicazione ha viaggiato per piantare radici all'interno di 2-3 giorni e ha iniziato colonizzatrici superfici radicolari.
- Per progettato a chemiluminescenza, assicurarsi di includere l'induttore (1 mM IPTG) nel mezzo di crescita della pianta di indurre l'espressione di luciferase.
6. metabolita profilatura degli essudati da EcoFABs
- Preparazione del campione per LC/MS basato su analisi metabolomica
- Mettere le provette microcentrifuga con essudati raccolti da EcoFABs in un liofilizzatori e accendere i liofilizzatori per rimuovere tutta l'acqua dai tubi.
- Aggiungere 300 µ l di metanolo LC-MS in ogni provetta e Sonicare per 30 min.
Attenzione: Indossare PPE quando si lavora con metanolo. - Posizionare i tubi in una centrifuga e li Centrifugare a 3000 x g per 5 min.
- Trasferire il surnatante soluzioni in nuove provette per microcentrifuga e far evaporare il metanolo in un concentratore a vuoto.
- Aggiungere 150 µ l di metanolo con standard interni di 1 mM LC-MS in ogni provetta e incubare le provette in un frigorifero a 4 ° C per 12 h.
- Centrifugare le provette a 3000 x g per 5 min e trasferire il surnatante in 0,22 µm filtro tubi.
- Centrifugare le provette di filtro e trasferire le soluzioni filtrate in fiale di LC/MS di 2,0 mL con 200 µ l di inserti.
- Posizionare le fiale all'interno di un rack di LC/MS e caricare il rack all'interno l'autocampionatore LC/MS.
- Analisi dei dati
- Ottenere un accesso del metabolita Atlas e personalizzati Python script26 o utilizzare altri software di analisi dati.
- Identificare i metaboliti basati su m /z valori, tempo di ritenzione e modelli di frammentazione composto utilizzando una libreria di campioni di metabolita. 27
7. massa spettroscopiche Imaging delle radici delle piante in EcoFABs (Figura 7)
Nota: Dispositivi EcoFAB costituiti da un elastomero di 5:1 base di miscela di agente di polimerizzazione con morsetti personalizzati (figura 7A) sono utilizzati per radice timbratura sul nanostruttura-iniziatore spettrometria di massa (NIMS) chip,28,29,30 poiché strati PDMS possono essere inversamente legati alle superfici di NIMS chip.
- Sterilizzare una superficie del chip NIMS con luce UV per 1 h.
- Scegliere un EcoFAB con una pianta che cresce dall'incubatrice e posizionarlo in una cappa sterile.
- Aprire il contenitore di EcoFAB e rimuovere la piastra superiore del morsetto.
- Sollevare lo strato di PDMS insieme all'impianto all'interno e fissare con attenzione lo strato PDMS con la pianta su un chip di NIMS (figura 7BD, E).
Nota: Una volta che la radice tocca la superficie del chip NIMS, non dovrebbe essere spostato. Questo impedisce di "spalmare" dei metaboliti radice. - Premere delicatamente verso il basso sulle radici attraverso lo strato PDMS finché le radici completamente contatto con la superficie di NIMS. Lasciare le radici sulla superficie NIMS per 20 min.
- Sollevare e rimuovere lo strato PDMS compresi gli impianti dal chip NIMS, ancora evitando la radice in movimento su tutta la superficie di NIMS. Restituire la pianta al morsetto, se lo si desidera.
- Collegare il chip NIMS su un piatto personalizzato di MALDI e caricare la piastra in uno spettrometro MALDI per massa imaging (Figura 7).
- OpenMSI programma consente di generare l'immagine di NIMS di radice metaboliti (Figura 7-G)31.
Risultati
Ogni sistema EcoFAB include un dispositivo di EcoFAB e una pianta di dimensioni contenitore di plastica trasparente. Un dispositivo di EcoFAB ha un serbatoio di impianto, una camera di crescita di radice, un'insenatura di flusso di 1,6 mm e una presa di 1.6 mm per dispositivo EcoFAB standard (Figura 2D & H di figura 3) o una presa di 10 mm per wide-Saldi EcoFAB dispositivo (Figura 2F & Figura 3I ). La pianta è stata progettata a forma trapezoidale che ha un'apertura superiore di 6 mm e l'apertura inferiore di 3 mm, e questa struttura riduce la probabilità di perdita di flusso durante l'iniezione di liquido e garantisce anche abbastanza spazio per la crescita delle piante. La camera di crescita di radice adotta una forma ovale con 2 mm di profondità per adattarsi apparato radicale delle piante modello molti, come mostrato in Figura 2 ed E. Canali di ingresso e di uscita di un dispositivo di EcoFAB standard possono essere collegati con tubi in PTFE così soluzioni nutritive possono fluire nella camera di crescita di radice senza aprire il contenitore EcoFAB. Il dispositivo EcoFAB wide-Saldi notevolmente riduce la resistenza al flusso della presa e preferibilmente viene utilizzato quando la coltivazione di piante con sistemi della radice spessi o essudati radicali periodicamente raccolta dopo complessi sistemi della radice sono derivati dalle piante.
Gli stampi di colata per la realizzazione di strati PDMS dei dispositivi EcoFAB vengono creati in un software di progettazione e quindi 3D stampato in rigida fotopolimeri opaco, come mostrato nella Figura 2 e Figura 3. Piante all'interno di EcoFABs possono essere direttamente osservate con un microscopio utilizzando una distanza di lavoro lungo, assicurando che la sterile crescere ambiente (Figura 8A, File supplementari 1). EcoFAB dispositivi con piante possono anche montare su un palcoscenico di microscopio ad alta risoluzione, che permette l'imaging a risoluzione più alta delle interazioni piante-microrganismi (Figura 8B, File supplementari 2). Sterilità non è mantenuto in questo ambiente, e imaging ad alta risoluzione solo è quindi adatto per misure di endpoint.
EcoFABs sono progettati per consentire studi sistematici di piante, come la loro morfologia, metabolismi e comunità microbiche nelle loro fasi di crescita differenti tra loro cicli di vita. Qui, EcoFABs sono stati esaminati come una piattaforma generale per studiare una varietà di specie vegetali. Figura 8 -E Visualizza 7 - giorno-vecchio di Arabidopsis thaliana, Brachypodium distachyone Panicum virgatum crescendo in EcoFABs. Tutti i tre impianti sono stati trovati per crescere bene nella EcoFAB per oltre un mese. Sia le dicotiledoni, Arabidopsis thaliana e le monocotiledoni, Brachypodium distachyon sono stati trovati a vivere fino al loro fasi di riproduzione nella EcoFABs.
Il reversibile sistema di tenuta consente l'utilizzo di substrati solidi (ad es., suolo) all'interno di EcoFABs (punto 2.2). Questo approccio di sigillamento di reversibile consente il caricamento di substrati solidi in camere di crescita di radice e consente inoltre la raccolta di campioni da regioni specifiche e di metodologie di radice. Figura 8F -H Visualizza un gruppo di 14 - giorno-vecchio Brachypodium distachyon crescendo in mezzo idroponico, come sabbia e terreno completati con mezzo idroponico (sabbia) e acqua (terreno). Lo strato sottile substrato solido in camere di crescita di radice permette alla luce di penetrare per formazione immagine microscopica degli apparati radicali.
Morfologia della radice è definito come configurazione spaziale e la distribuzione di un sistema di radice di pianta ed è stato approvato come risposta fisiologia essenziali per gli ambienti di crescita diversificata, come sostanza nutriente o acqua disponibilità32,33, 34. EcoFABs fornire un approccio conveniente di studiare la morfologia della pianta nel tempo o in condizioni diverse sostanze nutritive. Figura 9A-F Visualizza un esempio di utilizzo di EcoFABs per tenere traccia di morfologie di radice di Brachypodium distachyon nelle prime tre settimane. Una piantina di Brachypodium distachyon fu trasferita nel dispositivo EcoFAB, e la struttura principale è stata registrata da una telecamera all'interno di un imager di gel BIO-RAD. Programma di elaborazione di immagine, come immagine J, python e matlab, possa essere applicato per quantificare le modifiche delle morfologie di radice nel tempo o a diversi ambienti medi. La quantificazione dell'area radice totale nel corso di tre settimane ha mostrato un aumento graduale nella fase iniziale (< 1 settimana) seguita da un trend di crescita lineare fino alla fine di tre settimane, come illustrato nella Figura 9.
Una motivazione primaria per la costruzione del EcoFAB è quello di indagare le interazioni piante-microrganismi. Come descritto al punto 5.4, microrganismi vengono trasferiti in camere di crescita di radice di EcoFAB dispositivi attraverso il canale di ingresso. La figura 10 Mostra, un EcoFAB contenente Pseudomonas simea (precedentementefluorescens) WCS417 (WCS417), una crescita di pianta Promozione rhizobacteria con etichette a chemiluminescenza, è stato aggiunto in sistemi della radice di pianta con una concentrazione di 106 cellule per pianta. Il segnale di WCS417 è stato rilevato con un imager di gel, che ha indicato una distinta distribuzione spaziale dei microbi WCS417 in camere di crescita di radice. In entrambi MS mezzo liquido con e senza sabbia substrato solido, WCS417 microbi colonizzarono le superfici dei sistemi della radice intera con microbi concentrati intorno alle aree di punta di radice, possibilmente dovuto la produzione attiva di nutrienti di punte delle radici (Figura 10 & H)35. D'altra parte, i microbi WCS417 nel substrato di terreno accumulato intorno alla regione di serbatoio pianta invece di punte delle radici (Figura 10ho). Come i microbi sono stati aggiunti tramite il canale di sbocco, i microbi sono stati anche in grado di muoversi nel substrato del terreno, ma non si accumulano sulla radice, come osservato in mezzo liquido con o senza sabbia. Questo potrebbe indicare che il terreno è una fonte di nutrienti sufficiente, e i microbi migrarono al serbatoio impianto per condizioni di respirazione ottimale.
Per studiare il profiling del metabolita di essudati radicali pianta così come metabolita assorbimento e rilascio dalle interazioni piante-microrganismi, le soluzioni di essudato dalle camere di crescita di radice è stato raccolto attraverso varie fasi di crescita delle piante in EcoFABs. Come descritto nel passaggio 6, campioni di essudato vengono poi estratti per analisi LC-MS. Usando questo metodo, una gamma di metaboliti trasudava dalla pianta e consumato dai microbi è stata rilevata, e il profiling del metabolita correlata di essudati radicali con e senza colonizzazione di microbi è attualmente sotto inchiesta.
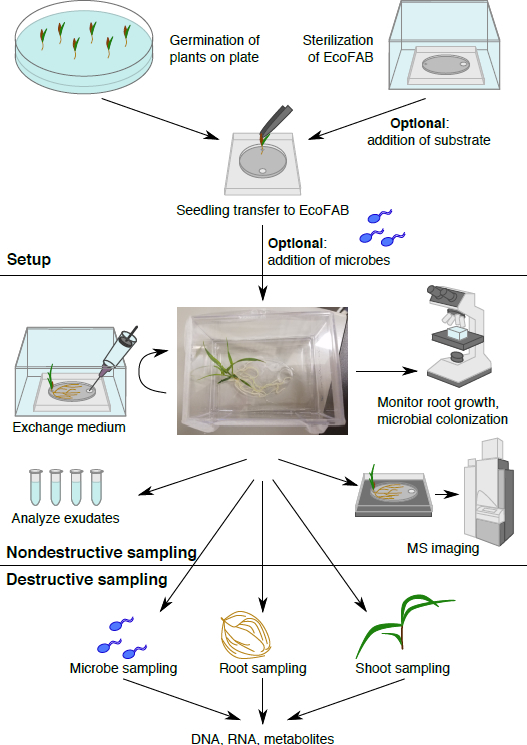
Figura 1: flusso di lavoro The EcoFAB. Piante sono germinati sulla piastra e trasferiti a EcoFAB sterilizzati, i microbi possono essere aggiunti. Campionamento non distruttivo: essudati radicali possono essere campionati ed imaged e morfologia della radice possa essere visualizzato. Campionamento distruttivo permette l'analisi di microbo, radice e sparare parametri in dettaglio.
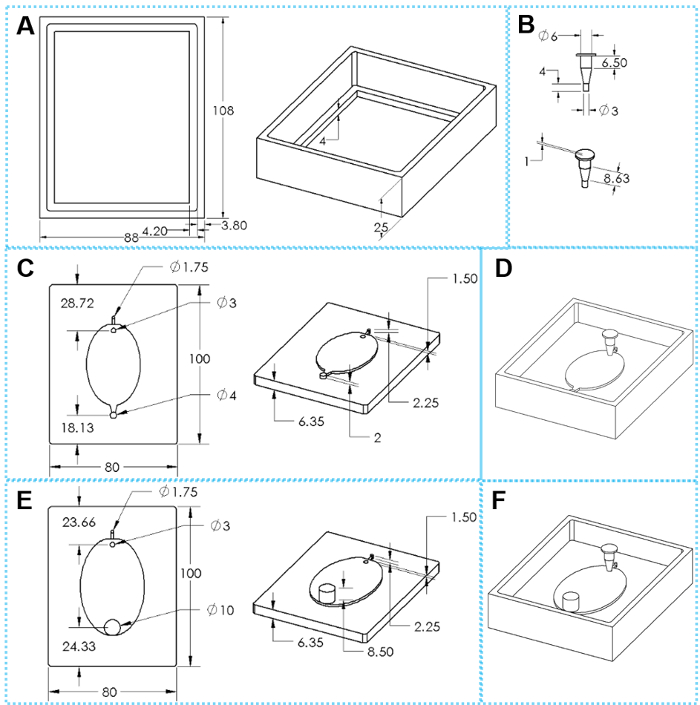
Figura 2: I componenti di 3D stampato stampi per la fabbricazione di dispositivi EcoFAB. (A) viste superiore e inclinate di un frame di colata. (B) viste superiore e inclinate di un'istruzione insert. (C) alto e inclinati visualizzazioni di una base di stampo standard. (E) viste superiore e inclinate di un wide-Saldi stampo base. (D, F) Assemblati stampi per fabbricare dispositivi EcoFAB standard e wide-presa di corrente, rispettivamente. Le dimensioni ovale sono 51 x 34 mm per la piccola EcoFAB muffa e 76 mm x 62 mm per grandi EcoFAB muffa. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: fabbricazione di dispositivi EcoFAB. (A) versare il composto di base e polimerizzazione agente di elastomero nello stampo. (B) riscaldamento dello stampo con la miscela a 85 ° C per 4 h. (C) rimozione dell'inserto dallo stampo. (D) che separa il PDMS dal telaio della colata. (E) spingendo lo stampo base fuori della cornice di colata. (F) utilizzando un coltello per separare il PDMS dallo stampo lungo i bordi. (G) peeling lo strato PDMS lentamente fuori la base dello stampo. (H) Poking fori per canali di ingresso e di uscita del livello standard PDMS. (I) che prendono in un buco per il canale di ingresso del livello PDMS wide-presa. Strato (J) il PDMS (costituito da un elastomero di 15:1 base di miscela di agente di polimerizzazione) e un vetrino da microscopio sono sciacquati e trasferiti in un plasma pulitore per l'incollaggio. (K) tramite morsetti per tenere il livello PDMS (in una base di 5:1 in elastomero per polimerizzazione miscela agente) su un vetrino da microscopio. (L) premendo lo strato PDMS (in una base di elastomero di 30: 1 a miscela agente di polimerizzazione) direttamente su un vetrino da microscopio. Clicca qui per visualizzare una versione più grande di questa figura.
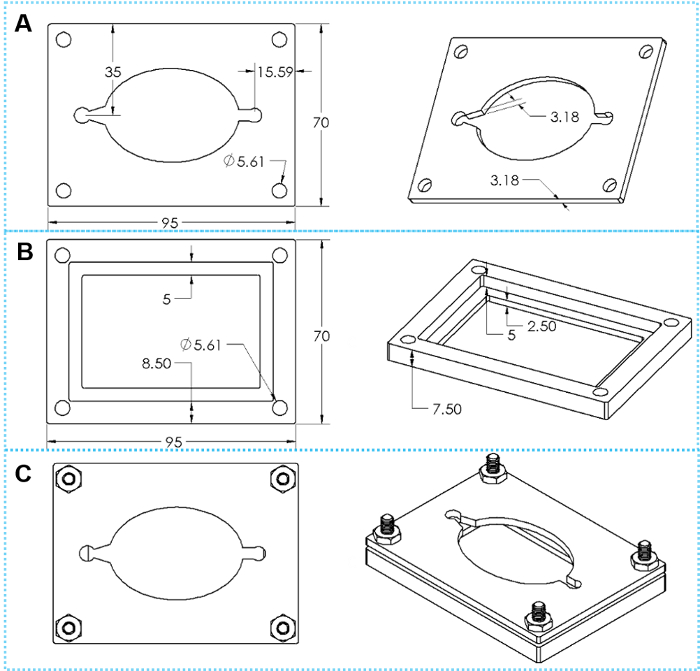
Figura 4: il design dei morsetti personalizzati. (A) viste superiore e inclinate di un top piastra di serraggio. (B) piastra di serraggio viste superiore e inclinate di un fondo. (C) superiore e vista inclinata del morsetto assemblato con quattro serie di viti a testa esagonale. Clicca qui per visualizzare una versione più grande di questa figura.
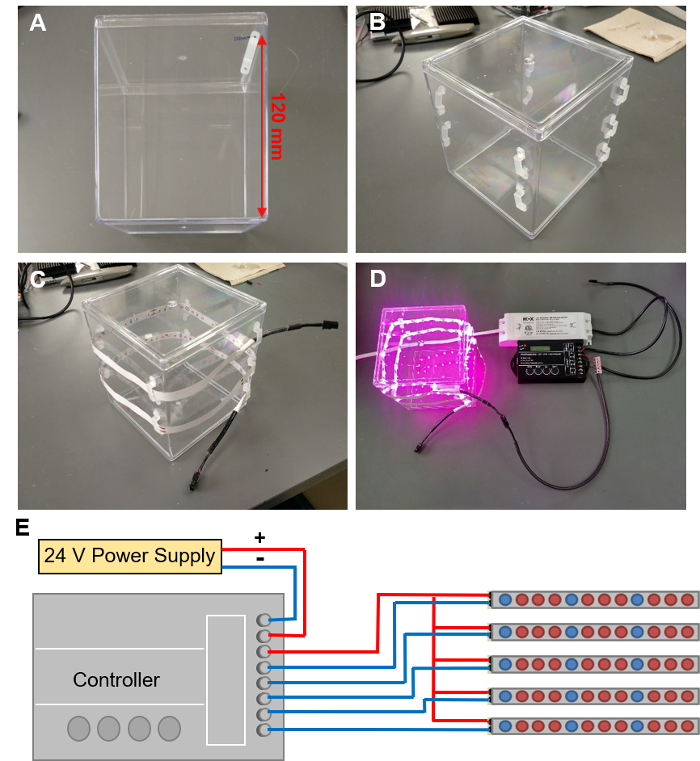
Figura 5: installazione LED coltiva le luci. (A) marcatura fuori le posizioni per 9 clip LED in una spirale attorno al contenitore EcoFAB. (B) il LED clip collegato al contenitore EcoFAB. (C) una striscia di LED attraverso queste clip di threading. (D) la striscia di LED di collegamento a un controller cablato con un'alimentazione elettrica 24V. (E) lo schema dei collegamenti dei cavi al controller. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: trasferimento di piantine in EcoFABs. (A) Brachypodium distachyon piante coltivate per 2 giorni su una zolla di 0,5 MS. (B) la principale camera di riempimento con mezzo di crescita della pianta. (C) utilizzando una pinzetta per inserire con cautela la radice nel serbatoio dell'impianto. (D) sigillare il contenitore EcoFAB con nastro microforato, dopo l'aggiunta di 3 mL di acqua alla parte inferiore del contenitore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: NIMS imaging della pianta radici in EcoFABs. (A) un Brachypodium distachyon crescendo in una sterile EcoFAB. (B) Posizionare lo strato PDMS con la pianta su un chip di NIMS per 20 min (C) usando rame nastro collegare il chip NIMS su un piatto MALDI personalizzato e caricarlo in uno spettrometro di massa MALDI. (D-G) uno 7 - giorno-vecchio e un 20 - giorno-vecchio Brachypodium distachyon pianta usata per NIMS imaging (D, E) e le corrispondenti immagini di NIMS (F, G). Gli ioni predominanti sono stati evidenziati in rosso, verde e blu. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: le applicazioni generali di EcoFABs. (A) direttamente catturare la crescita delle radici di Brachypodium distachyon in un EcoFAB con un setup di microscopio di distanza lungo lavoro. (B) direttamente osservando le interazioni di radice-microbo con un setup di microscopio ad alta definizione. Panicum virgatum (E) in mezzo idroponico di 0,5 MS, (F-H) 14 - giorno-vecchio Brachypodium distachyon coltivato in idroponica 0,5 MS (F), in sabbia (G) e terreno (H), Brachypodium distachyon (D) e (C-E) 7 - giorno-vecchio thaliana di Arabidopsis (C) substrato fornito con 0,5 MS Media e acqua, rispettivamente. Clicca qui per visualizzare una versione più grande di questa figura.
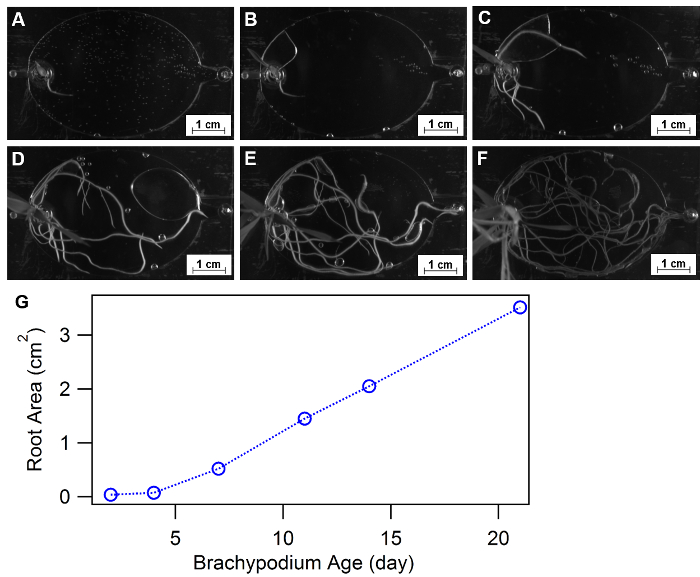
Figura 9: utilizzo di EcoFABs per studiare la morfologia della radice. (A-F) Lo sviluppo delle radici di Brachypodium distachyon crescendo in EcoFABs riempito con il mezzo di 0,5 MS durante le prime tre settimane: (A) 2 giorni, (B) 4 giorni, (C) 7 giorni, (D) 11 giorni, (E) 14 giorni, (F) 21 giorni di crescita. (G) aree di superficie media radice sono state stimate dal software ImageJ. Clicca qui per visualizzare una versione più grande di questa figura.
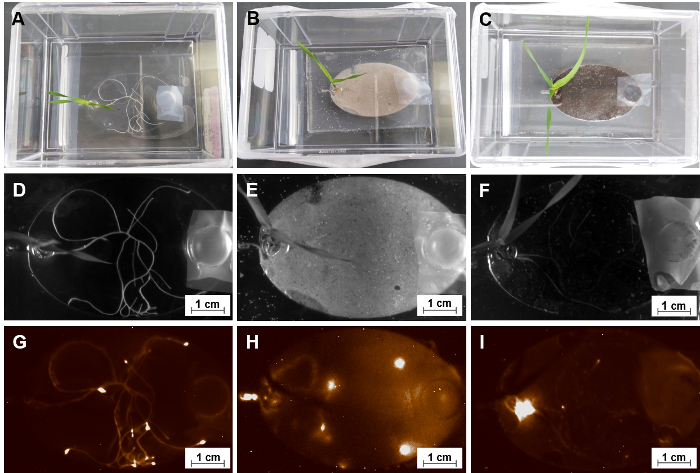
Figura 10: utilizzando EcoFABs per studiare le interazioni di radice-microbo. (A, B, C) Un gruppo di 15 - giorno-vecchio Brachypodium distachyon colonizzando con Pseudomonas fluorescens WCS417 in diverse forme di media-MS substrati di soluzione, sabbia e terreno liquidi. (D, E, F) Immagini di campo luminoso dei loro sistemi di root. (G, H, I) Le immagini corrispondenti a chemiluminescenza di questi sistemi di radice dopo co-coltura di 14 giorni. Clicca qui per visualizzare una versione più grande di questa figura.
File supplementari 1. Usando EcoFAB per catturare la crescita delle radici. Per favore clicca qui per scaricare questo file.
File supplementare 2. Usando EcoFAB per catturare interazioni radice-microbi. Per favore clicca qui per scaricare questo file.
Discussione
I protocolli segnalato qui per l'utilizzo di fabbricazione ecosistema per creare che ecofabs fornisce risorse comunitarie per impianto sistematico studi di biologia in condizioni di laboratorio altamente controllate. I progressi nella stampa 3D offrono tecnologie ampiamente accessibili per costruire e perfezionare in modo iterativo EcoFAB disegni. La camera di root presentata qui è trovata per essere adatto per imaging microscopia e mantenere la sterilità, consentendo l'aggiunta controllata di microbi per indagare le interazioni piante-microrganismi. La piattaforma EcoFAB è compatibile con varie specie di piante. È importante riconoscere gli effetti fisiologici della crescita delle piante all'interno della camera di radice stretta tale che ulteriori esperimenti saranno necessario generalizzare i risultati a piante che crescono in ambienti naturali.
L'utilizzo di camere sterili e LED coltiva la luce consente l'indagine degli effetti delle diverse condizioni di luce, tra cui lunghezza d'onda, intensità e durata, sulla crescita delle piante e dei relativi parametri fisiologici in parallelo. Legame reversibile radice camere permettono l'utilizzo di substrati solidi anche per quanto riguarda spazialmente raccogliere campioni solidi per analisi biochimica e genetica. Le applicazioni di substrati solidi, quali terreni, sabbia e perle di quarzo, offrono la possibilità di usare EcoFABs per costruire gli ecosistemi di laboratorio più ecologicamente rilevanti. Tuttavia, tutti i sistemi presentati qui uso liquido saturo (colture idroponiche) che non sono una riflessione accurata della maggior parte dei suoli e sarà importante ulteriormente perfezionare questi disegni per mantenere le sacche d'aria all'interno del suolo tale che meglio rappresentano suoli naturali.
L'uso di macchine fotografiche semplici e di microscopi è descritto allo sviluppo di morfologia di radice sistema immagine a entrambi rinfusa ai livelli cellulari. Questa idoneità per monitoraggio radice morfologia imaging e quantificazione sarà probabilmente utile per comprendere i meccanismi di regolazione dei segnali fisiologici e molecolari di pianta innescati da adattamenti genotipica di pianta a condizioni di crescita. Tuttavia, una limitazione per studiare lo sviluppo fisiologico della radice è l'attuale posizionamento orizzontale del dispositivo EcoFAB. Negli ambienti naturali, la risposta di radici gravitropic conduce ad uno sviluppo prevalentemente verticale del sistema della radice. Così, il sistema orizzontale presentato qui probabilmente differisce in alcuni fattori da un ambiente naturale, e la realizzazione di sistemi di EcoFAB con posizionamento verticale della camera principale è un obiettivo desiderabile per le future versioni di EcoFAB. Sebbene i dispositivi EcoFAB correnti vengono posizionati orizzontalmente, l'analisi dei parametri di morfologia radice in varie condizioni, o in risposta ai microbi, è possibile. Formazione immagine ad alta risoluzione può essere applicata per l'acquisizione dinamica di colonizzazione radice singoli isolati o comunità, fornendo informazioni su quale pianta parti sono colonizzati in varie condizioni sufficienti e carente dei nutrienti. Si prevede che tali studi forniranno importanti nuove intuizioni come pianta microbiomi vengono assemblati, e come queste dinamiche cambiano nel tempo, per esempio come le radici si sviluppano.
Attivare dispositivi microfluidici imaging di piante molto giovani, e di solito la quantità di metaboliti raccolti non è sufficiente per l'analisi LCMS. Sistemi basati su terreno, ad esempio rhizotrons, consentono l'imaging della morfologia della radice quando entrambi le piante si trasformano con costrutto chemiluminescente (Glo-radice) o con metodi basati su NMR33,34. Estrazioni di metabolita da questi sistemi sono molto tempo a causa del grande volume di campioni. EcoFABs sono una combinazione di entrambi: la fabbricazione è simile a dispositivi microfluidici. EcoFABs sono stati progettati per essere semplice e poco costoso da riprodurre, ma la dimensione della camera può essere regolata per crescere le piante con piccoli o grandi sistemi di radice, fino a loro fasi riproduttive. Osservazioni simultanee di cambiamenti di morfologia di radice ed essudazione di radice sono possibili. Il sistema è sterile, consentendo l'aggiunta controllata di microbi specifici.
EcoFABs sono progettati per consentire l'introduzione controllata e campionamento dei microbi e dei metaboliti. In particolare, campioni raccolti da camere di crescita di radice si trovano ad per essere sufficiente per il profiling del metabolita massa spettroscopica. L'integrazione di imaging con spettrometria di massa (ad es., NIMS tecnica presentata qui) fornisce un approccio non-distruttivo di studiare distribuzioni spaziali di metabolita degli apparati radicali. Questa tecnica sarà probabilmente esperimenti di analisi isotopica utile in futuro e mappatura microbica localizzazione di specifici metaboliti36. Mentre questo protocollo si è concentrata su singoli isolati, lo stesso design certamente può essere utilizzato per comunità più complesse. I volumi di campione e la biomassa all'interno del EcoFABs sono probabilmente più che sufficiente per un'ulteriore integrazione con tecnologie di sequenziamento del DNA, che sarà importante per caratterizzare e monitoraggio comunità microbica struttura ed espressione genica.
In conclusione, questo protocollo dettaglia la fabbricazione degli ecosistemi di laboratorio progettato per l'indagine sulle interazioni piante-microrganismi, con enfasi sui metodi semplici e accessibili che può essere facilmente implementato ed estesa dai ricercatori di tutto il mondo. Attuali sforzi sono volti a dimostrare la riproducibilità tra laboratori e l'integrazione di un sistema di controllo di temperatura tale che ogni EcoFAB sarà hanno controllato in modo indipendente luce e temperatura. Un ulteriore avanzamento del sistema sarà l'integrazione di campionamento automatico e riempimento delle camere EcoFAB radice e lo sviluppo di protocolli riproducibile per stabilire il relativo impianto microbiomi all'interno EcoFABs.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal programma laboratorio diretto di ricerca e sviluppo (LDRD) del Lawrence Berkeley National Laboratory supportati da Office of Science, del US Department of Energy sotto contratto n. DE-AC02-05CH11231 e un premio DE-SC0014079 da dipartimento US di energia Office of Science all'Università di Berkeley. Lavoro presso la fonderia molecolare è stato sostenuto sotto U.S. Dipartimento di energia contratto numero DE-AC02-05CH11231. Ringraziamo anche Suzanne M. Kosina, Katherine Louie, Benjamin P. Bowen e Benjamin J. Cole al Lawrence Berkeley National Laboratory per il loro aiuto.
Materiali
| Name | Company | Catalog Number | Comments |
| 3D printed custom mold | LBNL | STL files available here www.eco-fab.org; The EcoFABs molds described here were printed by FATHOM: http://studiofathom.com | |
| Dow sylgard 184 silicone elastomer clear kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| Air duster spray | VWR | 75780-350 | any compressed gas duster should work |
| 15 gauge blunt needle | VWR | 89166-240 | |
| 5 mL syringe with Luer-Lok Tip | VWR | BD309646 | |
| 3”x2” microscope glass slide | VWR | 48382-179 | |
| 1.75" x 2.56" x 3.56" EcoFAB box | Amazon | B005GAQ25Q | |
| 4” x 3 ¼” microscope glass slide | Ted Pella | 260231 | |
| 4.87" x 4.87" x 5.50" EcoFAB box | Amazon | B00P9QVOS2 | |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| 3D printed custom clamp | LBNL | STL files available from Trent Northen's lab | |
| Sterile hood | AirClean Systems | AC600 Series PCR Workstations | |
| PTFE syringe tubing | Sigma-Aldrich | Z117315-1EA | |
| Ethanol | VWR | 89125-172 | |
| Bleach | |||
| Murashige and Skoog (MS) Macronutrient Salt Base | Phytotechnologies Laboratories | M502 | |
| Murashige and Skoog (MS) Micronutrient Salt Base | Phytotechnologies Laboratories | M554 | |
| Soil | Hummert International | Pro-Mix PGX | |
| Phytagel | Sigma-Aldrich | 71010-52-1 | |
| Arabidopsis thaliana | Lehle Seeds | WT-24 Col-4 Columbia wild type | |
| Brachypodium distachyon | LBNL | Standard Bd-21 line | Available from John Vogel's lab |
| Panicum virgatum | The Samuel Roberts Noble Foundation | Alamo switchgrass | |
| Micropore tape | VWR | 56222-182 | |
| LC-MS grade methanol | VWR | JT9830-3 | |
| Lyophilizer | LABCONCO | FreeZone 2.5 Plus | |
| SpeedVAC concentrator | Thermo Scientific | Savant™ SPD111 SpeedVac | |
| Ultrafree-MC GV Centrifugal Filter-0.22 µm | Millipore | UFC30GV00 | |
| Liquid chromotography system | Agilent | Agilent 1290 LC system | |
| Q Exactive mass spectrometer | Thermo Scientific | Q Exactive™ Hybrid Quadrupole-Orbitrap MS | |
| NIMS chip and custom MALDI plate | LBNL | For detailed protocol see: doi:10.1038/nprot.2008.110 | |
| MALDI mass spectrometer | AB Sciex | TOF/TOF 5800 MALDI MS | |
| Nano-coated LED grow light strip | LED World Lighting | HH-SRB60F010-2835 | |
| Power supply | LED World Lighting | MD45W24VA, LV100-24N-UNV-J | |
| TC420 controller | Amazon | B0197U7R8Q | |
| Silicone LED clips | Amazon | B00N9X1GI0 | |
| Hot glue gun | Amazon | B006IY359K | |
| Female-to-bare LED connector cable | LED World Lighting | HH-F05 | |
| Female-to-male LED connector extension cable | LED World Lighting | HH-MF1 | |
| 20AWG 2-wire cable | LED World Lighting | 6102051TFT4 | |
| WAGO 221-415 Splicing Connector | LED World Lighting | 221-415 |
Riferimenti
- Morrissey, J. P., Dow, J. M., Mark, G. L., O'Gara, F. Are microbes at the root of a solution to world food production. EMBO Rep. 5 (10), 922-926 (2004).
- Farrar, K., Bryant, D., Cope-Selby, N. Understanding and engineering beneficial plant-microbe interactions: plant growth promotion in energy crops. Plant Biotechnol J. 12 (9), 1193-1206 (2014).
- Singh, J. S., Abhilash, P. C., Gupta, V. K. Agriculturally Important Microbes in Sustainable Food Production. Trends Biotechnol. 34 (10), 773-775 (2016).
- Dubey, R. K., Tripathi, V., Dubey, P. K., Singh, H. B., Abhilash, P. C. Exploring rhizospheric interactions for agricultural sustainability: the need of integrative research on multi-trophic interactions. J Clean Prod. 115, 362-365 (2016).
- Hunter, P. Plant microbiomes and sustainable agriculture. EMBO Rep. 17 (12), 1696-1699 (2016).
- van der Heijden, M. G. A., Hartmann, M. Networking in the Plant Microbiome. PLoS Biol. 14 (2), e1002378(2016).
- Vessey, J. K. Plant growth promoting rhizobacteria as biofertilizers. Plant Soil. 255 (2), 571-586 (2003).
- Yang, J., Kloepper, J. W., Ryu, C. -M. Rhizosphere bacteria help plants tolerate abiotic stress. Trends Plant Sci. 14 (1), 1-4 (2009).
- Reynolds, H. L., Packer, A., Bever, J. D., Clay, K. GRASSROOTS ECOLOGY: PLANT-MICROBE-SOIL INTERACTIONS AS DRIVERS OF PLANT COMMUNITY STRUCTURE AND DYNAMICS. Ecology. 84 (9), 2281-2291 (2003).
- Finkel, O. M., Castrillo, G., Herrera Paredes, S., Salas González, I., Dangl, J. L. Understanding and exploiting plant beneficial microbes. Curr Opin Plant Biol. 38, 155-163 (2017).
- Northen, T. R., Zhang, Z., Gao, J., Swenson, T., Yoshikuni, Y. Advancing Our Understanding of the Chemistry of Soil Microbiomes. National Academies of Sciences, Engineering, and Medicine. 2017. The Chemistry of Microbiomes: Proceedings of a Seminar Series. , The National Academies Press. Washington, DC. (2017).
- Busby, P. E., et al. Research priorities for harnessing plant microbiomes in sustainable agriculture. PLOS Biology. 15 (3), e2001793(2017).
- Sanati Nezhad, A. Microfluidic platforms for plant cells studies. Lab Chip. 14 (17), 3262-3274 (2014).
- Oburger, E., et al. Evaluation of a novel tool for sampling root exudates from soil-grown plants compared to conventional techniques. Environ Exp Bot. 87, 235-247 (2013).
- Van Der Krift, T. A. J., Berendse, F. Root life spans of four grass species from habitats differing in nutrient availability. Funct Ecol. 16 (2), 198-203 (2002).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. P Natl. Acad. Sci. USA. 114 (17), 4549-4554 (2017).
- Sanati Nezhad, A., Naghavi, M., Packirisamy, M., Bhat, R., Geitmann, A. Quantification of cellular penetrative forces using lab-on-a-chip technology and finite element modeling. P Natl. Acad. Sci. USA. 110 (20), 8093-8098 (2013).
- Jiang, H., Xu, Z., Aluru, M. R., Dong, L. Plant chip for high-throughput phenotyping of Arabidopsis. Lab Chip. 14 (7), 1281-1293 (2014).
- Parashar, A., Pandey, S. Plant-in-chip: Microfluidic system for studying root growth and pathogenic interactions in Arabidopsis. Appl. Phys. Lett. 98 (26), 263703(2011).
- Busch, W., et al. A microfluidic device and computational platform for high-throughput live imaging of gene expression. Nat Methods. 9 (11), 1101-1106 (2012).
- Grossmann, G., et al. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23 (12), 4234-4240 (2011).
- Aufrecht, J. A., Ryan, J. M., Hasim, S., Allison, D. P., Nebenführ, A., Doktycz, M. J., Retterer, S. T. Imaging the Root Hair Morphology of Arabidopsis Seedlings in a Two-layer Microfluidic Platform. J. Vis. Exp. (126), (2017).
- Garvin, D. F., et al. Development of Genetic and Genomic Research Resources for Brachypodium distachyon, a New Model System for Grass Crop Research. Crop Sci. 48 (Supplement_1), S69-S84 (2008).
- Lisensky, G. C., et al. Replication and Compression of Surface Structures with Polydimethylsiloxane Elastomer. J. Chem. Educ. 76 (4), 537(1999).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502(2010).
- Yao, Y., et al. Analysis of Metabolomics Datasets with High-Performance Computing and Metabolite Atlases. Metabolites. 5 (3), 431-442 (2015).
- Sumner, L. W., et al. Proposed minimum reporting standards for chemical analysis Chemical Analysis Working Group (CAWG) Metabolomics Standards Initiative (MSI). Metabolomics. 3 (3), 211-221 (2007).
- Gao, J., de Raad, M., Bowen, B. P., Zuckermann, R. N., Northen, T. R. Application of Black Silicon for Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 88 (3), 1625-1630 (2016).
- Gao, J., et al. Morphology-Driven Control of Metabolite Selectivity Using Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 89 (12), 6521-6526 (2017).
- Woo, H. -K., Northen, T. R., Yanes, O., Siuzdak, G. Nanostructure-initiator mass spectrometry: a protocol for preparing and applying NIMS surfaces for high-sensitivity mass analysis. Nat. Protoc. 3 (8), 1341-1349 (2008).
- Rübel, O., et al. OpenMSI: A High-Performance Web-Based Platform for Mass Spectrometry Imaging. Anal. Chem. 85 (21), 10354-10361 (2013).
- López-Bucio, J., Cruz-Ramı́rez, A., Herrera-Estrella, L. The role of nutrient availability in regulating root architecture. Curr Opin Plant Biol. 6 (3), 280-287 (2003).
- Lynch, J. P. Steep, cheap and deep: an ideotype to optimize water and N acquisition by maize root systems. Ann. Bot. 112 (2), 347-357 (2013).
- Rellán-Álvarez, R., et al. GLO-Roots: an imaging platform enabling multidimensional characterization of soil-grown root systems. eLife. 4, e07597(2015).
- Kamilova, F., Validov, S., Azarova, T., Mulders, I., Lugtenberg, B. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria. Environ. Microbiol. 7 (11), 1809-1817 (2005).
- Klitgaard, A., Nielsen, J. B., Frandsen, R. J. N., Andersen, M. R., Nielsen, K. F. Combining Stable Isotope Labeling and Molecular Networking for Biosynthetic Pathway Characterization. Anal. Chem. 87 (13), 6520-6526 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon