Method Article
Eine Volumetrische Methode zur Quantifizierung der zerebralen Vasospasmus in einem Mausmodell der Subarachnoidalblutung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Ziel dieses Artikels ist es, eine Methode zu präsentieren, die ermöglicht eine 3-dimensionale Rekonstruktion des Baumes zerebrovaskuläre bei Mäusen nach Mikro berechnet, Tomographie und Ermittlung der Volumina der gesamte Behälter-Segmente, die verwendet werden können, zu quantifizieren, zerebralen Vasospasmus in Murine Modelle der Subarachnoidalblutung.
Zusammenfassung
Subarachnoidalblutung (SAH) ist ein Untertyp von Hämorrhagischer Schlaganfall. Zerebralen Vasospasmus, der im Anschluss an die Blutung auftritt, ist ein wichtiger Faktor für Patienten-Outcome und wird daher häufig als studienendpunkt einer getroffen. Quantifizierung der zerebralen Vasospasmus ist jedoch in kleinen tierexperimentellen Studien auf SAH, eine große Herausforderung. Hier ist eine ex-Vivo -Methode vorgestellt, die Quantifizierung der Bände der gesamte Behälter Segmente, wodurch als ein objektiver Maßstab verwendet werden kann, um zu zerebralen Vasospasmus zu quantifizieren. In einem ersten Schritt wird endovaskuläre Casting des zerebralen Gefäßsystems mit einer röntgendichten Casting-Agent ausgeführt. Dann werden Cross-Sectional Bilddaten von Mikro-Computertomographie erworben. Der letzte Schritt beinhaltet 3-dimensionale Rekonstruktion der virtuellen vaskuläre Struktur, gefolgt von einem Algorithmus, Mittellinien und Volumen der ausgewählten Schiff Segmente zu berechnen. Die Methode führte zu eine hochgenaue virtuelle Rekonstruktion des Baumes zerebrovaskuläre durch einen Durchmesser-basierte Vergleich der anatomischen Proben mit ihren virtuellen Rekonstruktionen gezeigt. Verglichen mit Schiffs Durchmesser allein, markieren die Schiff-Volumes die Unterschiede zwischen vasospastische und nicht-vasospastische Schiffe in einer Reihe von SAH und Schein betrieben Mäusen gezeigt.
Einleitung
Aneurysmatic Subarachnoidalblutung (SAH), ein Untertyp von Hämorrhagischer Schlaganfall ist eine häufige Erkrankung in Neurointensive Einheiten. Neben frühen Hirnschädigung (EBI), der zerebralen Schäden, die durch das blutende Ereignis selbst besteht, ist ein weiterer wichtiger Faktor, die Bestimmung der Patienten-Outcome verzögerte zerebraler Ischämie (DCI), definiert durch klinische Verschlechterung durch zerebrale beeinträchtigt Perfusion oder Hirninfarkt nicht interventionelle oder chirurgischen Eingriffen1,2,3zugeordnet. Wichtige Mechanismen zur DCI sind Vasospasms der großen Hirngefäße auf der einen Seite; auf der anderen Seite mikrozirkulatorischen Dysfunktion mit vasospasmen mikrogefäßen mikrothrombosierung und Ischämie im Zusammenhang mit kortikalen Verbreitung Depressionen eine Rolle (rezensiert in Madonald 2014-1). Daher Diagnose des Vasospasmus der großen Hirngefäße ist von entscheidender Bedeutung in der klinischen Praxis und zeigt einen wichtigen Endpunkt in vielen klinischen und experimentellen Studien.
Trotz der Tatsache, dass die Merkmale des Vasospasmus in murinen SAH Modelle nicht direkt übertragbar auf die menschlichen Patienten, murine Modelle der SAH Verwandte Vasospasmus wurden von wachsender Bedeutung in den letzten Jahren. In diesen Modellen wird durch endovaskuläre Filament Perforation4,5,6,7,8, Durchtrennung des cisternal Schiffe9oder Injektion von Blut in den Liquor10 SAH induziert. ,11,12. Im Gegensatz zu großen Tiermodellen der SAH die traditionell gestaltet wurden, um vasospasmen13zu studieren, haben murine Modelle den großen Vorteil, dass zahlreiche Transgene Mäuse Stämme zur Verfügung stehen. Dadurch haben sie ein ausgezeichnetes Werkzeug für die Erforschung der molekularer Mechanismen zu vasospasmen und DCI. Bestimmung der zerebralen Vasospasmus bei Mäusen ist jedoch schwierig. Und zwar deshalb, weil im Gegensatz zu großen Tiermodelle in denen Vasospasmus mit klinischen und bildgebenden Verfahren untersucht werden kann, in Vivo imaging um zu analysieren, zerebralen Vasospasmus bei Mäusen noch nicht verfügbar ist. Vasospasmus ist daher häufig bestimmt, mit beiden histologischen Abschnitte10,11 oder mikroskopisch nach Gießen der Hirngefäße7,9,12. Jedoch haben diese Techniken den Nachteil dieses Schiffes werden Durchmesser an definierten Punkten nur untersucht.
Basierend auf einer früheren Studie7, stellt dieses Manuskript eine Methode für Objektive und reproduzierbare Analyse der Vasospasmus in einem Mausmodell SAH. Die Methode ist basiert auf Perfusion und Casting der Hirngefäße, Ex Vivo Mikro-CT Scans, digitale Rekonstruktion des Schiffes Baumes, und die anschließende Auswertung der Bände der gesamten Hirngefäße.
Protokoll
Der Tierversuche wurde vom zuständigen Tierpflege-Ausschuss (Landesuntersuchungsamt Rheinland-Pfalz) genehmigt und durchgeführt in Übereinstimmung mit dem deutschen Tierschutzgesetz (TierSchG). Alle geltende internationale, nationale und institutionellen Richtlinien für die Pflege und Verwendung von Tieren folgten.
In dieser Studie wurden männliche C57BL6 Mäuse (Alter 10-12 Wochen) verwendet. In Kürze wurde Subarachnoidalblutung durch endovaskuläre Filament Perforation unter Narkose mit Isofluran induziert. Die linke äußere Halsschlagader wurde chirurgisch vorbereitet. Dann wurde ein Faden in die äußere Halsschlagader eingefügt und erweiterte intracranially über der inneren Halsschlagader, die an der Carotis T, induzieren eine Subarachnoidalblutung perforiert wurde. Ein Anstieg des intrakraniellen Druck erfolgte als Indikator für erfolgreiche endovaskuläre Perforation. Ein detailliertes Protokoll eines endovaskulären Filament Perforation Modells der SAH bei Mäusen wurde veröffentlicht von anderen8,14.
(1) Perfusion und endovaskuläre Casting
- In dieser Studie erfolgte Perfusion 72 Stunden nach Induktion der SAH. Induzieren Sie Betäubung durch die intraperitoneale Injektion von 5 µg/g Körper Gewicht (bw) Midazolam, 30 ng/g bw Fentanyl und 0,5 µg/g bw Medetomidin. Weiter erst nach ein ausreichenden Anästhesie erreicht ist, die durch das Fehlen von Reaktionen auf Schmerzreize bestätigt wird.
- Öffnen Sie den Brustkorb, Punktion des linken Ventrikels mit einer Kanüle 21G, öffnen Sie den rechten Vorhof und Klemmen Sie die absteigende Aorta wie beschrieben an anderer Stelle15.
- Durchführen einer Transcardiac Perfusion mit den folgenden Lösungen: (i) Dulbecco Phosphat gepufferte Kochsalzlösung mit MgCl2 und CaCl2 bei pH 7.4 mit 1 g/L Glukose und (Ii) 4 % Paraformaldehyd Lösung.
- Beginnen Sie die Durchblutung mit Lösung (i) für 2 Minuten und fahren Sie mit Lösung (Ii) für 4 Minuten.
- Ziehen Sie die Lösungen bei einer Temperatur von 37 ° C und mit einer druckgesteuerten Pumpe mit variabler Perfusion um zu durchspülen mit einem konstanten Druck von 70 MmHg, die gefunden wurde, die optimale Perfusionsdruck, Vasospasmus in Mäusen16zu analysieren sein. Vermeiden Sie einen Druckverlust beim Wechsel von Lösung (i) zur Lösung (Ii).
- Nach Perfusion mit Lösungen (i) und (Ii), weiter Perfusion für 20 Minuten bei Raumtemperatur mit röntgendichten Casting-Agent (siehe Tabelle der Materialien) mit einer Konstanten Rate von 0,2 ml/min.
- Für die Heilung von röntgendichten Gussmaterial bei 4 ° C über Nacht zu ermöglichen. Entfernen Sie dann das Gehirn aus dem Schädel wie zuvor beschrieben17, die Probe auf 4 % PFA Lösung übertragen und bis zur Mikro-CT-Scan die Probe bei 4 ° C lagern.
2. Mikro-Computertomographie
- Platzieren Sie das Gehirn in der Mitte ein Kunststoffrohr mit einer stumpfen anatomische Pinzette. Wählen Sie einen Schlauch mit einem etwas größeren Durchmesser als die Probe um sicherzustellen, dass das Objekt sich nicht während der Bildaufnahme bewegt. Verwenden Sie Gaze um den Schlauch zu schließen.
- Legen Sie das Kunststoffrohr auf der Mikro-stepping Motor auf die Computer-navigierte-Steuerung (CNC) Positioniersystem in der Röntgen-Kabine, in der das Objekt um seine horizontale Achse gedreht wird.
- Richten Sie die Probe in das Sichtfeld unter Röntgen Röntgen. Um die maximale Vergrößerung zu erreichen, platzieren Sie das Objekt so nah wie möglich an die Röntgenquelle und maximieren Sie den Abstand zum Detektor so weit wie möglich.
- Ein Schritt-and-Shoot-Bild-Übernahme-Protokoll mit den folgenden Scan-Parameter verwenden: Belichtungszeit auf 1 gesetzt s für jede Projektion zur Optimierung des Signal-Rausch-Verhältnis (SNR), Rohr Spannung 80 kV (aktuelle 38 µA), 360°-Drehung wiederum 1.000 Projektionen.
- Für den Wiederaufbau von RAW-Dateien verwenden einen gefilterte Rückprojektion Algorithmus anwenden des Filters Shepp-Logan mit einer Matrix von 1024 x 1024 x 1024 Voxel mit Wiederaufbau-Software (siehe Tabelle der Materialien). Zur weiteren Analyse der daraus resultierenden DICOM-Daten in 3D Visualisierungs-Software importieren (siehe Tabelle der Materialien).
(3) 3-dimensionale Rekonstruktion der intrakraniellen vaskulären Baum und Bestimmung des Schiffes Bände
Hinweis: Hintergrundinformationen zu den Funktionen der Visualisierungssoftware finden Sie mit der Funktion helfen.
- Visualisierungs-Software mit der Funktion Importimportieren Sie Dicom-Daten.
- Visualisieren Sie die gefäßbaums mit der Funktion Volren. Wählen Sie die Visualisierung Schwelle, damit die großen Hirnarterien in scharfen Konturen dargestellt werden. Es ist wichtig, die gleiche Visualisierung Schwelle für alle Datensätze aus der experimentellen Serie verwenden.
- Virtuell sezieren der basalen Hirnarterien (Kreis von Willis) mit der Funktion VolumeEdit durch die umgebenden Gefässe mit dem Cursor. Dann sezieren Sie virtuell das Schiff Segment analysiert werden. Deshalb drehen Sie die 3-dimensionale Modell der vaskuläre Struktur um genau alle kleine Äste von der Hauptschlagader zu trennen. Es ist wichtig für die weitere Analyse, alle Schiffe mit Ausnahme der Schiff-Segment zu analysierenden zu löschen.
- Wendet die Funktion Autoskeleton mit Grenzwert zur Visualisierung Schwelle, die erzeugt ein Center-Line -Grundlage SpatialGraph.
- Wenden Sie dann die Funktion SpatialGraphToLineSet zum Erstellen einer Linie Set. Teilen Sie die Linie in seine einzelnen Untersegmente manuell die einzelnen Untersegmente mit dem Cursor auswählen und klicken Sie auf "Split". Dieser Schritt ist entscheidend, um das Volumen der einzelnen Untersegmente zu berechnen.
- Verwenden Sie die Funktion LineSetToSpatialGraph , um wieder ein räumliches Diagramm zu erstellen.
- Verwenden Sie die Funktion SpatialGraphStatistics , Länge, Volumen und Durchmesser von jedem Teilsegment bestimmen. Für farbcodierte Darstellung repräsentiert den Kurs des Schiffes Durchmessers, verwenden Sie die Funktion SpatialGraphView. Legen Sie Segment Färbung in "Dicke", die mit dem Schiff Durchmesser korreliert. Es ist wichtig, die gleichen Farb-Map für alle Datensätze aus der experimentellen Serie wählen.
- Fügen Sie die Längen der Untersegmente zu bestimmen, welche Untersegmente sind in der weiteren Analyse aufgenommen werden. In der vorliegenden Studie ausgewertet wir ein Schiff-Segment, bestehend aus 1 mm von der inneren Halsschlagader proximal der Carotis T und 2,5 mm der mittleren zerebralen Arterie distal der Carotis T. Dann fügen Sie die Mengen um das Schiff Volumen des Segments definierten Schiffes zu ermitteln.
Ergebnisse
Virtuelle Rekonstruktion des 3-dimensionalen intrakraniellen vaskulären Baumes
Die 3-dimensional rekonstruierten intrakraniellen vaskulären Bäume zur Verfügung gestellt einer hochgenauen vaskulären Anatomie (Abbildung 1). Um die Genauigkeit zu bewerten, führten wir einen Durchmesser-basierte Vergleich zwischen Schiffs Durchmesser mikroskopisch bestimmt und von der 3-dimensionale virtuellen Rekonstruktionen an 2 anatomisch definierten Punkten (1: Links mittlere zerebrale Arterie (MCA) 1 mm distal von der Carotis T; 2: rechts MCA 1 mm distal der Carotis T). Für mikroskopische Bestimmung des Schiffs Durchmesser wurde eine hochauflösende Kamera (Infinity X-21, Deltapix) mit DeltaPix Insight Software-Version 2.0.1 auf einer Mikrometer Skala kalibriert verwendet. Für diese Auswertung wurden 10 Gehirn Proben (5 SAH, 5 Schein) analysiert. Diese wurden von einer Reihe von 12 Mäuse, 7 von denen eine SAH induziert wurde, während 5 Schein operiert (2 Tiere des Arbeitskreises SAH starb am postoperativen Tage 1 und 2, beziehungsweise). Es gab keine signifikanten Unterschiede zwischen den Durchmessern bestimmt mikroskopisch und praktisch, zeigt eine genaue virtuelle Rekonstruktion der intrakraniellen vaskulären Anatomie (mikroskopische Bestimmung vs. virtuelle Rekonstruktion, meine ± Standardfehler: Links MCA 150 ± 9 µm vs. linke MCA 150 ± 8 µm; gerade MCA 153 ± 8 µm vs.154 ± 9 µm, Abbildung 2zu sehen).
Quantifizierung der zerebralen Vasospasmus bei Mäusen mit SAH
Quantifizierung der zerebralen Vasospasmus (i) die Lautstärke eines vordefinierten repräsentative 3,5 mm Schiff Segments, bestehend aus 1 mm inneren Halsschlagader (ICA) und 2,5 mm MCA auf der linken Seite, und (Ii) das Schiff Durchmesser 2 anatomisch definierten Zeitpunkten (Links und rechts MCA) wurden im Gehirn Proben aus SAH und Schein betrieben Tiere bestimmt (n = 5). Das Schiff Volumen war signifikant niedriger in SAH im Vergleich zum Schein (36 ± 4 nL vs. 71 ± 9 nL, p < 0,05). Schiffs Durchmesser lagen in SAH im Vergleich zum Schein (MCA Links: 140 ± 11 µm vs. 160 ± 10 µm, p = 0,11; rechts MCA: 130 ± 16 µm vs. 158 ± 13 µm, p < 0,05; siehe Abbildung 3), während das Signifikanzniveau nur für Analys erreicht wurde ist die richtige MCA.

Abbildung 1. Virtuelle Rekonstruktion des intrakraniellen vaskulären Baumes. (A) zeigt eine repräsentative Gehirn Probe; (B) zeigt, dass die entsprechenden praktisch Kreislauf Baum rekonstruiert. (C) farbcodierte Visualisierung des Durchmessers der linken MCA. Bitte klicken Sie hier für eine größere Version dieser Figur.
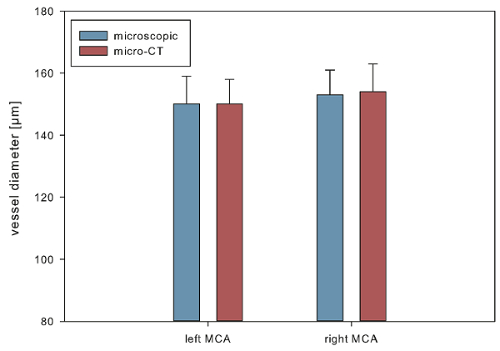
Abbildung 2 . Genauigkeit der digitalen Rekonstruktion des Gefäßsystems. Mittlere Durchmesser gemessen von 3D rekonstruierten Gehirn Proben verglichen mit denen mikroskopisch bestimmt. Daten sind als Mittelwert ± Standardfehler des Mittelwerts ausgewiesen. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 . Behälter-Volumen und Schiffs Durchmesser nach SAH. (A) Vergleich von MCA Durchmesser gemessen von 3D rekonstruierten Gefäßsystem in SAH und sham Mäuse. (B) Schiff Volumen in SAH und sham Mäuse. Daten sind als Mittelwert ± Standardfehler des Mittelwerts ausgewiesen. p < 0,05. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Murine SAH Modelle sind ein wichtiges Instrument für die Grundlagenforschung SAH. Zerebraler Vasospasmus dient häufig als Endpunkt in experimentellen Studien untersuchen die Mechanismen nach SAH9,11, DCI führen. Quantifizierung der zerebralen Vasospasmus bei Mäusen oder anderen kleinen Tiermodellen SAH ist jedoch schwierig. Im Allgemeinen wird Vasospasmus durch ex-Vivo Bestimmung des Schiffs Durchmesser an definierten anatomischen Punkten nach endovaskulären Perfusion und Casting7,9,12 oder durch Bestimmung des Umfangs quantifiziert. definierten Schiffe auf histologischen Abschnitte10,11. Diese Methoden haben jedoch einige Nachteile: Vasospasmus wird ausgewertet, nur an definierten anatomischen Punkten; Vasospasmus der benachbarten Schiff Segmente kann Bewertung entziehen. Histologische Artefakte stellen eine weitere Quelle von Fehlern. Darüber hinaus kann die Bewertung eher subjektiv, da die genaue Position, wo der Schiff Durchmesser gemessen wird, vom Prüfer bestimmt wird.
Ziel war es daher, ein Verfahren zu etablieren, die zerebralen Vasospasmus quantifiziert durch Berechnung des Volumens des Schiffes der gesamte zerebrale Behälter Segmente von Cross-Sectional imaging Daten7. Der wichtigste Vorteil der hier vorgestellten Volumetrische Methode ist das gesamte Schiff, die Segmente untersucht werden können. Damit entfällt die Notwendigkeit der Definition eines Punktes, wo die Schiffs Durchmesser gemessen wird. Ein weiterer Vorteil der Evaluierung des ganzen Schiffes Segmente ist jedoch, dass es vermutlich einen objektiveren Parameter Quantifizierung Vasospasmus als Bestimmung des Schiffs Durchmesser an definierten Punkten, wo Vasospasmus des proximalen oder distalen Schiffes entkommen kann Bewertung. Digitale Darstellung des Schiffs Durchmesser mit einem Farbcode ermöglicht eine intuitive Einschätzung des Grades der Vasospasmus. Darüber hinaus führt die volumetrische Bewertung zu größeren Differenzen zwischen vasospastische Schiffe im Vergleich zur Bewertung des Schiffs Durchmesser wie in die repräsentativen Ergebnisse gezeigt. Die virtuelle Rekonstruktion erreicht mit der hier vorgestellten Methode entspricht genau die vaskuläre Anatomie. Dies zeigt die Auswertung der repräsentativen Serie, in welchem Gefäß Durchmesser gemessen mikroskopisch und aus der digitalen Rekonstruktionen ähnelten, reproduzieren die Beobachtungen von einer früheren Studie7. Jedoch trotz seiner Vorteile sind weitere Studien erforderlich, unabhängig davon, ob die hier vorgestellte Methode besser als herkömmliche Methoden der Vasospasmus Analyse ist zu bewerten.
Eine Einschränkung der hier vorgestellten Methode ist, dass es mehr Zeit im Vergleich zur mikroskopischen Analyse von Proben, gegossene Gehirn oder histologische Analyse (Mikro-CT Scan-Zeit 90 Minuten pro Gehirn Probe, Datenverarbeitung 45 min pro Gehirn Probe) gewährt. Darüber hinaus kann die Verfügbarkeit von Mikro-CT-Scanner seine Anwendung beschränken. Die Anzahl der hier untersuchten Tiere war ausreichend, um die Machbarkeit des Protokolls beschrieben in dieser Handschrift zeigen. Jedoch wenn das Protokoll in Behandlungsstudien verwendet werden soll, anhand Tier, den Zahlen berechnet werden müssten der erwarteten Auswirkungen auf Schiff Volumen und Durchmesser. Eine weitere Einschränkung dieser und anderer Studien mit murinen SAH Modellen ist, dass vasospasmen entschlossen ex Vivo. Dies macht Längsschnittstudien unmöglich, die Ausgangswerte vor SAH Induktion und Vasospasmus zu verschiedenen Zeitpunkten zu untersuchen. Obwohl Studien, daß es belegen ist möglich, die Anatomie der großen intrakraniellen Gefäße von Mäusen in Vivo mit Magnet-Resonanz-Tomographie18, Computertomographie-Angiographie-19oder digitale Subtraktion darstellen Angiographie20, diese Methoden nach unserer Kenntnis wurden nicht noch verwendet, zerebralen Vasospasmus in murinen SAH Modelle in Vivozu analysieren. Der Hinweis ist die digitale Rekonstruktion des zerebralen Gefäßsystems mit volumetrischen Folgebewertung des zerebralen Vasospasmus hier vorgestellten nicht auf den Einsatz auf ex Vivo Mikro-CT-Daten beschränkt. Sollten hochauflösende vaskulären Cross sectional bildgebenden bei Mäusen in der Zukunft verfügbar werden, könnte es verwendet werden, um eine Volumetrische Analyse des Vasospasmus in Vivodurchzuführen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Teile dieser Studie sind Teil der Dissertation von T. Pantel, vorgelegt an der medizinischen Fakultät der Johannes Gutenberg-Universität Mainz. Die Studie wurde unterstützt durch die Friedhelm befreit-Stiftung und der Stiftung Neurochirurgische Forschung (Zuschüsse, A.N.).
Materialien
| Name | Company | Catalog Number | Comments |
| Medetomidin | Pfizer, Karlsruhe, Germany | n.a. | |
| Midazolam | Ratiopharm, Ulm, Germany | n.a. | |
| Fentanyl | Curamed, Karlsruhe, Germany | n.a. | |
| Venofix 21G | B Braun Melsungen AG, Melsungen, Germany | n.a. | 21G cannula |
| Dulbecco’s Phosphate Buffered Saline containing MgCl2 and CaCl2, pH 7.4 | Sigma-Aldrich, Hamburg, Germany | D8662 | |
| 4% paraformaldehyde solution | Sigma-Aldrich, Hamburg, Germany | 100496 | |
| Microfil MV-122 | Flowtech Inc., Carver, MA, USA | n.a. | Radiopaque |
| Micro-CT system Y.Fox | Yxlon, Garbsen, Germany | n.a. | |
| Reconstruction Studio software version 1.2.8.1 | TeraRecon, Frankfurt am Main, Germany | n.a. | Reconstruction software |
| Amira software version 5.4.2 | FEI Visualization Sciences Group, Hillsboro, OR, USA | n.a. | Visualization software |
| PHD ultra syringe pump | Harvard Apparatus | 70-3 | Pressure controlled pump |
| anatomical forceps (blunt) | B Braun Melsungen AG, Melsungen, Germany | 160323_v | |
| Infinity X-21 | Deltapix, Maalov, Denmark | n.a. | high resolution camera |
| DeltaPix Insight software version 2.0.1 | Deltapix, Maalov, Denmark | n.a. | |
| C57BL6 mice | Charles River, Cologne, Germany |
Referenzen
- Macdonald, R. L. Delayed neurological deterioration after subarachnoid haemorrhage. Nature Reviews Neurology. 10 (1), 44-58 (2014).
- Dorsch, N. A clinical review of cerebral vasospasm and delayed ischaemia following aneurysm rupture. Acta Neurochirurgica Supplement. 110 (Pt 1), 5-6 (2011).
- Vergouwen, M. D., et al. Definition of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage as an outcome event in clinical trials and observational studies: Proposal of a multidisciplinary research group. Stroke. 41 (10), 2391-2395 (2010).
- Friedrich, B., et al. CO2 has no therapeutic effect on early microvasospasm after experimental subarachnoid hemorrhage. Journal of Cerebral Blood Flow & Metabolism. 34 (8), e1-e6 (2014).
- Friedrich, B., Muller, F., Feiler, S., Scholler, K., Plesnila, N. Experimental subarachnoid hemorrhage causes early and long-lasting microarterial constriction and microthrombosis: An in vivo microscopy study. Journal of Cerebral Blood Flow & Metabolism. 32 (3), 447-455 (2012).
- Terpolilli, N. A., et al. Nitric oxide inhalation reduces brain damage, prevents mortality, and improves neurological outcome after subarachnoid hemorrhage by resolving early pial microvasospasms. Journal of Cerebral Blood Flow & Metabolism. 36 (12), 2096-2107 (2016).
- Neulen, A., et al. A segmentation-based volumetric approach to localize and quantify cerebral vasospasm based on tomographic imaging data. PLoS One. 12 (2), e0172010 (2017).
- Schuller, K., Buhler, D., Plesnila, N. A murine model of subarachnoid hemorrhage. Journal of Visualized Experiments. (81), e50845 (2013).
- Altay, T., et al. A novel method for subarachnoid hemorrhage to induce vasospasm in mice. Journal of Neuroscience Methods. 183 (2), 136-140 (2009).
- Momin, E. N., et al. Controlled delivery of nitric oxide inhibits leukocyte migration and prevents vasospasm in haptoglobin 2-2 mice after subarachnoid hemorrhage. Neurosurgery. 65 (5), 937-945 (2009).
- Froehler, M. T., et al. Vasospasm after subarachnoid hemorrhage in haptoglobin 2-2 mice can be prevented with a glutathione peroxidase mimetic. Journal of Clinical Neurocience. 17 (9), 1169-1172 (2010).
- Lin, C. L., et al. A murine model of subarachnoid hemorrhage-induced cerebral vasospasm. Journal of Neuroscience Methods. 123 (1), 89-97 (2003).
- Marbacher, S., Fandino, J., Kitchen, N. D. Standard intracranial in vivo animal models of delayed cerebral vasospasm. British Journal of Neurosurgery. 24 (4), 415-434 (2010).
- Feiler, S., Friedrich, B., Scholler, K., Thal, S. C., Plesnila, N. Standardized induction of subarachnoid hemorrhage in mice by intracranial pressure monitoring. Journal of Neuroscience Methods. 190 (2), 164-170 (2010).
- Ghanavati, S., Yu, L. X., Lerch, J. P., Sled, J. G. A perfusion procedure for imaging of the mouse cerebral vasculature by X-ray micro-CT. Journal of Neuroscience Methods. 221, 70-77 (2014).
- Parra, A., et al. Mouse model of subarachnoid hemorrhage associated cerebral vasospasm: methodological analysis. Neurological research. 24 (5), 510-516 (2002).
- Boulay, A. C., Saubamea, B., Decleves, X., Cohen-Salmon, M. Purification of Mouse Brain Vessels. Journal of Visualized Experiments. 105 (e53208), (2015).
- Marjamaa, J., et al. Mice with a deletion in the first intron of the Col1a1 gene develop dissection and rupture of aorta in the absence of aneurysms: High-resolution magnetic resonance imaging, at 4.7 T, of the aorta and cerebral arteries. Magnetic Resonance in Medicine. 55 (3), 592-597 (2006).
- Schambach, S. J., et al. Ultrafast high-resolution in vivo volume-CTA of mice cerebral vessels. Stroke. 40 (4), 1444-1450 (2009).
- Figueiredo, G., et al. Comparison of digital subtraction angiography, micro-computed tomography angiography and magnetic resonance angiography in the assessment of the cerebrovascular system in live mice. Clinical Neuroradiology. 22 (1), 21-28 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten