Method Article
Risikogefährdete Programme zur Vermehrung von Schmetterlingen, um das Wissen um die Lebensgeschichte und effektive Ex-Situ-Konservierungstechniken zu verbessern
In diesem Artikel
Zusammenfassung
Hier stellen wir Protokolle für 1) die Laborvermehrung des bundesweit gefährdeten Miami-Blaufalters (Cyclargus thomasi bethunebakeri) und 2) zur Bewertung grundlegender lebensgeschichtliche Informationen wie unreife Entwicklungszeit und Anzahl der Larvenstadien vor. Beide Methoden können für den Einsatz mit anderen Ex-situ-Konservierungsprogrammen angepasst werden.
Zusammenfassung
Die Verbesserung der Kenntnisse über Ex-situ-Best Practices für gefährdete Schmetterlinge ist wichtig, um erfolgreiche Ergebnisse des Erhaltungs- und Verwertungsprogramms zu erzielen. Die Forschung an solchen in Gefangenschaft gehaltenen Populationen kann auch wertvolle Daten liefern, um wichtige Informationslücken über das Verhalten, die Lebensgeschichte und die Ökologie der Zieltaxa zu schließen. Wir beschreiben ein Protokoll zur Vermehrung des vom Bund bedrohten Cyclargus thomasi bethunebakeri, das als Modell für andere gefährdete Schmetterlingsex-situ-Programme verwendet werden kann, insbesondere für die in der Familie Lycaenidae. Darüber hinaus bieten wir ein einfaches und einfaches Protokoll zur Aufzeichnung verschiedener Lebensverlaufsmetriken, die für die Information von Ex-situ-Methoden nützlich und für Laborstudien anderer Lepidopterageeignet sein können.
Einleitung
Eine wachsende Liste von Studien zeigt weit verbreitete und ernste globale Rückgänge in Schmetterlingpopulationen1,2,3,4,5. Dazu gehört die überwiegende Mehrheit der gefährdeten Arten. Naturschutzprogramme, die solche Rückgänge abmildern sollen, verwenden häufig eine Mischung aus Strategien, einschließlich Bevölkerungsüberwachung, Habitatmanagement und -wiederherstellung, wissenschaftliche Forschung, Vermehrung in Gefangenschaft und Umsiedlung von Organismen6. Allein innerhalb der USA und ihrer Territorien sind insgesamt 30 Schmetterlingstaxa nach dem Endangered Species Act (ESA) als bedroht oder gefährdet aufgeführt, von denen 21 Entwürfe oder endgültige Wiederauffüllungspläne genehmigt haben. Für solche Taxa empfiehlt mehr als die Hälfte der identifizierten Verwertungsstrategien die Vermehrung in Gefangenschaft oder geben an, dass die Vermehrung in Gefangenschaft zu bewerten ist7. Der Einsatz von Ex-situ-Erhaltungsbemühungen für Schmetterlinge hat in den letzten Jahren erheblich zugenommen8,9, und hat das Potenzial, ein kritisches Instrument zur Unterstützung der Verwertungsbemühungen zu sein10. Zahlreiche Institutionen, Organisationen und Agenturen sind derzeit an Ex-situ-Bemühungen für mindestens 11 von der ESA gelistete Schmetterlingstaxa (z. B. Cyclargus thomasi bethunebakeri, Euphydryas editha quino, Euphydryas editha taylori, Heraclides aristodemus, Hesperia dacotae, Lycaeides melissa samuelis, Oarisma poweshiek, Pyrgus ruralis lagunae, und Speryeria zerene hippolyta) und mehrere andere gefährdete Taxa (z.B. Callophrys irus, Euphydryas phaeton, Speyeria idalia, Eumaeus atala)11. Trotz der Vielzahl robuster und erfolgreicher Bemühungen fehlt es nach wie vor an regelmäßiger Kommunikation zwischen Programmen und zwischen Naturschutzpraktikern, die den Austausch von Ideen, Daten, wirksamen Methoden und Ergebnissen beinhalten. Ein solcher Wissensaustausch ist von wesentlicher Bedeutung, da er dazu beiträgt, Doppelarbeit zu minimieren, bewährte Verfahren insgesamt zu verbessern und die Auswirkungen auf die Erhaltung zu verstärken. Nur wenige veröffentlichte Head-Starting-, Captive-Aufzucht-, Zucht- oder Zuchtprotokolle sind für gefährdete Schmetterlingstaxa leicht verfügbar, und solche, denen oft genügend narrative Details und/oder Illustrationen fehlen. Diese bieten oft zusammenfassende Details mit begrenzten Schritt-für-Schritt-Anleitungen und begleitenden Bildern, was die Replikation schwierig macht oder eine Anwendung auf andere Taxa schwierig macht,12,13,14,15zu beurteilen. Viele der verfügbaren Protokolle sind in irgendeiner Weise begrenzt: sie existieren nur in der grauen Literatur oder in unterschiedlichen Detailebenen, in der Erscheinungszeit oder als Bestandteile in Symposiumsverfahren, Agentur-/Funder-Berichten oder internen Handbüchern16,17,18,19,20,21,22,23,24.
Bei den meisten Erhaltungsprogrammen wird die Vermehrung in Gefangenschaft in erster Linie durchgeführt, um die Konservierungstranslokation zu unterstützen, die wieder eingeführt, verstärkt (d. h. Augmentation) und Einführung25,26umfasst. Diese Aktivitäten sollen strategisch als Bestandteil der allgemeinen Wiederherstellungsstrategie durchgeführt werden, um das Aussterben einer denkmalgeschützten Art, Unterart oder Populationen zu verhindern. Es sollte jedoch angemerkt werden, dass dies eine von mehreren anderen potenziellen Rollen ist, die solche Ex-situ-Programme erfüllen können. Dazu gehören auch die Aufrechterhaltung einer Versicherungspopulation (d. h. Widerlegung), die vorübergehende Rettung von Organismen, die Unterstützung von Erholungsforschung und/oder Ausbildung sowie die Förderung der erhaltungsbezogenen Aufklärungs- und Sensibilisierungsbemühungen27,28. Unabhängig davon, ob Ex-situ-Programme ein einzelnes definiertes Ziel oder eine Mischung aus mehreren Zielen haben, sollten Naturschutzpraktiker die Möglichkeiten zur Datenerfassung maximieren, um wichtige Informationslücken nach Möglichkeit zu schließen. Dies ist besonders wichtig, da die überwiegende Mehrheit der gefährdeten Taxa im Allgemeinen schlecht untersucht wurde, bevor die wildlebenden Populationen erheblich zurückgingen. Das daraus resultierende verbesserte Wissen über verschiedene verhaltens-, ökologische oder lebensgeschichtliche Aspekte des Fokaltaxons kann dazu beitragen, einen effektiven Artenschutz und -management voranzubringen29.
Hier beschreiben wir detailliert das Vermehrungsprotokoll, das für den vom Bund gefährdeten Blauen Schmetterling Miami (Cyclargus thomasi bethunebakeri) (Ergänzende Abbildung 1) als Teil eines größeren Erhaltungs- und Erholungsprogramms entwickelt wurde. In diesem Fall dient das Vermehrungsprogramm in Gefangenschaft drei spezifischen, identifizierten Rollen: 1) eine Versicherungspopulation, sollte die bestehende Wildpopulation verloren gehen, 2) eine Forschungspopulation, die darauf ausgelegt ist, identifizierte Wissenslücken in der ökologischen und lebensgeschichtlichen Geschichte zu füllen, die zur Unterstützung der Erholung und/oder Desastole beitragen können, und 3) um lebensfähige Organismen für die Umwandlung in Gebiete innerhalb des historischen Bereichs des Taxons zu produzieren. Das resultierende Protokoll wurde gut geprüft und bewährt, nachdem es seit über einem Jahrzehnt genutzt und verbessert wurde. Daher sind wir der Ansicht, dass die beschriebenen Techniken und Methoden ein praktikables Modell darstellen, das auf andere Ex-situ-Risiko-Schmetterlingsprogramme angewendet oder leicht angepasst werden kann, insbesondere solche, die Lycaenidae oder verwandte Taxa betreffen. Obwohl wir nicht behaupten, dass das beschriebene Protokoll anderen überlegen ist, sind wir der Meinung, dass es Möglichkeiten gibt, einige der Methoden breiter anzuwenden, um Produktivität, Pflege oder Effizienz zu steigern. Dies gilt umso mehr, als ein Großteil unserer Zucht unter Laborbedingungen in Innenräumen mit begrenztem Platz durchgeführt wird, ähnlich den Erhaltungsprogrammen mit Euphydryas editha taylori und Speryeria zerene hippolyta17,23. Zahlreiche andere Protokolle verwenden oft Topfmaterial für die Eileiter oder Larvenzucht, was manchmal zu erhöhten Komplexitäten im Zusammenhang mit Raubtierkontrolle, Umweltkontrolle (d. h. Feuchtigkeit, Temperatur), Viehüberwachung, Datenerfassung, Pflanzenschädlingsprobleme und Raum führen kann, um nur einige21,22zu nennen. Schließlich werden in dem vorgelegten Protokoll die Methoden für die Zucht in Gefangenschaft beschrieben. Viele andere risikobegefährdete Programme zur Erhaltung von Schmetterlingen beinhalten eine Kopf-Start-oder -Aufzucht in Gefangenschaft mit den repräsentativen Protokollen, die diese Unterschiede widerspiegeln. Obwohl dies oft geringfügig ist, sind wir der Meinung, dass dies dazu beiträgt, den vorhandenen Pool an verfügbaren Informationen für andere zu überprüfende Programme zu erweitern. Dies ist von entscheidender Bedeutung, da die meisten Ex-situ-Programme wegweisende Bemühungen darstellen, die Wiederherstellung seltener und oft schlecht untersuchter Taxa zu erleichtern. Verfügbare Protokolle können als hervorragender Ausgangspunkt dienen, um wertvolle Erkenntnisse zu liefern, Doppelarbeit zu reduzieren und Innovationen zu fördern. Aufgrund der "umfangreichen interspezifischen Vielfalt von Schmetterlingsverhalten, lebensgeschichtlichen Merkmalen und ökologischen Anforderungen in Verbindung mit oft deutlichen Unterschieden in Programmeinrichtungen, Budgets, Praktiker-Expertise" und anderen inhärenten Unterschieden ist die Abhängigkeit von einer einzigen Methodik, selbst für eng verwandte Taxa, oft begrenzt und ungerechtfertigt30. Flexibilität bei der Verfeinerung oder Entwicklung neuer Protokolle, die auf die Bedürfnisse bestimmter Taxa oder Programme zugeschnitten sind, ist für den Erfolg von entscheidender Bedeutung und sollte daher hervorgehoben werden. Darüber hinaus beschreiben wir Labortechniken zur Erfassung von Metriken zur Entwicklung von Organismen unter Captive-Bedingungen, einschließlich der Anzahl der Larveninsterne, der Dauer einzelner Entwicklungsstadien, der Gesamtentwicklungszeit sowie der Larven- und Pupallänge. Diese Techniken haben eine breite Anwendbarkeit für lebensgeschichtliche Studien von Lepidoptera, die verwendet werden können, um Ex-situ-Protokolle zu verfeinern oder Felddaten zu informieren.
Protokoll
1. Sicherung erfolgreicher Erwachsenen-Ehe und Paarung
- Nach erfolgreicher Eclosion können lebensfähige erwachsene Schmetterlinge in einen sicheren, begehbaren, abgeschirmten Flugkäfig in einem temperaturgeregelten Gewächshaus(Ergänzende Abbildung 2) freigelassen werden.
ANMERKUNG: Erwachsene können auf der ventralen Oberfläche der Flügel mit permanenten Tintenmarkern gekennzeichnet werden, wenn die Identifizierung bestimmter Individuen für die Trennung von genetischen Linien, den Bestandsursprung oder für die spezifische Datensammlung im Zusammenhang mit der Langlebigkeit, dem Verhalten des Organismus, gewünscht wird, Etc.- Während die genauen Käfigabmessungen variieren können, stellen Sie sicher, dass genügend Platz vorhanden ist, um ausreichend Nektar-Pflanzenmaterial aufzunehmen, das notwendig ist, um die Dichte der untergebrachten erwachsenen Schmetterlinge zu unterstützen und Platz für einen Menschen zu bieten, der frei stehen und sich umschwenken kann.
- Stellen Sie über die Temperaturregulierung hinaus sicher, dass das Gewächshaus sicher ist, damit es eine zweite Einschließungsschicht sowie Schutz vor schlechtem Wetter (z. B. Starkregen, Wind) bieten kann.
- Elevate Topf Nektar Pflanzenmaterial, so dass es nicht mehr als 30 cm Raum von der Innenseite des Käfigs zu den höchsten blühenden Blumen(Ergänzende Abbildung 2). Dies bietet einen optimalen Zugang zu den verfügbaren Nektarressourcen, bietet reichlich Erwachsene und minimiert die fremde Flugaktivität.
- Legen Sie eine Topfwirtpflanze in den Flugkäfig. Dadurch wird sichergestellt, dass auch bei Fehlen eines gepaarten Paares die daraus werdenden Eier gesammelt werden können.
- Sorgen Sie für einen gleichmäßigen Luftstrom. Dies fördert die Balztätigkeit und den Paarungserfolg. In einer Gewächshausumgebung werden Gebläse und Festluftlüfter am besten zur Verbesserung der Belüftung und Luftbewegung verwendet. Kleinere tragbare Lüftungsanlagen wie Box- oder Tischventilatoren können ebenfalls verwendet werden.
- Halten Sie die interne Gewächshaustemperatur zwischen 27 °C und 32 °C aufrecht, um eine optimale Aktivität der Erwachsenen und den Paarungserfolg zu fördern. Die Temperatur im Käfig wird mit einem rückverfolgbaren Speicherüberwachungsthermometer überwacht.
- Vernebeln Sie den abgeschirmten Flugkäfig regelmäßig (ca. einmal alle 2 h) mit Wasser mit einer Handpumpe, einem Kunststofftanksprühgerät oder einem Gartenschlauch.
- Sammeln Sie vorsichtig einzelne Paarungspaare aus dem abgeschirmten Flugkäfig mit einer 50 dram klaren Kunststoff-Snap-Cap-Fläschigkeit(Tabelle der Materialien), Platzierung ein bis zwei Paare pro Durchstechflasche, und Transport zu einem Indoor-Aufzuchtraum oder Labor(Ergänzende Abbildung 3).
2. Maximierung der Eierproduktion
- Montieren Sie die Eileiterkammer.
- Nehmen Sie eine 12 Unzen schlichte weiße Papiertasse und mit einem Snap Blade Utility Messer, machen zwei horizontale Schnitte auf jeder Seite der Tasse gegenüber zueinander. Jeder Schnitt sollte ca. 1 cm unter der Felge liegen.
- Schneiden Sie einen einzelnen Wattestäbchen in die Hälfte und legen Sie das Stangenende von jedem in die beiden horizontalen Schnitte auf jeder Seite der Papiertasse, so dass die Wattestäbchen Portion erstreckt sich etwa 2 cm in Richtung des Inneren der Tasse.
- Mit einem Schnappklinge Utility Messer, machen Sie zwei "X" Schnitte in der Unterseite der Papiertasse. Jeder diagonale Schnitt sollte ca. 1 cm lang sein.
- Nehmen Sie eine 9 Unzen Kunststofftasse und füllen Sie den Boden mit ca. 2 cm Leitungswasser.
- Legen Sie einen frischen Schnitt, ca. 15 cm lang, des TerminalLarvenwirtpflanzenwachstums in den Papierbecher, indem Sie den Stiel durch einen der "X"-Schnitte in den Boden einlegen. Drücken Sie den Stiel durch den Schnitt, so dass ca. 4-5 cm aus dem Boden herausragt.
- Legen Sie den Papierbecher mit Wirtsmaterial in den Kunststoffbecher, um sicherzustellen, dass der Pflanzenstamm in Wasser ist.
- Füllen Sie eine 1 ml Sub-Q Spritze (0,45 mm x 16 mm) mit einem aromatigen Sportgetränk und sättigen Sie beide Wattestäbchen in der Papiertasse. Diese wirken wie künstliche Blumen.
HINWEIS: Melone und Fruchtpunsch aromatisierte Sportgetränk bieten die beste Nektar-Alternative. - Sobald sich jedes Paar trennt, legen Sie 2-3 Gravid-Weibchen in die montierte Becherkonfiguration (d.h. die Eileiterkammer).
- Bedecken Sie den Becher mit einem geschnittenen quadratischen Fragment aus schwarzem Tüll (ca. 15 cm x 15 cm) und befestigen Sie ihn mit einem Gummiband um den Deckel(Zusatzabbildung 4). Schwarzer Tüll bietet die beste Sicht in die Tasse und einfache Identifizierung aller Eier, die gelegentlich auf den Tüll gelegt werden können.
- Stimulieren Sie die Aktivität des Erwachsenenfalters und die Eileiterei.
- Legen Sie jede Eileiterkammer auf eine Laborbank oder einen Tisch ca. 19 cm unter einem 21,59 cm großen Klemmlicht mit einem Aluminiumreflektor, der eine 40 W Glühbirne gehäuset(Zusatzabbildung 5).
HINWEIS: Das Glühlampenlicht liefert die Strahlungswärme, die notwendig ist, um die Aktivität und Eiposition von Erwachsenen zu stimulieren. - Legen Sie ein rückverfolgbares Speicherüberwachungsthermometer neben den Lichtern und führen Sie den Temperatursensor so aus, dass er auf einer Eileiterkammer ruht, die sich direkt unter einem Klemmlicht befindet.
HINWEIS: Der Zieltemperaturbereich liegt zwischen 27,5 °C und 29 °C. - Fügen Sie bei Bedarf zusätzliche Klemmleuchten hinzu, abhängig von der Gesamtzahl der eingesetzten Eileiterkammern.
- Klemmleuchten in einen programmierbaren 15 Amp 24 h Innensteck-mechanischen Timer mit zwei Ausgängen (programmierbar in 30 Minuten Zeitabständen) stecken.
- Stellen Sie den Timer ein, um das Klemmlicht für 30 min Intervalle einzuschalten (d. h. einen wiederholbaren Zyklus von 30 min ein, 30 min aus).
HINWEIS: Dieser Lichtzyklus hilft, die Eiproduktion zu maximieren, indem er wiederholbare Perioden der Beleuchtung bereitstellt, um die Aktivität von Schmetterlingen für Erwachsene und die Bildung mit anschließender kurzer dunkler Ruhezeit zu stimulieren. - Erfrischen Sie die Wattestäbchen in jeder Tasse mit aromatisiertem Sportgetränk über die Sub-Q-Spritze und vernebeln Sie regelmäßig mit Wasser mit einer Plastiksprühflasche etwa alle 2-3 h oder nach Bedarf.
HINWEIS: Dies bietet ausreichend künstlichen Nektar und Feuchtigkeit, damit die Schmetterlinge nach Belieben frei füttern können. Es verbessert damit sowohl die Langlebigkeit von Erwachsenen als auch die Eileiterproduktivität unter Laborbedingungen, in denen lebendes, blühendes Pflanzenmaterial nicht ohne weiteres genutzt werden kann. - Becher regelmäßig überwachen und Wirtspflanze bei Bedarf durch frische Stecklinge ersetzen.
- Wenn die Eier zu schlüpfen beginnen oder die Dichte der Eier hoch wird, bewegen Sie das Weibchen(n) zu einer neuen Tasse mit frischem Wirt und beginnen Larven Protokoll mit Neugeborenen.
- Legen Sie jede Eileiterkammer auf eine Laborbank oder einen Tisch ca. 19 cm unter einem 21,59 cm großen Klemmlicht mit einem Aluminiumreflektor, der eine 40 W Glühbirne gehäuset(Zusatzabbildung 5).
3. Larval Pflege und Wartung
- Wiederholen Sie die Schritte 2.3-2.6, um Becher für Larven zu montieren.
- Wenn die Eier zu schlüpfen beginnen, bewegen Sie wirt Pflanzenmaterial mit Eiern und neugeborenen Larven in eine neu zusammengesetzte Tasse, indem Sie den Stiel durch das zweite "X" in den Boden legen, um sicherzustellen, dass der Pflanzenstamm in Wasser ist und die Blätter den angrenzenden frischen Wirtsschnitt berühren.
- Wenn Larven jung sind (neonate-2 instar), überprüfen Larvenbecher täglich auf Frische des Wirtspflanzenmaterials und das Vorhandensein von Schimmel oder übermäßige frakturen.
HINWEIS: Die tägliche Entfernung von Wirtsmaterial wird nicht empfohlen, wenn Larven jung sind, da dies zu Einer Verletzung des Organismus aufgrund der Handhabung und/oder unnötigen Verschwendung von frischem Wirtsmaterial führen kann. - Wenn Wirtsmaterial verwelkt ist oder sich in einem ansonsten schlechten Zustand befindet, legen Sie einen weiteren Schnitt von frischem Wirtsmaterial in die Tasse, damit es vorhandenes Laub berührt und Larven auf eigene Faust zum neuen Wirt bewegen können.
- Sobald die Larven den3. Instar erreichen, ersetzen Sie die Papiertasse und fügen Sie täglich frisches Wirtsmaterial hinzu.
- Verwenden Sie einen kleinen Kamel Haar Aquarell Pinsel, um sanft die Larven aus dem alten Wirtsmaterial oder Tasse Oberfläche zu frischen Wirt Material in der neuen Tasse zu bewegen.
- Legen Sie das alte Wirtsmaterial in einen leeren rechteckigen Kunststoff-Lebensmittelbehälter.
- Wiederholen Sie die Schritte 3.5-3.7 täglich und bis alle Becher mit Larven verarbeitet sind.
- Nach Fertigstellung eine kleine Menge frisches Wirtsmaterial auf den Pflanzenabfall im Lebensmittelbehälter geben und locker einen Deckel darauf legen.
HINWEIS: Dies dient als Schutz für den Fall, dass Alle Larven bei der täglichen Verarbeitung übersehen werden, da sie auf das neue Wirtsmaterial auf dem Anlagenabfall kriechen und am nächsten Tag entfernt werden können. - Becher unter Labortemperatur zwischen 25 °C-28 °C für optimale Larvenaktivität und -entwicklung pflegen (Ergänzende Abbildung 6).
HINWEIS: Um optimale Aufzuchttemperaturen unter Innenbedingungen zu erreichen, ist es oft notwendig, Tassen unter Klemmleuchten mit Aluminiumreflektoren Gehäuse 40 W Glühbirnen zu platzieren. Die Temperaturen können dann aktiv mit einem rückverfolgbaren Speicherüberwachungsthermometer überwacht und die Lichthöhe so eingestellt werden, dass optimale Aufzuchtbedingungen erreicht werden.
4. Bau der Vergupmungskammer
- Schneiden Sie eine einzelne Face-Wellpapierrolle in gleich große 3,8 cm x 3,8 cm Quadrate.
- Legen Sie ein Quadrat in eine 2 Unze klare Kunststoff Portion Tasse.
- Legen Sie den Becher auf eine klare Plastikbecherschale(Zusatzabbildung 7).
5. Vorbereitung von Larven für die Verpfupation
- Identifizieren Sie reife Larven, die während der täglichen Kolonieverarbeitung verpupen können.
HINWEIS: Solche Larven werden eine einheitliche stumpfgrün-braun drehen, verlieren ihre Chevrons, und oft wandern aus dem Wirt. - Entfernen Sie vorsichtig jede reife Larve mit einem kleinen Kamel Haar Aquarell Pinsel oder Zange und legen Sie eine in jeder Verpupationskammer.
- Schnappen Sie den klaren Kunststoffdeckel fest an der Vergupmungskammer.
- Wiederholen Sie die Schritte 5.1-5.3, bis alle verpupesfertigen Larven in Verpupationskammern überführt wurden und bei Bedarf neue Kunststoffschalen hinzugefügt wurden(Zusatzabbildung 8).
6. Erhaltung von Welpen
- Notieren Sie für jedes Tablett mit Verpupationskammern das Datum der ersten Verpupation und alle anderen erforderlichen relevanten Informationen (z. B. genetische Linie, experimentelle Studie usw.).
- Organisieren Sie Tabletts nach Datum und Ort an einem sicheren Ort im Labor (Ergänzende Abbildung 8).
- Überwachen Sie die Schalen täglich auf die Eclosion für Erwachsene.
HINWEIS: Laborbedingungen wie Temperatur werden die Entwicklungszeit stark beeinflussen. - Vor der Erwachsenen-Eclosion (in der Regel innerhalb von 10 Tagen nach der ersten Verpupation) entfernen Sie die Deckel aus den einzelnen Verpupationskammern und legen Sie das Tablett in einen 34,29 cm x 34,29 cm x 60,96 cm zusammenklappbaren Mesh-Pop-up-Aufzuchtkäfig(Zusatzabbildung 9).
HINWEIS: Pupae, die sicher in den Rillen der Wellpappe quadratisch befestigt sind, erleichtern eine erfolgreiche Erwachsenenbildung (Zusatzabbildung 10). - Wiederholen Sie das gesamte Protokoll aus Schritt 1.1 für die nachfolgende Captive-Generierung.
7. Bewertung der Entwicklungszeit unreifer Stadien und der Anzahl der Stadien
- Legen Sie eine einzelne Larve unter ein Sezierendes Mikroskop. Verwenden Sie einen kleinen Kamel Haar Aquarell Pinsel sorgfältig zu bewegen und larare Larven zu vermeiden, Verletzungen des Organismus.
- Tauchen Sie ein einzelnes Haar des Pinsels in ungiftige leuchtende Farbe (Tisch der Materialien), und legen Sie vorsichtig einen kleinen Tropfen Farbe auf den Rücken (dorsum) der Larve. Verwenden Sie eine Farbe, die sich von der Hintergrundfarbe und Der Musterfarbe der Larve abhebt (Ergänzende Abbildung 11). Achten Sie darauf, keine Farbe auf den Kopf der Larve zu legen.
- Sobald die Farbe trocknet (ca. 30 s oder so), legen Sie jede einzelne Larve in ihre eigene 2 Unze klare Kunststoff Portion Tasse enthält etwa 1-3 kleine Blätter von frischem Terminal-Host-Material und schreiben Sie eine einzigartige Kennung auf den Becher und Deckel(ErgänzungAbbildung 12).
- Überprüfen Sie jede Larve täglich sorgfältig. Entfernen Sie die Blätter und setzen Sie sie auf eine weiße Oberfläche. Prüfen Sie Tasse, klaren Deckel, und untersuchen Sie Blätter unter einem Sezieren Mikroskop auf das Vorhandensein von Larvenexuvia (Gegossene) und /oder Kopfkapseln.
- Wenn ein Larvenexuvia gefunden wird, entfernen Sie es aus der Tasse und legen Sie es in ein Mikrozentrifugenrohr, das mit der entsprechenden Bechernummer und dem Datum gekennzeichnet ist (siehe Schritte 8.1-8.6. unten).
- Larven nach jedem Molt neu streichen und Molt-Datteln aufzeichnen.
- Messen Sie die gesamte Körperlänge (Kopf bis letztes Bauchsegment) jeder Larve täglich mit digitalen Sätteln. Nehmen Sie drei Messungen vor und erfassen Sie den Durchschnitt der drei, zusammen mit Datum und Uhrzeit. Bei frühen Insternlarven sollte bei der Messung eine Lupe oder ein Sezieren verwendet werden, um genaue Messungen zu gewährleisten.
- Larven in den entsprechenden Kunststoffportionsbecher zurückgeben.
- Fügen Sie nach Bedarf frisches Hostmaterial hinzu und entfernen Sie alle Frass und alten Host-Trümmer. Wenn Schimmel in der Tasse gefunden wird, entsorgen und verwenden Sie einen neuen Becher. Schreiben Sie die richtige eindeutige Kennzahl in den neuen Becher.
- Wiederholen Sie die Schritte 7.5-7.9, bis alle Larven ihren letzten Instar erreichen und die Vorbereitungsphase beginnen. Wenn Larven aufhören zu füttern, drehen Sie eine einheitliche stumpfgrün-braune Farbe, verlieren ihre Chevrons, und oft wandern sie vom Wirt, minimieren sie stören.
- Legen Sie ein kleines Stück Wellpappe in den Becher (siehe Schritt 4.1).
- Sobald jede Larve vollständig verpupiert ist, messen Sie ihre Gesamtlänge wie in Schritt 7.8 oben und notieren Sie das Datum der Verpupation. Dies wird der letzte Molt jedes Einzelnen sein.
- Überprüfen Sie täglich Pupae und zeichnen Sie das Datum und das Geschlecht jedes resultierenden erwachsenen Schmetterlings auf.
- Messen Sie die Flügelakkordlänge jedes Schmetterlings mit digitalen Sätteln. Schmetterlinge können zur Messung schonend mit Zangen gehalten werden. Wenn der Schmetterling zu aktiv ist, um leicht zu messen, legen Sie ihn vorübergehend für 30 s oder weniger in einen Kühlschrank und versuchen Sie es erneut.
8. Sammeln von Larvenexuvia
- Wenn ein Larvenexuvia beobachtet wird, füllen Sie ein Mikrozentrifugenrohr mit 0,2 l Glycerin. Beschriften Sie die Oberseite des Deckels und die Seite mit der Larvennummer, dem Datum des Molts und der Kopfkapsel (H.C.).
HINWEIS: Die Larven einiger Lepidopteranlarven konsumieren regelmäßig ihr Exuvia, aber die Kopfkapsel sollte bleiben. - Legen Sie die Larvenexuvia und die zugehörige Kopfkapsel in einen durchsichtigen Plastikportionsbecherdeckel und legen Sie ein paar Tropfen Ethanol hinein.
- Untersuchen Sie die Larvenexuvia unter einem Sezierendes Mikroskop, indem Sie sie in einen durchsichtigen Plastikportionsbecherdeckel legen und ein paar Tropfen Ethanol darauf legen. Wenn die Larvenkopfkapsel bereits vom Exuvia getrennt ist, legen Sie einen Tropfen Glycerin auf die Spitze der spitzen entomologischen Zange und berühren Sie sanft die Kopfkapsel zum Glycerin. Legen Sie die Kopfkapsel in das zugehörige Mikrozentrifugenrohr.
- Wenn die Kopfkapsel noch an der Larvenexuvia befestigt ist, verwenden Sie spitze Zangen und einen Insektenstift, um die Kopfkapsel von der Larvenexuvia zu trennen.
- Sobald es getrennt ist, verwenden Sie die Glycerin-Technik, um die Kopfkapsel aufzunehmen. Wenn es zu viel Ethanol gibt, können Sie ein kleines Papiertuch verwenden, um einige zu entfernen, aber achten Sie darauf, nicht versehentlich die Kopfkapsel zu entfernen.
- Legen Sie die Kopfkapsel in eine mit Glycerin gefüllte Durchstechflasche und schließen Sie den Deckel fest.
Ergebnisse
Im Rahmen von zwei separaten Erhaltungsinitiativen, die die Erholung von Cyclargus thomasi bethunebakeri von Februar 2003 bis Dezember 2010 und von November 2016 bis heute zum Ziel hatten, wurde dieses Protokoll verwendet, um einen Überschuss von 51.052 lebensfähigen Organismen erfolgreich zu produzieren. Basierend auf der einjährigen Zusammenfassung der Gesamtproduktivität der Gefangenen von Juni 2018 bis Juni 2019 wurden insgesamt 10.166 lebensfähige Organismen produziert, was 782,00 bis 118,93 Organismen pro Monat über 13 Generationen entspricht. In ähnlicher Weise betrug die durchschnittliche Gesamteierproduktion je Frau unter Laborbedingungen 114,00 bis 26,12 (n = 12)31. Die daraus resultierende beträchtliche Produktivität des Organismus zählt dieses Programm zu den größten ex situ-Bemühungen in den USA, zusammen mit denen von Euphydryas editha taylori, Speyeria zerene hippolyta und Lycaeides melissa samuelis24. Ein Teil dieser Produktivität ist auf die Tatsache zurückzuführen, dass der Schmetterling kontinuierlich brütet und eine Generation etwa alle 4-6 Wochen in Gefangenschaft produziert. Die Mehrheit der anderen ErhaltungZuchtprogramme beinhalten Taxa, die Univoltin oder Bivoltin sind. Dennoch übersteigt selbst bei Programmen mit extrem fecund taxa wie Speyeria spp. die Gesamtzahl der lebensfähigen Organismen, die jährlich für die Erhaltungstranslokation produziert werden, selten ein paar tausend32. Dementsprechend hat unsere in Gefangenschaft gehaltene Population eine gezielte Forschung und umfassende Datenerhebung zu zahlreichen wichtigen Datenlücken ermöglicht, die wichtig sind, um die besten Laborzucht- und Haltungspraktiken zu verbessern (Abbildung 1) sowie bei der Information über Rückgewinnungs- und Managemententscheidungen.
Die durchschnittliche Gesamtentwicklungszeit von der Neugeborenenlarve bis zum Erwachsenen betrug 28,63 Tage (Tabelle 1). Die Mehrheit der Larven hatte vier Molts (Abbildung 2, Abbildung 3), obwohl zwei fünf Molts hatten, und einer hatte sechs Molts. Die mittlere Gesamtlänge aller Larvensterne betrug 5,97 mm, und die Larven waren in der vierten und der vorspeiselichen Lebensphase am größten (Tabelle 1). Wenn nur Variablen mit mehr als 30 Beobachtungen enthalten, wurde die kürzeste Zeit in der ersten Instern- und Vorbereitungsphase verbracht, und die längste wurde als Pupae verbracht (Tabelle 1, Abbildung 2). Weibchen entwickelten sich in der Regel schneller in allen unreifen Stadien im Vergleich zu Männern, obwohl dies keine signifikante Wirkung war (p = 0,625). Statistische Analysen wurden mit RStudio Version 1.1.463 (R Core Team 2016)33durchgeführt. Die mittlere Flügelakkordlänge für Erwachsene betrug 12,64 mm (Tabelle 2), und es gab einen signifikanten Unterschied zwischen den Geschlechtern (p = 0,047). Der zweiseitige t-Test wurde durchgeführt, um den Flügelakkordunterschied zwischen den Geschlechtern zu bewerten. Lineares Regressionsmodell und stufenweise Regression für die durchschnittliche Länge jeder Lebensstufe zeigten, dass die Pupallänge der beste Prädiktor für die Länge des erwachsenen Flügelakkords war (Tabelle 3, Tabelle 4). Regressionsmodelle für die Entwicklungszeit zeigten, dass die Anzahl der Tage, die im zweiten und vierten Instern verbracht wurden, und die Gesamtzahl der Tage die besten Prädiktoren für die Länge des erwachsenen Flügelakkords waren, aber nur die Anzahl der Tage im vierten Instern signifikant war (Tabelle 5, Tabelle 6). Da die Variablen kontinuierlich waren, wurden zwei lineare Regressionsmodelle für die Entwicklungszeit jeder Lebensphase sowie die Länge jeder Lebensphase mit der Länge des Erwachsenenflügelakkords als abhängige Variable ausgeführt. Schrittweise Regressionen wurden auf beiden Regressionsmodellen durchgeführt, um die besten Prädiktoren der Erwachsenenflügelakkordlänge zu bestimmen.

Ergänzende Abbildung 1: Gepinnte Exemplare des erwachsenen Cyclargus thomasi bethunebackeri. (A) Erwachsener Rüde, dorsal (links), ventral (rechts). (B) Erwachsene weiblich, dorsal (links), ventral (rechts). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 2: Abgeschirmter Flugkäfig im temperaturgeregelten Gewächshaus untergebracht. (A) Das Innere zeigt topfierte adulte Nektarpflanzen und eine einzige Topflarvenwirtpflanze. (B) Metallregale helfen, Topfnektarpflanzen zu erhöhen, so dass es nicht mehr als 30 cm Raum von der Innenseite des Käfigs zu den höchsten blühenden Blumen gibt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 3: Verfahren zur Sammlung erwachsener Paare in Copula. (A) Paar des erwachsenen Cyclargus thomasi bethunebakeri im abgeschirmten Flugkäfig (weiblich, rechts und männlich, links). (B) Paarungspaare, die aus dem Flugkäfig in Schnappkappenfläschchen gesammelt und ins Labor gebracht wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 4: Verfahren zur Montage der Eileiterkammer. (A) Zwei Tassensystem mit Terminal-Host-Material und Wattestäbchen. (B) Eine 1 ml Sub-Q Spritze (0,45 mm x 16 mm) mit aromatiertem Sportgetränk, das Wattestäbchen in der Papiertasse sätt. (C) Tassen Gehäuse gravid Weibchen mit schwarzem Tüll gesichert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 5: Laboreinrichtung zur Maximierung der Eierproduktion. (A) Ovipositionskammern auf einer Laborbank unter einem Klemmlicht mit einer 40 W Glühbirne. (B) Ein rückverfolgbares Speicherüberwachungsthermometer wird neben den Lichtern platziert, wobei der Temperatursensor auf einer Eileiterkammer ruht, die sich direkt unter einem Klemmlicht befindet. (C) Eine 1 ml Sub-Q Spritze und ein kleines Becherglas mit aromatiertem Sportgetränk, das neben den Eileiterkammern platziert wird, um die regelmäßige Erfrischung der Wattestäbchen während des Tages zu erleichtern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 6: Laboreinrichtung für Larvenpflege und -wartung. (A) Zwei Bechersystem mit jeweils frischem Terminal-Wirtsmaterial und Larven. (B) Die Temperatur in den Bechern wird zwischen 25 °C-28 °C gehalten, um eine optimale Larvenaktivität und Entwicklung durch Overhead-Klemmenmitleuchtete mit 40 W Glühbirnen zu gewährleisten. (C) Zur Temperaturüberwachung wird ein rückverfolgbares Speicherüberwachungsthermometer mit dem direkt in eine Tasse platzierten Temperatursensor verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 7: Vorbereitete Verpfupluplkammern. (A) Individuelle Plastikportionsbecher auf den durchsichtigen Plastikbecherschalen untergebracht. (B) In jedem Kunststoffportionsbecher wird ein Wellpapierquadrat platziert. (C) Eine einzige reife Larve wird in jedem vorbereiteten Kunststoffportionsbecher zum Verpupten gelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 8: Vorbereitung von Larven für die Verpupation und Pupalpflege. (A) Reife Larve bereit, auf Wellpappe zu verpupen. Es ist ein einheitliches stumpfgrün-braun und hat alle Chevrons verloren. (B) Verpfupluplkammern bereit, reife Larven neben Bechern mit Fütterunglarven zu erhalten. Alle Verpupationskammern mit Deckeln Hauslarven, die sich vorbereiten, um zu verpupieren. (C) Pupationskammern mit Welpen. (D) Bänke von Vergupserkammern mit Welpen, die nach Datum geordnet und unter Laborbedingungen gewartet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 9: Labor-Emergenzkäfig. (A) Ein zusammenklappbarer Mesh-Pop-up-Aufzuchtkäfig, in dem die besetzten Verguphkammern untergebracht sind. (B) Die Deckel aller Vergupmungskammern werden entfernt, um eine erfolgreiche Erwachsenenbildung zu erleichtern. (C) Alle daraus resultierenden lebensfähigen erwachsenen Schmetterlinge werden in den abgeschirmten Flugkäfig entlassen, um eine erfolgreiche Kopulation zu gewährleisten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 10: Erwachsener männlicher Schmetterling, der erfolgreich von Derpupa auf einem Wellpappenquadrat ausschließt. (A) Erwachsene, die aus Pupa ausschließen. (B) Erwachsene vollständig aus dem Pupalgehäuse entfernt. (C) Erwachsene positioniert, um seine Flügel zu erweitern. (D) Erwachsene erweitern ihre Flügel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 11: Fünfte Instar-Larve mit ungiftiger Leuchtfarbe gekennzeichnet. (A) Ein kleiner Tropfen kontrastierender roter, ungiftiger Leuchtfarbe wird mit einem Pinsel auf den Dorsum gelegt, um die Larve erfolgreich zu markieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 12: Aufbau einrichtungsaufbau für das Studium der Lebensgeschichte. (A) Einzigartig beschriftet 2 Unze klare Kunststoff Portion Tassen. (B) In jeder Tasse wird eine einzelne Larve beschlagnahmt. (C) Alle Larven werden individuell durch alle Entwicklungsstadien vom Neugeborenen bis zum erwachsenen Schmetterling verfolgt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
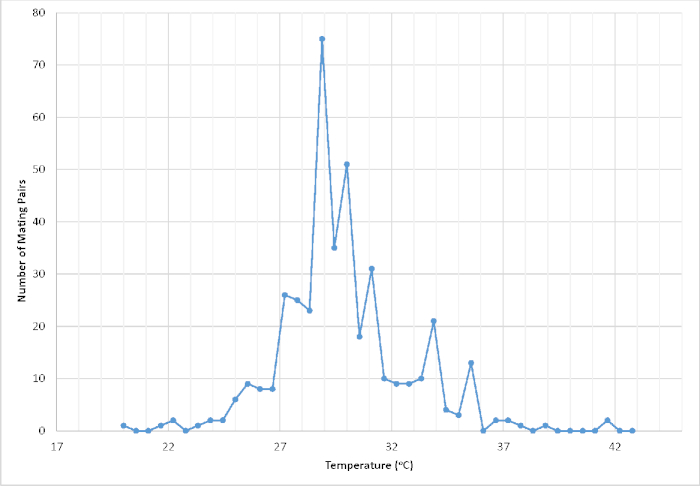
Abbildung 1: Anzahl der aufgezeichneten Paare in Copula basierend auf der Temperatur (°C) in einem begehbaren, abgeschirmten Flugkäfig, der in einem temperaturgeregelten Gewächshaus untergebracht ist. Die Temperatur wurde innerhalb der ersten 2 min eines erfolgreichen Paarungsereignisses (n = 411) aufgezeichnet. Die resultierenden Daten wurden verwendet, um die kontrollierten Umgebungsbedingungen zu verfeinern, um den Paarungserfolg und letztlich die Gesamtvermehrungsproduktivität zu maximieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Mittlere Entwicklungszeit (Anzahl der Tage) jedes unreifen Lebensstadiums. (A) Balken zeigen den Mittelwert jeder Gruppe an, und Fehlerbalken stellen die oberen und unteren Standardabweichungswerte für jede Gruppe dar. (B) Dunkelblaue Balken stellen Weibchen dar, und hellblau stehen für Männchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
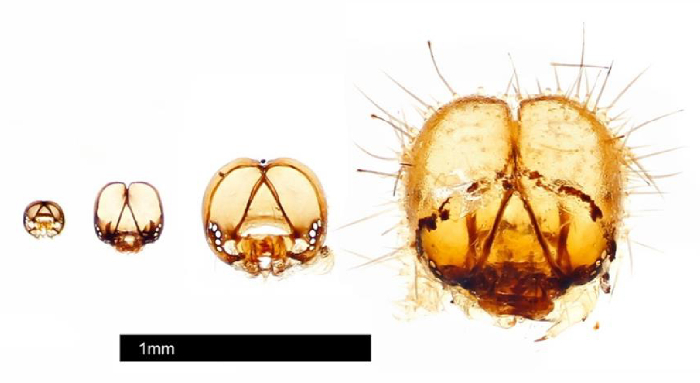
Abbildung 3: Kopfkapseln, die aus einzelnen #25 mit dem Life History-Protokoll gesammelt wurden. Kopfkapseln wurden von Johnathan Bremer mit einem Automontagesystem fotografiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Lebensphase | Mittlere Körperlänge (mm) | Std. Fehler (Länge) | Mittlere Entwicklungszeit (num. Tage) | Std. Fehler (Dev. Zeit) |
| Instar I | 1.69478261 (n=23) | 0.02152643 | 2.90625 (n=32) | 0.08229783 |
| Instar II | 2.77248958 (n=32) | 0.04302826 | 3.375 (n=32) | 0.16649857 |
| Instar III | 5.45751042 (n=32) | 0.12120829 | 3,5 (n=32) | 0.20080483 |
| Instar IV | 10.2369688 (n=32) | 0.23653991 | 3.875 (n=32) | 0.18917265 |
| Instar V | 8.7625 (n=2) | 2.6125 | 1.5 (n=2) | 0.5 |
| Instar VI | 10.2666667 (n=1) | Na | 3 (n=1) | Na |
| Pre-Pupa | 11.0858333 (n=24) | 0.23948251 | 2.9375 (n=32) | 0.21504641 |
| Puppe | 9.0316129 (n=31) | 0.12106792 | 11.6578947 (n=38) | 0.3272288 |
Tabelle 1: Mittlere Länge und Entwicklungszeit jedes Lebensabschnitts. Standardfehler für jede Variable und Stichprobengröße in Klammern.
| Lebensphase | Mittlere Flügelakkordlänge (mm) | Std. Fehler |
| Erwachsene | 12.63895 (n=38) | 0.1365516 |
| Weiblich | 12.960 (n=13) | 0.1465588 |
| Männlich | 12.472 (n=25) | 0.1863205 |
Tabelle 2: Mittlere Flügelakkordlänge für erwachsene Schmetterlinge. Beinhaltet Mittel für Frauen, Männer und alle Erwachsenen (beide Geschlechter kombiniert).
| LM Modell 1 | Std. Fehler der Schätzung | t-Wert | p-Wert |
| Abfangen | 1.9179 | 3.128 | 0.0046 ** |
| Avg. Länge zweiter instar | 0.6822 | -1.11 | 0.278 |
| Avg. Länge dritter instar | 0.2928 | 0.476 | 0.6381 |
| Avg. Länge vierter instar | 0.1373 | -0.57 | 0.5739 |
| Avg. Länge Pupae | 0.246 | 3.957 | 0.0005 *** |
| p < 0,001; ** p < 0,01; * p < 0,05. | |||
Tabelle 3: Tabelle Koeffizienten für lineares Regressionsmodell (LM-Modell 1), um die Beziehung zwischen der durchschnittlichen Länge jeder Lebensstufe (n > 30 in der Analyse enthalten) und der Akkordlänge des Erwachsenenflügels zu bewerten. Abhängig variabel: Erwachsene Flügelakkordlänge (mm).
| Koeffizienten | Std. Fehler der Schätzung | t-Wert | Pr (>|t|) |
| Abfangen | 1.7091 | 3.031 | 0.0053 ** |
| Avg. Länge Pupae | 0.1878 | 4.414 | 0.0002 *** |
Tabelle 4: Schrittweise Regression (Schritt 1). Abhängig variabel: Erwachsene Flügelakkordlänge (mm).
| LM Modell 2 | Std. Fehler der Schätzung | t-Wert | p-Wert |
| Abfangen | 1.1888 | 12.643 | 4.21e-12 *** |
| Num. Tage erste instar | 0.3486 | 0.937 | 0.3583 |
| Num. Tage zweiter instar | 0.2603 | -0.686 | 0.4993 |
| Num. Tage dritte instar | 0.2281 | 1.028 | 0.3141 |
| Num. Tage vierter instar | 0.2048 | 2.378 | 0.0257 * |
| Num. Tage vor der Pupae | 0.222 | 1.133 | 0.2686 |
| Num. Tage pupae | 0.2495 | 0.616 | 0.5435 |
| Gesamtzahl der Tage | 0.1913 | -1.454 | 0.1589 |
| p < 0,001; ** p < 0,01; * p < 0,05. | |||
Tabelle 5: Tabelle Koeffizienten für lineares Regressionsmodell (LM-Modell 2), um die Beziehung zwischen Entwicklungszeit und Alterslänge des Erwachsenenflügels zu bewerten. Abhängig variabel: Erwachsene Flügelakkordlänge (mm).
| Koeffizienten | Std. Fehler der Schätzung | t-Wert | p-Wert |
| Abfangen | 0.89304 | 16.314 | 7.86e-16 *** |
| Num. Tage zweiter instar | 0.17974 | -1.809 | 0,0811 • |
| Num. Tage vierter instar | 0.16917 | 2.075 | 0.0473 * |
| Gesamtzahl der Tage | 0.04184 | -1.787 | 0,0848 • |
| p < 0,001; ** p < 0,01; * p < 0,05; • p < 0,1 | |||
Tabelle 6: Schrittweise Regression (Stepwise 2) für die Entwicklungszeit. Abhängig variabel: Erwachsene Flügelakkordlänge (mm).
Diskussion
Hier veranschaulichen wir die Wirksamkeit dieses bewährten Ex-situ-Erhaltungszuchtprotokolls für die Massenproduktion von gefährdeten Schmetterlingen und wie es für die wissenschaftliche Forschung angepasst werden kann, um wichtige Verhaltens-, Lebens- oder ökologische Datenlücken zu beheben. Ein verbessertes Verständnis der mittleren Gesamtentwicklungszeit (Ei bis Erwachsene), die mittlere Dauer in jeder Lebensphase und die optimale Temperatur für die Paarung wurden beispielsweise verwendet, um das Protokoll zu verfeinern und den Gesamterfolg des Programms zu verbessern. Die überwiegende Mehrheit der bestehenden Protokolle beschreibt nur methoden der Haltung von Organismen und behandelt nicht die Datenerhebung, die wissenschaftliche Forschung oder die Verwendung solcher Ergebnisse, um Ex-situ-Methoden zu informieren und potenziell anzupassen.
Dieses Protokoll erfordert die tägliche Haltung des Organismus. Die Gesundheit und Produktivität des Organismus wird durch saubere Aufzuchtbedingungen, mangelnde Überbelegung des Organismus und die Verfügbarkeit von hochwertigem Larvenwirtpflanzenmaterial maximiert. Zum größten Teil verwenden wir Einweg-Aufzuchtzubehör und -behälter (z. B. Papier- und Plastikbecher) und ersetzen diese in der Regel regelmäßig, oft täglich, und verwenden das Material nie wieder. Dies ist sowohl kostengünstig als auch minimiert den Bedarf an arbeitsintensiverer Materialhygiene. Häufig verwendete Werkzeuge wie entomologische Zangen, Aquarellpinsel und kleine Pop-up-Flugkäfige sowie alle Aufzuchtflächen wie Tischplatten und Labortischplatten werden regelmäßig mit einer Bleichlösung von 5 % desinfiziert. Der genaue Zeitplan der Abwasserentsorgung hängt stark von der Häufigkeit der Nutzung, der Phänomenologie des Organismus und anderen Variablen ab und sollte auf die spezifischen Bedürfnisse jedes Ex-situ-Programms zugeschnitten werden. Darüber hinaus stellen wir fest, dass weißes Metzgerpapier nützlich ist, um alle Aufzuchtflächen abzudecken. Es bietet ein kostengünstiges, leicht einsetzbares sauberes Substrat, und die weiße Hintergrundfarbe erleichtert die Sichtung von streunenden Organismen. Für die tägliche Haltung sollten alle Labormitarbeiter immer Einweg-Labor-Untersuchungshandschuhe tragen, um Die Kontamination zu minimieren und das Personal vor möglichen Hautreizungen durch die Handhabung von Pflanzen oder Organismen zu schützen. Dies ist besonders wichtig, wenn Laborpersonal Haustiere hat, die topische Flohbehandlungen benötigen. Schon eine geringe Menge an Wirkstoffrückständen kann für in Gefangenschaft gehaltene Tiere gefährlich sein.
Darüber hinaus sollte darauf geachtet werden, die Überbelegung des Organismus zu minimieren. Eine Überbelegung von Larven kann schnell zu einer verminderten Gesundheit des Organismus und sogar zu Kannibalismus in bestimmten Taxa, insbesondere Lycaenidae, führen. Regelmäßiglarven zu trennen, um die Anzahl in Aufzuchtbehältern zu reduzieren und/oder sogar einzelne Larven zu isolieren, wie im lebensgeschichtlichen Teil des Protokolls beschrieben, kann notwendig sein. Die idealen Zahlen pro Container können je nach Taxon und verschiedenen Ex-situ-Programmeinschränkungen wie verfügbarem Budget, Laboreinrichtungen und Gesamtanzahl des Haltungspersonals erheblich variieren. Ebenso empfehlen wir, ausreichend Platz zwischen den Bechern zu lassen, die Larven beherbergen, um das Potenzial der Bewegung des Organismus zwischen Behältern zu minimieren. Schließlich wird für größere Bestände in Gefangenschaft dringend empfohlen, den Bestand zwischen einer oder mehreren Laboreinrichtungen zu trennen. Diese Schutzstrategie kann dazu beitragen, den katastrophalen Verlust der gesamten Bevölkerung aufgrund von Krankheiten oder anderen unvorhergesehenen Auswirkungen zu minimieren.
Die Qualität und Verfügbarkeit von Larval-Wirtsanlagen treibt die Tierproduktion an und beeinflusst sowohl die Larvenentwicklung als auch die allgemeine Gesundheit der Bevölkerung stark. Dennoch werden nur wenige veröffentlichte Berichte oder Studien diese Backstage-Anforderung hervorheben oder die besten Kindergartenpraktiken diskutieren. Die erfolgreiche Ex-situ-Programmplanung muss angemessene Anlagenmengen, Produktion und Wartung berücksichtigen. Da viele Larven auch bestimmte Pflanzenteile benötigen oder bevorzugen (z. B. terminales neues Wachstum, Blütenknospen und Blütenstände, Früchte usw.), ist eine effektive Inszenierung erforderlich, um eine angemessene Pflanzenphäuologie zu gewährleisten.
Weitere Überlegungen umfassen ein angemessenes demografisches und genetisches Management und die Minimierung möglicher negativer Auswirkungen von Gefangenschaft. Wir empfehlen die Entwicklung eines genetischen Managementplans. Dies kann Strategien umfassen, die die Infusion von neuem genetischem Material regelmäßig einschließen, die Vielfalt maximieren und eine enge Inzucht verhindern, regelmäßig Die Fitnessvariablen wichtiger Organismen bewerten und die Genetik auf einer gewissen Ebene überwachen, um einen Vergleich mit erhaltenen Populationen zu ermöglichen und die Gesundheit von Beständen in Gefangenschaft zu überprüfen. Regelmäßiger Vergleich der Merkmale von Gefangenen mit Individuen aus der Gründungsbevölkerung ist ebenfalls gerechtfertigt34,35.
Diese Protokolle stellen bewährte Best Practices dar. Sie sollten für eine Vielzahl von Forschern und Naturschutzpraktikern von Vorteil sein, die unsere Methoden direkt anwenden oder an ihre eigenen Studien und Ex-situ-gefährdeten Schmetterlings- oder Insektenschutz- und -wiederherstellungsprogramme anpassen können. Das spezifische beschriebene Zuchtprotokoll in Gefangenschaft ist wahrscheinlich am besten auf Programme anwendbar, die sich auf andere Lycaenidae, verwandte Taxa oder kleinere Taxa konzentrieren. Nichtsdestotrotz könnten zahlreiche Komponenten wie die Sicherung einer erfolgreichen Balz und Kopulation, die Pflege von Erwachsenen mit künstlichem Nektar, die Maximierung der Eileiter und die allgemeine Larvenpflege wohl breiter angelegt oder an ein breiteres Spektrum angepasst werden. von taxa. Wie bereits erwähnt, sollte zwar die Flexibilität des Protokolls hervorgehoben werden, doch kann der Zugang zu anderen etablierten Methoden dazu beitragen, wertvolle Erkenntnisse und einen gangbaren Ausgangspunkt für Anpassung und Innovation zu bieten. Die methoden zur Bewertung verschiedener lebensgeschichtliche Merkmale wie Larvenentwicklungszeit und die Anzahl der Larvenstadien haben wohl eine breite Anwendbarkeit auf andere Erhaltungszuchtprogramme und gefährdete Taxa. Wir ermutigen andere, bei der Begehbung wichtiger ökologischer Datenlücken zu helfen, wenn möglich, und geprüfte Protokolle und Programmergebnisse zu veröffentlichen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der U.S. Fish and Wildlife Service es Conservation Recovery Initiative (F17AP00467) und des Disney Conservation Fund unterstützt. Weitere Unterstützung erhielten das Florida Museum of Natural History und das Department of Entomology and Nematology der University of Florida.
Materialien
| Name | Company | Catalog Number | Comments |
| 12 oz plain white paper cups (Karat) | Lollicup | C-KC16 | |
| 15-Amp 2-Outlet Mechanical Residential Plug-in Countdown Lighting Timer | Lowes | UTTNI2423 | |
| 1ml sub-Q syringes (0.45 mm x 16 mm) | Fisher Scientific | 14-829-10F | |
| 2 oz clear plastic portion cup lids | Party City | #791091 | |
| 2 oz Clear Plastic Portion Cups | Party City | #791088 | |
| 34.29 cm x 34.29 cm x 60.96 cm collapsible mesh popup rearing cage | Bioquip | 1466BV | |
| 8.5" 1-Watt Incandescent Clamped Work Light | Lowes | PTC301L | |
| Adoric Electronic Digital Caliper | Amazon.com | B07QX2SK2F | |
| Big Kid's Choice Arts & Crafts Brush Set-12/Pkg, assorted sizes | Walmart | #10965135 | |
| Clear Plastic Cup Tray | Frontier Scientific Services | AG_9040 | |
| Fisher Scientific traceable memory monitoring thermometer | Fisher Scientific | 15-077-8D | |
| Forceps, Straight Points, Swiss Style #4, Stainless | BioQuip | 4531 | |
| Humco Glycerin 6 oz | Walmart | #303951037966 | |
| Luminous Paint Kit, Blue, Red, Yellow, 4 Dram | Bioquip | 1166A | |
| Melon flavored Gatorade Fierce Thirst Quencher or fruit punch flavored Gatorade Thirst Quencher sports drink | Walmart | #568456137 | |
| Neoteck Digital 2 in 1 Hygrometer-Thermometer | Amazon.com | NTK026 | |
| Olympus 0.6 ml Microtubes, Clear, Polypropylene, Nonsterile | Amazon.com | 24-272C | |
| Plastic Tank Sprayer | Lowes | #5318 | |
| Q-tips Cotton swabs | Walmart | #551398298 | |
| Rectangular plastic tupperware container with lid (Rubbermaid) | Walmart | #554320171 | |
| Showgard 903 Stamp Tongs, 4 5/8 inch Spade Tip | Amazon.com | #787793151378 | |
| Single face corrugated paper roll | Amazon.com | BXSF12 | |
| Snap blade utility knife | OLFA | #5023 | |
| Solo 9 oz plastic cups | Solo | SQ950 | |
| Thorton Plastics 50 dram clear plastic snap cap vial (6.25 oz.) | Thorton Plastics | #50 | |
| Tulle Spool 9 inch x 150 feet - Black | Jo Ann Fabrics | #16029696 | |
| Zep 32 oz Plastic Spray Bottle | Lowes | HDPRO36 |
Referenzen
- Thomas, J. A. Butterfly communities under threat. Science. 352 (6296), 216-218 (2016).
- Swengel, S. R., Schlicht, D., Olsen, F., Swengel, A. B. Declines of prairie butterflies in the Midwestern USA. Journal of Insect Conservation. 15 (1-2), 327-339 (2011).
- Habel, J. C., et al. Butterfly community shifts over two centuries. Conservation Biology. 30 (4), 754-762 (2016).
- Gilburn, A. S., et al. Are neonicotinoid insecticides driving declines of widespread butterflies? Peer J. 3, e1402(2015).
- Sánchez-Bayo, F., Wyckhuys, K. A. G. Worldwide decline of the entomofauna: A review of its drivers. Biological Conservation. 232, 8-27 (2019).
- Daniels, J. C., Magdich, M., Tolson, P. Butterfly recovery planning: Determining how to contribute. Butterfly Conservation in North America: Efforts to Help Save Our Charismatic Microfauna. Daniels, J. C. , Springer Science+Business Media B.V. New York. 1-21 (2015).
- U.S. Fish and Wildlife Service. Environmental Conservation Online System. Listed Animals. , https://ecos.fws.gov/ecp (2019).
- Schultz, C. B., Russell, C., Wynn, L. Restoration, reintroduction and captive propagation efforts for at-risk butterflies: a review. Israel Journal of Ecology and Evolution. 54, 41-61 (2008).
- Grow, S., Allard, R., Luke, D. The role of AZA-accredited zoos and aquariums in butterfly conservation. Butterfly Conservation in North America: Efforts to Help Save Our Charismatic Microfauna. Daniels, J. C. , Springer Science+Business Media B.V. New York. 23-34 (2015).
- Crone, E. E., Pickering, D., Schultz, C. B. Can captive rearing promote recovery of endangered butterflies? An assessment in the face of uncertainty. Biological Conservation. 139, 103-112 (2007).
- Sanchez, S. J., Daniels, J. C. The butterfly conservation initiative: Developing a new conservation vision through compound eyes. News of the Lepidopterists' Society. 49 (3), 75-77 (2007).
- Wardlaw, J. C., Elmes, G. W., Thomas, J. A. Techniques for studying Maculinea butterflies: I. Rearing Maculinea caterpillars with Myrmica ants in the laboratory. Journal of Insect Conservation. 2 (1), 79-84 (1998).
- Mattooni, R., Longcore, T., Krenova, Z., Lipman, A. Mass rearing the endangered Palos Verdes blue butterfly (Glaucopsyche lygdamus palosverdesensis:Lycaenidae). Journal of Research on the Lepidoptera. 37, 55-67 (1998).
- Pearce-Kelly, P., et al. The captive rearing of threatened Orthoptera: a comparison of the conservation potential and practical considerations of two species' breeding programmes at the Zoological Society of London. Journal of Insect Conservation. 2 (3-4), 201-210 (1998).
- Wells, C. N., Edwards, L., Hawkins, R., Smith, L., Tonkyn, D. A rearing method for Agrynnis (Speyeria) diana (Lepidoptera: Nymphalidae) that avoids diapause. Psyche. , 1-6 (2011).
- Grosboll, D. N. Captive Rearing the Endangered Mardon Skipper (Polites mardon) and Taylor's Checkerspot (Euphydryas editha taylori) Butterflies: Initial Results (Lepidoptera, Nymphalidae). Proceedings of the species at risk, pathways to recovery conference. , Species at Risk Pathways to Recovery Conference Organizing Committee. Victoria. 1-6 (2004).
- Barclay, E., Arnold, M., Andersen, M., Shepherdson, D. Husbandry manual: Taylor's checkerspot (Euphydryas editha taylori). , 1st edition, Oregon Zoo. Portland, Oregon. (2009).
- Johnson, J., et al. Captive Rearing of the Laguna Mountains Skipper (Pyrgus ruralis laguanae): Final Report. , (2010).
- Linders, M. Captive rearing and translocation of Taylor's checkerspot in South Puget Sound: 2011-2012. 2012 Annual Progress Report to the ACUB Technical Review Committee. , (2012).
- Linders, M., Lewis, K. Captive rearing and translocation of Taylor's checkerspot butterfly (Euphydryas editha taylori.): South Puget Sound, Washington, 2012–2013. 2013 Annual Report to the US Fish and Wildlife Service (Cooperative Agreement F12ACI00835), Joint Base Lewis-McChord Fish and Wildlife Program and JBLM-ACUB Technical Review Committee. , (2013).
- Department of Conservation and Research, Toledo Zoo. Propagation Handbook for the Karner Blue Butterfly Lycaeides melissa samuelis. , Fourth edition, (2006).
- Johnson, J. J., et al. Captive Rearing of Lange's Metalmark Butterfly, 2011-2015. United States Fish and Wildlife Service, CVPIA Habitat Restoration Program (F11AP00168). , (2016).
- Andersen, M. J., et al. Oregon Silverspot Butterfly Husbandry Manual. , Oregon Zoo. Portland, Oregon. (2010).
- Washington Department of Fish and Wildlife. Threatened and Endangered Wildlife in Washington: 2012 Annual Report. Listing and Recovery Section, Wildlife Program, Washington Department of Fish and Wildlife. , Olympia. (2013).
- McGowan, P. J. K., Traylor-Holzer, K., Leus, K. IUCN guidelines for determining how ex situ management should be used in species conservation. Conservation Letters. 10 (3), 361-366 (2017).
- Pearce-Kelly, P., et al. The conservation value of insect breeding programmes: Rationale, evaluation tools and example programme case studies. Insect Conservation Biology: Proceedings of the Royal Entomological Society's 23nd Symposium. Stuart, A. J. A., New, T. R., Lewis, O. T., et al. , 57-75 (2007).
- U.S. Fish and Wildlife Service. Policy Regarding Controlled Propagation of Species Listed Under the Endangered Species Act. United States Federal Register. 65 (183), 56916-56922 (2000).
- IUCN/SSC. Guidelines on the use of ex situ management for species conservation. Version 2.0. IUCN Species Survival Commission. , Gland, Switzerland. (2014).
- Sutherland, W. J., Pullin, A. S., Dolman, P. M., Knight, T. M. The need for evidence-based conservation. Trends in Ecology & Evolution. 19 (6), 305-308 (2004).
- Daniels, J. C., Nordmeyer, C., Runquist, E. Improving standards for at-risk butterfly translocations. Diversity. 10, 67(2018).
- Saarinen, E. V. Population genetics of the endangered Miami blue butterfly Cyclargus thomasi bethunebakeri.: implications for conservation. , University of Florida. Gainesville. (2009).
- Becker, T. Propagation and repatriation of the regal fritillary butterfly. , http://titag.org/2016/2016papers/beckerregal.pdf (2019).
- R Core Team. R A Language and Environment for Statistical Computing. R Foundation for Statistical Computing. , Vienna, Austria. (2016).
- Schultz, C. B., Dzurisin, J. D., Russell, C. Captive rearing of Puget blue butterflies (Icaricia icarioides blackmorei) and implications for conservation. Journal of Insect Conservation. 13 (3), 309-313 (2009).
- Frankham, R., Loebel, D. A. Modeling problems in conservation genetics using captive Drosophila populations: Rapid genetic adaptation to captivity. Zoo Biology. 11 (5), 333-342 (1992).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten