Method Article
Programas de propagação em cativeiro de borboletas em risco para melhorar o conhecimento da história da vida e técnicas eficazes de conservação ex situ
Neste Artigo
Resumo
Aqui, apresentamos protocolos para 1) a propagação em cativeiro laboratorial da borboleta azul miami ameaçada pelo governo federal(Cyclargus thomasi bethunebakeri) e 2) avaliando informações básicas da história da vida, como tempo de desenvolvimento imaturo e número de estádios larvais. Ambos os métodos podem ser adaptados para uso com outros programas de conservação ex situ.
Resumo
Melhorar o conhecimento das melhores práticas ex situ para borboletas em risco é importante para gerar resultados bem-sucedidos do programa de conservação e recuperação. Pesquisas sobre essas populações cativas também podem produzir dados valiosos para abordar lacunas de informações importantes sobre o comportamento, histórico de vida e ecologia do imposto alvo. Descrevemos um protocolo de propagação em cativeiro do Cyclargus thomasi bethunebakeri que pode ser usado como modelo para outros programas de ex situ borboleta em risco, especialmente aqueles da família Lycaenidae. Fornecemos ainda um protocolo simples e simples para o registro de várias métricas de histórico de vida que podem ser úteis para informar metodologias ex situ, bem como adaptadas para estudos laboratoriais de outras lepidopteras.
Introdução
Uma lista crescente de estudos indica declínios globais generalizados e graves nas populações de borboletas1,2,3,4,5. Isso inclui a grande maioria das espécies em risco. Programas de conservação projetados para mitigar tais declínios muitas vezes empregam uma mistura de estratégias, incluindo monitoramento populacional, gestão e restauração de habitats, pesquisa científica, propagação em cativeiro e translocação de organismos6. Apenas nos EUA e seus territórios, um total de 30 borboletas são listadas a Lei de Espécies Ameaçadas (ESA) como ameaçadas ou ameaçadas, com 21 deles tendo aprovado projetos ou planos finais de recuperação. Para tal taxa, mais da metade das estratégias de recuperação identificadas recomendam propagação em cativeiro ou afirmam que a propagação em cativeiro deve ser avaliada7. O uso de esforços de conservação ex situ para borboletas cresceu consideravelmente nos últimos anos8,9, e tem potencial para ser uma ferramenta crítica para ajudar os esforços de recuperação10. Numerosas instituições, organizações e agências estão atualmente envolvidas com esforços ex situ para pelo menos 11 taxas de borboleta listadas na ESA (ou seja, Cyclargus thomasi bethunebakeri, Euphydryas editha quino, Euphydryas editha taylori, Heraclides aristodemus, Hesperia dacotae, Lycaeides melissa samuelis, Oarisma poweshiek, Pyrgus ruralis lagunae, e Speryeria zerene hippolyta) e vários outros taxas em risco (por exemplo, Callophrys irus, Euphydryas phaeton, Speyeria idalia, e Eumaeus atala)11. Apesar do número de esforços robustos e bem-sucedidos, ainda há falta de comunicação regular entre programas e entre os praticantes de conservação que envolvem a troca de ideias, dados, metodologias efetivas e resultados. Esse compartilhamento de conhecimento é essencial, pois ajuda a minimizar a duplicação do esforço, melhora as melhores práticas gerais e melhora o impacto na conservação. Poucos protocolos publicados de criação, criação, reprodução ou criação estão prontamente disponíveis para taxa de borboleta sem risco, e aqueles que muitas vezes não têm detalhes narrativos suficientes e/ou ilustrações. Estes geralmente fornecem detalhes sumários com instruções limitadas passo a passo e imagens de acompanhamento, tornando a replicação desafiadora ou aplicação para outras taxas difíceis de avaliar12,13,14,15. Muitos dos protocolos disponíveis são limitados de alguma forma: existem apenas na literatura cinza, ou em diferentes níveis de detalhes, idade de publicação ou como componentes em processos de simpósio, relatórios de agência/financiador, ou manuais internos16,17,18,19,20,21,22,23,24.
Para a maioria dos programas de conservação, a propagação em cativeiro é conduzida principalmente para apoiar a translocação de conservação, que engloba reintrodução, reforço (ou seja, aumento) e introdução25,26. Tais atividades devem ser implementadas estrategicamente como componente da estratégia global de recuperação, a fim de ajudar a evitar a extinção de uma espécie listada, subespécie ou populações. Deve-se notar, no entanto, que este é um dos vários outros papéis potenciais que esses programas ex situ podem servir. Estes também podem incluir a manutenção de uma população de seguros (ou seja, refugia), resgate temporário de organismos, apoio à pesquisa e/ou treinamento relacionados à recuperação, e a promoção dos esforços de educação e conscientização relacionados à conservação27,28. Independentemente de os programas ex situ terem um único objetivo definido ou uma mistura de vários, os profissionais de conservação devem maximizar as oportunidades de coleta de dados, a fim de preencher lacunas de informações importantes quando possível. Isso é particularmente importante porque a grande maioria dos impostos em risco geralmente têm sido mal estudados antes de declínios substanciais da população selvagem. O conhecimento aprimorado resultante adquirido em vários aspectos comportamentais, ecológicos ou históricos de vida do taxon focal pode servir para ajudar a promover a conservação e o manejo efetivo de espécies29.
Aqui, descrevemos em detalhes o protocolo de propagação em cativeiro que foi desenvolvido para a borboleta azul miami ameaçada pelo governo federal(Cyclargus thomasi bethunebakeri)comoparte de um programa maior de conservação e recuperação. Neste caso, o programa de propagação em cativeiro atende a três funções específicas identificadas: 1) uma população de seguros caso a população selvagem existente seja perdida, 2) uma população de pesquisa projetada para preencher lacunas de conhecimento ecológicas e de história de vida identificadas que possam ajudar a informar a recuperação e/ou gestão, e 3) para produzir organismos viáveis para a translocação de conservação em locais dentro da faixa histórica do taxon. O protocolo resultante tem sido bem examinado e comprovado, tendo sido utilizado e melhorado por mais de uma década. Consequentemente, sentimos que as técnicas e metodologias descritas representam um modelo viável que pode ser aplicado ou prontamente adaptado para outros programas de borboletas ex situ em risco, particularmente aqueles que envolvem Lycaenidae ou taxa relacionada. Embora não sugiramos que o protocolo descrito seja superior aos outros, sentimos que há oportunidades para aplicar alguns dos métodos de forma mais ampla para ajudar a aumentar a produtividade, o cuidado ou a eficiência. Isso é particularmente verdade, pois grande parte de nossa criação é feita em condições laboratoriais internas com espaço limitado, semelhante aos programas de conservação envolvendo Euphydryas editha taylori e Speryeria zeree hippolyta17,23. Inúmeros outros protocolos geralmente utilizam material em vasos para oviposição ou criação larval, o que às vezes pode levar a maiores complexidades relacionadas ao controle predatório, controle ambiental (ou seja, umidade, temperatura), monitoramento da pecuária, coleta de dados, questões de pragas vegetais e espaço para citar alguns21,22. Por fim, o protocolo apresentado descreve os métodos de reprodução em cativeiro. Muitos outros programas de conservação de borboletas em risco envolvem a criação de cabeça ou em cativeiro com os protocolos representativos refletindo essas diferenças. Embora muitas vezes menores, sentimos que isso ajuda a ampliar o pool existente de informações disponíveis para outros programas revisarem. Isso é fundamental, pois a maioria dos programas ex situ representam esforços pioneiros para ajudar a facilitar a recuperação de taxas raras e muitas vezes mal estudadas. Os protocolos disponíveis podem servir como um excelente ponto de partida para ajudar a fornecer uma visão valiosa, reduzir a duplicação do esforço e promover a inovação. Devido à "extensa diversidade interespecífica de comportamentos de borboletas, traços de história da vida e requisitos ecológicos combinados com diferenças muitas vezes marcadas nas instalações do programa, orçamentos, experiência satistecida" e outras diferenças inerentes, a dependência de uma única metodologia, mesmo para taxas intimamente relacionadas, muitas vezes é limitante e injustificada30. A flexibilidade para refinar ou desenvolver novos protocolos adaptados às necessidades de taxas ou programas específicos é essencial para o sucesso e, portanto, deve ser enfatizada. Descrevemos além técnicas laboratoriais para coletar métricas sobre o desenvolvimento de organismos em condições cativas, incluindo o número de estrelas larvais, duração de estágios individuais de desenvolvimento, tempo total de desenvolvimento e comprimento larval e pupal. Essas técnicas têm ampla aplicabilidade para estudos de história da vida de Lepidoptera que podem ser usados para refinar protocolos ex situ ou informar dados de campo.
Protocolo
1. Garantir namoro adulto bem sucedido e acasalamento
- Após a eclosão bem sucedida, libere borboletas adultas viáveis em uma gaiola de voo segura, acompanhada e exibida localizada em uma estufa controlada pela temperatura(Figura Suplementar 2).
NOTA: Adultos podem ser marcados na superfície ventral das asas com marcadores de tinta permanentes se a identificação de indivíduos específicos for desejada para separação de linhas genéticas, origem do estoque ou para coleta específica de dados relacionadas à longevidade do organismo, comportamento, Etc.- Embora as dimensões exatas da gaiola possam variar, certifique-se de que há amplo espaço para acomodar material adequado da planta de néctar necessário para suportar a densidade de borboletas adultas abrigadas e fornecer espaço para um humano ficar livremente em pé e girar ao redor.
- Além da regulação da temperatura, certifique-se de que a estufa esteja segura para que possa fornecer uma segunda camada de contenção, juntamente com proteção contra o tempo inclemente (por exemplo, chuva forte, vento).
- Elevar o material da planta de néctar de vasos para que não haja mais de 30 cm de espaço desde o topo interno da gaiola até as flores mais altas florescendo(Figura Suplementar 2). Isso proporciona acesso ideal aos recursos de néctar disponíveis, oferece amplos poleiros adultos e minimiza a atividade de voo estranho.
- Coloque uma planta hospedeira em vasos na gaiola de voo. Isso garante que, mesmo que um par acasalado seja perdido, podem ser coletados ovos resultantes.
- Fornecer fluxo de ar consistente. Isso aumenta a atividade de namoro e o sucesso do acasalamento. Em um ambiente de estufa, sopradores e ventiladores de circulação de montagem fixa são melhor usados para ajudar a melhorar a ventilação e o movimento do ar. Uma ventilação portátil menor, como ventiladores de caixa ou mesa, também pode ser usada.
- Mantenha a temperatura interna do efeito estufa entre 27 °C e 32 °C para promover a atividade adulta ideal e o sucesso do acasalamento. A temperatura dentro da gaiola é monitorada usando um termômetro de monitoramento de memória rastreável.
- Misture a gaiola de voo exibida regularmente (aproximadamente uma vez a cada 2 h) com água usando uma bomba de mão, pulverizador de tanque de plástico ou mangueira de jardim.
- Colete suavemente pares individuais de acasalamento da gaiola de voo com tela usando um frasco de tampa de plástico transparente de 50 dram(Tabela de Materiais),colocando de um a dois pares por frasco, e transporte para uma sala de criação ou laboratório interno (Figura Complementar 3).
2. Maximizando a produção de ovos
- Montar câmara de oviposição.
- Pegue um copo de papel branco simples de 12 onças e use uma faca utilitário de lâmina de estalo, faça dois cortes horizontais em cada lado do copo em frente um ao outro. Cada corte deve ser aproximadamente 1 cm abaixo da borda.
- Corte um único cotonete de algodão ao meio e insira a extremidade da haste de cada um nos dois cortes horizontais em cada lado do copo de papel para que a porção de cotonete de algodão se estenda aproximadamente 2 cm em direção ao interior do copo.
- Usando uma faca de utilidade de lâmina de estalo, faça dois cortes "X" na parte inferior do copo de papel. Cada corte diagonal deve ter aproximadamente 1 cm de comprimento.
- Pegue um copo plástico de 9 onças e encha o fundo com aproximadamente 2 cm de água da torneira.
- Coloque um corte fresco, de aproximadamente 15 cm de comprimento, do crescimento da planta de hospedeiro sértero terminal no copo de papel, inserindo o caule através de um dos cortes "X" na parte inferior. Empurre a haste através do corte para que aproximadamente 4-5 cm se prostrutam para fora da parte inferior.
- Coloque o copo de papel com material hospedeiro no copo plástico, garantindo que o caule da planta esteja na água.
- Encha uma seringa sub-Q de 1 ml (0,45 mm x 16 mm) com uma bebida esportiva aromatizada e saqueie ambos os cotonetes de algodão no copo de papel. Estes agem como flores artificiais.
NOTA: Melão e bebida esportiva sabor de ponche de frutas fornecem a melhor alternativa de néctar. - Uma vez que cada par de acasalamento se separe, coloque 2-3 fêmeas gravid na configuração do copo montado (ou seja, a câmara de oviposição).
- Cubra o copo com um fragmento quadrado cortado de tule preto (aproximadamente 15 cm x 15 cm) e fixe-o com um elástico ao redor da tampa (Figura Suplementar 4). O tule preto fornece a melhor visibilidade no copo e a fácil identificação de quaisquer ovos que possam ocasionalmente ser colocados no tule.
- Estimular a atividade e a oviposição das borboletas adultas.
- Coloque cada câmara de oviposição em um banco de laboratório ou mesa aproximadamente 19 cm abaixo de uma luz de grampo de 21,59 cm com um refletor de alumínio que abriga uma lâmpada incandescente de 40 W (Figura Suplementar 5).
NOTA: A luz incandescente fornece o calor radiante necessário para estimular a atividade e a oviposição adulta. - Coloque um termômetro de monitoramento de memória rastreável adjacente às luzes e execute o sensor de temperatura para que ele repode em cima de uma câmara de oviposição localizada diretamente uma luz de grampo.
NOTA: A faixa de temperatura-alvo é entre 27,5 °C-29 °C. - Adicione luzes de fixação suplementar conforme necessário, dependendo do número total de câmaras oposicionais implantadas.
- Tampe as luzes de fixação em um temporizador mecânico de plug-in indoor programável de 15 Amp 24 h com duas tomadas (programável em intervalos cronometrados de 30 minutos).
- Coloque o temporizador para acender a luz do grampo por intervalos de 30 minutos (ou seja, um ciclo repetitivo de 30 min ligado, 30 min desligado).
NOTA: Este ciclo de luz ajuda a maximizar a produção de ovos, proporcionando períodos repetitivos de iluminação para estimular a atividade e oviposição das borboletas adultas, seguido de curtos períodos de descanso escuro. - Refrescar os cotonetes de algodão em cada xícara com bebida esportiva aromatizada através da seringa sub-Q e névoa regularmente com água usando uma garrafa de spray plástico aproximadamente a cada 2-3 h ou conforme necessário.
NOTA: Isso fornece néctar artificial adequado e umidade para permitir que as borboletas se alimentem livremente conforme desejado. Assim, aumenta tanto a longevidade adulta quanto a produtividade da oposição em condições laboratoriais onde o material vegetal vivo e florescente não pode ser facilmente utilizado. - Monitore os copos regularmente e substitua a planta hospedeira por cortes frescos conforme necessário.
- Quando os ovos começam a eclodir ou a densidade de ovos se torna alta, mova as fêmeas para uma nova xícara com hospedeiro fresco e comece o protocolo larvas com recém-nascidos.
- Coloque cada câmara de oviposição em um banco de laboratório ou mesa aproximadamente 19 cm abaixo de uma luz de grampo de 21,59 cm com um refletor de alumínio que abriga uma lâmpada incandescente de 40 W (Figura Suplementar 5).
3. Cuidados e manutenção larval
- Repita as etapas 2.3-2.6 para montar copos para larvas.
- Quando os ovos começam a eclodir, mova o material da planta hospedeira com ovos e larvas de neonato em um copo recém-montado, colocando o caule através do segundo "X" na parte inferior garantindo que o caule da planta esteja na água e deixe tocar o corte de hospedeiro fresco adjacente.
- Quando as larvas são jovens (onroto-2 instar), verifique copos larvais diariamente para frescor do material vegetal hospedeiro e presença de ou frass excessiva.
NOTA: A remoção diária do material hospedeiro não é recomendada quando as larvas são jovens porque isso pode resultar em lesão no organismo devido ao manuseio e/ou desperdício desnecessário de material hospedeiro fresco. - Se o material hospedeiro estiver murcho ou em condições precárias, coloque outro corte de material hospedeiro fresco em copo para que ele esteja tocando folhagens existentes e permita que larvas se movam para o novo hospedeiro por conta própria.
- Uma vez que as larvas cheguem ao3º instar, substitua o copo de papel e adicione material hospedeiro fresco diariamente.
- Use um pequeno pincel de tinta aquarela de camelo para mover suavemente as larvas do material antigo hospedeiro ou superfície do copo para material hospedeiro fresco no novo copo.
- Coloque o antigo material hospedeiro em um recipiente vazio de armazenamento de alimentos plásticos retangulares.
- Repita as etapas 3.5-3.7 diariamente e até que todos os copos com larvas tenham sido processados.
- Quando estiver completo, adicione uma pequena quantidade de material hospedeiro fresco em cima do lixo da planta no recipiente de armazenamento de alimentos e coloque livremente uma tampa por cima.
NOTA: Isso serve como uma salvaguarda no caso de quaisquer larvas forem negligenciadas durante o processamento diário, pois elas rastejarão para o novo material hospedeiro em cima dos resíduos da planta e podem ser removidas no dia seguinte. - Mantenha copos temperatura laboratorial entre 25 °C-28 °C para atividade e desenvolvimento larval ideal (Figura Complementar 6).
NOTA: Para atingir as temperaturas de criação ótimas em condições internas, muitas vezes é necessário colocar copos luzes de fixação com refletores de alumínio que abrigam lâmpadas incandescentes de 40 W. As temperaturas podem então ser monitoradas ativamente usando um termômetro de monitoramento de memória rastreável e a altura da luz ajustada para atingir as melhores condições de criação.
4. Construção da câmara de pupação
- Corte um rolo de papel ondulado de rosto único em quadrados de 3,8 cm x 3,8 cm.
- Coloque um quadrado em um copo de porção de plástico transparente de 2 onças.
- Coloque o copo em uma bandeja de copo de plástico transparente (Figura Complementar 7).
5. Preparando larvas para a pupação
- Identifique larvas maduras prontas para pupato durante o processamento diário da colônia.
NOTA: Tais larvas vão virar um uniforme maçante verde-marrom, perder seus chevrons, e muitas vezes vagar para fora do hospedeiro. - Remova suavemente cada larva madura com um pequeno pincel de tinta aquarela de camelo ou fórceps e coloque uma em cada câmara de pupação.
- Firmemente estalo a tampa de plástico transparente na câmara de pupação.
- Repita as etapas 5.1-5.3 até que todas as larvas prontas para pupato tenham sido transferidas para câmaras de pupação adicionando novas bandejas de plástico conforme necessário (Figura Suplementar 8).
6. Manutenção de pupas
- Para cada bandeja de câmaras de pupação, registre a data da primeira pupação e quaisquer outras informações pertinentes necessárias (ou seja, linha genética, ensaio experimental, etc.).
- Organize bandejas por data e local em local seguro dentro do laboratório (Figura Suplementar 8).
- Monitore bandejas diariamente para eclosão adulta.
NOTA: Condições laboratoriais como a temperatura influenciarão fortemente o tempo de desenvolvimento. - Antes da eclosão adulta (tipicamente dentro de 10 dias da primeira pupação), remova as tampas das câmaras individuais de pupação e coloque a bandeja em uma gaiola de criação de malha dobrável de 34,29 cm x 34,29 cm x 60,96 cm de malha dobrável(Figura Suplementar 9).
NOTA: Pupae presa seguramente dentro das ranhuras dos quadrados de papel ondulado facilitam a eclosão adulta bem sucedida (Figura Complementar 10). - Repita todo o protocolo da etapa 1.1 para a geração em cativeiro subsequente.
7. Avaliando o tempo de desenvolvimento das etapas imaturas e o número de estádios
- Coloque uma única larva um microscópio dissecando. Use um pequeno pincel de tinta aquarela capilar de camelo para se mover cuidadosamente e isolar larvas para evitar lesões ao organismo.
- Mergulhe um único cabelo do pincel em tinta luminosa não tóxica (Tabela de Materiais)e coloque cuidadosamente uma pequena gota de tinta na parte de trás (dorsum) da larva. Use uma cor de tinta que se destaque da cor de fundo e da cor padrão da larva (Figura Complementar 11). Não deixe de colocar tinta na cabeça da larva.
- Uma vez que a tinta seca (cerca de 30 s ou mais), coloque cada larva individual em seu próprio copo de porção de plástico transparente de 2 onças contendo aproximadamente 1-3 pequenas folhas de material de hospedeiro terminal fresco e escreva um identificador único no copo e na tampa (Figura Complementar 12).
- Verifique cuidadosamente cada larva diariamente. Remova as folhas e coloque na superfície branca. Inspecione copos, limpe a tampa e examine as folhas um microscópio dissecando para a presença de exuviadas larvais (peles de molde) e/ou cápsulas de cabeça.
- Se uma exuvia larval for encontrada, remova-a do copo e coloque-a em um tubo de microcentrífuga rotulado com o número correspondente do copo e a data (veja os passos 8.1-8.6. abaixo).
- Repinte larvas após cada molt e registre datas de molt.
- Meça o comprimento total do corpo (cabeça a último segmento abdominal) de cada larva diariamente usando pinças digitais. Tome três medidas e registre a média das três, juntamente com a data e a hora. Para larvas instar precoces, deve-se utilizar uma lupa ou escopo dissecando ao medir para garantir medidas precisas.
- Retornasse a larva ao seu copo de porção de plástico correspondente.
- Adicione material de hospedeiro fresco conforme necessário e remova todos os frass e detritos antigos do hospedeiro. Se o molde for encontrado no copo, descarte e use um copo novo. Escreva o número de identificador único correto no novo copo.
- Repita as etapas 7.5-7.9 até que todas as larvas cheguem ao seu último instar e comecem a fase preparatória. Quando as larvas deixam de se alimentar, vire um uniforme de cor verde-marrom maçante, perca seus chevrons, e muitas vezes vagueiam pelo hospedeiro, minimizem perturbá-los.
- Coloque um pequeno pedaço de papel ondulado no copo (veja passo 4.1).
- Uma vez que cada larva tenha totalmente pupado, meça seu comprimento total como na etapa 7,8 acima e registre a data da pupação. Este será o molt final de cada indivíduo.
- Verifique diariamente a data de eclosão de pupas e registre data de eclosão e sexo de cada borboleta adulta resultante.
- Meça o comprimento do acorde de cada borboleta usando pinças digitais. Borboletas podem ser suavemente mantidas com fórceps para medição. Se a borboleta estiver muito ativa para medir facilmente, coloque-a temporariamente em uma geladeira por 30 s ou menos e tente novamente.
8. Coleta de larvas exuviae
- Quando uma exuvia larval é observada, encha um tubo de microcentrífuga com 0,2 μl de glicerina. Rotular a parte superior da tampa e o lado com o número da larva, data de molt e cápsula da cabeça (H.C.).
NOTA: As larvas de algumas larvas lepidopteranas consomem regularmente seu exávia, mas a cápsula da cabeça deve permanecer. - Coloque a exuvia larval e a cápsula da cabeça associada em uma tampa de copo de porção de plástico transparente e coloque algumas gotas de etanol nele.
- Examine a exuvia larval um microscópio dissecando colocando-o em uma tampa de copo de porção de plástico transparente e colocando algumas gotas de etanol sobre ele. Se a cápsula da cabeça larval já estiver separada da exuvia, coloque uma gota de glicerina na ponta dos fórceps entomológicos pontiagudos e toque suavemente na cápsula da cabeça para a glicerina. Coloque a cápsula da cabeça no tubo de microcentrífuga associado.
- Se a cápsula da cabeça ainda estiver presa à exuvia larval, use fórceps pontiagudos e um pino de inseto para separar a cápsula da cabeça da exuvia larval.
- Uma vez separado, use a técnica de glicerina para pegar a cápsula da cabeça. Se houver muito etanol, você pode usar uma toalha de papel pequena para remover alguns, mas tenha cuidado para não remover acidentalmente a cápsula da cabeça.
- Coloque a cápsula da cabeça em um frasco preenchido com glicerina rotulado e feche a tampa firmemente.
Resultados
Ao longo de duas iniciativas separadas de conservação voltadas para a recuperação de Cyclargus thomasi bethunebakeri de fevereiro de 2003 a dezembro de 2010 e de novembro de 2016 até o presente, este protocolo foi usado para produzir com sucesso um excesso de 51.052 organismos viáveis. Com base no instantâneo resumo de um ano da produtividade geral da população cativa de junho de 2018 a junho de 2019, foram produzidos 10.166 organismos viáveis, representando 782,00 ± 118,93 organismos por mês em 13 gerações. Da mesma forma, a produção total total de ovos por fêmea em condições laboratoriais foi de 114,00 ± 26,12 (n = 12)31. A produtividade substancial do organismo está neste programa entre os maiores esforços ex situ nos EUA, juntamente com os de Euphydryas editha taylori, Speyeria zerene hippolyta, e Lycaeides melissa samuelis24. Parte dessa produtividade pode ser atribuída ao fato de que a borboleta é continuamente ninhada, produzindo uma geração aproximadamente a cada 4-6 semanas em cativeiro. A maioria dos outros programas de reprodução de conservação envolve taxas univoltinas ou bivoltinas. No entanto, mesmo para programas que envolvem taxas extremamente fecundas, como speyeria spp., o número total de organismos viáveis produzidos para translocação de conservação anualmente raramente excede alguns milharesde 32. Assim, nossa população cativa possibilitou a pesquisa direcionada e a coleta extensiva de dados sobre inúmeras lacunas de dados importantes para melhorar as melhores práticas de reprodução laboratorial e pecuária(Figura 1),bem como ajudar a informar as decisões de recuperação e gestão.
O tempo total de desenvolvimento médio da larva de neonato para adulto foi de 28,63 dias (Tabela 1). A maioria das larvas tinha quatro molts (Figura 2, Figura 3), embora duas tivessem cinco molts, e uma tinha seis molts. O comprimento médio total de todas as estrelas larvais foi de 5,97 mm, e as larvas foram as maiores na quarta fase de vida preparatória(Tabela 1). Quando só inclui variáveis com mais de 30 observações, o menor tempo foi gasto nas primeiras etapas instar e prepupal, e o mais longo foi gasto como pupae (Tabela 1, Figura 2). As fêmeas tipicamente se desenvolveram mais rapidamente em todas as etapas imaturas em comparação com os machos, embora este não tenha sido um efeito significativo (p = 0,625). Foram realizadas análises estatísticas utilizando rStudio versão 1.1.463 (R Core Team 2016)33. O comprimento médio do acorde da asa adulta foi de 12,64 mm(Tabela 2), e houve uma diferença significativa entre os sexos (p = 0,047). O teste t de dois lados foi executado para avaliar a diferença de acordes de asa entre os sexos. Modelo de regressão linear e regressão stepwise para o comprimento médio de cada fase de vida mostraram que o comprimento pupal foi o melhor preditor para o comprimento do acorde da asa adulta (Tabela 3, Tabela 4). Modelos de regressão para o tempo de desenvolvimento mostraram que o número de dias gastos na segunda e quarta estrelas e o número total de dias foram os melhores preditores para o comprimento do acorde da asa adulta, mas apenas o número de dias na quarta instar foi significativo (Tabela 5, Tabela 6). Como as variáveis eram contínuas, dois modelos de regressão linear eram executados para o tempo de desenvolvimento de cada fase de vida, bem como o comprimento de cada fase de vida, com o comprimento do acorde da asa adulta como variável dependente. Regressões stepwise foram executadas em ambos os modelos de regressão para determinar os melhores preditores do comprimento do acorde das asas adultas.

Figura Suplementar 1: Espécimes fixados do adulto Cyclargus thomasi bethunebackeri. (A)Homem adulto, dorsal (esquerda), ventral (direita). (B) Mulher adulta, dorsal (esquerda), ventral (direita). Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 2: Gaiola de voo exibida abrigada em estufa controlada pela temperatura. (A) Interior mostra plantas de néctar adultoem em vasos e uma única planta de hospedeiro larval em vasos. (B)A prateleira metálica ajuda a elevar as plantas de néctar em vasos para que não haja mais de 30 cm de espaço desde o topo interno da gaiola até as flores mais altas florescendo. Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 3: Procedimento para coleta de pares adultos na copula. (A)Par de acasalamento de Cyclargus thomasi bethunebakeri adulto dentro da gaiola de voo screened (feminino, direito e masculino, esquerda). (B) Pares de acasalamento coletados da gaiola de voo em frascos de tampa instantânea e trazidos para o laboratório. Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 4: Procedimento para montagem da câmara de oviposição. (A)Dois sistemas de copos com material hospedeiro terminal e cotonetes de algodão. (B) Uma seringa sub-Q de 1 ml (0,45 mm x 16 mm) com bebidas esportivas aromatizadas saturando cotonetes de algodão no copo de papel. (C) Xícaras de habitação de fêmeas gravid garantidas com tule preto. Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 5: Configuração laboratorial para maximizar a produção de ovos. (A)Câmaras de oviposição colocadas em um banco de laboratório uma luz de grampo com uma lâmpada incandescente de 40 W. (B)Um termômetro de monitoramento de memória rastreável é colocado ao lado das luzes com o sensor de temperatura descansando em cima de uma câmara de oviposição localizada diretamente uma luz de grampo. (C)Uma seringa sub-Q de 1 ml e um pequeno béquer segurando bebida esportiva aromatizada colocada ao lado das câmaras de oviposição para facilitar a refrescação dos cotonetes de algodão regularmente ao longo do dia. Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 6: Configuração laboratorial para cuidados e manutenção larval. (A)Dois sistemas de xícara com cada um contendo material de hospedeiro terminal fresco e larvas. (B) A temperatura nos copos é mantida entre 25 °C-28 °C para atividade larval ideal e desenvolvimento por luzes de fixação aéreas com lâmpadas incandescentes de 40 W. (C)Um termômetro de monitoramento de memória rastreável com o sensor de temperatura colocado diretamente em um copo é usado para monitorar a temperatura. Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 7: Câmaras de pupação preparadas. (A)Copos de porção de plástico individual alojados nas bandejas de copos de plástico transparente. (B)Um quadrado de papel ondulado é colocado em cada xícara de porção de plástico. (C) Uma única larva madura será colocada em cada copo de porção de plástico preparado para pupato. Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 8: Preparando larvas para pupação e manutenção pupal. (A) Larva madura pronta para filhote em papel ondulado. É um uniforme maçante verde-marrom e perdeu qualquer chevrons. (B)Câmaras de pupação prontas para receber larvas maduras adjacentes a copos com larvas de alimentação. Todas as câmaras de pupação com larvas casa de tampas que estão se preparando para pupa. (C) Câmaras de pupação com pupas. (D) Bancos de câmaras de pupação com pupas organizadas por data e mantidos em condições laboratoriais. Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 9: Gaiola de emergência laboratorial. (A)Uma gaiola de criação de malha dobrável que abriga as câmaras de pupação ocupadas. (B)As tampas de todas as câmaras de pupação são removidas para facilitar a eclosão adulta bem sucedida. (C) Todas as borboletas adultas viáveis resultantes serão lançadas na gaiola de voo exibida para garantir uma cópula bem sucedida. Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 10: Borboleta macho adulta se aproximando com sucesso de pupa em um quadrado de papel ondulado. (A)Adulto se aproximando de pupa. (B)Adulto totalmente removido do invólucro pupal. (C) Adulto posicionado para expandir suas asas. (D)Adulto expandindo suas asas. Clique aqui para ver uma versão maior deste valor.

Figura Suplementar 11: Quinta larva instar marcada com tinta luminosa não tóxica. (A)Uma pequena gota de tinta luminosa vermelha e não tóxica contrastante é colocada no dorsum usando um pincel para marcar com sucesso a larva. Clique aqui para ver uma versão maior deste valor.

Figura Complementar 12: Criação de configuração para estudo de história da vida. (A)Exclusivamente rotulados copos de porção de plástico transparente de 2 onças. (B)Uma única larva é seqüerapada em cada xícara. (C) Todas as larvas são rastreadas individualmente em todos os estágios de desenvolvimento, do neonato a borboleta adulta. Clique aqui para ver uma versão maior deste valor.
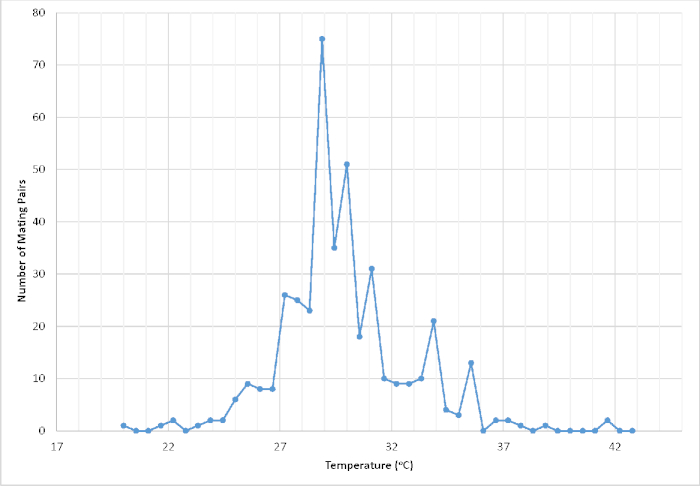
Figura 1: Número de pares registrados em copula com base na temperatura (°C) dentro de uma gaiola de voo rastreada e exibida abrigada em uma estufa controlada pela temperatura. A temperatura foi registrada nos primeiros 2 minutos de um evento de pareamento bem sucedido (n = 411). Os dados resultantes foram usados para ajudar a refinar as condições ambientais controladas, a fim de maximizar o sucesso do acasalamento e, finalmente, a produtividade geral da propagação em cativeiro. Clique aqui para ver uma versão maior deste valor.

Figura 2: Tempo médio de desenvolvimento (número de dias) de cada fase de vida imatura. (A) As barras mostram a média de cada grupo, e as barras de erro representam os valores de desvio padrão superior e inferior para cada grupo. (B)As barras azuis escuras representam fêmeas, e azul claro representam machos. Clique aqui para ver uma versão maior deste valor.
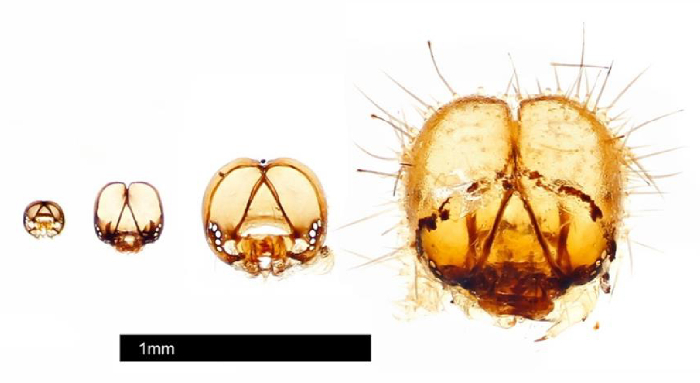
Figura 3: Cápsulas de cabeça coletadas de #25 individuais usando protocolo de história da vida. Cápsulas de cabeça foram fotografadas por Johnathan Bremer usando um sistema de automontagem. Clique aqui para ver uma versão maior deste valor.
| Fase da vida | Comprimento médio do corpo (mm) | Erro de Std. (comprimento) | Tempo médio de desenvolvimento (num. dias) | Erro de Std. (tempo de v. ) |
| Instar I | 1.69478261 (n=23) | 0.02152643 | 2.90625 (n=32) | 0.08229783 |
| Instar II | 2.77248958 (n=32) | 0.04302826 | 3.375 (n=32) | 0.16649857 |
| Instar III | 5.45751042 (n=32) | 0.12120829 | 3.5 (n=32) | 0.20080483 |
| Instar IV | 10.2369688 (n=32) | 0.23653991 | 3.875 (n=32) | 0.18917265 |
| Instar V | 8,7625 (n=2) | 2.6125 | 1.5 (n=2) | 0.5 |
| Instar VI | 10.2666667 (n=1) | NA | 3 (n=1) | NA |
| Pré-pupa | 11.0858333 (n=24) | 0.23948251 | 2,9375 (n=32) | 0.21504641 |
| Pupa | 9.0316129 (n=31) | 0.12106792 | 11.6578947 (n=38) | 0.3272288 |
Tabela 1: Comprimento médio e tempo de desenvolvimento de cada fase de vida. Erro padrão incluído para cada variável e tamanho da amostra em parênteses.
| Fase da vida | Comprimento médio do acorde da asa (mm) | Erro de DST |
| Adulto | 12.63895 (n=38) | 0.1365516 |
| Fêmea | 12.960 (n=13) | 0.1465588 |
| Masculino | 12.472 (n=25) | 0.1863205 |
Tabela 2: Comprimento médio do acorde das asas para borboletas adultas. Inclui meios para mulheres, machos e todos os adultos (ambos os sexos combinados).
| Modelo LM 1 | Erro de estimativa do Std. | t valor | p-valor |
| Interceptar | 1.9179 | 3.128 | 0.0046 ** |
| Avg. comprimento segunda instar | 0.6822 | -1.11 | 0.278 |
| Avg. comprimento terceira instar | 0.2928 | 0.476 | 0.6381 |
| Avg. comprimento quarta instar | 0.1373 | -0.57 | 0.5739 |
| Pupae de comprimento avg. | 0.246 | 3.957 | 0.0005 *** |
| p < 0,001; ** p < 0,01; * p < 0,05. | |||
Tabela 3: Tabela de coeficientes para modelo de regressão linear (LM Modelo 1) para avaliar relação entre o comprimento médio de cada fase de vida (n > 30 incluídos na análise) e comprimento do acorde da asa adulta. Variável dependente: comprimento do acorde da asa adulta (mm).
| Coeficientes | Erro de estimativa do Std. | t valor | Pr (>|t|) |
| Interceptar | 1.7091 | 3.031 | 0.0053 ** |
| Pupae de comprimento avg. | 0.1878 | 4.414 | 0.0002 *** |
Tabela 4: Regressão stepwise (Stepwise 1). Variável dependente: comprimento do acorde da asa adulta (mm).
| Modelo LM 2 | Erro de estimativa do Std. | t valor | p-valor |
| Interceptar | 1.1888 | 12.643 | 4.21e-12 *** |
| Num. dias primeira instar | 0.3486 | 0.937 | 0.3583 |
| Num. dias segunda instar | 0.2603 | -0.686 | 0.4993 |
| Num. dias terceira instar | 0.2281 | 1.028 | 0.3141 |
| Num. dias quarta instar | 0.2048 | 2.378 | 0.0257 * |
| Num. dias pré-pupae | 0.222 | 1.133 | 0.2686 |
| Num. dias pupae | 0.2495 | 0.616 | 0.5435 |
| Total de num. dias | 0.1913 | -1.454 | 0.1589 |
| p < 0,001; ** p < 0,01; * p < 0,05. | |||
Tabela 5: Tabela coeficientes para modelo de regressão linear (LM Model 2) para avaliar relação entre tempo de desenvolvimento e comprimento do acorde da asa adulta. Variável dependente: comprimento do acorde da asa adulta (mm).
| Coeficientes | Erro de estimativa do Std. | t valor | p-valor |
| Interceptar | 0.89304 | 16.314 | 7.86e-16 *** |
| Num. dias segunda instar | 0.17974 | -1.809 | 0,0811 • |
| Num. dias quarta instar | 0.16917 | 2.075 | 0.0473 * |
| Total de num. dias | 0.04184 | -1.787 | 0,0848 • |
| p < 0,001; ** p < 0,01; * p < 0,05; • p < 0.1 | |||
Tabela 6: Regressão stepwise (Stepwise 2) para o tempo de desenvolvimento. Variável dependente: comprimento do acorde da asa adulta (mm).
Discussão
Aqui, ilustramos a eficácia deste protocolo comprovado de reprodução de conservação ex situ para a produção em massa de borboletas em risco, e como ele pode ser adaptado para pesquisas científicas para ajudar a enfrentar as principais lacunas comportamentais, histórico de vida ou dados ecológicos. Maior compreensão do tempo médio de desenvolvimento total (ovo para adulto), duração média em cada fase de vida, e temperatura ideal para acasalamento, por exemplo, foram usados para ajudar a refinar o protocolo e melhorar o sucesso geral do programa. A grande maioria dos protocolos existentes detalha apenas métodos de criação de organismos e não discute coleta de dados, pesquisa científica ou o uso desses resultados para ajudar a informar e potencialmente adaptar métodos ex situ.
Este protocolo requer a criação diária do organismo. A saúde e a produtividade do organismo são maximizadas pelas condições de limpeza da criação, falta de superlotação de organismos e pela disponibilidade de material de planta de hospedeiro larval de alta qualidade. Na maioria das vezes, utilizamos suprimentos e recipientes descartáveis de criação (por exemplo, papel e copos plásticos), e normalmente os substitui regularmente, muitas vezes diariamente, e nunca reutilizamos o material. Isso é econômico e minimiza a necessidade de mais saneamento intensivo de materiais. Ferramentas comumente utilizadas, no entanto, como fórceps entomológicos, pincéis de tinta aquarela e pequenas gaiolas de voo pop-up, bem como todas as superfícies de criação, como mesas e topos de banco de laboratório, são regularmente higienizadas usando uma solução alvejante de 5%. O cronograma exato do saneamento é altamente dependente da frequência de uso, fenologia do organismo e outras variáveis, e deve ser adaptado às necessidades específicas de cada programa ex situ. Além disso, descobrimos que o papel de açougueiro branco é útil para cobrir todas as superfícies de criação. Ele fornece um substrato limpo barato e facilmente implantável, e a cor branca de fundo facilita o avistamento de quaisquer organismos perdidos. Para a criação diária, todo o pessoal do laboratório deve sempre usar luvas descartáveis de exame laboratorial para minimizar a contaminação e proteger o pessoal de qualquer potencial irritação da pele resultante do manuseio de plantas ou organismos. Isso é particularmente crítico se algum pessoal de laboratório tem animais domésticos que requerem tratamentos tópicos com pulgas. Mesmo uma pequena quantidade de resíduo de ingrediente ativo pode ser perigosa para o gado em cativeiro.
Além disso, deve-se tomar cuidado para minimizar a superlotação do organismo. A superlotação das larvas pode rapidamente levar à redução da saúde do organismo e até mesmo ao canibalismo em determinadataxa, particularmente Lycaenidae. Separar regularmente larvas para reduzir o número dentro da criação de recipientes e/ou mesmo isolar larvas individuais como descrito na parte do histórico de vida do protocolo pode ser necessário. Os números ideais por contêiner podem variar consideravelmente com base no imposto específico e várias restrições do programa ex situ, como orçamento disponível, instalações laboratoriais e número total de pessoal da pecuária. Da mesma forma, recomendamos deixar espaço adequado entre copos que abrigam larvas para minimizar o potencial de movimento do organismo entre os recipientes. Por fim, para populações maiores em cativeiro, recomenda-se fortemente separar o estoque entre uma ou mais instalações laboratoriais. Essa estratégia de salvaguarda pode ajudar a minimizar a perda catastrófica de toda a população devido a doenças ou outros impactos imprevistos.
A qualidade e a disponibilidade das plantas hospedeiras larvais impulsionam a produção e influencia fortemente tanto as taxas de desenvolvimento larval quanto a saúde geral da população. No entanto, poucos relatórios ou estudos publicados destacam essa exigência dos bastidores ou discutem as melhores práticas de berçário. O planejamento bem-sucedido do programa Ex Situ deve responder por quantidades adequadas, produção e manutenção da planta. Como muitas larvas também requerem ou preferem certas partes vegetais (por exemplo, novo crescimento terminal, botões de flores e inflorescências, frutas, etc.), uma encenação eficaz para garantir que a fenologia vegetal apropriada seja necessária.
Considerações adicionais incluem manejo demográfico e genético adequado, e a minimização de quaisquer potenciais efeitos negativos do cativeiro. Recomendamos o desenvolvimento de um plano de gestão genética. Isso pode incluir estratégias para incluir a infusão de novos materiais genéticos regularmente, maximizar a diversidade e prevenir a endogamia próxima, avaliar periodicamente as variáveis chave de aptidão do organismo e monitorar a genética em algum nível para permitir a comparação com populações existentes e verificar a saúde do estoque em cativeiro. A comparação periódica das características dos indivíduos cativos com indivíduos das populações fundadoras também é justificada34,35.
Esses protocolos representam as melhores práticas comprovadas. Eles devem ser benéficos para uma variedade de pesquisadores e praticantes de conservação que podem aplicar ou adaptar diretamente nossos métodos a seus próprios estudos e ex situ em risco programas de conservação e recuperação de insetos. O protocolo específico de reprodução cativa delineado é provavelmente mais aplicável a programas focados em outros Lycaenidae, taxa relacionada ou taxa de menor porte. No entanto, inúmeros componentes como aqueles que envolvem garantir namoro e cópula bem-sucedidos, manutenção adulta com néctar artificial, maximização da oviposição e cuidados larvais gerais poderiam, sem dúvida, ser mais amplamente aplicados ou adaptados a uma matriz mais ampla de taxa. Como mencionado anteriormente, embora a flexibilidade do protocolo deva ser enfatizada, o acesso a outras metodologias estabelecidas pode ajudar a fornecer uma visão valiosa e um ponto de partida viável para adaptação e inovação. Os métodos apresentados para avaliar várias características do histórico de vida, como o tempo de desenvolvimento larval e o número de estádios larvais, sem dúvida, tem ampla aplicabilidade a outros programas de conservação e taxa de risco. Encorajamos outros a ajudar a resolver as principais lacunas de dados ecológicos quando possível e a publicar protocolos e resultados do programa vetados.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado por subsídios da Iniciativa de Recuperação de Conservação do Serviço de Pesca e Vida Selvagem dos EUA (F17AP00467) e do Disney Conservation Fund. O apoio adicional foi fornecido pelo Museu de História Natural da Flórida e pelo Departamento de Entomologia e Nematologia da Universidade da Flórida.
Materiais
| Name | Company | Catalog Number | Comments |
| 12 oz plain white paper cups (Karat) | Lollicup | C-KC16 | |
| 15-Amp 2-Outlet Mechanical Residential Plug-in Countdown Lighting Timer | Lowes | UTTNI2423 | |
| 1ml sub-Q syringes (0.45 mm x 16 mm) | Fisher Scientific | 14-829-10F | |
| 2 oz clear plastic portion cup lids | Party City | #791091 | |
| 2 oz Clear Plastic Portion Cups | Party City | #791088 | |
| 34.29 cm x 34.29 cm x 60.96 cm collapsible mesh popup rearing cage | Bioquip | 1466BV | |
| 8.5" 1-Watt Incandescent Clamped Work Light | Lowes | PTC301L | |
| Adoric Electronic Digital Caliper | Amazon.com | B07QX2SK2F | |
| Big Kid's Choice Arts & Crafts Brush Set-12/Pkg, assorted sizes | Walmart | #10965135 | |
| Clear Plastic Cup Tray | Frontier Scientific Services | AG_9040 | |
| Fisher Scientific traceable memory monitoring thermometer | Fisher Scientific | 15-077-8D | |
| Forceps, Straight Points, Swiss Style #4, Stainless | BioQuip | 4531 | |
| Humco Glycerin 6 oz | Walmart | #303951037966 | |
| Luminous Paint Kit, Blue, Red, Yellow, 4 Dram | Bioquip | 1166A | |
| Melon flavored Gatorade Fierce Thirst Quencher or fruit punch flavored Gatorade Thirst Quencher sports drink | Walmart | #568456137 | |
| Neoteck Digital 2 in 1 Hygrometer-Thermometer | Amazon.com | NTK026 | |
| Olympus 0.6 ml Microtubes, Clear, Polypropylene, Nonsterile | Amazon.com | 24-272C | |
| Plastic Tank Sprayer | Lowes | #5318 | |
| Q-tips Cotton swabs | Walmart | #551398298 | |
| Rectangular plastic tupperware container with lid (Rubbermaid) | Walmart | #554320171 | |
| Showgard 903 Stamp Tongs, 4 5/8 inch Spade Tip | Amazon.com | #787793151378 | |
| Single face corrugated paper roll | Amazon.com | BXSF12 | |
| Snap blade utility knife | OLFA | #5023 | |
| Solo 9 oz plastic cups | Solo | SQ950 | |
| Thorton Plastics 50 dram clear plastic snap cap vial (6.25 oz.) | Thorton Plastics | #50 | |
| Tulle Spool 9 inch x 150 feet - Black | Jo Ann Fabrics | #16029696 | |
| Zep 32 oz Plastic Spray Bottle | Lowes | HDPRO36 |
Referências
- Thomas, J. A. Butterfly communities under threat. Science. 352 (6296), 216-218 (2016).
- Swengel, S. R., Schlicht, D., Olsen, F., Swengel, A. B. Declines of prairie butterflies in the Midwestern USA. Journal of Insect Conservation. 15 (1-2), 327-339 (2011).
- Habel, J. C., et al. Butterfly community shifts over two centuries. Conservation Biology. 30 (4), 754-762 (2016).
- Gilburn, A. S., et al. Are neonicotinoid insecticides driving declines of widespread butterflies? Peer J. 3, e1402(2015).
- Sánchez-Bayo, F., Wyckhuys, K. A. G. Worldwide decline of the entomofauna: A review of its drivers. Biological Conservation. 232, 8-27 (2019).
- Daniels, J. C., Magdich, M., Tolson, P. Butterfly recovery planning: Determining how to contribute. Butterfly Conservation in North America: Efforts to Help Save Our Charismatic Microfauna. Daniels, J. C. , Springer Science+Business Media B.V. New York. 1-21 (2015).
- U.S. Fish and Wildlife Service. Environmental Conservation Online System. Listed Animals. , https://ecos.fws.gov/ecp (2019).
- Schultz, C. B., Russell, C., Wynn, L. Restoration, reintroduction and captive propagation efforts for at-risk butterflies: a review. Israel Journal of Ecology and Evolution. 54, 41-61 (2008).
- Grow, S., Allard, R., Luke, D. The role of AZA-accredited zoos and aquariums in butterfly conservation. Butterfly Conservation in North America: Efforts to Help Save Our Charismatic Microfauna. Daniels, J. C. , Springer Science+Business Media B.V. New York. 23-34 (2015).
- Crone, E. E., Pickering, D., Schultz, C. B. Can captive rearing promote recovery of endangered butterflies? An assessment in the face of uncertainty. Biological Conservation. 139, 103-112 (2007).
- Sanchez, S. J., Daniels, J. C. The butterfly conservation initiative: Developing a new conservation vision through compound eyes. News of the Lepidopterists' Society. 49 (3), 75-77 (2007).
- Wardlaw, J. C., Elmes, G. W., Thomas, J. A. Techniques for studying Maculinea butterflies: I. Rearing Maculinea caterpillars with Myrmica ants in the laboratory. Journal of Insect Conservation. 2 (1), 79-84 (1998).
- Mattooni, R., Longcore, T., Krenova, Z., Lipman, A. Mass rearing the endangered Palos Verdes blue butterfly (Glaucopsyche lygdamus palosverdesensis:Lycaenidae). Journal of Research on the Lepidoptera. 37, 55-67 (1998).
- Pearce-Kelly, P., et al. The captive rearing of threatened Orthoptera: a comparison of the conservation potential and practical considerations of two species' breeding programmes at the Zoological Society of London. Journal of Insect Conservation. 2 (3-4), 201-210 (1998).
- Wells, C. N., Edwards, L., Hawkins, R., Smith, L., Tonkyn, D. A rearing method for Agrynnis (Speyeria) diana (Lepidoptera: Nymphalidae) that avoids diapause. Psyche. , 1-6 (2011).
- Grosboll, D. N. Captive Rearing the Endangered Mardon Skipper (Polites mardon) and Taylor's Checkerspot (Euphydryas editha taylori) Butterflies: Initial Results (Lepidoptera, Nymphalidae). Proceedings of the species at risk, pathways to recovery conference. , Species at Risk Pathways to Recovery Conference Organizing Committee. Victoria. 1-6 (2004).
- Barclay, E., Arnold, M., Andersen, M., Shepherdson, D. Husbandry manual: Taylor's checkerspot (Euphydryas editha taylori). , 1st edition, Oregon Zoo. Portland, Oregon. (2009).
- Johnson, J., et al. Captive Rearing of the Laguna Mountains Skipper (Pyrgus ruralis laguanae): Final Report. , (2010).
- Linders, M. Captive rearing and translocation of Taylor's checkerspot in South Puget Sound: 2011-2012. 2012 Annual Progress Report to the ACUB Technical Review Committee. , (2012).
- Linders, M., Lewis, K. Captive rearing and translocation of Taylor's checkerspot butterfly (Euphydryas editha taylori.): South Puget Sound, Washington, 2012–2013. 2013 Annual Report to the US Fish and Wildlife Service (Cooperative Agreement F12ACI00835), Joint Base Lewis-McChord Fish and Wildlife Program and JBLM-ACUB Technical Review Committee. , (2013).
- Department of Conservation and Research, Toledo Zoo. Propagation Handbook for the Karner Blue Butterfly Lycaeides melissa samuelis. , Fourth edition, (2006).
- Johnson, J. J., et al. Captive Rearing of Lange's Metalmark Butterfly, 2011-2015. United States Fish and Wildlife Service, CVPIA Habitat Restoration Program (F11AP00168). , (2016).
- Andersen, M. J., et al. Oregon Silverspot Butterfly Husbandry Manual. , Oregon Zoo. Portland, Oregon. (2010).
- Washington Department of Fish and Wildlife. Threatened and Endangered Wildlife in Washington: 2012 Annual Report. Listing and Recovery Section, Wildlife Program, Washington Department of Fish and Wildlife. , Olympia. (2013).
- McGowan, P. J. K., Traylor-Holzer, K., Leus, K. IUCN guidelines for determining how ex situ management should be used in species conservation. Conservation Letters. 10 (3), 361-366 (2017).
- Pearce-Kelly, P., et al. The conservation value of insect breeding programmes: Rationale, evaluation tools and example programme case studies. Insect Conservation Biology: Proceedings of the Royal Entomological Society's 23nd Symposium. Stuart, A. J. A., New, T. R., Lewis, O. T., et al. , 57-75 (2007).
- U.S. Fish and Wildlife Service. Policy Regarding Controlled Propagation of Species Listed Under the Endangered Species Act. United States Federal Register. 65 (183), 56916-56922 (2000).
- IUCN/SSC. Guidelines on the use of ex situ management for species conservation. Version 2.0. IUCN Species Survival Commission. , Gland, Switzerland. (2014).
- Sutherland, W. J., Pullin, A. S., Dolman, P. M., Knight, T. M. The need for evidence-based conservation. Trends in Ecology & Evolution. 19 (6), 305-308 (2004).
- Daniels, J. C., Nordmeyer, C., Runquist, E. Improving standards for at-risk butterfly translocations. Diversity. 10, 67(2018).
- Saarinen, E. V. Population genetics of the endangered Miami blue butterfly Cyclargus thomasi bethunebakeri.: implications for conservation. , University of Florida. Gainesville. (2009).
- Becker, T. Propagation and repatriation of the regal fritillary butterfly. , http://titag.org/2016/2016papers/beckerregal.pdf (2019).
- R Core Team. R A Language and Environment for Statistical Computing. R Foundation for Statistical Computing. , Vienna, Austria. (2016).
- Schultz, C. B., Dzurisin, J. D., Russell, C. Captive rearing of Puget blue butterflies (Icaricia icarioides blackmorei) and implications for conservation. Journal of Insect Conservation. 13 (3), 309-313 (2009).
- Frankham, R., Loebel, D. A. Modeling problems in conservation genetics using captive Drosophila populations: Rapid genetic adaptation to captivity. Zoo Biology. 11 (5), 333-342 (1992).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados