Method Article
Analyse der Durchlässigkeit der Blut-Hirn-Barriere durch mikrobielle Traversale durch mikrovaskuläre Endothelzellen
In diesem Artikel
Zusammenfassung
Die menschliche Blut-Hirn-Schranke verhindert selektiv das Eindringen hydrophiler Moleküle und Krankheitserreger in das Gehirn. Mehrere Pathologien, einschließlich Meningitis und postoperatives Delirium, sind mit einer erhöhten Durchlässigkeit der Blut - Hirn-Schranke verbunden. Hier beschreiben wir ein Endothelzellkulturmodell, um die Barrieredurchlässigkeit durch mikrobielle Traversal zu testen.
Zusammenfassung
Die menschliche Blut-Hirn-Schranke (BBB) zeichnet sich durch eine sehr geringe Durchlässigkeit für Biomoleküle aus, um den Stoffwechsel des Gehirns zu schützen und zu regulieren. Die BBB besteht hauptsächlich aus Endothelzellen, die in Kollagen IV und fibronectinreichen Kellermembranen eingebettet sind. Mehrere Pathologien resultieren aus einer Dysfunktion der BBB gefolgt von mikrobiellen Traversal, verursacht Krankheiten wie Meningitis. Um die Wirkung mehrerer Parameter, einschließlich verschiedener Medikamente und Anästhetika, auf die Durchlässigkeit des BBB zu testen, haben wir ein neuartiges menschliches Zellkulturmodell etabliert, das das BBB mit mikrovaskulären Endothelzellen des menschlichen Gehirns imitiert. Die Endothelzellen werden bis zum Zusammenfluss auf Kollagen IV und Fibronectin-beschichteten Filtereinheiten angebaut und können dann mit unterschiedlichen Verbindungen von Interesse behandelt werden. Um eine mikrobielle Traversal zu demonstrieren, wird die obere Kammer mit der apikalen Oberfläche der Endothelzellen mit Bakterien geimpft. Nach einer Inkubationszeit werden Proben der unteren Kammer auf Agarplatten plattiert und die erhaltenen Kolonien gezählt, wobei die Anzahl der Kolonien mit der Durchlässigkeit der BBB korreliert. Endogene zelluläre Faktoren können in diesem experimentellen Aufbau analysiert werden, um grundlegende zelluläre Mechanismen der Endothelzellen, die zum BBB beitragen, aufzuklären. Darüber hinaus ermöglicht diese Plattform die Durchführung eines Bildschirms für Verbindungen, die die Durchlässigkeit der Endothelzellen beeinflussen könnten. Schließlich kann die bakterielle Durchquerung untersucht und mit verschiedenen Pathologien wie Meningitis in Verbindung gebracht werden. Es könnte möglich sein, das Modell zu erweitern und die Wege der Bakterien durch die BBB zu analysieren. In diesem Artikel stellen wir ein detailliertes Protokoll der beschriebenen Methode zur Untersuchung der Durchlässigkeit der BBB zur Verfügung.
Einleitung
Die menschliche BBB ist eine einzigartige Grenze des Gehirngewebes, die das Gehirn vom Blut trennt. Es reguliert streng den Durchgang von größeren und hydrophilen Molekülen, blockiert die parazelluläre Diffusion und hält die Homöostase des Gehirns aufrecht. Es schützt auch das Gehirn vor Plasmaschwankungen, Toxinen, Mikroben, und leitet entzündliche Zellen als Teil des zentralen Nervensystems (ZNS) Immunität. Seit seiner Entdeckung vor einem Jahrhundert1wurden viele Studien durchgeführt, um die Struktur und Funktion des BBB zu verstehen. Die komplexen Wechselwirkungen von Zellen, Proteinen und Signalen aus Gehirn und Blut erfordern noch weitere Untersuchungen und Modelle.
Das menschliche BBB besteht aus drei Zelltypen: mikrovaskuläre Endothelzellen (BMECs), Pericyten und Astrozyten2,3. Die BMECs unterscheiden sich von der Mehrheit der Endothelzellen im Körper dadurch, dass sie eine hohe Anzahl von engen Knoten besitzen und Verbindungen4, niedrige pinozytotische Aktivität2,5, und eine kontinuierliche Kellermembran6,7, um parazelluläre Diffusion zu blockieren. Kleine lipophile Moleküle können diffundieren und die BBB nach ihrem Konzentrationsgradienten passieren; größere und hydrophile Moleküle gelangen oder verlassen das Gehirn nur durch polarisierte, exprimierte selektive Transportsysteme8. Diese Regelung führt zu einem hohen transendothelialen elektrischen Widerstand (TEER) von 1.500-2.000 x2, der umgekehrt mit der Durchlässigkeitkorreliert 9,10. Obwohl BMECs eine enge Barriere bilden, können sie auf lokale und periphere Signalereagieren 11,12. Es besteht eine enge Wechselwirkung zwischen BMECs und Astrozyten13; die Astrozyten-Endfüße bauen eine Schicht um die Gefäße und induzieren die Bildung von engen Kreuzungen13,14. Sie sind an der BBB-Reifung mit verschiedenen Faktoren beteiligt, einschließlich transformierender Wachstumsfaktor --15,16. Darüber hinaus spielen Pericyten eine Schlüsselrolle bei der Regulation der Angiogenese17 und der Verhinderung der Apoptose des Endothels bei der zellulären Differenzierung18 (Abbildung 1). Sie sind in die Kellermembran eingebettet und sorgen für strukturelle Stabilität der Gefäßwand19.
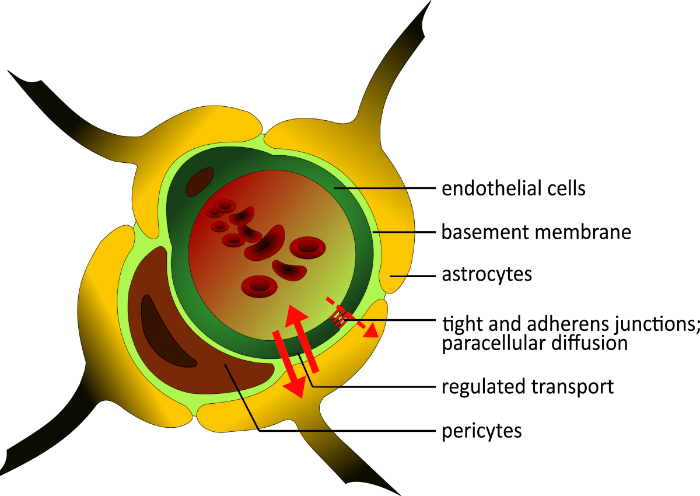
Abbildung 1: Schematische Struktur der Blut- und Hirnschranke. Die einzigartige Struktur des menschlichen BBB besteht aus drei verschiedenen Zelltypen. Das Mikrogefäßlumen ist von Endothelzellen umgeben, die in engen Kreuzungen angereichert sind und nicht fenestiert sind. Sie sind in die Kellermembran eingebettet, wie die Pericyten. Diese Zellen sind wichtig für die strukturelle Stabilität der Gefäßwand und spielen eine Rolle bei der Entwicklung der BBB neben den Astrozyten. Ihre Endfüße bilden eine enge Schicht um das Schiff und unterstützen den Bau von engen Kreuzungen. Alle Komponenten des BBB sind wichtig für die physiologische Funktionalität. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Viele verschiedene Pathologien stehen im Zusammenhang mit dem Zusammenbruch des BBB (z.B. septische Enzephalopathie). Die betroffenen Patienten haben den Proteinspiegel in der Zerebrospinalflüssigkeit20erhöht, und das Hirnparenchym bei betroffenen Nagetieren zeigt eine erhöhte Aufnahme von ausgeprägtem kolloidalem Eisenoxid und Aminosäuren21,22. Diese Ergebnisse deuten auf eine erhöhte Durchlässigkeit der BBB hin, die zusammen mit einer erhöhten Pinozytose in BMECs21 und endotheliale Aktivierung23auftritt. Eine weitere assoziierte Pathologie im Zusammenhang mit einer veränderten BBB ist Meningitis, ein medizinischer Notfall und eine komplexe Entzündung begleitet mit Hirnödem, die zum neuronalen Zelltod führen kann. Die primäre Einfahrtsstelle der zirkulierenden Bakterien sollen die Mikrogefäße24sein; die BBB verhindert jedoch das Eindringen von Bakterien. Die Durchlässigkeit der BBB ist nicht immer mit einer Zunahme der experimentellen hämatogenen Meningitis25 verbunden und die Mechanismen können multifaktoriell sein. Die Koinzidenz der Sepsis mit dem postoperativen Delirium (POD)26 und die Assoziation mit präoperativen Infektionen27,28 zeigt die Notwendigkeit eines BBB-Modells, das es der direkten Exposition gegenüber Bakterien ermöglicht, ein besseres Verständnis für bakterielle Pathogenese zu erhalten.
Es gibt viele Lücken im Verständnis und der Quantifizierung der mikrobiellen Traverse durch die BBB. Daher haben wir ein Modell entwickelt, das eine bequeme Prüfung verschiedener Faktoren und Bedingungen mit einer direkten Korrelation zwischen bakteriellem Durchqueren und Einflüssen auf die Durchlässigkeit des BBB ermöglicht. Frühere Arbeiten konzentrierten sich auf die parazelluläre Durchlässigkeit und umfassten TEER-Messungen und Tracer-Fluss. Darüber hinaus wurde der Makromolekültransport durch konjugierte Moleküle oder Antikörper analysiert, wobei verschiedene Modelle mit ausschließlich Endothelzellen oder Kombinationen mit Astrozyten und Pericyten entwickelt wurden. Aufgrund der Schwierigkeit, regelmäßig menschliches Gewebe zu erhalten, werden viele tierbasierte Modelle verwendet. Hirnendothelzellen aus Rinder- und Schweineherkunft bilden enge Monolayer mit einem hohen TEER, bilden eine gut geformte apikal-basale Polarität und eignen sich für Untersuchungen des kleinen Molekültransports durch das BBB. Die Proteine unterscheiden sich in der Reihenfolge von ihren menschlichen Homologen29,30, was die Untersuchung von therapeutischen Antikörpern erschwert. Aus diesem Grund können murine oder menschliche Kulturmodelle vorzuziehen sein. Maus oder Ratten als Probenquellen haben den Vorteil, dass sie von gut charakterisierten Arten gewonnen werden, aber nur wenige Zellen für Studienzwecke ergeben. Dies kann durch die Verwendung von verewigten Maus Gehirn Endotheliom (END) Zelllinien bEND.3, bEND.5 oder cEND31,32,33umgangen werden.
Primäre kultivierte Zellen aus menschlichem Gewebe sind schwer zu erhalten und regelmäßig zu handhaben. Daher sind die meisten menschlichen Zellmodelle, die in der Forschung zur Untersuchung der menschlichen BBB verwendet werden, verewigte Endothelzelllinien. Eine veröffentlichte Zelllinie ist die menschliche zerebrale mikrovaskuläre Endothelzelllinie hCMEC/D3, die sich gut für die Untersuchung der Arzneimittelaufnahme eignet und leicht zu handhaben ist. Die Zellen bilden eine Monoschicht und exprimieren die charakteristischen engen Knotenproteine der BBB34, während der Expressionsgrad von Claudin-5 niedriger ist als in intakten Mikrogefäßen35 und viele spezifische Transporter auf Transkriptsebene36 sowie in proteomischen Studien34nachgewiesen wurden. Ein relativ niedriger TEER im Bereich von 30-50 x2 ist immer noch eine Herausforderung37. Eine weitere Quelle für Endothelzellen des Gehirns sind menschliche pluripotente Stammzellen (hPSCs)38 und menschliche Nabelschnurblut-abgeleitete Stammzellen zirkulierender endotheliale Vorläufer und hämatopoetische Linien39,40. Beide Differenzierungsprotokolle führen zu engen Zellmonolayern und hohen TEER-Werten (z.B. 1.450 x2 in Kokulturen)38. Diese Stammzellmodelle erfordern eine extreme Pflege für die Kultivierung, bieten aber die Möglichkeit, den Einfluss von regulierenden Hormonen41 oder Krankheiten mit genetischem Hintergrund42 auf die BBB-Entwicklung zu untersuchen.
In dieser Studie haben wir eine verewigte transfizierte mikrovaskuläre Endothelzelllinie des menschlichen Gehirns, THBMEC43, eingerichtet, um die BBB nachzuahmen und bakterielle Traversal zu untersuchen. Zellen werden auf einem Filter gesät und in diesem Zellkulturmodell zu 100 % Konfluenz angebaut. Bakterien werden im oberen Teil der Zellkulturkammer geimpft. Wir verwenden Escherichia coli (E. coli) in unserer Probenstudie wegen der hohen Inzidenz von E. coli Meningitis44. Es hat sich gezeigt, dass die niedrigste Permeabilität der Zellmonolayer zwischen Tag 13 und Tag 15 nach der Aussaat45auftritt. Daher wird die Behandlung der THBMEC-Monoschicht nach dieser Zeit durchgeführt und Bakterien anschließend im Medium auf der apikalen Oberfläche der Monoschicht geimpft. Nach einer Inkubationszeit werden Bakterien, die die Barriere überqueren konnten, über Beschichtungsmedium mit den Bakterien auf Agarplatten quantifiziert und die Kolonien gezählt. Eine erhöhte Anzahl von Kolonien korreliert mit höheren bakteriellen Traversen durch die BBB. Der TEER ist ca. 70 xcm 246. Es ist jedoch nicht erforderlich, den TEER in der beschriebenen Methode zu messen. Obwohl es ein etablierter Wert für die Durchlässigkeit der BBB ist, scheint es keinen Einfluss auf die Durchquerung von Bakterien durch die BBB zu haben. Unbehandelte Zellen dienen als Kontrolle der Dichtheit in unserem Modell. Es hat sich in früheren Arbeiten gezeigt, dass die Zellen in der Lage sind, auf proinflammatorische Zytokine zu reagieren und typische enge Knotenproteine auszudrücken47. Dies ermöglicht das Compound-Screening und die Validierung eines größeren Satzes von Transportersubstraten und Rezeptoren.
Protokoll
1. Herstellung von Puffer und Reagenzien
- 10x Phosphatpuffer-Salin (10x PBS) vorbereiten, indem Sie 80 g Natriumchlorid (NaCl), 2 g Kaliumchlorid (KCl), 14,4 g Dinatrium-Wasserstoff-Phosphat-Dihydrat (Na2HPO4 - 2H2O) und 2 g Kalium-Dihydrogenphosphat (KH2PO4) in einen 1 L-Glaskolben in 1 L doppeldestilliertem H2O hinzufügen. Autoklavdie 10x PBS-Lösung und verdünnen Sie 100 ml dieser Lösung in 900 ml doppelt destilliertem Wasser, um 1x PBS zu erhalten.
- Verwenden Sie den Autoklaven, um Lösungen zu sterilisieren. Den Glaskolben in den Korb geben, den Deckel schließen und 15 min bei 121 °C und 98,9 kPa sterilisieren.
HINWEIS: Dieses Protokoll wird immer für Autoklavierlösungen in weiteren Schritten verwendet.
- Verwenden Sie den Autoklaven, um Lösungen zu sterilisieren. Den Glaskolben in den Korb geben, den Deckel schließen und 15 min bei 121 °C und 98,9 kPa sterilisieren.
- Bereiten Sie eine 10-g/ml-Kollagen-IV- und 10-ml-Fibronectin-Lösung vor, indem Sie 0,5 mg/ml Fibronectin-Lösung und die 0,3 mg/ml-Kollagen-IV-Lösung mit jeweils 1x PBS bis 100 mg/L Aliquots in 1,5 ml Mikroröhren verdünnen. Danach 100 l beider Aliquots mit 1.800 l 1x PBS in 2 ml Mikroröhren mischen und bei -20 °C lagern.
- Bereiten Sie DMEM/F-12 medium vor, indem Sie 4% fetales Rinderserum und 2 mM L-Glutamin und 100 mg/L Penicillin/Streptomycin auf das Medium aufbewahren und bei 4 °C aufbewahren.
- 1x Trypsin-EDTA-Lösung vorbereiten, indem Sie 5 ml der 10x konzentrierten Trypsin-EDTA-Lösung mit 45 ml 1x PBS in einem 50 ml-Rohr verdünnen und bei 4 °C lagern.
- Bereiten Sie 500 ml LB Medium vor, indem Sie 10 g LB-Brühebasis in einem 500 ml Glaskolben wiegen. Fügen Sie 500 ml sterilisiertes Wasser hinzu und autoklavieren Sie es.
- Bereiten Sie LB Agar vor, indem Sie 10 g LB-Brühebasis und 7,5 g Agar-Agar in einem 500 ml Glaskolben wiegen. 500 ml sterilisiertes Wasser vor dem Autoklavieren hinzufügen und den Deckel des Kolbens nicht schließen. Autoklav und lassen Sie die Lösung abkühlen, bis es warm ist.
- Bereiten Sie antibiotikafreies Medium vor, indem Sie 4% fetales Rinderserum und 2 mM L-Glutamin, aber kein Penicillin/Streptomycin zum DMEM/F-12-Medium zubereiten und es bei 4 °C wie in Schritt 1.3 aufbewahren.
2. Wachstum der Blut-Hirn-Schranke Imitieren von Zellen
- Um die 12 Brunnenplatte zu montieren, legen Sie die Zellkultureinsätze in die Brunnen (Abbildung 2A).
- Entpacken Sie die Platte und jeden Einsatz in einem biologischen Sicherheitsschrank und führen Sie dort weitere Schritte aus. Verwenden Sie sterilisierte Zangen, um den Einsatz an seiner breiten Basis zu greifen, um ihn zu bewegen.
- Beschichten Sie die poröse Membran jedes Inserts mit 90 l mit 10 g/ml Kollagen IV und 10 g/ml Fibronectin-Gemisch. Inkubieren Sie die 12 Wellplatte für 24 h bei 37 °C in einem Zellkultur-Inkubator (Abbildung 2B).
- Waschen Sie die Einsätze zweimal, indem Sie 1 ml 1x PBS in jeden Einsatz einleiten und die Lösung mit einer Vakuumpumpe für Zellkulturen aspirieren.
- Gleichgewichten Sie die Membranen, indem Sie 0,5 ml vorgewärmtes DMEM/F-12-Medium in der oberen und 1,5 ml in der unteren Kammer pipetieren. Inkubieren Sie die Platte 30 min bei 37 °C in einem Zellkultur-Inkubator mit 5%CO2-Atmosphäre (Abbildung 2C).
- Samen 2 x 105 menschliche mikrovaskuläre Endothelzellen in jede obere Kammer und inkubieren die 12 Wellplatte bei 37 °C in einem Zellkultur-Inkubator (Abbildung 2D).
- Das Medium mit einer Vakuumpumpe für Zellkulturen aus dem Zellkulturkolben absaugen und die Monoschicht waschen, indem man 10 ml 1x PBS pipetiert und die Lösung anschließend mit einer Vakuumpumpe ansaugt.
- Bedecken Sie die Zellen vollständig mit 1x konzentrierten Trypsin-EDTA, indem Sie 5 ml der Lösung in den Zellkulturkolben pipetieren. Inkubieren Sie den Kolben für 3-5 min bei 37 °C in einem Zellkultur-Inkubator.
HINWEIS: Wenn die Zellen nicht dissoziiert sind, tippen Sie fest auf den Kolben gegen die Handfläche, um die Zellen zu lösen. - Nehmen Sie 5 ml mit einer Pipette als Aliquot aus der Zellsuspension in einem 15 ml Rohr und fügen Sie 5 ml des FCS-haltigen Mediums hinzu, um die enzymatische Reaktion zu stoppen.
- Zentrifugieren Sie die Suspension für 3 min bei 210 x g, entfernen Sie den Überstand mit einer Vakuumpumpe und setzen Sie das Pellet in 5 ml Medium mit einer Pipette wieder auf.
- Verwenden Sie den Zellzähler, indem Sie 10 l der Zellsuspension mit 10 l 0,4% Trypan-Blaufleck in einem 1,5 ml Mikroröhrchen mischen. Fügen Sie 10 l des Gemischs in eine Zählkammerrutsche, legen Sie sie in den Zellzähler und beginnen Sie mit der Zählung.
- Konzentrieren Sie den Zähler auf die Zellen, sodass ihre Kante dunkelblau und das mittlere Weiß ist. Danach starten Sie das entsprechende Programm für die Zellzählung.
- Um das Volumen für jeden Einsatz zu berechnen, teilen Sie die erhaltenen 2 x 105 Zellen pro Einsatz mit der berechneten Konzentration der Zellsuspension.
3. Kultivierung des Blut-Hirn-Barrieremodells
- Die 12 Wellplatte 14 Tage lang bei 37 °C bebrüten.
- Ändern Sie 0,5 ml Medium für die obere Kammer und 1,5 ml Medium für die untere alle 2-3 Tage. Erwärmen Sie das Medium, bevor Sie es in den Zellkolben legen. Aspirat mit der Vakuumpumpe (Abbildung 2E).
HINWEIS: Arbeiten Sie sorgfältig, um zu vermeiden, dass die Membran berührt wird. - Überprüfen Sie den Status der Zellen, indem Sie sie mit einem Mikroskop abbilden und die Konfluenz bestimmen. Stellen Sie sicher, dass die Konfluenz nach 14 Tagen 100% beträgt.
4. Herstellung von Bakterien
- Einen Tag vor der Messung eine Kolonie des E. coli-Stamms GM2163 in lb Medium. Inkubieren Sie das Kulturrohr für 24 h bei 37 °C mit 180 U/min in einem Inkubationsshaker (Abbildung 2F).
- Kultivieren Sie den E. coli-Stamm auf einer LB-Agarplatte bei 4 °C. Nehmen Sie eine Kolonie mit einem sterilisierten Pick und legen Sie den Pick in die vorbereitete Kulturröhre mit 3 ml LB Medium.
- Bereiten Sie eine LB Agar Platte für jeden Einsatz mit warmer LB Agar Lösung und füllen Sie die Petri-Gerichte auf die Hälfte ihres Gesamtvolumens. Lassen Sie sie fest werden und lagern Sie sie bei 4 °C.
5. Behandlung von Zellen
- Behandeln Sie am 14. Tag nach der Aussaat Zellen mit Verbindungen oder messen Sie gegebenenfalls den transendotheliaalen elektrischen Widerstand (TEER), falls geplant (Abbildung 2G).
HINWEIS: Haben Sie immer einige unbehandelte Zellen als Steuerelement.- Um Zellen mit der Zinsverbindung zu behandeln, verdünnen Sie die Verbindung bis zur Endkonzentration in DMEM/F-12 Medium. 0,5 ml dieser Mischung in die obere Kammer und 1,5 ml in die untere Kammer geben. Inkubieren Sie die Platte in einem Zellkultur-Inkubator für die gewünschte Zeit.
- Anschließend das komplette Medium mit dem antibiotikafreien Medium durch Ansaugung mit der Vakuumpumpe und Pipettierung austauschen (Abbildung 2H).
6. Messung der Permeabilität
- Um konstante Konzentrationen von Bakterien zu erhalten, messen Sie die optische Dichte mit einem Photometer bei einer Wellenlänge von 600 nm. Verdünnen Sie die Übernachtlösung von Bakterien mit LB-Medium in einem 50 ml Falkenrohr auf eine OD600 von 0,5 x 0,05. Arbeiten auf Eis.
- 1 ml LB-Medium in eine Küvette füllen. Starten Sie das Photometer und setzen Sie die Küvette ein, die seitlich nach vorne markiert ist. Drücken Sie unten "Leer", um den Leerwert anschließend zu messen.
- Messen Sie die Dichte der bakteriellen Lösung, indem Sie sie in eine Küvette füllen, sie einteilen und die bodenlange Probe drücken. Wiederholen Sie die Messung während der Verdünnung bis zur Endgültigen Konzentration.
- Arbeiten Sie in einem biologischen Sicherheitsschrank, in dem Bakterien mit der vorbereiteten 12-Well-Platte und bakteriellen Lösung bei OD600 = 0,5 behandelt werden können. Fügen Sie 450 l bakterielle Lösung nur in jede obere Kammer mit 0,5 ml Medium (Abbildung 2I).
- Inkubieren Sie die 12 Wellplatte für 6 h bei 37 °C in einem Inkubator.
HINWEIS: Das Protokoll schreibt vor, hier zu pausieren. - Probe 50 l des Mediums mit einer Pipette aus jeder unteren Kammer durch Entfernen des Einsatzes mit Zangen (Abbildung 2J). Achten Sie darauf, das Medium nicht aus den oberen Kammern auf die unteren zu verschütten.
- Jede Probe auf eine separate Agarplatte geben (Abbildung 2K). Lassen Sie die Probe auf die Platte und streichen Sie die Lösung mit einem Zellstreuer.
- Die Agarplatten für 24 h bei 37 °C in einem Inkubator inkubieren.
- Zählen Sie die Kolonien in jeder Platte (Abbildung 2L).
7. Analysieren von Daten
- Schreiben Sie die Daten in eine Tabelle und berechnen Sie die durchschnittliche und Standardabweichung der beobachteten Kolonien behandelter und unbehandelter Zellen.
- Zeigen Sie den Durchschnitt als absolute Anzahl von Kolonien an.
- Um die Ergebnisse zu normalisieren, berechnen Sie die relative Anzahl der Kolonien, indem Sie alle Ergebnisse mit dem Kontrollwert dividieren.
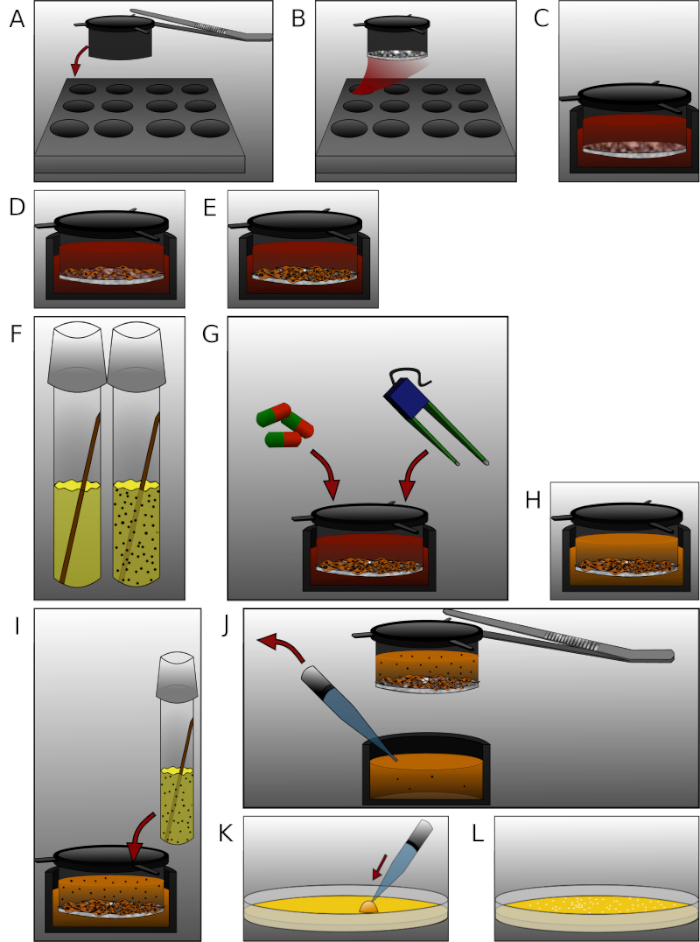
Abbildung 2: Detaillierte Darstellung der einzelnen Schritte im Protokoll. (A) Setzen Sie die Einsätze mit sterilisierten Zangen in die 12 Wellplatte. (B) Mantel jeder Einsatz mit 90 L Fibronectin und Kollagen IV Mischung und inkubieren für 24 h. (C) Equilibrate die Membranen mit vorgewärmten Medium für 30 min. (D) Samen 2 x 105 menschliche Gehirn mikrovaskuläre Endothelzellen pro Einsatz. (E) Kultivieren Sie die Platte für die entsprechende Zeit. (F) Einen Tag vor der Messung eine E. coli-Kolonie in ein LB-Mittelkulturrohr geben und 24 h inkubieren. (G) Behandeln Sie Zellen oder messen Sie TEER. (H) Komplettes Medium mit antibiotikafreiem Medium austauschen. (I) Fügen Sie 450 l bakterielle Lösung (OD600 = 0,5) in jede obere Kammer und inkubieren für 6 h. (J) Probe 50 l Medium aus jeder unteren Kammer entfernen Einsatz mit Zangen. (K) Die Probe auf Agarplatten aufkleben und 24 h inkubieren . (L) Zählen Sie die Kolonien und analysieren Sie die Daten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Nach dem Protokoll wurden die Zellen gesät und das BBB-Modell wurde erstellt. Am 14. Tag nach der Aussaat wurden die Zellen mit Glyoxal als reaktives Aldehyd behandelt. Ziel des Experiments war es, den Zusammenhang zwischen Alter und Diabetes in POD27 und die hohe Inzidenz von Meningitis bei älteren Patienten zu untersuchen48. Die erhöhten Konzentrationen fortgeschrittener Glykationsendprodukte (AGEs) sowohl im Alter als auch bei Diabetes49 erfordern eine weitere Untersuchung der Wirkung der Glykation bei der Pathogenese der mikrobiellen Durchquerung durch die BBB. Glykation ist eine nicht-enzymatische Reaktion freier Aminogruppen in Proteinen mit Carbonylgruppen von reduzierenden Kohlenhydraten oder anderen Carbonylverbindungen. Glukose ist als Spender von Carbonylgruppen bekannt; es sind jedoch reaktivere bekannt. Nach dem Aufbau einer instabilen Schiffsbasis ordnen sie sich zu stabileren und reaktiven Dicarbonylverbindungen wie Glyoxal um. AGEs, die Endprodukte, können Zukreuzverbindungen zwischen Proteinenverursachen 50. Sie können zelluläre Strukturen schädigen und die zelluläre Funktion durch Interaktion mit dem AGEs-Rezeptor (RAGE)51verändern.
Die Zellen wurden mit einer 0,05- und 0,15 mM-Glyoxallösung (GO) für 1 h behandelt, und unbehandelte Zellen dienten als Kontrolle. Die Glykation wurde durch Immunoblotting und Detektion mit einem Anti-AGE-Antikörper nachgewiesen (Abbildung 3). Die erhaltenen Bakterienkolonien wurden gezählt und als absolute Anzahl von Kolonien (Abbildung 4A) oder die relative Anzahl der Kolonien, die zur Kontrolle normalisiert wurden (Abbildung 4B). Das Medium, das aus Brunnen mit den unbehandelten Zellen entnommen wurde, bildete nur sehr wenige Kolonien. Dieses Ergebnis zeigte, dass die unbehandelten Zellen in der Lage waren, eine Barriere zu bauen und als Kontrolle dienen konnten. Proben, die mit Glyoxal behandelt wurden, zeigten eine erhöhte Anzahl von Kolonien, was zu der Schlussfolgerung führte, dass es eine Wirkung von Glyoxal auf die THBMECs und die zelluläre Barrieredichte gibt, da die Anzahl der Kolonien einen signifikanten Unterschied zwischen unbehandelten und behandelten Zellen aufwies. Die erhöhte bakterielle Überquerung der Barriere nach der Behandlung mit Glyoxal könnte erklären, warum Diabetes mit Krankheiten mit einem BBB-Zusammenbruch korreliert.
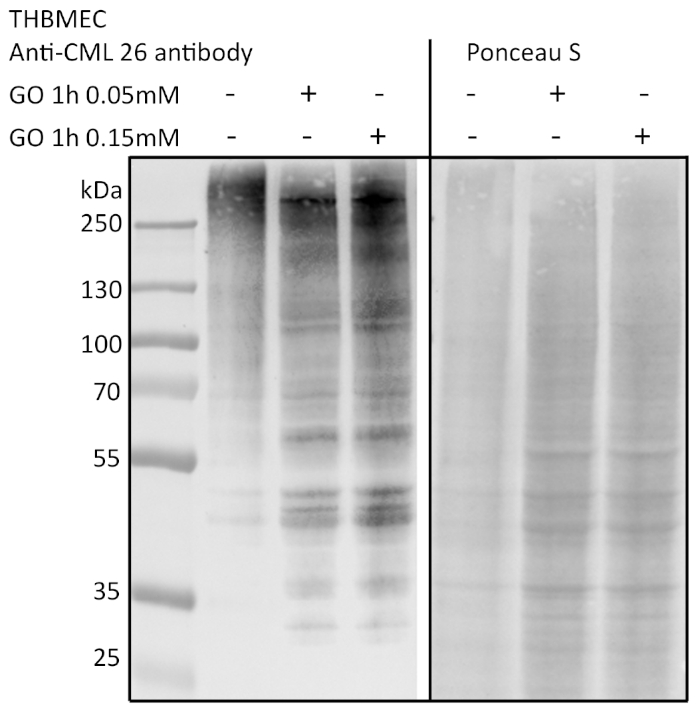
Abbildung 3: Nachweis der Proteinglykation durch Immunoblotting. THBMECs wurden mit GO in verschiedenen Konzentrationen für 1 h behandelt. Gesamtprotein wurde isoliert und mit SDS-PAGE getrennt. Die Glykation der Proteine wurde mittels Immunoblotting mit Anti-AGE-Antikörpern (CML-26) nachgewiesen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
In einer anderen Umgebung wurde die Proteinglykation von THBMECs durch Glukose induziert. Sterilisierte Glukose wurde dem DMEM/F-12-Medium zugesetzt, um die Glukosekonzentration vom normalen Glukosemedium (NG) mit 17,5 mM auf ein hohes Glukosemedium (HG) mit 42,5 mM zu erhöhen. THBMECs wurden in zwei verschiedenen Zellkulturkolben angebaut: einer in normalem Glukosemedium (NG) und das andere in hohem Glukosemedium (HG). Diese beiden verschiedenen Medien wurden auch für das Wachstum der BBB auf Filtern in 12 Brunnenplatten verwendet. Zellen, die in NG-Medium angebaut wurden, dienten als Kontrolle. Die erhaltenen Kolonien werden als absolute Anzahl von Kolonien dargestellt (Abbildung 4C) oder die relative Anzahl der Kolonien, die zur Kontrolle normalisiert wurden (Abbildung 4D). Die Ergebnisse deuten darauf hin, dass keine signifikante neuflische Wirkung auf die Durchquerung von Bakterien durch den menschlichen BBB zu dem Schluss geführt hat, dass die Wirkung von NG vs. HG nicht schwerwiegend genug war, um die Integrität des BBB zu beeinträchtigen. Die verschiedenen Szenarien wurden entwickelt, um das Modell und die Integrität der Zellen zu beweisen, die die BBB imitieren.
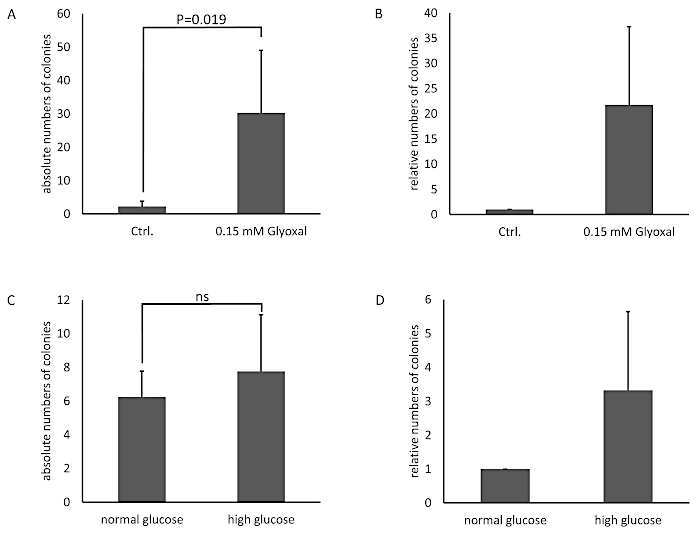
Abbildung 4: Absolute und relative Anzahl der gezählten Bakterienkolonien im BBB-Modell mit THBMECs. THBMECs wurden mit 0,15 mM GO für 1 h behandelt, unbehandelte Zellen dienten als Kontrolle. Jeder oberen Kammer wurden insgesamt 450 l E. coli Suspension (OD600 = 0,5) zugesetzt. Medium aus den unteren Kammern wurde nach 6 h auf Agarplatten plattiert. (A) Die Grafik zeigt den durchschnittlichen Mittelwert +/- SEM der gezählten Kolonien. (B) Das Diagramm zeigt die gezählten Kolonien, die zu den unbehandelten Zellen als Steuerung normalisiert wurden +/- SEM (n = 4). In (C) und (D) wurden THBMECs in NG und HG medium angebaut. Jeder oberen Kammer wurden insgesamt 450 l E. coli Suspension (OD600 = 0,5) zugesetzt. Medium aus der unteren Kammer wurde nach 6 h auf Agarplatten plattiert. (C) Die Grafik zeigt den durchschnittlichen Mittelwert +/- SEM der gezählten Kolonien. (D) Das Diagramm zeigt die gezählten Kolonien, die zu den unbehandelten Zellen als Steuerung normalisiert wurden +/- SEM (n = 3). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Begrenzte Einblicke in die Pathogenese mikrobiellen Traversal grenzen die weitere Entwicklung von Therapien für POD oder Meningitis. Die Sterblichkeit und Morbidität dieser Krankheiten erfordern eine bessere Patientenbehandlung, erfordern die Erforschung der zugrunde liegenden Mechanismen und eine robuste Plattform für das Zusammengesetzte Screening. Die multifaktoriellen Ereignisse können mit menschlichen BMECs untersucht werden. Mehrere erfolgreiche gemeldete Isolationsverfahren von BMECs von einer Reihe von Arten haben einen Verlust der Zelleigenschaften molekulare Signaturgezeigt 52,53. Die beschriebenen THBMECs in diesem Verfahren wurden in sehr frühen Passagen transfiziert, wo sie spezifische Charaktereigenschaften der Endothelzellartifika des Gehirns aufwiesen undsie 43konservierten. Dies ist wichtig, da bisher nicht alle Schritte in den betroffenen Wegen entdeckt wurden, und dieses Modell scheint konventionelle BMECs nachzuahmen. Unser vorgestelltes Modell zeigt direkte Einflüsse auf BMECs und die mikrobielle Traversaldurchquerung durch die BBB.
Der Umgang mit THBMEC-Zellen ist einfach, und die erforderliche technische Ausrüstung gibt es in den meisten Life-Science-Labors. Unser Modell ermöglicht den sofortigen Beginn von Ermittlungsverfahren, nachdem die THBMECs eine enge Monolayer gebaut haben. Das Einsatzgebiet kann aufgrund der möglichen Kombinationen zwischen neuen Tests und konventionellen Tests wie TEER-Messung oder Kennzeichnung mit Tracern54umfangreich sein. Es ist auch möglich, Astrozyten oder Pericyten hinzuzufügen, um ein Ko- oder Dreifachkulturmodell zu erstellen. Der Einfluss von Medikamenten auf die mikrobielle Traversale könnte auch in unserem Modell getestet werden, indem die THBMECs mit Verbindungen behandelt werden, bevor die obere Kammer mit Bakterien inokaiert wird. In der Tat ist es möglich, Einsätze mit Filtern für 96 Wellplatten zu kaufen, die die Automatisierung des Verfahrens ermöglichen. Dies kann die Implementierung von Systemen zum Screening von Arzneimitteln mit hohem Durchsatz erleichtern, um die Entdeckung von Medikamenten gegen die genannten Krankheiten zu beschleunigen und Nebenwirkungen auf die BBB während der Arzneimittelentwicklung zu reduzieren.
Ein kritischer Schritt in der vorgestellten Methode ist die Inkubationszeit nach dem Hinzufügen der Bakterien in die obere Kammer. Es ist wichtig, Stunden als Zeitleisten im Protokoll zu verwenden, da die Erzeugungszeit von E. coli nur 20 min55beträgt. Andernfalls könnte die Verwendung unterschiedlicher Zeitpunkte zu irreführenden Ergebnissen führen. Es besteht auch ein mögliches Risiko einer Kontamination zwischen Ober- und Unterkammer während der bakteriellen Exposition, wenn die Platten nicht mit Sorgfalt behandelt werden. Jede Änderung der 12-Well-Platte an dieser Stelle könnte das Medium in der unteren Kammer verunreinigen.
E. coli ist eine bekannte, sehr häufige Ursache für bakterielle Meningitis. Weitere Untersuchungen sollten verschiedene Bakterien testen, die auch mit Meningitis in Verbindung gebracht werden, wie Neisseria meningitidis56 oder Streptococcus pneumoniae57. Diese scheinen verschiedene Mechanismen zu nutzen, um die BBB zu überqueren und müssen für die Behandlung von Patienten besser verstanden werden. Bei älteren Patienten erhöht sich die Inzidenz von POD um26 sowie die Anzahl der auftretenden Komorbiditäten. Es ist bekannt, dass es Wechselwirkungen zwischen verschiedenen Krankheiten, vor allem systemische wie Diabetes. In unserem Modell ist es möglich, diese Bedingungen zu simulieren oder die Zellen zu behandeln, bevor die Bakterien hinzugefügt werden.
Das Modell wird durch den direkten Kontakt von THBMECs und Bakterien begrenzt, und weitere Forschung ist notwendig, um mögliche Kontaktmechanismen zu untersuchen, um die beteiligten Pfade und Proteine zu erkennen. Es ist jedoch möglich, Einsätze zu entfernen und die Zellen zur weiteren Analyse zu ernten. Der TEER des Modells ist niedriger als bei den Stammzellmodellen38,39,40. Wir bestätigten dies durch die Verwendung einer bakteriellen Konzentration, die die BBB in unbehandelten Zellen nach 6 h nicht kreuzte.
Zusammenfassend stellt diese Methode eine robuste Plattform dar, um die Durchquerung von Bakterien durch die BBB zu analysieren, mit dem Potenzial, sie für Drogenscreenings mit hohem Durchsatz zu erweitern.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren würdigen Dr. Maryam Hussain für frühere Arbeiten zu dieser Methode, die Gruppe von PD Dr. Kerstin Danker (Charité-Universitätsmedizin, Berlin) für die Bereitstellung der THBMECs und Juliane Weber für die kritische Lektüre des Manuskripts. Diese Studie wurde von der RTK 2155 (ProMoAge) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Agar - Agar | Carl Roth | 6494.3 | BioScience-Grade |
| Autoclave | Systec | VX-150 | |
| Bacteria E.coli strain GM2163 | Fermentas Life Sciences, Lithuania | ||
| Photometer | Eppendorf | 6131 | |
| Cells THBMEC | Group of M. F. Stins | ||
| Cell culture flasks | Greiner Bio-One | 658175 | |
| Centrifuge Universal 320 | Hettrichlab | 1401 | |
| Collagen IV | SIGMA Aldrich | C6745 | from human cell culture |
| Countess Automated Cell Counter with cell counting chamber slides and Trypan Blue stain 0.4% | Invitrogen | C10311 | |
| Culture tubes | Greiner Bio-One | 191180 | |
| Cuvettes | BRAND | 759015 | |
| Di sodium hydrogen phosphate di hydrate | MERCK | 1065800500 | |
| DMEM/F-12 | GIBCO/ Thermo Sc. | 11330032 | HEPES |
| Falcon tubes 15 ml | Greiner Bio-One | 188271 | |
| Falcon tubes 50 ml | Greiner Bio-One | 227261 | |
| Fetal Bovine Serum | GIBCO/ Thermo Sc. | 10270 | value FBS -Brazil |
| Fibronectin | SIGMA Aldrich | F0556 | solution human fibroblasts |
| Heracell 150 CO2 Incubator | Heraeus | 50116047 | |
| Incubator shaker I 26 New Brunswick | Eppendorf | M1324-0000 | |
| Inoculation loop | Dr. Ilona Schubert - Laborfachhandel | 641000 | |
| LB Broth Base | GIBCO/ Thermo Sc. | 12780029 | |
| L-Glutamine | GIBCO/ Thermo Sc. | 25030-081 | |
| Microbial incubator B 6200 | Heraeus | 51015192 | |
| Microbiological Safety Cabinet AURA 2000 M.A.C. Class II | BIOAIR | 12469 | |
| Microscope inverse | Zeiss | TELAVAL 31 | |
| Micro tubes 2 ml | Sarstedt | 72,695,400 | |
| Micro tubes 1,5 ml | Sarstedt | 72,706,400 | |
| Penicillin / Streptomycin | GIBCO/ Thermo Sc. | 15140122 | |
| Petri dish | Dr. Ilona Schubert - Laborfachhandel | 464-800 | |
| Potassium chloride | Roth | HN02.3 | |
| Potassium-di-hydrogen phosphate | Roth | P018.2 | |
| Sodium chloride | Roth | 9265.2 | |
| ThinCerts + Multiwell Plates | Greiner Bio-One | 665631 | 12 well, pore size 3.0 µm |
| Trypsin - EDTA | GIBCO/ Thermo Sc. | 15400054 | |
| Vacuumpump Laboport | KNF | N 86 KT.18 |
Referenzen
- Goldmann, E. E. . Vitalfärbung am Zentralnervensystem: Beitrag z. Physio-Pathologie d Plexus chorioideus ud Hirnhäute. , (1913).
- Reese, T. S., Karnovsky, M. J. Fine structural localization of a blood-brain barrier to exogenous peroxidase. Journal of Cell Biology. 34 (1), 207-217 (1967).
- Risau, W., Dingler, A., Albrecht, U., Dehouck, M. P., Cecchelli, R. Blood-brain barrier pericytes are the main source of gamma-glutamyltranspeptidase activity in brain capillaries. Journal of Neurochemistry. 58 (2), 667-672 (1992).
- Brightman, M. W., Reese, T. S. Junctions between intimately apposed cell membranes in the vertebrate brain. Journal of Cell Biology. 40 (3), 648-677 (1969).
- Coomber, B. L., Stewart, P. A. Morphometric analysis of CNS microvascular endothelium. Microvascular Research. 30 (1), 99-115 (1985).
- Tilling, T., Korte, D., Hoheisel, D., Galla, H. J. Basement membrane proteins influence brain capillary endothelial barrier function in vitro. Journal of Neurochemistry. 71 (3), 1151-1157 (1998).
- Morris, A. W., et al. Vascular basement membranes as pathways for the passage of fluid into and out of the brain. Acta Neuropathologica. 131 (5), 725-736 (2016).
- Betz, A. L., Goldstein, G. W. Polarity of the blood-brain barrier: neutral amino acid transport into isolated brain capillaries. Science. 202 (4364), 225-227 (1978).
- Butt, A. M., Jones, H. C., Abbott, N. J. Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study. Journal of Physiology. 429, 47-62 (1990).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- O'Carroll, S. J., et al. Pro-inflammatory TNFalpha and IL-1beta differentially regulate the inflammatory phenotype of brain microvascular endothelial cells. Journal of Neuroinflammation. 12 (131), (2015).
- Simi, A., Tsakiri, N., Wang, P., Rothwell, N. J. Interleukin-1 and inflammatory neurodegeneration. Biochemical Society Transactions. 35 (Pt 5), 1122-1126 (2007).
- Janzer, R. C., Raff, M. C. Astrocytes induce blood-brain barrier properties in endothelial cells. Nature. 325 (6101), 253-257 (1987).
- Tao-Cheng, J. H., Nagy, Z., Brightman, M. W. Tight junctions of brain endothelium in vitro are enhanced by astroglia. Journal of Neuroscience. 7 (10), 3293-3299 (1987).
- Utsumi, H., et al. Expression of GFRalpha-1, receptor for GDNF, in rat brain capillary during postnatal development of the BBB. American Journal of Physiology and Cell Physiology. 279 (2), (2000).
- Tran, N. D., Correale, J., Schreiber, S. S., Fisher, M. Transforming growth factor-beta mediates astrocyte-specific regulation of brain endothelial anticoagulant factors. Stroke. 30 (8), 1671-1678 (1999).
- Balabanov, R., Washington, R., Wagnerova, J., Dore-Duffy, P. CNS microvascular pericytes express macrophage-like function, cell surface integrin alpha M, and macrophage marker ED-2. Microvascular Research. 52 (2), 127-142 (1996).
- Ramsauer, M., Krause, D., Dermietzel, R. Angiogenesis of the blood-brain barrier in vitro and the function of cerebral pericytes. Faseb Journal. 16 (10), 1274-1276 (2002).
- Lindahl, P., Johansson, B. R., Leveen, P., Betsholtz, C. Pericyte loss and microaneurysm formation in PDGF-B-deficient mice. Science. 277 (5323), 242-245 (1997).
- Young, G. B., Bolton, C. F., Archibald, Y. M., Austin, T. W., Wells, G. A. The electroencephalogram in sepsis-associated encephalopathy. Journal of Clinical Neurophysiology. 9 (1), 145-152 (1992).
- Carlyle Clawson, C., Francis Hartmann, J., Vernier, R. L. Electron microscopy of the effect of gram-negative endotoxin on the blood-brain barrier. Journal of Comparative Neurology. 127 (2), 183-197 (1966).
- Jeppsson, B., et al. Blood-brain barrier derangement in sepsis: cause of septic encephalopathy?. The American Journal of Surgery. 141 (1), 136-142 (1981).
- Tighe, D., Moss, R., Bennett, D. Cell surface adrenergic receptor stimulation modifies the endothelial response to SIRS. Systemic Inflammatory Response Syndrome. New Horizons (Baltimore, Md). 4 (4), 426-442 (1996).
- Kim, K. S., et al. The K1 capsule is the critical determinant in the development of Escherichia coli meningitis in the rat. Journal of Clinical Investigation. 90 (3), 897-905 (1992).
- Kim, K. S., Wass, C. A., Cross, A. S. Blood-brain barrier permeability during the development of experimental bacterial meningitis in the rat. Experimental Neurology. 145 (1), 253-257 (1997).
- Arshi, A., et al. Predictors and Sequelae of Postoperative Delirium in Geriatric Hip Fracture Patients. Geriatric Orthopaedic Surgery and Rehabililation. 9, 2151459318814823 (2018).
- Smulter, N., Lingehall, H. C., Gustafson, Y., Olofsson, B., Engstrom, K. G. Delirium after cardiac surgery: incidence and risk factors. Interactive CardioVascular and Thoracic Surgery. 17 (5), (2013).
- Kratz, T., Heinrich, M., Schlauss, E., Diefenbacher, A. Preventing postoperative delirium. Deutsches Arzteblatt International. 112 (17), 289-296 (2015).
- Uchida, Y., et al. Quantitative targeted absolute proteomics of human blood-brain barrier transporters and receptors. Journal of Neurochemistry. 117 (2), 333-345 (2011).
- Warren, M. S., et al. Comparative gene expression profiles of ABC transporters in brain microvessel endothelial cells and brain in five species including human. Pharmacology Research. 59 (6), 404-413 (2009).
- Omidi, Y., et al. Evaluation of the immortalised mouse brain capillary endothelial cell line, b.End3, as an in vitro blood-brain barrier model for drug uptake and transport studies. Brain Research. 990 (1-2), 95-112 (2003).
- Steiner, O., Coisne, C., Engelhardt, B., Lyck, R. Comparison of immortalized bEnd5 and primary mouse brain microvascular endothelial cells as in vitro blood-brain barrier models for the study of T cell extravasation. Journal of Cerebral Blood Flow and Metabolism. 31 (1), 315-327 (2011).
- Burek, M., Salvador, E., Forster, C. Y. Generation of an immortalized murine brain microvascular endothelial cell line as an in vitro blood brain barrier model. Journal of Visualized Experiments. (66), e4022 (2012).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmacolgy. 10 (1), 289-296 (2013).
- Urich, E., Lazic, S. E., Molnos, J., Wells, I., Freskgard, P. O. Transcriptional profiling of human brain endothelial cells reveals key properties crucial for predictive in vitro blood-brain barrier models. PLoS One. 7 (5), e38149 (2012).
- Lopez-Ramirez, M. A., et al. Cytokine-induced changes in the gene expression profile of a human cerebral microvascular endothelial cell-line, hCMEC/D3. Fluid Barrier CNS. 10 (27), (2013).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow Metabolism. 28 (2), 312-328 (2008).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Boyer-Di Ponio, J., et al. Instruction of circulating endothelial progenitors in vitro towards specialized blood-brain barrier and arterial phenotypes. PLoS One. 9 (1), e84179 (2014).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Lippmann, E. S., Al-Ahmad, A., Azarin, S. M., Palecek, S. P., Shusta, E. V. A retinoic acid-enhanced, multicellular human blood-brain barrier model derived from stem cell sources. Science Reports. 4, 4160 (2014).
- Lim, R. G., et al. Huntington's Disease iPSC-Derived Brain Microvascular Endothelial Cells Reveal WNT-Mediated Angiogenic and Blood-Brain Barrier Deficits. Cell Reports. 19 (7), 1365-1377 (2017).
- Stins, M. F., Badger, J., Sik Kim, K. Bacterial invasion and transcytosis in transfected human brain microvascular endothelial cells. Microbiological Pathogens. 30 (1), 19-28 (2001).
- Gaschignard, J., et al. Neonatal Bacterial Meningitis: 444 Cases in 7 Years. Pediatric Infectious Disease Journal. 30 (3), 212-217 (2011).
- Hussain, M. . The Effect of Glycation on the Permeability of an in vitro Blood-brain Barrier Model. , (2015).
- Weber, V. . The effect of glycation on the permeability of human blood-brain barrier. , (2019).
- Hussain, M., et al. Novel insights in the dysfunction of human blood-brain barrier after glycation. Mechanism of Ageing Development. 155, 48-54 (2016).
- Choi, C. Bacterial meningitis in aging adults. Clinical Infectious Disease. 33 (8), 1380-1385 (2001).
- Furth, A. J. Glycated proteins in diabetes. British Journal of Biomedical Science. 54 (3), 192-200 (1997).
- Sajithlal, G. B., Chithra, P., Chandrakasan, G. Advanced glycation end products induce crosslinking of collagen in vitro. Biochimica and Biophysica Acta. 1407 (3), 215-224 (1998).
- Ray, R., Juranek, J. K., Rai, V. RAGE axis in neuroinflammation, neurodegeneration and its emerging role in the pathogenesis of amyotrophic lateral sclerosis. Neuroscience and Biobehavior Reviews. 62, 48-55 (2016).
- DeBault, L. E., Cancilla, P. A. Gamma-Glutamyl transpeptidase in isolated brain endothelial cells: induction by glial cells in vitro. Science. 207 (4431), 653-655 (1980).
- Diglio, C. A., Grammas, P., Giacomelli, F., Wiener, J. Primary culture of rat cerebral microvascular endothelial cells. Isolation, growth, and characterization. Laboratory Investigation. 46 (6), 554-563 (1982).
- Buchert, M., Turksen, K., Hollande, F. Methods to examine tight junction physiology in cancer stem cells: TEER, paracellular permeability, and dilution potential measurements. Stem Cell Reviews. 8 (3), 1030-1034 (2012).
- Gibson, B., Wilson, D. J., Feil, E., Eyre-Walker, A. The distribution of bacterial doubling times in the wild. Proceedings of the Royal Society B: Biological Sciences. 285 (1880), (2018).
- Pron, B., et al. Interaction of Neisseria maningitidis with the components of the blood-brain barrier correlates with an increased expression of PilC. Journal of Infectious Diseases. 176 (5), 1285-1292 (1997).
- Iovino, F., Orihuela, C. J., Moorlag, H. E., Molema, G., Bijlsma, J. J. Interactions between blood-borne Streptococcus pneumoniae and the blood-brain barrier preceding meningitis. PLoS One. 8 (7), e68408 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten