Method Article
Analyse de la perméabilité de la barrière hémato-encéphalique par traversale microbienne à travers les cellules endothéliales microvasculaires
Dans cet article
Résumé
La barrière hémato-encéphalique humaine empêche sélectivement la pénétration des molécules hydrophiles et des agents pathogènes dans le cerveau. Plusieurs pathologies, y compris la méningite et le délire postopératoire, sont associées à une perméabilité accrue de la barrière hémato-encéphalique. Ici, nous décrivons un modèle de culture cellulaire endothéliale pour tester la perméabilité de barrière par traversal microbien.
Résumé
La barrière hémato-encéphalique humaine (BBB) est caractérisée par une très faible perméabilité pour les biomolécules afin de protéger et de réguler le métabolisme du cerveau. Le BBB est principalement formé à partir de cellules endothéliales incorporées dans le collagène IV et les membranes riches en fibronectin soude. Plusieurs pathologies résultent d’un dysfonctionnement du BBB suivi d’une traversée microbienne, causant des maladies telles que la méningite. Afin de tester l’effet de plusieurs paramètres, y compris différents médicaments et anesthésiques, sur la perméabilité du BBB, nous avons établi un nouveau modèle de culture cellulaire humaine imitant le BBB avec des cellules endothéliales microvasculaires du cerveau humain. Les cellules endothéliales sont cultivées sur le collagène IV et les unités de filtre enduites de fibronectin jusqu’à la confluence et peuvent ensuite être traitées avec différents composés d’intérêt. Afin de démontrer une traversée microbienne, la chambre supérieure avec la surface apicale des cellules endothéliales est inoculée avec des bactéries. Après une période d’incubation, des échantillons de la chambre inférieure sont plaqués sur des plaques d’agar et les colonies obtenues sont comptées, ce qui correspond au nombre de colonies en corrélation avec la perméabilité du BBB. Les facteurs cellulaires endogènes peuvent être analysés dans cette configuration expérimentale afin d’élucider les mécanismes cellulaires de base des cellules endothéliales contribuant au BBB. En outre, cette plate-forme permet d’effectuer un écran pour les composés qui pourraient affecter la perméabilité des cellules endothéliales. Enfin, la traversée bactérienne peut être étudiée et liée à différentes pathologies, telles que la méningite. Il pourrait être possible d’étendre le modèle et d’analyser les voies de la bactérie à travers le BBB. Dans cet article, nous fournissons un protocole détaillé de la méthode décrite pour étudier la perméabilité du BBB.
Introduction
Le BBB humain est une limite unique du tissu cérébral, séparant le cerveau du sang. Il régule strictement le passage des molécules plus grandes et hydrophiles, bloque la diffusion paracellulaire, et maintient l’homéostasie du cerveau. Il protège également le cerveau contre les fluctuations plasmatiques, les toxines, les microbes, et guide les cellules inflammatoires dans le cadre de l’immunité du système nerveux central (SNC). Depuis sa découverte il y a un siècle1, de nombreuses études ont été réalisées pour comprendre la structure et la fonction du BBB. Les interactions complexes des cellules, des protéines et des signaux du cerveau et du sang exigent encore davantage d’investigation et de modèles.
Le BBB humain est composé de trois types de cellules : les cellules endothéliales microvasculaires du cerveau (BMECs), les péricytes, et les astrocytes2,3. Les BMEC diffèrent de la majorité des cellules endothéliales dans le corps en ce qu’ils possèdent un nombre élevé de jonctions serrées et les jonctions adhérentes4, faible activité pinocytotique2,5, et une membrane de sous-sol continue6,7 pour bloquer la diffusion paracellulaire. Les petites molécules lipophiles peuvent diffuser et passer le BBB suivant leur gradient de concentration; les molécules plus grandes et hydrophiles entrent ou ne quittent le cerveau que par des systèmes de transport sélectifs exprimés polarisés8. Ce règlement se traduit par une résistance électrique transendothéliale élevée (TEER) de 1 500 à 2 000 cm2 qui est inversement corrélée à la perméabilité9,10. Bien que les BMEC construisent une barrière serrée, ils peuvent réagir aux signaux locaux et périphériques11,12. Il existe une interaction étroite entre les BMEC et les astrocytes13; l’astrocyte pieds d’extrémité construire une couche autour des navires et induire la formation de jonctions serrées13,14. Ils sont impliqués dans la maturation de BBB avec différents facteurs, y compris la transformation du facteur de croissance -MD (TGF-MD)15,16. En outre, les péritéytes jouent un rôle clé dans la régulation de l’angiogenèse17 et dans la prévention de l’apoptosis de l’endothélium dans la différenciation cellulaire18 (Figure 1). Ils sont encastrés dans la membrane du sous-sol et assurent la stabilité structurale du mur du navire19.
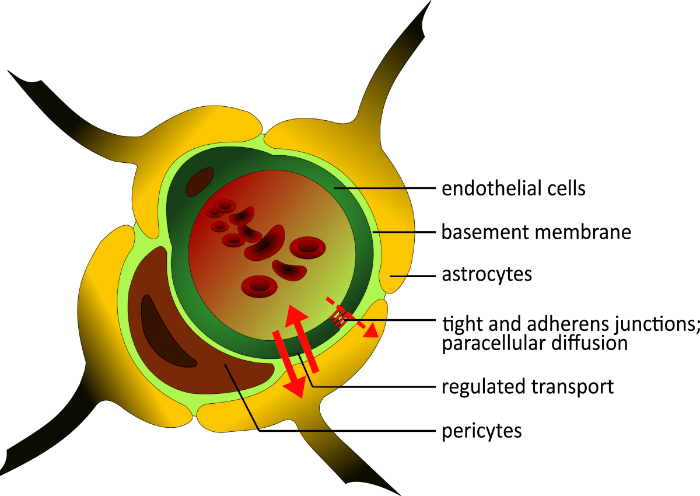
Figure 1 : Structure schématique de la barrière hémato-encéphalique. La structure unique du BBB humain est composée de trois types de cellules différents. Le microvessel lumen est entouré de cellules endothéliales, qui sont enrichies en jonctions serrées, et ne sont pas fenestrés. Ils sont intégrés dans la membrane du sous-sol, comme les péricartes. Ces cellules sont importantes pour la stabilité structurelle de la paroi du vaisseau et jouent un rôle dans le développement du BBB à côté des astrocytes. Leurs pieds d’extrémité construisent une couche étroite autour du navire et soutiennent la construction de jonctions serrées. Tous les composants du BBB sont importants pour la fonctionnalité physiologique. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
De nombreuses pathologies différentes sont liées à l’effondrement du BBB (p. ex., encéphalopathie septique). Les patients affectés ont augmenté des niveaux de protéine dans le fluide céphalo-rachidien20,et le parenchyme de cerveau dans les rongeurs affectés montre une prise accrue de l’oxyde de fer colloïdal marqué et des acides aminés21,22. Ces résultats indiquent une perméabilité accrue du BBB qui se produit parallèlement à une pinocytose accrue dans les BMECs21 et l’activation endothéliale23. Une autre pathologie associée liée à un BBB modifié est la méningite, une urgence médicale et une inflammation complexe accompagnée d’un oedème cérébral qui peut conduire à la mort des cellules neuronales. Le principal site d’entrée des bactéries en circulation est censé être les micronavires24; cependant, le BBB empêche l’entrée de bactéries. La perméabilité du BBB n’est pas toujours liée à une augmentation de la méningite hématogène expérimentale25 et les mécanismes peuvent être multifactoriels. Coïncidence de la septicémie avec le délire postopératoire (POD)26 et l’association avec les infections préopératoires27,28 indique la nécessité d’un modèle bBB qui permet à l’exposition directe aux bactéries pour obtenir une meilleure compréhension de la pathogénie bactérienne.
Il existe de nombreuses lacunes dans la compréhension et la quantification de la traversée microbienne à travers le BBB. Par conséquent, nous avons développé un modèle qui permet un test pratique de différents facteurs et conditions avec une corrélation directe entre la traversale bactérienne et les influences sur la perméabilité de la BBB. Les travaux antérieurs ont porté sur la perméabilité paracellulaire et ont inclus la mesure TEER et le flux de traceur. En outre, le transport macromolécule a été analysé par des molécules ou des anticorps conjugués, par lequel différents modèles utilisant seulement des cellules endothéliales ou des combinaisons avec des astrocytes et des péricytes ont été développés. En raison de la difficulté à obtenir des tissus humains sur une base régulière, de nombreux modèles à base d’animaux sont utilisés. Les cellules endothéliales cérébrales d’origine bovine et porcine forment des monocouches serrées avec un TEER élevé qui forment une polarité apical-basale bien formée et sont adaptés pour les investigations du transport de petites molécules à travers le BBB. Les protéines diffèrent dans l’ordre de leurs homologues humains29,30, ce qui rend l’étude des anticorps thérapeutiques difficile. Pour cette raison, les modèles de culture murine ou humaine peuvent être préférables. La souris ou les rats comme sources d’échantillons ont l’avantage d’être obtenus à partir d’espèces bien caractérisées, mais produisent peu de cellules à des fins d’étude. Ceci peut être contourné par l’utilisation de l’endothéliome immortalisé de cerveau de souris (END) lignes cellulaires bEND.3, bEND.5 ou cEND31,32,33.
Les cellules cultivées primaires à partir des tissus humains sont difficiles à obtenir et à manipuler sur une base régulière. Par conséquent, la plupart des modèles cellulaires humains utilisés dans la recherche sur le BBB humain sont immortalisés lignées cellulaires endothéliales. Une lignée cellulaire publiée est la lignée cellulaire endothéliale cérébrale humaine hCMEC/D3, qui est bien adaptée pour étudier l’apport médicamenteux et est facile à manipuler. Les cellules construisent une monocouche et expriment les protéines de jonction serrées caractéristiques du BBB34, tandis que le niveau d’expression de claudin-5 est rapporté pour être inférieur à dans les micronavires intacts35 et de nombreux transporteurs spécifiques ont été détectés au niveau de transcription36 ainsi que dans les études protéomiques34. Un TEER relativement faible dans la gamme de 30-50 cm2 est toujours un défi37. Une autre source pour les cellules endothéliales de cerveau sont les cellules souches pluripotentes humaines (hPSCs)38 et les cellules souches du sang de cordon humain dérivées de l’ancêtre endothélial circulant et les lignées hématopoïétiques39,40. Les deux protocoles de différenciation donnent lieu à des monocouches cellulaires serrées et à des valeurs TEER élevées (p. ex., 1 450 cm2 dans les cocultures)38. Ces modèles de cellules souches nécessitent un soin extrême pour la culture, mais offrent la possibilité d’étudier l’influence de la régulation des hormones41 ou des maladies ayant des antécédents génétiques42 sur le développement de BBB.
Dans cette étude, nous avons établi une lignée de cellules endothéliales microvasculaires du cerveau humain immortalisée, THBMEC43, pour imiter le BBB et pour étudier la traversale bactérienne. Les cellules sont ensemoir sur un filtre et cultivées à 100% de confluence dans ce modèle de culture cellulaire. Les bactéries sont inoculées dans la partie supérieure de la chambre de culture cellulaire. Nous utilisons Escherichia coli (E. coli) dans notre étude d’échantillon en raison de l’incidence élevée de la méningite à E. coli 44. Il a été démontré que la plus faible perméabilité de la monocouche cellulaire se produit entre le jour 13 et le jour 15 après l’ensemencement45. Par conséquent, le traitement de la monocouche THBMEC est effectué après ce temps et les bactéries sont inoculées par la suite dans le milieu sur la surface apicale de la monocouche. Après un temps d’incubation, les bactéries qui ont pu traverser la barrière sont quantifiées par le biais du placage avec les bactéries sur les plaques d’agar et le comptage des colonies. Un nombre accru de colonies est en corrélation avec une traversée bactérienne plus élevée à travers le BBB. Le TEER est d’environ 70 cm246. Cependant, il n’est pas nécessaire de mesurer le TEER dans la méthode décrite. Bien qu’il s’agit d’une valeur bien établie pour la perméabilité de la BBB, il semble n’avoir aucun impact sur la traversée des bactéries à travers le BBB. Les cellules non traitées servent de contrôle de l’étanchéité dans notre modèle. Il a été démontré dans des travaux antérieurs que les cellules sont capables de réagir aux cytokines proinflammatoires et d’exprimer des protéines de jonction serrées typiques47. Cela permet le criblage composé et la validation d’un plus grand ensemble de substrats de transport et de récepteurs.
Protocole
1. Préparation de tampons et réactifs
- Préparer 10x tampon de phosphate salin (10x PBS) en ajoutant 80 g de chlorure de sodium (NaCl), 2 g de chlorure de potassium (KCl), 14,4 g de disodium-hydrogène-phosphate dihydrate (Na2HPO4 - 2H2O) et 2 g de phosphate de potassium-dihydrogène (KH2PO4) dans un flacon de verre de 1 L dans 1 L de H2O. Autoclave double distillé la solution 10x PBS et diluer 100 mL de cette solution dans 900 mL d’eau double distillée pour obtenir 1x PBS.
- Utilisez l’autoclave pour stériliser les solutions. Mettre le flacon de verre dans le panier, fermer le couvercle et le stériliser pendant 15 min à 121 oC et 98,9 kPa.
REMARQUE : Ce protocole est toujours utilisé pour l’autoclaclage des solutions dans d’autres étapes.
- Utilisez l’autoclave pour stériliser les solutions. Mettre le flacon de verre dans le panier, fermer le couvercle et le stériliser pendant 15 min à 121 oC et 98,9 kPa.
- Préparer une solution de collagène IV de 10 g/mL et une solution de fibronectin de 10 g/mL en diluant 0,5 mg/mL de fibronectin et la solution de collagène IV de 0,3 mg/mL chacune avec 1 x PBS à 100 mg/L d’aliquots dans des microtubes de 1,5 mL. Par la suite, mélanger 100 l des deux aliquots avec 1 800 oL de 1 x PBS dans des microtubes de 2 ml et les stocker à -20 oC.
- Préparer le milieu DMEM/F-12 en ajoutant 4 % de sérum bovin fœtal et 2 mM de L-glutamine et 100 mg/L de pénicilline/streptomycine au milieu et le stocker à 4 oC.
- Préparer 1x trypsine-EDTA solution en diluant 5 ml de la 10x concentré trypsin-EDTA solution avec 45 ml de 1x PBS dans un tube de 50 ml et le stocker à 4 oC.
- Préparer 500 ml de lb-moyen en pesant 10 g de base de bouillon LB dans un flacon de verre de 500 ml. Ajouter 500 ml d’eau stérilisée et l’autoclave.
- Préparer l’agar LB en pesant 10 g de base de bouillon LB et 7,5 g d’agar-agar dans un flacon de verre de 500 ml. Ajouter 500 ml d’eau stérilisée avant d’autoclacter et ne pas fermer le couvercle du flacon. Autoclave et laisser la solution pour refroidir jusqu’à ce qu’il soit chaud au toucher.
- Préparer un milieu sans antibiotiques en ajoutant 4 % de sérum bovin fœtal et 2 mM de L-glutamine, mais pas de pénicilline/streptomycine au milieu DMEM/F-12 et le stocker à 4 oC comme à l’étape 1.3.
2. Croissance des cellules imitant la barrière hémato-encéphalique
- Pour assembler la plaque de 12 puits, placez les inserts de culture cellulaire dans les puits (Figure 2A).
- Déballez la plaque et chaque insert dans une armoire de sécurité biologique et y effectuez d’autres étapes. Utilisez des forceps stérilisés pour saisir l’insert à sa large base pour le déplacer.
- Enrober la membrane poreuse de chaque insert de 90 oL de collagène IV de 10 g/mL et de 10 g/mL de mélange de fibronectin. Incuber la plaque de 12 puits pendant 24 h à 37 oC dans un incubateur de culture cellulaire (figure 2B).
- Laver les inserts deux fois en pipetting 1 ml de 1x PBS dans chaque insert et aspirer la solution avec une pompe à vide pour les cultures cellulaires.
- Équilibrez les membranes en tapotage de 0,5 ml de milieu DMEM/F-12 préchauffé dans la partie supérieure et de 1,5 mL dans la chambre inférieure. Incuber la plaque pendant 30 min à 37 oC dans un incubateur de culture cellulaire avec une atmosphère de CO2 de 5 %(figure 2C).
- Graine 2 x 105 cellules endothéliales microvasculaires humaines dans chaque chambre supérieure et incuber la plaque de 12 puits à 37 oC dans un incubateur de culture cellulaire (Figure 2D).
- Aspirez le milieu du flacon de culture cellulaire à l’aide d’une pompe à vide pour les cultures cellulaires et lavez la monocouche en pipetilant 10 ml de 1x PBS et en aspirant la solution par la suite à l’aide d’une pompe à vide.
- Couvrir complètement les cellules avec 1x concentré trypsine-EDTA en pipetting 5 ml de la solution dans le flacon de culture cellulaire. Incuber le flacon de 3 à 5 min à 37 oC dans un incubateur de culture cellulaire.
REMARQUE : Si les cellules ne sont pas dissociées, appuyez fermement sur le flacon contre la paume de la main pour déloger les cellules. - Prendre 5 ml avec une pipette comme aliquot de la suspension cellulaire dans un tube de 15 ml et ajouter 5 ml du milieu contenant du FCS pour arrêter la réaction enzymatique.
- Centrifuger la suspension pendant 3 min à 210 x g,retirer le supernatant à l’utilisation d’une pompe à vide et resuspendre la pastille en 5 ml de milieu avec une pipette.
- Utilisez le compteur cellulaire en mélangeant 10 l de la suspension cellulaire avec 10 l de tache bleu trypan de 0,4 % dans un microtube de 1,5 ml. Ajouter 10 l de mélange dans une glissière de chambre de comptage, le mettre dans le compteur cellulaire, et commencer à compter.
- Concentrez le compteur sur les cellules de sorte que leur bord soit bleu foncé et le blanc moyen. Par la suite, commencez le programme approprié pour le comptage cellulaire.
- Pour calculer le volume de chaque insert, diviser les 2 x 105 cellules obtenues par insert avec la concentration calculée de la suspension cellulaire.
3. Cultivation du modèle de barrière hémato-encéphalique
- Incuber l’assiette de 12 puits pendant 14 jours à 37 oC.
- Changer 0,5 ml de milieu pour la chambre supérieure et 1,5 ml de milieu pour le milieu inférieur tous les 2-3 jours. Chauffer le milieu avant de le mettre dans le flacon de la cellule. Aspirer avec la pompe à vide (Figure 2E).
REMARQUE : Travaillez soigneusement pour éviter de toucher la membrane. - Vérifiez l’état des cellules en les imagerie avec un microscope et de déterminer la confluence. Assurez-vous que la confluence est de 100% après 14 jours.
4. Préparation des bactéries
- Un jour avant la mesure, mettre une colonie de la souche E. coli GM2163 dans le milieu LB. Incuber le tube de culture pendant 24 h à 37 oC avec 180 tr/min dans un shaker d’incubation (Figure 2F).
- Cultiver la souche E. coli sur une plaque d’agar LB à 4 oC. Prenez une colonie avec un pic stérilisé et mettez le pic dans le tube de culture préparé avec 3 ml de milieu LB.
- Préparer une plaque d’agar LB pour chaque insert avec une solution d’agar LB chaude et remplir les plats Petri à la moitié de leur volume total. Laissez-les devenir solides et entreposez-les à 4 oC.
5. Traitement des cellules
- Le jour 14 après l’ensemencement, traitez les cellules avec des composés ou mesurez la résistance électrique transendothéliale (TEER), si prévu (Figure 2G).
REMARQUE: Ayez toujours quelques cellules non traitées comme un contrôle.- Pour traiter les cellules avec le composé d’intérêt, diluer le composé à la concentration finale dans le milieu DMEM/F-12. Ajouter 0,5 ml de ce mélange dans la chambre supérieure et 1,5 ml dans la chambre inférieure. Incuber la plaque dans un incubateur de culture cellulaire pour le temps désiré.
- Ensuite, échangez le milieu complet avec un milieu sans antibiotiques en aspirant avec la pompe à vide et la tuyauterie (Figure 2H).
6. Mesure de la perméabilité
- Pour obtenir des concentrations constantes de bactéries, mesurez la densité optique à l’arme à l’automètre à une longueur d’onde de 600 nm. Diluer la solution de nuit des bactéries avec le milieu LB dans un tube de faucon de 50 ml à un OD600 de 0,5 à 0,05. Travaillez sur la glace.
- Remplir 1 ml de milieu LB dans une cuvette. Démarrer le photomètre et mettre la cuvette dedans, côté marqué vers l’avant. Appuyez sur le bas "Blank" pour mesurer la valeur vierge par la suite.
- Mesurer la densité de la solution bactérienne en la remplissant dans une cuvette, en la mettant dedans et en appuyant sur l’échantillon inférieur. Répétez la mesure pendant la dilution jusqu’à l’obtention de la concentration finale.
- Travaillez dans un coffret de sécurité biologique où les bactéries peuvent être manipulées avec la plaque de 12 puits préparée et la solution bactérienne à OD600 -0,5. Ajouter 450 l de solution bactérienne seulement dans chaque chambre supérieure contenant 0,5 ml de milieu(figure 2I).
- Incuber la plaque de 12 puits pendant 6 h à 37 oC dans un incubateur.
REMARQUE: Le protocole dicte de faire une pause ici. - Échantillondez 50 l du milieu avec une pipette de chaque chambre inférieure en enlevant l’insert avec des forceps (Figure 2J). Veillez à ne pas renverser le milieu des chambres supérieures vers les chambres inférieures.
- Plaquer chaque échantillon sur une plaque d’agar séparée (Figure 2K). Déposer l’échantillon sur la plaque et sortir la solution à l’arme à l’écart.
- Incuber les plaques d’agar pendant 24 h à 37 oC dans un incubateur.
- Comptez les colonies dans chaque assiette (Figure 2L).
7. Analyse des données
- Écrivez les données dans un tableau et calculez l’écart moyen et standard des colonies observées de cellules traitées et non traitées.
- Afficher la moyenne comme le nombre absolu de colonies.
- Pour normaliser les résultats, calculez le nombre relatif de colonies en divisant tous les résultats avec la valeur de contrôle.
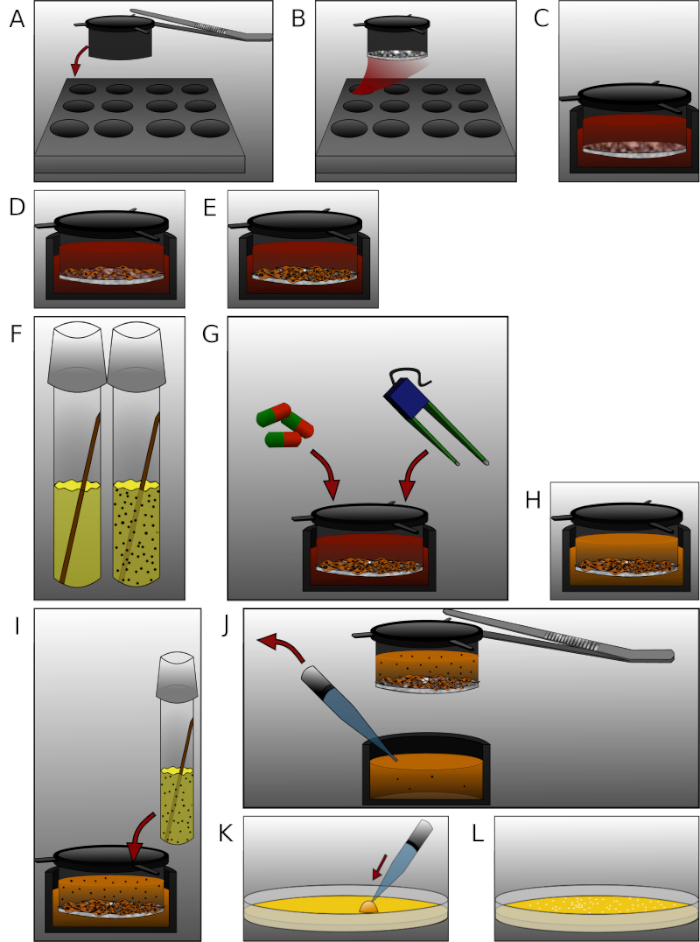
Figure 2 : Présentation détaillée des différentes étapes du protocole. (A) Mettre les inserts avec des forceps stérilisés dans la plaque de 12 puits. (B) Enrober chaque insert de 90 'L de mélange de fibronectin et de collagène IV et incuber pendant 24 h. (C) Équilibrez les membranes avec un milieu préchauffé pendant 30 min. (D) Graine 2 x 105 cellules endothéliales microvasculaires du cerveau humain par insert. (E) Cultivez la plaque pendant le temps approprié. (F) Un jour avant de mesurer, mettez une colonie d’E. coli dans un tube de culture moyenne LB et incubez pendant 24 h. (G) Traiter les cellules ou mesurer TEER. (H) Échange de milieu complet avec milieu sans antibiotiques. (I) Ajouter 450 l de solution bactérienne (OD600 à 0,5) dans chaque chambre supérieure et incuber pendant 6 h. (J) Échantillon de 50 'L de milieu de chaque chambre inférieure en levant l’insert avec des forceps. (K) Déposer l’échantillon sur des plaques d’agar et incuber pendant 24 h. (L) Comptez les colonies et analysez les données. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Résultats
Suivant le protocole, les cellules ont été ensecées, et le modèle BBB a été construit. Au jour 14 après l’ensemencement, les cellules ont été traitées avec le glyoxal comme aldéhyde réactif. Le but de l’expérience était d’étudier la corrélation entre l’âge et le diabète dans POD27 et l’incidence élevée de la méningite chez les patients âgés48. Les niveaux accrus des produits finaux avancés de glycation (AGEs) dans l’âge et le diabète49 exigent davantage d’examen de l’effet de la glycation dans la pathogénie de traversal microbien par le BBB. La glycation est une réaction non-enzymatique des groupes aminés libres dans les protéines avec des groupes carbonyles de réduire les glucides ou d’autres composés carbonyles. Le glucose est bien connu comme donateur de groupes de carbonyles; cependant, il y en a plus réactifs connus. Après avoir construit une base instable de Schiff, ils se réarrangent à des composés dicarbonyl plus stables et réactifs comme le glyoxal. AGEs, les produits finaux, peut provoquer des liens croisés entre les protéines50. Ils peuvent endommager les structures cellulaires et modifier la fonction cellulaire par interaction avec le récepteur des AE (RAGE)51.
Les cellules ont été traitées avec une solution glyoxal (GO) de 0,05 et 0,15 mM pendant 1 h, et les cellules non traitées ont servi de contrôle. La glycation a été détectée par immunoblotting et détection avec un anticorps anti-AGE (figure 3). Les colonies bactériennes obtenues ont été comptées et représentées comme le nombre absolu de colonies (figure 4A) ou le nombre relatif de colonies normalisées au contrôle (figure 4B). Le milieu prélevé dans les puits avec les cellules non traitées forme très peu de colonies. Ce résultat a démontré que les cellules non traitées étaient capables de construire une barrière et pouvaient servir de contrôle. Les échantillons traités au glyoxal présentaient un nombre accru de colonies, ce qui a mené à la conclusion qu’il y a un effet du glyoxal sur les THBMECetets et la densité de barrière cellulaire, parce que le nombre de colonies a démontré une différence significative entre les cellules non traitées et traitées. Le croisement bactérien accru de la barrière après le traitement avec le glyoxal pourrait expliquer pourquoi le diabète est corrélé aux maladies avec une panne de BBB.
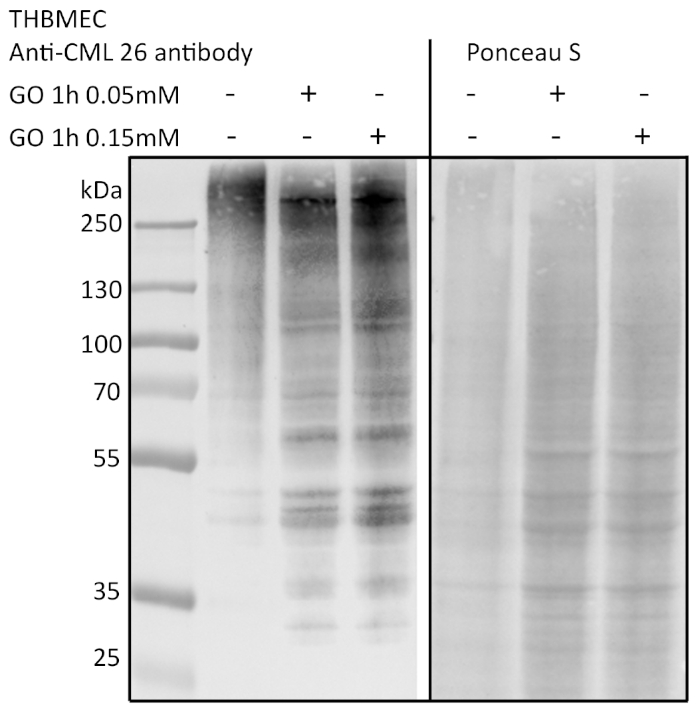
Figure 3 : Détection de la glycation protéique par immunoblotting. Les THBMEC ont été traités avec GO à différentes concentrations pendant 1 h. La protéine totale a été isolée et séparée à l’aide de SDS-PAGE. La glycation des protéines a été détectée par immunoblotting utilisant l’anti-age-anticorps (CML-26). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Dans un cadre différent, la glycation protéique des THBMECs a été induite par le glucose. Le glucose stérilisé a été ajouté au milieu de DMEM/F-12 pour augmenter la concentration de glucose du milieu normal de glucose (NG) avec 17.5 mM au milieu élevé de glucose (HG) avec 42.5 mM. Des THBMECs ont été cultivés dans deux flacons différents de culture cellulaire : l’un dans le milieu normal de glucose (NG) et l’autre dans le milieu de glucose élevé (HG). Ces deux supports différents ont également été utilisés pour la croissance du BBB sur des filtres dans 12 plaques de puits. Les cellules cultivées dans le milieu NG ont servi de contrôle. Les colonies obtenues sont représentées comme le nombre absolu de colonies (figure 4C) ou le nombre relatif de colonies normalisées au contrôle (figure 4D). Les résultats n’indiquent aucun effet significatif sur la traversée des bactéries par le BBB humain, menant à la conclusion que l’effet de NG contre HG n’était pas assez grave pour affecter l’intégrité du BBB. Les différents scénarios ont été conçus pour prouver le modèle et l’intégrité des cellules imitant le BBB.
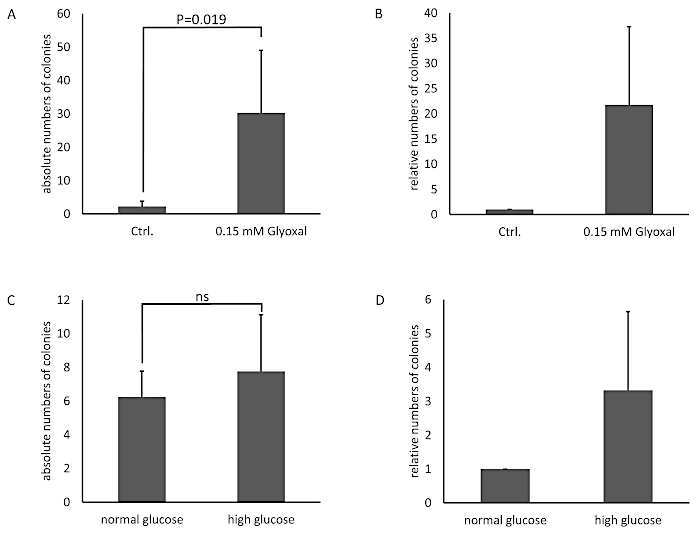
Figure 4 : Nombre absolu et relatif de colonies bactériennes comptées dans le modèle BBB avec thBMECs. Les THBMECs ont été traités avec 0.15 mM GO pendant 1 h, les cellules non traitées ont servi de contrôle. Un total de 450 l de suspension E. coli (OD600 - 0,5) a été ajouté à chaque chambre supérieure. Le moyen des chambres inférieures a été plaqué sur des plaques d’agar après 6 h. (A) Le graphique montre la moyenne moyenne de la SEM des colonies comptées. (B) Le graphique montre les colonies comptées normalisées aux cellules non traitées comme contrôle - / SEM (n ' 4). Dans (C) et (D), THBMECs ont été cultivés dans ng et HG milieu. Un total de 450 l de suspension E. coli (OD600 - 0,5) a été ajouté à chaque chambre supérieure. Le moyen de la chambre inférieure a été plaqué sur des plaques d’agar après 6 h. (C) Le graphique montre la moyenne moyenne de la SEM des colonies comptées. (D) Le graphique montre les colonies comptées normalisées aux cellules non traitées comme contrôle - / SEM (n ' 3). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Une connaissance limitée de la pathogénie de la traversale microbienne limite le développement de thérapies pour pod ou méningite. La mortalité et la morbidité de ces maladies exigent un meilleur traitement des patients, nécessitent des recherches sur les mécanismes sous-jacents et nécessitent une plate-forme solide pour le dépistage composé. Les événements multifactoriels peuvent être étudiés avec des BMEC humains. Plusieurs procédures d’isolement signalées réussies de BMECs d’un certain nombre d’espèces ont montré une perte des caractéristiques des cellules signature moléculaire52,53. Les THBMECs décrits dans cette procédure ont été transfectés dans les passages très tôt, où ils ont exhibé les caractéristiques endothéliales spécifiques de cellules de cerveau et les ont préservés43. Ceci est important, car toutes les étapes des voies touchées n’ont pas été découvertes jusqu’à présent, et ce modèle semble imiter les BMEC classiques. Notre modèle présenté montre des influences directes sur les BMEC et la traversée microbienne à travers le BBB.
La manipulation des cellules THBMEC est simple, et l’équipement technique requis existe dans la plupart des laboratoires des sciences de la vie. Notre modèle permet un démarrage immédiat des procédures d’enquête après que les THBMEC ont construit un monocouche serré. Le domaine des applications peut être étendu en raison des combinaisons possibles entre de nouveaux tests et des essais conventionnels tels que la mesure TEER ou l’étiquetage avec des traceurs54. Il est également possible d’ajouter des astrocytes ou des péricytes pour faire un modèle de co- ou de triple culture. L’influence des médicaments sur la traversale microbienne pourrait également être testée dans notre modèle en traitant les THBMEC avec des composés avant d’inoculer la chambre haute avec des bactéries. En fait, il est possible d’acheter des inserts avec des filtres pour 96 plaques de puits permettant l’automatisation de la procédure. Cela peut faciliter la mise en œuvre de systèmes de dépistage des médicaments à haut débit afin d’accélérer la découverte de médicaments contre les maladies mentionnées et de réduire les effets secondaires sur le BBB pendant le développement du médicament.
Une étape critique dans la méthode présentée est le temps d’incubation après l’ajout des bactéries à la chambre supérieure. Il est important d’utiliser les heures comme calendriers dans le protocole, parce que le temps de génération de E. coli est seulement 20 min55. Dans le cas contraire, l’utilisation de différents points de temps pourrait conduire à des résultats trompeurs. Il existe également un risque possible de contamination entre la chambre supérieure et la chambre inférieure pendant l’exposition bactérienne si les plaques ne sont pas manipulées avec soin. Toute modification de la plaque de puits 12 à ce stade pourrait contaminer le milieu dans la chambre inférieure.
E. coli est une cause bien connue et très fréquente de méningite bactérienne. D’autres études devraient tester différentes bactéries qui sont également associées à la méningite, telles que Neisseria meningitidis56 ou Streptococcus pneumoniae57. Ceux-ci semblent utiliser différents mécanismes pour traverser le BBB et doivent être mieux compris pour le traitement des patients. Chez les patients âgés, l’incidence du POD augmente26 ainsi que le nombre de comorbidités. On sait qu’il existe des interactions entre différentes maladies, en particulier systémiques comme le diabète. Dans notre modèle, il est possible de simuler ces conditions ou de traiter les cellules avant d’ajouter les bactéries.
Le modèle est limité par le contact direct des THBMEC et des bactéries, et d’autres recherches sont nécessaires pour étudier les mécanismes potentiels de contact pour détecter les voies et les protéines impliquées. Cependant, il est possible d’enlever les inserts et de récolter les cellules pour une analyse plus approfondie. Le TEER du modèle est plus faible par rapport aux modèles de cellules souches38,39,40. Nous avons confirmé ceci en utilisant une concentration bactérienne qui n’a pas traversé le BBB dans les cellules non traitées après 6 h.
En résumé, cette méthode représente une plate-forme robuste pour analyser la traversée des bactéries à travers le BBB avec le potentiel de l’étendre pour les dépistages de médicaments à haut débit.
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Les auteurs reconnaissent le Dr Maryam Hussain pour ses travaux antérieurs sur cette méthode, le groupe de DP Dr. Kerstin Danker (Charité-Universit-tsmedizin, Berlin) pour avoir fourni les THBMECs et Juliane Weber pour la lecture critique du manuscrit. Cette étude a été soutenue par le RTK 2155 (ProMoAge).
matériels
| Name | Company | Catalog Number | Comments |
| Agar - Agar | Carl Roth | 6494.3 | BioScience-Grade |
| Autoclave | Systec | VX-150 | |
| Bacteria E.coli strain GM2163 | Fermentas Life Sciences, Lithuania | ||
| Photometer | Eppendorf | 6131 | |
| Cells THBMEC | Group of M. F. Stins | ||
| Cell culture flasks | Greiner Bio-One | 658175 | |
| Centrifuge Universal 320 | Hettrichlab | 1401 | |
| Collagen IV | SIGMA Aldrich | C6745 | from human cell culture |
| Countess Automated Cell Counter with cell counting chamber slides and Trypan Blue stain 0.4% | Invitrogen | C10311 | |
| Culture tubes | Greiner Bio-One | 191180 | |
| Cuvettes | BRAND | 759015 | |
| Di sodium hydrogen phosphate di hydrate | MERCK | 1065800500 | |
| DMEM/F-12 | GIBCO/ Thermo Sc. | 11330032 | HEPES |
| Falcon tubes 15 ml | Greiner Bio-One | 188271 | |
| Falcon tubes 50 ml | Greiner Bio-One | 227261 | |
| Fetal Bovine Serum | GIBCO/ Thermo Sc. | 10270 | value FBS -Brazil |
| Fibronectin | SIGMA Aldrich | F0556 | solution human fibroblasts |
| Heracell 150 CO2 Incubator | Heraeus | 50116047 | |
| Incubator shaker I 26 New Brunswick | Eppendorf | M1324-0000 | |
| Inoculation loop | Dr. Ilona Schubert - Laborfachhandel | 641000 | |
| LB Broth Base | GIBCO/ Thermo Sc. | 12780029 | |
| L-Glutamine | GIBCO/ Thermo Sc. | 25030-081 | |
| Microbial incubator B 6200 | Heraeus | 51015192 | |
| Microbiological Safety Cabinet AURA 2000 M.A.C. Class II | BIOAIR | 12469 | |
| Microscope inverse | Zeiss | TELAVAL 31 | |
| Micro tubes 2 ml | Sarstedt | 72,695,400 | |
| Micro tubes 1,5 ml | Sarstedt | 72,706,400 | |
| Penicillin / Streptomycin | GIBCO/ Thermo Sc. | 15140122 | |
| Petri dish | Dr. Ilona Schubert - Laborfachhandel | 464-800 | |
| Potassium chloride | Roth | HN02.3 | |
| Potassium-di-hydrogen phosphate | Roth | P018.2 | |
| Sodium chloride | Roth | 9265.2 | |
| ThinCerts + Multiwell Plates | Greiner Bio-One | 665631 | 12 well, pore size 3.0 µm |
| Trypsin - EDTA | GIBCO/ Thermo Sc. | 15400054 | |
| Vacuumpump Laboport | KNF | N 86 KT.18 |
Références
- Goldmann, E. E. . Vitalfärbung am Zentralnervensystem: Beitrag z. Physio-Pathologie d Plexus chorioideus ud Hirnhäute. , (1913).
- Reese, T. S., Karnovsky, M. J. Fine structural localization of a blood-brain barrier to exogenous peroxidase. Journal of Cell Biology. 34 (1), 207-217 (1967).
- Risau, W., Dingler, A., Albrecht, U., Dehouck, M. P., Cecchelli, R. Blood-brain barrier pericytes are the main source of gamma-glutamyltranspeptidase activity in brain capillaries. Journal of Neurochemistry. 58 (2), 667-672 (1992).
- Brightman, M. W., Reese, T. S. Junctions between intimately apposed cell membranes in the vertebrate brain. Journal of Cell Biology. 40 (3), 648-677 (1969).
- Coomber, B. L., Stewart, P. A. Morphometric analysis of CNS microvascular endothelium. Microvascular Research. 30 (1), 99-115 (1985).
- Tilling, T., Korte, D., Hoheisel, D., Galla, H. J. Basement membrane proteins influence brain capillary endothelial barrier function in vitro. Journal of Neurochemistry. 71 (3), 1151-1157 (1998).
- Morris, A. W., et al. Vascular basement membranes as pathways for the passage of fluid into and out of the brain. Acta Neuropathologica. 131 (5), 725-736 (2016).
- Betz, A. L., Goldstein, G. W. Polarity of the blood-brain barrier: neutral amino acid transport into isolated brain capillaries. Science. 202 (4364), 225-227 (1978).
- Butt, A. M., Jones, H. C., Abbott, N. J. Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study. Journal of Physiology. 429, 47-62 (1990).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- O'Carroll, S. J., et al. Pro-inflammatory TNFalpha and IL-1beta differentially regulate the inflammatory phenotype of brain microvascular endothelial cells. Journal of Neuroinflammation. 12 (131), (2015).
- Simi, A., Tsakiri, N., Wang, P., Rothwell, N. J. Interleukin-1 and inflammatory neurodegeneration. Biochemical Society Transactions. 35 (Pt 5), 1122-1126 (2007).
- Janzer, R. C., Raff, M. C. Astrocytes induce blood-brain barrier properties in endothelial cells. Nature. 325 (6101), 253-257 (1987).
- Tao-Cheng, J. H., Nagy, Z., Brightman, M. W. Tight junctions of brain endothelium in vitro are enhanced by astroglia. Journal of Neuroscience. 7 (10), 3293-3299 (1987).
- Utsumi, H., et al. Expression of GFRalpha-1, receptor for GDNF, in rat brain capillary during postnatal development of the BBB. American Journal of Physiology and Cell Physiology. 279 (2), (2000).
- Tran, N. D., Correale, J., Schreiber, S. S., Fisher, M. Transforming growth factor-beta mediates astrocyte-specific regulation of brain endothelial anticoagulant factors. Stroke. 30 (8), 1671-1678 (1999).
- Balabanov, R., Washington, R., Wagnerova, J., Dore-Duffy, P. CNS microvascular pericytes express macrophage-like function, cell surface integrin alpha M, and macrophage marker ED-2. Microvascular Research. 52 (2), 127-142 (1996).
- Ramsauer, M., Krause, D., Dermietzel, R. Angiogenesis of the blood-brain barrier in vitro and the function of cerebral pericytes. Faseb Journal. 16 (10), 1274-1276 (2002).
- Lindahl, P., Johansson, B. R., Leveen, P., Betsholtz, C. Pericyte loss and microaneurysm formation in PDGF-B-deficient mice. Science. 277 (5323), 242-245 (1997).
- Young, G. B., Bolton, C. F., Archibald, Y. M., Austin, T. W., Wells, G. A. The electroencephalogram in sepsis-associated encephalopathy. Journal of Clinical Neurophysiology. 9 (1), 145-152 (1992).
- Carlyle Clawson, C., Francis Hartmann, J., Vernier, R. L. Electron microscopy of the effect of gram-negative endotoxin on the blood-brain barrier. Journal of Comparative Neurology. 127 (2), 183-197 (1966).
- Jeppsson, B., et al. Blood-brain barrier derangement in sepsis: cause of septic encephalopathy?. The American Journal of Surgery. 141 (1), 136-142 (1981).
- Tighe, D., Moss, R., Bennett, D. Cell surface adrenergic receptor stimulation modifies the endothelial response to SIRS. Systemic Inflammatory Response Syndrome. New Horizons (Baltimore, Md). 4 (4), 426-442 (1996).
- Kim, K. S., et al. The K1 capsule is the critical determinant in the development of Escherichia coli meningitis in the rat. Journal of Clinical Investigation. 90 (3), 897-905 (1992).
- Kim, K. S., Wass, C. A., Cross, A. S. Blood-brain barrier permeability during the development of experimental bacterial meningitis in the rat. Experimental Neurology. 145 (1), 253-257 (1997).
- Arshi, A., et al. Predictors and Sequelae of Postoperative Delirium in Geriatric Hip Fracture Patients. Geriatric Orthopaedic Surgery and Rehabililation. 9, 2151459318814823 (2018).
- Smulter, N., Lingehall, H. C., Gustafson, Y., Olofsson, B., Engstrom, K. G. Delirium after cardiac surgery: incidence and risk factors. Interactive CardioVascular and Thoracic Surgery. 17 (5), (2013).
- Kratz, T., Heinrich, M., Schlauss, E., Diefenbacher, A. Preventing postoperative delirium. Deutsches Arzteblatt International. 112 (17), 289-296 (2015).
- Uchida, Y., et al. Quantitative targeted absolute proteomics of human blood-brain barrier transporters and receptors. Journal of Neurochemistry. 117 (2), 333-345 (2011).
- Warren, M. S., et al. Comparative gene expression profiles of ABC transporters in brain microvessel endothelial cells and brain in five species including human. Pharmacology Research. 59 (6), 404-413 (2009).
- Omidi, Y., et al. Evaluation of the immortalised mouse brain capillary endothelial cell line, b.End3, as an in vitro blood-brain barrier model for drug uptake and transport studies. Brain Research. 990 (1-2), 95-112 (2003).
- Steiner, O., Coisne, C., Engelhardt, B., Lyck, R. Comparison of immortalized bEnd5 and primary mouse brain microvascular endothelial cells as in vitro blood-brain barrier models for the study of T cell extravasation. Journal of Cerebral Blood Flow and Metabolism. 31 (1), 315-327 (2011).
- Burek, M., Salvador, E., Forster, C. Y. Generation of an immortalized murine brain microvascular endothelial cell line as an in vitro blood brain barrier model. Journal of Visualized Experiments. (66), e4022 (2012).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmacolgy. 10 (1), 289-296 (2013).
- Urich, E., Lazic, S. E., Molnos, J., Wells, I., Freskgard, P. O. Transcriptional profiling of human brain endothelial cells reveals key properties crucial for predictive in vitro blood-brain barrier models. PLoS One. 7 (5), e38149 (2012).
- Lopez-Ramirez, M. A., et al. Cytokine-induced changes in the gene expression profile of a human cerebral microvascular endothelial cell-line, hCMEC/D3. Fluid Barrier CNS. 10 (27), (2013).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow Metabolism. 28 (2), 312-328 (2008).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Boyer-Di Ponio, J., et al. Instruction of circulating endothelial progenitors in vitro towards specialized blood-brain barrier and arterial phenotypes. PLoS One. 9 (1), e84179 (2014).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Lippmann, E. S., Al-Ahmad, A., Azarin, S. M., Palecek, S. P., Shusta, E. V. A retinoic acid-enhanced, multicellular human blood-brain barrier model derived from stem cell sources. Science Reports. 4, 4160 (2014).
- Lim, R. G., et al. Huntington's Disease iPSC-Derived Brain Microvascular Endothelial Cells Reveal WNT-Mediated Angiogenic and Blood-Brain Barrier Deficits. Cell Reports. 19 (7), 1365-1377 (2017).
- Stins, M. F., Badger, J., Sik Kim, K. Bacterial invasion and transcytosis in transfected human brain microvascular endothelial cells. Microbiological Pathogens. 30 (1), 19-28 (2001).
- Gaschignard, J., et al. Neonatal Bacterial Meningitis: 444 Cases in 7 Years. Pediatric Infectious Disease Journal. 30 (3), 212-217 (2011).
- Hussain, M. . The Effect of Glycation on the Permeability of an in vitro Blood-brain Barrier Model. , (2015).
- Weber, V. . The effect of glycation on the permeability of human blood-brain barrier. , (2019).
- Hussain, M., et al. Novel insights in the dysfunction of human blood-brain barrier after glycation. Mechanism of Ageing Development. 155, 48-54 (2016).
- Choi, C. Bacterial meningitis in aging adults. Clinical Infectious Disease. 33 (8), 1380-1385 (2001).
- Furth, A. J. Glycated proteins in diabetes. British Journal of Biomedical Science. 54 (3), 192-200 (1997).
- Sajithlal, G. B., Chithra, P., Chandrakasan, G. Advanced glycation end products induce crosslinking of collagen in vitro. Biochimica and Biophysica Acta. 1407 (3), 215-224 (1998).
- Ray, R., Juranek, J. K., Rai, V. RAGE axis in neuroinflammation, neurodegeneration and its emerging role in the pathogenesis of amyotrophic lateral sclerosis. Neuroscience and Biobehavior Reviews. 62, 48-55 (2016).
- DeBault, L. E., Cancilla, P. A. Gamma-Glutamyl transpeptidase in isolated brain endothelial cells: induction by glial cells in vitro. Science. 207 (4431), 653-655 (1980).
- Diglio, C. A., Grammas, P., Giacomelli, F., Wiener, J. Primary culture of rat cerebral microvascular endothelial cells. Isolation, growth, and characterization. Laboratory Investigation. 46 (6), 554-563 (1982).
- Buchert, M., Turksen, K., Hollande, F. Methods to examine tight junction physiology in cancer stem cells: TEER, paracellular permeability, and dilution potential measurements. Stem Cell Reviews. 8 (3), 1030-1034 (2012).
- Gibson, B., Wilson, D. J., Feil, E., Eyre-Walker, A. The distribution of bacterial doubling times in the wild. Proceedings of the Royal Society B: Biological Sciences. 285 (1880), (2018).
- Pron, B., et al. Interaction of Neisseria maningitidis with the components of the blood-brain barrier correlates with an increased expression of PilC. Journal of Infectious Diseases. 176 (5), 1285-1292 (1997).
- Iovino, F., Orihuela, C. J., Moorlag, H. E., Molema, G., Bijlsma, J. J. Interactions between blood-borne Streptococcus pneumoniae and the blood-brain barrier preceding meningitis. PLoS One. 8 (7), e68408 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon