Method Article
Analisando a Permeabilidade da Barreira Hematoencefálica por Travessia Microbiana através de Células Endoteliais Microvasculares
Neste Artigo
Resumo
A barreira sangue-cérebro humana impede seletivamente a penetração de moléculas hidrofônicas e patógenos no cérebro. Várias patologias, incluindo meningite e delírio pós-operatório, estão associadas a uma maior permeabilidade da barreira hematoencefálica. Aqui, descrevemos um modelo de cultura celular endotelial para testar a permeabilidade da barreira por travessia microbiana.
Resumo
A barreira hematoencefálica humana (BBB) é caracterizada por uma permeabilidade muito baixa para biomoléculas, a fim de proteger e regular o metabolismo do cérebro. O BBB é formado principalmente a partir de células endoteliais embutidas em membranas de porão ricas em colágeno IV e fibronectina. Várias patologias resultam de disfunção do BBB seguida de travessia microbiana, causando doenças como meningite. Para testar o efeito de múltiplos parâmetros, incluindo diferentes drogas e anestésicos, sobre a permeabilidade do BBB estabelecemos um novo modelo de cultura celular humana imitando o BBB com células endoteliais cerebrais humanas. As células endoteliais são cultivadas em unidades de filtro revestidas de colágeno IV e fibronectin até confluência e podem então ser tratadas com diferentes compostos de interesse. Para demonstrar uma travessia microbiana, a câmara superior com a superfície apical das células endoteliais é inoculada com bactérias. Após um período de incubação, são contabilizadas amostras da câmara baixa em placas de agar e as colônias obtidas, pelo qual o número de colônias se correlaciona com a permeabilidade do BBB. Fatores celulares endógenos podem ser analisados nesta configuração experimental, a fim de elucidar mecanismos celulares básicos das células endoteliais que contribuem para o BBB. Além disso, esta plataforma permite realizar uma tela para compostos que possam afetar a permeabilidade das células endoteliais. Finalmente, a travessia bacteriana pode ser estudada e ligada a diferentes patologias, como a meningite. Talvez seja possível estender o modelo e analisar os caminhos da bactéria através do BBB. Neste artigo, fornecemos um protocolo detalhado do método descrito para investigar a permeabilidade do BBB.
Introdução
O BBB humano é um limite único do tecido cerebral, separando o cérebro do sangue. Regula estritamente a passagem de moléculas maiores e hidrofílicas, bloqueia difusão paracelular e mantém homeostase cerebral. Ele também protege o cérebro de flutuações plasmáticas, toxinas, micróbios e guia células inflamatórias como parte da imunidade do sistema nervoso central (CNS). Desde sua descoberta há um século1,muitos estudos foram realizados para entender a estrutura e a função do BBB. As interações complexas de células, proteínas e sinais do cérebro e do sangue exigem ainda mais investigação e modelos.
O BBB humano é composto por três tipos de células: células endoteliais microvasculares cerebrais (BMECs), pericites e astrócitos2,3. Os BMECs diferem da maioria das células endoteliais do corpo, na deter idade, em que possuem um alto número de junções apertadas e junções de adeptos4, baixa atividade pinocitotica2,5, e uma membrana contínua do porão6,7 para bloquear a difusão paracelular. Pequenas moléculas lipofílicas podem difundir e passar pelo BBB após seu gradiente de concentração; moléculas maiores e hidrofílicas entram ou deixam o cérebro apenas através de sistemas de transporte seletivo expressos polarizados8. Esta regulamentação resulta em uma alta resistência elétrica tranportelial (TEER) de 1.500-2.000 Ω·cm2 que está inversamente correlacionada com permeabilidade9,10. Embora os BMECs construam uma barreira apertada, eles podem reagir a sinais locais e periféricos11,12. Há uma interação estreita entre BMECs e astrócitos13; os pés finais astrócitos constroem uma camada ao redor dos vasos e induzem a formação de junções apertadas13,14. Eles estão envolvidos no amadurecimento do BBB com diferentes fatores, incluindo transformar o fator de crescimento-β (TGF-β)15,16. Além disso, os pericites desempenham um papel fundamental na regulação da angiogênese17 e na prevenção da apoptose do endotelo na diferenciação celular18 (Figura 1). Eles estão embutidos na membrana do porão e fornecem estabilidade estrutural da parede da embarcação19.
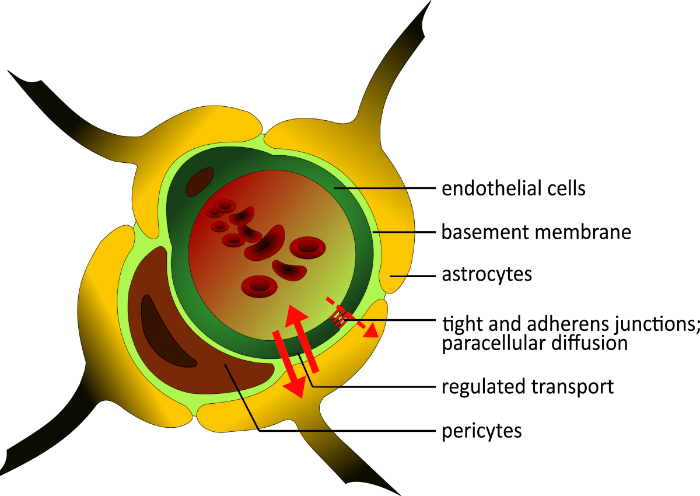
Figura 1: Estrutura esquemática da barreira hematoencefálica. A estrutura única do BBB humano é composta por três tipos diferentes de células. O lúmen microvasoérérico é cercado por células endoteliais, que são enriquecidas em junções apertadas, e não são fenestrizadas. Eles estão embutidos na membrana do porão, como os pericytes. Essas células são importantes para a estabilidade estrutural da parede da embarcação e desempenham um papel no desenvolvimento do BBB ao lado dos astrócitos. Seus pés finais constroem uma camada próxima ao redor da nave e apoiam a construção de junções apertadas. Todos os componentes do BBB são importantes para a funcionalidade fisiológica. Clique aqui para ver uma versão maior deste valor.
Muitas patologias diferentes estão relacionadas ao colapso do BBB (por exemplo, encefalopatia séptica). Os pacientes afetados aumentaram os níveis de proteína no fluido cefalorraquidiano20,e o parenchyma cerebral nos roedores afetados mostra uma maior absorção de óxido de ferro cocoloidal marcado e aminoácidos21,22. Esses resultados apontam para um aumento da permeabilidade do BBB que ocorre ao lado de uma pinocitose aumentada nos BMECs21 e ativação endólial23. Outra patologia associada relacionada a um BBB alterado é a meningite, uma emergência médica e uma inflamação complexa acompanhada de edema cerebral que pode levar à morte celular neuronal. O local de entrada primária das bactérias circulantes deveria ser os microvasos24; no entanto, o BBB impede a entrada de bactérias. A permeabilidade do BBB nem sempre está ligada ao aumento da meningite hematogena experimental25 e os mecanismos podem ser multifatoriais. Coincidência de sepse com delírio pós-operatório (POD)26 e associação com infecções pré-operatórias27,28 indica a necessidade de um modelo BBB que permita a exposição direta a bactérias para obter uma melhor compreensão em patógense bacteriana.
Há muitas lacunas na compreensão e quantificação do travessia microbiano através do BBB. Por isso, desenvolvemos um modelo que permite um teste conveniente de diferentes fatores e condições com correlação direta entre travessia bacteriana e influências sobre a permeabilidade do BBB. Trabalhoanterior se concentrou na permeabilidade paracelular e incluiu medição TEER e fluxo de rastreador. Além disso, o transporte de macromoléculas foi analisado por moléculas conjugadas ou anticorpos, pelos quais foram desenvolvidos diferentes modelos utilizando apenas células oundoteliais ou combinações com astrócitos e pericites. Devido à dificuldade de obtenção de tecido humano regularmente, muitos modelos de origem animal são usados. Células endoteliais cerebrais de origem bovina e suína formam monocamadas apertadas com um TEER alto que formam a polaridade apical-basal bem moldada e são adequadas para investigações de transporte de pequenas moléculas através do BBB. As proteínas diferem em sequência de seus homôgos humanos29,30, dificultando a investigação de anticorpos terapêuticos. Por essa razão, modelos de murina ou cultura humana podem ser preferíveis. Camundongos ou ratos como fontes amostrais têm a vantagem de serem obtidos de espécies bem caracterizadas, mas produzem poucas células para fins de estudo. Isso pode ser contornado pelo uso de linhas celulares de camundongoimortalizado (END) bEND.3, bEND.5 ou cEND31,32,33.
Células cultivadas primárias do tecido humano são difíceis de obter e manusear regularmente. Portanto, a maioria dos modelos celulares humanos usados em pesquisas que investigam o BBB humano são linhas de células endoteliais imortalizadas. Uma linha celular publicada é a linha de células endoteliais do cérebro cerebral humano hCMEC/D3, que é bem adequada para estudar a captação de medicamentos e é fácil de manusear. As células constroem um monocamada e expressam as características proteínas de junção apertada do BBB34, enquanto o nível de expressão do claudin-5 é relatado ser menor do que em microvasos intactos35 e muitos transportadores específicos foram detectados no nível da transcrição36, bem como em estudos proteomicos34. Um TEER relativamente baixo na faixa de 30-50 Ω·cm2 ainda é um desafio37. Outra fonte para células-tronco endoteliais cerebrais são células-tronco pluripotentes humanas (hPSCs)38 e células-tronco derivadas do sangue do cordão humano de progenitor endotelial circulante e linhagenietic39,40. Ambos os protocolos de diferenciação resultam em monocamadas de células apertadas e altos valores TEER (por exemplo, 1.450 Ω·cm2 em co-culturas)38. Esses modelos de células-tronco requerem extremo cuidado para o cultivo, mas oferecem a oportunidade de estudar a influência de hormônios reguladoresde 41 ou doenças com formação genética42 no desenvolvimento do BBB.
Neste estudo, estabelecemos uma linha de células endoteliais endoteliais transvasculares transmortais transinfectadas, THBMEC43,para imitar o BBB e estudar travessia bacteriana. As células são semeadas em um filtro e cultivadas para 100% de confluência neste modelo de cultura celular. As bactérias são vacinadas na parte superior da câmara de cultura celular. Usamos Escherichia coliemnosso estudo amostral devido à alta incidência de meningite E. coli 44. Foi demonstrado que a menor permeabilidade da monocamada celular ocorre entre o dia 13 e o dia 15 após a semeação45. Portanto, o tratamento da monocamada THBMEC é realizado após esse tempo e as bactérias são inoculadas depois no meio na superfície apical da monocamada. Após um tempo de incubação, as bactérias que foram capazes de atravessar a barreira são quantificadas através do meio de chapeamento com as bactérias em placas de agar e contando as colônias. Um número crescente de colônias se correlaciona com maior travessia bacteriana através do BBB. O TEER é cerca de 70 Ω·cm246. No entanto, não é necessário medir o TEER no método descrito. Embora seja um valor bem estabelecido para a permeabilidade do BBB, parece não ter impacto na travessia de bactérias através do BBB. Células não tratadas servem como um controle do aperto em nosso modelo. Foi mostrado em trabalhos anteriores que as células são capazes de reagir a citocinas proinflamatórias e expressar proteínas típicas de junção apertada47. Isso permite a triagem composta e validação de um conjunto maior de substratos e receptores transportadores.
Protocolo
1. Preparação de Buffer e Reagentes
- Prepare 10x de sorofito tampão de fosfato (10x PBS) adicionando 80 g de cloreto de sódio (NaCl), 2 g de cloreto de potássio (KCl), 14,4 g de dihidratante de dissólo-hidrogênio-hidrogênio (Na2HPO4 · 2H2O) e 2 g de fosfato de potássio-dihidrogênio (KH2PO4) em um frasco de vidro 1 L de duplo destilado Hstilled2.Autoclave a solução PBS de 10x e diluir 100 mL desta solução em 900 mL de água destilada dupla para obter 1x PBS.
- Use o autoclave para esterilizar soluções. Coloque o frasco de vidro na cesta, feche a tampa e esterilize-a por 15 min a 121 °C e 98,9 kPa.
NOTA: Este protocolo é sempre usado para soluções de autoclaving em etapas adicionais.
- Use o autoclave para esterilizar soluções. Coloque o frasco de vidro na cesta, feche a tampa e esterilize-a por 15 min a 121 °C e 98,9 kPa.
- Prepare uma solução de 10 μg/mL de colágeno IV e 10 μg/mL fibronectin diluindo 0,5 mg/mL de solução fibronectina e a solução de colágeno IV de 0,3 mg/mL cada uma com alíquotas de 1x PBS a 100 mg/μL em micro tubos de 1,5 mL. A partir daí, misture 100 μL de ambas as alíquotas com 1.800 μL de 1x PBS em 2 micro tubos mL e armazene-os a -20 °C.
- Prepare o meio DMEM/F-12 adicionando 4% de soro bovino fetal e 2 mM L-glutamina e 100 mg/L penicilina/estreptomicina ao médio e armazená-lo a 4 °C.
- Prepare a solução 1x trypsin-EDTA diluindo 5 mL da solução trypsin-EDTA concentrada de 10x com 45 mL de 1x PBS em um tubo de 50 mL e armazená-la a 4 °C.
- Prepare 500 mL de meio LB pesando 10 g de base de caldo LB em um frasco de vidro de 500 mL. Adicione 500 mL de água esterilizada e autoclave-lo.
- Prepare agar LB pesando 10 g de base de caldo LB e 7,5 g de ágar-agar em um frasco de vidro de 500 mL. Adicione 500 mL de água esterilizada antes de autoclaving e não feche a tampa do frasco. Autoclave e deixe a solução para esfriar até que esteja quente ao toque.
- Prepare o meio sem antibióticos adicionando 4% de soro bovino fetal e 2 mM L-glutamina, mas sem penicilina/estreptomicina ao meio DMEM/F-12 e armazená-lo a 4 °C como na etapa 1.3.
2. Crescimento da Barreira hematoencefálica imitando células
- Para montar a placa de 12 poços, coloque as pastilhas de cultura celular nos poços(Figura 2A).
- Desempacotar a placa e cada inserção em um armário de segurança biológica e realizar mais passos lá. Use fórceps esterilizados para pegar a inserção em sua base ampla para movê-la.
- Cubra a membrana porosa de cada inserção com 90 μL de 10 μg/mL colágeno IV e 10 μg/mL mistura de fibronectina. Incubar a placa de 12 poços por 24 h a 37 °C em uma incubadora de cultura celular (Figura 2B).
- Lave as pastilhas duas vezes canalizando 1 mL de 1x PBS em cada inserção e aspiraa a solução com uma bomba de vácuo para culturas celulares.
- Equilibre as membranas canalizando 0,5 mL de meio DMEM/F-12 pré-aquecido na parte superior e 1,5 mL na câmara inferior. Incubar a placa por 30 min a 37 °C em uma incubadora de cultura celular com 5% de atmosfera de CO2 (Figura 2C).
- Sementes 2 x 105 células endoteliais microvasculares humanas em cada câmara superior e incubam a placa de 12 poços a 37 °C em uma incubadora de cultura celular (Figura 2D).
- Aspirar o meio do frasco de cultura celular usando uma bomba de vácuo para culturas celulares e lave a monocamada canalizando 10 mL de 1x PBS e aspirando a solução depois com uma bomba de vácuo.
- Cubra as células completamente com 1x de trippsina concentrada-EDTA, canalizando 5 mL da solução para o frasco de cultura celular. Incubar o frasco de 3-5 min a 37 °C em uma incubadora de cultura celular.
NOTA: Se as células não forem dissociadas, toque firmemente no frasco contra a palma da mão para desalojar as células. - Tome 5 mL com uma pipeta como uma alíquota da suspensão celular em um tubo de 15 mL e adicione 5 mL do meio contendo FCS para parar a reação enzimática.
- Centrífuga a suspensão por 3 min a 210 x g, remova o supernatant com uma bomba de vácuo e resuspenda a pelota em 5 mL de médio com uma pipeta.
- Use o contador de células misturando 10 μL da suspensão celular com 10 μL de 0,4% de mancha azul trypan em um micro tubo de 1,5 mL. Adicione 10 μL da mistura em um slide de câmara de contagem, coloque-a no balcão da célula e comece a contar.
- Concentre o balcão nas células para que sua borda seja azul escuro e o branco médio. Depois disso, inicie o programa apropriado para contagem de células.
- Para calcular o volume de cada inserção, divida as 2 x 105 células obtidas por inserção com a concentração calculada da suspensão celular.
3. Cultivo do Modelo de Barreira Hematoencefálica
- Incubar a placa de 12 poços por 14 dias a 37 °C.
- Troque 0,5 mL de média para a câmara superior e 1,5 mL de média para o menor a cada 2-3 dias. Aqueça o meio antes de colocá-lo no frasco celular. Aspirado com a bomba de vácuo (Figura 2E).
NOTA: Trabalhe cuidadosamente para evitar tocar na membrana. - Verifique o status das células imagenndo-as com um microscópio e determine a confluência. Certifique-se de que a confluência seja 100% após 14 dias.
4. Preparação de Bactérias
- Um dia antes da medição, coloque uma colônia da cepa E. coli GM2163 em meio LB. Incubar o tubo de cultura por 24 h a 37 °C com 180 rpm em um shaker de incubação (Figura 2F).
- Cultive a tensão E. coli em uma placa de agar LB a 4 °C. Pegue uma colônia com uma picareta esterilizada e coloque a picareta no tubo de cultura preparado com 3 mL de meio LB.
- Prepare uma placa de agar LB para cada inserção com solução de ágar LB quente e encha os pratos de Petri para metade de seu volume total. Deixe-os se tornarem sólidos e armazená-los a 4 °C.
5. Tratamento de Células
- No dia 14 após a semeada, trate células com compostos ou mede a resistência elétrica transerthelial (TEER), se planejada (Figura 2G).
NOTA: Sempre tenha algumas células não tratadas como controle.- Para tratar células com o composto de interesse, dilua o composto à concentração final no meio DMEM/F-12. Adicione 0,5 mL desta mistura na câmara superior e 1,5 mL na câmara inferior. Incubar a placa em uma incubadora de cultura celular pelo tempo desejado.
- Posteriormente, troque o meio completo com meio sem antibióticos aspirando com a bomba de vácuo e pipetting(Figura 2H).
6. Medição da Permeabilidade
- Para obter concentrações constantes de bactérias, meça a densidade óptica com um fotômetro a um comprimento de onda de 600 nm. Diluir a solução noturna de bactérias com meio LB em um tubo falcão de 50 mL para um OD600 de 0,5 ± 0,05. Trabalhe no gelo.
- Preencha 1 mL de meio LB em um cuvette. Inicie o fotômetro e coloque o cuvette, marcado lateral para a frente. Pressione o fundo "Blank" para medir o valor em branco depois.
- Meça a densidade da solução bacteriana enchendo-a em um cuvette, colocando-a e pressionando a amostra inferior. Repita a medição durante a diluição até obter a concentração final.
- Trabalhe em um gabinete de segurança biológica onde as bactérias podem ser manuseadas com a placa de poço preparada 12 e solução bacteriana em OD600 = 0,5. Adicione 450 μL de solução bacteriana apenas em cada câmara superior contendo 0,5 mL de média(Figura 2I).
- Incubar a placa de 12 poços por 6 h a 37 °C em uma incubadora.
NOTA: O protocolo dita fazer uma pausa aqui. - Prove 50 μL do meio com uma pipeta de cada câmara inferior, removendo a inserção com fórceps(Figura 2J). Tome cuidado para não derramar o meio das câmaras superiores para as inferiores.
- Prato cada amostra em um agar-plate separado (Figura 2K). Largue a amostra na placa e esgote a solução com um espalhador de células.
- Incubar as placas de ágar por 24 h a 37 °C em uma incubadora.
- Conte as colônias em cada prato (Figura 2L).
7. Analisando dados
- Escreva os dados em uma tabela e calcule o desvio médio e padrão das colônias observadas de células tratadas e não tratadas.
- Mostre a média como o número absoluto de colônias.
- Para normalizar os resultados, calcule o número relativo de colônias dividindo todos os resultados com o valor de controle.
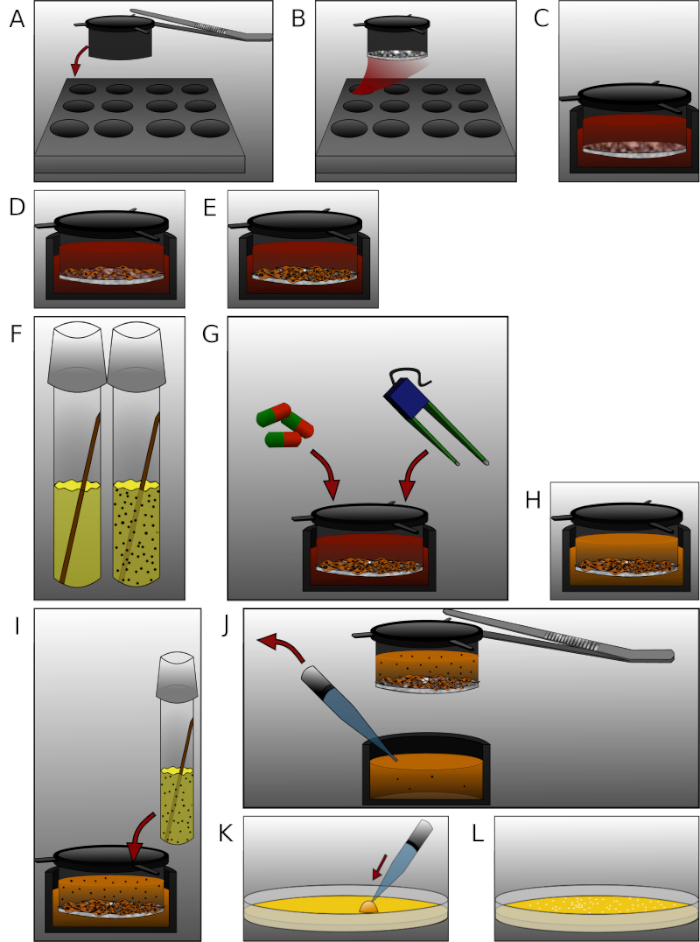
Figura 2: Apresentação detalhada das etapas individuais no protocolo. (A)Coloque as pastilhas com fórceps esterilizados na placa de 12 poços. (B) Cubra cada inserção com 90 μL de fibronectina e mistura de colágeno IV e incubar por 24 h.(C) Equilibrar as membranas com meio pré-aquecido por 30 min.(D) Sementes 2 x 105 células endoteliais cerebrais humanas microvasculares por inserção. (E) Cultivar a placa pelo tempo adequado. (F) Um dia antes da medição, coloque uma colônia E. coli em um tubo de cultura média LB e incuba por 24 h.(G) Trate células ou meça TEER. (H) Trocar meio completo com meio sem antibióticos. (I) Adicione 450 μL de solução bacteriana (OD600 = 0,5) em cada câmara superior e incubar por 6 h.(J) Amostra de 50 μL de média de cada câmara inferior removendo inserção com fórceps. (K) Plaquere a amostra em placas de ágar e incuba por 24 h.(L) Conte as colônias e analise os dados. Clique aqui para ver uma versão maior deste valor.
Resultados
Seguindo o protocolo, as células foram semeadas, e o modelo BBB foi construído. No dia 14 após a semeada, as células foram tratadas com glioxal como aldeído reativo. O objetivo do experimento foi investigar a correlação entre idade e diabetes no POD27 e a alta incidência de meningite em pacientes idosos48. O aumento dos níveis de produtos avançados de glicação (AGEs) tanto na idade quanto no diabetes49 exigem um exame mais aprofundado do efeito da glicação na patogênese da travessia microbiana através do BBB. A glicação é uma reação não enzimática de grupos de amino gratuitos em proteínas com grupos carbonídeos de redução de carboidratos ou outros compostos carbonídeos. A glicose é bem conhecida como doadora de grupos carbonilos; no entanto, há mais reativos conhecidos. Depois de construir uma base instável de Schiff, eles reorganizam compostos dicarboníolos mais estáveis e reativos como glyoxal. AGEs, os produtos finais, pode causar ligações cruzadas entre proteínas50. Eles podem danificar estruturas celulares e alterar a função celular por interação com o receptor de AGEs (RAGE)51.
As células foram tratadas com uma solução glyoxal de 0,05 m e 0,15 mM (GO) por 1h, e as células não tratadas serviram como controle. A glicação foi detectada via imunolote e detecção com um anticorpo anti-AGE (Figura 3). As colônias bacterianas obtidas foram contadas e representadas como o número absoluto de colônias (Figura 4A) ou o número relativo de colônias normalizadas ao controle (Figura 4B). O médium retirado de poços com as células não tratadas formou pouquíssimas colônias. Este resultado demonstrou que as células não tratadas foram capazes de construir uma barreira e poderiam servir como um controle. Amostras tratadas com glioxal apresentaram um número aumentado de colônias, levando à conclusão de que há um efeito de glioxal nos THBMECs e a densidade da barreira celular, pois o número de colônias demonstrou uma diferença significativa entre células não tratadas e tratadas. O aumento da travessia bacteriana da barreira após o tratamento com glyoxal poderia explicar por que o diabetes está correlacionado com doenças com um rompimento do BBB.
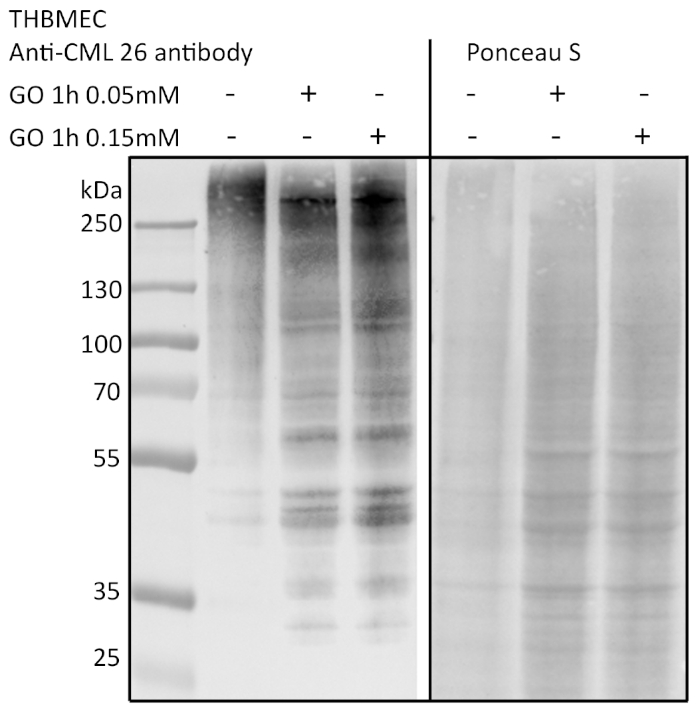
Figura 3: Detecção da glicação proteica via imunolote. ThBMECs foram tratados com GO em diferentes concentrações por 1 h. A proteína total foi isolada e separada usando SDS-PAGE. A glicação das proteínas foi detectada através da imunocoagulação usando anti-age-anticorpo (CML-26). Clique aqui para ver uma versão maior deste valor.
Em um cenário diferente, a glicação proteica dos THBMECs foi induzida pela glicose. A glicose esterilizada foi adicionada ao meio DMEM/F-12 para aumentar a concentração de glicose do meio de glicose normal (NG) com 17,5 mM para médio de glicose elevado (HG) com 42,5 mM. Os THBMECs foram cultivados em dois frascos diferentes de cultura celular: um em meio de glicose normal (NG) e outro em meio de alta glicose (HG). Essas duas mídias diferentes também foram utilizadas para o crescimento do BBB em filtros em 12 placas de poço. Células cultivadas em meio ng serviram como controle. As colônias obtidas são representadas como o número absoluto de colônias (Figura 4C) ou o número relativo de colônias normalizadas ao controle (Figura 4D). Os resultados não indicam nenhum efeito significativo na travessia de bactérias através do BBB humano, levando à conclusão de que o efeito de NG vs. HG não foi grave o suficiente para afetar a integridade do BBB. Os diferentes cenários foram projetados para provar o modelo e a integridade das células imitando o BBB.
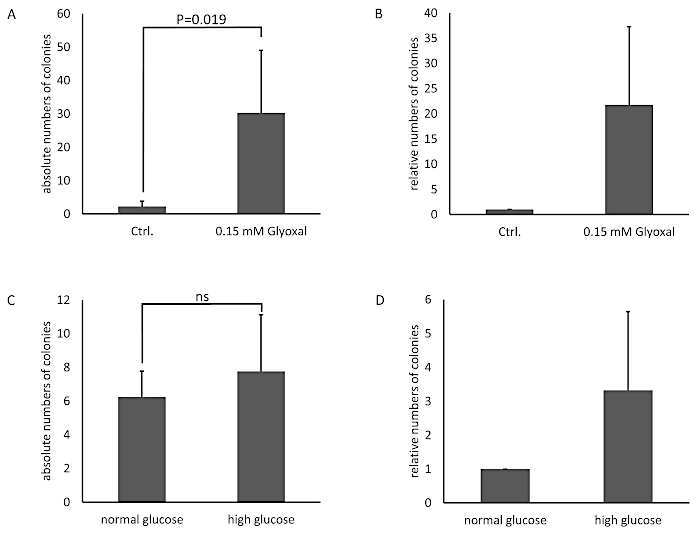
Figura 4: Números absolutos e relativos de colônias bacterianas contadas no modelo BBB com THBMECs. ThBMECs foram tratados com 0,15 mM GO por 1h, as células não tratadas serviram como controle. Um total de 450 μL de suspensão E. coli (OD600 = 0,5) foi adicionado a cada câmara superior. Médio das câmaras inferiores foi banhado em placas de ágar após 6 h. (A) O gráfico mostra a média média +/- SEM de colônias contadas. (B) O gráfico mostra as colônias contadas normalizadas para as células não tratadas como controle +/- SEM (n = 4). Em (C) e (D),thbmecs foram cultivados em NG e HG médio. Um total de 450 μL de suspensão E. coli (OD600 = 0,5) foi adicionado a cada câmara superior. Médio da câmara inferior foi banhado em placas de ágar após 6 h. (C) O gráfico mostra a média média +/- SEM de colônias contadas. (D) O gráfico mostra as colônias contadas normalizadas para as células não tratadas como controle +/- SEM (n = 3). Clique aqui para ver uma versão maior deste valor.
Discussão
Visão limitada da patogênese da travessia microbiana limita ainda mais o desenvolvimento de terapias para POD ou meningite. A mortalidade e a morbidade dessas doenças exigem melhor tratamento do paciente, requerem pesquisas dos mecanismos subjacentes e precisam de uma plataforma robusta para triagem composta. Os eventos multifatoriais podem ser estudados com BMECs humanos. Vários procedimentos de isolamento relatados bem-sucedidos de BMECs de várias espécies mostraram perda das características das células assinatura molecular52,53. Os THBMECs descritos neste procedimento foram transfeccionados em passagens muito precoces, onde apresentaram características específicas das células endoteliais cerebrais e as preservaram43. Isso é importante, porque nem todos os passos nas vias afetadas foram descobertos até agora, e este modelo parece imitar BMECs convencionais. Nosso modelo apresentado mostra influências diretas nos BMECs e na travessia microbiana através do BBB.
O manuseio das células THBMEC é simples, e o equipamento técnico necessário existe na maioria dos laboratórios de ciências da vida. Nosso modelo permite um início imediato de procedimentos investigativos depois que os THBMECs construíram uma monocamada apertada. O campo de aplicações pode ser extenso devido às possíveis combinações entre novos testes e ensaios convencionais, como medição teer ou rotulagem com rastreadores54. Também é possível adicionar astrócitos ou pericitos para fazer um modelo de co ou tríplice cultura. A influência das drogas na travessia microbiana também poderia ser testada em nosso modelo tratando os THBMECs com compostos antes de inocular a câmara superior com bactérias. Na verdade, é possível comprar inserções com filtros para 96 placas de poço que permitem a automação do procedimento. Isso pode facilitar a implementação de sistemas de triagem de medicamentos de alto porte para acelerar a descoberta de medicamentos contra as doenças mencionadas e reduzir os efeitos colaterais no BBB durante o desenvolvimento de medicamentos.
Um passo crítico no método apresentado é o tempo de incubação depois de adicionar as bactérias à câmara superior. É importante usar horas como cronogramano protocolo, pois o tempo de geração de E. coli é de apenas 20 min55. Caso contrário, o uso de diferentes pontos de tempo pode levar a resultados enganosos. Há também um possível risco de contaminação entre câmara superior e inferior durante a exposição bacteriana se as placas não forem manuseadas com cuidado. Qualquer alteração na placa de 12 poços neste momento poderia contaminar o meio na câmara inferior.
E. coli é uma causa bem conhecida e muito comum de meningite bacteriana. Investigações mais aprofundadas devem testar diferentes bactérias que também estão associadas à meningite, como neisseria meningite56 ou Streptococcus pneumoniae57. Estes parecem usar diferentes mecanismos para atravessar o BBB e precisam ser melhor compreendidos para o tratamento dos pacientes. Em pacientes idosos, a incidência de POD aumenta26, bem como o número de comorbidades ocorridas. Sabe-se que existem interações entre diferentes doenças, especialmente as sistêmicas como o diabetes. Em nosso modelo, é possível simular essas condições ou tratar as células antes de adicionar as bactérias.
O modelo é limitado pelo contato direto de THBMECs e bactérias, e novas pesquisas são necessárias para investigar mecanismos potenciais de contato para detectar as vias e proteínas envolvidas. No entanto, é possível remover as pastilhas e colher as células para análise posterior. O TEER do modelo é menor em comparação com os modelos de células-tronco38,39,40. Confirmamos isso usando uma concentração bacteriana que não atravessou o BBB em celas não tratadas após as 6h.
Em resumo, esse método representa uma plataforma robusta para analisar a travessia de bactérias através do BBB com potencial para expandi-la para exames de drogas de alto nível.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores reconhecem o Dr. Maryam Hussain por trabalhos anteriores sobre este método, o grupo do Dr. Kerstin Danker (Charité-Universitätsmedizin, Berlim) por fornecer os THBMECs e Juliane Weber para ler criticamente o manuscrito. Este estudo foi apoiado pela RTK 2155 (ProMoAge).
Materiais
| Name | Company | Catalog Number | Comments |
| Agar - Agar | Carl Roth | 6494.3 | BioScience-Grade |
| Autoclave | Systec | VX-150 | |
| Bacteria E.coli strain GM2163 | Fermentas Life Sciences, Lithuania | ||
| Photometer | Eppendorf | 6131 | |
| Cells THBMEC | Group of M. F. Stins | ||
| Cell culture flasks | Greiner Bio-One | 658175 | |
| Centrifuge Universal 320 | Hettrichlab | 1401 | |
| Collagen IV | SIGMA Aldrich | C6745 | from human cell culture |
| Countess Automated Cell Counter with cell counting chamber slides and Trypan Blue stain 0.4% | Invitrogen | C10311 | |
| Culture tubes | Greiner Bio-One | 191180 | |
| Cuvettes | BRAND | 759015 | |
| Di sodium hydrogen phosphate di hydrate | MERCK | 1065800500 | |
| DMEM/F-12 | GIBCO/ Thermo Sc. | 11330032 | HEPES |
| Falcon tubes 15 ml | Greiner Bio-One | 188271 | |
| Falcon tubes 50 ml | Greiner Bio-One | 227261 | |
| Fetal Bovine Serum | GIBCO/ Thermo Sc. | 10270 | value FBS -Brazil |
| Fibronectin | SIGMA Aldrich | F0556 | solution human fibroblasts |
| Heracell 150 CO2 Incubator | Heraeus | 50116047 | |
| Incubator shaker I 26 New Brunswick | Eppendorf | M1324-0000 | |
| Inoculation loop | Dr. Ilona Schubert - Laborfachhandel | 641000 | |
| LB Broth Base | GIBCO/ Thermo Sc. | 12780029 | |
| L-Glutamine | GIBCO/ Thermo Sc. | 25030-081 | |
| Microbial incubator B 6200 | Heraeus | 51015192 | |
| Microbiological Safety Cabinet AURA 2000 M.A.C. Class II | BIOAIR | 12469 | |
| Microscope inverse | Zeiss | TELAVAL 31 | |
| Micro tubes 2 ml | Sarstedt | 72,695,400 | |
| Micro tubes 1,5 ml | Sarstedt | 72,706,400 | |
| Penicillin / Streptomycin | GIBCO/ Thermo Sc. | 15140122 | |
| Petri dish | Dr. Ilona Schubert - Laborfachhandel | 464-800 | |
| Potassium chloride | Roth | HN02.3 | |
| Potassium-di-hydrogen phosphate | Roth | P018.2 | |
| Sodium chloride | Roth | 9265.2 | |
| ThinCerts + Multiwell Plates | Greiner Bio-One | 665631 | 12 well, pore size 3.0 µm |
| Trypsin - EDTA | GIBCO/ Thermo Sc. | 15400054 | |
| Vacuumpump Laboport | KNF | N 86 KT.18 |
Referências
- Goldmann, E. E. . Vitalfärbung am Zentralnervensystem: Beitrag z. Physio-Pathologie d Plexus chorioideus ud Hirnhäute. , (1913).
- Reese, T. S., Karnovsky, M. J. Fine structural localization of a blood-brain barrier to exogenous peroxidase. Journal of Cell Biology. 34 (1), 207-217 (1967).
- Risau, W., Dingler, A., Albrecht, U., Dehouck, M. P., Cecchelli, R. Blood-brain barrier pericytes are the main source of gamma-glutamyltranspeptidase activity in brain capillaries. Journal of Neurochemistry. 58 (2), 667-672 (1992).
- Brightman, M. W., Reese, T. S. Junctions between intimately apposed cell membranes in the vertebrate brain. Journal of Cell Biology. 40 (3), 648-677 (1969).
- Coomber, B. L., Stewart, P. A. Morphometric analysis of CNS microvascular endothelium. Microvascular Research. 30 (1), 99-115 (1985).
- Tilling, T., Korte, D., Hoheisel, D., Galla, H. J. Basement membrane proteins influence brain capillary endothelial barrier function in vitro. Journal of Neurochemistry. 71 (3), 1151-1157 (1998).
- Morris, A. W., et al. Vascular basement membranes as pathways for the passage of fluid into and out of the brain. Acta Neuropathologica. 131 (5), 725-736 (2016).
- Betz, A. L., Goldstein, G. W. Polarity of the blood-brain barrier: neutral amino acid transport into isolated brain capillaries. Science. 202 (4364), 225-227 (1978).
- Butt, A. M., Jones, H. C., Abbott, N. J. Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study. Journal of Physiology. 429, 47-62 (1990).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- O'Carroll, S. J., et al. Pro-inflammatory TNFalpha and IL-1beta differentially regulate the inflammatory phenotype of brain microvascular endothelial cells. Journal of Neuroinflammation. 12 (131), (2015).
- Simi, A., Tsakiri, N., Wang, P., Rothwell, N. J. Interleukin-1 and inflammatory neurodegeneration. Biochemical Society Transactions. 35 (Pt 5), 1122-1126 (2007).
- Janzer, R. C., Raff, M. C. Astrocytes induce blood-brain barrier properties in endothelial cells. Nature. 325 (6101), 253-257 (1987).
- Tao-Cheng, J. H., Nagy, Z., Brightman, M. W. Tight junctions of brain endothelium in vitro are enhanced by astroglia. Journal of Neuroscience. 7 (10), 3293-3299 (1987).
- Utsumi, H., et al. Expression of GFRalpha-1, receptor for GDNF, in rat brain capillary during postnatal development of the BBB. American Journal of Physiology and Cell Physiology. 279 (2), (2000).
- Tran, N. D., Correale, J., Schreiber, S. S., Fisher, M. Transforming growth factor-beta mediates astrocyte-specific regulation of brain endothelial anticoagulant factors. Stroke. 30 (8), 1671-1678 (1999).
- Balabanov, R., Washington, R., Wagnerova, J., Dore-Duffy, P. CNS microvascular pericytes express macrophage-like function, cell surface integrin alpha M, and macrophage marker ED-2. Microvascular Research. 52 (2), 127-142 (1996).
- Ramsauer, M., Krause, D., Dermietzel, R. Angiogenesis of the blood-brain barrier in vitro and the function of cerebral pericytes. Faseb Journal. 16 (10), 1274-1276 (2002).
- Lindahl, P., Johansson, B. R., Leveen, P., Betsholtz, C. Pericyte loss and microaneurysm formation in PDGF-B-deficient mice. Science. 277 (5323), 242-245 (1997).
- Young, G. B., Bolton, C. F., Archibald, Y. M., Austin, T. W., Wells, G. A. The electroencephalogram in sepsis-associated encephalopathy. Journal of Clinical Neurophysiology. 9 (1), 145-152 (1992).
- Carlyle Clawson, C., Francis Hartmann, J., Vernier, R. L. Electron microscopy of the effect of gram-negative endotoxin on the blood-brain barrier. Journal of Comparative Neurology. 127 (2), 183-197 (1966).
- Jeppsson, B., et al. Blood-brain barrier derangement in sepsis: cause of septic encephalopathy?. The American Journal of Surgery. 141 (1), 136-142 (1981).
- Tighe, D., Moss, R., Bennett, D. Cell surface adrenergic receptor stimulation modifies the endothelial response to SIRS. Systemic Inflammatory Response Syndrome. New Horizons (Baltimore, Md). 4 (4), 426-442 (1996).
- Kim, K. S., et al. The K1 capsule is the critical determinant in the development of Escherichia coli meningitis in the rat. Journal of Clinical Investigation. 90 (3), 897-905 (1992).
- Kim, K. S., Wass, C. A., Cross, A. S. Blood-brain barrier permeability during the development of experimental bacterial meningitis in the rat. Experimental Neurology. 145 (1), 253-257 (1997).
- Arshi, A., et al. Predictors and Sequelae of Postoperative Delirium in Geriatric Hip Fracture Patients. Geriatric Orthopaedic Surgery and Rehabililation. 9, 2151459318814823 (2018).
- Smulter, N., Lingehall, H. C., Gustafson, Y., Olofsson, B., Engstrom, K. G. Delirium after cardiac surgery: incidence and risk factors. Interactive CardioVascular and Thoracic Surgery. 17 (5), (2013).
- Kratz, T., Heinrich, M., Schlauss, E., Diefenbacher, A. Preventing postoperative delirium. Deutsches Arzteblatt International. 112 (17), 289-296 (2015).
- Uchida, Y., et al. Quantitative targeted absolute proteomics of human blood-brain barrier transporters and receptors. Journal of Neurochemistry. 117 (2), 333-345 (2011).
- Warren, M. S., et al. Comparative gene expression profiles of ABC transporters in brain microvessel endothelial cells and brain in five species including human. Pharmacology Research. 59 (6), 404-413 (2009).
- Omidi, Y., et al. Evaluation of the immortalised mouse brain capillary endothelial cell line, b.End3, as an in vitro blood-brain barrier model for drug uptake and transport studies. Brain Research. 990 (1-2), 95-112 (2003).
- Steiner, O., Coisne, C., Engelhardt, B., Lyck, R. Comparison of immortalized bEnd5 and primary mouse brain microvascular endothelial cells as in vitro blood-brain barrier models for the study of T cell extravasation. Journal of Cerebral Blood Flow and Metabolism. 31 (1), 315-327 (2011).
- Burek, M., Salvador, E., Forster, C. Y. Generation of an immortalized murine brain microvascular endothelial cell line as an in vitro blood brain barrier model. Journal of Visualized Experiments. (66), e4022 (2012).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmacolgy. 10 (1), 289-296 (2013).
- Urich, E., Lazic, S. E., Molnos, J., Wells, I., Freskgard, P. O. Transcriptional profiling of human brain endothelial cells reveals key properties crucial for predictive in vitro blood-brain barrier models. PLoS One. 7 (5), e38149 (2012).
- Lopez-Ramirez, M. A., et al. Cytokine-induced changes in the gene expression profile of a human cerebral microvascular endothelial cell-line, hCMEC/D3. Fluid Barrier CNS. 10 (27), (2013).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow Metabolism. 28 (2), 312-328 (2008).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Boyer-Di Ponio, J., et al. Instruction of circulating endothelial progenitors in vitro towards specialized blood-brain barrier and arterial phenotypes. PLoS One. 9 (1), e84179 (2014).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Lippmann, E. S., Al-Ahmad, A., Azarin, S. M., Palecek, S. P., Shusta, E. V. A retinoic acid-enhanced, multicellular human blood-brain barrier model derived from stem cell sources. Science Reports. 4, 4160 (2014).
- Lim, R. G., et al. Huntington's Disease iPSC-Derived Brain Microvascular Endothelial Cells Reveal WNT-Mediated Angiogenic and Blood-Brain Barrier Deficits. Cell Reports. 19 (7), 1365-1377 (2017).
- Stins, M. F., Badger, J., Sik Kim, K. Bacterial invasion and transcytosis in transfected human brain microvascular endothelial cells. Microbiological Pathogens. 30 (1), 19-28 (2001).
- Gaschignard, J., et al. Neonatal Bacterial Meningitis: 444 Cases in 7 Years. Pediatric Infectious Disease Journal. 30 (3), 212-217 (2011).
- Hussain, M. . The Effect of Glycation on the Permeability of an in vitro Blood-brain Barrier Model. , (2015).
- Weber, V. . The effect of glycation on the permeability of human blood-brain barrier. , (2019).
- Hussain, M., et al. Novel insights in the dysfunction of human blood-brain barrier after glycation. Mechanism of Ageing Development. 155, 48-54 (2016).
- Choi, C. Bacterial meningitis in aging adults. Clinical Infectious Disease. 33 (8), 1380-1385 (2001).
- Furth, A. J. Glycated proteins in diabetes. British Journal of Biomedical Science. 54 (3), 192-200 (1997).
- Sajithlal, G. B., Chithra, P., Chandrakasan, G. Advanced glycation end products induce crosslinking of collagen in vitro. Biochimica and Biophysica Acta. 1407 (3), 215-224 (1998).
- Ray, R., Juranek, J. K., Rai, V. RAGE axis in neuroinflammation, neurodegeneration and its emerging role in the pathogenesis of amyotrophic lateral sclerosis. Neuroscience and Biobehavior Reviews. 62, 48-55 (2016).
- DeBault, L. E., Cancilla, P. A. Gamma-Glutamyl transpeptidase in isolated brain endothelial cells: induction by glial cells in vitro. Science. 207 (4431), 653-655 (1980).
- Diglio, C. A., Grammas, P., Giacomelli, F., Wiener, J. Primary culture of rat cerebral microvascular endothelial cells. Isolation, growth, and characterization. Laboratory Investigation. 46 (6), 554-563 (1982).
- Buchert, M., Turksen, K., Hollande, F. Methods to examine tight junction physiology in cancer stem cells: TEER, paracellular permeability, and dilution potential measurements. Stem Cell Reviews. 8 (3), 1030-1034 (2012).
- Gibson, B., Wilson, D. J., Feil, E., Eyre-Walker, A. The distribution of bacterial doubling times in the wild. Proceedings of the Royal Society B: Biological Sciences. 285 (1880), (2018).
- Pron, B., et al. Interaction of Neisseria maningitidis with the components of the blood-brain barrier correlates with an increased expression of PilC. Journal of Infectious Diseases. 176 (5), 1285-1292 (1997).
- Iovino, F., Orihuela, C. J., Moorlag, H. E., Molema, G., Bijlsma, J. J. Interactions between blood-borne Streptococcus pneumoniae and the blood-brain barrier preceding meningitis. PLoS One. 8 (7), e68408 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados