Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Induktion von diffusen axonalen Hirnverletzungen bei Ratten basierend auf Rotationsbeschleunigung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll validiert ein zuverlässiges, einfach durchzuführendes und reproduzierbares Nagetiermodell der diffusen Axonalverletzung (DAI), das weit verbreitete Schäden an weißer Materie ohne Schädelfrakturen oder Prellungen verursacht.
Zusammenfassung
Traumatische Hirnverletzungen (TBI) sind eine der Hauptursachen für Tod und Behinderung. Diffuse axonale Verletzungen (DAI) ist der vorherrschende Mechanismus der Verletzung bei einem großen Prozentsatz der TBI-Patienten, die stationär behandelt werden müssen. DAI beinhaltet weit verbreitete axonale Schäden durch Schüttel-, Rotations- oder Explosionsverletzungen, was zu schnellen axonalen Dehnungsverletzungen und sekundären axonalen Veränderungen führt, die mit einem lang anhaltenden Einfluss auf die funktionelle Wiederherstellung verbunden sind. Historisch gesehen waren experimentelle Modelle von DAI ohne Fokalverletzungen schwer zu entwerfen. Hier validieren wir ein einfaches, reproduzierbares und zuverlässiges Nagetiermodell von DAI, das weitverbreitete Schäden an weißer Materie ohne Schädelfrakturen oder Prellungen verursacht.
Einleitung
Traumatische Hirnverletzungen (TBI) sind eine der Hauptursachen für Tod und Behinderung in den Vereinigten Staaten. TbIs tragen zu etwa 30% aller verletzungsbedingten Todesfällebei 1,2. Die Hauptursachen von TBI unterscheiden sich zwischen den Altersgruppen und umfassen Stürze, Hochgeschwindigkeitskollisionen beim Sport, vorsätzliche Selbstverletzung, Autounfälle und Übergriffe1,2,3.
Hirndiffuse axonale Verletzung (DAI) ist eine spezifische Art von TBI durch Rotationsbeschleunigung, Schütteln oder Explosion Verletzung des Gehirns infolge einer uneingeschränkten Kopfbewegung im Augenblick nach Derverletzung4,5,6,7,8induziert. DAI beinhaltet weit verbreitete axonale Schäden, die zu lang anhaltenden neurologischen Beeinträchtigungen führen, die mit schlechtem Ergebnis, belastenden Gesundheitskosten und einer 33-64% Sterblichkeitsrate1,2,4,5,9,10,11verbunden sind. Trotz signifikanter neuer erforschungder E-Krankheit von DAI, gab es keinen Konsens über die besten Behandlungsmöglichkeiten11,12,13,14.
In den letzten Jahrzehnten haben zahlreiche experimentelle Modelle versucht, verschiedene Aspekte von DAI11,12,15,16genau zu replizieren. Diese Modelle haben jedoch Einschränkungen angesichts der einzigartigen Darstellung von DAI im Vergleich zu anderen fokalen Verletzungen. Diese früheren Modelle verursachen nicht nur axonale Verletzungen in weißen Materieregionen, sondern führen auch zu fokalen Hirnverletzungen. Klinisch wird DAI von Mikroblutungen begleitet, die eine Hauptursache für Schäden an weißer Materie darstellen können.
Es wurde nur gezeigt, dass zwei Tiermodelle die wichtigsten klinischen Merkmale von DAI replizieren. Gennarelli und Kollegen produzierten 1982 das erste seitliche Kopfrotationsgerät, das die Rotationsbeschleunigung ohne Aufprallkopf benutzte, um mit DAI in einem nichtmenschlichen Primatenmodell15komaieren zu können. Dieses Primatenmodell verwendete eine kontrollierte Einzelrotation zur Beschleunigung und Verzögerung, um den Kopf innerhalb von 10-20 ms um 60° zu verdrängen. Diese Technik war in der Lage, bewusstseinsbeeinträchtigtes Bewusstsein und weit verbreitete axonale Schäden zu emulieren, die den Auswirkungen schwerer TBI ähnelten, die im menschlichen Gehirn beobachtet wurden. Primatenmodelle sind jedoch sehr teuer4,11,16. Basierend auf dem Vorgängermodell wurde 1994 ein Schweinemodell der Rotationsbeschleunigung sbrain injury (Ross et al.) mit ähnlichen Ergebnissen14entwickelt.
Diese beiden Tiermodelle, obwohl sie unterschiedliche Darstellungen typischer Pathologie produzierten, haben die Konzepte der DAI-Pathogenese stark erweitert. Schnelle Kopfrotation wird allgemein als die beste Methode zur Induktion von DAI akzeptiert, und Nagetiere bieten ein kostengünstigeres Modell für die schnellen Kopfrotationsstudien11,16. Hier validieren wir ein einfaches, reproduzierbares und zuverlässiges Nagetiermodell von DAI, das weitverbreitete Schäden an weißer Materie ohne Schädelfrakturen oder Prellungen verursacht. Dieses aktuelle Modell wird ein besseres Verständnis der Pathophysiologie von DAI und die Entwicklung wirksamerer Behandlungen ermöglichen.
Protokoll
Die Versuche wurden im Anschluß an die Empfehlungen der Erklärungen von Helsinki und Tokio sowie der Leitlinien für die Verwendung von Versuchstieren der Europäischen Gemeinschaft durchgeführt. Die Experimente wurden vom Animal Care Committee der Ben-Gurion University of the Negev genehmigt.
1. Vorbereitung von Ratten auf das Experimentelle Verfahren
HINWEIS: Wählen Sie erwachsene männliche Sprague-Dawley Ratten mit einem Gewicht von 300-350 g.
- Die Genehmigung für die Durchführung dieser Experimente wird vom Institutional Animal Care and Use Committee einholen.
- Halten Sie Ratten bei einer Raumtemperatur von 22 °C bei 1 °C, mit 12 Stunden Licht und 12 Stunden dunklen Zyklen. Geben Sie Ratte Chow und Wasser ad libitum.
- Führen Sie alle Experimente zwischen 6:00 Uhr und 12:00 Uhr durch.
- Verwenden Sie ein kontinuierliches Isofluran-Verabreichungssystem, um Anästhesie zu induzieren. Stellen Sie sicher, dass das Verdampfersystem mit Isofluran gefüllt ist.
- Anästhesisieren Sie die Ratten mit 2% Isofluran.
- Bestätigen Sie, dass die Ratte vollständig betäuisiert wird, indem Sie einen Mangel an Bewegung oder Pedalreflex als Reaktion auf äußere Reize beobachten.
2. Induktion von diffusen axonalen Verletzungen
ANMERKUNG: Das Gerät besteht aus folgenden Komponenten: 1) transparenter Kunststoffzylinder, 2) Eisengewicht (1308 g), 3) Rotationsmechanismus bestehend aus einem zylindrischen Rohr, zwei Lagern, an denen sich die Achse dreht, und einer Kopfbefestigung (für Ohrstifte); 4) horizontale Plattform, auf der zwei Lager befestigt sind.
- Stellen Sie das Gerät auf einen schweren, stabilen Labortisch.
- Befestigen Sie das Gewicht an einer Zeichenfolge, die auf eine Höhe von 120 cm erhöht ist.
- Lassen Sie das frei fallende Gewicht die Schraube treffen und aktivieren Sie den Rotationsmechanismus. Mit hilfe der seitlichen Kopfdrehvorrichtung wird der Kopf des Nagers schnell von 0 auf 90° gedreht.
- Nach der Induktion einer diffusen axonalen Hirnverletzung, übertragen Sie die Ratte in einen Erholungsraum.
3. Messung der Rotationskinematik/Biomechanische Natik.
- Messen Sie die Rotationskinematik/biomechanischen Parameter wie folgt:
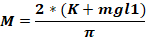
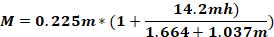

wobei Fo - Kraft auf den Tierkopf angewendet wird (kg); M – Moment der Gewalt; K – kinetische Energie; m – Masse des fallenden Gewichts; g - Gravitationsbeschleunigung; h – Höhe (cm); D – Abstand zwischen den Ohrnadeln (cm).
ANMERKUNG: Um die Kraft auf den Kopf des Tieres (Fo) zu berechnen, ist es notwendig, die Masse des fallenden Gewichts, die Höhe, in der das Gewicht fällt, und den Abstand zwischen den Ohrnadeln zu kennen. Die anderen Parameter bleiben unverändert.
4. Bewertung des neurologischen Schweregrads nach 48 Stunden
HINWEIS: Neurologische Defizite wurden mit einem neurologischen Schweregrad bewertet und bewertet, wie zuvor beschrieben17,18,19. Veränderungen in motorischer Funktion und Verhalten werden von einem Punktsystem so bewertet, dass eine maximale Punktzahl von 24 eine schwere neurologische Dysfunktion darstellt. Eine Punktzahl von 0 gibt einen intakten neurologischen Status an. Die folgenden Verhaltensfunktionen werden bewertet.
- Bewerten Sie die Unfähigkeit der Ratte, aus einem Kreis (50 cm Durchmesser) zu verlassen, wenn sie in der Mitte gelassen wird. Führen Sie dies für drei Einzelsitzungen mit einer Dauer von 30 min, 60 min und mehr als 60 min durch.
- Testen Sie die Ratte auf einen Verlust des Rechtenreflexes in drei Sitzungen mit einer Dauer von 20 min, 40 min und über 60 min.
- Führen Sie den Test für Hemiplegie, die Unfähigkeit der Ratte, erzwungene Veränderungen in der Position zu widerstehen.
- Heben Sie die Ratte um ihren Schwanz, um die Beugung des Hinterteils zu testen.
- Legen Sie die Ratte auf den Boden, um ihre Fähigkeit zu testen, gerade zu gehen.
- Test auf drei verschiedene Reflexe: den Pinnareflex, den Hornhautreflex und den Entzündungsreflex.
- Bewerten Sie die Ratte mit einem klinischen Grad basierend auf Verlust des Suchverhaltens und Prostration.
- Testen Sie Gliedmaßenreflexe für die Platzierung. Führen Sie den Test auf der linken und rechten Vorderbeine, und dann die linke und rechte Hinterbeine.
- Führen Sie einen Funktionstest über die Strahlausgleichsaufgabe durch. Der Strahl sollte 1,5 cm breit sein. Führen Sie den Test für Sitzungen mit 20 s, 40 s und mehr als 60 s aus.
- Führen Sie einen Balken-Walking-Test an der Ratte mit Balken in drei verschiedenen Breiten durch: 8,5 cm breit, 5 cm breit und 2,5 cm breit.
5. Hirnsammlung zur histologischen Untersuchung nach 48 Stunden
- Nach 48 Stunden nach der Verletzung die Ratten einschläfern, indem sie ihr inspiriertes Gasgemisch durch 20% O2/80% CO2ersetzen. Stellen Sie sicher, dass CO2 gemäß den Richtlinien des Institutionellen Tierschutz- und Nutzungsausschusses zu einem vorgegebenen Preis geliefert wird.
- Stellen Sie die Sterbebestätigung in Übereinstimmung mit den Richtlinien des Institutional Animal Care and Use Committee sicher.
- Transkardial perfuse die Ratte mit 0,9% heparinisierter Saline bei einer Temperatur von 4 °C, gefolgt von 500 ml 4% Paraformaldehyd in 0,1 M Phosphatpuffer-Saline (pH 7,4).
- Führen Sie nach der Perfusion die Enthauptung mit einer Guillotine durch.
- Führen Sie die Gehirnsammlung durch Entfernen der Calvarien mit Knochenschneiden Zangen, um schädliches Gehirngewebe zu vermeiden.
- Entfernen Sie das Gehirn sofort und fixieren Sie in einer 4% gepufferten Formaldehyd-Lösung für 48 h bei 4 °C.
- Blockieren Sie Gehirne in 5 mm koronalen Abschnitten von der olfaktorischen Glühbirne Gesicht zum visuellen Kortex und Bisect Kleinhirne und Hirnstämme.
- Nach Paraffineinbettung, schneiden Koronaoder und sagittale Abschnitte (5 m) durch Mikrotome-Sektion vom Thalamus weg.
6. Immunchemische Färbung und Untersuchung
- Legen Sie die Scheiben vorsichtig auf Glasgweise mit einem weichen Pinsel, 1 Scheibe pro Folie.
- Produzieren Sie eine immunchemische Färbung von APP.
- Scheiben mit Xylol deparaffinisieren (3 mal für je 5 min) und mit allmählich reduzierten Ethanolkonzentrationen bei Raumtemperatur rehydrieren: 3 min 100% Ethanol zweimal, 3 min 95% Ethanol zweimal, 3 min in 90% Ethanol, 3 min in 70% Ethanol und 3 min in DDW.
- Behandeln Sie deparaffinierte und rehydrierte Hirnabschnitte mit 3%H2O2 für 15 min bei Raumtemperatur, um die endogene Peroxidaseaktivität zu blockieren.
- Inkubieren Sie Abschnitte mit 0,01 M Natriumcitrat (pH 6,0) bei 98 °C für 5 min für Antigenrückgewinnung.
- Halten Sie die Dias im Puffer für 20 min bei Raumtemperatur abkühlen.
- Abschnitte mit phosphatgepufferter Saline-Lösung (PBS) zweimal für 5 min waschen.
- Blockieren Sie die Abschnitte mit 2,5% normalem Pferdeserum für 1 h bei Raumtemperatur und inkubieren Sie über Nacht bei 4 °C in Primärkaninchen Anti-APP (1:4000) im blockierenden Serum verdünnt.
- Nach der Inkubation im Primärantikörper die Abschnitte in PBS bei Raumtemperatur waschen.
- Inkubieren Sie Abschnitte in entsprechend verdünnten biotinylierten Sekundärantikörpern für 15 min und waschen Sie sie zweimal bei Raumtemperatur mit PBS.
- In stronavidin-peroxidase für 15 min inkubieren und zweimal bei Raumtemperatur 3 min in PBS waschen.
- Inkubieren Abschnitte mit gepufferter Substratlösung (pH 7.5), die Wasserstoffperoxid und 3,3-Diaminobenzidin-Chromogenlösung enthält und vor Licht schützen, bis die Farbe entwickelt wird.
- Inkubieren Sie die Dias mit DDW bei Raumtemperatur für 5 min, um die Reaktion zu stoppen.
- Counterstain Abschnitte mit Hämatoxylin für 3 min bei Raumtemperatur und waschen für 5 min mit fließendem Leitungswasser.
- Dehydrieren Sie die Dias mit allmählich steigenden Konzentrationen von Ethanol bei Raumtemperatur: 2 min in DDW, 2 min in 70% Ethanol, 2 min in 90% Ethanol, 2 min in Ethanol 95%, 2 min in 100% Ethanol und 3 min in Xylol dreimal.
- Trocken und montieren mit Montagemedium.
- Untersuchen Sie die Scheiben unter dem Mikroskop Vergrößerung von 200x mit einer 20 mm Objektivlinse mit einem Mikroskop.
Ergebnisse
Tabelle 1 veranschaulicht die Protokollzeitachse. Die Sterblichkeitsrate in diesem DAI-Modell betrug 0%. Ein Mann-Whitney-Test zeigte, dass das neurologische Defizit bei den 15 DAI-Ratten signifikant größer war als bei den 15 Scheinratten nach 48 Stunden nach Intervention (Mdn = 1 vs. 0), U = 22,5, p < 0,001, r = 0,78 (siehe Tabelle 2). Die Daten werden in Zahlen gemessen und als Median- und 25-75-Perzentilbereich dargestellt.
Repräsentative Photomikroskope...
Diskussion
Dieses Protokoll beschreibt ein Nagetiermodell von DAI. In DAI verursacht die Rotationsbeschleunigung im Gehirn einen Schereffekt, der axonale und biochemische Veränderungen auslöst, die in einem progressiven Prozess zum Verlust der axonalen Funktion führen. Sekundäre axonale Veränderungen werden durch eine schnelle axonale Dehnungsverletzung erzeugt und sind in Ihrem Ausmaß und Schweregradvariabel 4,5,10. Innerhalb von St...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken Dr. Nathan Kleeorin (Department of Mechanical Engineering, Ben-Gurion University of the Negev) für seine Unterstützung bei den biomechanischen Messungen. Wir danken auch Professor Olena Severynovska, Maryna Kuscheriava, Maksym Kryvonosov, Daryna Yakumenko und Evgenia Goncharyk von der Abteilung für Physiologie, Fakultät für Biologie, Ökologie und Medizin, Oles Honchar Dnipro Universität, Dnipro, Ukraine für ihre Unterstützung und hilfreiche Beiträge zu unseren Diskussionen.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.01 M sodium citrate | SIGMA - ALDRICH | ||
| 2.5% normal horse serum | SIGMA - ALDRICH | H0146 | Liquid |
| 4 % buffered formaldehyde solution | |||
| Anti-Amyloid Precursor Protein, C - terminal antibodyproduced in rabbit | SIGMA - ALDRICH | Lot 056M4867V | |
| biotinylated secondary antibody | Vector | BA-1000-1.5 | 10 mM sodium phosphate, pH 7.8, 0.15 M NaCl, 0.08% sodium azide, 3 mg/ml bovine serum albumin |
| bone-cutting forceps | |||
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | vector laboratory | ||
| embedding cassettes | |||
| ethanol 99.9 % | ROMICAL | Flammable Liquid | |
| guillotine | |||
| Hematoxylin | SIGMA - ALDRICH | H3136-25G | |
| Hydrogen peroxide solution | Millipore | 88597-100ML-F | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | ||
| Olympus BX 40 microscope | Olympus | ||
| paraffine | paraplast plus leica biosystem | Tissue embedding medium | |
| phosphate-buffered saline (PBS) | SIGMA - ALDRICH | P5368-10PAK | Contents of one pouch, when dissolved in one liter of distilled or deionized water, will yield 0.01 M phosphate buffered saline (NaCl 0.138 M; KCl - 0.0027 M); pH 7.4, at 25 °C. |
| Streptavidin HRP | ABCAM | ab64269 | Streptavidin-HRP for use with biotinylated secondary antibodies during IHC / immunohistochemistry. |
| xylene |
Referenzen
- Faul, M., Wald, M. M., Xu, L., Coronado, V. G. Traumatic brain injury in the United States; emergency department visits, hospitalizations, and deaths, 2002-2006. US Government. , (2010).
- Taylor, C. A., Bell, J. M., Breiding, M. J., Xu, L. Traumatic Brain Injury-Related Emergency Department Visits, Hospitalizations, and Deaths - United States, 2007 and 2013. MMWR Surveillance Summaries. 66, 1-16 (2017).
- Peterson, A. B., Xu, L., Daugherty, J., Breiding, M. J. Surveillance report of traumatic brain injury-related emergency department visits, hospitalizations, and deaths, United States, 2014. US Government. , (2014).
- Su, E., Bell, M. Diffuse axonal injury. Translational Research in Traumatic Brain Injury. 57, 41 (2016).
- Hammoud, D. A., Wasserman, B. A. Diffuse axonal injuries: pathophysiology and imaging. Neuroimaging Clinics. 12, 205-216 (2002).
- Adams, J. H., Graham, D. I., Gennarelli, T. A., Maxwell, W. L. Diffuse axonal injury in non-missile head injury. Journal of Neurology, Neurosurgery, and Psychiatry. 54, 481-483 (1991).
- Slazinski, T., Johnson, M. C. Severe diffuse axonal injury in adults and children. Journal of Neuroscience Nursing. 26, 151-154 (1994).
- Gentleman, S. M., et al. Axonal injury: a universal consequence of fatal closed head injury. Acta Neuropathologica. 89, 537-543 (1995).
- Marehbian, J., Muehlschlegel, S., Edlow, B. L., Hinson, H. E., Hwang, D. Y. Medical Management of the Severe Traumatic Brain Injury Patient. Neurocritical Care. 27, 430-446 (2017).
- Adams, J. H., et al. Diffuse axonal injury in head injury: definition, diagnosis and grading. Histopathology. 15, 49-59 (1989).
- Xiao-Sheng, H., Sheng-Yu, Y., Xiang, Z., Zhou, F., Jian-ning, Z. Diffuse axonal injury due to lateral head rotation in a rat model. Journal of Neurosurgery. 93, 626-633 (2000).
- Ross, D. T., Meaney, D. F., Sabol, M. K., Smith, D. H., Gennarelli, T. A. Distribution of forebrain diffuse axonal injury following inertial closed head injury in miniature swine. Experimental Neurology. 126, 291-299 (1994).
- Bullock, R. Opportunities for neuroprotective drugs in clinical management of head injury. Journal of Emergency Medicine. 11, 23-30 (1993).
- Gennarelli, T. A. Mechanisms of brain injury. Journal of Emergency Medicine. 11, 5-11 (1993).
- Gennarelli, T. A., et al. Diffuse axonal injury and traumatic coma in the primate. Annals of Neurology. 12, 564-574 (1982).
- Xiaoshengi, H., Guitao, Y., Xiang, Z., Zhou, F. A morphological study of diffuse axonal injury in a rat model by lateral head rotation trauma. Acta Neurologica Belgica. 110, 49-56 (2010).
- Zlotnik, A., et al. beta2 adrenergic-mediated reduction of blood glutamate levels and improved neurological outcome after traumatic brain injury in rats. Journal of Neurosurgical Anesthesiology. 24, 30-38 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedures Online. 21, 9 (2019).
- Boyko, M., et al. The neuro-behavioral profile in rats after subarachnoid hemorrhage. Brain Research. 1491, 109-116 (2013).
- Ma, J., Zhang, K., Wang, Z., Chen, G. Progress of Research on Diffuse Axonal Injury after Traumatic Brain Injury. Neural Plasticity. 2016, 9746313 (2016).
- Medana, I. M., Esiri, M. M. Axonal damage: a key predictor of outcome in human CNS diseases. Brain. 126, 515-530 (2003).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Experimental Neurology. 233, 364-372 (2012).
- Johnson, V. E., Stewart, W., Smith, D. H. Traumatic brain injury and amyloid-beta pathology: a link to Alzheimer's disease. Nature Reviews Neuroscience. 11, 361-370 (2010).
- Sherriff, F. E., Bridges, L. R., Sivaloganathan, S. Early detection of axonal injury after human head trauma using immunocytochemistry for beta-amyloid precursor protein. Acta Neuropathologica. 87, 55-62 (1994).
- Reichard, R. R., White, C. L., Hladik, C. L., Dolinak, D. Beta-amyloid precursor protein staining of nonaccidental central nervous system injury in pediatric autopsies. Journal of Neurotrauma. 20, 347-355 (2003).
- Gentleman, S. M., Nash, M. J., Sweeting, C. J., Graham, D. I., Roberts, G. W. Beta-amyloid precursor protein (beta APP) as a marker for axonal injury after head injury. Neuroscience Letters. 160, 139-144 (1993).
- Smith, D. H., Hicks, R., Povlishock, J. T. Therapy development for diffuse axonal injury. Journal of Neurotrauma. 30, 307-323 (2013).
- McKenzie, K. J., et al. Is beta-APP a marker of axonal damage in short-surviving head injury. Acta Neuropathologica. 92, 608-613 (1996).
- Wilkinson, A., Bridges, L., Sivaloganathan, S. Correlation of survival time with size of axonal swellings in diffuse axonal injury. Acta Neuropathologicaogica. 98, 197-202 (1999).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Alder, J., Fujioka, W., Lifshitz, J., Crockett, D. P., Thakker-Varia, S. Lateral fluid percussion: model of traumatic brain injury in mice. Journal of Visualized Experiments. , e3063 (2011).
- Povlishock, J., Marmarou, A., McIntosh, T., Trojanowski, J., Moroi, J. Impact acceleration injury in the rat: evidence for focal axolemmal change and related neurofilament sidearm alteration. Journal of Neuropathology & Experimental Neurology. 56, 347-359 (1997).
- Heath, D. L., Vink, R. Impact acceleration-induced severe diffuse axonal injury in rats: characterization of phosphate metabolism and neurologic outcome. Journal of Neurotrauma. 12, 1027-1034 (1995).
- Lighthall, J. W. Controlled cortical impact: a new experimental brain injury model. Journal of Neurotrauma. 5, 1-15 (1988).
- Palmer, A. M., et al. Traumatic brain injury-induced excitotoxicity assessed in a controlled cortical impact model. Journal of Neurochemistry. 61, 2015-2024 (1993).
- Hamm, R. J., et al. Cognitive deficits following traumatic brain injury produced by controlled cortical impact. Journal of Neurotrauma. 9, 11-20 (1992).
- Nyanzu, M., et al. Improving on Laboratory Traumatic Brain Injury Models to Achieve Better Results. International Journal of Medical Sciences. 14, 494-505 (2017).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Lighthall, J. W., Dixon, C. E., Anderson, T. E. Experimental models of brain injury. Journal of Neurotrauma. 6, 83-97 (1989).
- Meaney, D. F., et al. Modification of the cortical impact model to produce axonal injury in the rat cerebral cortex. Journal of Neurotrauma. 11, 599-612 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten