Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Индукция диффузной Аксональной травмы мозга у крыс на основе вращения ускорения
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол подтверждает надежную, легкую в исполнении и воспроизводимую модель грызунов, диффузную аксональную травму мозга (DAI), которая вызывает широкое повреждение белого вещества без переломов черепа или ушибов.
Аннотация
Травматическая черепно-мозговая травма (ТБИ) является основной причиной смерти и инвалидности. Диффузная аксональная травма (DAI) является преобладающим механизмом травмы в большом проценте пациентов ТБИ, нуждающихся в госпитализации. DAI включает в себя широкое повреждение аксонального от встряхивания, вращения или взрыва травмы, что приводит к быстрой травмы аксонального растяжения и вторичные аксональные изменения, которые связаны с длительным воздействием на функциональное восстановление. Исторически экспериментальные модели DAI без координационных травм было трудно разработать. Здесь мы проверяем простую, воспроизводимую и надежную модель грызунов DAI, которая вызывает широкое повреждение белого вещества без переломов черепа или ушибов.
Введение
Травматическая черепно-мозговая травма (TBI) является одной из основных причин смерти и инвалидности в Соединенных Штатах. TBIs способствовать около 30% всех травм, связанных смертей1,2. Основные причины TBI различаются между возрастными группами и включают падения, скоростные столкновения во время занятий спортом, умышленное причинение себе вреда, дорожно-транспортных происшествий и нападений1,2,3.
Мозг диффузной аксональной травмы (DAI) является специфическим типом TBI индуцированных вращательного ускорения, встряхивания или взрыва травмы головного мозга в результате неограниченного8движения головы в момент после травмы4,5,6,7. DAI включает в себя широкое повреждение аксонального приводит к длительным неврологическим нарушениям, что связано с плохим результатом, обременительные расходы на здравоохранение, и 33-64% смертности1,2,4,99,,10,11. Несмотря на значительные недавние исследования патогенеза DAI, не было консенсуса по лучшим вариантам лечения11,12,13,14.
За последние десятилетия, многочисленные экспериментальные модели пытались точно воспроизвести различные аспекты DAI11,12,15,16. Тем не менее, эти модели имеют ограничения, учитывая уникальную презентацию DAI по сравнению с другими фокусными травмами. Эти предыдущие модели не только вызывают аксональные повреждения в областях белого вещества, но и приводят к очаговым травмам головного мозга. Клинически, DAI сопровождается микро кровоизлияния, которые могут представлять собой основную причину повреждения белого вещества.
Только две модели животных были показаны, чтобы повторить ключевые клинические особенности DAI. Дженнарелли и его коллеги произвели первое боковое устройство вращения головы в 1982 году, используя неэффективное ускорение вращения головы, чтобы вызвать кому с DAI в нечеловеческой модели приматов15. Эта модель приматов использовала контролируемое однократное вращение для ускорения и замедления, чтобы вытеснить голову через 60 градусов в течение 10-20 мс. Эта техника была в состоянии подражать нарушенного сознания и широко ежексональных повреждений, которые напоминали последствия тяжелых TBI наблюдается в человеческом мозге. Тем не менее, примат модели очень дорогие4,11,16. Основываясь частично на предыдущей модели, свинья модель вращения ускорения черепно-мозговой травмы была разработана в 1994 году (Росс и др.) с аналогичными результатами14.
Эти две модели животных, хотя они произвели различные презентации типичной патологии, значительно добавили к понятиям ПАтогенеза DAI. Быстрая вращение головы, как правило, принято как лучший метод для индуцирования DAI, и грызуны обеспечивают менее дорогую модель для быстрого исследования вращения головы11,16. Здесь мы проверяем простую, воспроизводимую и надежную модель грызунов DAI, которая вызывает широкое повреждение белого вещества без переломов черепа или ушибов. Эта нынешняя модель позволит лучше понять патофизиологию ДАИ и развитие более эффективных методов лечения.
протокол
Эксперименты проводились в соответствии с рекомендациями Хельсинкских и Токиоских деклараций и Руководящими принципами по использованию экспериментальных животных Европейского сообщества. Эксперименты были одобрены Комитетом по уходу за животными Университета Бен-Гуриона в Негеве.
1. Подготовка крыс к экспериментальной процедуре
ПРИМЕЧАНИЕ: Выберите взрослых самцов крыс Sprague-Dawley весом 300-350 г.
- Получить разрешение на проведение этих экспериментов от Институционального комитета по уходу за животными и использованию.
- Поддерживайте крыс при комнатной температуре 22 и 1 градусов по Цельсию, с 12-часовым светом и 12 часами темных циклов. Предоставьте крысиный чау и воду объявление libitum.
- Выполняйте все эксперименты с 6:00 до 12:00.
- Используйте непрерывную систему администрирования изофруран для индуцирования анестезии. Убедитесь, что система испарителей заполнена изофрураном.
- Анестезия крыс с 2% изолюран.
- Подтвердите, что крыса полностью обезглавила, наблюдая отсутствие движения или педали рефлекс в ответ на внешние раздражители.
2. Индукция диффузной аксональной травмы
ПРИМЕЧАНИЕ: Устройство состоит из следующих компонентов: 1) прозрачный пластиковый цилиндр, 2) железный вес (1308 г), 3) механизм вращения, состоящий из цилиндрической трубки, двух подшипников, на которых вращается ось и фиксация головы (для ушных булавок); 4) горизонтальная платформа, на которой закреплены два подшипника.
- Поместите устройство на тяжелый, стабильный лабораторный стол.
- Прикрепите вес к веревке, которая поднимается на высоту 120 см.
- Разрешить свободно падающий вес ударить болт, активации механизма вращения. Используя боковое устройство вращения головы, голова грызуна быстро поворачивается от 0 до 90 градусов.
- После индукции диффузной аксональной черепно-мозговой травмы, передача крысы в комнату восстановления.
3. Измерение вращательных параметров кинематики/биомеханических.
- Измерьте вращательную кинематику/биомеханические параметры следующим образом:
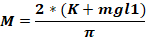
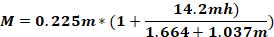

где Fo - сила применяется к головке животного (кг); M - момент силы; K - кинетическая энергия; м - масса падающего веса; g - гравитационное ускорение; h - рост (см); D - расстояние между ушными булавками (см).
ПРИМЕЧАНИЕ: Чтобы рассчитать силу, применяемую к голове животного (Fo),необходимо знать массу падающего веса, высоту, с которой падает вес, и расстояние между ушными булавами. Остальные параметры остаются неизменными.
4. Оценка неврологической тяжести Оценка после 48 часов
ПРИМЕЧАНИЕ: Неврологические дефициты были оценены и градуированы с помощью неврологической тяжести Оценка, как ранее описано17,18,19. Изменения в двигательной функции и поведении оцениваются точечной системой таким образом, что максимальный балл 24 представляет собой тяжелую неврологическую дисфункцию. Оценка 0 указывает на нетронутый неврологический статус. Оцениваются следующие поведенческие функции.
- Оцените неспособность крысы выйти из круга (50 см в диаметре), когда она остается в центре. Выполните это в течение трех индивидуальных сессий продолжительностью 30 минут, 60 мин и более 60 мин.
- Проверьте крысу на потерю выправлия рефлекс ажиотажа в трех сессиях продолжительностью 20 минут, 40 мин и более 60 мин.
- Выполните тест на гемиплегию, неспособность крысы противостоять вынужденным изменениям в положении.
- Поднимите крысу за хвост, чтобы проверить сгибание задней конечности.
- Поместите крысу на пол, чтобы проверить ее способность идти прямо.
- Тест для трех отдельных рефлексов: рефлекс Пинна, роговицы рефлекс, и испуганый рефлекс.
- Оцените крысу с клиническим сортом, основанным на потере поведения и прострации.
- Тест рефлексы конечностей для размещения. Выполните тест на левом и правом передних конечностях, а затем влево и вправо задние конечности.
- Выполните функциональный тест с помощью задачи балансировки пучка. Луч должен измерять 1,5 см в ширину. Выполнить тест для сессий 20 с, 40 с, и более 60 с.
- Выполните испытание пучка ходьбы на крысе с балками трех различных ширин: 8,5 см в ширину, 5 см в ширину и 2,5 см в ширину.
5. Сбор мозга для гистологического обследования после 48 часов
- В 48 часов после травмы, эвтаназии крыс, заменив их вдохновили газовой смеси с 20% O2/80% CO2. Убедитесь, что CO2 поставляется по заранее определенной ставке в соответствии с руководящими принципами Комитета по институциональному уходу и использованию животных.
- Обеспечить подтверждение смерти в соответствии с руководящими принципами Институционального комитета по уходу за животными и использованию.
- Транскардионно пронзить крысу с 0,9% гепаринизированного солима при температуре 4 градусов по Цельсию, а затем 500 мл 4% параформальдегида в 0,1 М фосфатного буфера солей (pH 7.4).
- После перфузии, выполнять обезглавливание с гильотиной.
- Выполните сбор мозга, удалив кальварии с костной резки щипцы, чтобы избежать повреждения ткани мозга.
- Немедленно удалите мозг и зафиксировать в 4% буферизированном растворе формальдегида в течение 48 ч при 4 градусах Цельсия.
- Блок головного мозга в 5 мм корональных секций от обонятельной лампы лицом к зрительной коре и двухсекционных мозжечков и стеблей мозга.
- После встраивания парафина, вырезать корональные и сагитальные разделы (5 мкм) от таламуса по микротому секции.
6. Иммунохимическое окрашивание и обследование
- Аккуратно поместите ломтики на стеклянные горки с мягкой кистью, 1 ломтик на слайд.
- Производить иммунохимическое окрашивание ЗАПП.
- Депарафинизировать ломтики ксилена (3 раза по 5 мин каждый) и регидратировать с постепенно снижаемыми концентрациями этанола при комнатной температуре: 3 мин в 100% этанола дважды, 3 мин в 95% этанола дважды, 3 мин в 90% этанола, 3 мин в 70% этанола, и 3 мин в DDW.
- Лечить депарафинизированные и регидратированные участки мозга с 3% H2O2 в течение 15 минут при комнатной температуре, чтобы блокировать эндогенной активности перекислина.
- Инкубировать секции с 0,01 М цитрат натрия (pH 6.0) на 98 градусов по Цельсию в течение 5 минут для поиска антигена.
- Держите слайды в буфере в течение 20 минут при комнатной температуре, чтобы остыть.
- Вымойте секции с фосфат-буферным сольным раствором (PBS) дважды в течение 5 мин.
- Блок разделы с 2,5% нормальной сыворотки лошади на 1 ч при комнатной температуре и инкубировать на ночь при температуре 4 градусов по Цельсию в первичной кролика анти-APP (1:4000) разбавленной в блокирующей сыворотке.
- После инкубации в первичных антителах, мыть разделы в PBS при комнатной температуре.
- Инкубировать секции в соответствующим образом разбавленных биотинилатированных вторичных антител в течение 15 мин и мыть с PBS в течение 3 минут дважды при комнатной температуре.
- Инкубировать в стрептавидино-пероксидазе в течение 15 минут и снова мыть в PBS в течение 3 минут дважды при комнатной температуре.
- Инкубировать секции с буферным субстратным раствором (pH 7.5), содержащим перекись водорода и 3,3-диаминобензидинхромный хромогенный раствор и защищать от света до тех пор, пока цвет не развился.
- Инкубировать слайды с DDW при комнатной температуре в течение 5 минут, чтобы остановить реакцию.
- Противокоительные секции с гематоксилин в течение 3 мин при комнатной температуре и мыть в течение 5 мин с проточной водопроводной водой.
- Обезвоживать горки с постепенно увеличивающимися концентрациями этанола при комнатной температуре: 2 мин в DDW, 2 мин в 70% этанола, 2 мин в 90% этанола, 2 мин в этаноле 95%, 2 мин в 100% этанола, и 3 мин в ксилане в три раза.
- Сухой и крепления с монтажной средой.
- Изучите ломтики под микроскопом увеличения 200x с 20 мм объектив с помощью микроскопа.
Результаты
Таблица 1 иллюстрирует временную шкалу протокола. Коэффициент смертности в этой модели ДАИ составил 0%. Тест Манн-Уитни показал, что неврологический дефицит был значительно больше для 15 ДАИ крыс по сравнению с 15 фиктивных крыс в 48 часов после вмешательства (Mdn No 1 против 0), U 22,5, р ю...
Обсуждение
Этот протокол описывает модель грызунов DAI. В DAI, вращательное ускорение на мозге вызывает эффект сдвига, который вызывает аксональные и биохимические изменения, которые приводят к потере аксональной функции в прогрессивном процессе. Вторичные аксональные изменения производятся быст?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы с благодарностью признают д-ра Натана Клейорина (департамент машиностроения, Университет Бен-Гуриона в Негеве) за его помощь в биомеханических измерениях. Также благодарим профессора Елену Севериновскую, Марину Кущеву, Максима Кривоносова, Дарину Якуменко и Евгению Гончарик на кафедре физиологии, факультета биологии, экологии и медицины, Днепровского университета Олеся Гончара, Днепр, Украину за поддержку и полезный вклад в наши обсуждения.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.01 M sodium citrate | SIGMA - ALDRICH | ||
| 2.5% normal horse serum | SIGMA - ALDRICH | H0146 | Liquid |
| 4 % buffered formaldehyde solution | |||
| Anti-Amyloid Precursor Protein, C - terminal antibodyproduced in rabbit | SIGMA - ALDRICH | Lot 056M4867V | |
| biotinylated secondary antibody | Vector | BA-1000-1.5 | 10 mM sodium phosphate, pH 7.8, 0.15 M NaCl, 0.08% sodium azide, 3 mg/ml bovine serum albumin |
| bone-cutting forceps | |||
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | vector laboratory | ||
| embedding cassettes | |||
| ethanol 99.9 % | ROMICAL | Flammable Liquid | |
| guillotine | |||
| Hematoxylin | SIGMA - ALDRICH | H3136-25G | |
| Hydrogen peroxide solution | Millipore | 88597-100ML-F | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | ||
| Olympus BX 40 microscope | Olympus | ||
| paraffine | paraplast plus leica biosystem | Tissue embedding medium | |
| phosphate-buffered saline (PBS) | SIGMA - ALDRICH | P5368-10PAK | Contents of one pouch, when dissolved in one liter of distilled or deionized water, will yield 0.01 M phosphate buffered saline (NaCl 0.138 M; KCl - 0.0027 M); pH 7.4, at 25 °C. |
| Streptavidin HRP | ABCAM | ab64269 | Streptavidin-HRP for use with biotinylated secondary antibodies during IHC / immunohistochemistry. |
| xylene |
Ссылки
- Faul, M., Wald, M. M., Xu, L., Coronado, V. G. Traumatic brain injury in the United States; emergency department visits, hospitalizations, and deaths, 2002-2006. US Government. , (2010).
- Taylor, C. A., Bell, J. M., Breiding, M. J., Xu, L. Traumatic Brain Injury-Related Emergency Department Visits, Hospitalizations, and Deaths - United States, 2007 and 2013. MMWR Surveillance Summaries. 66, 1-16 (2017).
- Peterson, A. B., Xu, L., Daugherty, J., Breiding, M. J. Surveillance report of traumatic brain injury-related emergency department visits, hospitalizations, and deaths, United States, 2014. US Government. , (2014).
- Su, E., Bell, M. Diffuse axonal injury. Translational Research in Traumatic Brain Injury. 57, 41 (2016).
- Hammoud, D. A., Wasserman, B. A. Diffuse axonal injuries: pathophysiology and imaging. Neuroimaging Clinics. 12, 205-216 (2002).
- Adams, J. H., Graham, D. I., Gennarelli, T. A., Maxwell, W. L. Diffuse axonal injury in non-missile head injury. Journal of Neurology, Neurosurgery, and Psychiatry. 54, 481-483 (1991).
- Slazinski, T., Johnson, M. C. Severe diffuse axonal injury in adults and children. Journal of Neuroscience Nursing. 26, 151-154 (1994).
- Gentleman, S. M., et al. Axonal injury: a universal consequence of fatal closed head injury. Acta Neuropathologica. 89, 537-543 (1995).
- Marehbian, J., Muehlschlegel, S., Edlow, B. L., Hinson, H. E., Hwang, D. Y. Medical Management of the Severe Traumatic Brain Injury Patient. Neurocritical Care. 27, 430-446 (2017).
- Adams, J. H., et al. Diffuse axonal injury in head injury: definition, diagnosis and grading. Histopathology. 15, 49-59 (1989).
- Xiao-Sheng, H., Sheng-Yu, Y., Xiang, Z., Zhou, F., Jian-ning, Z. Diffuse axonal injury due to lateral head rotation in a rat model. Journal of Neurosurgery. 93, 626-633 (2000).
- Ross, D. T., Meaney, D. F., Sabol, M. K., Smith, D. H., Gennarelli, T. A. Distribution of forebrain diffuse axonal injury following inertial closed head injury in miniature swine. Experimental Neurology. 126, 291-299 (1994).
- Bullock, R. Opportunities for neuroprotective drugs in clinical management of head injury. Journal of Emergency Medicine. 11, 23-30 (1993).
- Gennarelli, T. A. Mechanisms of brain injury. Journal of Emergency Medicine. 11, 5-11 (1993).
- Gennarelli, T. A., et al. Diffuse axonal injury and traumatic coma in the primate. Annals of Neurology. 12, 564-574 (1982).
- Xiaoshengi, H., Guitao, Y., Xiang, Z., Zhou, F. A morphological study of diffuse axonal injury in a rat model by lateral head rotation trauma. Acta Neurologica Belgica. 110, 49-56 (2010).
- Zlotnik, A., et al. beta2 adrenergic-mediated reduction of blood glutamate levels and improved neurological outcome after traumatic brain injury in rats. Journal of Neurosurgical Anesthesiology. 24, 30-38 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedures Online. 21, 9 (2019).
- Boyko, M., et al. The neuro-behavioral profile in rats after subarachnoid hemorrhage. Brain Research. 1491, 109-116 (2013).
- Ma, J., Zhang, K., Wang, Z., Chen, G. Progress of Research on Diffuse Axonal Injury after Traumatic Brain Injury. Neural Plasticity. 2016, 9746313 (2016).
- Medana, I. M., Esiri, M. M. Axonal damage: a key predictor of outcome in human CNS diseases. Brain. 126, 515-530 (2003).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Experimental Neurology. 233, 364-372 (2012).
- Johnson, V. E., Stewart, W., Smith, D. H. Traumatic brain injury and amyloid-beta pathology: a link to Alzheimer's disease. Nature Reviews Neuroscience. 11, 361-370 (2010).
- Sherriff, F. E., Bridges, L. R., Sivaloganathan, S. Early detection of axonal injury after human head trauma using immunocytochemistry for beta-amyloid precursor protein. Acta Neuropathologica. 87, 55-62 (1994).
- Reichard, R. R., White, C. L., Hladik, C. L., Dolinak, D. Beta-amyloid precursor protein staining of nonaccidental central nervous system injury in pediatric autopsies. Journal of Neurotrauma. 20, 347-355 (2003).
- Gentleman, S. M., Nash, M. J., Sweeting, C. J., Graham, D. I., Roberts, G. W. Beta-amyloid precursor protein (beta APP) as a marker for axonal injury after head injury. Neuroscience Letters. 160, 139-144 (1993).
- Smith, D. H., Hicks, R., Povlishock, J. T. Therapy development for diffuse axonal injury. Journal of Neurotrauma. 30, 307-323 (2013).
- McKenzie, K. J., et al. Is beta-APP a marker of axonal damage in short-surviving head injury. Acta Neuropathologica. 92, 608-613 (1996).
- Wilkinson, A., Bridges, L., Sivaloganathan, S. Correlation of survival time with size of axonal swellings in diffuse axonal injury. Acta Neuropathologicaogica. 98, 197-202 (1999).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Alder, J., Fujioka, W., Lifshitz, J., Crockett, D. P., Thakker-Varia, S. Lateral fluid percussion: model of traumatic brain injury in mice. Journal of Visualized Experiments. , e3063 (2011).
- Povlishock, J., Marmarou, A., McIntosh, T., Trojanowski, J., Moroi, J. Impact acceleration injury in the rat: evidence for focal axolemmal change and related neurofilament sidearm alteration. Journal of Neuropathology & Experimental Neurology. 56, 347-359 (1997).
- Heath, D. L., Vink, R. Impact acceleration-induced severe diffuse axonal injury in rats: characterization of phosphate metabolism and neurologic outcome. Journal of Neurotrauma. 12, 1027-1034 (1995).
- Lighthall, J. W. Controlled cortical impact: a new experimental brain injury model. Journal of Neurotrauma. 5, 1-15 (1988).
- Palmer, A. M., et al. Traumatic brain injury-induced excitotoxicity assessed in a controlled cortical impact model. Journal of Neurochemistry. 61, 2015-2024 (1993).
- Hamm, R. J., et al. Cognitive deficits following traumatic brain injury produced by controlled cortical impact. Journal of Neurotrauma. 9, 11-20 (1992).
- Nyanzu, M., et al. Improving on Laboratory Traumatic Brain Injury Models to Achieve Better Results. International Journal of Medical Sciences. 14, 494-505 (2017).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Lighthall, J. W., Dixon, C. E., Anderson, T. E. Experimental models of brain injury. Journal of Neurotrauma. 6, 83-97 (1989).
- Meaney, D. F., et al. Modification of the cortical impact model to produce axonal injury in the rat cerebral cortex. Journal of Neurotrauma. 11, 599-612 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены