É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Indução de lesão cerebral axonal difusa em ratos com base na aceleração rotacional
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo valida um modelo de roedor confiável, fácil de executar e reprodutível da lesão axonal difusa cerebral (DAI) que induz danos generalizados de matéria branca sem fraturas no crânio ou contusões.
Resumo
Lesão cerebral traumática (TCE) é uma das principais causas de morte e incapacidade. A lesão axonal difusa (DAI) é o mecanismo predominante de lesão em uma grande porcentagem de pacientes com TCE que necessitam de internação. Dai envolve danos axonais generalizados por tremor, rotação ou lesão de explosão, levando a lesões rápidas de estiramento axonal e alterações axonais secundárias que estão associadas a um impacto duradouro na recuperação funcional. Historicamente, modelos experimentais de DAI sem lesão focal têm sido difíceis de projetar. Aqui validamos um modelo de roedor simples, reprodutível e confiável do DAI que causa danos generalizados de matéria branca sem fraturas no crânio ou contusões.
Introdução
A lesão cerebral traumática (TCE) é uma das principais causas de morte e incapacidade nos Estados Unidos. Os TBIs contribuem para cerca de 30% de todas as mortes relacionadas a lesões1,2. As principais causas de TCE diferem entre as faixas etárias e incluem quedas, colisões em alta velocidade durante esportes, automutilação intencional, acidentes de veículos automotores e assaltos1,2,3.
A lesão axonal difusa cerebral (DAI) é um tipo específico de TCE induzido pela aceleração rotacional, tremor ou lesão de explosão do cérebro resultante do movimento irrestrito da cabeça no instante após a lesão4,5,6,7,8. O DAI envolve danos axonais generalizados que levam a um comprometimento neurológico de longa duração que está associado a um desfecho ruim, custos de saúde pesados e uma taxa de mortalidadede33-64% 1,2,4,5,9,10,11. Apesar de pesquisas recentes significativas sobre a patogênese do DAI, não houve consenso sobre as melhores opções de tratamento11,12,13,14.
Ao longo das últimas décadas, inúmeros modelos experimentais tentaram replicar com precisão diferentes aspectos do DAI11,,12,,15,,16. No entanto, esses modelos têm limitações dada a apresentação única do DAI em comparação com outras lesões focais. Esses modelos anteriores não só causam lesões axonais em regiões de matéria branca, mas também resultam em lesões cerebrais focais. Clinicamente, o DAI é acompanhado por micro hemorragias, que podem constituir uma grande causa de danos à matéria branca.
Apenas dois modelos animais foram mostrados para replicar as principais características clínicas do DAI. Gennarelli e colegas produziram o primeiro dispositivo de rotação de cabeça lateral em 1982, usando aceleração rotacional de cabeça sem impacto para induzir o coma com dai em um primata não humano modelo15. Este modelo primata utilizou rotação única controlada para aceleração e desaceleração para deslocar a cabeça através de 60° dentro de 10-20 ms. Esta técnica foi capaz de emular consciência prejudicada e dano axonal generalizado que se assemelhava aos efeitos do Tce grave observado em cérebros humanos. No entanto, os4modelos primatas são muito caros4,11,,16. Baseado em parte no modelo anterior, um modelo suíno de lesão cerebral de aceleração rotacional foi projetado em 1994 (Ross et al.) com resultados semelhantes14.
Esses dois modelos animais, embora tenham produzido diferentes apresentações de patologia típica, têm adicionado muito aos conceitos de patogênese da DAI. A rotação rápida da cabeça é geralmente aceita como o melhor método para induzir o DAI, e os roedores fornecem um modelo mais barato para os estudos rápidos de rotação da cabeça11,16. Aqui, validamos um modelo de roedor simples, reprodutível e confiável do DAI que causa danos generalizados de matéria branca sem fraturas no crânio ou contusões. Este modelo atual permitirá uma melhor compreensão da fisiopatologia do DAI e desenvolvimento de tratamentos mais eficazes.
Protocolo
Os experimentos foram realizados seguindo as recomendações das Declarações de Helsinque e Tóquio e das Diretrizes para o Uso de Animais Experimentais da Comunidade Europeia. Os experimentos foram aprovados pelo Comitê de Cuidados Animais da Universidade Ben-Gurion do Negev.
1. Preparar ratos para o procedimento experimental
NOTA: Selecione ratos machos adultos sprague-dawley pesando 300-350 g.
- Obter aprovação para a realização desses experimentos no Comitê de Cuidado e Uso institucional de Animais.
- Mantenha os ratos a uma temperatura ambiente de 22 ± 1 °C, com ciclos de luz de 12 horas e 12 horas de escuridão. Forneça comida de rato e água ad libitum.
- Realize todos os experimentos entre 6:00 e 12:00.
- Use um sistema de administração isoflurano contínuo para induzir anestesia. Certifique-se de que o sistema de vaporizador está cheio de isoflurano.
- Anestesiar os ratos com 2% de isoflurano.
- Confirme que o rato está totalmente anestesiado observando a falta de movimento ou reflexo do pedal em resposta a um estímulo externo.
2. Indução de lesão axonal difusa
NOTA: O dispositivo é constituído pelos seguintes componentes: 1) cilindro plástico transparente, 2) peso de ferro (1308 g), 3) mecanismo de rotação composto por um tubo cilíndrico, dois rolamentos sobre os quais o eixo gira e uma fixação da cabeça (para pinos de ouvido); 4) plataforma horizontal na qual são fixados dois rolamentos.
- Coloque o dispositivo em uma mesa de laboratório pesada e estável.
- Fixar o peso a uma corda que é elevada a uma altura de 120 cm.
- Deixe o peso em queda livre para acertar o parafuso, ativando o mecanismo de rotação. Usando o dispositivo de rotação lateral da cabeça, a cabeça do roedor é virada rapidamente de 0 a 90°.
- Após a indução de lesão cerebral axonal difusa, transfira o rato para uma sala de recuperação.
3. Medição de parâmetros de Cinemática rotacional/Biomecânica.
- Medir os parâmetros cinéticos/biomecânicos de medida da seguinte forma:
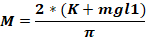
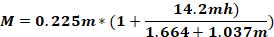

onde Fo - força aplicada à cabeça animal (kg); M – momento de força; K – energia cinética; m – massa do peso em queda; g - aceleração gravitacional; h – altura (cm); D – distância entre os pinos auricados (cm).
NOTA: Para calcular a força aplicada na cabeça do animal (Fo), é necessário conhecer a massa do peso em queda, a altura em que o peso cai e a distância entre os pinos de ouvido. Os outros parâmetros permanecem inalterados.
4. Avaliação do Escore de Gravidade Neurológica após 48 horas
NOTA: Os déficits neurológicos foram avaliados e classificados por meio de um Escore de Gravidade Neurológica, conforme descrito anteriormente17,18,19. Alterações na função motora e comportamento são avaliadas por um sistema de pontos de tal forma que uma pontuação máxima de 24 representa disfunção neurológica grave. Uma pontuação de 0 indica estado neurológico intacto. As seguintes funções comportamentais são avaliadas.
- Avalie a incapacidade do rato de sair de um círculo (50 cm de diâmetro) quando deixado no centro. Realize isso para três sessões individuais com duração de 30 min, 60 min e mais de 60 min.
- Teste o rato para uma perda de reflexo de redireitaem em três sessões com duração de 20 min, 40 min e mais de 60 min.
- Realizar o teste para hemiplegia, a incapacidade do rato de resistir a mudanças forçadas de posição.
- Levante o rato pela cauda para testar a flexão do membro traseiro.
- Coloque o rato no chão para testar sua habilidade de andar em linha reta.
- Teste para três reflexos separados: o reflexo da pinna, o reflexo da córnea e o reflexo de assusto.
- Avalie o rato com grau clínico baseado na perda de comportamento de busca e prostração.
- Teste os reflexos dos membros para colocação. Realize o teste nos membros dianteiros esquerdo e direito, e depois nos membros traseiros esquerdo e direito.
- Realize um teste funcional através da tarefa de balanceamento de feixes. O feixe deve medir 1,5 cm de largura. Execute o teste para sessões de 20, 40 s e mais de 60 s.
- Realizar teste de caminhada de feixe no rato com vigas de três larguras diferentes: 8,5 cm de largura, 5 cm de largura e 2,5 cm de largura.
5. Coleta cerebral para exame histológico após 48 horas
- Às 48 horas após a lesão, eutanize os ratos substituindo sua mistura de gás inspirada por 20% O2/80% CO2. Certifique-se de que o CO2 seja entregue a uma taxa pré-determinada de acordo com as diretrizes do Comitê de Cuidados e Uso de Animais Institucionais.
- Garantir a confirmação de óbito de acordo com as diretrizes do Comitê de Cuidados e Uso de Animais Institucionais.
- Transcardiacally perfundir o rato com 0,9% de soro salino heparinizado a temperatura de 4 °C, seguido por 500 mL de 4% de paraformaldeído em 0,1 M salino tampão fosfato (pH 7.4).
- Após a perfusão, realize a decapitação com uma guilhotina.
- Realize a coleta cerebral removendo as calvarias com fórceps de corte ósseo para evitar danos ao tecido cerebral.
- Remova o cérebro imediatamente e fixe em uma solução de formaldeído tampão de 4% para 48 h a 4 °C.
- Bloqueie cérebros em seções coronais de 5 mm da face da lâmpada olfativa para o córtex visual e cerebelo bissecto e hastes cerebrais.
- Após a incorporação da parafina, corte as seções coronal e sagital (5 μm) de distância do tálamo por secção de microtome.
6. Coloração e exame imunoquímicos
- Coloque delicadamente as fatias em lâminas de vidro com um pincel macio, 1 fatia por slide.
- Produzir coloração imunoquímica de βAPP.
- Deparafinar fatias com xileno (3 vezes para 5 min cada) e reidratar com concentrações gradualmente reduzidas de etanol à temperatura ambiente: 3 min em 100% etanol duas vezes, 3 min em 95% etanol duas vezes, 3 min em 90% de etanol, 3 min em 70% de etanol e 3 min em DDW.
- Tratar seções cerebrais deparafinadas e rehidratadas com 3% H2O2 por 15 min à temperatura ambiente para bloquear a atividade endógena da peroxidase.
- Incubar seções com citrato de sódio de 0,01 M (pH 6.0) a 98 °C por 5 min para recuperação de antígenos.
- Mantenha os slides no tampão por 20 min em temperatura ambiente para esfriar.
- Lave as seções com solução de solução salina tamponada com fosfato (PBS) duas vezes por 5 min.
- Bloqueie as seções com soro de cavalo normal de 2,5% para 1 h à temperatura ambiente e incuba durante a noite a 4 °C no anti-APP do coelho primário (1:4000) diluído no soro de bloqueio.
- Após a incubação em anticorpo primário, lave seções em PBS à temperatura ambiente.
- Incubar seções em anticorpo secundário biotinylado devidamente diluído por 15 min e lavar com PBS por 3 min duas vezes à temperatura ambiente.
- Incubar em streptavidin-peroxidase por 15 min e lavar novamente em PBS por 3 min duas vezes em temperatura ambiente.
- Incubar seções com solução de substrato tampão (pH 7.5) contendo peróxido de hidrogênio e solução cromogeno de 3,3 diaminobenzidinae e proteger da luz até que a cor seja desenvolvida.
- Incubar os slides com DDW em temperatura ambiente por 5 min, a fim de parar a reação.
- Seções de contra-coloração com Hematoxilina por 3 min em temperatura ambiente e lave por 5 min com água da torneira fluindo.
- Desidratar os slides com concentrações gradualmente crescentes de etanol à temperatura ambiente: 2 min em DDW, 2 min em 70% de etanol, 2 min em 90% de etanol, 2 min de etanol 95%, 2 min em 100% de etanol e 3 min em xileno três vezes.
- Seque e monte com meio de montagem.
- Examine as fatias sob a ampliação do microscópio de 200x com uma lente objetiva de 20 mm usando um microscópio.
Resultados
A Tabela 1 ilustra a linha do tempo do protocolo. A taxa de mortalidade nesse modelo de DAI foi de 0%. Um teste de Mann-Whitney indicou que o déficit neurológico foi significativamente maior para os 15 ratos DAI em comparação com os 15 ratos falsos em 48 horas após a intervenção (Mdn = 1 vs. 0), U = 22,5, p < 0,001, r = 0,78 (ver Tabela 2). Os dados são medidos em contagem e são apresentados como intervalo mediano e de 25 a 75 percentis.
Fotomicrograf...
Discussão
Este protocolo descreve um modelo de roedor da DAI. No DAI, a aceleração rotacional no cérebro causa um efeito de cisalhamento que desencadeia alterações axonais e bioquímicas que levam à perda da função axonal em um processo progressivo. As alterações axonais secundárias são produzidas por uma lesão de estiramento axonal rápida e são variáveis em sua extensão e gravidade4,5,10. Dentro de horas a dias após a l...
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Os autores reconhecem com gratidão o Dr. Nathan Kleeorin (Departamento de Engenharia Mecânica da Universidade Ben-Gurion do Negev) por sua ajuda com as medidas biomecânicas. Além disso, agradecemos à professora Olena Severynovska, Maryna Kuscheriava, Maksym Kryvonosov, Daryna Yakumenko e Evgenia Goncharyk do Departamento de Fisiologia, Faculdade de Biologia, Ecologia e Medicina, Universidade Oles Honchar Dnipro, Dnipro, Ucrânia por seu apoio e contribuições úteis às nossas discussões.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.01 M sodium citrate | SIGMA - ALDRICH | ||
| 2.5% normal horse serum | SIGMA - ALDRICH | H0146 | Liquid |
| 4 % buffered formaldehyde solution | |||
| Anti-Amyloid Precursor Protein, C - terminal antibodyproduced in rabbit | SIGMA - ALDRICH | Lot 056M4867V | |
| biotinylated secondary antibody | Vector | BA-1000-1.5 | 10 mM sodium phosphate, pH 7.8, 0.15 M NaCl, 0.08% sodium azide, 3 mg/ml bovine serum albumin |
| bone-cutting forceps | |||
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | vector laboratory | ||
| embedding cassettes | |||
| ethanol 99.9 % | ROMICAL | Flammable Liquid | |
| guillotine | |||
| Hematoxylin | SIGMA - ALDRICH | H3136-25G | |
| Hydrogen peroxide solution | Millipore | 88597-100ML-F | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | ||
| Olympus BX 40 microscope | Olympus | ||
| paraffine | paraplast plus leica biosystem | Tissue embedding medium | |
| phosphate-buffered saline (PBS) | SIGMA - ALDRICH | P5368-10PAK | Contents of one pouch, when dissolved in one liter of distilled or deionized water, will yield 0.01 M phosphate buffered saline (NaCl 0.138 M; KCl - 0.0027 M); pH 7.4, at 25 °C. |
| Streptavidin HRP | ABCAM | ab64269 | Streptavidin-HRP for use with biotinylated secondary antibodies during IHC / immunohistochemistry. |
| xylene |
Referências
- Faul, M., Wald, M. M., Xu, L., Coronado, V. G. Traumatic brain injury in the United States; emergency department visits, hospitalizations, and deaths, 2002-2006. US Government. , (2010).
- Taylor, C. A., Bell, J. M., Breiding, M. J., Xu, L. Traumatic Brain Injury-Related Emergency Department Visits, Hospitalizations, and Deaths - United States, 2007 and 2013. MMWR Surveillance Summaries. 66, 1-16 (2017).
- Peterson, A. B., Xu, L., Daugherty, J., Breiding, M. J. Surveillance report of traumatic brain injury-related emergency department visits, hospitalizations, and deaths, United States, 2014. US Government. , (2014).
- Su, E., Bell, M. Diffuse axonal injury. Translational Research in Traumatic Brain Injury. 57, 41 (2016).
- Hammoud, D. A., Wasserman, B. A. Diffuse axonal injuries: pathophysiology and imaging. Neuroimaging Clinics. 12, 205-216 (2002).
- Adams, J. H., Graham, D. I., Gennarelli, T. A., Maxwell, W. L. Diffuse axonal injury in non-missile head injury. Journal of Neurology, Neurosurgery, and Psychiatry. 54, 481-483 (1991).
- Slazinski, T., Johnson, M. C. Severe diffuse axonal injury in adults and children. Journal of Neuroscience Nursing. 26, 151-154 (1994).
- Gentleman, S. M., et al. Axonal injury: a universal consequence of fatal closed head injury. Acta Neuropathologica. 89, 537-543 (1995).
- Marehbian, J., Muehlschlegel, S., Edlow, B. L., Hinson, H. E., Hwang, D. Y. Medical Management of the Severe Traumatic Brain Injury Patient. Neurocritical Care. 27, 430-446 (2017).
- Adams, J. H., et al. Diffuse axonal injury in head injury: definition, diagnosis and grading. Histopathology. 15, 49-59 (1989).
- Xiao-Sheng, H., Sheng-Yu, Y., Xiang, Z., Zhou, F., Jian-ning, Z. Diffuse axonal injury due to lateral head rotation in a rat model. Journal of Neurosurgery. 93, 626-633 (2000).
- Ross, D. T., Meaney, D. F., Sabol, M. K., Smith, D. H., Gennarelli, T. A. Distribution of forebrain diffuse axonal injury following inertial closed head injury in miniature swine. Experimental Neurology. 126, 291-299 (1994).
- Bullock, R. Opportunities for neuroprotective drugs in clinical management of head injury. Journal of Emergency Medicine. 11, 23-30 (1993).
- Gennarelli, T. A. Mechanisms of brain injury. Journal of Emergency Medicine. 11, 5-11 (1993).
- Gennarelli, T. A., et al. Diffuse axonal injury and traumatic coma in the primate. Annals of Neurology. 12, 564-574 (1982).
- Xiaoshengi, H., Guitao, Y., Xiang, Z., Zhou, F. A morphological study of diffuse axonal injury in a rat model by lateral head rotation trauma. Acta Neurologica Belgica. 110, 49-56 (2010).
- Zlotnik, A., et al. beta2 adrenergic-mediated reduction of blood glutamate levels and improved neurological outcome after traumatic brain injury in rats. Journal of Neurosurgical Anesthesiology. 24, 30-38 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedures Online. 21, 9 (2019).
- Boyko, M., et al. The neuro-behavioral profile in rats after subarachnoid hemorrhage. Brain Research. 1491, 109-116 (2013).
- Ma, J., Zhang, K., Wang, Z., Chen, G. Progress of Research on Diffuse Axonal Injury after Traumatic Brain Injury. Neural Plasticity. 2016, 9746313 (2016).
- Medana, I. M., Esiri, M. M. Axonal damage: a key predictor of outcome in human CNS diseases. Brain. 126, 515-530 (2003).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Experimental Neurology. 233, 364-372 (2012).
- Johnson, V. E., Stewart, W., Smith, D. H. Traumatic brain injury and amyloid-beta pathology: a link to Alzheimer's disease. Nature Reviews Neuroscience. 11, 361-370 (2010).
- Sherriff, F. E., Bridges, L. R., Sivaloganathan, S. Early detection of axonal injury after human head trauma using immunocytochemistry for beta-amyloid precursor protein. Acta Neuropathologica. 87, 55-62 (1994).
- Reichard, R. R., White, C. L., Hladik, C. L., Dolinak, D. Beta-amyloid precursor protein staining of nonaccidental central nervous system injury in pediatric autopsies. Journal of Neurotrauma. 20, 347-355 (2003).
- Gentleman, S. M., Nash, M. J., Sweeting, C. J., Graham, D. I., Roberts, G. W. Beta-amyloid precursor protein (beta APP) as a marker for axonal injury after head injury. Neuroscience Letters. 160, 139-144 (1993).
- Smith, D. H., Hicks, R., Povlishock, J. T. Therapy development for diffuse axonal injury. Journal of Neurotrauma. 30, 307-323 (2013).
- McKenzie, K. J., et al. Is beta-APP a marker of axonal damage in short-surviving head injury. Acta Neuropathologica. 92, 608-613 (1996).
- Wilkinson, A., Bridges, L., Sivaloganathan, S. Correlation of survival time with size of axonal swellings in diffuse axonal injury. Acta Neuropathologicaogica. 98, 197-202 (1999).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Alder, J., Fujioka, W., Lifshitz, J., Crockett, D. P., Thakker-Varia, S. Lateral fluid percussion: model of traumatic brain injury in mice. Journal of Visualized Experiments. , e3063 (2011).
- Povlishock, J., Marmarou, A., McIntosh, T., Trojanowski, J., Moroi, J. Impact acceleration injury in the rat: evidence for focal axolemmal change and related neurofilament sidearm alteration. Journal of Neuropathology & Experimental Neurology. 56, 347-359 (1997).
- Heath, D. L., Vink, R. Impact acceleration-induced severe diffuse axonal injury in rats: characterization of phosphate metabolism and neurologic outcome. Journal of Neurotrauma. 12, 1027-1034 (1995).
- Lighthall, J. W. Controlled cortical impact: a new experimental brain injury model. Journal of Neurotrauma. 5, 1-15 (1988).
- Palmer, A. M., et al. Traumatic brain injury-induced excitotoxicity assessed in a controlled cortical impact model. Journal of Neurochemistry. 61, 2015-2024 (1993).
- Hamm, R. J., et al. Cognitive deficits following traumatic brain injury produced by controlled cortical impact. Journal of Neurotrauma. 9, 11-20 (1992).
- Nyanzu, M., et al. Improving on Laboratory Traumatic Brain Injury Models to Achieve Better Results. International Journal of Medical Sciences. 14, 494-505 (2017).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Lighthall, J. W., Dixon, C. E., Anderson, T. E. Experimental models of brain injury. Journal of Neurotrauma. 6, 83-97 (1989).
- Meaney, D. F., et al. Modification of the cortical impact model to produce axonal injury in the rat cerebral cortex. Journal of Neurotrauma. 11, 599-612 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados