Method Article
Eine telemetrische, gravimetrische Plattform für die physiologische Phänotypisierung von Pflanzen-Umwelt-Interaktionen in Echtzeit
In diesem Artikel
Zusammenfassung
Diese gravimetrische Phänotypisierungsmethode mit hohem Durchsatz, telemetrischen, ganzpflanzlichen Wasserverhältnissen ermöglicht direkte und gleichzeitige Echtzeitmessungen sowie die Analyse mehrerer ertragsbezogener physiologischer Merkmale, die an dynamischen Wechselwirkungen zwischen Pflanze und Umgebung beteiligt sind.
Zusammenfassung
Die Ernährungssicherheit für die wachsende Weltbevölkerung ist ein großes Anliegen. Die von genomischen Werkzeugen zur Verfügung gestellten Daten übersteigen bei weitem das Angebot an phänotypischen Daten, wodurch eine Wissenslücke entsteht. Um der Herausforderung zu begegnen, die Ernten zu verbessern, um die wachsende Weltbevölkerung zu ernähren, muss diese Kluft überbrückt werden.
Physiologische Merkmale werden als zentrale funktionelle Merkmale im Kontext der Reaktionsfähigkeit oder Empfindlichkeit gegenüber Umgebungsbedingungen betrachtet. Viele kürzlich eingeführte Hhänotypisierungstechniken mit hohem Durchsatz (HTP) basieren auf Fernerkundung oder Bildgebung und sind in der Lage, morphologische Merkmale direkt zu messen, messen aber physiologische Parameter hauptsächlich indirekt.
Dieser Artikel beschreibt eine Methode zur direkten physiologischen Phänotypisierung, die mehrere Vorteile für die funktionelle Phänotypisierung von Wechselwirkungen zwischen Pflanze und Umwelt hat. Es hilft Benutzern, die vielen Herausforderungen zu meistern, die bei der Verwendung von Gravimetrischen Systemen der Lastzelle und Topfexperimenten auftreten. Die vorgeschlagenen Techniken werden es den Anwendern ermöglichen, zwischen Bodengewicht, Pflanzengewicht und Bodenwassergehalt zu unterscheiden, und bieten eine Methode zur kontinuierlichen und gleichzeitigen Messung dynamischer Boden-, Pflanzen- und Atmosphärenbedingungen sowie die Messung wichtiger physiologischer Merkmale. Diese Methode ermöglicht es Forschern, Feldstressszenarien unter Berücksichtigung der Auswirkungen der Umgebung auf die Physiologie der Pflanzen genau nachzuahmen. Diese Methode minimiert auch Topfeffekte, die eines der Hauptprobleme bei der Pre-Feld-Phänotypisierung sind. Es enthält ein Rückspeise-Fertigierungssystem, das ein wirklich randomisiertes experimentelles Design bei einer feldähnlichen Pflanzendichte ermöglicht. Dieses System erkennt die Boden-Wasser-Gehaltsbegrenzungsschwelle () und ermöglicht die Übersetzung von Daten in Wissen durch den Einsatz eines Echtzeit-Analysetools und einer statistischen Online-Ressource. Diese Methode zur schnellen und direkten Messung der physiologischen Reaktionen mehrerer Pflanzen auf eine dynamische Umgebung hat ein großes Potenzial für den Einsatz beim Screening auf vorteilhafte Merkmale im Zusammenhang mit Reaktionen auf abiotischen Stress im Zusammenhang mit der Vorfeldzucht und der Verbesserung der Ernte.
Einleitung
Die Gewährleistung der Ernährungssicherheit für eine wachsende Weltbevölkerung unter sich verschlechternden Umweltbedingungen ist derzeit eines der Hauptziele der Agrarforschung1,2,3. Die Verfügbarkeit neuer molekularer Werkzeuge hat die Programme zur Verbesserung der Ernte erheblich verbessert. Doch während genomische Werkzeuge eine enorme Datenmenge liefern, schafft das begrenzte Verständnis der tatsächlichen phänotypischen Merkmale eine erhebliche Wissenslücke. Diese Lücke zu überbrücken ist eine der größten Herausforderungen für die moderne Pflanzenwissenschaft4,5,6. Um den Herausforderungen zu begegnen, die sich im Prozess der Pflanzenverbesserung ergeben, und die Wissenslücke zwischen Genotyp und Phänotyp zu minimieren, müssen wir den genotypischen Ansatz mit einem phänozentrischen7,8ausbalancieren.
In letzter Zeit haben verschiedene High-Throughput-Phänotypisierungsplattformen (HTP) die zerstörungsfreie Phänotypisierung großer Pflanzenpopulationen im Laufe der Zeit ermöglicht und diese Plattformen können uns helfen, die Wissenslücke zwischen Genotyp-Phänotyp zu verringern6,8,9,10. HTP-Siebtechniken ermöglichen die Messung von Merkmalen in einer großen Anzahl von Anlagen innerhalb eines relativ kurzen Zeitraums, dank Robotik und Förderbändern oder Portalen, die verwendet werden, um die Anlagen oder Sensoren (bzw.) zu bewegen, im Gegensatz zu handbetriebenen Techniken, die auf Gasaustausch oder Fotografie basieren. Dennoch stellen die enormen Datenmengen von HTP-Systemen zusätzliche Datenverarbeitungs- und analytische Herausforderungendar 11,12.
Die meisten dieser HTP-Plattformen beinhalten die Bewertung von phänotiver Eigenschaften durch elektronische Sensoren oder automatisierte Bildaufnahme13,14. Die fortgeschrittene Feldphänomene beinhalten den Einsatz von proximalen Sensoren und Bildgebungstechnologien im Feld sowie eine hochauflösende, präzise und großflächige Messskala15. Sensor- und Bilddaten müssen in andere Multi-Omics-Daten integriert werden, um einen ganzheitlichen phänomischen Ansatz der zweiten Generation zu schaffen16. Methodische Fortschritte bei der Datenerfassung, -handhabung und -verarbeitung gewinnen jedoch zunehmend an Bedeutung, da die Herausforderungen bei der Umsetzung von Sensorinformationen in Wissen in den ersten Jahren der Pflanzenphänomenforschung stark unterschätzt wurden13. Die Zuverlässigkeit und Genauigkeit der derzeit verfügbaren bildgebenden Verfahren zur Tiefenphänotypisierung dynamischer Genotyp-Umgebungsinteraktionen und Pflanzenspannungsreaktionen ist jedoch fragwürdig17,18. Darüber hinaus unterscheiden sich die Ergebnisse aus kontrollierten Umgebungen oft sehr von denen, die vor Ort beobachtet werden, insbesondere wenn es um Diephänotypisierung von Dürre-Stress geht. Dies ist auf unterschiedliche Situation zurückzuführen, die die Pflanzen in Bezug auf Bodenvolumen, Bodenumwelt und mechanische Impedanz aufgrund abnehmender Bodenfeuchtigkeit während Trockenbelastung erleben. Daher sind Ergebnisse aus kontrollierten Umgebungen schwer auf das Feld19zu extrapolieren. Schließlich ist der Einstiegspreis für bildbasierte HTP-Systeme sehr hoch, nicht nur wegen der Preise für Sensoren, sondern auch wegen der Robotik, Förderbänder und Portale, die auch höhere Standards der Wachstums-Anlagen-Infrastruktur und erhebliche Wartung erfordern (viele bewegliche Teile, die in einer Gewächshausumgebung arbeiten).
In diesem Beitrag stellen wir eine HTP-telemetrische Phänotypisierungsplattform vor, die viele der oben genannten Probleme lösen soll. Die Telemetrietechnologie ermöglicht die automatische Messung und Übertragung von Daten von entfernten Quellen an eine Empfangsstation zur Aufzeichnung und Analyse. Hier zeigen wir eine zerstörungsfreie HTP-telemetrische Plattform, die mehrere Wägelysimeter (ein gravimetrisches System) und Umgebungssensoren umfasst. Dieses System kann für die Erfassung und sofortige Berechnung (Bildanalyse ist nicht erforderlich) einer Vielzahl von Daten verwendet werden, wie z. B. Biomassegewinn in ganzen Pflanzen, Transpirationsraten, stomatale Leitfähigkeit, Wurzelflüsse und Wassernutzungseffizienz (WUE). Die Echtzeitanalyse der Big Data, die direkt vom Controller im System an die Software gespeist wird, stellt einen wichtigen Schritt bei der Übersetzung von Daten in Wissen14 dar, der einen großen Wert für die praktische Entscheidungsfindung hat, und erweitert das Wissen, das aus kontrollierten Phänotypisierungsexperimenten der Umgebung im Allgemeinen und Gewächshausstudien über Stress im Besonderen erworben werden kann, erheblich.
Weitere Vorteile der Telemetrieplattform sind die Skalierbarkeit und einfache Installation sowie die minimalen Anforderungen an die Infrastruktur für Wachstumseinrichtungen (d. h. sie kann problemlos in den meisten Wachstumseinrichtungen installiert werden). Da dieses sensorbasierte System keine beweglichen Teile hat, sind die Wartungskosten relativ gering, einschließlich des Einstiegspreises und der langfristigen Wartungskosten. So wird beispielsweise der Preis für ein 20-Einheiten-Gravimetriesystem, einschließlich des Rückkopplungssystems für jede Anlage, meteorologische Station und Software, dem Preis eines tragbaren Gasaustauschsystems einer führenden Marke entsprechen.
Reis (Oryza sativa L.) wurde als Modellpflanze verwendet und Trockenheit war die untersuchte Behandlung. Reis wurde gewählt, da es sich um eine große Getreidepflanze mit großer genetischer Vielfalt handelt und es ist das Grundnahrungsmittel für mehr als die Hälfte der Weltbevölkerung20. Dürre ist ein wichtiger abiotischer Umweltstressfaktor, der das Pflanzenwachstum und die Entwicklung beeinträchtigen kann, was zu geringeren Ernteerträgen führt21. Diese Kombination aus Kulturundbehandlung wurde verwendet, um die Fähigkeiten der Plattform sowie die Menge und Qualität der Daten, die sie produzieren kann, zu demonstrieren. Weitere Informationen zum theoretischen Hintergrund dieser Methode finden Sie unter 22.
Protokoll
In diesem Protokoll haben wir auf 4 L-Töpfe verwiesen, die auf 20 cm x 20 cm Waagen geladen sind, wobei jeder Topf eine Pflanze enthält. Das gleiche Protokoll ist leicht skalierbar und kann mit viel größeren Töpfen (bis zu 25 L auf 40 cm x 40 cm Waage, mit nur einer linearen Anpassung an die Protokollmaße) und mehreren Pflanzen pro Topf verwendet werden. So kann das Protokoll für Anlagen vieler Arten und Größen leicht angepasst werden. Die Systemkomponenten entnehmen Sie bitte Abbildung 1 und Abbildung 2.
1. Bereiten Sie die Töpfe für das Experiment vor
- Setzen Sie den Bodenfilter ein. Verteilen Sie das Nylon-Mesh (Netz) auf den gesamten Topf und legen Sie den Netzhalter auf das Netz. Mit einer Hand, schieben Sie langsam den Netzhalter auf halbem Weg nach unten das Innere des ganzen Topfes. Stellen Sie sicher, dass das Netz gleichmäßig verteilt bleibt, während es zwischen den beiden Töpfen nach unten gedrückt wird.
- Setzen Sie den Fiberglasstab (Pol) zwischen die beiden Töpfe und schieben Sie es den ganzen Weg nach unten auf den Boden des gesamten Topfes, um sicherzustellen, dass es auf der Außenseite des Netzes als auch und drückt nicht das Netz.
- Bevor Sie den Netzhalter ganz nach unten drücken, drücken Sie das Netz von Hand aus dem Topf nach unten und stellen Sie es so ein, dass es gleichmäßig und fest über den Boden des Topfes verteilt ist, sobald der Netzhalter vollständig eingesetzt wurde (Abbildung 2CI).
- Schieben Sie den Dichtungsring von der Unterseite des oben beschriebenen Topfaufbaus, ein Drittel des Weges auf der Seite des Topfes. Stellen Sie sicher, dass sich die Schlitze des Rings zum unteren Rand des Topfes öffnen (Abbildung 2CII).
- Wiederholen Sie die Schritte 1.1-1.4 für alle experimentellen Töpfe, bevor Sie mit dem nächsten Schritt fortfahren. Randomize die Position der Pflanzen(Abbildung 2D; entweder in einem randomisierten Block-Design oder ein vollständig zufälliges Design) mit der Array Randomizer Anwendung.
HINWEIS: Um das kostenlose Programm herunterzuladen und weitere Informationen zu erhalten, lesen Sie bitte den Link: https://drive.google.com/open?id=1y4QbTpxRK5Lx430xzu1RFdrlcL8pz_1q). - Beschriften Sie die Töpfe nach ihren Standorten im Array im Gewächshaus. Die Bezeichnung "B10D" entspricht beispielsweise einem Topf auf Tabelle B in Spalte 10 und Zeile D. Bereiten Sie für jede Tabelle drei zusätzliche Töpfe für Boden-Wasser-Gehaltsmessungen vor (siehe Abschnitt 7.1).
2. Wachsen Sie die Pflanzen
- Wählen Sie das wachsende (Topf-)Medium, das am besten zum Experiment passt. Die Wahl des richtigen Mediums für das Experiment ist entscheidend und die richtige Wahl hängt von mehreren Faktoren ab (siehe Diskussion). Für Erstanwender empfehlen wir dringend die Verwendung eines porösen, keramischen, kleinen Mediums. Weitere Informationen zur Auswahl des richtigen Mediums für das Experiment finden Sie in Tabelle 1 und Tabelle 2.
- Keimen Sie die Samen in Hohlraumschalen mit dem gewünschten Topfmedium. Wenn möglich, tun Sie dies im selben Gewächshaus, um für den Hauptteil des Experiments verwendet zu werden, um die Pflanzen an die Umweltbedingungen innerhalb dieses Gewächshauses zu gewöhnen.
- Wenn die Sämlinge nicht in Schalen gekeimt wurden, transplantieren Sie sie in Hohlraumschalen, die das Vergussmedium enthalten. Pflanzen Sie einen Sämling in jeden Hohlraum und lassen Sie ihn wachsen, bis seine Wurzeln dicht genug sind, um die Form des Hohlraums (Wurzel-Boden-Stecker) anzunehmen.
- Lassen Sie 5–7 Hohlräume ohne Sämlinge für Bodengewichtsmessungen (nur Vergussmedium; Abbildung 3). Weitere Informationen finden Sie in Abschnitt 5.9.
3. Verbessern Sie den Signal-Rausch-Pegel
HINWEIS: Die folgenden Schritte verbessern die Qualität der Messungen und reduzieren den Geräuschpegel.
- Kalibrieren Sie das Lysimeter.
- Verwenden Sie einen Spirituosenpegel, um zu überprüfen, ob alle Lysimeter eben sind, und starten Sie dann den Gewichtkalibrierungsprozess. Verwenden Sie zwei Standardgewichte (1–10 kg). Führen Sie die Kalibrierung durch, während sich der grüne Behälter, einschließlich aller Stecker, auf der Wägezelle befindet.
- Setzen Sie das erste (leichtere) Kalibriergewicht auf jede Wägezelle.
- Gehen Sie in der Bediensoftware auf die Registerkarte Kalibrierung und wählen Sie das Gewicht für den ersten Punkt aus. Wählen Sie dann die Load-Cell-Position aus, an der die Gewichtung platziert wurde, und klicken Sie auf Punkt abrufen1 (Zusatzabbildung 1A). Dieser Schritt kann auf mehrere Wägezellen gleichzeitig angewendet werden.
- Wiederholen Sie den Vorgang für die zweite Gewichtung, und klicken Sie auf Punkt 2 abrufen.
- Klicken Sie auf Kalibrierung anwenden.
- Sicherstellung einer ausreichenden Anzahl von Pflanzen mit einer angemessenen Größe für das Experiment
HINWEIS: Je kleiner die Pflanze, desto schwächer wird ihr Signal sein (z. B. Gewicht des Wassers an einem Tag im Vergleich zum Topfgewicht). Die folgenden Schritte helfen, das Signal-Rausch-Verhältnis zu verbessern.- Starten Sie das Experiment, wenn die Pflanze etwa 10% der maximalen Topfwasserkapazität ausläuft.
HINWEIS: Wenn Sie beispielsweise mit einem sandigen Medium arbeiten, das ca. 1 L Wasser bei Topfkapazität enthält (siehe Tabelle 2),starten Sie das Experiment, wenn die Pflanzen ca. 100 ml pro Tag durchdringen. Wenn Sie mit einem torfbasierten Medium arbeiten, das etwa 2 L Wasser bei Topfkapazität fasst (siehe Tabelle 2),beginnen Sie die Messungen, wenn die Pflanzen etwa 200 ml pro Tag durchführen. - Schätzen Sie die anfängliche tägliche Transpiration der Pflanze, bevor Sie sie auf das System laden, indem Sie (manuell) die Gewichtsunterschiede am Abend bei einigen Sämlingen messen.
- Bei der Arbeit mit kleinen Pflanzen mehrere Pflanzen in jeden Topf (z.B. sechs Arabidopsis-Pflanzen in einem 3,9 L Topf23, um das empfohlene Minimale der Transpiration zu erreichen)*.
- Starten Sie das Experiment, wenn die Pflanze etwa 10% der maximalen Topfwasserkapazität ausläuft.
4. Einrichten des Experiments
ANMERKUNG: Bei der Einrichtung des Versuchs wird das Gewicht aller Teile des Systems berücksichtigt, nämlich das Gewicht des Vergussmediums (einschließlich des Boden-Wasser-Gewichts bei Topfkapazität) und das Anfangsgewicht der Sämlinge. Führen Sie die folgenden Schritte aus:
- Arbeiten Sie nach Möglichkeit mit ähnlichen statischen Komponenten mit ähnlichen Gewichtungen. Zu den statischen Gewichtskomponenten gehören Topfsets, Bodensonden und andere Kunststoffteile.
- Um ein neues Experiment zu starten, öffnen Sie die Betriebssoftware. Öffnen Sie die Registerkarte Experimente im Menü auf der linken Seite des Bildschirms. Klicken Sie auf Neu erstellen oder duplizieren Sie die Experimenteigenschaften aus einem vorherigen Experiment, indem Sie mit der rechten Maustaste auf das gewünschte Experiment klicken und Duplizierenauswählen. Benennen Sie das Experiment um (ergänzende Abbildung 1B).
- Stellen Sie sicher, dass keine Einheit in einem anderen Experiment verwendet wird, das derzeit im System ausgeführt wird. Überprüfen Sie, ob alle Pflanzen im Plants-Tisch mit dem experimentellen Design übereinstimmen. Falls nicht, ändern Sie die Tabelle entsprechend dem Entwurf (siehe Abschnitte 5.18, 6 und Ergänzende Abbildung 1C).
- Starten Sie das Experiment, indem Sie auf den Versuchsnamen und dann auf Startklicken.
- Nehmen Sie manuelle Messungen der vorgefertigten leeren Töpfe (Doppeltopf, Netz, Stock und schwarzer Dichtungsring). Wenn Sie Teile verwenden, die einander ähneln, reicht das durchschnittliche Gewicht von 10 aus.
- Das Topfmedium mit etwas Wasser mindestens 1 h gründlich vermischen, so dass es in homogene Partikel zerfällt und gesättigt ist, um Gleichförmigkeit und Homogenität zu gewährleisten. Für Erstanwender empfehlen wir dringend die Verwendung eines porösen, keramischen, kleinen Mediums (siehe Tabelle 1 und Tabelle 2). Als zweite Option verwenden Sie groben Sand.
- Verwenden Sie einen mechanischen Mischer (z. B. einen Betonmischer).
- Wenn ein sehr homogenes Medium (d. h. Industriesand) verwendet wird, überspringen Sie Schritt 4.6.1.
- Füllen Sie alle Töpfe gleichmäßig für das Experiment mit dem entsprechenden Topfmedium (z.B. Sand, Boden oder Torf).
- Legen Sie einen Guss einer Hohlraumform (Abbildung 3B) ein, der in Form und Größe dem Wurzel-Boden-Stecker der Sämlinge (aus der Hohlraumschale) in die Mitte des Vergussmediums ähnelt. Schieben Sie es vollständig ein. Tippen Sie ein paar Mal auf den Boden, um sicherzustellen, dass das Topfmedium im Topf gut verteilt ist. Wiederholen Sie dies für alle Töpfe.
- Gießen Sie die Töpfe gut und spülen Sie die Außenseite der Töpfe ab. Lassen Sie die Töpfe 30 min abtropfen, bevor Sie mit dem nächsten Schritt fortfahren. Stellen Sie sicher, dass die Töpfe frei abfließen. Wenn das Topfmedium zu langsam abfließt (z.B. dichter Torf), mischen Sie es mit einem luftigen Substrat (z.B. Perlit; siehe auch Tabelle 1 und Tabelle 2), um eine schnellere Entwässerung zu gewährleisten.
- Nachdem die Entwässerung vollständig eingestellt wurde, legen Sie alle gefüllten Töpfe auf die Mitte des Lysimeter-Arrays (in den grünen Behältern, die bereits vorhanden sind) nach dem experimentellen Entwurf (Abbildung 2A).
- Stellen Sie fest, ob die grünen Behälter ordnungsgemäß in die Wägezellenabdeckung eingebaut sind und sich nicht berühren.
- Öffnen Sie in der Bediensoftware die Registerkarte Experimentieren, und wählen Sie die Registerkarte Komponenten messen aus. Klicken Sie auf Measure-Objekt. Benennen Sie die Messung"1. Messung" (Zusatzabbildung 1D).
- Legen Sie die Bewässerungstropfen, Sonden und Topfabdeckungen auf jeden Topf. Stellen Sie sicher, dass die Leitungen für die Multi-Outlet-Tropfen und die Sondenkabel durch ihre jeweiligen Ständer (an den Einheiten für jede Lysimeterskala befestigt; Abbildung 1E) bevor Sie sie in die Töpfe legen. Stellen Sie sicher, dass alle Tropftropfen, Sonden und Abdeckungen sicher positioniert sind.
- Warten Sie bis zu 3 min, bis eine neue Messung durchgeführt wird (Die Daten werden automatisch alle 3 min gesammelt) und öffnen Sie dann die Registerkarte Experiment. Wählen Sie die Registerkarte Experimentieren aus, und klicken Sie auf Die Option Experimentieren. Meta-tag diese Messung auf die"1. Messung" genommen und nennen Sie es "Statische Komponenten" (Ergänzende Abbildung 1E). Meta-Tags werden verwendet, wenn Sie einen Gewichtungswert aufzeichnen möchten, der durch Subtrahieren eines Messwerts von einem anderen ermittelt wird.
- Nachdem Sie die erforderlichen Anpassungen am System vorgenommen haben, warten Sie, bis ein neuer Datenpunkt aufgezeichnet wird (alle 3 min), bevor Sie die nächste Messung durchführen.
- Überprüfen Sie die Spalte Statische Komponenten, um sicherzustellen, dass die in der Tabelle "Pflanzen" aufgezeichneten Werte keine Ausreißer enthalten. Wenn eines der aufgezeichneten Gewichte zu niedrig oder zu hoch ist, überprüfen Sie, ob es zu interferenadieren mit der Wägezelle ist (z. B. stellen Sie sicher, dass nichts sie berührt) und nehmen Sie dann eine neue Messung vor (nachdem das System noch 3 min betrug).
- Klicken Sie auf die Registerkarte Pflanzen. Exportieren Sie die Tabelle Plants als Tabellenkalkulation, fügen Sie das durchschnittliche Topfgewicht (ab Schritt 4.5) zur Messung der statischen Komponenten hinzu - "Tare weight". Speichern und hochladen der Datei (Registerkarte Importieren).
- Stellen Sie sicher, dass alle Tropftropfen sicher in das Vergussmedium und in das Rohr vom Controller eingesetzt werden. Zurück in der Bediensoftware wählen Sie auf der Registerkarte Experimentieren Behandlungsszenarienaus. Klicken Sie auf Neu erstellen, um einen neuen "Plan" zu erstellen.
- Wählen Sie im Plan den ersten Schritt aus (erstellen Sie bei Bedarf einen neuen Schritt), und öffnen Sie ihn. Wählen Sie "Test" für die Behandlung und "Nie" für die Beendigung. Wählen Sie in der Schrittoption alle Behandlungen aus, die auf der Registerkarte Bewässerungsbehandlungen oben auf Experimente aufgeführt sind(Ergänzende Abbildung 1F; siehe auch Schritt 4.21). Drücken Sie die Registerkarte Anwenden.
- Extrahieren Sie die Tabelle Plants als Tabellenkalkulation, fügen Sie der Spalte Behandlung "Plan" hinzu, und fügen Sie der Spalte Schritt "1" hinzu. Speichern und laden Sie die Datei hoch.
- Wählen Sie unter der Registerkarte Bewässerungsbehandlungen die "Test"-Behandlung aus und stellen Sie sie auf eine Bewässerungszeit von 4–5 min [mit der genauen Zeitinabhängigkeit abhängig vom volumetrischen Wassergehalt (VWC) des verwendeten Bodens] ein, um die Entwässerung zu ermöglichen. Stellen Sie die Zeit 2 min voraus und gehen Sie zu den Töpfen im Gewächshaus. Andere Behandlungen können ebenfalls erstellt werden. (Siehe die ausführliche Erläuterung in Schritt 7.4.)
- Überprüfen Sie visuell, ob alle Tropftropfen funktionieren und dass Wasser aus dem perforierten Ablassstopfen des grünen Behälters tropft.
- Ändern Sie im Experiment die Bewässerungsbehandlung auf Plan "X", Schritt 1 (siehe Schritt 4.19-4.20) auf die gewünschte Bewässerungsbehandlung. Stellen Sie sicher, dass jede Nachtbewässerung (mit Fertigation; siehe Tabelle 3 für die verwendeten Fertigationskomponenten) in mehrere kurze Impulse (Ereignisse) mit erheblichen Pausen zwischen ihnen (mindestens drei Ereignisse pro Nacht) unterteilt ist, um sicherzustellen, dass der Boden seine Feldkapazität vor dem Morgengrauen erreicht.
- Lassen Sie das Bewässerungsprogramm für 1 oder 2 Tage laufen, damit der Boden seine Feldkapazität erreichen kann und fahren Sie mit der nächsten Phase fort.
5. Starten des Experiments
HINWEIS: Die in dieser Phase gesammelten Daten werden als Referenzwerte für den Rest des Experiments verwendet. Daher ist es wichtig, die nächsten Schritte sorgfältig zu befolgen.
- Wiederholen Sie die Schritte 4.18 bis 4.20. Alternativ können Sie den Prozess am frühen Morgen beginnen, nicht lange nach dem letzten Bewässerungsschritt.
- Überprüfen Sie visuell, ob alle Töpfe bewässert sind und dass überschüssige Bewässerungsflüssigkeit aus dem perforierten Abflussstopfen des grünen Bades tropft.
- Entfernen Sie den grünen, unperforierten Stecker (aus der untersten Öffnung) des grünen Behälters und lassen Sie das Wasser vollständig abfließen. Setzen Sie dann den Stecker wieder an seine Stelle (Abbildung 1D). Wenn Sie an "Drainage 0" arbeiten (d. h. wenn das untere Loch geöffnet ist/der Hohlentwässerungsstecker an der untersten Bohrung angeschlossen ist), überspringen Sie diesen Schritt.
- Öffnen Sie in der Bediensoftware die Registerkarte für das Experiment, und wechseln Sie zu Komponenten messen. Klicken Sie auf Measure Object and name the measurement as "Cast-pre". Entfernen Sie vorsichtig alle Gussteile aus den Töpfen und warten Sie dann 3 min, bis eine neue Messung aufgezeichnet wird (Zusatzabbildung 1D).
- Klicken Sie auf Measure Object, nennen Sie es "Cast-post" und markieren Sie die Messung auf "Cast-pre". Die Option berechnet automatisch die Differenz zwischen den beiden Messwerten und gibt das Gussgewicht an, um die Gewichtsempfindlichkeit zu überprüfen.
- Überprüfen Sie die Gewichtswerte in der Tabelle Pflanzen. Der Unterschied zwischen den "Cast-post"-Messungen sollte nicht mehr als 20 oder 30 g betragen.
- Um das Gewicht des nassen Bodens in der Bediensoftware zu messen, gehen Sie zur Registerkarte Komponenten messen im Experiment und wählen Sie die Option Bodennassgewicht messen aus. Nehmen Sie die Messung vor, indem Sie auf OK klicken, wenn Sie gefragt werden. Überprüfen Sie die Boden-Nassgewichtsmessungen in der Tabelle Pflanzen des Yotheur-Experiments. Das Gewicht wird in der Spalte "Bodennassgewicht" (Zusatzabbildung 1D,G) angezeigt.
- Wenn einige der Messungen unangemessen zu schwanken scheinen, gehen Sie bitte wie folgt vor:
- Vergewissern Sie sich, dass jeder Pot richtig positioniert ist und keine benachbarten Töpfe berührt.
- Trennen Sie den ersten Controller auf dem Tisch für 2 min vom Strom (der Rest der Steuerungen sind seriell miteinander verbunden und werden somit auch heruntergefahren) und schließen Sie ihn dann wieder an.
- Messen Sie manuell das durchschnittsgewicht einiger (5-10) Hohlräume mit Vergussmedium (ab Schritt 2.3) ohne Sämlinge (Bodenstecker). [Stellen Sie sicher, dass die Bodenstecker vor manuellen Messungen gut bewässert sind (d. h. auf Feldkapazität nach Entwässerung).] Drücken Sie auf der Registerkarte Komponenten messen, set Seedling Bulk-Soil Weight and fill in the average weight (Supplementary Figure 1D).
- Klicken Sie auf Anlagenanfangsgewicht messen. Diese erste Messung ist ein Bezugspunkt vor der Pflanzung (Zusatzabbildung 1D).
- Stellen Sie sicher, dass die Sämlinge in den Hohlraumschalen gut bewässert sind (d. h. auf Feldkapazität nach der Entwässerung). Ziehen Sie die Sämlinge vorsichtig mit ihrem Wurzel-Boden-Stecker aus den Hohlräumen, um sicherzustellen, dass sie nicht verletzt werden, und legen Sie sie vorsichtig in die Hohlräume, die von Gussteilin den Töpfen gemacht werden, nach dem Experimententwurf. Es ist vorzuziehen, die Pflanzen in der Morgen- oder Abenddämmerung zu übertragen, um die Belastung der Pflanzen zu minimieren (d.h. das Welken zu minimieren).
- Warten Sie 3 min. Klicken Sie erneut auf Anfangsgewicht der Pflanze messen. Diese zweite Messung ist das Anfangsgewicht der Anlage. Meta-tag die Messung auf die erste (den Referenzpunkt). Die Software berechnet die Differenz zwischen den beiden Messungen und subtrahiert das Seedling Bulk-Soil Weight. Das Ergebnis ist das Anfangsgewicht der Pflanze.
- Überprüfen Sie die Messwerte in der Tabelle Pflanzen des Experiments, um sicherzustellen, dass sie innerhalb eines vernünftigen und logischen Bereichs liegen (Ergänzende Abbildung 1C).
- Sättigen Sie den Boden, indem Sie die Schritte 4.18 bis 4.20 wiederholen.
- Stellen Sie sicher, dass alle Töpfe ordnungsgemäß entleeren. Wenn dies nicht der Fall ist, wiederholen Sie den Sättigungsprozess. Warten Sie 30 min, bis die Entwässerung eingestellt wird. (Siehe auch Tabelle 1 zur richtigen Wahl des Vergussmediums.)
- Klicken Sie auf der Registerkarte Komponenten messen auf Reserviertes Wassergewicht messen (Ergänzende Abbildung 1D).
- Extrahieren Sie die Tabelle Pflanzen als Tabellenkalkulation, subtrahieren Sie das gemessene Pflanzenanfangsgewicht und das Seedling Bulk-Soil Weight von der reservierten Wassergewichtsmessung (Spalte "Reservewater Inventory"). Laden Sie die Datei hoch (ergänzende Abbildung 1C).
- Bestätigen Sie, dass der Zeitraum, in dem die tägliche Transpiration aufgezeichnet wird, für die Ziele des Experiments geeignet ist. Füllen Sie die Werte in der Registerkarte "Experiment" entsprechend dem Projekt aus (ergänzende Abbildung 1H).
- Null-Stunde ausfüllen: Der Zeitpunkt, zu dem die Software prüft, ob sie zum nächsten Schritt im Behandlungsszenario wechseln muss.
- Tägliche Transpirationswerte ausfüllen: Die tägliche Transpiration wird als Differenz zwischen zwei Gewichtsfenstern während des Tages für alle Tage berechnet. Die tägliche Transpirationsstartzeit ist die Zeit, zu der die Software beginnt, das durchschnittliche Gewicht zu messen.
- Überwachen Sie die Pflanzen 1-2 Tage lang, bevor Sie ein neues Experiment starten (duplizieren und benennen Sie das Experiment um).
6. Ändern Sie die Pflanzentabelle
- Extrahieren Sie die Tabelle Plants als Tabellenkalkulation und ändern Sie die Tabelle nach Bedarf. Ändern Sie die Anlagen-IDs, -Namen oder -Positionen nicht. Speichern und laden Sie die Datei hoch.
- Beschriftung (Gruppierung) Spalten: Um gruppierte Pflanzen basierend auf gemeinsamen Etiketten (z. B. Behandlung, Linie) zu präsentieren oder zu analysieren (siehe Schritt 8), fügen Sie eine neue Spalte und ein Etikett hinzu, das mit dem Wert (z. B. #Treatment) beginnt. Machen Sie in dieser Spalte eine Notation für jede Pflanze (z. B. für das Etikett "#Treatment", markieren Sie die Pflanzen als Trockenheit, Kontrolle usw.; Ergänzende Abbildung 2).
HINWEIS: Das oben vorgestellte Protokoll ist das fortschrittlichste und umfassendste Protokoll für dieses System. Erstbenutzer können jedoch mit dem vereinfachten Protokoll beginnen (siehe Ergänzende MS). Das vereinfachte Protokoll liefert Informationen über weniger Merkmale und kann zu höheren Geräuschpegeln führen. Gleichzeitig bietet es jedoch eine Möglichkeit, die wichtigsten experimentellen Verfahren, Hardware und Software leichter kennenzulernen und kennen zu lernen.
7. Führen Sie das Experiment aus
- Berechnen Sie den gravimetrischen Wassergehalt/Bodenwassergehalt des Bodens (SWC-Wert).
HINWEIS: Der Gravimetrische Bodenwassergehalt unterscheidet sich vom volumentrregenden Bodenwassergehalt (VWC).- Der SWC-Wert ist das Verhältnis zwischen dem Trockengewicht des Bodens und dem Nassgewicht des Bodens. Um SWC zu berechnen, verwenden Sie die drei zusätzlichen bodengefüllten Töpfe (Schritt 1.3) ohne Pflanzen, die zuvor vorbereitet und auf einem Beistelltisch im Gewächshaus für ein paar Tage platziert und regelmäßig bewässert wurden. Wiegen Sie den nassen Boden in einer Aluminiumschale am frühen Morgen, so schnell wie möglich nach dem letzten Bewässerungsereignis.
- Trocknen Sie die Aluminiumschale mit dem Boden im Ofen (bei 105 °C) für 4–5 Tage. Stellen Sie sicher, dass der Boden vollständig trocken ist, indem Sie zwei aufeinander folgende Gewichtsmessungen im Abstand von mindestens 60 min durchführen. Wenn die Gewichte identisch sind, ist der Boden in der Tat trocken und die letzte Messung kann als trockenes Bodengewicht aufgezeichnet werden.
- Gehen Sie in der Bediensoftware zu Komponenten messen und klicken Sie auf die Registerkarte Bodentrockengewicht berechnen. Füllen Sie den Boden nass und trocken Gewichte für jede Probe, klicken Sie auf Bewerben und Fertigstellen (ergänzende Abbildung 3).
- Alternativ können Sie SWC manuell mit der unten gezeigten Gleichung berechnen.

- Durchschnittlich die beiden SWC-Messungen manuell aus mindestens drei Töpfen. Wählen Sie die Registerkarte Komponenten messen aus, und klicken Sie auf Bodentrockengewicht berechnen, den Wert von [g/g], klicken Sie auf Übernehmen und Beenden. Die Bodentrockengewichte aller Experimentiertöpfe werden automatisch von der Software berechnet (vorausgesetzt, dass alle Töpfe im Experiment das gleiche Medium enthalten; Ergänzende Abbildung 1D und Zusatzabbildung 3).
- Wenden Sie die Bewässerungsbehandlungen an. Bewässerungsszenarien können angewendet werden, indem ein Schritt-für-Schritt-Behandlungsplan verstellt wird.
- Um einen neuen Bewässerungsbehandlungsplan zu erstellen, gehen Sie zu Bewässerungsbehandlung, klicken Sie auf Neu erstellen, und nennen Sie die neue Behandlung. Öffnen Sie die spezifische Behandlung in der Liste der Bewässerungsbehandlungen und klicken Sie auf die Standardeinstellung "00:00".
HINWEIS: Im Hauptfenster (Ergänzende Abbildung 4A) gibt "Zeit" die Zeit an, die das Ventil öffnet (d. h. der Beginn der Bewässerungsbehandlung). "Ventil" ist das zu öffnende Ventil (A oder B, abhängig vom Ventil, das mit der gewünschten Lösung verbunden ist). "Befehlstyp" gibt den Datentyp an, der verwendet wird, um zu bestimmen, wann das Ventil geschlossen wird:- Nach Zeit – Wie viele Sekunden das Ventil geöffnet sein wird.
- Nach Gewicht – Die Gewichtszunahme/Wasser (in Gramm), die dem Topf durch Bewässerung hinzugefügt werden soll.
- Durch Transpiration – Bewässerung kann differenziell auf jeden Topf angewendet werden, basierend auf der Transpiration jeder einzelnen Pflanze über den Vortag. Der Benutzer kann entscheiden, welcher Prozentsatz der vorherigen Tagestranspiration während der Bewässerung angewendet wird. (Unter dem gut bewässerten Zustand wird vorgeschlagen, der Pflanze mehr als 100% zu geben, um den Boden zu waschen und das Pflanzenwachstum auszugleichen.) Trockenheitsbehandelte Pflanzen sollten weniger Wasser erhalten, mit genauen Mengen, die auf der gewünschten Trockenspannungsrate basieren.
- Durch Sensoren – Bewässerung kann nach einem Sensor-Messwert angewendet werden, wie z. B. scheinbare dielektrische Permittivität (die zur Bestimmung des VWC verwendet werden kann). Wählen Sie den Sensortyp, den gewünschten Parameter und den gewünschten Parameterwert aus.
- Alle Möglichkeiten beinhalten eine Time Out-Option, die den Hahn schließt, auch wenn die eingestellten Bedingungen nicht erreicht wurden. Legen Sie die Zeit für einen Zeitraum fest, der länger als die festgelegten Bedingungen ist.
- Nachdem Sie die Bewässerungsbehandlungen für das Experiment definiert haben, öffnen Sie das gewünschte Experiment in der Liste der Experimente, öffnen Sie das Behandlungsszenario, öffnen Sie den Standardplan und wählen Sie den ersten Schritt aus (Ergänzende Abbildung 4B).
- Wählen Sie in der Behandlungeine Bewässerungsbehandlung aus der Liste aus. Wählen Sie dann unter Beendendie entsprechende Bedingung aus, um den aktuellen Schritt zu beenden, und fahren Sie mit dem nächsten Schritt fort.
- Nachdem Sie ein Bewässerungsszenario ausgewählt haben, öffnen Sie die Tabelle Pflanzen des Experiments (Ergänzende Abbildung 2) und geben Sie die "Behandlung" und "Schritt" für jede Pflanze ein. "Behandlung" ist der Name des Behandlungsszenarios und "Schritt" ist die Ereignisnummer innerhalb des Behandlungsszenarios.
- Um einen neuen Bewässerungsbehandlungsplan zu erstellen, gehen Sie zu Bewässerungsbehandlung, klicken Sie auf Neu erstellen, und nennen Sie die neue Behandlung. Öffnen Sie die spezifische Behandlung in der Liste der Bewässerungsbehandlungen und klicken Sie auf die Standardeinstellung "00:00".
- Planen Sie eine Dürrebehandlung.
- Jede einzelne Pflanze hat eine einzigartige Transpirationsrate basierend auf ihrer Größe und Lage im Gewächshaus. Um eine Standard-Trockenheitsbehandlung zu ermöglichen (d. h. eine ähnliche Trocknungsrate für alle Töpfe während der Behandlung), planen Sie ein Dürreszenario und kontrollieren Sie es über das Rückkopplungs-Bewässerungswerkzeug des Systems(ergänzende Abbildung 5).
8. Analysieren Der Daten mit Datenanalysesoftware
- Öffnen Sie die Datenanalyse-Software (z. B. SPAC Analytics). Klicken Sie in die obere rechte Ecke, um das Steuerungssystem und den Namen des Experiments auszuwählen (Ergänzende Abbildung 6A). Wählen Sie in der Spalte der linken Seite des Bildschirms Experimente (Ergänzende Abbildung 6B) aus, und geben Sie den Namen des Experiments in die Namensleiste unter dem Abschnitt Suchen ein. Der Name des Experiments wird unter dem Abschnitt "Suchen" im Abschnitt Experimente(ergänzende Abbildung 6C)angezeigt. Klicken Sie auf das Experiment, um die Abschnitte Info und Pflanzen zu öffnen (Ergänzende Abbildung 6D).
- Bearbeiten Sie im Info-Bereich die WUE-Start- und WUE-Enddaten für einen Zeitraum von mindestens 3 (vorzugsweise mehr) Tagen vor Beginn der Dürrebehandlung, und klicken Sie dann auf Aktualisieren. Der WUE- und der RR2-Wert für jeden Topf werden im Abschnitt Pflanzen angezeigt. Wählen Sie aus, ob Sie eine Skala mit einem negativen WUE-Wert oder einem RR2-Wert von weniger als 0,5 ausschließen möchten, indem Sie auf das "Auge"-Symbol unter der Spalte Aktiv klicken, das dann rot wird. Dadurch wird der ausgewählte Maßstab (Werk) von allen weiteren Berechnungen ausgeschlossen. Die Daten können exportiert werden, indem Sie auf die Schaltfläche Daten exportieren im Abschnitt Pflanzen (Ergänzende Abbildung 6D) klicken.
- Klicken Sie in der Spalte auf der linken Seite des Gerölls auf Analyse. Dann werden verschiedene Unterabschnitte angezeigt: Graph Viewer, Histogramm, T-Test, ANOVA und Piecewise lineare Kurve.
- Klicken Sie auf Graph viewer. Legen Sie im Abschnitt Filter die Datumsangaben für das Experiment fest.
- Klicken Sie auf Etiketten (siehe Schritt 6), um die Kombination von Experimentellen Gruppen (Genotyp) und Behandlung(en) auszuwählen. Automatisch werden alle Töpfe in der ausgewählten Gruppe im Unterabschnitt "Pflanze" angezeigt. Deaktivieren Sie in diesem Unterabschnitt alle Töpfe (Pflanzen), indem Sie darauf klicken. Bis zu zwei verschiedene Parameter der Wahl können gleichzeitig als "Y1-Parameter" und "Y2-Parameter" ausgewählt werden. Klicken Sie schließlich auf Diagramm anzeigen (Ergänzende Abbildung 5).
- Im Diagramm-Viewer-Fenster wird für jedes Werk ein Liniendiagramm der Werte des ausgewählten Parameters angezeigt. Entfernen Sie Daten aus einzelnen Pflanzen, oder fügen Sie dem Diagramm hinzu, indem Sie auf ihre Legendensymbole auf der rechten Seite des Diagramms klicken. In der oberen rechten Ecke gibt es auch Optionen zum Exportieren der Daten als Kalkulationstabelle und zum Vergrößern des Graph Viewer-Fensters, um den Vollbildmodus auszufüllen (diese Rohdaten-Download-Funktion ist für alle anderen Fenster relevant). Weitere Optionen zum Ändern des Diagramms werden angezeigt, wenn der Cursor in die obere rechte Ecke des Bildschirms verschoben wird(ergänzende Abbildung 5).
- Das Histogrammmodul stellt die Verteilung eines einzelnen Merkmals in und zwischen Populationen für einen bestimmten Zeitraum dar. Um dieses Modul zu verwenden, klicken Sie auf Histogramm.
- Legen Sie im Abschnitt Filter Datum und Uhrzeit, Parameter, Beschriftungen und Anlagen fest, wie in Schritt 8.4.1 erläutert. Wählen Sie mehrere Beschriftungen (Gruppen) aus, indem Sie auf das Symbol + klicken. Klicken Sie schließlich auf Diagramm anzeigen (Ergänzende Abbildung 7).
- Das Histogramm wird im Abschnitt Histogramm angezeigt, in dem oben auf dem Bildschirm die Option zum Ändern der "Bins" und "Datum" besteht. In der oberen rechten Ecke gibt es verschiedene Optionen, wie in Schritt 8.4.2 beschrieben. Im Abschnitt Lagediagramm ist die tatsächliche Lage der Pflanzen auf der Versuchstabelle und deren jeweilige Merkmalswerte zu sehen (Zusatzabbildung 7).
- Klicken Sie auf T-test. Um die Mittelwerte eines gemessenen Merkmals zweier Gruppen statistisch zu vergleichen, geben Sie die Daten, Beschriftungen, Pflanzen und Parameter im Abschnitt "T-Testparameter" ein, wie in Schritt 8.4.1 erläutert.
- Legen Sie den Stundenbereich fest, um die Durchschnittswerte der Datenpunkte innerhalb des Zinszeitraums zu berechnen (der Standardwert ist eine kontinuierliche 24-Stunden-Präsentation). Klicken Sie schließlich auf Diagramm anzeigen (Ergänzende Abbildung 8).
- Auf der rechten Seite des Bildschirms werden zwei Fenster angezeigt. Die oberste ist der Abschnitt Graph Viewer für alle Ausfeinerungspflanzen, die aus beiden Gruppen ausgewählt wurden. Unterhalb dieses Fensters befindet sich der T-Testabschnitt, in dem der Vergleich der beiden Gruppen als t-Testdes ausgewählten physiologischen Parameters angezeigt wird. Signifikanzstufen können durch Ändern des α-Werts in der oberen linken Ecke des T-Testabschnitts angepasst werden. Ein roter Punkt wird unter Werten angezeigt, die sich erheblich unterscheiden. Sehen Sie in der oberen rechten Ecke verschiedene Optionen, wie in Schritt 8.4.2 beschrieben (Ergänzende Abbildung 8).
- Klicken Sie auf ANOVA. Um die Mittelwerte eines gemessenen Merkmals über mehr als zwei Gruppen hinweg statistisch zu vergleichen, geben Sie die Daten, Beschriftungen, Pflanzen und Parameter im Abschnitt "Filter" ein, wie in Schritt 8.5.1 erläutert.
- Wählen Sie mehrere Beschriftungen (Gruppen) aus, indem Sie auf das +-Symbol klicken (wie in Schritt 8.5). Legen Sie den Stundenbereich fest. Klicken Sie schließlich auf "SHOW GRAPH" (Zusatzabbildung 9).
- Verwenden Sie im ANOVA-Abschnitt einen ANOVA-Test (Tukeys HSD), um die physiologischen Parameter der verschiedenen Gruppen zu vergleichen. Balken stellen die Standardfehler dar (±SE). In der oberen rechten Ecke des Bildschirms gibt es verschiedene Optionen, wie in Schritt 8.4.2 beschrieben. Klicken Sie auf das Liniendiagramm, um einen Balkendiagrammvergleich für einen bestimmten Tag anzuzeigen. Verschiedene Buchstaben geben Gruppen an, die sich erheblich voneinander unterscheiden (Ergänzende Abbildung 9A).
- Die Darstellung der Beziehung zwischen ganzer Transpirationskinetik oder stomatischer Leitfähigkeit und VWC ist eine genauere Möglichkeit, die physiologischen Reaktionen verschiedener Pflanzen mit Trockenheit zu vergleichen, verglichen mit einem zeitbasierten Ansatz. Präsentieren Sie diese Beziehung mit der Funktion "Piece-wise Linear Curve".
- Klicken Sie auf Piecewise lineare Kurve. Geben Sie die Datumsangaben, Beschriftungen, Pflanzen und Parameter (sowohl die x-Achse als auch die y-Achse) ein, und legen Sie dann den Stundenbereich im Abschnitt "Filter" fest, wie oben erläutert.
HINWEIS: Das "von"-Datum sollte so nah wie möglich am Behandlungsbeginndatum liegen. - Legen Sie den x-Achsenparameter als VWC und den y-Achsenparameter als physiologischen Parameter der Wahl fest (z. B. Transpirationsrate, stomataale Leitfähigkeit usw.). Klicken Sie schließlich auf Diagramm anzeigen. Klicken Sie im Abschnitt "Filter" auf Alle Empfehlungen auswählen und dann auf Diagramm anzeigen (Zusatzabbildung 10).
HINWEIS: Andere physiologische Parameter (z. B. normalisierte Transpiration, Transpirationsrate, Pflanzenanfangsgewicht, stomataale Leitfähigkeit, Wurzelfluss usw.) und Umgebungsparameter (z. B. Temperatur, relative Luftfeuchtigkeit usw.) werden leicht über die SPAC-Software (z. B. Zusatzabbildung 9C)ermittelt. Weitere Informationen zum theoretischen Hintergrund ihrer Berechnungen finden Sie unter Halperin et al. (2017).
- Klicken Sie auf Piecewise lineare Kurve. Geben Sie die Datumsangaben, Beschriftungen, Pflanzen und Parameter (sowohl die x-Achse als auch die y-Achse) ein, und legen Sie dann den Stundenbereich im Abschnitt "Filter" fest, wie oben erläutert.
Ergebnisse
Die Dauer des Experiments betrug 29 Tage. Das Experiment wurde im August durchgeführt, wenn das lokale Wetter warm und stabil ist und die Tage lang sind. Zwei verschiedene Bewässerungsszenarien wurden verwendet, um die Fähigkeit der Phänotypisierungsplattform zu demonstrieren, das physiologische Verhalten von drei verschiedenen Reissorten (z. B. Indica, Karla und Risotto) in Gegenwart von Dürrestress zu vergleichen. Es gab zwei Dürre-Stress-Behandlungen: (i) optimale Bewässerung [bis jeder Topf seine Topfkapazität in der Nacht nach der Bewässerung (Kontrolle)] erreichte und (ii) eine Dürre, die 5 Tage nach Beginn des Experiments begann, 14 Tage dauerte und eine 10-tägige Erholungsphase folgte (optimale Bewässerung, Tage 19–29). Der Einfachheit halber sind in den hier vorgestellten Zahlen nicht alle Sorten und Gruppen dargestellt. Die Ergebnisse zeigten, dass das HTP-telemetrische System Veränderungen der atmosphärischen Bedingungen, des Bodens und der Physiologie der Pflanzen effizient messen kann.
Umweltbedingungen
Die Umgebungsbedingungen [photosynthetisch aktive Strahlung (PAR) und Dampfdruckdefizit (VPD)] wurden während des gesamten Experiments von einer atmosphärischen Sonde überwacht. Die gesammelten Daten deuten darauf hin, dass PAR und VPD über die verschiedenen Tage und im Laufe des Tages ähnlich blieben (Abbildung 4).
Der VWC der mit Dürre behandelten Töpfe wurde während des gesamten Versuchszeitraums mit Bodensonden gemessen. Die VWC-Daten aus einem mit Dürre behandelten cv. Indica-Anlage ist in Abbildung 5dargestellt.
Physiologische Parameter
Die tägliche Transpiration nahm in allen vier Behandlungen (Karla-Kontrolle, Karla-Dürre, Risotto-Kontrolle und Risotto-Dürre) in der ersten Phase des Experiments, in der alle Pflanzen gut bewässert waren, allmählich zu. Später gab es eine Verringerung der Transpiration, die mit der Dürreperiode (Tag 5 bis Tag 18) in den beiden wasserarmen Behandlungen verbunden war. In der Folge nahm die tägliche Transpiration in den beiden wasserarmen Gruppen (ab dem 18. Tag) wieder zu, allerdings auf ein wesentlich niedrigeres Niveau als vor der Trockenheitsbehandlung(Zusatzabbildung 9B).
Das durchschnittliche berechnete Pflanzengewicht (d.h. die Rate der Pflanzengewichtszunahme) stieg sowohl bei derKarla-Kontrolleals auch bei den Karla-Dürre-Behandlungen in der ersten Phase des Experiments, als alle Pflanzen eine ähnliche Bewässerung erhielten, durchgängig an (Tage 1–5). Wenn die Trockenheitsbehandlung auf die cv angewendet wurde. Karla-Pflanzen (Tage 5-18), diese Pflanzen hörten auf, Gewicht zu gewinnen und wieder an Gewicht zu gewinnen, bis die Erholungsphase. Zu diesem Zeitpunkt gab es eine Gewichtszunahme, die langsamer voranging als das, was für die Kontrolle beobachtet wurde. Im Gegensatz dazu nahmen die Gewichte derKarla-Kontrollanlagenwährend des gesamten Versuchszeitraums kontinuierlich zu (Abbildung 6).
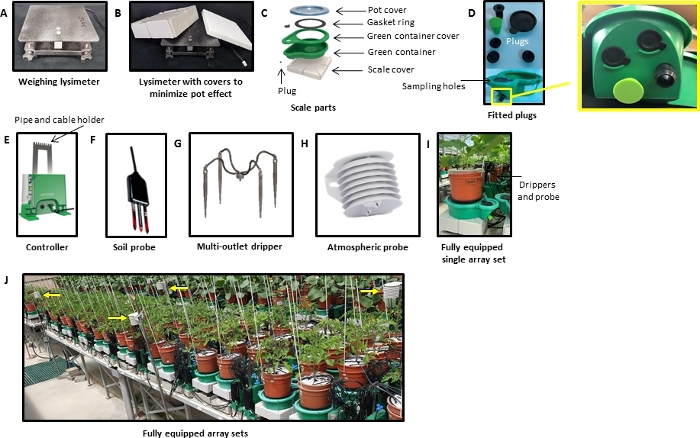
Abbildung 1: Komponenten und Einrichtung des gravimetrischen Phänotypisierungssystems.
(A) Wiegen lysimeter. Das Lysimeter umfasst die Wägezelle, die die mechanische Last eines Objekts in eine elektrische Ladung umwandelt, und eine Metallplattform, die den oberen und unteren Teil der Wägezelle abdeckt, so dass das Gewicht des Objekts richtig gemessen werden kann. (B) Das Lysimeter ist mit einem Polystyrolblock und einer Kunststoffabdeckung zur Wärmedämmung überzogen. (C) Skalieren Von Teilen. Ein Wasserreservoir (grüner Behälter) wird auf die Lysimeterabdeckung gelegt, um die Flüssigkeit zu sammeln, die aus dem Topf abfließt. Der grüne Behälter ist mit einer grünen Abdeckung gekoppelt, die eine große runde Öffnung hat, durch die der Topf eingefügt wird. An einer Seite der grünen Abdeckung ist ein schwarzer Gummidichtungsring befestigt und der Topf auf der anderen Seite befestigt, um den Wasserverlust durch Verdunstung aus dem Behälter zu minimieren. Die grüne Abdeckung hat zwei Probenahmelöcher (klein und groß) über der Drainageverlängerung, die mit Gummisteckern abgedichtet sind. (D) Stecker. Der Behälter hat eine Drainageverlängerung mit vier Löchern (mit Steckern) in verschiedenen Höhen, die verwendet werden können, um den Wasserstand im Behälter nach der Entwässerung durch ein bestimmtes Loch stoppt (das Reservewasservolumen) einzustellen. Das gewünschte Wasservolumen hängt von der Pflanzenart, der Art des verwendeten Vergussmediums und dem Wasserbedarf der Pflanzen ab (d. h. vom geschätzten Tagesdurchflässchen). (E) Die Steuereinheit besteht aus einem grünen rechteckigen Kasten, der die elektronische Steuerung und Magnetventile enthält. Es gibt Löcher, durch die die Fertigationslösung in die Töpfe eindringen und verlassen kann, sowie Steckdosen zum Anschluss der Wägezelle und verschiedener Sensoren. Verschiedene Behandlungen, wie z. B. unterschiedliche Salzgehalte oder unterschiedliche Mineralzusammensetzungen, können über die Fertigationslösung angewendet werden. Ein Metallständer ist mit dem Controller verbunden, um die Rohre und Kabel zu halten und zu verhindern, dass sie die Töpfe berühren und Gewichthinzufügen. Die weiteren erforderlichen Komponenten sind (F) Bodensonden (z.B. Feuchte-, Temperatur- und EC-Sensoren - 5TE), optional (G) Multi-Outlet-Tropfen (für Fertigations- und/oder Behandlungsanwendungen) und (H) atmosphärische Sonden [zur Messung des Dampfdruckdefizits (VPD) und der Strahlung]. (I) Voll ausgestattetes Einzelarray. (J) Voll ausgestattetes Array im Gewächshaus, gelbe Pfeile, die auf die atmosphärischen Sonden zeigen, die die stomatole Leitfähigkeitsnormalisierung basierend auf den lokalen atmosphärischen Bedingungen ermöglicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Teile, die für eine einzelne Topfeinrichtung erforderlich sind.
(A–C) Folgende Komponenten werden benötigt: ein 4 L Topf, ein 4 L Topf ohne Boden als Netzhalter, ein kreisförmiges Stück Nylongewebe (Porengröße = 60 Mesh) mit einem doppelten Durchmesser des Bodens des Topfes, eine Abdeckung mit ausgewiesenen Löchern für Pflanzen- und Bewässerungstropfen, ein 60 cm, ein weißer Fiberglasstab (Pol) und ein schwarzer Dichtungsring. (D) Beispiel für einen Tabellenplan, in dem die Töpfe randomisiert wurden. Im Gewächshaus hatte jeder Tisch 1-18 Spalten und vier Reihen, hier haben wir 24 Positionen verwendet. Die Arraystruktur kann jedoch leicht an jede Form angepasst werden, basierend auf der Größe des eigenen Gewächshauses. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Pot-Setup.
(A) Pflanzen, die in Hohlraumschalen wachsen. (Die hier gezeigten Tomatensämlinge sind nur ein Beispiel; viele andere Pflanzenarten könnten auf die gleiche Weise angebaut werden). (B) Gussteile von Formen für (C) Erstellen von Hohlräumen im Vergussmedium, die (D) eng in die Wurzelbodenstopfen der Sämlinge passen, um die erfolgreiche Verpflanzung der (E) sämigen den Sämlinge in die Töpfe zu gewährleisten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Atmosphärische Bedingungen im Laufe des Experiments.
Die y-Achse rechts zeigt das tägliche Dampfdruckdefizit (VPD) und die y-Achse links die photosynthetisch aktive Strahlung (PAR) an den 29 aufeinanderfolgenden Tagen des Experiments. Dieses Diagramm wurde von der Datenanalyse-Software erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Volumenwassergehalt (VWC), der im Laufe des Experiments von einer Bodensonde gemessen wird.
Die Daten stellen die VWC-Werte für einen cv dar. Indica-Pflanze, die während des gesamten Versuchszeitraums der Trockenheitsbehandlung unterzogen wurde, einschließlich der Erholung. Dieses Diagramm wurde von der Datenanalyse-Software erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Ganzpflanzengewichte (d. h. ± SE) über den gesamten Versuchszeitraum für cv. Karla unter gut bewässerten (Kontrolle) und Dürrebedingungen.
Gruppen wurden mit ANOVA (Tukeys HSD; p < 0,05). Jeder Mittelwert ± SE stellt mindestens vier Pflanzen dar. Das Diagramm und die statistische Analyse wurden von der Datenanalyse-Software erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Bedienen von Softwarefenstern zum Einrichten eines Experiments. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Abbildung 2: Tabelle "Pflanzen" als Tabellenkalkulation; Betriebssoftware. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Abbildung 3: Softwarefenster zur Berechnung des Bodentrockengewichts; Betriebssoftware. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Abbildung 4: Softwarefenster für die Einrichtung einer Bewässerungsbehandlung; Betriebssoftware. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzendes Abbildung5: Fenster Datenanalyse Diagramm Viewer. In unserem Experiment verwendeten wir drei Reissorten (d.h. Indica, Karla und Risotto) und zwei verschiedene Bewässerungsszenarien, gut bewässert (Kontrolle) und Trockenheit. Die Rohdaten zeigten im Laufe des Experiments Eine Veränderung des Gewichts der Pflanzen. Jede Linie stellt eine Pflanze/einen Topf dar. Im Laufe des Tages vergingen die Pflanzen, so dass das System an Gewicht verlor, wie man an den Hängen der Tageskurven sehen kann. Die Töpfe wurden jede Nacht bis zur vollen Kapazität bewässert, wie die Spitzen in den Kurven dargestellt. Auf das Bewässerungsereignis folgte die Entwässerung von überschüssigem Wasser, nachdem das Topfmedium gesättigt war. Anfangs waren alle Anlagen gut bewässert (Kontrolle). Ab dem 7. August 2018 wurde die Hälfte der Pflanzen einer Dürrebehandlung unterzogen. Gleichzeitig erhielten die übrigen Pflanzen weiterhin eine optimale Bewässerung. Die differenzierte Erholung wurde durch die Wiederherstellung der Bewässerung der mit Dürre behandelten Pflanzen erreicht, beginnend am 20. August 2018 (so dass jede Pflanze einen ähnlichen Stressgrad erfahren konnte) und bis zum Ende des Experiments fortgesetzt wurde. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Das Feedback-Bewässerungstool des Systems ermöglicht es dem Anwender, Bewässerungsprogramme für jeden einzelnen Topf basierend auf Zeit, Topfgewicht, Daten eines Bodensensors (z.B. VWC) oder Anlagentranspiration über den Vortag zu entwerfen. Jede Anlage kann individuell auf basis ihrer eigenen Leistung bewässert werden. Diese Differenzbewässerung minimiert die Unterschiede zwischen dem Bodenwassergehalt der Pflanzen, so dass alle Pflanzen unabhängig von ihrem individuellen Wasserbedarf einer kontrollierten Trockenheitsbehandlung ausgesetzt sind.
Ergänzende Abbildung 6: Fenster Datenanalyse für die Datenanalyse. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzendes Abbildung7: Histogrammfenster der Datenanalyse. Diese Abbildung zeigt eine grafische Darstellung der Verteilung der Tagestranspirationswerte in den drei verschiedenen Reissorten (d.h. Indica, Karla und Risotto) unter gut bewässerten (Kontroll-)Bedingungen. Das untere Diagramm stellt eine Wärmekartenvisualisierung der pflanzen täglichen Transpiration basierend auf der physikalischen Position der Töpfe auf dem Tisch dar. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzendes Abbildung 8: Datenanalyse T-Testfenster. Linien stellen die Unterschiede in der täglichen Transpiration (ein grundlegendes und wichtiges physiologisches Merkmal) zwischen zwei Reissorten (d.h. Karla und Risotto) unter gut bewässerten (Kontroll-)Bedingungen dar. Das Fenster zeigt die tägliche Transpiration der einzelnen Pflanzen (oben rechts) und einen Vergleich der Mittel ± SE jeder Gruppe, die mit dem Student es t-test (unten rechts) durchgeführt wird. Die statistische Auswertung wurde automatisch von der Software durchgeführt. Die roten Punkte stellen signifikante Unterschiede zwischen den Behandlungen nach den t-Testsdes Studenten dar; p < 0,05. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzendes Abbildung 9: Datenanalyse ANOVA-Fenster. (A) Grafische Darstellung der Unterschiede in der täglichen Transpiration zwischen zwei Reissorten (d. h. Karla und Risotto) unter gut bewässerten (Kontroll-)und Dürrebedingungen während des gesamten Versuchszeitraums. Die Trockenbehandlung wurde 5 Tage nach Beginn des Experiments begonnen. Wenn Sie auf einen beliebigen Tag klicken, wird der (B) Gruppenvergleich mit ANOVA (Tukeys HSD; p < 0.05), hier auf AUG am 12. Jeder Mittelwert ± SE stellt mindestens vier Pflanzen dar. Dieselben Gruppen könnten auch als (C) kontinuierliche Vollpflanzentranspirationsrate (Means ± SE) über den gesamten Versuchszeitraum dargestellt werden. Die Graphiken und die statistische Analyse wurden von der Datenanalyse-Software erstellt. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Abbildung 10: Datenanalyse stückweise lineares Kurvenfenster. Dieses Fenster zeigt die stückweise linearen Kurven von drei Reissorten (z.B. Indica, Karla und Risotto) unter Dürrebedingungen. Die Software kann eine stückweise lineare Anpassungsanalyse der Beziehung zwischen jedem physiologischen Parameter (hier, tägliche Transpiration) und dem berechneten Volumenwassergehalt (VWC) der Pflanzen, die der Trockenheitsbehandlung unterzogen werden, durchführen. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Materialien. Bitte klicken Sie hier, um diese Materialien herunterzuladen.
| Mittel | Beschreibung | |
| Grober Sand | Kieselsäuresand 20-30 (obere und untere Maschengitter, durch die der Sand geleitet wurde: 0,841 bzw. 0,595 mm) | |
| Feiner Sand | Kieselsäuresand 75-90 (obere und untere Maschengitter, durch die der Sand geleitet wurde: 0,291 bzw. 0,163 mm) | |
| Torfboden | Klasmann 686 | |
| Lehmboden (natürlicher Boden) | Sandiger Lehmboden aus der obersten Schicht eines Grundstücks auf dem Versuchsbauernhof der Fakultät für Landwirtschaft, Ernährung und Umwelt, Rehovot, Israel | |
| Vermiculit | Vermiculit 3G | |
| Perlit | Perlite 212 (Größenbereich: 0,5-2,5 mm) | |
| Kompost | Bental 11 Potting Erde | |
| Porös, keramisch, klein | Profil Poröse Keramik 20-50 (obere und untere Maschensiebe, durch die die gemahlene Keramik geleitet wurde: 0,841 bzw. 0,297 mm) | |
| Porös, keramisch, mittelgroß | Profil Poröse Keramik 50% 20-50 Mesh und 50% 20-6 Mesh, 0.841– 3.36 mm | |
Tabelle 1: Topfmedien.
| Bodenmedientyp / Parameter | Grober Sand | Feiner Sand | Lehmboden | Perlit | Vermiculit | Poröse Keramik gemischt groß | Poröse Keramik klein | Torfboden | Kompost |
| Gesamtwasser (TW, ml) | 860 ± 7,2 (F) | 883,1 ± 24 (F) | 1076,3 ± 35,9 (E) | 1119,9 ± 8,5 (E) | 1286 ± 22,4 (D) | 1503,6 ± 15,4 (C) | 1713 ± 25,9 (B) | 1744,3 ± 8,2 (B) | 2089,6 ± 61,6 (A) |
| Volumenwassergehalt (VWC, ml3/ml3) | 0,26 (F) | 0,27 (F) | 0,33 (E) | 0,35 (E) | 0,4 (D) | 0,46 (C) | 0,53 (B) | 0,54 (B) | 0,65 (A) |
| Massendichte (BD, g/cm3) | 1.7 (A) | 1.6 (B) | 1.5(C) | 0,1 (H) | 0,2 (F) | 0,8 (D) | 0,7 (E) | 0,2 (G) | 0,1 (G) |
| Bodengewichtsstabilität (SWS, g/d) | ±2,3 ± 0,3 (B) | ± ± 4,3 ± 0,3 (B) | 2,9 ± ± 0,9 (B) | ± 14,9 ± ± 0,7 (A) | 7,6 ± ± 2,8 (B) | ± 1,3 ± 1,3 ± 0,1 (B) | 1,9 ± ± 0,4 (B) | ± 6,7 ± 6,7 ± 0,8 (B) | ±4,3 ± 1,2 (B) |
| Bodengewichtsstabilität bei reserviertem Wasser im Bad (g/Tag; siehe Abschnitt 6.14) | 3 ± 0,4 (B) | 3.3 ± 0,4 (B) | 3.2 ± 1.2 (B) | 6,3 ± 0,5 (A) | 2,7 ± 0,8 (B) | 1.6 ± 0,3 (B) | 1,9 ± 0,3 (B) | 10,6 ± 3 (A) | 1.5 ± 0.3 (B) |
| Topfkapazität gravimetrischer Feuchtigkeitsgehalt (SWC; siehe Abschnitt 8.2) | 0,18 (G) | 0,23 (G) | 0,23 (G) | 3,79 (C) | 3,0 (D) | 0,74 (F) | 0,99 (E) | 4.25 (B) | 6.13 (A) |
| Relative Drainagefähigkeit | Ausgezeichnet | Mittel | Mittel-niedrig | Ausgezeichnet | Ausgezeichnet | Ausgezeichnet | Ausgezeichnet | Niedrig | Mittel |
| Relative Zeit, um Topfkapazität zu erreichen | schnell | schnell | schnell | Langsam | Langsam | schnell | schnell | Langsam | Langsam |
| Relative Kationenaustauschkapazität (KEG) | Niedrig | Niedrig | Niedrig | Niedrig | Hoch | Hoch | Hoch | Hoch | Hoch |
| Kompatibilität mit: | |||||||||
| Wurzelwäsche (am Ende des Experiments) | ++ | ++ | + | ++ | + | ++ | ++ | - | - |
| Nährstoff-/biostimulierende Behandlung | ++ | ++ | - | ++ | + | + | + | - | - |
| Salinitätsbehandlungen | ++ | ++ | + | ++ | + | ++ | ++ | + | - |
| Genaue Messung der Wachstumsraten | ++ | ++ | + | -,+ | + | ++ | +++ | + | + |
| Körperliche Bodenstrukturerholung nach Trockenheit | +++ | +++ | ++ | + | - | +++ | +++ | -,+ | - |
| * Gesamtwasser (TW, ml) = Bodenfeuchtgewicht (bei Topfkapazität) – Bodentrockengewicht. Volumenwassergehalt (VWC) = TW/Bodenvolumen. | |||||||||
| Schüttdichte (BD) = Bodentrockengewicht/Bodenvolumen. Bodengewichtsstabilität (SWS) = Durchschnittliche Veränderung des Nassgewichts des Bodens an 4 aufeinanderfolgenden Tagen (mittelbei Topfkapazität ohne Pflanze nach der letzten Bewässerung). | |||||||||
| Topfkapazität gravimetrischer Feuchtigkeitsgehalt (SWC); für die Berechnung siehe Abschnitt 7.2. | |||||||||
Tabelle 2: Allgemeine Merkmale von 9 verschiedenen Vergussmedien und deren Kompatibilität mit der gravimetrischen Plattform. Die Messungen wurden mit 4-L-Töpfen durchgeführt, die mit 3,2 l Medium bei Feldkapazität (Topfkapazität) gefüllt waren. Die Daten werden als Mittel ± SE dargestellt. Verschiedene Buchstaben in den Spalten weisen auf signifikante Unterschiede zwischen den Medien hin, gemäß Tukeys HSD-Test (P < 0,05; 3 ≤ n ≤ 5).
| Fertigationskomponenten | Endkonzentration (ppm) | Endkonzentration (mM) |
| NaNO3 | 195.8 | 2.3 |
| H3PO4 | 209 | 0.000969 |
| KNO3 | 271.4 | 2.685 |
| MgSO4 | 75 | 0.623 |
| ZnSO4 | 0.748 | 0.0025 |
| CuSO4 | 0.496 | 0.00198 |
| MoO3 | 0.131 | 0.00081 |
| MnSO4 | 3.441 | 0.0154 |
| Borax | 0.3 | 0.00078 |
| C10H12N2NaFeO8 (Fe) | 8.66 | 0.0204 |
| Der pH-Wert der Endbewässerungslösung aus dem Tropf (nach Verdünnung mit Leitungswasser) schwankte zwischen 6,5 und 7. | ||
Tabelle 3: Fertigationskomponenten.
Diskussion
Die Wissenslücke zwischen Genotyp und Phänotyp spiegelt die Komplexität der Wechselwirkungen zwischen Genotyp x Umgebung wider (überprüft durch18,24). Es könnte möglich sein, diese Lücke durch den Einsatz von hochauflösenden, HTP-telemetrischen diagnosen und phänotypischen Screening-Plattformen zu überbrücken, die verwendet werden können, um die physiologische Leistung von ganzen Pflanzen und die Wasser-Beziehungskintik8,9zu untersuchen. Die Komplexität von Genotyp-x-Umgebungsinteraktionen macht Phänotypisierung zu einer Herausforderung, insbesondere angesichts der Schnellen, wie Pflanzen auf ihre sich verändernden Umgebungen reagieren. Obwohl derzeit verschiedene Phänotypisierungssysteme verfügbar sind, basieren die meisten dieser Systeme auf Fernerkundung und fortschrittlichen Bildgebungstechniken. Obwohl diese Systeme simultane Messungen durchführen, beschränken sich ihre Messungen bis zu einem gewissen Grad auf morphologische und indirekte physiologische Merkmale25. Physiologische Eigenschaften sind sehr wichtig im Zusammenhang mit der Reaktionsfähigkeit oder Empfindlichkeit gegenüber Umweltbedingungen26. Daher können direkte Messungen, die kontinuierlich und gleichzeitig in einer sehr hohen Auflösung (z.B. 3 min Intervalle) durchgeführt werden, eine sehr genaue Beschreibung des physiologischen Verhaltens einer Pflanze liefern. Trotz dieser wesentlichen Vorteile des gravimetrischen Systems muss auch die Tatsache berücksichtigt werden, dass dieses System einige potenzielle Nachteile hat. Die Hauptnachteile ergeben sich aus der Notwendigkeit, mit Töpfen und unter Gewächshausbedingungen zu arbeiten, was große Herausforderungen für die Behandlungsregulierung (insbesondere die Regulierung von Dürrebehandlungen) und die experimentelle Wiederholbarkeit mit sich bringen kann.
Um diese Probleme anzugehen, sollte man die angewendeten Spannungen standardisieren, eine wirklich randomisierte Versuchsstruktur schaffen, Topfeffekte minimieren und mehrere dynamische Verhaltensweisen von Pflanzen unter sich verändernden Umgebungsbedingungen innerhalb kurzer Zeit vergleichen. Der in diesem Dokument beschriebene HTP-telemetrische funktionelle Phänotypisierungsansatz befasst sich mit diesen Problemen, wie unten erwähnt.
Um die dynamische Reaktion der Pflanze mit ihrer dynamischen Umgebung zu korrelieren und ein vollständiges, umfassendes Bild komplexer Wechselwirkungen zwischen Pflanzen und Umwelt zu erfassen, müssen sowohl die Umgebungsbedingungen (Abbildung 4) als auch die Reaktionswerte der Anlage (ergänzende Abbildung 9B) kontinuierlich gemessen werden. Diese Methode ermöglicht die Messung physikalischer Veränderungen im Topfmedium und in der Atmosphäre kontinuierlich und gleichzeitig neben Pflanzenmerkmalen (Boden-Pflanzen-Atmosphäre-Kontinuum, SPAC).
Um das Verhalten der Pflanzen im Feld optimal vorherzusagen, ist es wichtig, den Phänotypisierungsprozess unter Bedingungen durchzuführen, die denen im Feld18so ähnlich wie möglich sind. Wir führen die Experimente in einem Gewächshaus unter halbkontrollierten Bedingungen durch, um Feldbedingungen so weit wie möglich nachzuahmen. Eine der wichtigsten Bedingungen ist das Anbau- oder Topfmedium. Die Auswahl des am besten geeigneten Vergussmediums für das Gravimetrische Systemexperiment ist von entscheidender Bedeutung. Es ist ratsam, ein Bodenmedium zu wählen, das schnell abfließt, die schnelle Erreichung der Topfkapazität ermöglicht und eine sehr stabile Topfkapazität hat, da diese Merkmale genauere Messungen durch das gravimetrische System ermöglichen. Darüber hinaus müssen auch die verschiedenen Behandlungen berücksichtigt werden, die im Experiment anzuwenden sind. Beispielsweise erfordern Behandlungen mit Salzen, Düngemitteln oder Chemikalien die Verwendung eines inerten Vergussmediums, vorzugsweise eines mit geringer Kationenaustauschkapazität. Dürrebehandlungen, die auf pflanzenarme Pflanzenarten angewendet werden, würden am besten mit Blumenmedien mit relativ niedrigen VWC-Werten funktionieren. Im Gegensatz dazu würden langsame Dürrebehandlungen, die auf hochtranspirierende Anlagen angewendet werden, am besten mit Blumenmedien mit relativ hohen VWC-Werten funktionieren. Wenn die Wurzeln für die Analyse nach dem Experiment (z. B. Wurzelmorphologie, Trockengewicht usw.) benötigt werden, wird die Verwendung eines Mediums mit relativ geringem Gehalt an organischen Stoffen (d. h. Sand, poröse Keramik oder Perlit) das Waschen der Wurzeln erleichtern, ohne sie zu beschädigen. Für Experimente, die für längere Zeit andauern, ist es ratsam, Medien zu vermeiden, die reich an organischer Substanz sind, da diese organische Substanz mit der Zeit zersetzen kann. Ausführlichere Informationen zu diesem Thema finden Sie in Tabelle 1 und Tabelle 2.
Feldphäotypisierung und Gewächshaus-Phänotypisierung (Vorfeld) haben ihre eigenen Ziele und erfordern unterschiedliche Versuchsaufgebungen. Pre-Field-Phänotypisierung unterstützt die Auswahl vielversprechender Kandidatengenotypen, die eine hohe Wahrscheinlichkeit haben, sich auf dem Feld gut zu behaupten, um Feldversuche fokussierter und kostengünstiger zu machen. Die Pre-Feld-Phänotypisierung beinhaltet jedoch eine Reihe von Einschränkungen (z. B. Topfeffekte), die dazu führen können, dass Pflanzen anders abschneiden als unter Feldbedingungen18,27. Kleine Topfgröße, Wasserverlust durch Verdunstung und Erwärmung der Lysimeter-Skalen sind Beispiele für Faktoren in Gewächshausexperimenten, die zu Topfeffekten führen können18. Die hier beschriebene Methode wurde entwickelt, um diese potenziellen Auswirkungen auf folgende Weise zu minimieren:
a) Die Topfgröße wird auf der Grundlage des zu untersuchenden Genotyps gewählt. Das System ist in der Lage, verschiedene Topfgrößen (bis zu 25 l) und Bewässerungsbehandlungen zu unterstützen, die die Untersuchung jeder Art von Kulturpflanzen ermöglichen.
b) Die Töpfe und die Lysimeterwaagen sind isoliert, um zu verhindern, dass Wärme übertragen wird und die Töpfe erwärmt werden.
c) Dieses System umfasst ein sorgfältig konzipiertes Bewässerungs- und Entwässerungssystem.
d) Für jeden Topf gibt es einen separaten Controller, um eine echte Randomisierung mit selbstbewässernden und selbstüberwachten Behandlungen zu ermöglichen.
e) Die Software berücksichtigt bei der Berechnung der stomatalen Leitfähigkeit der Pflanzen die lokale VPD der Anlagen. Bitte beachten Sie die Lokalisierung mehrerer VPD-Stationen in Abbildung 1J.
Dieses System beinhaltet direkte physiologische Messungen an feldartigen Pflanzendichten, wodurch entweder große Räume zwischen den Pflanzen oder das Verschieben der Pflanzen zur bildbasierten Phänotypisierung entfallen. Dieses System umfasst die Echtzeit-Datenanalyse sowie die Fähigkeit, den physiologischen Stresspunkt jeder Pflanze genau zu erkennen. Dies ermöglicht es dem Forscher, die Pflanzen zu überwachen und Entscheidungen darüber zu treffen, wie das Experiment durchgeführt werden soll und wie eventuelle Proben im Laufe des Experiments gesammelt werden sollen. Die einfache und einfache Gewichtskalibrierung des Systems ermöglicht eine effiziente Kalibrierung. Hochdurchsatzsysteme generieren riesige Datenmengen, die zusätzliche Datenverarbeitungs- und analytische Herausforderungen darstellen11,12. Die Echtzeitanalyse der Big Data, die direkt vom Controller an die Software zugeführt wird, ist ein wichtiger Schritt bei der Übersetzung von Daten in Wissen14, der einen großen Wert für die praktische Entscheidungsfindung hat.
Diese HTP-telemetrische physiologische Phänotypisierungsmethode könnte hilfreich sein, um Gewächshausexperimente unter nah feldnahen Bedingungen durchzuführen. Das System ist in der Lage, wasserbezogene physiologische Reaktionen von Pflanzen auf ihre dynamische Umgebung zu messen und direkt zu berechnen, während es die meisten Probleme im Zusammenhang mit dem Topfeffekt effizient überwindet. Die Fähigkeiten dieses Systems sind in der Pre-Field-Phänotypisierungsphase extrem wichtig, da sie die Möglichkeit bieten, Ertragsstrafen in frühen Stadien des Pflanzenwachstums vorherzusagen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch das gemeinsame IsF-NSFC-Forschungsprogramm (Grant Nr. 2436/18) unterstützt und teilweise vom israelischen Ministerium für Landwirtschaft und ländliche Entwicklung (Eugene Kandel Knowledge Centers) als Teil des Root of the Matter – The Root Zone Knowledge Center for Leveraging Modern Agriculture unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Atmospheric Probes | SpectrumTech/Meter group | 3686WD | Watchdog 2475 |
| 40027 | VP4 | ||
| Array Randomizer | None | The software "Array Randomizer" can be used for creating an experimental design of a randomized block design, or fully random design. It was developed to have better control over the random distribution of the experimental samples (plants) in order to normalize the atmospheric microvariation inside the greenhouse. | |
| Free download and more information, please click on the following link: https://drive.google.com/open?id=1y4QbTpxRK5Lx430xzu1RFdrlcL8pz_1q | |||
| Cavity trays | Danish size with curved rim for nursery | 30162 | 4X4X7 Cell, 84 cell per tray https://desch.nl/en/products/seed_propagation_trays/danish-size-with-curved-rim-for-nursery~p92 |
| Coarse sand | Negev Industrial Minerals Ltd., Israel | ||
| Compost | Tuff Marom Golan, Israel | ||
| Data Analysis software | Plant-Ditech Ltd., Israel | SPAC Analytics | |
| Drippers | Netafim | 21500-001520 | PCJ 8L/h |
| Fine sand | Negev Industrial Minerals Ltd., Israel | ||
| Loamy soil (natural soil) | |||
| Nylon mesh | Not relevant (generic products) | ||
| Operating software | Plant-Ditech Ltd., Israel | Plantarray Feedback Control (PFC) | |
| Peat-based soil | Klasmann-Deilmann GmbH, Germany | ||
| Perlite | Agrekal , Israel | ||
| Plantarray 3.0 system | Plant-Ditech Ltd., Israel | SCA400s | Weighing lysimeters |
| PLA300S | Planter unit container | ||
| CON100 | Control unit | ||
| part of the planter set | Fiberglass stick | ||
| part of the planter set | Gasket ring | ||
| Operating software | |||
| SPAC Analytics software | |||
| Porous, ceramic, mixed-sized medium | Greens Grade, PROFILE Products LLC., USA | ||
| Porous, ceramic, small-sized medium | Greens Grade, PROFILE Products LLC., USA | ||
| Pots | Not relevant (generic products) | ||
| Soil | Bental 11 by Tuff Marom Golan | ||
| Soil Probes | Meter group | 40567 | 5TE |
| 40636 | 5TM | ||
| 40478 | GS3 | ||
| Vermiculite | Agrekal , Israel |
Referenzen
- Ray, D. K., Mueller, N. D., West, P. C., Foley, J. A. Yield Trends Are Insufficient to Double Global Crop Production by 2050. PLoS One. 8, 66428(2013).
- Food and Agriculture Organization of the United Nations. The future of food and agriculture: Trends and challenges. , Rome. (2017).
- Dhankher, O. P., Foyer, C. H. Climate resilient crops for improving global food security and safety. Plant, Cell & Environment. 41, 877-884 (2018).
- Chen, D., et al. Dissecting the phenotypic components of crop plant growthand drought responses based on high-throughput image analysis w open. Plant Cell. 26, 4636-4655 (2014).
- Ubbens, J. R., Stavness, I. Deep Plant Phenomics: A Deep Learning Platform for Complex Plant Phenotyping Tasks. Frontiers in Plant Science. , (2017).
- Danzi, D., et al. Can High Throughput Phenotyping Help Food Security in the Mediterranean Area. Frontiers in Plant Science. , (2019).
- Miflin, B. Crop improvement in the 21st century. Journal of Experimental Botany. 51, 1-8 (2000).
- Dalal, A., et al. Dynamic Physiological Phenotyping of Drought-Stressed Pepper Plants Treated With "Productivity-Enhancing" and "Survivability-Enhancing" Biostimulants. Frontiers in Plant Science. , (2019).
- Moshelion, M., Altman, A. Current challenges and future perspectives of plant and agricultural biotechnology. Trends in Biotechnology. 33, 337-342 (2015).
- Singh, A., Ganapathysubramanian, B., Singh, A. K., Sarkar, S. Machine Learning for High-Throughput Stress Phenotyping in Plants. Trends in Plant Science. 21, 110-124 (2016).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: The next challenge. Nature Reviews Genetics. 11, 855-866 (2010).
- Fiorani, F., Schurr, U. Future Scenarios for Plant Phenotyping. Annual Review of Plant Biology. 64, 267-291 (2013).
- Tardieu, F., Cabrera-Bosquet, L., Pridmore, T., Bennett, M. Plant Phenomics, From Sensors to Knowledge. Current Biology. 27, 770-783 (2017).
- Negin, B., Moshelion, M. The advantages of functional phenotyping in pre-field screening for drought-tolerant crops. Functional Plant Biology. , (2017).
- Gebremedhin, A., Badenhorst, P. E., Wang, J., Spangenberg, G. C., Smith, K. F. Prospects for measurement of dry matter yield in forage breeding programs using sensor technologies. Agronomy. 9, 65(2019).
- Roitsch, T., et al. New sensors and data-driven approaches-A path to next generation phenomics. Plant Science. 282, 2-10 (2019).
- Li, L., Zhang, Q., Huang, D. A review of imaging techniques for plant phenotyping. Sensors (Switzerland). 14, 20078-20111 (2014).
- Gosa, S. C., Lupo, Y., Moshelion, M. Quantitative and comparative analysis of whole-plant performance for functional physiological traits phenotyping: New tools to support pre-breeding and plant stress physiology studies. Plant Science. 282, 49-59 (2019).
- Araus, J. L., Cairns, J. E. Field high-throughput phenotyping: the new crop breeding frontier. Trends in Plant Science. 19, 52-61 (2014).
- Ito, V. C., Lacerda, L. G. Black rice (Oryza sativa L.): A review of its historical aspects, chemical composition, nutritional and functional properties, and applications and processing technologies. Food Chemistry. 301, 125304(2019).
- Anjum, S. A., et al. physiological and biochemical responses of plants to drought stress. African Journal of Agricultural Research. , (2011).
- Halperin, O., Gebremedhin, A., Wallach, R., Moshelion, M. High-throughput physiological phenotyping and screening system for the characterization of plant-environment interactions. The Plant Journal. 89, 839-850 (2017).
- Yaaran, A., Negin, B., Moshelion, M. Role of guard-cell ABA in determining steady-state stomatal aperture and prompt vapor-pressure-deficit response. Plant Science. 281, 31-40 (2019).
- Dalal, A., Attia, Z., Moshelion, M. To produce or to survive: how plastic is your crop stress physiology. Frontiers in Plant Science. 8, 2067(2017).
- Araus, J. L., Kefauver, S. C., Zaman-Allah, M., Olsen, M. S., Cairns, J. E. Translating High-Throughput Phenotyping into Genetic Gain. Trends in Plant Science. 23, 451-466 (2018).
- Ghanem, M. E., Marrou, H., Sinclair, T. R. Physiological phenotyping of plants for crop improvement. Trends in Plant Science. 20, 139-144 (2015).
- Sinclair, T. R., et al. Pot binding as a variable confounding plant phenotype: theoretical derivation and experimental observations. Planta. 245, 729-735 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten