Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Transuterine Fetal Tracheal Okklusion Modell bei Mäusen
In diesem Artikel
Zusammenfassung
Verschiedene Tiermodelle der angeborenen zwerchmatischen Hernie und fetalen Trachealverschluss stellen Vor- und Nachteile in Bezug auf ethische Fragen, Kosten, chirurgische Schwierigkeiten, Größe, Überlebensraten und Verfügbarkeit genetischer Werkzeuge dar. Dieses Modell bietet ein neues Werkzeug, um die Auswirkungen von Trachealokklusion und erhöhtem Luminaldruck auf die Lungenentwicklung zu untersuchen.
Zusammenfassung
Fetale Trachealverschluss (TO), eine etablierte Behandlungsmodalität, fördert das fetale Lungenwachstum und das Überleben bei schwerer angeborener Zwerchfellhernie (CDH). Nach TO erhöht die Retention der abgesonderten Epithelflüssigkeit den Luminaldruck und induziert Lungenwachstum. Verschiedene Tiermodelle wurden definiert, um die Pathophysiologie von CDH und TO zu verstehen. Alle haben ihre eigenen Vor- und Nachteile wie die Schwierigkeit der Technik, die Größe des Tieres, die Kosten, die hohen Sterblichkeitsraten und die Verfügbarkeit genetischer Werkzeuge. Hierin wird ein neuartiges transuterines Modell des murinen fetalen TO beschrieben. Schwangere Mäuse wurden anästhesisiert und die Gebärmutter über eine Mittellinien-Laparotomie exponiert. Die Luftröhre ausgewählter Föten wurde mit einer einzigen transuteren Naht hinter der Luftröhre, einer Karotisarterie und einer jugularen Vene ligiert. Der Damm wurde geschlossen und konnte sich erholen. Fetusen wurden kurz vor der Teilnahme gesammelt. Lungen-Körper-Gewicht-Verhältnis bei To Föten war höher als bei der Kontrolle Föten. Dieses Modell bietet Forschern ein neues Werkzeug, um die Auswirkungen von TO und erhöhtem Luminaldruck auf die Lungenentwicklung zu untersuchen.
Einleitung
Angeborene Zwerchfellhernie (CDH) tritt in 1:2500 Schwangerschaften auf und führt zu pulmonaler Hypoplasie und neonataler pulmonaler Hypertonie1,2,3,4,5,6. Fetale Trachealverschluss (TO) ist eine etablierte pränatale Therapie bei schweren CDH-Patienten mit Fetoskopie in der 26-30. Schwangerschaftswoche, in der ein Ballon knapp über der Karina platziert und dann in der32. Schwangerschaftswoche entfernt wird. Diese vorübergehende TO induziert fetales Lungenwachstum und verbessert das Überleben. Das angeborene High Airway Obstruction Syndrom ist eine tödliche Erkrankung im Zusammenhang mit Lungenhyperplasie, die Chirurgen dazu inspirierte, künstliche Okklusion der Luftröhre durchzuführen, um die Retention der abgesonderten Epithelflüssigkeit zu fördern. Diese Okklusion erhöhte den Luminaldruck und induzierte Lungenwachstum7. Die Okklusion sollte jedoch umgekehrt werden, um die Epithelzellreifung zu ermöglichen.
Verschiedene Tiermodelle von CDH und TO - Schafe, Kaninchen, Ratten und Mäuse - wurden entwickelt, um die Pathophysiologie von CDH und TO zu verstehen. Alle haben ihre eigenen Vor- und Nachteile wie die Schwierigkeit der Technik, die Größe des Tieres, die Kosten, die hohen Sterblichkeitsraten und die Verfügbarkeit genetischer Werkzeuge. Obwohl die chirurgische Technik, die für das Schafmodell verwendet wird, der beim Menschen verwendeten sehr ähnlich ist und umgekehrt werden könnte, sind die Hauptnachteile dieses Modells die Kosten des Tieres, die lange Schwangerschaftszeit und die begrenzte Anzahl von Operationen möglich. Das Kaninchenmodell hat eine kürzere Trächtigkeitszeit und ist kostengünstiger als das Schafmodell. Das Kaninchenmodell ist jedoch irreversibel8,9. Das murine Modell hat die niedrigsten Kosten, die höchste Anzahl von Föten pro Schwangerschaft, das am besten charakterisierte Genom und weit verbreitete Werkzeuge für zelluläre und molekulare Analysen. Ein wesentlicher Nachteil ist jedoch die fehlende Reversibilität des TO, wodurch ein vollständiges Verständnis der Auswirkungen von TO verhindert wird. Hierin wird eine Methode vorgestellt, die alle Vorteile der oben genannten Modelle vereint und ein einfaches, potenziell reversibles und minimalinvasives Nagetier-TO-Modell schafft.
Protokoll
Alle Experimente entsprechen dem National Institutes of Health Guide for the Care and Use of Laboratory Animals (NIH Publications No. 80023, revidiert 1978). Das Verfahren wurde mit dem IACUC-Protokoll #2016-0068 vom Ausschuss für institutionelle Tierpflege und -nutzung der Cincinnati Children es Research Foundation genehmigt.
1. Vorbereitung
- Um altersgerechte Wildtyp (WT) C57BL/6 Mäuse zu paaren, legen Sie sie um 18:00 uhr .m. in denselben Käfig und trennen Sie sie am nächsten Tag um 9:00 .m.
- Um den embryonalen Tag 0 (E0) zu bestimmen, schauen Sie sich den Vaginalstecker an, der eine homogene äußere Zone an der Scheidenwand und eine innere Zone hat, die faserig ist und einige Spermatozoen enthält, die verschränkte Massen bilden, die mit den Fasern des Steckermaterials vermischt sind.
- Zeichnen Sie das Gewicht der Mäuse zum Zeitpunkt der Paarung auf.
- Wiegen Sie die Mäuse auf E10 erneut, um eine laufende Schwangerschaft zu gewährleisten.
- Führen Sie die Operation an E16.5 (frühe simkuläre Stufe) durch.
- Sterilisieren Sie die Instrumente, die während der Operation verwendet werden: Schere, Nadelhalter, Zange, Klammern und chirurgische Messer und Griffe.
- Die Operationsplattform auf 24 °C vorheizen und vor der Operation warme Saline (24 °C) vorbereiten.
- Schaffen Sie eine warme Umgebung für die Erholung, und lassen Sie nasse Nahrung im Käfig für die frühe Fütterung.
- Bleiben Sie bei den operierten Tieren, bis sie sich selbst ernähren können.
- Halten Sie die operierten Mäuse nach der Operation allein in ihren einzelnen Käfigen.
2. Anästhesie
- Subkutane 0,1 mg/kg Buprenorphin auf die trächtigen Muttermütter 1 h vor dem Eingriff auftragen.
- Verwenden Sie inhalierte 5 ml/h Isofluran zur Induktion und 2 ml/h kontinuierlich während des Anästhesieverfahrens.
- Überwachen Sie die Bewegungen der Kinn der trächtigen Mäuse.
3. Laparotomie
- Reinigen Sie die Bauchoberfläche mit Alkohol und Povidon-Jod. Halten Sie die sterilen Bedingungen während des gesamten Betriebs aufrecht.
- Führen Sie einen vertikalen Schnitt für die Laparotomie von schwangeren Muttertieren durch. Schneiden Sie alle Ebenen separat.
- Identifizieren Sie Uterushörner auf jeder Seite.
- Bestimmen Sie die Kandidaten Föten für die Operation.
HINWEIS: Betreiben Sie nicht an den Föten, die der Vagina am nächsten sind. - Betreiben Sie auf zwei Föten in jedem Gebärmutterhorn, wenn es eine gerade Anzahl von Föten auf jeder Seite (4 die meiste Zeit), und auf 1 Fötus in jedem Gebärmutterhorn, wenn es eine ungerade Anzahl der Gebärmutter (3 die meiste Zeit).
4. Trachealverschluss
- Verwenden Sie 2,5-fache Vergrößerungsgläser für die Visualisierung.
- Positionieren Sie das Gebärmutterhorn quer.
- Nehmen Sie die Welpen, nach oben gerichtet, zwischen zwei Fingern mit den Augen der Welpen und dem Schwanz als Leitfaden, um den Fötus zu positionieren.
- Tragen Sie sanften Druck auf den Kopf des Welpen, um eine Verlängerung des Kopfes und damit die Visualisierung des Halses zu ermöglichen.
- Verwenden Sie eine 6,0-Polypropylen-Nähte mit einer atraumatischen Nadel, um TO durchzuführen (Abbildung 1). Halten Sie die Plazenta auf der Seite und weit von den Ein- und Ausstiegspunkten der Nadel.
- Legen Sie die Nadel quer durch die Seite der Gebärmutter weg von der Plazenta durch den 1/3rd vorderen Teil des Halses.
- Bewegen Sie die Nadel sanft bis zur Mittellinie des Halses und lenken Sie sie zum vorderen Teil, dann verlassen Sie den Hals zwischen der Luftröhre und gegenüber der Karotisscheide und Gebärmutter.
- Knoten Sie die Naht, achten Sie darauf, die Integrität der Membranen und Der Gebärmutterwand zu erhalten, und halten Sie die Nabelschnur während des Knotens sicher.
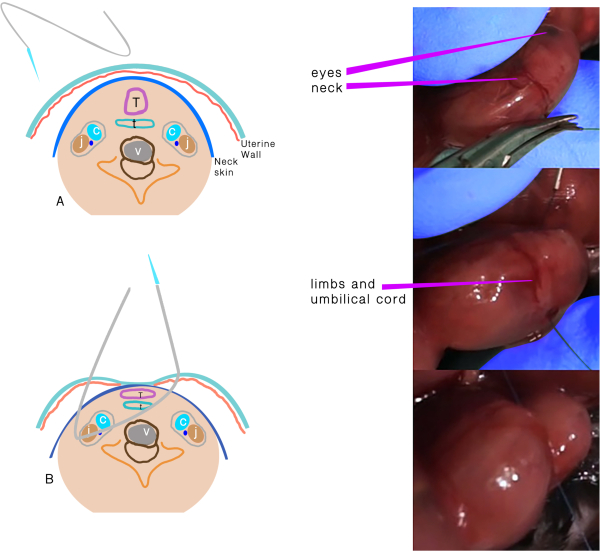
Abbildung 1: Trachealverschluss. (A) Die transuterine Naht, die durch den Hals geht. (B) Schematische Darstellung der Strukturen nach der Naht durchundgeht und vor dem Knoten. Abkürzungen: C = Halsschlagader; J = Jugularvene; T =Trachea; E = Speiseröhre; V = Wirbel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Bauchwandverschluss
- Ersetzen Sie das Gebärmutterhorn im Bauch.
- Vor verschluss 2 ml warmsterile Saline in die Peritonealhöhle geben.
- Legen Sie eine laufende 5/0 Polyglactin Naht, um die Bauchwand zu schließen, und schließen Sie die Haut mit einer nicht laufenden Seidennaht.
- 0,1 mg/kg Buprenorphin intraperitoneal für Analgesie auftragen und die Rückgewinnung des Damms in einem warmen Inkubator ermöglichen.
6. Ernte
- Anästhesie auf die schwangere Mutter auftragen und alle Föten bei E18.5 per Kaiserschnitt ernten.
- Überprüfen Sie die Lebensfähigkeit der Föten, indem Sie die Bewegungen der Föten beobachten.
- Verwenden Sie mindestens zwei verschiedene Techniken für die Euthanasie: Kohlendioxid-Insufflation und zervikale Dislokation.
- Entfernen Sie die Stellen gemäß der Verordnung des Veterinärlabors.
- Wiegen Sie alle Föten.
- Führen Sie einen vertikalen Schnitt am Thorax für Thorakotomie, um die Lunge zu entfernen.
- Sezieren Sie die Lunge von Embryonen und wiegen Sie sie, um das Gesamtgewicht von Lunge zu Körper zu berechnen (LBWR = (linkes Lungengewicht + rechtes Lungengewicht)/Körpergewicht x100).
7. Histologie
- Fangen Sie das Gewebe in flüssigem Stickstoff, optimaler Schnitttemperaturverbindung und Trockeneis ein.
- Schneiden Sie die Proben in 10 m Abschnitte mit einem Kryostat und montieren Sie sie auf polylysinbeschichteten Dias.
- Backen Sie die Dias bei 60 °C über Nacht und färben Sie die gebackenen Dias mit Hämatoxylin und Eosin, bevor Sie sie zur Bildaufnahme bei 10-20-facher Vergrößerung mit einem Weitfeldmikroskop montieren.
8. Gewebeverarbeitung für Protein- und DNA-Analysen
- Die sezierten fetalen Lungen einfrieren und in 300 L Radioimmunopräzipitations-Assay-Puffer homogenisieren. Zentrifuge bei 4 °C für 5 min bei 18.000 × g.
- Extrahieren und quantifizieren Sie Protein, DNA und RNA10,12.
Ergebnisse
Diese Studie untersuchte 37 Föten: 20 (54,1%) wie TO vs. 17 (45,9%) als Kontrolle. Da die Luftröhre nicht in 4 Föten der TO-Gruppe verfeinert werden konnte, wurden sie von der Studie ausgeschlossen. In beiden Gruppen gab es keinen signifikanten Unterschied in der Sterblichkeit: 4 Föten (25%) in der TO-Gruppe und 2 Föten (12%) in der Kontrollgruppe (p=0,334, Odds Ratio (OR) 2,5, 95% Konfidenzintervall (CI) 0,39-16,05). Das mittlere Körpergewicht, das Lungengewicht und das Verhältnis...
Diskussion
Diese Methode beschreibt einen chirurgischen Eingriff der fetalen Trachealverschlussbeiklusion bei Mäusen und seine Auswirkungen auf die Lungenentwicklung. Es gibt einige wichtige Schritte im Protokoll, die sorgfältig ausgeführt werden sollten, um erfolgreicheTO durchzuführen. Die Wärme der Plattform, auf der die Operation stattfindet und die in die Peritonealhöhle eingeführte Saline ist entscheidend für das Fortschreiten der Schwangerschaft. Darüber hinaus muss ein leichter Druck auf den Kopf der Welpen ausgeü...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Forschung erhielt keine spezifischen Zuschüsse von Förderstellen in den Bereichen öffentliche, kommerzielle oder gemeinnützige Zwecke. Alle Autoren haben wesentliche Beiträge zur Konzeption und Gestaltung der Studie, des Erwerbs, der Analyse und der Interpretation von Daten geleistet, den Artikel verfasst und für wichtige intellektuelle Inhalte und die endgültige Genehmigung der einzureichenden Fassung überarbeitet. Die Autoren danken Can Sabuncuo-lu für seine freundlichen Bemühungen bei der Herstellung des Kunstwerks der chirurgischen Technik.
Materialien
| Name | Company | Catalog Number | Comments |
| Buprenorphine | Par Pharmaceutical | NDC 42023-179-05 | For regional anesthesia |
| Isoflurane | Halocarbon Life Sciences | NDC 66794-017-25 | For general anesthesia |
| Magnification glasses | USA Medical-Surgical | SLR-250LBLK | At least 2.5x |
| Nikon 90i microscope | Nikon | 3417 | Motorized Fluorescence |
| Nucleospin Tissue Kit | Macherey-Nagel, Düren, Germany | 740952.5 | DNA isolation |
| Pierce BCA Protein Assay Kit | Thermo Fisher, IL, USA | 23225 | Protein quantification |
| Polyglactin suture | Ethicon | VCP451H | 4-0, 24 mm, cutting |
| Polylysine slides | VWR | 48382-117 | Microscope adhesion slides |
| Polypropylene suture | Ethicon | Y432H | 6-0, 13 mm 1/2c Taperpoint |
| RIPA buffer | Sigma-Aldrich, Missouri, USA | R0278-50ml | Protein isolation |
| Silk suture | Ethicon | VCP682G | 4-0, 24 mm, cutting |
| Trizol | Invitrogen | 15596026 | RNA isolation |
Referenzen
- Wright, N. J. Global PaedSurg Research Collaboration. Management and outcomes of gastrointestinal congenital anomalies in low, middle and high income countries: protocol for a multicentre, international, prospective cohort study. BMJ Open. 9, 030452 (2019).
- Aydin, E. Current approach for prenatally diagnosed congenital anomalies that requires surgery. Turkish Clinics Journal of Gynecology and Obstetrics. 27, 193-199 (2016).
- Nolan, H., et al. Hemorrhage after on-ECMO repair of CDH is equivalent for muscle flap and prosthetic patch. Journal of Pediatric Surgery. 54 (10), 2044-2047 (2019).
- Aydin, E., et al. Congenital diaphragmatic hernia: the good, the bad, and the tough. Pediatric Surgery International. 35 (3), 303-313 (2019).
- Aydın, E., Özler, O., Burns, P., Lim, F. Y., Peiró, J. L. Left congenital diaphragmatic hernia-associated musculoskeletal deformities. Pediatric Surgery International. 35 (11), 1265-1270 (2019).
- Aydın, E., et al. When primary repair is not enough: a comparison of synthetic patch and muscle flap closure in congenital diaphragmatic hernia. Pediatric Surgery International. 36 (4), 485-491 (2020).
- Wilson, M., Difiore, J. W., Peters, C. A. Experimental fetal tracheal ligation prevents the pulmonary hypoplasia associated with fetal nephrectomy: Possible application for congenital diaphragmatic hernia. Journal of Pediatric Surgery. 28 (11), 1433-1440 (1993).
- Mudri, M., et al. The effects of tracheal occlusion on Wnt signaling in a rabbit model of congenital diaphragmatic hernia. Journal of Pediatric Surgery. 54 (5), 937-944 (2019).
- Khan, P. A., Cloutier, M., Piedboeuf, B. Tracheal occlusion: a review of obstructing fetal lungs to make them grow and mature. American Journal of Medical Genetics. Part C, Seminars in Medical Genetics. 145 (2), 125-138 (2007).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. Biotechniques. 15 (3), 532-537 (1993).
- Beurskens, N., Klaassens, M., Rottier, R., De Klein, A., Tibboel, D. Linking animal models to human congenital diaphragmatic hernia. Birth Defects Research Part A: Clinical and Molecular Teratology. 79 (8), 565-572 (2007).
- Varisco, B. M., et al. Excessive reversal of epidermal growth factor receptor and ephrin signaling following tracheal occlusion in rabbit model of congenital diaphragmatic hernia. Molecular Medicine. 22, 398-411 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten