Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Трансутерная фетальная трахеальная модель окклюзии у мышей
В этой статье
Резюме
Различные животные модели врожденной диафрагмальной грыжи и окклюзии плода трахеи представляют преимущества и недостатки в отношении этических вопросов, стоимости, хирургических трудностей, размера, выживаемости и наличия генетических инструментов. Эта модель представляет 2000 новых инструментов для изучения влияния как трахеи окклюзии, так и повышенного светимого давления на развитие легких.
Аннотация
Фетальная трахеальная окклюзия (ТО), установленный метод лечения, способствует росту легких плода и выживанию при тяжелой врожденной диафрагмальной грыже (CDH). После TO, задержка выделяется эпителиальной жидкости увеличивает светимое давление и вызывает рост легких. Различные модели животных были определены, чтобы понять патофизиологию CDH и TO. Все они имеют свои преимущества и недостатки, такие как сложность техники, размер животного, стоимость, высокие показатели смертности, а также наличие генетических инструментов. В этом и описывается новая трансутерная модель муринального плода TO. Беременные мыши были обезболены, а матка подвергалась воздействию лапаротомии средней линии. Трахея отдельных плодов была перевязана одним трансматозным швом, помещенным за трахеей, одной сонной артерией и одной яремной веной. Плотина была закрыта и разрешена к восстановлению. Плоды были собраны незадолго до партурии. Соотношение веса легких к телу у плодов TO было выше, чем у контрольных плодов. Эта модель предоставляет исследователям новый инструмент для изучения влияния как TO, так и повышенного светимого давления на развитие легких.
Введение
Врожденная диафрагмальная грыжа (CDH) возникает при 1:2500 беременностях и приводит к легочной гипоплазии и неонатальнойлегочной гипертензии 1,2,3,4,5,6. Фетальная трахеальная окклюзия (TO) является установленной пренатальной терапии у тяжелых пациентов CDH с участием фетоскопии в26-30-й гестационной недели, в которой воздушный шар помещается чуть выше карины, а затем удалены в 32-йгестационной недели. Это временное ТО индуцирует рост легких плода и улучшает выживание. Врожденный синдром обструкции дыхательных путей является смертельным состоянием, связанным с гиперплазией легких, которая вдохновила хирургов на искусственное окклюзию трахеи для содействия удержанию выделяется эпителиальной жидкости. Это окклюзия повышенное светимое давление и индуцированный ростлегких 7. Тем не менее, окклюзия должна быть обращена вспять, чтобы эпителиальные клетки созревания.
Для понимания патофизиологии CDH и TO были разработаны различные модели животных CDH и TO - яйцеклетки, кролика, крысы и мыши. Все они имеют свои преимущества и недостатки, такие как сложность техники, размер животного, стоимость, высокие показатели смертности, а также наличие генетических инструментов. Хотя хирургическая техника, используемая для модели яйцеклетки очень похожа на то, что используется в организме человека и может быть обращена вспять, основными недостатками этой модели являются расходы на животное, длительный гестационный период, и ограниченное количество операций возможно. Модель кролика имеет более короткий гестационный период и дешевле, чем модель овец. Тем не менее, модель кролика необратима8,9. Модель мурина имеет самую низкую стоимость, наибольшее количество плодов на беременность, наиболее характерный геном и широко доступные инструменты для клеточного и молекулярного анализа. Однако ключевым недостатком является отсутствие обратимости ТО, препятствуя полному пониманию воздействия ТО. В этом случае представлен метод, который сочетает в себе все преимущества ранее упомянутых моделей и создает легкую, потенциально обратимую и минимально инвазивную модель грызунов TO.
протокол
Все эксперименты были проведены в соответствии с Национальными институтами здравоохранения руководство по уходу и использованию лабораторных животных (NIH Публикации No 80023, пересмотренный 1978). Процедура была одобрена протоколом МАКУК #2016-0068 Комитетом по институциональному уходу и использованию животных Фонда детей Цинциннати.
1. Подготовка
- Чтобы спаривать возрастных диких мышей (WT) C57BL/6, поместите их в ту же клетку в 18:00 .m. и раздельйте их в 9:00 .m на следующий день.
- Чтобы определить эмбриональный день 0 (E0), посмотрите на вагинальный штепсельной вилки, которая имеет однородную внешнюю зону, прикрепленную к стенке влагалища и внутренней зоне, которая волокниста и включает в себя некоторые сперматозоиды, которые образуют запутанные массы, смешанные с волокнами вилки материала.
- Заметь вес мышей во время спаривания.
- Повторное взвешивание мышей на E10 для обеспечения текущей беременности.
- Выполните операцию на E16.5 (ранняя стадия канала).
- Стерилизовать инструменты, которые будут использоваться во время операции: ножницы, держатель иглы, типсы, зажимы, а также хирургические ножи и ручки.
- Предварительно разогреть хирургический платформу до 24 градусов по Цельсию и подготовить теплый солевой раствор (24 градусов по Цельсию) до операции.
- Создайте теплую среду для восстановления и оставьте влажную пищу внутри клетки для раннего кормления.
- Оставайтесь с эксплуатируемыми животными, пока они не смеют себя.
- Держите оперировать мышей в одиночку в своих отдельных клетках после операции.
2. Анестезия
- Нанесите подкожный 0,1 мг/кг бупренорфина на беременные плотины за 1 ч до процедуры.
- Используйте вдыхаемые 5 мл/ч изофлурана для индукции и 2 мл/ч непрерывно во время процедуры анестезии.
- Мониторинг движений подбородков беременных мышей.
3. Лапаротомия
- Очистите брюшную поверхность алкоголем и повидедоном-йодом. Поддерживайте стерильные условия на протяжении всей операции.
- Выполните вертикальный разрез для лапаротомии беременных плотин. Вырезать все слои отдельно.
- Определите рога матки с каждой стороны.
- Определите кандидата плода для операции.
ПРИМЕЧАНИЕ: Не оперировать плодов, которые находятся ближе всего к вагине. - Оперировать на двух плодах в каждом роге матки, если есть четное количество плодов с каждой стороны (4 большую часть времени), и на 1 плод в каждом роге матки, если есть нечетное количество матки (3 большую часть времени).
4. Трахеальная окклюзия
- Используйте 2,5x увеличенные очки для визуализации.
- Распоить рог матки поперечным способом.
- Возьмите щенков, лицом вверх, между двумя пальцами, используя глаза щенков и хвост в качестве руководства для положения плода.
- Нанесите нежное давление на голову щенка, чтобы обеспечить расширение головы и, следовательно, визуализацию шеи.
- Используйте 6,0 полипропиленовый шов с атрауматической иглой для выполнения TO (Рисунок 1). Держите плаценту на стороне и вдали от входных и выходных точек иглы.
- Вставьте иглу поперечно через сторону матки от плаценты через 1/3rd передней части шеи.
- Переместите иглу осторожно до средней линии шеи и навейте ее на переднюю часть, затем вывяйте шею между трахеей и напротив сонной оболочки и матки.
- Узел шва, заботясь, чтобы сохранить целостность мембран и стенок матки, и сохранить пуповину безопасной во время завязывания.
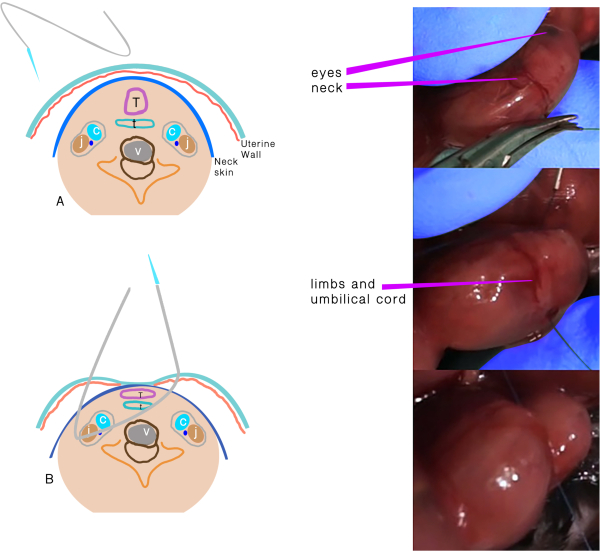
Рисунок 1: Трахеальная окклюзия. (A)Трансутерный шов, проходящий через шею. (B)Схематическое представление структур после шва проходит через и перед узлом. Аббревиатуры: C и сонная артерия; J и яремная вена; Т Трахея; E и пищевод; V и позвонок. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
5. Закрытие брюшной стенки
- Замените рог матки в брюшной полости.
- Введите 2 мл теплого стерильного солевого раствора в брюшную полость перед закрытием.
- Положите работает 5/0 полиглактина шва, чтобы закрыть брюшную стенку, и закрыть кожу с не работает шелковый шов.
- Нанесите 0,1 мг/кг бупренорфина intraperitoneally для анальгезии, и позволяют восстановления плотины в теплом инкубаторе.
6. Урожай
- Нанесите анестезию на беременную плотину и соготмите все плоды на E18.5 кесаревым сечением.
- Проверьте жизнеспособность плода, наблюдая за движениями плода.
- Используйте по крайней мере два различных метода для эвтаназии: инция двуокиси углерода и дислокация шейки матки.
- Удалить органов в соответствии с регулированием ветеринарной лаборатории.
- Взвесь все плоды.
- Выполните вертикальный разрез на грудной клетке для торакотомии, чтобы удалить легкие.
- Вскрыть легкие эмбрионов, и взвесить их, чтобы вычислить общее соотношение веса легких к телу (LBWR - (левый вес легких и правого веса легких)/вес тела x100).
7. Гистология
- Snap-заморозить ткани в жидком азоте, оптимальное соединение температуры резки, и сухой лед.
- Разрежьте образцы на 10 мкм секциях с помощью криостата и смонтировать их на полилин-покрытых слайдах.
- Выпекать слайды при температуре 60 градусов по Цельсию на ночь, и пятно запеченные слайды с гематоксилином и эозином, прежде чем монтаж их для получения изображения на 10-20x увеличение с помощью широкоугольного микроскопа.
8. Обработка тканей для анализа белков и ДНК
- Snap-заморозить вскрыли легких плода, и гомогенизировать их в 300 йл радиоиммунопрофильизации анализа буфера. Центрифуга при 4 градусов по Цельсию в течение 5 мин при 18000 × г.
- Экстракт и количественная оценка белка, ДНК иРНК 10,12.
Результаты
В этом исследовании было изучено 37 плодов: 20 (54,1%) как TO против 17 (45.9%) как контроль. Поскольку трахея не может быть закрыта у 4 плодов в группе ТО, они были исключены из исследования. Существенной разницы в смертности в обеих группах не было: 4 плода (25%) в группе TO и 2 плода (12%)...
Обсуждение
Этот метод описывает хирургическую процедуру окклюзии плода трахеи у мышей и ее влияние на развитие легких. Есть некоторые важные шаги в протоколе, которые должны быть тщательно выполнены для успешного TO. Тепло платформы, на которой проводится операция, и солевой раствор, введенный в б?...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Это исследование не получило каких-либо конкретных субсидий от финансовых учреждений в государственном, коммерческом или некоммерческом секторах. Все авторы внесли существенный вклад в разработку и разработку исследования, приобретение, анализ и интерпретацию данных, составление статьи и ее пересмотр на основе важного интеллектуального содержания и окончательного утверждения представленного варианта. Авторы благодарят Кан Сабункуоглу за его добрые усилия по производству произведений хирургической техники.
Материалы
| Name | Company | Catalog Number | Comments |
| Buprenorphine | Par Pharmaceutical | NDC 42023-179-05 | For regional anesthesia |
| Isoflurane | Halocarbon Life Sciences | NDC 66794-017-25 | For general anesthesia |
| Magnification glasses | USA Medical-Surgical | SLR-250LBLK | At least 2.5x |
| Nikon 90i microscope | Nikon | 3417 | Motorized Fluorescence |
| Nucleospin Tissue Kit | Macherey-Nagel, Düren, Germany | 740952.5 | DNA isolation |
| Pierce BCA Protein Assay Kit | Thermo Fisher, IL, USA | 23225 | Protein quantification |
| Polyglactin suture | Ethicon | VCP451H | 4-0, 24 mm, cutting |
| Polylysine slides | VWR | 48382-117 | Microscope adhesion slides |
| Polypropylene suture | Ethicon | Y432H | 6-0, 13 mm 1/2c Taperpoint |
| RIPA buffer | Sigma-Aldrich, Missouri, USA | R0278-50ml | Protein isolation |
| Silk suture | Ethicon | VCP682G | 4-0, 24 mm, cutting |
| Trizol | Invitrogen | 15596026 | RNA isolation |
Ссылки
- Wright, N. J. Global PaedSurg Research Collaboration. Management and outcomes of gastrointestinal congenital anomalies in low, middle and high income countries: protocol for a multicentre, international, prospective cohort study. BMJ Open. 9, 030452 (2019).
- Aydin, E. Current approach for prenatally diagnosed congenital anomalies that requires surgery. Turkish Clinics Journal of Gynecology and Obstetrics. 27, 193-199 (2016).
- Nolan, H., et al. Hemorrhage after on-ECMO repair of CDH is equivalent for muscle flap and prosthetic patch. Journal of Pediatric Surgery. 54 (10), 2044-2047 (2019).
- Aydin, E., et al. Congenital diaphragmatic hernia: the good, the bad, and the tough. Pediatric Surgery International. 35 (3), 303-313 (2019).
- Aydın, E., Özler, O., Burns, P., Lim, F. Y., Peiró, J. L. Left congenital diaphragmatic hernia-associated musculoskeletal deformities. Pediatric Surgery International. 35 (11), 1265-1270 (2019).
- Aydın, E., et al. When primary repair is not enough: a comparison of synthetic patch and muscle flap closure in congenital diaphragmatic hernia. Pediatric Surgery International. 36 (4), 485-491 (2020).
- Wilson, M., Difiore, J. W., Peters, C. A. Experimental fetal tracheal ligation prevents the pulmonary hypoplasia associated with fetal nephrectomy: Possible application for congenital diaphragmatic hernia. Journal of Pediatric Surgery. 28 (11), 1433-1440 (1993).
- Mudri, M., et al. The effects of tracheal occlusion on Wnt signaling in a rabbit model of congenital diaphragmatic hernia. Journal of Pediatric Surgery. 54 (5), 937-944 (2019).
- Khan, P. A., Cloutier, M., Piedboeuf, B. Tracheal occlusion: a review of obstructing fetal lungs to make them grow and mature. American Journal of Medical Genetics. Part C, Seminars in Medical Genetics. 145 (2), 125-138 (2007).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. Biotechniques. 15 (3), 532-537 (1993).
- Beurskens, N., Klaassens, M., Rottier, R., De Klein, A., Tibboel, D. Linking animal models to human congenital diaphragmatic hernia. Birth Defects Research Part A: Clinical and Molecular Teratology. 79 (8), 565-572 (2007).
- Varisco, B. M., et al. Excessive reversal of epidermal growth factor receptor and ephrin signaling following tracheal occlusion in rabbit model of congenital diaphragmatic hernia. Molecular Medicine. 22, 398-411 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены