Method Article
Funktionalisierung von Silber/Titandioxid-Kompositen in Chitosan-basierten Beschichtungen und ihre Leistungen bei der Konservierung von Eiern
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Um die Stabilität und Sterilisierbarkeit von Chitosan-basiertenBeschichtungen zu verbessern und die Anwendung spezifischer Nanopartikel in der Lebensmittelkonservierung zu erweitern, werden Ag/TiO2-Komposite synthetisiert, um Chitosan-Beschichtungen für die Eikonservierung zu funktionalisieren. Die Eierschalenmorphologie, der Gewichtsverlust, die Haugh-Einheit und der pH-Wert des Eiweißes werden verwendet, um die Konservierungsleistung der Beschichtungen zu charakterisieren.
Zusammenfassung
Eier sind eine ausgezeichnete Quelle für Proteine, Mineralien und Vitamine, die auf der ganzen Welt in der täglichen Ernährung konsumiert werden. Die Mikroporen und Mikrorisse auf den Eierschalen führen jedoch zum Verlust von Feuchtigkeit und zum Entweichen von CO2, was zu einer Beschleunigung des Verderbens der Eier und zu wirtschaftlichen Verlusten führt. Um die Stabilität und Sterilisierbarkeit der bestehenden Beschichtungsmaterialien auf Chitosan-Basis zu verbessern und neuartige multifunktionale Nanokomposite für die antibakterielle und Eikonservierung zu entwickeln, werden Silber/Titandioxid (Ag/TiO2)-Komposite synthetisiert und zur Modifizierung von Chitosan zur Verlängerung der Haltbarkeit von Eiern eingesetzt. Elektronenmikroskopische (REM) Bilder werden verwendet, um die Struktur und Morphologie von Kompositpartikeln und die Morphologie von beschichteten Eierschalen zu analysieren. Die Konservierungsleistung von Kompositbeschichtungen wird anhand verschiedener Parameter bewertet: Gewichtsverlust, Haugh-Einheit, Albumin-pH-Wert und Eierschalenmorphologien der Proben. Die Verwendung von Ag/TiO2-Kompositen trägt zu einem synergistischen Effekt zu Chitosan bei, der die Konservierungsdauer weiter verlängern könnte. Die Leistungsfähigkeit der Chitosan-Beschichtung ist jedoch derzeit durch die vorhandenen Partikelspezies und -konzentrationen begrenzt, was in zukünftigen Studien optimiert werden muss. Die Methoden in dieser Studie untersuchen neuartige Beschichtungsmaterialien, die durch Zugabe spezifischer Nanopartikel in den Beschichtungsvorläufer hergestellt werden könnten, um die kombinative Wirkung des Nanopartikels und des Vorläufers zu erzielen, sowie um neuartige multifunktionale Beschichtungen im Bereich der Lebensmittelkonservierung herzustellen.
Einleitung
Als hervorragende und beliebte Quelle für Proteine, anorganisches Salz und Vitamine sind Eier beliebte Lieferanten für die menschliche Ernährung, die weltweit in großem Umfang produziert und konsumiert werden 1,2. Obwohl Eierschalen eine natürliche Schutzbarriere darstellen, sind sie zu zerbrechlich, um ihre Integrität während des Eitransports und der Lagerung zu bewahren. Der Gasaustausch und die mikrobielle Penetration zwischen dem Eiweiß und der Umwelt, die leicht durch winzige Poren auf den Eierschalen erfolgen kann, würden zu CO2 -Verlusten sowie zur Verschlechterung der Eiqualität führen 3,4. Darüber hinaus würden winzige Risse auf den Eierschalen das Risiko einer mikrobiellen Kontamination erhöhen. Daher müssen dringend wirksame Methoden zur Konservierung von Eiern zum wirtschaftlichen Nutzen und zur menschlichen Gesundheit entwickelt werden.
Gegenwärtig gibt es zwei Arten von Methoden zur Konservierung von Eizellen. Der erste Weg besteht darin, die Mikroorganismen auf den Eierschalenzu deaktivieren 5,6,7,8. Der Deaktivierungsprozess verlängert die Konservierungszeit der Eizellen, indem die Oberfläche der Eierschale von der Erosion durch Mikroorganismen und Feuchtigkeit befreit wird. Andererseits könnte die Beschichtung der winzigen Poren und Risse auf der Eierschale mit speziellen Funktionsmaterialien auch als hervorragende Methode dienen, um den Verlust von Wasserdampf und CO2 aus dem Eialbumin zu verhindern und die Eierschale vor der Zerstörung durch Mikroorganismen zu schützen. Da sie einfach, effektiv und energiesparend sind, rücken Beschichtungen für die Eikonservierung immer mehr in den Fokus. Die wichtigsten Prinzipien, die geeignete Beschichtungsmaterialien erfüllen sollten, sind chemische Stabilität, effektive Permeabilität, breite Verfügbarkeit und zuverlässige Sicherheit. Die am häufigsten untersuchten Beschichtungsmaterialien sind Öl 9,10, Proteine11, Biopolymere3 und Chitosan12.
Chitosan gilt aufgrund seiner hervorragenden Eigenschaften in Bezug auf Filmbildung, antibakterielle Wirkung und Sicherheit als beliebtes Beschichtungsmaterial13. Es wurde nachgewiesen, dass die physikalisch-chemischen Veränderungen und die mikrobielle Kontamination der Eier durch eine Chitosan-Beschichtung geschützt sind, die sich als effiziente Methode zur Konservierung von Eizellen erwiesen hat. Als hydrophiles Polymer mit schlechter Wasserdampfsperre und Feuchtigkeitsadsorption ist Chitosan jedoch in einer Umgebung mit hoher Luftfeuchtigkeit instabil, was die Konservierungseffekte einschränkt und die Haltbarkeit von Eiern bis zu einem gewissen Grad verkürzt.
Um dieses Problem zu überwinden und die Konservierungsleistung von Chitosan zu fördern, wurden bestimmte Nanopartikel als Verfälschungsmittel in Beschichtungen auf Chitosanbasis verwendet. Darin wurde Nanosilber (Ag) als Nanofüllstoff mit antibakteriellem Charakter14 mit Chitosan dotiert. Die Zugabe von Ag könnte nicht nur die Barriereeigenschaft der Chitosanfolie verbessern, sondern auch ihre antibakterielle Wirkung verstärken, die nachweislich die Konservierungswirkung der Beschichtung verbessert. Die leichte Aggregation und die einfache Struktur der Ag-Partikel können jedoch die Stabilität und Haltbarkeit des Chitosanfilms verringern, die nachweislich durch die Abscheidung spezifischer Nanopartikel verbessert werden können. Titandioxid (TiO2) ist eine typische Metalloxidverbindung mit hervorragenden Eigenschaften wie chemischer Stabilität, geringer Toxizität sowie angemessenen Kosten. Diese funktionellen Eigenschaften verleihen TiO2 ein großes Potenzial in vielen Forschungsbereichen15. So könntenTiO2-Partikel aufgrund ihrer Adhäsivität und bakteriziden Wirkung als Additive in Medizinprodukten und Biomaterialien dienen. Die tatsächliche Anwendung von TiO2 -Partikeln ist jedoch weitgehend durch ihre instabile Thermodynamik und Agglomerattrends begrenzt. Daher wurde vorgeschlagen, bestimmte Funktionsmaterialien in TiO2 zu dotieren, um die kombinative Wirkung von antibakterieller Aktivität, verbesserter Dispergierbarkeit und Thermostabilität zu erzielen.
In dieser Studie werden antibakterielle Ag/TiO 2-Komposite synthetisiert und in eine Chitosan-Beschichtung zur Eikonservierung eingebracht. REM-Bilder werden verwendet, um die Struktur und Morphologie der Ag/TiO2-Partikel und der Eierschalen zu analysieren. Die Konservierungsleistung der Beschichtung wird anhand des Gewichtsverlusts, der Haugh-Einheit, des Albumin-pH-Werts und der Eierschalenmorphologien bewertet und verglichen. Diese Studie zeigt die Möglichkeit und das Potenzial von Nanokomposit-Misch-Chitosan-Beschichtungen in der Lebensmittelkonservierung.
Protokoll
1. Synthese von Nano-Ag/TiO-2-Kompositen
- Zur Herstellung des Nano-Silber-Sols werden 100 ml AgNO-3-Lösung, 100 ml Schutzmittel und 50 ml NaBH4 zu einem 500-ml-Brecher kombiniert.
- Essigsäure und Methansäure (analytische Qualität) werden im Volumenverhältnis 1:1 gemischt, um 100 mL komplexe Säurelösung als Vorläufer für das Schutzmittel zu erhalten. Verdünnen Sie die saure Lösung mit entionisiertem Wasser (18 MΩ•cm) auf 500 mL als Schutzmittel.
- AgNO3 Lösung (0,3 mol/L) unter kräftigem Rühren in das resultierende Schutzmittel geben, bis die gelösten AgNO3 in der Schutzlösung gleichmäßig verteilt sind. 0,4 g NaBH4 werden zugegeben, um das gut dispergierte Agsol zu erhalten, nachdem das Gemisch 1 h lang bei Raumtemperatur umgesetzt wurde.
VORSICHT: Die Partikelgröße von Nanosilber kann durch die Konzentration des Schutzmittels und die Rührgeschwindigkeit in Schritt 1.1.2 eingestellt werden.
- Kombinieren Sie Ag unter Rühren mit einer Tetrabutyltitanat (TBOT)-Ethanollösung und fügen Sie dann tropfenweise 80 ml Säurekatalysator hinzu.
- Kombinieren Sie 500 μl Benzolsulfonsäure (BA) und Eisessig (AA), um die gemischte Lösung (BA und AA im Volumenverhältnis 1:2) zu erhalten. Die Lösung wird in 100 mL entionisiertem Wasser (18 MΩ•cm) verdünnt, um den Säurekatalysator vorzubereiten.
- Das resultierende Ag-Sol in die vordispergierte Tetrabutyltitanat (TBOT)-Ethanollösung (2,5 TBOT in 100 mL Ethanollösung) geben und 1 h lang rühren, um das gemischte Sol zu erhalten. Danach das Sol tropfenweise in 80 ml sauren Katalysator geben und 4 Stunden lang bei 70 °C rühren.
- Die Mischung wird 48 Stunden lang bei Raumtemperatur kontinuierlich gerührt, um das endgültige Ag/TiO 2-Komposit herzustellen.
KATION: Kräftiges Rühren kann zum Verspritzen von Lösungstropfen führen. Verwenden Sie Schutzvorrichtungen, um die Sicherheit zu gewährleisten, wie z. B. eine Mund-Nasen-Schutzmaske, einen Laborkittel und Handschuhe. Es gibt keinen strengen Standard für die Drehzahl in den oben genannten Verfahren.
2. Vorbereitung der Chitosanbeschichtung
- Chitosan in 1 Vol.-% Essigsäure auflösen und 24 h bei 25 °C rühren, um die Beschichtungslösung herzustellen (stellen Sie sicher, dass die Chitosankonzentration in der resultierenden Lösung 0,5 % (wt) beträgt.
- Ag/TiO2-Partikel werden separat in die Suspension gegeben (0, 0,5, 1 bzw. 1,5 g Ag/TiO2 in 50 g Chitosanlösung), um 0 %, 1 %, 2 % und 3 Gew.-% Ag/TiO2-Chitosanlösungen zu erhalten, die als Ag/TiO2-CS0, Ag/TiO2-CS1, Ag/TiO2-CS2 und Ag/TiO2-CS3 bezeichnet werden. beziehungsweise.
ACHTUNG: Es gibt keinen strengen Standard für die Drehzahl in den oben genannten Verfahren.
3. Betrachtung mit Rasterelektronenmikroskopie (REM)
- Schneide die experimentelle Eierschale in Stücke (quadratische Maße von ca. 2-3 mm).
- Immobilisieren Sie die Eierschalenstücke auf einem Metallstummel mit einem leitfähigen Klebstoff (z. B. doppelseitiges leitfähiges Kohleband oder andere ähnliche Materialien). Tragen Sie während der Probenvorbereitung Handschuhe, um eine Kontamination der Probe durch die Hände zu vermeiden. Markieren Sie die Probe (z. B. mit einem L-förmigen Kratzer mit einem Diamantstiftschneider).
- Alternativ können Sie eine gesputterte Beschichtung mit leitfähigem Material (~10 nm dick) auftragen, um Aufladeeffekte zu vermeiden.
- Nehmen Sie mindestens drei hochauflösende REM-Mikroskopaufnahmen (idealerweise mindestens fünf) aus der Draufsicht auf die Probe auf. Stellen Sie sicher, dass jedes Bild einen Bereich von mindestens 25 μm x 25 μm mit einem Auflösungsverhältnis von 20 μm anzeigt. Vermeiden Sie die Aufnahme von Bildern aus Oberflächenbereichen mit makroskopischen Oberflächendefekten.
- Verwenden Sie die folgenden REM-Parameter: Betriebsspannung von 30 kV. Die Auflösung des zweiten Elektronenbildes kann 2 nm erreichen, indem eine Feldemissionselektronenkanone in einem hochwertigen Rasterelektronenmikroskop verwendet wird (die Stromdichte des Ionenstrahls beträgt etwa 10,5 A/cm2).
- Notieren Sie sich die genaue Position jedes Bildes in Bezug auf die L-förmige Markierung.
4. Experimente zur Konservierung von Eiern
HINWEIS: Bei den frisch gelegten Eiern handelt es sich um Hühnereier, die von einem lokalen Bauernhof in Shenzhen, China, zur Verfügung gestellt werden.
- Untersuchen Sie experimentelle Eier, indem Sie Eier mit Rissen, Makula, Sand auf ihrer Oberfläche ausschließen, um einen günstigen experimentellen Prozess zur Eikonservierung zu gewährleisten.
- Die frisch gelegten Eier in fünf Gruppen mit je 30 Eiern aufteilen. Die vier beschichteten Gruppen, die mit dem Chitosan beschichtet sind, sind Ag/TiO-2-Chitosan, dotiert mit 0 %, 1 %, 2 % und 3 % (wt), als Ag/TiO2-CS0, Ag/TiO2-CS1, Ag/TiO2-CS2 bzw. Ag/TiO2-CS3 zu gestalten.
- Führen Sie den Beschichtungsprozess durch, um Eier 5 Minuten lang in verschiedene Beschichtungslösungen zu tauchen und 24 Stunden lang unter Umgebungsbedingungen zu trocknen. Stellen Sie die wassergewaschenen Eier (WE) als Kontrollexperiment ein. Nach den oben genannten Behandlungen lagern Sie die behandelten Eier bei 25 °C. Nehmen Sie die fünf markierten Eier, um den Gewichtsverlust zu messen, die Haugh-Einheit, den pH-Wert des Eiweißes und die Eierschalenmorphologien, um die Konservierungsleistung zu bewerten und zu vergleichen.
- Ermitteln Sie den Gewichtsverlust (%) des Eies, indem Sie den Gewichtsunterschied in Prozent des Eies im Vergleich zum ersten Tag berechnen. Messen Sie alle 5 Tage das Gewicht der Eizellen in jeder Gruppe.
- Berechnen Sie die Haugh-Einheit, um das Eigewicht mit der Dicke des Eiweißes in Beziehung zu setzen (Gleichung 1)12.
HU = 100 log (H-1,7W0,37+7,6) (1)
wobei H für die Eizähzhöhe (mm) und W für das Eigewicht (g) steht.- Klassifizieren Sie die Eier entsprechend dem Wert der Haugh-Einheit in die Klassen AA, A und B, wenn die Haugh-Einheit eines Eies über 72, zwischen 71 und 60 bzw. unter 60 liegt (die US-amerikanischen Standards für die Qualität einzelner Schaleneier).
- Trennen Sie das Eiweiß vom Eigelb und verwenden Sie ein digitales pH-Messgerät, um die pH-Werte des Eiweißes zu messen.
- Beobachten Sie die Morphologien der Oberflächen von Eierschalen mit einem Rasterelektronenmikroskop nach dem Platin-Sputtern der Proben.
KATION: Die Eierschalen sind spröde Substanzen, die heftige Stöße nicht aushalten können. Achten Sie daher darauf, dass die Eierschalen nicht beschädigt werden. Darüber hinaus sind die Prozeduren in Schritt 4.3.4 die gleichen wie in Schritt 3.
Ergebnisse
Die Partikelgrößeder Ag/ TiO2-Komposite reicht von 100 bis 300 nm, was von den Synthesebedingungen beeinflusst wird (Abbildung 1).

Abbildung 1: REM-Aufnahmen von Ag/TiO 2-Kompositpartikeln in unterschiedlichen Auflösungsverhältnissen (500 nm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Gewichtsverluste verschiedener Eiproben während der Lagerung sind in Tabelle 1 dargestellt. Ein kontinuierlich erhöhter Gewichtsverlust ist auf das Austreten von Eiweiß CO2 und Wasserdampf durch die Poren der Eierschalen zurückzuführen, was zu einer Verschlechterung der Eiqualität führt. Die Gewichtsverluste von WE-Eiern sind viel höher als bei anderen Gruppen, was auf die Schutzwirkung von Beschichtungen auf Chitosanbasis für die Eiqualität hinweist. Nach der Beschichtung mit Chitosan werden die Risse auf der Eierschale sichtbar verringert, was den Verlust von CO2 und Wasserdampf begrenzt.
| Lagerzeit (Tag) | Gewichtsverlust (Gew.-%) | ||||
| WIR | Ag/TiO 2-CS0 | Ag/TiO 2-CS1 | Ag/TiO 2-CS2 | Ag/TiO 2-CS3 | |
| 6 | 0,78±0,09C | 0,69±0,09C | 0,53±0,12 A | 0,49±0,21a,b | 0,48±0,06a |
| 11 | 1,85±0,13 Mrd. | 1,54±0,18c | 1,34±0,15 A | 1,28±0,13a,b | 1,26±0,21a |
| 16 | 2,53±0,21 Mrd. | 2,34±0,27c | 1,95±0,21 Mrd. | 1,93±0,35 A | 1,89±0,38 A |
| 21 | 4.01±0.25c | 3,63±0,32 Mrd. | 3.21±0.09b | 3.18±0.22a | 3.09±0.16a |
| 26 | 4,86±0,34 Mrd. | 4.18±0.25b | 4.09±0.39b | 4.05±0.29a | 3,98±0,21a,b |
| 31 | 5.62±0.41a | 5,01±0,51 Mrd. | 4,76±0,48 A | 4,69±0,17 A | 4,58±0,35 A |
| In der gleichen Zeile mit unterschiedlichen abgebildeten Buchstaben unterscheiden sich erheblich. | |||||
Tabelle 1: Die Variation des Gewichtsverlusts verschiedener Eier während der Lagerzeit.
Darüber hinaus verschließen Chitosan-Beschichtungen, die mit Ag/TiO2-Partikeln dotiert sind, die Poren besser und bilden dichte Schichten, was zu einem erheblich gehemmten Gewichtsverlust führt. Je höher die Dosierung der Ag/TiO2 -Partikel ist, desto stärker ist die Wirkung der entsprechenden Beschichtung zur Reduzierung des CO2 - und Dampfverlustes (Abbildung 2).

Abbildung 2: REM-Bilder der rohen Eierschalenoberflächen und der mit Chitosan behandelten Eierschalenoberflächen an den Tagen 0, 11, 16 und 31. (A) die Oberflächen der rohen Eierschalen; (B) mit Chitosan behandelte Eierschalenoberflächen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Haugh-Einheit wird aus den altersbedingten Veränderungen der weißen Proteine berechnet, was die Variation der Albuminverdünnung widerspiegelt, die eng mit der Proteinproteolyse und dem Albumin-pH-Wert zusammenhängt. Die raschere Abnahme und ausnahmslos niedrigere Werte der Haugh-Einheit in der WE-Gruppe als die Chitosan-Beschichtungsgruppen weisen auf die wirksame Schutzfähigkeit von Chitosan hin. Eier in mit Chitosan behandelten Gruppen behalten 26 Tage lang die höhere Klasse A, während die WE-Gruppe nach Tag 6 auf Stufe B herabgestuft wird. Die Werte der Haugh-Einheit in Ag/TiO 2-CS1 sind immer die höchsten unter allen behandelten Gruppen, was darauf hindeutet, dass: (i) die Zugabe von Ag/TiO2-Partikeln zu einem synergistischen Effekt mit Chitosan beiträgt, die für die Stabilisierung der Beschichtung und die Bakterienkontrolle wirksamer sind; während (ii) überschüssige Ag/TiO2-Partikel die Schichtstruktur der Chitosanbeschichtung zerstören würden, was zu einer schlechteren Konservierungskapazität führen würde. Den Ergebnissen in Tabelle 2 zufolge zeigt Chitosan, das mit 1 Gew.-% Ag/TiO2-Partikeln dotiert ist, die beste Leistung, um den Verfall von Albuminproteinen zu verlangsamen und so die Haltbarkeit um bis zu 30 Tage zu verlängern.
| Lagerzeit (Tag) | Haugh-Einheit | ||||
| WIR | Ag/TiO 2-CS0 | Ag/TiO 2-CS1 | Ag/TiO 2-CS2 | Ag/TiO 2-CS3 | |
| 6 | 73,23±0,68c | 80.32±0.59b | 83.34±0.12a,b | 81.60±1.41a | 77.06±0.35a |
| 11 | 69,86±3,25 Cent | 75.64±1.27b | 77.18±2.45a,b | 76.05±3.13a,b | 74.32±1.41a |
| 16 | 67.31±2.43b | 73.88±2.06b | 75.36±1.34a | 75.61±2.15a | 71.53±2.18a |
| 21 | 62.93±5.32c | 71.06±3.88c | 73.20±3.09a | 72.94±3.52a | 69.35±1.34a,b |
| 26 | 58,55±2,89 Mrd. | 69,85 ±1,53 c | 71.85±2.39a | 70.34±4.19a,b | 66.21±2.10a |
| 31 | 55.24±3.04a | 65.26±0.51a | 69.31±3.18a | 68.96±1.17a | 62.64±4.03a |
| In der gleichen Reihe mit unterschiedlichen hochgestellten Buchstaben unterscheiden sich deutlich | |||||
Tabelle 2: Die Variation der Haugh-Einheit verschiedener Eier während der Lagerzeit.
Die Variation des pH-Werts des Albumins wird durch die CO2 -Evakuierung verursacht, was zu einem langsamen Anstieg der pH-Werte mit der Lagerzeit führt. Der pH-Wert des Eiweißes von WE-Eiern steigt innerhalb von 10 Tagen stark an und erreicht am 30. Tag sogar 9,5. Der Abbau von Proteinen in Fett und Pepton führt zu einer Absenkung des pH-Werts. Nach dem Schutz durch eine Chitosan-Beschichtung zeigt der pH-Wert des Albumins innerhalb von 20 Tagen ähnliche Trends, die sich bei etwa pH 8,0-8,2 stabilisieren. Nach Tag 20 zeigen die pH-Werte von Ag/TiO 2-CS0 und Ag/TiO2-CS1 leichte Schwankungen bei etwa pH 8,2 und stabilisieren sich zwischen pH 7,5-8,0 für Ag/TiO2-CS2 und Ag/TiO2-CS3. Der relativ stabile Albumin-pH-Wert der behandelten Gruppen im Vergleich zur WE-Gruppe verdeutlicht die wirksame Reduzierung des CO2 -Verlusts im Albumin (Abbildung 3). Die Zugabe von Ag/TiO2-Partikeln fördert die Stabilität von Chitosan, das eine gute Stabilität bis zu 31 Tagen aufrechterhalten kann (Abbildung 4).
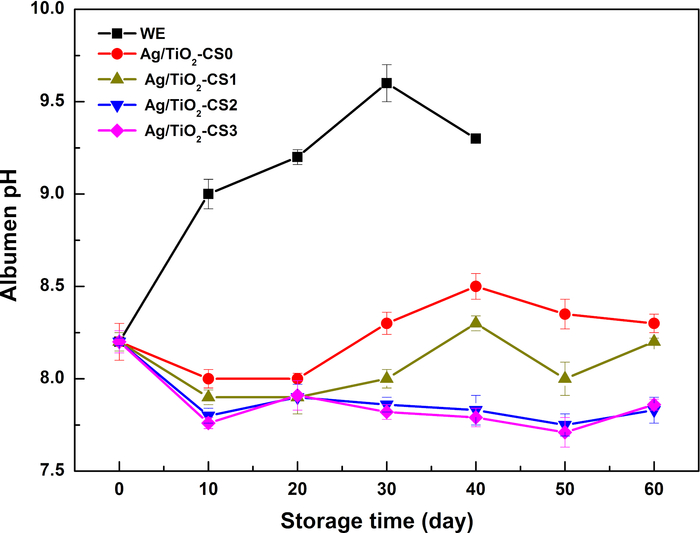
Abbildung 3: Veränderungen des Albumin-pH-Werts verschiedener Eier während der Lagerzeit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: REM-Bilder von Ag/TiO 2-CS-beschichteten Eierschalenoberflächen an den Tagen 0, 11, 16 und 31. a) Ag/TiO 2-CS1; b) Ag/TiO 2-CS2, (C) Ag/TiO 2-CS3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Probleme bei der Erhaltung der Eiproteinqualität könnten durch eine Chitosan-Beschichtung gelöst werden, die sich als wirksames Mittel zur Verlängerung der Haltbarkeit von Eiern erwiesen hat. Die Verwendung einer einzigen Chitosan-Beschichtung führt jedoch zu mehreren Problemen, wie z. B. Instabilität, Begrenzung der Konservierungszeit und der tatsächlichen Anwendung von Beschichtungen auf Chitosan-Basis. Insbesondere wurde vorgeschlagen, bestimmte antibakterielle Nanopartikel in Chitosan zu dotieren, um die Haltbarkeit weiter zu verlängern. In dieser Studie wurden Ag/TiO2 -Partikel erfolgreich synthetisiert und in eine Chitosan-Beschichtung dotiert, die die Konservierungszeit auf mindestens 30 Tage verlängern könnte.
REM-Aufnahmen werden verwendet, um die Struktur und Morphologie der Ag/TiO 2-Partikel sowie die Morphologie der beschichteten Eierschalen zu analysieren. Die Konservierungsleistung von Kompositbeschichtungen wird anhand des Gewichtsverlusts, der Haugh-Einheit, des Albumin-pH-Werts und der Eierschalenmorphologien der Proben bewertet. Die Verwendung von Ag/TiO2-Kompositen trägt zu einem synergistischen Effekt zu Chitosan bei, der die Konservierungsdauer weiter verlängern könnte.
Die Partikelgrößen von Ag/TiO 2-Kompositen liegen im Bereich von 100-300 nm (gesteuert durch die Synthesebedingung), was die Poren auf der Oberseite der Eierschale verstopfen und die Konservierungsleistung verbessern könnte. Überschüssige Ag/TiO2 -Partikel würden jedoch die Schichtstruktur der Chitosanbeschichtung zerstören, was zu einer geringeren Konservierungsfähigkeit führt.
Gegenwärtig sind die Leistungen der Chitosan-Beschichtung in dieser Studie jedoch durch die vorhandenen Partikelspezies und -konzentrationen begrenzt, was in zukünftigen Studien optimiert werden muss.
Die Methoden in dieser Studie zeigen neuartige Beschichtungsmaterialien, die durch spezifische Nanopartikel in den Beschichtungsvorläufer gemischt werden können, um kombinative Effekte von Nanopartikeln und dem Vorläufer zu erzielen, sowie neuartige multifunktionale Beschichtungen im Bereich der Lebensmittelkonservierung herzustellen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde unterstützt vom Guangxi Key Laboratory der New Energy and Building Energy Saving Foundation (Nr. 19-J-21-17, 19-J-21-30), dem Guangxi Universities Scientific Research Project (2020KY06029) und dem Wuhan University of Technology-Tibet University Joint Innovation Fund (LZJ2020003).
Materialien
| Name | Company | Catalog Number | Comments |
| acetate | Aladdin | 64-19-7 | GR, 99.8% |
| Benzenesulfonic acid | Aladdin | 03/11/1998 | 98% |
| Chitosan | Aladdin | 9012-76-4 | <200 mPa•s |
| Deionized water | prepared by ourselves | - | 18 MΩ•cm |
| Electronic precision balance | Sartorius | BSA124S-CW | |
| Ethanol | Aladdin | 64-17-5 | ≥99.8% |
| Formate | Aladdin | 64-18-6 | Standard for GC, >99% |
| pH meter | HeYi | PHS-25 | |
| Scanning electron microscope | Hiatchi | SU8010 | |
| Silver nitrate (AgNO3) | Aladdin | 7761-88-8 | ≥99.9% |
| Sodium borohydride (NaBH4 ) | Aladdin | 16940-66-2 | 98% |
| Temperature humidity chamber | YiHeng | LHS-50CH | |
| Titanium butoxide (TBOT) | Aladdin | 5593-70-4 | CP,98% |
Referenzen
- Kuroli, S., Kanoo, T., Itoh, H., Ohkawa, Y. Nondestructive measurement of yolk viscosity in lightly heated chicken shelleggs. Journal of Food Engineering. 205, 18-24 (2017).
- Kostogrys, R. B., et al. Effect of dietary pomegranate seed oil on laying hen performance and physicochemical properties of eggs. Food Chemistry. 221, 1096-1103 (2017).
- Morsy, M. K., Sharoba, A. M., Khalaf, H. H., El-Tanahy, H. H., Cutter, C. N. Efficacy of antimicrobial pullulan-based coating to improve internal quality and shelf-life of chicken eggs during storage. Journal of Food Science. 80, 1066-1074 (2015).
- Damaziak, K., et al. Effect of dietary canthaxanthin and iodine on the production performance and egg quality of laying hens. Journal of Poultry Science. , (2018).
- Sert, D., Aygun, A., Demir, M. K. Effects of ultrasonic treatment and storage temperature on egg quality. Journal of Poultry Science. 90, 869-875 (2011).
- Yaceer, M., Aday, M. S., Caner, C. Ozone treatment of shell eggs to preserve functional quality and enhance shelf life during storage. Journal of the Science of Food and Agriculture. 96, 2755-2763 (2016).
- Viswanathan, K., Priyadharshini, M. L. M., Nirmala, K., Raman, M., Raj, G. D. Bactericidal paper trays doped with silver nanoparticles for egg storing applications. Bulletin of Materials Science. 39, 819-826 (2016).
- Aygun, A., Sert, D. Effects of vacuum packing on eggshell microbial activity and egg quality in table eggs under different storage temperatures. Journal of the Science of Food and Agriculture. 93, 1626-1632 (2013).
- Ryu, K. N., No, H. K., Prinyawiwatkul, W. Internal quality and shelf life of eggs coated with oils from different sources. Journal of Food Science. 76, 325-329 (2011).
- Figueiredo, T. C., et al. Effects of packaging, mineral oil coating, and storage time on biogenic amine levels and internal quality of eggs. Journal of Poultry Science. 93, 3171-3178 (2014).
- Caner, C., Ydceer, M. Efficacy of various protein-based coating on enhancing the shelf life of fresh eggs during storage. Journal of Poultry Science. 94, 1665-1677 (2015).
- Xu, D., Wang, J., Ren, D., Wu, X. Y. Effects of chitosan coating structure and changes during storage on their egg preservation performance. Coatings. 8, 317(2018).
- Kopacic, S., Bauer, W., Walzl, A., Leitner, E., Zankel, A. Alginate and chitosan as a functional barrier for paper-based packaging materials. Coatings. 8, 235(2018).
- Sagnelli, D., et al. Cross-linked amylose bio-plastic:A transgenic-based compostable plastic alternative. International Journal of Molecular Sciences. 18, 2075(2017).
- Megan, T., Robert, C. P., Ivan, P. P., Clara, P. Nanostructured titanium dioxide coatings prepared by aerosol assisted chemical vapour deposition (AACVD). Journal of Phothchemistry and Photobiology A-Chemistry. 400, 112727(2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten