Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bewertung der Mausurteilsverzerrung durch eine olfaktorische Grabaufgabe
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel enthält eine detaillierte Beschreibung eines neuartigen Mausurteils-Bias-Protokolls. Beweise für die Empfindlichkeit dieser olfaktorischen Grabungsaufgabe für den affektiven Zustand werden ebenfalls demonstriert und ihr Nutzen in verschiedenen Forschungsbereichen diskutiert.
Zusammenfassung
Judgement Bias (JB) sind Unterschiede in der Art und Weise, wie Individuen in positiven und negativen affektiven / emotionalen Zuständen mehrdeutige Informationen interpretieren. Dieses Phänomen wird seit langem beim Menschen beobachtet, wobei Individuen in positiven Zuständen "optimistisch" auf Mehrdeutigkeit reagieren und Personen in negativen Zuständen stattdessen "Pessimismus" zeigen. Forscher, die den Einfluss von Tieren beurteilen wollen, haben diese unterschiedlichen Reaktionen genutzt und Aufgaben entwickelt, um die Urteilsverzerrung als Indikator für den affektiven Zustand zu bewerten. Diese Aufgaben werden in verschiedenen Arten und Forschungsfeldern immer beliebter. Für Labormäuse, die am häufigsten verwendeten Wirbeltiere in der Forschung und eine Spezies, auf die man sich stark verlässt, um affektive Störungen zu modellieren, wurde jedoch nur eine JB-Aufgabe erfolgreich als empfindlich gegenüber Veränderungen des affektiven Zustands validiert. Hier geben wir eine detaillierte Beschreibung dieser neuartigen murinen JB-Aufgabe und Beweise für ihre Empfindlichkeit gegenüber Mausaffekten. Obwohl noch Verfeinerungen erforderlich sind, öffnet die Bewertung von Maus-JB die Tür zur Beantwortung praktischer Fragen zum Schutz der Maus und grundlegender Fragen zu den Auswirkungen des affektiven Zustands in der translationalen Forschung.
Einleitung
Die Messung der affektiv modulierten Urteilsverzerrung (im Folgenden JB) hat sich als nützliches Werkzeug zur Untersuchung der emotionalen Zustände von Tieren erwiesen. Dieser innovative Ansatz lehnt sich an die menschliche Psychologie an, da Menschen, die positive oder negative affektive Zustände (Emotionen und längerfristige Stimmungen) erleben, zuverlässig Unterschiede in der Art und Weise zeigen, wie sie Informationen verarbeiten 1,2,3. Zum Beispiel können Menschen, die an Angstzuständen oder Depressionen leiden, neutrale Gesichtsausdrücke als negativ oder neutrale Sätze als bedrohlichinterpretieren 4,5. Es ist wahrscheinlich, dass diese Verzerrungen einen adaptiven Wert haben und daher über Spezies 6,7 hinweg erhalten bleiben. Forscher, die darauf abzielen, den Einfluss von Tieren zu bewerten, haben dieses Phänomen geschickt ausgenutzt und Optimismus als erhöhte Erwartung von Belohnung als Reaktion auf neutrale oder mehrdeutige Hinweise und Pessimismus als erhöhte Erwartung von Bestrafung oder Belohnungsmangel 8,9 operationalisiert. So können in einem experimentellen Umfeld optimistische und pessimistische Reaktionen auf mehrdeutige Reize als Indikatoren für positive und negative Affekte interpretiert werden, jeweils10,11.
Im Vergleich zu anderen Indikatoren für tierische Affekte haben JB-Aufgaben das Potenzial, besonders wertvolle Werkzeuge zu sein, da sie in der Lage sind, sowohl die Wertigkeit als auch die Intensität affektiver Zustände zu erkennen10,11. Die Fähigkeit von JB-Aufgaben, positive Zustände zu erkennen (z. B. Rygula et al.12), ist besonders nützlich, da die meisten Indikatoren für den Einfluss von Tieren auf die Erkennung negativer Zuständebeschränkt sind 13. Während JB-Aufgaben werden die Tiere in der Regel darauf trainiert, auf einen positiven diskriminierenden Hinweis zu reagieren, der die Belohnung vorhersagt (z. B. Hochfrequenzton) und einen negativen diskriminierenden Hinweis, der die Bestrafung vorhersagt (z. B. niederfrequenter Ton), bevor ihnen ein mehrdeutiger Hinweis (z. B. Zwischenton) angezeigt wird8. Wenn ein Tier als Reaktion auf mehrdeutige Hinweise "optimistisch" die trainierte Reaktion auf den positiven Hinweis ausführt (als ob es eine Belohnung erwarten würde), deutet dies auf eine positive Urteilsverzerrung hin. Alternativ, wenn Tiere die negative trainierte Reaktion zeigen, um Bestrafung zu vermeiden, ist dies ein Hinweis auf "Pessimismus" oder negative Urteilsverzerrung.
Seit der Entwicklung der ersten erfolgreichen JB-Aufgabe für Tiere durch Harding und Kollegen8 wurden mehrere JB-Aufgaben für ein breites Spektrum von Arten in verschiedenen Forschungsbereichen entwickelt7. Aber trotz ihrer zunehmenden Beliebtheit sind Tier-JB-Aufgaben oft arbeitsintensiv. Darüber hinaus, vielleicht weil sie sich methodisch von den menschlichen Aufgaben unterscheiden, die sie inspiriert haben, produzieren sie manchmal null oder kontraintuitive Ergebnisse14 und führen in der Regel nur zu kleinen Behandlungseffektgrößen15. Infolgedessen können JB-Aufgaben schwierig zu entwickeln und umzusetzen sein. Tatsächlich wurde für Labormäuse, die am häufigsten verwendeten Wirbeltiere in der Forschung 16,17 und eine Spezies, auf die man sich stark stützt, um affektive Störungen zu modellieren 18, nur eine JB-Aufgabe trotz vieler Versuche in den letzten zehn Jahren erfolgreich als empfindlich gegenüber Veränderungen im affektiven Zustand validiert 19 (siehe ergänzendes Material von Resasco et al.19 für eine Zusammenfassung). Dieser Artikel beschreibt die kürzlich validierte murine JB-Aufgabe, beschreibt ihr biologisch relevantes Design und hebt die Möglichkeiten hervor, wie diese humane Aufgabe angewendet werden kann, um wichtige Hypothesen zu testen, die für den Mausaffekt relevant sind. Insgesamt kann das Protokoll implementiert werden, um die affektiven Auswirkungen jeder Variablen von Interesse auf JB in Mäusen zu untersuchen. Dies würde kategorische Behandlungsvariablen wie hier beschrieben (Arzneimittel- oder Krankheitseffekte, Umweltbedingungen, genetischer Hintergrund usw.) oder Beziehungen mit kontinuierlichen Variablen (physiologische Veränderungen, häusliches Käfigverhalten usw.) umfassen.
Protokoll
Die Experimente wurden vom Animal Care Committee (AUP #3700) der University of Guelph genehmigt, in Übereinstimmung mit den Richtlinien des Canadian Council on Animal Care durchgeführt und gemäß den Anforderungen von ARRIVE (Animal Research: Reporting of In Vivo Experiments)20 gemeldet.
1. Versuchsvorbereitung
- Versuchsplanung (siehe Tabelle 1).
HINWEIS: Dieser Verhaltenstest ist eine geruchsbasierte Go / Go-Grabaufgabe, bei der Mäuse nach hochwertigen oder minderwertigen Belohnungen graben müssen. Es nutzt eine rechteckige Arena (Abbildung 1) mit zwei Armen, in denen ein Arm parfümiert wird, während der andere unparfümiert ist. Wie unten beschrieben, werden Mäuse darauf trainiert, zwischen positiven und negativen Geruchshinweisen zu unterscheiden, bevor sie mit einer mehrdeutigen Geruchsmischung konfrontiert werden.- Weisen Sie Käfige pseudozufällig Mint- oder Vanille-positiven diskriminativen Reizgruppen (DS+) wie folgt zu.
HINWEIS: Dieses Protokoll wurde nur für Mäuse validiert, die der Vanille-DS+-Geruchsmischung zugeordnet sind (siehe Repräsentative Ergebnisse und Resasco et al.19 für Details). Pilotversuche werden jedoch dringend empfohlen, um zu bestätigen, dass die DS+-, DS- und mehrdeutigen Gemische die Anforderungen für eine gültige JB-Bewertung erfüllen (Schritte 4.7.3 und 5.3). Daher umfassen die hier beschriebenen Methoden das Testen sowohl einer Vanille als auch einer Minze DS+, um ein Beispiel für eine Gruppe zu geben, die die Anforderungen für die Bewertung von JB (die Vanille DS + -Mäuse) erfolgreich erfüllt, und einer Gruppe, die dies nicht tut (die Minze DS + -Mäuse). Frühere Pilotversuche würden diese Art von Problem im Voraus identifizieren. - Mint DS+ Mäuse: Markieren Sie für diese Mäuse während des Arena-Setups für das Training (siehe Schritt 1.4 unten) Duftspender und Töpfe, die eine hochwertige Belohnung enthalten, mit dem Minzgeruchshinweis und solche, die keine Belohnung mit dem Vanillegeruchshinweis enthalten.
- Vanilla DS+ Mäuse: Markieren Sie bei diesen Mäusen während des Arena-Setups für das Training (siehe Schritt 1.4 unten) Duftspender und -töpfe, die eine hochwertige Belohnung enthalten, mit dem Vanille-Geruchshinweis und solche, die keine Belohnung mit dem Minzgeruchshinweis enthalten.
HINWEIS: Diese Aufgabe besteht aus verstärkten Trainingsversuchen und unverstärkten Testversuchen. Während unverstärkter Testversuche sind den Mäusen keine Belohnungen zugänglich (siehe Schritt 1.4.3 unten) und der mehrdeutige Geruchshinweis für Minze und Vanille DS + -Mäuse ist die gleiche 1: 1 Minze / Vanille-Mischung. - Weisen Sie Käfige pseudozufällig links oder rechts duftenden Armgruppen zu (Gegengewicht zwischen DS+ Geruchsgruppen) wie folgt.
- Links: Markieren Sie bei diesen Mäusen während des Arena-Setups für Training und Tests (siehe Schritt 1.4 unten) den linken Arm mit dem entsprechenden DS+- oder DS-Geruchshinweis und stellen Sie sicher, dass der rechte Arm immer unparfümiert ist (nur mit destilliertem Wasser markiert).
- Rechts: Markieren Sie bei diesen Mäusen während des Arena-Setups für Training und Tests (siehe Schritt 1.4 unten) den rechten Arm mit dem entsprechenden DS+- oder DS-Geruchshinweis und stellen Sie sicher, dass der linke Arm immer unparfümiert ist (nur mit destilliertem Wasser markiert).
- Weisen Sie jedem Tier nach dem Zufallsprinzip einen "Blindcode" wie folgt zu.
HINWEIS: Die Verblindung ermöglicht es dem Forscher, der mit den Mäusen umgeht und ihr Verhalten bewertet, sich der Tier-ID oder -Behandlung nicht bewusst zu sein, wodurch unerwünschte subjektive Vorurteile vermieden werden. Dies ist ein obligatorischer Schritt, um die ARRIVE-Richtlinien (Animal Research: Reporting of In Vivo Experiments) und andere Referenzdokumente20 einzuhalten. - Fügen Sie eine Spalte für blinden Code in einer Tabelle hinzu, die jede Tier-ID und die entsprechende Behandlung enthält, der sie zugewiesen wurden.
- Weisen Sie jedem Tier nach dem Zufallsprinzip einen eindeutigen Code zu (z. B. eine Buchstaben- und Zahlenkombination "A2"), der nichts mit der Käfignummer oder der Behandlung zu tun hat.
HINWEIS: Alle Randomisierungen sollten mit einem Zufallszahlengenerator (z. B. Random.org) durchgeführt werden. Während dieses Randomisierungsschritts sollten Sie gegebenenfalls ein Gegengewicht über Behandlung, Stamm usw. bilden. Lassen Sie dies von einem Forschungsassistenten tun, der während der gesamten Experimente für die Behandlung "unblind" bleibt. Diese Person darf während des Tests keine Daten sammeln, um voreingenommene Bewertungen zu vermeiden. - Stellen Sie während der gesamten Datenerfassung dem "blinden" Forscher, der eine Live- und Video-Scoring-Latenz hat, zur Verfügung, um die Grabungs- und Grabungsdauer nur mit dem Blindcode des Tieres zu verbringen, um den Forscher für die Behandlung blind zu halten.
HINWEIS: Tabellenkalkulationen, die während der Datenerfassung verwendet werden, enthalten nur den Blindcode des Tieres und die entsprechende Latenzzeit zum Graben und Graben für jede Studie. Am Ende der Experimente können die entsprechenden Tier-ID- und Behandlungsinformationen in die Tabelle aufgenommen werden, wodurch Forscher für Datenanalysen "entblindet" werden.
- Weisen Sie Käfige pseudozufällig Mint- oder Vanille-positiven diskriminativen Reizgruppen (DS+) wie folgt zu.
- Materialvorbereitung.
- Hochwertige Lebensmittelbelohnungen: Getrocknete gesüßte Bananenchips von Hand in ca. 0,5 cm x 0,5 cm große Stücke brechen.
- Belohnungen für minderwertige Lebensmittel: Schneiden Sie mit einem Schneidebrett und einem Messer Nagetierfutter (aus der normalen Ernährung der Tiere) in ca. 0,125 cm3 Stück.
HINWEIS: Pilottests zur Identifizierung von Belohnungen mit hohem und niedrigem Wert sollten vor Beginn der Aufgabe durchgeführt werden. - Minz- und Vanilleessenzen: Mit einer 1-ml-Spritze oder Mikropipette Minz- und Vanilleextrakt in etikettierte Zentrifugenröhrchen geben. Extrakte 1:4 mit destilliertem Wasser verdünnen und durch mehrmaliges Umkehren mischen. Machen Sie diese täglich und kehren Sie sie vor Gebrauch wiederholt um, um sicherzustellen, dass die Mischungen frisch und konsistent sind.
- Mehrdeutige Geruchsmischung: Nachdem Minz- und Vanilleessenzen verdünnt wurden, fügen Sie gleiche Volumina zu einem Zentrifugenröhrchen hinzu (wodurch eine 1: 1-Mischung der verdünnten Essenzen entsteht). Machen Sie diese am Tag der Testreaktion auf mehrdeutige Geruchsmischung und kehren Sie sie vor der Verwendung wiederholt um, um sicherzustellen, dass die Mischung frisch und konsistent ist.
HINWEIS: Pilotversuche zur Identifizierung geeigneter Verdünnungen und Zwischengeruchsgemische werden dringend empfohlen, um den Nutzen mehrdeutiger Sonden sicherzustellen, da die Intensität zwischen Herstellern, Chargen usw. variieren kann. Wenn mehrere mehrdeutige Hinweise angeboten werden, weisen Sie Mäuse nach dem Zufallsprinzip den nahe positiven, mittleren und nahezu negativen Testhinweisen zu. Weitere Informationen finden Sie in der Diskussion. - Wattepads: Schneiden Sie jedes kreisförmige Wattepad in sechs gleiche Stücke (so dass sie in die Gewebekassetten passen, die als Duftspender verwendet werden).
HINWEIS: Die Anzahl der hochwertigen und minderwertigen Lebensmittelbelohnungen, Wattepads und Mengen an Geruchsmischungen hängt von der Anzahl der getesteten Probanden ab. Bitte beachten Sie Tabelle 1 für die Anzahl der Versuche pro Probanden in jeder Phase und Tabelle 2 für die in jeder Versuchsart benötigten Materialien. - Identifizieren Sie den Versuchsbereich: Führen Sie Schulungen und Tests auf einer Bank im Kolonieraum oder anderswo durch. Führen Sie alle Versuche unter rotem Licht während der dunklen Phase durch, wenn Mäuse aktiv sind.
- Vortraining (1 Woche vor den Experimenten) zum Graben im heimischen Käfig.
- Gießen Sie für jeden zu testenden Käfig eine kleine Menge Maiskolbeneinstreu in zwei Grabtöpfe (gerade genug, um den Boden des Topfes zu bedecken), damit die Leckereien beim Bestatten in der Mitte des Topfes bleiben.
- Legen Sie in einem Topf Stücke mit hochwertiger Belohnung auf die Maiskolbenschicht, damit jede Maus im Käfig ein Stück haben kann (z. B. drei Stück Bananenchips für einen Käfig mit drei Mäusen). Legen Sie im anderen Topf Stücke mit geringwertiger Belohnung auf die Maiskolbenschicht, damit jede Maus im Käfig ein Stück haben kann (z. B. drei Stücke Chow für einen Käfig mit drei Mäusen).
- Gießen Sie langsam Maiskolbenbettwäsche über die Leckereien in jedem Topf, decken Sie sie ab und füllen Sie die Töpfe bis zu einer Höhe von 3 cm.
- Legen Sie gleichzeitig einen hochwertigen und einen minderwertigen Topf für 10 Minuten in jeden Käfig. Nach 10 Minuten die Töpfe aus allen Käfigen nehmen.
- Entsorgen Sie alle Maiskolben und Leckereien, die im Topf verbleiben. Wischen Sie alle Töpfe gründlich mit 70% Ethanol ab, um zu verhindern, dass Tier- und Käfiggerüche zukünftige Versuche beeinflussen.
- Wiederholen Sie die Schritte 1.3.1-1.3.5 einmal täglich an 5 aufeinanderfolgenden Tagen.
HINWEIS: Das Ziel dieser Phase ist es, allen Käfigkameraden die Möglichkeit zu geben, vor Beginn des formalen Trainings ein Leckerli zu graben und zu essen. Dies erleichtert auch die Gewöhnung an Nahrungsbelohnungen.
- Arena für Training und Tests eingerichtet.
- Stellen Sie die Arena auf eine Werkbank unter rotem Licht. Wischen Sie alle Komponenten der Arena, der Grabtöpfe und Duftspender gründlich mit 70% Ethanol ab, um Staub und Gerüche aus früheren Versuchen zu entfernen.
- Bereiten Sie die Grabtöpfe wie folgt vor.
- Legen Sie die entsprechenden Lebensmittelbelohnungen in das "unzugängliche Fach" (siehe Abbildung 1).
HINWEIS: Die in diesem Fach enthaltenen Belohnungen hängen davon ab, welche Leckereien (falls vorhanden) in einer bestimmten Studie vergraben werden (siehe Tabelle 2). So enthält jeder Topf immer ein Stück Bananenchip und ein Stück Chow über die beiden Fächer.- DS+ Geruchstöpfe: Legen Sie bei verstärkten Versuchen ein Stück Chow in das unzugängliche Fach und vergraben Sie ein Stück Bananenchip im zugänglichen Bereich des Topfes.
- DS-Geruchstöpfe: Legen Sie bei verstärkten Versuchen ein Stück Chow und ein Stück Bananenchip in das unzugängliche Fach. Im zugänglichen Bereich des Topfes sind keine Belohnungen für Lebensmittel verfügbar.
- Unparfümierte Töpfe: Legen Sie während verstärkter Versuche ein Stück Bananenchip in das unzugängliche Fach und vergraben Sie ein Stück Chow im zugänglichen Bereich des Topfes.
- Legen Sie während aller unverstärkten Testversuche (positiv, negativ und mehrdeutig) ein Stück Chow und ein Stück Bananenchip in das unzugängliche Fach. Im zugänglichen Bereich des Topfes sind keine Belohnungen für Lebensmittel verfügbar.
HINWEIS: Dieser Schritt soll verhindern, dass der Duft der vergrabenen Leckereien enthüllt, welcher Topf belohnt wird. So ist die Barriere zwischen den beiden Fächern perforiert, um die Geruchsübertragung zu erleichtern.
- Gießen Sie eine kleine Menge Maiskolben in jeden Topf, um die Lebensmittelbelohnungen zentriert zu halten, wenn sie begraben werden. Legen Sie ein Stück der entsprechenden Futterbelohnung (siehe Tabelle 2) auf die Maiskolbenschicht und gießen Sie langsam Maiskolbeneinstreu über die Leckereien, bedecken Sie sie und füllen Sie die Töpfe bis zu einer Höhe von 3 cm.
- Mit einer 1-ml-Spritze oder Mikropipette werden 0,1 ml der entsprechenden Geruchsmischung (d. h. Minze, Vanille oder mehrdeutige Gemische) oder destilliertes Wasser (siehe Tabelle 2) entnommen und in kreisförmiger Bewegung direkt auf den Maiskolben injiziert.
- Duftspender vorbereiten.
- Legen Sie ein Wattepadstück in den Boden der Taschentuchkassette. Mit einer 1-ml-Spritze oder Mikropipette werden 0,1 ml der entsprechenden Geruchsmischung (d. h. Minze-, Vanille- oder mehrdeutige Mischungen) oder destilliertem Wasser (siehe Tabelle 2) aufgezogen und auf das Baumwollstück injiziert. Decken Sie die Taschentuchkassette mit ihrem Deckel ab, um die duftende Baumwolle zu umschließen und einen Duftspender zu schaffen.
- Stellen Sie die Grabtöpfe an die Enden der Arme und die Duftspender an den Anfang jedes Arms. Setzen Sie die herausnehmbare "Tür" unmittelbar vor den Kassettenfächern ein, um den Zugang zu den Arenaarmen zu blockieren und das Startfach zu erstellen (siehe Abbildung 1).
HINWEIS: Grabtöpfe, Duftspender und Spritzen müssen deutlich gekennzeichnet und nur für einen Duft während der Experimente verwendet werden, um eine unbeabsichtigte Vermischung von Geruchshinweisen zu vermeiden (d. H. Verwenden Sie einen anderen Satz von Materialien für Minze, Vanille, unparfümierte und mehrdeutige Mischungen).
2. Grabungstraining: 5 Tage, zwei positive Versuche pro Tag (Tabelle 2)
- Schnelle Mäuse für 1 Stunde vor dem Training in ihrem Heimkäfig, indem sie Nahrung aus dem Trichter nehmen.
- Richte die Arena für einen verstärkten positiven Test ein, indem du die obigen Anweisungen zum Aufbau der Arena befolgst (Schritt 1.4).
- Legen Sie am Tag 1 des Grabtrainings die Essensbelohnungen auf die 3 cm Maiskolbeneinstreu, anstatt sie zu vergraben.
- Vergraben Sie die Belohnungen in den folgenden 4 Tagen nach und nach tiefer unter dem Maiskolben, bis sie sich an Tag 5 am Boden der 3 cm Bettwäsche befinden (d. H. Tag 1: auf Maiskolben, Tag 2: begraben von einer sehr dünnen Schicht Maiskolben, Tag 3: auf halbem Weg zum Boden des Topfes begraben, Tag 4: drei Viertel des Weges zum Boden des Topfes begraben, und Tag 5: begraben am Boden des Topfes).
- Bewegen Sie Mäuse aus ihrem Heimkäfig in einen leeren Transportkäfig. Legen Sie eine Cue-Karte mit dem Jalousiecode des Tieres auf den Transportkäfig, damit der Forscher, der Experimente durchführt, für die Tieridentifikation und -behandlung blind bleibt. Tragen Sie Mäuse in den Versuchsbereich.
HINWEIS: Die Schritte 2.1 und 2.5 sollten von einem wissenschaftlichen Mitarbeiter ausgeführt werden, der mit den Mäusen vertraut ist. Die nachfolgenden Schritte während der Studien werden von einem Forscher durchgeführt, der blind für die Tier-ID (und gegebenenfalls die Behandlung) ist. Behandeln Sie Mäuse immer mit Becherhandhabung (offene Hand) oder Tunnelhandhabung (mit einem Pappbecher oder Kunststofftunnel), um die aversiven Auswirkungen der traditionellen Heckhandhabung zu vermeiden21. - Bewegen Sie Mäuse aus dem Transportkäfig in das Startfach der Arena. Entfernen Sie die Starttür, senken Sie sofort den Plexiglasdeckel über der Arena und starten Sie den 5-minütigen Testtimer.
HINWEIS: Wenn mehrere Mäuse aus demselben Käfig getestet werden, sollte dies gleichzeitig erfolgen. Die Anzahl der Tiere, die gleichzeitig getestet werden, hängt jedoch von der Anzahl der verfügbaren blinden Beobachter ab. Im Idealfall beobachtet und behandelt ein Forscher jeweils ein Tier, aber eine Person kann bei Bedarf zwei Tiere gleichzeitig beobachten und handhaben. - Live-Score-Latenz zum Graben und Latenz, um die Belohnung in beiden Armen zu fressen.
- Zeichnen Sie die Latenz zum Graben als den Zeitpunkt auf, zu dem das erste Auftreten des Grabens beobachtet wird. Graben wird als Maus beschrieben, die aktiv Maiskolbeneinstreu mit den Vorderpfoten und / oder der Schnauze schiebt oder manipuliert.
- Notieren Sie die Latenz zum Essen als den Zeitpunkt, zu dem das erste Auftreten des Essens beobachtet wird. Essen wird als eine Maus beschrieben, die eine Belohnung konsumiert, während sie sie in den Vorderpfoten hält und auf Haunches sitzt.
- Wenn der Versuch beendet ist, heben Sie den Plexiglasdeckel an und bewegen Sie die Maus zurück in ihren Transportkäfig.
- Entsorgen Sie alle Maiskolbenbettwäsche und Leckereien, die in den Töpfen übrig geblieben sind. Decken Sie die Gewebekassetten und werfen Sie Baumwollstücke weg. Wischen Sie alle Komponenten der Arena und der Grabtöpfe ab und riechen Sie die Spender gründlich mit 70% Ethanol.
- Richten Sie die Arena für eine zweite positive Studie ein (Schritt 1.4). Wiederholen Sie die Schritte 2.6-2.9 für eine verstärkte positive Studie.
- Geben Sie den Transportkäfig an den Forschungsassistenten zurück, damit die Mäuse wieder in ihren Heimkäfig gebracht werden können.
- Wiederholen Sie die Schritte 2.1-2.11 an 5 aufeinanderfolgenden Tagen.
3. Diskriminierungstraining: 10 Tage, vier Versuche pro Tag
- Richten Sie die Arena für eine positive oder negative Studie ein (siehe Tabelle 2) gemäß den Anweisungen in Schritt 1.4.
- Führen Sie zwei positive und zwei negative Studien pro Tag gemäß der in Tabelle 2 beschriebenen Reihenfolge durch (d. h. abwechselnd positive und negative Studien an den Tagen 1-5 und pseudozufällige Reihenfolge an den Tagen 6-10).
- Befolgen Sie die Anweisungen in Schritt 2.1 zu Beginn jedes Trainingstages und dann die Schritte 2.5-2.10. Wiederholen Sie den Vorgang, bis die Mäuse insgesamt vier Versuche durchlaufen haben.
- Geben Sie den Transportkäfig an den Forschungsassistenten zurück, damit die Mäuse wieder in ihren Heimkäfig gebracht werden können.
- Wiederholen Sie die Schritte 3.1-3.4 einmal täglich für insgesamt 10 Tage (d. h. zwei aufeinanderfolgende 5-Tage-Arbeitswochen, getrennt durch ein 2-tägiges Wochenende).
4. Testen
HINWEIS: Die Testdauer beträgt 3-5 Tage (abhängig von der Zeit, die jede Maus benötigt, um die Lernkriterien zu erfüllen), fünf Studien pro Tag für die Sitzungen, in denen positive und negative Testversuche durchgeführt werden, und drei Studien pro Tag, wenn der mehrdeutige Test durchgeführt wird.
- Schnelle Mäuse für 1 Stunde vor dem Training / Test in ihrem Heimkäfig, indem Sie Lebensmittel aus dem Trichter entfernen.
- Führen Sie eine positive und eine negative Studie in randomisierter Reihenfolge (siehe Tabelle 1) durch, indem Sie die Anweisungen zur Einrichtung der Arena in Schritt 1.4 und die verstärkten Studienanweisungen in den Schritten 2.5-2.10 befolgen.
- Führen Sie einen videoaufgezeichneten, unverstärkten Testversuch durch.
HINWEIS: Die unverstärkten Prüfungen sind identisch mit den verstärkten Prüfungen, mit Ausnahme des Ortes, an dem die Belohnungen platziert werden. Daher wird im unverstärkten Versuch ein Stück jeder hochwertigen und minderwertigen Belohnung in das unzugängliche Fach sowohl für die duftenden als auch für die unparfümierten Töpfe gelegt.- Führen Sie täglich einen positiven oder negativen Testversuch für jede Maus durch, bis die Lernkriterien erfüllt sind (maximal 4 Tage; Lernkriterien werden in Schritt 4.7.3 beschrieben). Stellen Sie sicher, dass positive und negative Testversuche in abwechselnder Reihenfolge über Tage hinweg durchgeführt werden (z. B. Tag 1: positiver Test, Tag 2: negativer Test, Tag 3: positiver Test usw.).
- Befolgen Sie die Anweisungen zur Einrichtung der Arena in Schritt 1.4.
- Bewegen Sie Mäuse aus dem Transportkäfig in das Startfach der Arena. Stellen Sie eine Videokamera auf einem Stativ auf, so dass beide Töpfe an den Enden der Arme sichtbar sind, und starten Sie die Aufnahme. Stellen Sie sicher, dass die Cue-Karte mit dem Jalousiecode des Tieres und dem Versuchstyp (positiver Test oder negativer Test) im Video aufgezeichnet wird (als Referenz während der Videobewertung).
- Entfernen Sie die Start-"Tür", senken Sie sofort den Plexiglasdeckel über der Arena und starten Sie den 2-minütigen Testtimer.
- Wenn der Prozess beendet ist, stoppen Sie die Aufnahme, bewegen Sie die Kamera zur Seite, heben Sie den Plexiglasdeckel an, bewegen Sie die Maus zurück zu ihrem Transportkäfig.
- Entsorgen Sie alle Maiskolbenbettwäsche und Leckereien, die in den Töpfen übrig geblieben sind. Decken Sie die Gewebekassetten und werfen Sie Baumwollstücke weg. Wischen Sie alle Komponenten der Arena, der Grabtöpfe und Duftspender gründlich mit 70% Ethanol ab.
- Führen Sie eine positive und eine negative Studie in randomisierter Reihenfolge (siehe Tabelle 1) durch, indem Sie die Anweisungen zur Einrichtung der Arena in Schritt 1.4 und die verstärkten Studienanweisungen in den Schritten 2.5-2.10 befolgen.
- Geben Sie den Transportkäfig an den Forschungsassistenten zurück, damit die Mäuse wieder in ihren Heimkäfig gebracht werden können.
- Sobald alle Mäuse ihre fünf täglichen Tests abgeschlossen haben, übertragen Sie Videos von der Speicherkarte der Kamera auf einen Computer, um sie zu vertonen.
- Bewerten Sie positive und negative Testtestvideos am Tag des Tests, um zu beurteilen, ob Mäuse die Lernkriterien erfüllt haben. Stellen Sie sicher, dass das Video-Scoring am selben Tag durchgeführt wird, da Tiere, die Lernkriterien erfüllen, am nächsten Tag mehrdeutigen Tests unterzogen werden.
- Lassen Sie den Forscher, der für die Behandlung blind ist, mithilfe einer Ereignisaufzeichnungssoftware oder einer Stoppuhr die Latenz jeder Maus aufzeichnen, um in jedem Topf während der ersten Minute positiver und negativer Testversuche zu graben und zu graben.
- Zeichnen Sie die Latenz zum Graben als den Zeitpunkt auf, zu dem das erste Auftreten des Grabens beobachtet wird. Graben wird als Maus beschrieben, die aktiv Maiskolbeneinstreu mit den Vorderpfoten und / oder der Schnauze schiebt oder manipuliert. Notieren Sie die Grabungsdauer als die Gesamtzeit, die eine Maus mit dem Graben verbringt.
- Vergleichen Sie die Grabungsdauer im duftenden Arm zwischen positiven (DS+) und negativen (DS-) Versuchen für jede Maus, um festzustellen, ob Tiere die Aufgabe unterscheiden können. Betrachten Sie das Lernkriterium als erfüllt, wenn die Grabdauer im DS+-Duftarm während der ersten Testminute mindestens doppelt so lang ist wie die des DS+-Duftarms (mit einer Mindestgrabdauer von 3 s).
- Wiederholen Sie die Schritte 4.1-4.7 täglich, bis die Mäuse das Lernkriterium erfüllt haben.
- Schließen Sie Personen, die das Kriterium bis Tag 4 nicht erfüllt haben, von mehrdeutigen Studien (und damit von der Beurteilung der Urteilsverzerrung) aus.
- Testen Sie bei Mäusen, die die Lernkriterien erfüllt haben, die Reaktionen auf die mehrdeutige Geruchsmischung.
- Schnelle Mäuse für 1 Stunde vor dem Training / Test in ihrem Heimkäfig, indem Sie Lebensmittel aus dem Trichter entfernen.
- Führen Sie eine positive und eine negative verstärkte Studie in einer randomisierten Reihenfolge durch, indem Sie die Anweisungen zur Einrichtung der Arena in den Schritten 1.4 und die Anweisungen für die verstärkte Studie in den Schritten 2.5-2.10 befolgen.
- Führen Sie einen videoaufgezeichneten, unverstärkten Testversuch durch, wie in Schritt 4.3 beschrieben, unter Verwendung der mehrdeutigen Geruchsmischung (siehe Tabelle 2).
- Bewerten Sie mehrdeutige Prozessvideos, um die Verzerrung von Urteilen zu beurteilen.
- Lassen Sie einen Forscher, der für Tier-ID blind ist, mithilfe einer Ereignisaufzeichnungssoftware oder einer Stoppuhr die Latenz jeder Maus zum Graben (siehe Schritt 4.7.2) in jedem Topf während der ersten 1 Minute und 2 Minuten der Testversuche aufzeichnen.
5. Datenanalyse
HINWEIS: Die genauen erforderlichen Analysen hängen von den Details des Versuchsplans ab. Ein allgemeiner Überblick wird hier skizziert, aber den Forschern wird dringend empfohlen, sich bei der Planung von Analysen für Tier-JB-Experimente auf Gygax22 und bei der Auswahl der Stichprobengröße auf Gaskill und Garner23 zu beziehen (da erforderliche Analysen für A-priori-Potenzanalysen oft zu komplex sind).
- "Entblinden" Sie den Forscher, indem Sie die entsprechenden Tierausweis- und Behandlungsinformationen (z. B. angereicherte oder konventionelle Unterbringung; Medikament oder Placebo usw.) für jeden blinden Code in die Tabelle aufnehmen. Stellen Sie sicher, dass die resultierende Tabelle drei Zeilen für jedes Tier enthält, das die Lernkriterien erfüllt hat (d. h. für die positiven, negativen und mehrdeutigen Testversuche), die Latenzen zum Graben im duftenden Arm angeben.
- Führen Sie ein verallgemeinertes lineares gemischtes Modell mit wiederholten Messungen unter Verwendung bevorzugter statistischer Software aus. Hier ist die Ergebnisvariable die Latenz zum Graben. Stellen Sie sicher, dass das Modell die Behandlung (oder eine kontinuierliche Variable von Interesse), den Studientyp und die Interaktion "Behandlung x Studientyp" als feste Effekte enthält. Fügen Sie die Maus-ID (verschachtelt innerhalb der Behandlung) als zufälligen Effekt hinzu. Zusätzliche Begriffe, die im Modell enthalten sind, hängen vom verwendeten Versuchsdesign ab.
HINWEIS: Wenn Mäuse in Gruppen untergebracht sind (wie es für diese soziale Spezies24 angemessen ist) und Käfigpartner getestet werden, muss der Käfig, der während der Behandlung verschachtelt ist (falls vorhanden), als zufälliger Effekt in das Modell aufgenommen werden (und die Maus-ID muss anschließend im Käfig verschachtelt werden). - Zeichnen Sie die am wenigsten quadratischen Latenzmittel in jedem Versuchstyp auf, um zu bestätigen, dass der angegebene mehrdeutige Hinweis als Zwischenwert interpretiert wurde (d. h. die Schätzung der Latenz am kleinsten Quadrat für die mehrdeutige Studie sollte in der Mitte zwischen der positiven und der negativen Latenz liegen). Bewerten Sie die Maus-JB nur, wenn diese Anforderung erfüllt ist.
- Bewerten Sie den einfachen Effekt der Behandlung (oder einer kontinuierlichen Variablen von Interesse) auf die Latenz, um die mehrdeutige Studie zu untersuchen, indem Sie die Interaktion mit dem Behandlungstyp x untersuchen, um festzustellen, ob Mäuse eine ektmodulierte JB aufweisen.
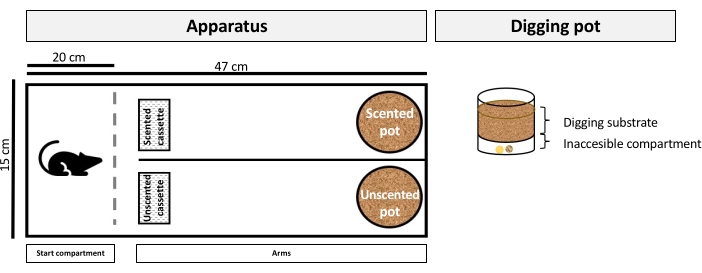
Abbildung 1: Diagramm der Versuchsapparatur. Der JB-Apparat umfasst eine rechteckige Arena mit zwei Armen. Jeder Arm enthält einen Duftspender am Anfang und einen Grabtopf am Ende. Nachdruck von Resasco et al.19 mit Genehmigung von Elsevier. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Phase: | Experimentelles Design | |
| Alle | Hochwertige Belohnung | Bananenchip |
| Belohnung mit geringem Wert | Nagetier-Chow | |
| DS+ | Minze oder Vanille (Gegengewicht) | |
| DS- | Minze oder Vanille (Gegengewicht) | |
| Grabungstraining | Grabungs-Trainingsplan | 5 Tage: 2 Pos Tests/Tag |
| Dauer des Digging-Versuchs | 5 Minuten | |
| Diskriminierungstraining | Schulungsplan für Diskriminierung | 10 Tage: 4 Testversionen/Tag |
| Graben von Probereihenfolge | Tage 1-5: 4 Versuche/Tag | |
| Versuch 1: Pos | ||
| Versuch 2: Neg | ||
| Versuch 3: Pos | ||
| Versuch 4: Neg | ||
| Tage 6-10: 4 Versuche/Tag* | ||
| Dauer des Diskriminierungsverfahrens | 5 Minuten | |
| Testen | Testzeitplan | 3-5 Tage (abhängig von der Zeit, um die Lernkriterien zu erfüllen) |
| 5 Testversionen/Tag | ||
| Reihenfolge der Testphase | Versuche 1 und 2: Pos oder Neg** | |
| Versuch 3: Testversuch | ||
| Versuche 4 und 5: Pos oder Neg** | ||
| Dauer der Testversion | 2 min | |
| * Die Studien waren pseudorandomisiert, so dass Mäuse immer zwei Pos- und zwei Neg-Studien pro Tag hatten. | ||
| ** Die Studien waren pseudorandomisiert, so dass Mäuse vor und nach der Teststudie immer eine Pos- und eine Neg-Studie hatten | ||
Tabelle 1: Zusammenfassung des Versuchsplans und Zeitplan für Training und Tests. Anzahl und Reihenfolge der Versuche pro Tag für die Phasen Digging Training, Discrimination Training und Testing zusätzlich zu experimentellen Designdetails. Nachdruck von Resasco et al.19 mit Genehmigung von Elsevier.
| Details zur Testversion | |||||||
| Phase | Art der Testversion | Duftarm | Unparfümierter Arm | ||||
| Geruchs-Queue | Vergrabene Belohnung | Unzugängliche Belohnung | Geruchs-Queue | Vergrabene Belohnung | Unzugängliche Belohnung | ||
| Grabungs- und Diskriminierungstraining | Pos-Schulung | DS+ | Banane | Futter | Wasser | Futter | Banane |
| Neg-Training | DS- | Keine Belohnung | Banane + Chow | Wasser | Futter | Banane | |
| Testen | Pos-Test | DS+ | Keine Belohnung | Banane + Chow | Wasser | Keine Belohnung | Banane + Chow |
| Neg-Test | DS- | Keine Belohnung | Banane + Chow | Wasser | Keine Belohnung | Banane + Chow | |
| Mehrdeutiger Test | Münze/ Vanillemischung | Keine Belohnung | Banane + Chow | Wasser | Keine Belohnung | Banane + Chow | |
| Lernkriterium | Mäuse müssen im DS+ Topf doppelt so lange graben (Pos-Test) wie im DS-Topf (Neg-Test) und mindestens 3 s graben | ||||||
Tabelle 2. Zusammenfassung der Studiendetails. Geruchshinweise und Belohnungen, die in jedem Versuchstyp während der Phasen Digging Training, Discrimination Training und Testing präsentiert werden. DS(+): positiver diskriminierender Reiz, DS(-): negativer diskriminierender Reiz, Pos: positiv, Neg: negativ. Nachdruck von Resasco et al.19 mit Genehmigung von Elsevier. Siehe Zusatztabelle S2 im Originalartikel für die erweiterte Tabelle.
Ergebnisse
Die hier vorgestellten Ergebnisse spiegeln relevante Ergebnisse aus Experiment 1 von Resasco et al.19 wider. Probanden in diesem Experiment waren 18 weibliche C57BL/6NCrl ('C57') und 18 Balb/cAnNCrl ('Balb') Mäuse. Die Tiere kamen im Alter von 3-4 Wochen in die Einrichtung und wurden nach dem Zufallsprinzip in gemischten Stammquartetten25 umweltangereicherten oder konventionellen Haltungsbehandlungen (EH bzw. CH) zugeteilt. Jeder Käfig enthielt einen C57 und einen Balb, z...
Diskussion
Das duftbasierte Grabprotokoll und die hier beschriebenen Ergebnisse demonstrieren die Fähigkeit dieser neuartigen JB-Aufgabe, Veränderungen im affektiven Zustand der Maus zu erkennen. Die Aufgabe stellt somit ein wertvolles Werkzeug für verschiedene Forschungsfelder dar. Ähnlich wie bei jeder JB-Aufgabe ist es bei der Beurteilung des Tiereffekts entscheidend, dass Tiere zunächst lernen, zwischen Hinweisen zu unterscheiden (Schritt 4.7.3) und dass der mehrdeutige Reiz als Zwischenstufe interpretiert wird (Schritt 5....
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren danken Miguel Ayala, Lindsey Kitchenham, Dr. Michelle Edwards, Sylvia Lam und Stephanie Dejardin für ihre Beiträge zur Validierungsarbeit von Reseasco et al.19, auf der dieses Protokoll basiert. Wir möchten uns auch bei den Mäusen und unseren wunderbaren Tierpflegetechnikern Michaela Randall und Michelle Cieplak bedanken.
Materialien
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Commercial alcohol | P016EAAN | Dilute to 70% with distilled water, for cleaning |
| Centrifuge tubes | Fischer | 55395 | 15 mL tubes used to dilute essences here. However, size may be selected based on total volume required for sample size |
| Cheerios (original) | Cheerios | N/A | Commercially available. Used as reward to train animals to enter annex cage for handling |
| Corncob bedding | Envigo | 7092 | Teklad 1/8 corncob bedding used in digging pots and animal cages |
| Cotton pads | Equate | N/A | Commercially available. Modified in lab to fit within tissue cassettes for scent dispensing |
| Digging pots | Rubbermaid | N/A | Commercially available. Containers were modified to fit the apparatus in the lab |
| Dried, sweetened banana chips | Stock and Barrel | N/A | Commercially available. High value reward in JB task |
| JB apparatus | N/A | The apparatus was made in the lab | |
| JWatcher event recording software | Animal Behavior Laboratory, Macquarie University | Version 1.0 | Freely available for download online. Used to score digging behavior during JB task |
| Mint extract | Fleibor | N/A | Commercially "Menta (Solución)". Discriminative stimulus odor |
| Rodent Diet | Envigo | 2914 | Teklad global 14% protein rodent maintenance diets. Low value reward in JB task and regular diet in home cage |
| SAS statistical software | SAS | Version 9.4 | Other comparable software programs (e.g. R) are also appropriate |
| Vanilla extract | Fleibor | Commercially available "Vainilla (Solución)". Discriminative stimulus odor | |
| Video camera | Sony | DCR-SX22 | Sony handycam. |
Referenzen
- Mathews, A., MacLeod, C. Cognitive vulnerability to emotional disorders. Annual Review of Clinical Psychology. 1, 167-195 (2005).
- Mathews, A., MacLeod, C. Cognitive approaches to emotions. Anual Review of Psychology. 45 (1), 25-50 (1994).
- Blanchette, I., Richards, A. The influence of affect on higher level cognition: A review of research on interpretation, judgement, decision making and reasoning. Cognition and Emotion. 24 (4), 561-595 (2010).
- MacLeod, C., Cohen, I. L. Anxiety and the interpretation of ambiguity: A text comprehension study. Journal of Abnormal Psychology. 102 (2), 238-247 (1993).
- Everaert, J., Podina, I. R., Koster, E. H. W. A comprehensive meta-analysis of interpretation biases in depression. Clinical Psychology Review. 58, 33-48 (2017).
- Haselton, M. G., Nettle, D. The paranoid optimist: An integrative evolutionary model of cognitive biases. Personality and Social Psychology Review. 10 (1), 47-66 (2006).
- Mendl, M., Paul, E. Getting to the heart of animal welfare. The study of animal emotion. Stichting Animales. , (2017).
- Harding, E. J., Paul, E. S., Mendl, M. Cognitive bias and affective state. Nature. 427 (6972), 312 (2004).
- Douglas, C., Bateson, M., Walsh, C., Bédué, A., Edwards, S. A. Environmental enrichment induces optimistic cognitive biases in pigs. Applied Animal Behaviour Science. 139 (1-2), 65-73 (2012).
- Paul, E. S., Harding, E. J., Mendl, M. Measuring emotional processes in animals: The utility of a cognitive approach. Neuroscience and Biobehavioral Reviews. 29 (3), 469-491 (2005).
- Mendl, M., Burman, O. H. P., Parker, R. M. A., Paul, E. S. Cognitive bias as an indicator of animal emotion and welfare: Emerging evidence and underlying mechanisms. Applied Animal Behaviour Science. 118 (3-4), 161-181 (2009).
- Rygula, R., Pluta, H., Popik, P. Laughing rats are optimistic. PLoS ONE. 7 (12), 51959 (2012).
- Boissy, A., et al. Assessment of positive emotions in animals to improve their welfare. Physiology and Behavior. 92 (3), 375-397 (2007).
- Ross, M., Garland, A., Harlander-Matauschek, A., Kitchenham, L., Mason, G. Welfare-improving enrichments greatly reduce hens' startle responses, despite little change in judgment bias. Scientific Reports. 9 (1), 1-14 (2019).
- Lagisz, M., et al. Optimism, pessimism and judgement bias in animals: A systematic review and meta-analysis. Neuroscience and Biobehavioral Reviews. 118, 3-17 (2020).
- . Canadian Council on Animal Care CCAC Animal Data Report 2019 Available from: https://ccac.ca/Documents/AUD/2019-Animal-Data-Report.pdf (2019)
- Report From the Commission to the European Parlaiment and the Council. European Commission Available from: https://eur-lex.europa.eu/legal-content/EN/TXT/HTML/?uri=CELEX:52020DC0016&from=EN (2020)
- Cryan, J. F., Holmes, A. Model organisms: The ascent of mouse: Advances in modelling human depression and anxiety. Nature Reviews Drug Discovery. 4 (9), 775-790 (2005).
- Resasco, A., et al. Cancer blues? A promising judgment bias task indicates pessimism in nude mice with tumors. Physiology and Behavior. 238, 113465 (2021).
- Percie du Sert, N., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. Journal of Cerebral Blood Flow and Metabolism. 40 (9), 1769-1777 (2020).
- Gouveia, K., Hurst, J. L. Optimising reliability of mouse performance in behavioural testing: The major role of non-aversive handling. Scientific Reports. 7, 44999 (2017).
- Gygax, L. The A to Z of statistics for testing cognitive judgement bias. Animal Behaviour. 95, 59-69 (2014).
- Gaskill, B. N., Garner, J. P. Power to the people: Power, negative results and sample size. Journal of the American Association for Laboratory Animal Science: JAALAS. 59 (1), 9-16 (2020).
- MacLellan, A., Adcock, A., Mason, G. Behavioral biology of mice. Behavioral Biology of Lab Animals. , 89-111 (2021).
- Walker, M., et al. Mixed-strain housing for female C57BL/6, DBA/2, and BALB/c mice: Validating a split-plot design that promotes refinement and reduction. BMC Medical Research Methodology. 16 (11), (2016).
- Weber, E. M., Dallaire, J. A., Gaskill, B. N., Pritchett-Corning, K. R., Garner, J. P. Aggression in group-housed laboratory mice: Why can't we solve the problem. Lab Animal. 46 (4), 157-161 (2017).
- Nip, E., et al. Why are enriched mice nice Investigating how environmental enrichment reduces agonism in female C57BL / 6, DBA / 2, and BALB / c mice. Applied Animal Behaviour Science. 217, 73-82 (2019).
- Tilly, S. C., Dallaire, J., Mason, G. J. Middle-aged mice with enrichment-resistant stereotypic behaviour show reduced motivation for enrichment. Animal Behaviour. 80 (3), 363-373 (2010).
- Fureix, C., et al. Stereotypic behaviour in standard non-enriched cages is an alternative to depression-like responses in C57BL/6 mice. Behavioural Brain Research. 305, 186-190 (2016).
- Nip, E. . The long-term effects of environmental enrichment on agonism in female C57BL/6, BALB/c, and DBA/2 mice. Thesis Dissertation. , (2018).
- Wei, J., Carroll, R. J., Harden, K. K., Wu, G. Comparisons of treatment means when factors do not interact in two-factorial studies. Amino Acids. 42 (5), 2031-2035 (2012).
- Ruxton, G. D., Neuhäuser, M. When should we use one-tailed hypothesis testing. Methods in Ecology and Evolution. 1 (2), 114-117 (2010).
- Young, J. W., et al. The odour span task: A novel paradigm for assessing working memory in mice. Neuropharmacology. 52 (2), 634-645 (2007).
- Latham, N., Mason, G. From house mouse to mouse house: The behavioural biology of free-living Mus musculus and its implications in the laboratory. Applied Animal Behaviour Science. 86 (3-4), 261-289 (2004).
- Jones, S., et al. Assessing animal affect: an automated and self-initiated judgement bias task based on natural investigative behaviour. Scientific Reports. 8 (1), 12400 (2018).
- Novak, J., et al. Effects of stereotypic behaviour and chronic mild stress on judgement bias in laboratory mice. Applied Animal Behaviour Science. 174, 162-172 (2016).
- Krakenberg, V., von Kortzfleisch, V. T., Kaiser, S., Sachser, N., Richter, S. H. Differential effects of serotonin transporter genotype on anxiety-like behavior and cognitive judgment bias in mice. Frontiers in Behavioral Neuroscience. 13, 263 (2019).
- Krakenberg, V., et al. Technology or ecology? New tools to assess cognitive judgement bias in mice. Behavioural Brain Research. 362, 279-287 (2019).
- Krakenberg, V., et al. Effects of different social experiences on emotional state in mice. Scientific Reports. 10, 15255 (2020).
- Bračić, M., Bohn, L., Krakenberg, V., Schielzeth, H., Kaiser, S. Once an optimist, always an optimist? Studying cognitive judgment bias in mice. EcoEvoRxiv. , (2021).
- Jones, S., Paul, E. S., Dayan, P., Robinson, E. S. J., Mendl, M. Pavlovian influences on learning differ between rats and mice in a counter-balanced Go/NoGo judgement bias task. Behavioural Brain Research. 331, 214-224 (2017).
- Roelofs, S., Boleij, H., Nordquist, R. E., vander Staay, F. J. Making decisions under ambiguity: Judgment bias tasks for assessing emotional state in animals. Frontiers in Behavioral Neuroscience. 10 (119), 1-16 (2016).
- Sherwin, C. M., Haug, E., Terkelsen, N., Vadgama, M. Studies on the motivation for burrowing by laboratory mice. Applied Animal Behaviour Science. 88 (3-4), 343-358 (2004).
- Deacon, R. M. J. Burrowing: A sensitive behavioural assay, tested in five species of laboratory rodents. Behavioural Brain Research. 200 (1), 128-133 (2009).
- MacDougall-Shackleton, S. A., Bonier, F., Romero, L. M., Moore, I. T. Glucocorticoids and "stress" are not synonymous. Integrative Organismal Biology. 1 (1), 1-8 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten