Method Article
Ein menschliches Hornhautorgan-Kulturmodell des Descemet-Strippings nur mit beschleunigter Heilung, stimuliert durch den künstlichen Fibroblasten-Wachstumsfaktor 1
In diesem Artikel
Zusammenfassung
Descemet's Stripping Only ist ein experimentelles Verfahren, bei dem Patienten mit zentralen Hornhautguttae, die aus Fuchs Endothelial Corneal Dystrophy resultieren, Descemets Membran für periphere Zellen abgestreift haben, um die Endothelschicht zu regenerieren. Wir stellen eine neuartige Methodik vor, die DSO in dystrophischen menschlichen Hornhäuten ex vivo mit beschleunigter Heilung simuliert, die durch eFGF1 (NM141) stimuliert wird.
Zusammenfassung
Fuchs Endotheliale Hornhautdystrophie (FECD) resultiert aus dysfunktionalen Hornhautendothelzellen (CECs) und wird derzeit durch Transplantation der gesamten Hornhaut oder Descemet-Membran behandelt. Jüngste Entwicklungen in der Augenchirurgie haben Descemets Stripping Only (DSO) etabliert, eine chirurgische Technik, bei der ein zentraler Kreis der guttadichten Descemet-Membran entfernt wird, um die Migration von CECs auf das glatte Stroma zu ermöglichen und Funktion und Sehvermögen der Hornhaut wiederherzustellen. Während diese potenzielle Behandlungsoption im Bereich der augenärztlichen Forschung von großem Interesse ist, wurden keine erfolgreichen Ex-vivo-Modelle von DSO etabliert und die klinischen Daten sind begrenzt. Diese Arbeit präsentiert ein neuartiges Wundheilungsmodell, das DSO in menschlichen Spenderhornhäuten simuliert. Mit diesem Ansatz zur Bewertung der Wirksamkeit des vom Menschen hergestellten FGF1 (NM141) fanden wir heraus, dass die Behandlung die Heilung durch Stimulation der Migration und Proliferation von CECs beschleunigte. Dieser Befund wurde bei 11 Paaren menschlicher Hornhäute mit Anzeichen von Dystrophie bestätigt, die von den Augenbanken gemeldet wurden, um zu überprüfen, ob diese Ergebnisse bei Patienten mit Fuchs-Dystrophie als Zielpopulation des DSO-Verfahrens repliziert werden können.
Einleitung
Die Fuchs-Endothel-Hornhautdystrophie (FECD) ist eine Erkrankung, die durch einen Verlust der Pumpfunktion in Hornhautendothelzellen (CECs) und den übermäßigen Aufbau von Kollagen und anderen extrazellulären Matrixproteinen auf der Oberfläche der Descemet-Membran gekennzeichnet ist und Hornhautgutta1 bildet. Die einzige bekannte Behandlung für FECD ist die endotheliale Keratoplastik in verschiedenen Formen, die alle mit dem Risiko einer Abstoßung und des Verlusts von Endothelzellen verbundensind 2. Während Fortschritte in der Augenchirurgie es diesen Verfahren ermöglicht haben, im Laufe der Zeit weniger invasiv zu werden, birgt jede Form der Transplantation das Risiko einer Abstoßung und die Möglichkeit der lebenslangen Verwendung von Steroiden, einer Behandlung mit ihren eigenen begleitenden unerwünschten Ereignissen. Darüber hinaus ist der weltweite Mangel an Spendergewebe so groß, dass nur eine Spenderhornhaut pro 70 bedürftige Patienten verfügbarist 3. Angesichts dieser Herausforderungen erforschen Forscher und Kliniker chirurgische Methoden, die den Bedarf an Spendergewebe vollständig vermeiden. Eine dieser experimentellen Techniken ist Descemet's Stripping Only (DSO) oder Descemetorhexis ohne Endothelkeratoplastik (DWEK), bei der FECD-Patienten mit Guttae, die in der Mitte der Hornhaut lokalisiert sind, einen zentralen 4-mm-Kreis der Descemet-Membran ohne Transplantatplatzierung abgestreift haben. Die Entfernung von Gutta ermutigt gesunde periphere Zellen, nach innen zu wandern und die endotheliale Monoschicht zu reformieren, wodurch das Stromaödem schließlich umgekehrt und das Sehvermögen verbessert wird. Das Konzept wurde ursprünglich in einer Reihe von Fallstudien beschrieben, in denen sich Patienten einer Operation unterzogen, die durch das Ablösen der Descemet-Membran kompliziert wurde, aber die CEC-Repopulationimmer noch 4,5,6,7 auftrat. Obwohl es viele Vorteile für diese Methode gibt, ist der Heilungsprozess langwierig und inkonsistent, da einige Patienten eine Rettungstransplantation benötigen, wenn in den Monaten nach der Operation keine Heilung beobachtetwird 8. Aus diesen Gründen kann ein Medikament, das eine schnellere Migration und Proliferation von CECs stimuliert, für den Genesungsprozess von FECD-Patienten, die sich DSO unterzogen haben, von Vorteil sein.
Mehrere neuere Studien haben ROCK-Inhibitoren als ergänzende Behandlung für Patienten, die sich einer DSO unterziehen, bewertet und festgestellt, dass sich die behandelten Patienten schneller erholten und höhere zentrale Endothelzelldichten (ECD) aufwiesen als diejenigen in der DSO-Gruppe 9,10,11. Aufgrund der geringen Stichprobengrößen und der Unterschiede zwischen den Dosierungsschemata sind jedoch mehr Daten erforderlich, um die Wirksamkeit von ROCK-Inhibitoren in diesem Umfeld besser zu verstehen.
Es wurde auch gezeigt, dass Fibroblastenwachstumsfaktoren die Regeneration des Hornhautendothels sowohl in vitro mit Rinder-CECs als auch in vivo in katzenartigen Hornhäutenstimulieren 12,13. eFGF1 (NM141) ist eine technische Version von FGF-1, die mehrere Aminosäuresubstitutionen zur Stabilisierung des Moleküls enthält, im Gegensatz zum nativen FGF-1, das eine viel kürzere Halbwertszeitvon 14,15 hat. Wir haben bereits die Fähigkeit von eFGF1 (NM141) gezeigt, die Proliferation von CECs ex vivo in geviertelten menschlichen Hornhäutenzu stimulieren 16. Diese Studie versuchte, diese Arbeit zu verbessern, indem sie das erste erfolgreiche Ex-vivo-Modell von DSO sowohl in normalen als auch in dystrophischen Hornhäuten etablierte, um festzustellen, ob Zusatzbehandlungen wie eFGF1 (NM141) die Heilung in dieser Anwendung beschleunigen.
Protokoll
Diese Arbeit verwendete vorhandene Proben ohne Identifizierung von Probanden und ist von der IRB-Zulassung gemäß 45 CFR 46.101 (b) (4) ausgenommen.
Menschliche Spenderhornhäute wurden aus verschiedenen Augenbanken in den USA gewonnen (siehe Tabelle der Materialien). Hornhäute wurden von den Augenbanken individuell als dystrophisch beurteilt, basierend auf Befunden wie Guttae, Pleomorphismus, Polymegathimus und / oder niedrigem ECD bei spiegelnder Bewertung. Abbildung 1 zeigt die Trypan Blue-Färbung in der Hornhaut während der Wundbildung, unmittelbar nach dem Abstreifen und nach 2 Wochen in Kultur.
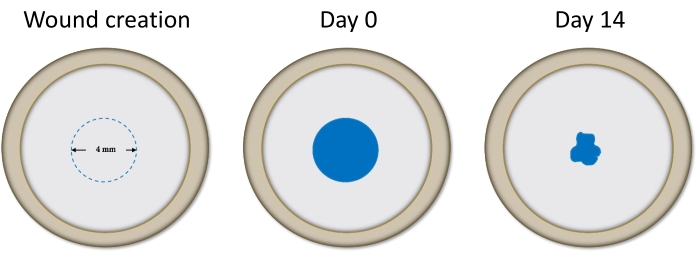
Abbildung 1: Diagramm, das die Hornhaut während der Wundbildung, unmittelbar nach dem Stripping und nach 14 Tagen in Kultur darstellt, wie von Trypan Blue visualisiert. Die Verringerung der gefärbten Fläche zwischen diesen Zeitpunkten wurde gemessen, um den Grad der Heilung zu bestimmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
1. Wundbildung
- Entfernen Sie mit einer sterilen Pinzette die Hornhaut aus dem Medium und spülen Sie sie in 1x PBS ab, um Medienreste und Zellablagerungen zu entfernen. Nach dem Spülen die Hornhaut-Endothelseite nach oben auf den Deckel einer Petrischale legen.
- Pipette 30 μL Trypan Blue in ein gewelltes Gericht. Tauchen Sie einen neuen 4-mm-Biopsie-Stempel in Trypan Blue und tippen Sie auf einen Überschuss.
- Positionieren Sie den Schlag mit beiden Händen über der Mitte der Hornhaut und senken Sie ihn unter minimalem Druck gerade auf die Endotheloberfläche.
- Ohne die Position oder den Druck auf die Hornhaut zu ändern, schieben Sie den Schlag auf eine Hand und greifen Sie mit der neu befreiten Hand nach einer Pinzette. Verwenden Sie die Pinzette, um die Hornhaut an Ort und Stelle zu halten, während Sie den Biopsiestempel mehrmals um etwa 90 ° hin und her drehen.
- Heben Sie den Schlag gerade von der Hornhaut nach oben und legen Sie ihn beiseite.
- Noch einmal in 1x PBS abspülen, um überschüssiges Trypan Blue zu entfernen.
2. Descemets
- Hornhaut auf einen Petrischaledeckel in ein Sezierfernrohr überführen.
HINWEIS: Hornhaut nicht länger als 5 min trocken lassen. Wenn mehr Zeit benötigt wird, um den Prozess abzuschließen, spülen Sie erneut in 1x PBS, um das Endothel zu rehydrieren. - Halten Sie die Hornhaut mit einer gekrümmten Pinzette an Ort und Stelle und erzielen Sie Descemets Membran, indem Sie die Spitze einer scharfen 30-G-Nadel leicht entlang des Rings von Trypan Blue ziehen, der vom Biopsieschlag hinterlassen wurde. Verwenden Sie minimalen Druck, um zu vermeiden, dass das darunter liegende Stroma gestört wird.
- Verwenden Sie mit einem Sinskey-Haken sanfte Schöpfbewegungen, um die Membran von Descemet um den Wundrand herum anzuheben und abzuziehen und in Richtung der Mitte der Läsion zu arbeiten.
HINWEIS: Die Membran von Descemet sollte sehr wenig Widerstand leisten. Wenn Schwierigkeiten auftreten, zieht man wahrscheinlich Stroma hoch. Wenn dies geschieht, beginnen Sie erneut und heben Sie von einem neuen Punkt entlang der Wundkante an. - Sobald der Großteil der Descemet-Membran vom Stroma getrennt wurde, verwenden Sie die Gorovoy-Pinzette, um die Membran zu entfernen und beiseite zu legen.
- Untersuchen Sie den abgestreiften Bereich auf verbleibende Membranstücke und entfernen Sie sie mit einer Gorovoy-Pinzette.
3. Trypan Blue Färbung
HINWEIS: Färben Sie nach Descemets Stripping die Hornhaut mit Trypan Blue, um den Wundbereich sichtbar zu machen.
- Geben Sie die Hornhaut auf einem Petrischalendeckel in die Biosicherheitskabine zurück und spülen Sie sie in 1x PBS mit 0,01% (w/v) CaCl 2 und MgCl2 ab, um Zellablagerungen zu entfernen und eine enge Haftung der verbleibenden CECs an der intakten Descemet-Membran zu erleichtern.
- Hornhaut in eine gewellte Schale geben und 30 μL Trypan Blue für 30 s auf die Endothelschicht pipettieren.
- Verwenden Sie eine Pinzette, um die Hornhaut sanft zu schaukeln, um sicherzustellen, dass die gesamte Endotheloberfläche bedeckt ist.
- Spülen Sie überschüssiges Trypan Blue in 1x PBS mit 0,01% (w / v) CaCl 2 und MgCl2 ab und stellen Sie die gefärbte Hornhaut unter einem Seziermikroskop für den Tag 0-Zeitpunkt ab.
- Stellen Sie sicher, dass die Hornhaut so ausbalanciert ist, dass das Licht gleichmäßig durchgelassen wird und die Positionierung über Zeitpunkte hinweg replizierbar ist.
HINWEIS: Pinzetten können verwendet werden, um Hornhaut während der Bildgebung an Ort und Stelle zu halten, falls erforderlich.
- Stellen Sie sicher, dass die Hornhaut so ausbalanciert ist, dass das Licht gleichmäßig durchgelassen wird und die Positionierung über Zeitpunkte hinweg replizierbar ist.
4. Kulturperiode
- Kulturhornhäute in einer Six-Well-Platte mit serumarmen Medien, bestehend aus OptiMEM; 1x Insulin, Transferrin und Selen; 1x Antibiotikum/Antimykotikum; 0,02 mg/ml CaCl2; 0,2 mg/ml Ascorbinsäure; und 0,8% hitzeinaktiviertes fetales Rinderserum. Kultur der linken Hornhaut in 8 ml serumarmem Medium allein und die rechte Hornhaut in 8 ml serumarmem Medium, ergänzt mit 100 ng/ml eFGF1 (NM141).
- Inkubieren bei 37 °C mit 6% CO2 für 14 Tage mit täglichem Medienwechsel.
- Wiederholen Sie den Trypan Blue-Färbevorgang an den Tagen 3, 6, 9, 12 und 14 und stellen Sie jede Hornhaut unmittelbar nach der Färbung ab. Achten Sie darauf, dass die Kameraeinstellungen über alle Zeitpunkte hinweg konsistent bleiben.
- Geben Sie am 12. Tag 10 μM EdU in die Kontroll- und eFGF1 (NM141)-supplementierten Medien und inkubieren Sie sie 48 h lang, um die sich ausbreitenden Zellen zu markieren. Erneuern Sie Medien mit EdU, das am Tag 13 erneut hinzugefügt wurde.
- Am Tag 14, 48 h nach der Zugabe von EdU, Trypan-Flecken und Bildhornhäuten wie üblich, außer anstelle von 1x PBS mit CaCl 2 und MgCl2, verwenden Sie einfaches 1x PBS für Spülungen, um zu verhindern, dass das Kalzium mit dem Alizarin Red Fleck interagiert.
5. Alizarin Rot Färbung
- Am Tag 14 bereiten Sie 5% Alizarin Red in 0,9% Salzlösung vor.
HINWEIS: Alizarin Red löst sich nicht vollständig in Kochsalzlösung auf. Beim Kombinieren Wirbellösung und Gestein für mindestens 1 h aufwirbeln. Noch einmal vorwirbeln und vor Gebrauch filtrieren, um ungelöste Partikel zu entfernen. - Sobald die Trypan-Färbung und Bildgebung abgeschlossen ist, übertragen Sie die Hornhaut auf eine gewellte Schale und fügen Sie 200 μL Alizarin Red zur Endotheloberfläche jeder Hornhaut hinzu.
- Färben Sie für 2 min, dann spülen Sie jede Hornhaut in einer Petrischale von 1x PBS, um überschüssiges Alizarin Red zu entfernen, bevor Sie es in eine Platte mit sechs Vertiefungen legen, die mit 8 ml 1x PBS für zwei 5-minütige Wäschen vorgefüllt ist.
- Stellen Sie sich nach der zweiten Wäsche den abgestreiften Bereich jeder Hornhaut unter einem Seziermikroskop vor.
HINWEIS: Im Gegensatz zur Trypan-Bildgebung können Hornhäute in 1x PBS belassen werden, um Alizarin-Färbungen abzubilden, um zu verhindern, dass sie während des Prozesses austrocknen.
6. Fixierung und Permeabilisierung
- Sobald Alizarin-Bilder aufgenommen wurden, übertragen Sie Hornhäute auf eine 12-Well-Platte und waschen Sie 4 ml 1x PBS mit 0,05% Tween-20 (PBS-T) für 30 Minuten, um Partikel aus dem Gewebe vor der Fixierung zu entfernen.
- Fixieren Sie Hornhäute in 4 ml 4% PFA für 30 min bei Raumtemperatur.
- Permeabilisieren Sie Zellen für 5 min in 4 ml von 1x PBS mit 1% Triton X-100, dann waschen Sie dreimal in 4 ml von einfachen 1x PBS für jeweils 30 Minuten.
7. Immunhistochemie
- Blockhornhäute für 1 h bei 37°C in 4 ml 1x PBS mit 2% Rinderserumalbumin und 2% Ziegenserum.
- Inkubieren Sie in 1 ml Blockierlösung mit 2,5 μg / ml primärem Antikörper-Maus-Anti-ZO-1 für 1 h bei 37 ° C, dann waschen Sie dreimal in 4 ml von 1x PBS für jeweils 30 Minuten.
HINWEIS: Die Platte kann während der Antikörperfärbung geneigt werden, um das Volumen der benötigten Reagenzien zu minimieren. Stellen Sie einfach sicher, dass die gesamte Hornhaut vollständig in Antikörperlösung eingetaucht ist. - Führen Sie die EdU Click-iT-Reaktion mit einem Cocktail durch, der 0,88 mg/ml Ascorbinsäure, 0,26 mg/ml CuSO4 und 2,5 μM Alexa Fluor 488 Azid enthält.
- Reaktionskomponenten vorbereiten
- Fügen Sie 500 μL 1x PBS zu 88 mg Ascorbinsäure und Vortex hinzu, bis sie aufgelöst sind.
- Fügen Sie 840 μL entionisiertes Wasser zu 44 mg CuSO4 hinzu und wirbeln Sie es auf, bis es gelöst ist.
- Bereiten Sie den Cocktail zu, indem Sie die folgenden Reagenzien zu 6 ml 1x PBS in dieser Reihenfolge hinzufügen, wobei das Invertierungsröhrchen nach jeder Zugabe gemischt wird: 30 μL Ascorbinsäurelösung, 30 μLCuSO4-Lösung und dann 15 μL Alexa Fluor 488
HINWEIS: Nach der Vorbereitung ist diese Lösung lichtempfindlich. Für den Rest des Protokolls sollten Hornhäute nach Möglichkeit vor Licht geschützt werden. - Fügen Sie 1 ml EdU-Reaktionscocktail zu jeder Hornhaut hinzu und reagieren Sie 1 h lang bei Raumtemperatur.
- Reaktionskomponenten vorbereiten
- Geben Sie 4 ml von 10 μg / ml Hoechst 33342 zu jeder Hornhaut und reagieren Sie für 2 min bei Raumtemperatur, dann waschen Sie dreimal in 1x PBS-T für jeweils 30 Minuten.
- Inkubieren Sie in 1 ml Blockierlösung mit 2 μg/ml Alexa Fluor 555 markiertem Ziegen-Anti-Maus-IgG für 1 h bei 37 ° C, dann waschen Sie dreimal in 1x PBS-T für jeweils 30 Minuten.
- Lagern Sie Hornhäute bei 4 ° C in 4 ml von 1x PBS mit 1% Anti / Anti, 0,1% Ciprofloxacin und 0,1% Amphotericin B, um mikrobielles Wachstum zu verhindern.
- Wenn Sie konfokale Bildgebung durchführen, montieren Sie ganze Hornhäute in 200 μL Montagemedium auf Glasobjektträgern mit Deckglas, die zum Abflachen abgeklebt sind.
8. Trypan Bildanalyse
- Führen Sie alle Bildanalysen mit der Open-Source-Software ImageJ von NIH durch. Öffnen Sie ein Bild mit Datei > Öffnen und klicken Sie auf Bild > > Farbschwellenwert anpassen.
- Verwenden Sie die Schieberegler "Farbton", um nur den blauen Bereich zu erfassen, und passen Sie den oberen Schieberegler "Helligkeit" ganz nach links an, um mehr von dem gefärbten Bereich einzubeziehen.
HINWEIS: Wenn diese Aktion dazu führt, dass Teile des Bildes, die nicht von Trypan gefärbt sind, enthalten sind, kann der Schieberegler "Helligkeit" auf sein ursprüngliches Niveau zurückgesetzt werden. - Passen Sie den oberen Schieberegler "Sättigung" langsam an, bis der Schwellenwert den gefärbten Bereich genau umreißt.
HINWEIS: Es ist hilfreich, eine Kopie des Originalbildes geöffnet zu haben, auf die Sie während dieses Vorgangs verweisen können. - Klicken Sie im Menü "Farbschwellenwert" auf die Schaltfläche "Auswählen" und verwenden Sie dann das Auswahlpinselwerkzeug, um die Auswahl von Bereichen außerhalb der Wunde, die aufgenommen wurden, aufzuheben.
- Klicken Sie auf Analysieren > Maßnahme , um den gefärbten Bereich in Pixeln zu melden.
- Deaktivieren Sie alle mit " > Auswahl bearbeiten " > Wählen Sie "Keine" und verwenden Sie das ovale Auswahlwerkzeug, um den Limbus so genau wie möglich anzupassen, und klicken Sie dann auf "Analysieren > Messen ", um den Bereich der Hornhaut in Pixeln anzugeben.
HINWEIS: Die Helligkeit kann vorübergehend erhöht werden, um die Visualisierung des Limbus zu erleichtern, wenn dieser Teil des Bildes zu dunkel ist. - Notieren Sie Flächenwerte und dividieren Sie die gefärbte Fläche durch die Fläche der gesamten Hornhaut, dann multiplizieren Sie mit 100, um den Prozentsatz der Färbung zu berechnen.
- Wiederholen Sie diesen Vorgang zwei weitere Male für jedes Bild und nehmen Sie dann den Durchschnitt der drei Messungen.
9. Statistische Analyse
- Nachdem alle Bilder analysiert wurden, dividieren Sie den durchschnittlichen Prozentsatz, der an Tag 14 gefärbt wurde, durch den am Tag 0 gefärbten Prozentsatz, um den verbleibenden nicht verheilten Bereich zu bestimmen. Subtrahieren Sie diesen Betrag von 100%, um den Prozentsatz der über 14 Tage geheilten abgestreiften Fläche zu berechnen.
- Verwenden Sie einen gepaarten t-Test, um die prozentual geheilten Werte zwischen Kontroll- und Behandlungsgruppen zu vergleichen.
Ergebnisse
Dieses Experiment wurde ursprünglich in 10 Paaren normaler Forschungshornhäute durchgeführt, da sie am leichtesten verfügbar sind. Nachdem sich die Methode als erfolgreich erwiesen hatte, wurde die Studie in 11 Paaren dystrophischer Hornhäute repliziert, die von Augenbanken auf der Grundlage einer spiegelnden Bewertung als solche gekennzeichnet wurden, um die Auswirkungen von eFGF1 (NM141) in Hornhäuten zu untersuchen, die für die FECD-Patientenpopulation repräsentativ sind. Für eine größere klinische Relevanz stellen die in der vorliegenden Arbeit enthaltenen Zahlen Daten dar, die von dystrophischen Hornhäuten gesammelt wurden, sofern nicht anders angegeben.
Nach der Simulation des chirurgischen Ergebnisses von DSO wurde die Trypan Blue-Färbung durchgeführt und während der 14-tägigen Kulturperiode wiederholt, und die Verringerung der positiven Färbung wurde quantifiziert, um die Wundheilung zu bewerten (Abbildung 2). Alizarin Red Färbeung wurde auch an Tag 14 durchgeführt, um Zellgrenzen abzugrenzen. Dunkelrote Bereiche ohne sichtbares Muster (im Folgenden als negative Färbung bezeichnet) erschienen konsistent innerhalb des nicht geheilten Abschnitts der Läsion und in anderen Bereichen der Hornhaut, in denen angenommen wurde, dass Zellen beschädigt waren oder fehlten. Bereiche, die am 14. Tag positiv für Trypan Blue gefärbt wurden, entsprachen gut der negativen Färbung durch Alizarin Red (Abbildung 2). Alle dystrophischen Hornhäute, die mit eFGF1 (NM141) behandelt wurden, zeigten am 14. Tag eine bessere Heilung im Vergleich zum unbehandelten Partner. Im Durchschnitt zeigten behandelte Hornhäute eine Heilung von 91% im Gegensatz zu 38% bei Kontrollhornhäuten, und dieser Unterschied war statistisch signifikant (p < 0,001) (Abbildung 3A). Dies ist vergleichbar mit den Ergebnissen von 20 normalen Hornhäuten, bei denen die Kontrollen eine durchschnittliche Heilung von 32% zeigten und die behandelten Hornhäute 81% erreichten, was wiederum statistisch signifikant war (p < 0,001) (Ergänzende Abbildung 1). Der geheilte Prozentsatz wurde zwischen normalen und dystrophischen Hornhäuten unter Verwendung von zwei Stichproben-t-Tests unter Annahme der gleichen Varianz verglichen, und weder in der Kontroll- noch in der Behandlungsgruppe wurde ein signifikanter Unterschied beobachtet (Daten nicht gezeigt).
Spenderinformationen, die von Augenbanken (Tabelle 1) sowohl für normale als auch für dystrophische Hornhäute bereitgestellt wurden, wurden analysiert, um festzustellen, ob Merkmale wie Alter, in Optisol gespeicherte Tage, Todes- bis Sammlungsintervall, Zelldichte und Geschlecht mit der Heilung korrelieren. Pearsons Korrelationskoeffizient (r) wurde verwendet, um alle Faktoren außer dem Geschlecht zu untersuchen, das mit einem ungepaarten t-Test bewertet wurde, um die Heilung zwischen Männern und Frauen zu vergleichen. Der absolute Wert von r lag in allen Fällen unter 0,25, was darauf hindeutet, dass Korrelationen zwischen Heilung und Alter, in Optisol gespeicherten Tagen, Todes- bis Sammlungsintervall oder Zelldichte als vernachlässigbar angesehen wurden. Der Unterschied in der Heilung zwischen Männern und Frauen war statistisch nicht signifikant (p = 0,53).
Ähnlich wie der normale Datensatz wiesen 10 der 22 dystrophischen Hornhäute zu mindestens einem Zeitpunkt (normalerweise Tag 3) eine bemerkenswerte Trypan-Färbung außerhalb des abgestreiften Bereichs auf, der mit dem gefärbten Bereich innerhalb der Läsion verbunden war - eine Beobachtung, die wir als periphere Färbung bezeichneten (Abbildung 4A). Von diesen 10 waren nur zwei Kontrollhornhäute, deren behandelte Gegenstücke nicht die gleiche Wirkung zeigten. Die restlichen acht waren alle aufeinander abgestimmte Paare und präsentierten sich mit ähnlicher Schwere zwischen Hornhäuten desselben Individuums. Obwohl die Färbemuster zwischen normalen und dystrophischen Hornhäuten vergleichbar waren, war die Häufigkeit der peripheren Färbung im dystrophischen Datensatz mit 45% der Hornhäute positiv, verglichen mit 25% in der normalen Gruppe. Abbildung 4A zeigt ein Paar, das als positiv für die periphere Färbung angesehen wurde, da der gefärbte Bereich außerhalb der Läsion in den Bildern von Tag 6 auf den Wundrand traf und allmählich zurückging. In den entsprechenden Bildern von Alizarin Red erschienen Zellen in Bereichen mit peripherer Trypan-Färbung vergrößert und abnormal geformt, ähnlich wie die Zellen, die in den abgestreiften Bereich migrierten, und negative Färbungen korrelierten mit den Bereichen, in denen Trypan Blue an Tag 14 anwesend war. Trotz des großen Teils der Hornhaut, der während der gesamten Kulturperiode betroffen war, erfolgte bei allen 10 Hornhäuten eine teilweise oder vollständige Beseitigung der gefärbten Peripherie. Darüber hinaus lag der letzte Prozentsatz, der an Tag 14 geheilt wurde, im normalen Bereich, je nach Behandlungsgruppe, für alle bis auf eine Hornhaut. Der Ausreißer (0811L, in Abbildung 4A dargestellt) ergab einen negativen prozentualen Heilungswert aufgrund der Reste der peripheren Färbung, die am 14. Tag noch mit dem Läsionsbereich verbunden waren (Abbildung 3A und Abbildung 4A). Ein zweites Färbemuster, das als entfernte periphere Färbung bezeichnet wird, wurde in den Alizarin Red-Bildern aus Abbildung 4B erfasst, war aber auch in Trypan Blue-Bildern während der gesamten Kulturperiode in vielen Hornhäuten sichtbar (Abbildung 4B). Diese Beobachtung ist durch einen Ring dunkler Färbung um den Limbus gekennzeichnet, der auf ein kompromittiertes Endothel hinweist. Trotz des Begriffs war dieses Muster sowohl bei normalen als auch bei dystrophischen Hornhäuten so häufig, dass sie nicht als positiv für die periphere Färbung gezählt wurden. In diesen Bildern zeigte die Kontrollhornhaut am 14. Tag eine lebendigere und ausgedehntere Färbung, obwohl beide Hornhäute zu Beginn der Kulturperiode eine ähnliche Schwere und ein ähnliches Muster der Färbung aufwiesen. In der behandelten Hornhaut wurde auch eine scheinbar größere Anzahl von Zellen festgestellt, die im Vergleich zur Kontrolle kompakter und hexagonaler erschienen, obwohl diese Beobachtungen nicht quantitativ gemessen wurden. Aufgrund der Krümmung in der Peripherie wurde nur die Trypan-Färbung innerhalb und unmittelbar um den abgestreiften Bereich herum in die quantitative Analyse einbezogen. Wenn die prozentual gefärbten Werte über alle dystrophischen Hornhäute gemittelt wurden, führte das Aufkommen peripherer Färbungen zu einem anfänglichen Anstieg gegenüber dem Tag 0, im Gegensatz zu der stetigen Abnahme normaler Hornhäute, bei denen die periphere Färbung weniger verbreitet war (Abbildung 3B).
Die durch konfokale Bildgebung visualisierte Immunhistochemie zeigt eine halborganisierte Expression von ZO-1, einem funktionellen Marker für CEC-Tight Junctions, in und um den Läsionsrand (Abbildung 5), ein Muster, das in ähnlicher Weise durch die Alizarin Red-Färbung belegt wird (Abbildung 2 und Abbildung 4). Pleomorphismus und Polymegathism sind durch ZO-1 in den meisten dystrophischen Hornhäuten sichtbar; Diese Beobachtung kann jedoch auf ihren erkrankten Zustand zurückgeführt werden und wurde von der Augenbank bei der spiegelnden Untersuchung der Hornhäute vor der Kultivierung festgestellt. Eine unorganisierte ZO-1-Expression wird im Läsionsbereich der behandelten Hornhäute beobachtet, wo die Zellen nach innen gewandert waren, was ebenfalls mit den Alizarin-Rot-Mustern übereinstimmt. EdU-integrierende Zellen können um den Rand der Läsion und innerhalb des läsionierten Bereichs in Kontroll- und behandelten Hornhäuten gesehen werden (Abbildung 5). Das Muster der migrierten CECs spiegelt auch die Trypan Blue-Ergebnisse wider, bei denen in Kontrollhornhäuten die meisten Zellen in zwei Feldern des Läsionsrandes gefunden wurden, während CECs in behandelten Hornhäuten im gesamten abgestreiften Bereich zu sehen sind (Abbildung 2).
Die EdU-Kennzeichnung wurde in dieser Studie als qualitatives Maß durchgeführt, um zu bestätigen, dass die Proliferation zur Heilung beiträgt. Die Quantifizierung von Zellen, die EdU enthalten, konnte jedoch nicht systematisch durchgeführt werden, da Hornhautschwellungen verhinderten, dass konsistente, replizierbare Bilder in und um die Läsion aufgenommen werden konnten. Als Ersatz wurde die quantitative Analyse, die in einer Studie durchgeführt wurde, die vor der Etablierung des DSO-Modells durchgeführt wurde, aufgenommen, um die Auswirkungen von eFGF-1 (NM141) auf die Proliferation zu demonstrieren (Abbildung 6). Normale menschliche Spenderhornhäute wurden mit einem Skalpell in Viertel geschnitten und in Gegenwart von EdU mit oder ohne eFGF1 (NM141) für 48 h kultiviert, wie zuvor beschrieben (Eveleth, 2020)16. Die Bildgebung und anschließende Analyse von Hoechst 33342- und EdU-markierten Zellen wurde separat in der ungestörten mittleren Zone der Quartiere und in der Randzone innerhalb von drei Feldern durchgeführt, von wo aus die Hornhaut geschnitten wurde. In der mittleren Zone war der Prozentsatz der Zellen, die EdU enthielten, niedrig und über die 10 analysierten Hornhäute sehr variabel. Im Durchschnitt wiesen Quartale, die mit eFGF1 (NM141) behandelt wurden, im mittleren Bereich (4,1 % ± 7,9 %) im Vergleich zu Kontrollen (1,8 % ± 2,9 %), obwohl dieser Unterschied statistisch nicht signifikant war (p = 0,239). Am Wundrand zeigten behandelte Viertel, die mit eFGF1 (NM141) stimuliert wurden, signifikant höhere Raten der EdU-Einarbeitung im Durchschnitt (18,1% ± 11,5%) im Vergleich zu Kontrollquartalen (10% ± 9,6%, p = 0,012).
Tabelle 1: Spenderinformationen für 22 dystrophische und 20 normale Hornhäute, die in dieser Studie verwendet wurden, sowie 10 normale Hornhäute, die zuvor für die EdU-Quantifizierung verwendet wurden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
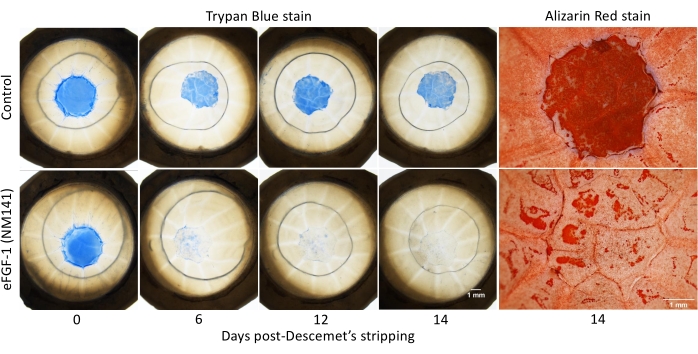
Abbildung 2: Vitale Farbstofffärbung von Hornhäuten nach Descemets Stripping. Dystrophische menschliche Hornhäute wurden von den zentralen 4 mm der Descemet-Membran befreit und mit oder ohne eFGF1 (NM141) (100 ng/ml) für 14 Tage inkubiert. Läsionen wurden durch Trypan Blue-Färbung an den Tagen 0, 3, 6, 9, 12 und 14 visualisiert. Die Grenzen der KEK wurden am 14. Tag durch die Färbung von Alizarin Red visualisiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
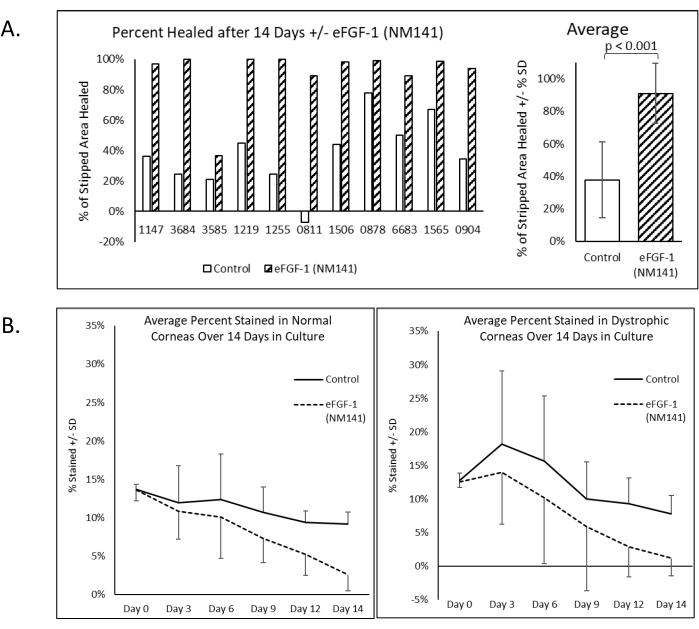
Abbildung 3: Dystrophische menschliche Hornhäute zeigen eine signifikant größere Heilung durch DSO, wenn sie mit eFGF1 (NM141) kultiviert werden. (A) Die prozentuale Heilung wurde bestimmt, indem die gefärbte Fläche an Tag 14 mit ImageJ gemessen und mit dem an Tag 0 gefärbten Prozentsatz verglichen wurde. (B) Der durchschnittliche Prozentsatz der im Laufe der Zeit dargestellten Färbungen zeigt eine konsistente Abnahme der normalen Hornhäute, während er am Tag 3 in dystrophischen Hornhäuten aufgrund der höheren Prävalenz der peripheren Färbung seinen Höhepunkt erreicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
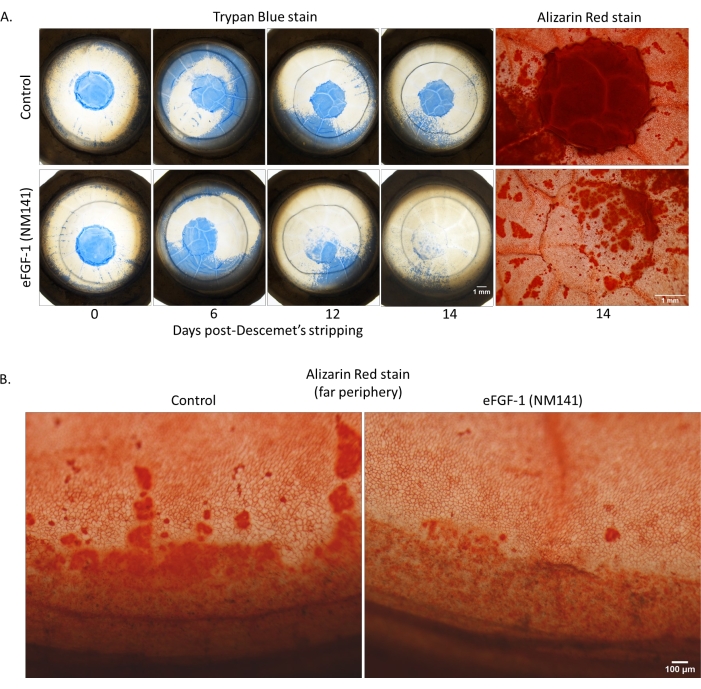
Abbildung 4: Vitale Farbstofffärbung von dystrophischen Hornhäuten mit peripherer Färbung. (A) Die Trypan-Färbung der intakten Descemet-Membran kann gesehen werden, wie sie sich in Richtung Zentrum bewegt und sich dann im Laufe der Zeit sowohl in der Kontrolle als auch in der behandelten Hornhaut auflöst. (B) Alizarin-Muster um den Limbus herum stellen eine typische Beobachtung von peripheren Schäden und unorganisierter Wiederherstellung des Endothels dar, die bei vielen Spenderhornhäuten beobachtet werden - in diesem Fall dystrophisch. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
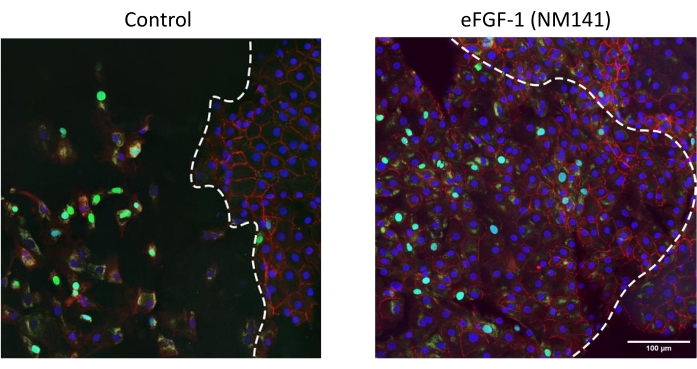
Abbildung 5: Stimulation der Migration und Proliferation von CECs durch eFGF1 (NM141) in abgestreiften dystrophischen Hornhäuten. Konfokale Aufnahmen der gestreiften Hornhäute von Descemet, die für ZO-1 (rot), EdU (grün) und Hoechst 33342 (blau) gefärbt sind. Die gepunktete Linie stellt die Läsionskante mit dem abgestreiften Bereich auf der linken Seite des Bildes und der intakten Descemet-Membran auf der rechten Seite dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
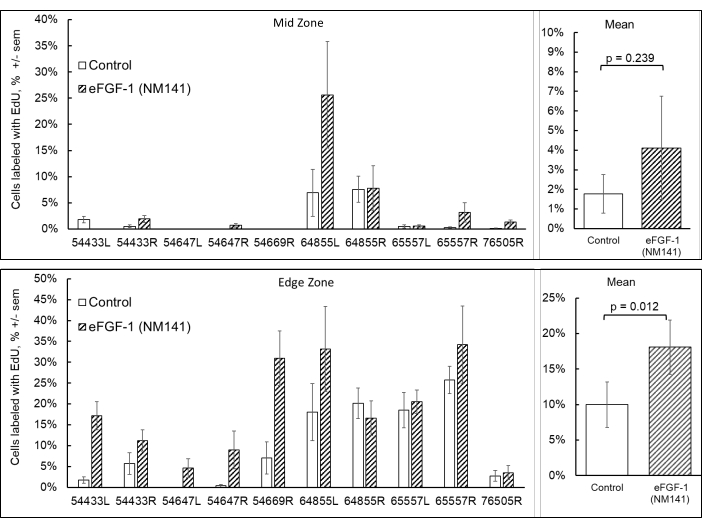
Abbildung 6: Quantifizierung von proliferierenden Zellen aus normalen Hornhäuten, die mit einem Skalpell geviertelt und in EdU-haltigen Medien mit oder ohne eFGF-1 (NM141) für 48 h inkubiert wurden. Die Quartiere wurden in dreifacher Ausfertigung in der ungestörten mittleren Zone und entlang der Schnittkante abgebildet, und die Anzahl wurde gemittelt, um den Prozentsatz der Zellen zu bestimmen, die EdU in der mittleren und Randzone enthalten. Abbildung modifiziert aus Journal of Ocular Pharmacology and Therapeutics, verwendet mit Genehmigung16. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Normale menschliche Hornhäute zeigen eine signifikant größere Heilung durch DSO, wenn sie mit eFGF1 (NM141) kultiviert werden. ImageJ wurde verwendet, um die gefärbten Bereiche zu messen und die prozentuale Heilung zu bestimmen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Viele Augenärzte haben Bedenken, ihren Patienten DSO aus zwei Hauptgründen zu empfehlen: 1) der langwierige Heilungsprozess und 2) der Mangel an Daten (DSO ist ein neues Konzept auf dem Gebiet der Augenchirurgie). Die Forschung, die wir vorgestellt haben, wäre von großem Nutzen, um diese beiden Bedenken zu zerstreuen. Basierend auf Daten aus dieser und anderen Studien hat die FDA eine klinische Phase-2-Studie genehmigt, in der eFGF1 (NM141) bei Patienten, die sich einem DSO17 unterziehen, in unterschiedlichen Dosierungsschemata verabreicht wird.
Die oben beschriebene Methode wurde nach einer von Soh et al. durchgeführten Studie modelliert, in der die Hornhautendothelheilung mit und ohne den ROCK-Inhibitor Y-27632 sowohl bei zerkratzten als auch bei geschälten Wunden18 bewertet wurde. Während Y-27632 die endotheliale Regeneration beschleunigte, wobei die Descemet-Membran noch intakt war, wurde bei abgestreiften Wunden selbst bei der Behandlung keine wesentliche Heilung gefunden. Mit einer ähnlichen Stripping-Technik, gefolgt von einer Behandlung mit oder ohne eFGF1 (NM141), stimmten die Beobachtungen, die wir fanden, nicht mit denen von Soh und Kollegen überein. Das Fehlen von Trypanblau-Färbungen in vielen behandelten Hornhäuten am 14. Tag und das Vorhandensein von ZO-1-positiven Tight Junctions innerhalb der reformierten Endothelschicht argumentieren, dass eine intakte Barriere, Teil der natürlichen Funktion des CEC, sowohl in normalen als auch in dystrophischen Hornhäuten wiederhergestellt wurde. Obwohl in dieser Studie nicht quantifiziert, deutet das Vorhandensein von EdU-positiven Zellen in und um den abgestreiften Bereich auch auf die Proliferation als Heilungsmechanismus hin, von dem wir zuvor festgestellt haben, dass er durch eFGF1 (NM141) in verletzten Hornhäuten16 stimuliert werden kann. Statistische Analysen zeigten, dass die Behandlung mit eFGF1 (NM141) zu einer signifikant besseren Heilung durch DSO führte, im Durchschnitt mehr als doppelt so hoch wie Kontrollhornhäute zum 14-Tage-Zeitpunkt. Obwohl die Heilungsraten zwischen den Individuen moderat variieren - ein typisches Merkmal der Spenderhornhäute -, zeigt die Replizierbarkeit der Ergebnisse über große Stichprobengrößen auch eine sehr messbare Methode. Unseres Wissens gibt es in der Literatur keine weiteren Beispiele für ein Ex-vivo-Descemet-Stripping-Modell .
Schlüsselkomponenten des Protokolls selbst, die für andere Forscher, die DSO untersuchen, wertvoll wären, sind die Verwendung von Trypan Blue zur Erkennung von nacktem Stroma und die Bildverarbeitungstechnik, die zur Messung der gefärbten Fläche verwendet wird. Trypan Blue wird häufig in der Augenchirurgie eingesetzt, insbesondere bei der Arbeit mit der Membran von Descemet, um nicht lebensfähige Zellen zu erkennen und die Sichtbarkeit des Gewebes zu unterstützen. Die in diesem Protokoll enthaltenen Färbezeitpunkte ermöglichten eine effektive Wiederholungsfärbung, ohne Hornhäute übermäßig Trypan Blue auszusetzen, da es sich bei hohen Konzentrationen als toxisch für CECs erwiesenhat 19. Die Verringerung der gefärbten Fläche über 14 Tage in allen Hornhäuten, die durch Alizarin Red und die Immunhistochemie als Ergebnis migrierter CECs bestätigt wurde, zeigt eine einfache und reproduzierbare Methode zur Messung der Heilung. Über das Farbschwellenwertmenü von ImageJ sammelten mehrere Analysten Daten mit Standardabweichungen von konstant unter 1 % (Daten nicht dargestellt). Obwohl alternative Programme ähnlich funktionieren können, ist ImageJ eine Open-Source-Software, die in der Lage ist, genaue Flächenmessungen zu erstellen, um die Heilung zu verfolgen.
Es gibt jedoch einen Aspekt des Stripping-Protokolls, den wir sowohl für die Wundbildung als auch für den gesamten Heilungsprozess als hinderlich empfunden haben. Die Verwendung einer scharfen 30-G-Nadel zur Bewertung der Descemet-Membran entlang der Markierung, die der Biopsiestempel hinterlassen hat, ermöglicht die Erzeugung einer glatten, kreisförmigen Wunde, die von Klinikern zur Unterstützung einer schnelleren Heilung festgestelltwird 10. Gleichzeitig schädigt dieser Schritt die Hornhaut, da er Risse in den Stromafasern verursachen kann, die den Tod von Stromazellen verursachen, die Migration von Endothelzellen über den Wundrand behindern und die Bildung von Knötchen induzieren, die zu einem anhaltenderen postoperativen Ödem führen20. Kliniker, die DSO durchführen, verwenden typischerweise einen umgekehrten Sinskey-Haken, um die Wunde einzuleiten, aber ohne einen Augeninnendruck, der die Hornhaut straff hält, ist dieses Werkzeug im Ex-vivo-Modell weniger effektiv. Ein alternatives Werkzeug, das in der Lage ist, die Membran von Descemet zu zerreißen, ohne das darunter liegende Stroma zu beschädigen, würde das Protokoll verbessern, zum Beispiel das von Macsai und Shiloach10 empfohlene Bewässerungs- und Aspirationshandstück. Weitere Experimente werden erforderlich sein, um festzustellen, ob diese Technik mit dem Ex-vivo-Modell kompatibel ist.
Eine Herausforderung, die dem Ex-vivo-Modell innewohnt, ist das häufige Auftreten von CEC-Todesfällen im Bereich der Wunde, insbesondere bei dystrophischen Hornhäuten. Dies verdeckte gelegentlich die Quantifizierung der Wundfläche, da die Genauigkeit des Farbschwellenwerkzeugs begrenzter wird, da sich der gefärbte Bereich über das Zentrum der Hornhaut hinaus erstreckt, wo seine Krümmung zu einer ungleichmäßigen Lichtverteilung führt. Diese variablen Messungen fanden jedoch hauptsächlich zu früheren Zeitpunkten statt, bevor die periphere Färbung allmählich zurückging, als beschädigte CECs beseitigt wurden und benachbarte Zellen gedehnt, migriert oder vermehrt wurden, um sie zu ersetzen. Zum letzten 14-Tage-Zeitpunkt hatte sich der gefärbte Bereich wieder in die Mitte der Hornhaut lokalisiert, und alle Bilder waren messbar. Eine ähnliche Beobachtung wurde mit vergleichbarer Häufigkeit von Soh et al. gemacht, wo fünf von 14 normalen Hornhäuten zu Beginn der Kulturperiode18 das präsentierten, was sie als "vorzeitiges Kulturversagen" (PCF) bezeichneten. Während sich der Schaden im Laufe der Zeit in unseren Hornhäuten umkehrte und dennoch in ihrem Fall dauerhaft war, kann dies auf die Tatsache zurückgeführt werden, dass ihre Methode die Wunde eines größeren Bereichs der Hornhaut erforderte. Die Beobachtung einer häufigeren peripheren Trypan-Färbung in dystrophischen Hornhäuten kann darauf hindeuten, dass dystrophische Hornhäute anfälliger für den Tod von Endothelzellen sind als gesunde Hornhäute. Während die genaue Ursache dieses Zelltodes noch nicht geklärt ist, halten wir es für unwahrscheinlich, dass dieses Thema für menschliche Hornhäute in vivo relevant sein wird. Eine Schädigung des peripheren Endothels wurde unseres Wissens in keiner klinischen Fallstudie von DSO berichtet, was darauf hindeutet, dass dieses Phänomen nur bei Spenderhornhäuten auftritt, die ex vivo 6,8,10,11,21 kultiviert werden. Abgesehen von zwei Fällen, in denen nur Kontrollhornhäute gefärbt wurden, wurden alle Beobachtungen der peripheren Färbung gepaart, so dass es unwahrscheinlich ist, dass die Ursache die Exposition gegenüber eFGF1 (NM141) war. Es ist jedoch möglich, dass in diesen Fällen die Behandlung eine schützende Wirkung gegen die Schädigung gehabt hätte, die sonst eine periphere Färbung in beiden Hornhäuten verursacht hätte. Weitere Untersuchungen zu dieser Hypothese sind erforderlich.
Eine weitere Einschränkung dieser Methode ist die Beschaffung von Spenderhornhäuten, die für den FECD-Phänotyp repräsentativ sind, für den DSO bestimmt ist. Spenderhornhäute jeglicher Art sind knapp, daher die Notwendigkeit einer Operation, die die Verwendung von Spendergewebe vermeidet. Für unsere Zwecke sind die einzigen verfügbaren Hornhäute diejenigen, die aus verschiedenen Gründen von der Transplantation abgelehnt werden. Augenbanken klassifizieren diese Hornhäute weiter als normal oder dystrophisch, basierend auf Kriterien wie dem Vorhandensein von Guttae, niedrigem oder nicht messbarem ECD und unregelmäßiger CEC-Morphologie. Die Bestätigung einer dystrophischen Diagnose vor der Annahme von Gewebe aus einer Augenbank ist ebenfalls nahezu unmöglich, da die Krankengeschichte der meisten Spender keine Vorgeschichte enthält und die einzigen Informationen der ECD-Wert, die Notizen des Technikers und in einigen Fällen ein repräsentatives Spiegelbild sind. Die für diese Studie erhaltenen dystrophischen Hornhäute zeigten keine konfluenten zentralen Gutta bei konfokaler Mikroskopie, die nach Abschluss der Kulturperiode durchgeführt wurde, was darauf hindeutet, dass sie "frühe" Stadien der FECD darstellen könnten. Wir erwarten nicht, dass dies einen signifikanten Einfluss auf die Implikationen der Studie haben wird, da der Zweck von DSO darin besteht, konfluente Bereiche von Gutta zu entfernen, so dass gesunde periphere Zellen nach innen wandern können.
Diese Methode bietet eine hochgradig anwendbare und reproduzierbare Technik zur Bewertung von Wirkstoffen, die sich auf die Verbreitung und Migration von CEC auswirken könnten. Das Modell weist mehrere Merkmale auf, die es physiologisch relevanter machen als In-vitro-Modelle, die kultivierte CECs beinhalten, selbst wenn es auf menschliches Hornhautgewebetransplantat22,23,24 gesät wird. Erstens befinden sich die zu stimulierenden CECs in einer Monoschicht genau so, wie sie im Auge des Patienten vorhanden sind, und wandern über das Hornhautstroma, wie sie es nach der klinischen DSO tun würden. Das fragliche Stroma stammt vom selben Patienten wie die CECs, wodurch potenzielle FECD-bedingte Stromadifferenzen kontrolliert werden. Es besteht keine Notwendigkeit, Kulturen von CECs mit den damit verbundenen Herausforderungen und dem Potenzial für den Übergang von Endothel zu Mesenchymal (EnMT) während des Kultivierungsprozesses zu explantieren, zu dissoziieren und zu erweitern. Das beschriebene Protokoll selbst ist dem klinischen DSO-Verfahren sehr ähnlich. Während es die Kultur- und Expansionsschritte umgeht, hat diese Methode die Einschränkung, dass die Dauer des Studiums durch Hornhautschwellungen eingeschränkt wird, da die Epithelschicht nicht erhalten bleibt. Dies hindert uns daran, die Morphologie von CECs zu untersuchen, die migriert sind, um den abgestreiften Bereich abzudecken, so dass unklar bleibt, ob sie sich in diesem Modell schließlich zu einem hexagonalen Array umordnen werden. Garcin et al. haben mit ihrer aktiven Speichermaschine (ASM) eine mögliche Lösung entwickelt, ein Gerät, das nachweislich Hornhäute bis zu 3 Monate lang mit deutlich weniger Ödemen in Kultur hält als Hornhäute in traditioneller Organkultur25. Ein solches Gerät kann hilfreich sein, um diese Arbeit zu replizieren und zu erweitern.
Dieses Modell hat potenziellen Nutzen bei der Prüfung anderer Wundheilungstherapien (z. B. ROCK-Inhibitoren), der Bewertung von Modifikationen der Operationstechnik und dem Vergleich der Heilung über verschiedene Spenderpopulationen oder Krankheitsstadien hinweg. Wir hoffen, dass diese Forschung in Verbindung mit klinischen Studiendaten, sobald sie herauskommt, Kliniker ermutigt, DSO als wertvolle Behandlungsoption für ihre berechtigten FECD-Patienten zu betrachten.
Offenlegungen
DDE, SP, GD und JW sind Mitarbeiter von Trefoil Therapeutics, Inc. und halten Anteile an Trefoil Therapeutics, Inc. DDE ist Erfinder von Patenten für eFGF1 (NM141).
Danksagungen
Die Finanzierung dieser Arbeit wurde von Trefoil Therapeutics und NIH NCATS TRND CRADA #2016-04 unterstützt. Die Autoren danken Tony Wong für die histopathologische Beratung und Dienstleistungen, dem Nikon Imaging Center an der UC San Diego für die Verwendung ihres konfokalen Mikroskops und Dr. Natalie Afshari und Marian Macsai für ihre Ratschläge zur Operationstechnik. Darüber hinaus bedanken sich die Autoren bei den Spendern der Augen und der Augenbanken für die Bereitstellung von Hornhäuten.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2µm sterile 1000 mL filter units | VWR | 10040-440 | |
| 0.2µm sterile 250 mL filter units | VWR | 10040-464 | |
| 0.2µm sterile 500 mL filter units | VWR | 10040-436 | |
| 10mL syringe Luer-Lok Tip | Becton Dickinson | 302995 | |
| 12 well tissue culture treated plate | Corning | 3513 | |
| 15 mL conical Tubes | VWR | 89039-668 | |
| 16% paraformaldehyde (PFA) | Electron Microscopy Science | 15710 | |
| 2mL aspirating pipette | VWR | 414004-265 | |
| 310 direct heat CO2 incubator | Forma Scientific | 13-998-082 | Set to 37°C, 6% CO2 |
| 50 mL conical tubes | VWR | 89039-660 | |
| 5-Ethynyl-2'-deoxyuridine (EdU) | Thermo Scientific | C10337 | |
| 5mL, 10mL, 25mL and 50mL serological pipettes | VWR | 89130-896, -898, -900, -902 | |
| 6 well tissue culture treated plate | Corning | 3516 | |
| 70% ethanol | BDH | BDH1164-4LP | |
| Alexa Fluor 488 azide | Thermo Scientific | A10266 | |
| Alizarin Red S | Sigma | A5533-25G | |
| Analytical balance | Sartorious | R200D | |
| Antibiotic & Antimycotic 100x (anti-anti) | Thermo Scientific | 15240-062 | |
| Anti-magnetic stainless steel forceps | Excelta | 7-SA | |
| Bottle top dispenser | Ward's Science | 470134-946 | |
| Bovine serum albumin (BSA) | Fisher Scientific | BP9700-100 | |
| Calcium chloride (CaCl) | Amresco | 1B1110-500G | |
| Chex-all II sterilzation pouches | Propperman | 24008 | |
| Cirpofloxacin hydrochloride | Alfa Aesar | J61970 | |
| Copper (II) sulfate pentahydrate (CuSO4) | Sigma | 469130-50g | |
| Dissecting microscope | Nikon | SMZ1270 | |
| Dry vacuum pump | Welch | 2019B-01 | |
| Fetal bovine serum (FBS) | Thermo Scientific | A31606-01 | |
| Frosted micro slides | VWR | 48311-703 | |
| Galaxy miniStar microcentrifuge | VWR | C1413, VWR | |
| Goat anti-mouse IgG (H+L) secondary antibody, Alexa Fluor Plus 555 | Thermo Scientific | A32727 | |
| Goat serum | Sigma | G9023 | |
| Haemo-Sol detergent | Haemo-Sol International LLC | 026-050 | |
| Hoechst 33342, trihydrochloride, trihydrate | Thermo Scientific | H3570 | |
| Hot plate/stirrer | Corning | PC-320 | |
| Human corneas | Lions Eye Institute for Transplant and Research, Advancing Sight Network, Eversight Eye Bank, Lions Vision Gift, and Georgia Eye Bank | NA | |
| Hydrochloric acid (HCl) | BDH | BDH7204 | |
| ImageJ | National Institute of Health | Version 1.52a | |
| Infinity 3s microscopy camera | Lumenera | 1URCAP2 | |
| Infinity analyze software | Lumenera | Version 6.5.5 | |
| Insulin transferrin selenium (ITS) | Corning | 41400-045 | |
| Iris scissors, 11 cm | World Precision Instruments | 501264-G | |
| L- Ascorbic acid | Sigma | A4544-25G | |
| Manual single channel pipet | Rainin | 17014-392, -391, -382 | |
| Needle PrecisionGlide 30G | Becton Dickinson | 305106 | |
| N-Met141 TTHX1114 | Biopharmaceutical Development Program | NA | |
| Opti-Mem I + GlutaMAX-1 (Opti-MEM) | Thermo Scientific | 51985-034 | |
| Orion Star A211 pH meter | Thermo Scientific | STARA211 | |
| Petri dishes | VWR | 89107-632 | |
| Potassium chloride (KCl) | BDH | BDH9258-500G | |
| Potassium phosphate monobasic (KH2PO4) | VWR | 0781-500G | |
| Powerpette plus pipet controller | VWR | 75856-456 | |
| Precision water bath 188 | Precision Scientific Incorporated | WB05 | Set to 37°C |
| Purifier Class II model biosafety cabinet | Labconco | 36213043726 | |
| Safe-Lock tubes, 1.5 mL | Eppendorf | 22363212 | |
| Scalpel size 22 stainless steel | Sklar | 446479 | |
| Sodium chloride (NaCl) | VWR | 2041-2.5K | |
| Sodium hosphate dibasic (Na2HPO4) | VWR | 0404-1KG | |
| Standard shaker | VWR | 89032-092 | |
| Standard solid refrigerator | VWR | 10820-402 | Set to 4°C |
| Sterilmatic autoclave | Market Forge | STM-EL | |
| Syringe filters | VWR | 28145-477 | |
| Test tube rocker | Thermo Scientific | M48725Q | |
| Tru-Punch disposable biopsy punch, 4 mm | Sklar | 96-1146 | |
| Trypan Blue | Thermo Scientific | 15250-061 | |
| Tween-20 | Sigma | P7949-100mL | |
| Vibrance antifade mounting medium with DAPI | Vector Laboratories Inc. | H-1800 | |
| VistaVision cover glasses, no. 1 | VWR | 16004-098 | |
| Vortex Genie 2 | Fisher Scientific | G-560 | |
| ZO-1 monoclonal antibody (ZO1-1A12) | Thermo Scientific | 33-9100 |
Referenzen
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Review of Ophthalmology. 5 (2), 147-159 (2010).
- Ku, B., et al. Endothelial cell loss in penetrating keratoplasty, endothelial keratoplasty, and deep anterior lamellar keratoplasty. Taiwan Journal of Ophthalmology. 7 (4), 199 (2017).
- Gain, P., et al. Global survey of corneal transplantation and eye banking. JAMA Ophthalmology. 134 (2), 167-173 (2016).
- Braunstein, R. E., Airiani, S., Chang, M. A., Odrich, M. G. Corneal edema resolution after "descemetorhexis". Journal of Cataract and Refractive Surgery. 29 (7), 1436-1439 (2003).
- Pan, J. C., Eong, K. G. A. Spontaneous resolution of corneal oedema after inadvertent 'descemetorhexis' during cataract surgery. Clinical and Experimental Ophthalmology. 34 (9), 896-897 (2006).
- Shah, R. D., et al. Spontaneous corneal clearing after Descemet's stripping without endothelial replacement. Ophthalmology. 119 (2), 256-260 (2012).
- Ziaei, M., Barsam, A., Mearza, A. Spontaneous corneal clearance despite graft removal in Descemet stripping endothelial keratoplasty in Fuchs endothelial dystrophy. Cornea. 32 (7), 164-166 (2013).
- Huang, M. J., Kane, S., Dhaliwal, D. K. Descemetorhexis without endothelial keratoplasty versus DMEK for treatment of fuchs endothelial corneal dystrophy. Cornea. 37 (12), 1497 (2018).
- Davies, E., Jurkunas, U., Pineda, R. Pilot study of corneal clearance with the use of a rho-kinase inhibitor after descemetorhexis without endothelial keratoplasty for Fuchs endothelial corneal dystrophy. Cornea. 40 (7), 899-902 (2021).
- Macsai, M. S., Shiloach, M. Use of topical rho kinase inhibitors in the treatment of Fuchs dystrophy after Descemet stripping only. Cornea. 38 (5), 529-534 (2019).
- Moloney, G., et al. Descemetorhexis without grafting for Fuchs endothelial dystrophy-supplementation with topical ripasudil. Cornea. 36 (6), 642-648 (2017).
- Thalmann-Goetsch, A., Engelmann, K., Bednarz, J. Comparative study on the effects of different growth factors on migration of bovine corneal endothelial cells during wound healing. Acta Ophthalmologica Scandinavica. 75 (5), 490-495 (1997).
- Landshman, N., et al. Regeneration of cat corneal endothelium induced in vivo by fibroblast growth factor. Experimental Eye Research. 45 (6), 805-811 (1987).
- Lee, J., Blaber, M. Increased functional half-life of fibroblast growth factor-1 by recovering a vestigial disulfide bond. Journal of Proteins & Proteomics. 1, 37-42 (2010).
- Xia, X., et al. Engineering a cysteine-free form of human fibroblast growth factor-1 for "second generation" therapeutic application. Journal of Pharmaceutical Sciences. 105 (4), 1444-1453 (2016).
- Eveleth, D., Pizzuto, S., Weant, J., Jenkins-Eveleth, J., Bradshaw, R. Proliferation of human corneal endothelia in organ culture stimulated by wounding and the engineered human fibroblast growth factor 1 derivative TTHX1114. Journal of Ocular Pharmacology and Therapeutics: the Official Journal of the. 36 (9), 686-696 (2020).
- TTHX1114(NM141) in Combination With DWEK/DSO. ClinicalTrials.gov Available from: https://clinicaltrials.gov/ct2/show/NCT04676737?term=TTHX1114&draw=2&rank=2 (2020)
- Soh, Y. Q., et al. Predicative factors for corneal endothelial cell migration). Investigative Ophthalmology & Visual Science. 57 (2), 338-348 (2016).
- van Dooren, B. T. H., Beekhuis, W. H., Pels, E. Biocompatibility of trypan blue with human corneal cells. Archives of Ophthalmology. 122, (2004).
- Davies, E., Jurkunas, U., Pineda, R. Predictive Factors for Corneal Clearance After Descemetorhexis Without Endothelial Keratoplasty. Cornea. 37 (2), 736-742 (2018).
- Borkar, D. S., Veldman, P., Colby, K. A. Treatment of Fuchs endothelial dystrophy by Descemet stripping without endothelial keratoplasty. Cornea. 35 (10), 1267-1273 (2016).
- Amano, S., Mimura, T., Yamagami, S., Osakabe, Y., Miyata, K. Properties of corneas reconstructed with cultured human corneal endothelial cells and human corneal stroma. Japanese Journal of Ophthalmology. 49 (6), 448-452 (2005).
- Rolev, K., OʼDonovan, D. G., Coussons, P., King, L., Rajan, M. S. Feasibility study of human corneal endothelial cell transplantation using an in vitro human corneal model. Cornea. 37 (6), 778-784 (2018).
- Spinozzi, D., et al. In vitro evaluation and transplantation of human corneal endothelial cells cultured on biocompatible carriers. Cell Transplantation. 29, 1-11 (2020).
- Garcin, T., et al. Three-month storage of human corneas in an active storage machine. Transplantation. 104 (6), 1159-1165 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten