Method Article
Ein Workflow zur quantitativen Bestimmung altersbedingter Makuladegenerationsläsions-spezifischer Variationen in der Fundus-Autofluoreszenz
In diesem Artikel
Zusammenfassung
Diese Forschungsarbeit beschreibt einen Arbeitsablauf zur Bestimmung und zum Vergleich von Autofluoreszenzniveaus aus einzelnen interessierenden Regionen (z. B. Drusen- und subretinale Drusenoidablagerungen bei altersbedingter Makuladegeneration [AMD]) unter Berücksichtigung unterschiedlicher Autofluoreszenzniveaus im gesamten Fundus.
Zusammenfassung
Die Fundus-Autofluoreszenz-Bildgebung (FAF) ermöglicht die nicht-invasive Kartierung von intrinsischen Fluorophoren des Augenhintergrundes, insbesondere des retinalen Pigmentepithels (RPE), das jetzt mit dem Aufkommen der konfokalen Scanning-Laser-Ophthalmoskopie-basierten quantitativen Autofluoreszenz (QAF) quantifiziert werden kann. Es hat sich gezeigt, dass die QAF bei altersbedingter Makuladegeneration (AMD) im Allgemeinen am hinteren Pol erniedrigt ist. Der Zusammenhang zwischen QAF und verschiedenen AMD-Läsionen (Drusen, subretinale Drusenoidablagerungen) ist noch unklar.
In diesem Artikel wird ein Arbeitsablauf zur Bestimmung der läsionsspezifischen QAF bei AMD beschrieben. Es wird ein multimodaler In-vivo-Bildgebungsansatz verwendet, einschließlich, aber nicht beschränkt auf optische Kohärenztomographie (SD-OCT) im Spektralbereich, Makulavolumen-Scanning und QAF. Mit Hilfe von kundenspezifischen FIJI-Plug-ins wird das entsprechende QAF-Bild mit dem Nahinfrarotbild aus dem SD-OCT-Scan abgeglichen (charakteristische Landmarken, d. h. Gefäßverzweigungen). Die Foveola und der Rand des Sehnervenkopfes werden in den OCT-Bildern markiert (und in das registrierte QAF-Bild übertragen), um eine genaue Positionierung der Analysegitter zu ermöglichen.
AMD-spezifische Läsionen können dann auf einzelnen OCT-BScans oder dem QAF-Bild selbst markiert werden. Normative QAF-Karten werden erstellt, um den variierenden Mittelwert und die Standardabweichung der QAF-Werte im gesamten Fundus zu berücksichtigen (QAF-Bilder aus einer repräsentativen AMD-Gruppe wurden gemittelt, um normative retinale QAF-AMD-Standardkarten zu erstellen). Die Plug-Ins zeichnen die X- und Y-Koordinaten, den Z-Score (eine numerische Messung, die den QAF-Wert im Verhältnis zum Mittelwert der AF-Maps in Bezug auf die Standardabweichung vom Mittelwert beschreibt), den mittleren Intensitätswert, die Standardabweichung und die Anzahl der markierten Pixel auf. Die Werkzeuge bestimmen auch Z-Scores aus der Randzone markierter Läsionen. Dieser Arbeitsablauf und die Analysewerkzeuge werden das Verständnis der Pathophysiologie und der klinischen AF-Bildinterpretation bei AMD verbessern.
Einleitung
Die Fundus-Autofluoreszenz-Bildgebung (FAF) ermöglicht eine nicht-invasive Kartierung von natürlich und pathologisch vorkommenden Fluorophoren des Augenhintergrundes1. Die häufigste blaue Autofluoreszenz (488 nm Anregung) (AF) erregt Lipofuszin- und Melanolipofuszin-Granula des retinalen Pigmentepithels (RPE)2,3,4. Die Verteilung und die Zunahme/Abnahme von Granula spielen eine zentrale Rolle beim normalen Altern und bei verschiedenen Netzhauterkrankungen, einschließlich der altersbedingten Makuladegeneration (AMD)5.
Eine Weiterentwicklung der FAF, die quantitative Fundusautofluoreszenz (QAF), ermöglicht nun die genaue Bestimmung topographisch aufgelöster retinaler AF-Intensitäten 4,6. Durch die Integration einer Referenz in den optischen Pfad des FAF-Bildgebungsgeräts können AF-Intensitäten zwischen Geräten, Zeitpunkten und Motiven verglichen werden. Diese Technik hat zu einem Paradigmenwechsel in Bezug auf einen vermuteten pathogenetischen Faktor bei der AMD geführt, der lange Zeit auf eine übermäßige Lipofuszin-Akkumulation in RPE-Zellen zurückgeführt wurde7. Die histologische und klinische Quantifizierung von Vorhofflimmern ergab jedoch eine Abnahme des Vorhofflimmerns bei AMD (aufgrund der Umverteilung und des Verlusts von autofluoreszierendem Lipofuszin und Melanolipofuszin-Granula) anstelle des vorgeschlagenen Anstiegs von Vorhofflimmern 8,9,10.
Die Überwachung von Vorhofflimmern hat klinische Auswirkungen. Von der Emde et al. und andere haben gezeigt, dass Vorhofflimmern nicht nur vermindert ist, sondern auch im Verlauf der AMD bei Hochrisiko-Augen mit intermediärer AMD weiter abnimmt 8,9. Darüber hinaus deuten histologische Studien darauf hin, dass die meisten AMD-betroffenen RPE-Zellen ein charakteristisches Verhalten mit Granulaaggregation und -extrusion vor dem Verlust von RPE-Zellen durch Subduktion, Supping, Migration oder Atrophie zeigen13,14,15,16. Dies deutet darauf hin, dass der Verlust von Vorhofflimmern ein Auslöser oder ein Surrogatsignal für ein bevorstehendes Fortschreiten der Krankheit sein könnte.
QAF-Studien haben AF bisher nur global am hinteren Pol unter Verwendung von vorgefertigten polaren Koordinatensystemen (z. B. QAF8/Delori-Gitter) untersucht17. Die Verwendung vorgefertigter Raster zur Messung des Autofokus führt zu mehreren AF-Werten in vordefinierten Bereichen pro Auge eines Motivs. Bei der Untersuchung von Vorhofflimmerwerten auf diese Weise könnten lokale Veränderungen in Bereichen mit pathologisch verändertem Vorhofflimmern übersehen werden, z. B. bei AMD auf oder in der Nähe von Drusen oder subretinalen Drusenoidablagerungen (SDDs). Drusen und in höherem Maße SDDs sind mit einem hohen Risiko für die Entwicklung einer späten AMD und eines Sehverlusts verbunden. Insbesondere Drusen haben einen typischen Zyklus, in dem sie über viele Jahre hinweg an Größe zunehmen und sich vor der Atrophie schnell verschlechtern können. Denkbar ist beispielsweise, dass das globale Vorhofflimmern bei AMD abnimmt, aber in und um diese spezifischen krankheitsbedingten fokalen Läsionen zunimmt oder sogar noch weiter reduziert wird.
Unterschiedliche lokale Vorhofflimmermuster könnten auch prognostische Relevanz für das Fortschreiten der Erkrankung haben. Zum Beispiel könnten Autofluoreszenzwerte verwendet werden, um zu beurteilen, ob Drusen an Größe zunehmen oder sich bereits in einer Regression zur Atrophie befinden. Es konnte bereits gezeigt werden, dass veränderte periläsionale Muster von Vorhofflimmern bei geografischer Atrophie das Fortschreiten der Atrophie im Laufe der Zeit maßgeblich beeinflussen18. Darüber hinaus könnten lokale Autofluoreszenzmuster weitere Details über den Zustand des RPE verraten. Die optische Kohärenztomographie (OCT) zeigt häufig eine Hyperreflexion in die Choriocapillaris, obwohl die RPE-Schicht intakt erscheint. Ein multimodaler Ansatz, der lokale QAF-Werte und OCT kombiniert, könnte helfen, Läsionen mit einem hohen Risiko für RPE-Störung und drohende Atrophie zu differenzieren.
Ein Grund, warum in Studien keine ortsaufgelösten Analysen durchgeführt wurden, liegt darin, dass die am häufigsten verwendete Software der Hersteller kein Werkzeug für diese Art von Analysen bereitstellt. Die Eigenschaften verschiedener Läsionen in Abhängigkeit vom AMD-Krankheitsstadium könnten die Pathogenese der AMD weiter erklären. Daher wäre ein Instrument zur Messung des regionalen, läsionsspezifischen Vorhofflimmerns wünschenswert. Um Läsionen, die sich in der gesamten Netzhaut befinden, genau vergleichen zu können, benötigt der Arbeitsablauf eine Möglichkeit, unterschiedliche Grade von Vorhofflimmern im menschlichen Fundus zu berücksichtigen19. Am zentralsten ist der Vorhofflimmern aufgrund der Abschattungseffekte des Makulapigments und der unterschiedlichen Körnchenzahlen charakteristisch niedriger20,21.
Der AF erreicht seinen Höhepunkt bei ~9° (Abstand zur Fovea in alle Richtungen) und nimmt peripher stärker ab4. Würde man also die absoluten Werte der AF-Pegel von weichen Drusen (in Bereichen mit niedrigem AF an der Fovea und Parafovea) und SDDs (in Bereichen mit hohem AF parazentral lokalisiert) vergleichen, wären die Ergebnisse nicht vergleichbar22. Inspiriert von der Arbeit von Pfau et al. und dem Konzept des Sensitivitätsverlusts (Korrektur der in AMD gemessenen Empfindlichkeit für den Sehhügel [abnehmende Netzhautempfindlichkeit mit Abstand zur Fovea] gesunder Kontrollen) für die funduskontrollierte Perimetrie wird Vorhofflimmern mit standardisierten Vorhofflimmerwerten in der gesamten Makula verglichen23,24. Die Ergebnisse werden als Z-Scores (numerische Messung der Beziehung eines Regions of Interest-Werts zum Mittelwert) angegeben.
Das Ziel dieser Studie ist es, den Einsatz eines neuen Instruments zur Messung der lokalen QAF-Spiegel bei verschiedenen Arten von Läsionen bei Patienten mit AMD zu evaluieren. Dieses Gerät wurde entwickelt, um den Autofluoreszenzgrad von Läsionen zu messen, die auf OCT-Scans identifiziert wurden. Dies ermöglicht die Beurteilung des lokalen Autofluoreszenzniveaus in Läsionen, wie z. B. weichen Drusen oder SDDs, und ermöglicht die Verfolgung von AF-Veränderungen von Läsionen im Laufe der Zeit. Der potenzielle Nutzen dieses Werkzeugs besteht darin, einen neuen strukturellen Biomarker zu ermöglichen, der den Zustand des RPE schätzt und möglicherweise einen prognostischen Wert für die untersuchten Läsionen hat.
Protokoll
Die Studie wurde in Übereinstimmung mit der Deklaration von Helsinki durchgeführt und von der Ethikkommission der Universität Bonn genehmigt (Protokollcode 305/21). Von allen an der Studie beteiligten Probanden wurde eine schriftliche Einverständniserklärung eingeholt. Wir verlangten von allen Teilnehmern des Videos, dass sie Freigabeformulare unterschreiben, die uns die Erlaubnis erteilen, ihr Abbild und ihre persönlichen Daten bei der Erstellung eines Online-Videos zu verwenden.
1. Quantitative Autofluoreszenz-Bildaufnahme (QAF)
- Für eine genaue Bildaufnahme mit dem QAF-Gerät ist darauf zu achten, dass der Teilnehmer bequem vor dem Gerät sitzt. Lassen Sie den Teilnehmer sein Kinn und seine Stirn gegen die Kinn- und Kopfstütze drücken. Stellen Sie die Höhe der Kinnstütze so ein, dass der seitliche Lidwinkel auf der gleichen Höhe wie die rote Markierung ist.
- Stellen Sie sicher, dass das Bild im Nahinfrarotmodus fokussiert wird, indem Sie das Rad am Aufnahmegerät drehen, bis die kleinen Gefäße scharf gestellt sind. Vergrößern Sie das Auge, indem Sie die Kamera nach vorne bewegen, bis die Ecken des Bildes gleichmäßig ausgeleuchtet sind. Als Faustregel gilt, dass Sie den Fokus auf das sphärische Äquivalent einstellen sollten. Reduzieren Sie den Fokus vor der QAF-Bildgebung um ein oder zwei Dioptrien, da die blaue QAF eine kürzere Wellenlänge verwendet, und schalten Sie den Modus des QAF-Geräts vom Nahinfrarot- in den QAF-Modus um.
- Passen Sie die Beleuchtung an und skalieren Sie sie hoch, und stimmen Sie den Fokus des Bildes fein ab, bis die kleinen Gefäße, die der Fovea am nächsten sind, scharf sind und das Bild hell ausgeleuchtet ist, ohne rote Punkte (was auf eine Überbeleuchtung hinweist). Bleichen Sie das Fotopigment, indem Sie vor der Bildaufnahme mindestens 30 s im QAF-Modus warten, damit die fortgesetzte Anregung des blauen Lichts das Photorezeptorpigment im Sichtfeld der Kameraeinstellungen ausbleichen kann.
- Um Bilder aufzunehmen, drücken Sie auf dem Touchpad des Bildverarbeitungsgeräts auf Bilderfassung . Stellen Sie sicher, dass Sie mehr als ein QAF-Bild aufnehmen, falls es während der Aufnahme blinzelt oder plötzliche Augenbewegungen gibt.
HINWEIS: Für den Arbeitsablauf sind auch Bilder der optischen Kohärenztomographie (SD-OCT) im Spektralbereich erforderlich. Die OCT-Bildaufnahme wird an anderer Stelle erläutert, da sie in der klinischen Praxis weit verbreitet ist25.
2. Bild-Export
- Stellen Sie für diese Analysepipeline sicher, dass die QAF- und OAT-Bilder im XML-Dateiformat (Extensible Markup Language) vorliegen. Klicken Sie im HEYEX-Viewer mit der rechten Maustaste auf ein gewünschtes QAF/OAT-Bild und wählen Sie im Dropdown-Menü Exportieren | als XML aus.
3. Open-Source-Plug-ins für die QAF-Analyse – Installation der Pipeline
HINWEIS: Bei der vorgestellten QAF-Software handelt es sich um ein Open-Source-Plug-in namens "Spectralis pipeline", das für die Open-Source-Software ImageJ (FIJI-Erweiterung)26 erstellt wurde.
- Um auf das Plug-in zuzugreifen, öffnen Sie FIJI, wählen Sie im Dropdown-Menü "Hilfe" und dann "Aktualisieren" und klicken Sie dann auf "Update-Sites verwalten", um die "https://sites.imagej.net/CreativeComputation/" der Creative Computation-Update-Site zu den bereits vorhandenen Update-Sites hinzuzufügen.
- Laden Sie die Plug-Ins herunter und starten Sie FIJI neu. Nun ist die Spectralis Pipeline installiert. Die verschiedenen Spectralis-Plug-ins finden Sie unter dem Dropdown-Menü Plugins | Spectralis oder Plugins | SpectralisBatch.
4. Einrichtung - Datenspeicherung
HINWEIS: Um einen nahtlosen Arbeitsablauf zu ermöglichen, wird empfohlen, die Ordnerstruktur wie folgt einzurichten. Richten Sie zunächst für jedes Studienfach einen Ordner ein. Oculus dexter (OD) und oculus sinister (OS) beziehen sich auf das rechte bzw. linke Auge, und diese Abkürzungen werden in diesem Workflow verwendet.
- Richten Sie für jedes untersuchte Auge jedes Studiensubjekts einen Ordner für ein OCT mit den Namen OD_OCT bzw. OS_OCT ein. Lassen Sie die Spectralis-Pipeline ihre Ausgabe des "Mark_BScans_OCT"-Plug-Ins automatisch als tabulatorgetrennte Werte in diesen Ordnern speichern.
- Erstellen Sie für die QAF-Images zwei Ordner mit den Namen OD_QAF und OS_QAF.
- Erstellen Sie zusätzliche Ordner, wenn andere multimodale Bildgebungsmodalitäten verwendet werden. Stellen Sie sicher, dass die resultierende Ordnerstruktur der unten aufgeführten Struktur ähnelt:
CASE_ID
OD_OCT
OD_QAF
OD_other_imaging_modality
OS_OCT
OS_QAF
OS_other_imaging_modality
5. Konvertierung der QAF-XML-Datei in ein QAF-Image (verwendetes Plug-in: QAF_xml_reader)
- Die Spectralis QAF XML-Exportdateien werden im Rot-Grün-Blau-Format (RGB) gespeichert, das auf eine Skala von 0 bis 255 (für gemessene AF-Werte) beschränkt ist und "Standard"- und "schwarze" Kalibrierungsbereiche enthält. Das Plug-in "QAF_xml_reader" erzeugt ein QAF-Bild. Öffnen Sie dazu das Dropdown-Menü Plug-ins , wählen Sie Spectralis | QAF_XML_Reader und verwerfen Sie den Startbildschirm.
- Es öffnet sich ein neues Fenster mit der Eingabeaufforderung Wählen Sie ein Verzeichnis, das einen Spectralis XML QAF Export: enthält. Wählen Sie das Verzeichnis aus und klicken Sie auf Auswählen.
- Geben Sie den Referenzkalibrierfaktor (RCF) des QAF-Geräts (in den Bildinformationen des QAF-Bildes enthalten) und das Alter des Patienten zum Zeitpunkt der Aufnahme des Bildes ein.
- Das nächste Fenster heißt QAF-Parameter. Wenn der Patient bei der Bildaufnahme pseudophak ist, wählen Sie stattdessen das Alter von 20 Jahren (dies hat zur Folge, dass keine Alterskorrektur vorgenommen wird). Nachdem Sie auf OK geklickt haben und ein Popup-Fenster mit der Bezeichnung Auf 8bit zuordnen angezeigt wird, geben Sie den minimalen QAF-Wert (qafMin) und den maximalen QAF-Wert (qafMax) für ein farbcodiertes QAF-Bild ein. Falls qafMin und qafMax unbekannt sind, verwenden Sie die Standardeinstellungen, klicken Sie auf OK und sehen Sie sich das Originalbild mit der Bezeichnung QAF-Rohdaten sowie das 32-Bit-QAF- und das 8-Bit-farbcodierte QAF-Bild an.
HINWEIS: Das farbcodierte QAF-Bild dient ausschließlich zur Veranschaulichung. Das 32-Bit-QAF-Bild mit den tatsächlichen QAF-Werten wird für die weitere Analyse verwendet.
6. Registrieren von QAF-Bildern mit dem OCT-Bild (verwendetes Plug-in: Register_OCT_2)
HINWEIS: Dieser Schritt ist erforderlich, um das OCT-Bild genau mit dem QAF-Bild auszurichten, sodass Läsionen in den QAF-Bildern und OCT-BScans ausgerichtet sind.
- Greifen Sie auf das Plug-in über das Dropdown-Menü Plugins | Spectralis, oder erstellen Sie einen Hotkey, um auf die verschiedenen verwendeten Plug-Ins zuzugreifen. Um dies zu erreichen, wählen Sie Register_OCT_2 unter Plugins | Tastaturkürzel | Fügen Sie eine Verknüpfung hinzu und wählen Sie den gewünschten Hotkey.
- Nachdem Sie das Plug-in geöffnet haben, klicken Sie im ersten angezeigten Fenster auf OK . Als Nächstes erscheint ein Fenster mit der Eingabeaufforderung: Wählen Sie ein Verzeichnis, das den Spectralis OCT-XML-Export: enthält: im Hauptfenster von ImageJ. Wählen Sie den Ordner aus, der den Spectralis OCT XML Export enthält, und klicken Sie auf Öffnen.
HINWEIS: Das OAT wird nun geladen, was je nach Rechenleistung des verwendeten Computers bis zu 2 Minuten dauern kann. - Warten Sie als Nächstes, bis ein Fenster mit der Aufforderung Registrierte Bilder speichern unter: angezeigt wird. Wählen Sie das Verzeichnis aus, in dem der EnFaceStack (ausgerichtete Bilddatei) gespeichert werden soll, und klicken Sie auf Öffnen.
- Warten Sie, bis ein Popup-Fenster mit der Eingabeaufforderung Wählen Sie ein Bild aus, das dem EnFaceStack hinzugefügt werden soll: Wählen Sie das 32-Bit-QAF-Bild aus, um das Bild am SD-OCT auszurichten, und klicken Sie auf Öffnen. Wenn alle erforderlichen Bilder in diesem EnFaceStack enthalten sind, wählen Sie Abbrechen aus.
- Wenn der Benutzer im nächsten Fenster aufgefordert wird, eine Beschriftung für den EnFaceStack auszuwählen, wählen Sie die vorgefertigte QAF-Beschriftung aus. Alternativ können Sie den gewünschten Namen der Modalität in das Feld Andere eingeben. Wählen Sie OK aus, um das Bild zu registrieren.
HINWEIS: Fügen Sie keine Leerzeichen oder andere Satzzeichen in das Feld "Sonstiges " ein. - Beobachten Sie die drei Fenster, die sich öffnen. Die erste ist mit Localizer beschriftet und zeigt das SD-OCT als Bild für das linke Auge (OS) an. Das zweite Fenster trägt den Namen QAF oder eine der anderen Modalitäten, die zuvor als ursprüngliches linkes (OS) oder rechtes (OD) Auge ausgewählt wurden. Das letzte Fenster heißt Landmarks und fordert Sie auf, ein bis drei Landmarken in jedem Bild auszuwählen.
- Richten Sie die beiden Bilder aus, indem Sie ein bis drei Landmarken pro Bild-Gefäß-Bifurkationen oder andere Merkmale auswählen, die sich auf beiden Modalitäten befinden. Vergrößern Sie die Ansicht (verwenden Sie das Tastaturzeichen " + zum Vergrößern und " -" zum Verkleinern), bevor Sie die Sehenswürdigkeit auswählen. Stellen Sie sicher, dass die ausgewählten Landmarken sowohl vertikal als auch horizontal im Bild verteilt sind. Nachdem alle Orientierungspunkte mit Anmerkungen versehen wurden, wählen Sie auf der Registerkarte Orientierungspunkte OK und bei der nächsten Eingabeaufforderung Abbrechen aus.
- Wenn ein Fenster mit der Aufforderung Möchten Sie die Ergebnisse anzeigen angezeigt wird, wählen Sie Ja aus, um zu überprüfen, ob das Bild richtig ausgerichtet wurde. Vergrößern Sie dazu ein kleines Gefäß und platzieren Sie den Cursor daneben, und scrollen Sie dann nach oben oder unten, um zu überprüfen, wie stark sich das Gefäß im Verhältnis zum Cursor bewegt. Wenn die Ausrichtung nicht präzise ist, löschen Sie die Datei ".tiff" im Verzeichnis OD_QAF und starten Sie den Prozess am Anfang von Schritt 2 neu.
HINWEIS: Da die Markierungen auf Mark_BScans_OCT präzise sein müssen, muss auch die Ausrichtung zwischen dem SD-OCT- und dem QAF-Bild sehr genau sein. Bei den meisten Bildern kann eine pixelgenaue Ausrichtung erreicht werden, obwohl die Ausrichtung in einigen Fällen auf eine Genauigkeit von drei oder vier Pixeln beschränkt ist.
7. Erstellen eines gemittelten QAF-Bildes zum Vergleich (verwendetes Plug-in: StandardRetina/BatchStandardRetina)
HINWEIS: Die QAF-Werte hängen stark von der Lage der Netzhaut ab (z. B. zentrale Abschattung durch Makulapigment). Daher sollten die QAF-Werte von Drusen mit den Standard-QAF-Werten der gleichen Region verglichen werden. Als Voraussetzung für die Analyse erstellt die StandardRetina eine Enface-Map von gemittelten QAF-Bildern (z. B. aus einer altersgematchten Kontrollkohorte). Die resultierende Enface-Map zeigt eine pixelweise Abbildung eines durchschnittlichen QAF-Wertes für die zentrale Netzhaut.
- Es gibt zwei Möglichkeiten, Standard-Netzhäute innerhalb der Spectralis-Pipeline zu erstellen: Die erste, AddToStandardRetina_OCT, lässt jeweils einen neuen Fall zur Enface-Karte zu, während die zweite, BatchStandardRetina, mehrere Fälle auf einmal hinzufügt.
- Um jeweils ein Bild hinzuzufügen, wählen Sie Plugins | Spektralis | AddToStandardRetina_OCT und schließen Sie den Startbildschirm. Wenn ein Fenster mit dem Text Choose a directory containing a Spectralis OCT XML export angezeigt wird, wählen Sie den Ordner aus und klicken Sie auf Auswählen, um den BScan zu öffnen.
- Wenn ein neues Fenster mit der Eingabeaufforderung Wählen Sie ein Verzeichnis mit registrierten EnFace-Bildern: angezeigt wird, wählen Sie den entsprechenden Ordner aus und klicken Sie auf Auswählen.
- Beobachten Sie die drei angezeigten Fenster, eines mit der Bezeichnung EnFaceStack , in dem die gestapelten Bilder aus dem im zweiten Schritt ausgewählten Ordner angezeigt werden, das zweite mit der Bezeichnung Bscan Stack , in dem der OCT-BScan angezeigt wird, und ein drittes Fenster, das in der Mitte mit der Bezeichnung Modalität auswählen angezeigt wird. Wählen Sie eine Modalität aus dem EnFaceStack aus.
- Wählen Sie eine Modalität aus und beobachten Sie das neue Fenster, das sich mit der Eingabeaufforderung Choose a directory containing the StandardRetina öffnet. Wenn noch kein Verzeichnis mit einer StandardRetina vorhanden ist, wählen Sie einen leeren Ordner aus, um eine neue StandardRetina zu erstellen.
- Untersuchen Sie die neue StandardRetina, scrollen Sie nach oben und unten, und bewegen Sie den Cursor, um den Mittelwert und die Standardabweichung für diese bestimmte Position anzuzeigen. Klicken Sie auf den Button Akzeptieren? Um entweder das neueste Foto zur StandardRetina hinzuzufügen oder es zu verwerfen.
- Wenn Sie mehrere Bilder gleichzeitig hinzufügen möchten, verwenden Sie Batch_QAF_StandardRetina.
- Bereiten Sie zunächst eine "manifest.txt" -Datei im selben Ordner wie die Fall-IDs vor und stellen Sie sicher, dass sie den relativen Pfad vom Speicherort der .txt-Datei zum OAT und zum EnFaceStack auflistet. Trennen Sie die beiden durch ein Tabulatorzeichen und stellen Sie sicher, dass sich vor und hinter den Namen keine zusätzlichen Leerzeichen befinden. Die Datei sollte diesem Setup ähneln:
pathToOCT_1>pathToEnFaceStack_1>001/OD-OKT>001/OD-QAF
pathToOCT_2>pathToEnFaceStack_2>002/OD-OCT>002/OD-QAF - Erstellen Sie die Datei in einer Tabellenkalkulationssoftware und speichern Sie sie als txt-Datei. Stellen Sie sicher, dass alle Pfade das Slice (Zeichenbuchstaben) QAF enthalten, damit die Manifestdatei ordnungsgemäß funktioniert. Die Plug-ins befinden sich unter dem Dropdown-Menü Plugins | SpectralisBatch-Batch | QAF_StandardRetina.
- Schließen Sie den Startbildschirm und warten Sie, bis sich ein neues Fenster öffnet, in dem die Eingabeaufforderung Select the initial Standard Retina angezeigt wird. Wählen Sie entweder einen Ordner mit einer bereits vorhandenen StandardRetina oder einen leeren Ordner aus, um eine neue StandardRetina zu erstellen.
- Suchen Sie nach einer Eingabeaufforderung mit der Bezeichnung "Modalität auswählen". Der Standardwert ist QAF. Stellen Sie sicher, dass der Dateiname der jeweiligen Modalität genau mit dem Dateinamen für einen Slice in jedem EnFaceStack übereinstimmt, der in der Manifestdatei benannt ist. Wenn sich dann ein Fenster öffnet, in dem der Benutzer aufgefordert wird, eine Manifestdatei auszuwählen (siehe oben), klicken Sie auf Abbrechen, wenn dieser StandardRetina keine andere Manifestdatei hinzugefügt werden soll, oder wählen Sie eine andere Manifestdatei aus. Untersuchen Sie die neue StandardRetina in einem neuen Fenster mit der Bezeichnung "Akzeptieren?", und entscheiden Sie, ob Sie die neueste Charge zur StandardRetina hinzufügen oder die neueste Charge verwerfen möchten.
HINWEIS: Der Prozess der Kombination aller QAFs zu einer StandardRetina kann eine Weile dauern.
- Bereiten Sie zunächst eine "manifest.txt" -Datei im selben Ordner wie die Fall-IDs vor und stellen Sie sicher, dass sie den relativen Pfad vom Speicherort der .txt-Datei zum OAT und zum EnFaceStack auflistet. Trennen Sie die beiden durch ein Tabulatorzeichen und stellen Sie sicher, dass sich vor und hinter den Namen keine zusätzlichen Leerzeichen befinden. Die Datei sollte diesem Setup ähneln:
8. Annotation von Interessenbereichen für die Analyse (verwendetes Plug-in: Mark_BScans_OCT)
- Um Läsionen (z. B. Drusen) zu markieren, öffnen Sie Plugins | Spektralis | Mark_BScans_OCT und schließen Sie die Eröffnungsaufforderung. Suchen Sie nach einem neuen Fenster mit der Bezeichnung Wählen Sie ein Verzeichnis aus, das einen Spectralis OCT-XML-Export enthält. Wählen Sie den Ordner mit dem gewünschten OAT aus, und klicken Sie auf OK.
- Nachdem FIJI das OAT geladen hat, beobachten Sie das neue Fenster mit der Beschriftung Wählen Sie ein Verzeichnis aus, das registrierte Bilder enthält, die angezeigt werden sollen. Wählen Sie das Verzeichnis aus, das den EnFaceStack enthält, und klicken Sie auf Auswählen.
- Es werden nun drei neue Fenster angezeigt, eines mit der Bezeichnung EnFaceStack, eines mit der Bezeichnung BscanStack und eines mit dem Namen Benutzerparameter.
- Im Fenster Benutzerparameter wird der Benutzer aufgefordert, die folgenden Parameter einzugeben: Case-ID, die dann im Namen der Ausgabe-CSV-Datei angezeigt wird, Bandbreite in mm, die Breite der Enface-Linie, die Breite der BScan-Linie und die Deckkraft der Regionsmaske.
- Der Parameter Bandbreite in mm bestimmt die Breite jeder Iso-Hülle in Millimetern (mm). Verwenden Sie Enface-Linienbreite , um die Linienbreite markierter Läsionen im Fenster mit der Bezeichnung EnFaceStack zu ändern.
- Die BScan-Linienbreite bestimmt die Linienbreite auf dem Bscan-Stack des Fensters. Beachten Sie, dass das Festlegen dieses Parameters auf 1 in den meisten Fällen die beste Einstellung für die Linienbreite ist.
- Wählen Sie zwischen einer En-Gesichtsmaske oder einer Entfernungskarte, die in einem separaten Fenster angezeigt wird, um zu entscheiden, ob Innenbänder eingefärbt werden sollen. Klicken Sie anschließend im Fenster In BScan markieren im Plug-in auf Fertig.
- Wenn Sie aufgefordert werden, eine bereits vorhandene StandardRetina auszuwählen, wählen Sie den Ordner aus, der die StandardRetina enthält, und klicken Sie auf Auswählen. Beachten Sie, dass, wenn eine StandardRetina ausgewählt ist, der Ausgangs-Mark_BScans_OCT den Modus Z-Score (eines gemessenen QAF-Wertes im Vergleich zu StandardRetina) auswählt. Wenn der rohe QAF-Wert bevorzugt wird, klicken Sie auf Abbrechen und warten Sie auf ein neues Fenster mit der Bezeichnung Meldung, in dem gewarnt wird, dass es sich bei den Ergebnissen um Rohwerte und nicht um Z-Werte handelt.
- Im Fenster Benutzerparameter wird der Benutzer aufgefordert, die folgenden Parameter einzugeben: Case-ID, die dann im Namen der Ausgabe-CSV-Datei angezeigt wird, Bandbreite in mm, die Breite der Enface-Linie, die Breite der BScan-Linie und die Deckkraft der Regionsmaske.
- Suchen Sie nach einem neuen Fenster, in dem Sie aufgefordert werden, ein Verzeichnis auszuwählen, das den gespeicherten Zustand mit den gespeicherten Daten enthält . Wenn eine Speicherdatei vorhanden ist, klicken Sie auf das Verzeichnis, das die Slices enthält | Wählen Sie aus. Falls der Fortschritt nicht gespeichert werden soll, wählen Sie Abbrechen. Suchen Sie in BScan nach einem neuen Fenster mit der Bezeichnung "Markieren" und wählen Sie in einem Dropdown-Menü "Speichern", " Ignorieren", "Fertig" und " Markieren" aus.
- Markieren: Beginnen Sie mit der Kommentierung der interessierenden Regionen im BScan, mit ähnlichen Befehlen wie im oben erklärten "Register_OCT_2"-Plug-in. Um einen Bereich zu markieren, wählen Sie Start , indem Sie mit der rechten Maustaste klicken und den Mauszeiger an das Ende der Läsion ziehen, stellen Sie sicher, dass die Markierung im Fenster In B-Sscan markieren ausgewählt ist, und klicken Sie auf OK. Die Region of Interest ist nun in diesem BScan markiert.
- Ignorieren: Wählen Sie im Fenster In BScan markieren die Option Ignorieren und klicken Sie auf OK, um die Markierung zu ignorieren.
- Retten: Wählen Sie Speichern im Fenster In BScan markieren und klicken Sie auf OK , um ein neues Fenster zu öffnen, das die Aufforderung enthält, ein Verzeichnis auszuwählen, das gespeichert werden soll. Wählen Sie einen bereits vorhandenen Ordner aus oder erstellen Sie einen neuen. Öffnen Sie bereits vorhandene Dateien, indem Sie "Mark_BScans_OCT" starten, und wählen Sie das Verzeichnis aus, das den Speicherstatus enthält, wenn das Fenster Wählen Sie ein Verzeichnis aus, das den gespeicherten Zustand enthält angezeigt wird.
HINWEIS: Mehrere Speicherstände können nicht in einem Verzeichnis gespeichert werden. Speicherzustände von einem Gebietsschema in ein anderes können nicht einfach umgeschaltet werden (z. B. DEUTSCH zu USA). - Fertig: Wählen Sie im Fenster In BScan markieren die Option Fertig aus und klicken Sie auf OK, um ein neues Fenster mit der Beschriftung Modalität auswählen anzuzeigen.
- Wenn eine Eingabeaufforderung mit der Bezeichnung "Bring the correct modality on above on the enface stack" angezeigt wird, bringen Sie die Modalität QAF nach oben, die mit "Register_OCT_2" ausgerichtet wurde. Scrollen Sie dazu entweder durch den EnFaceStack, wählen Sie das Fenster En-Face-Stack aus oder klicken Sie auf den Pfeil nach links oder rechts. Beachten Sie, dass der Name der Modalität in der oberen linken Ecke angezeigt wird.
- Um die Läsionen besser inspizieren und markieren zu können, zoomen Sie in das Bscan-Fenster. Klicken Sie auf das B-Bild-Fenster , zeigen Sie mit der Maus in die Richtung, in die Sie hineinzoomen möchten, und drücken Sie die Taste + . Um die Ansicht zu verkleinern, drücken Sie die Taste -.
- Scrollen Sie durch den BScan-Stapel, indem Sie mit der Maus nach oben oder unten scrollen, den Balken unten nach links oder rechts ziehen, um sich durch den Scan zu bewegen, oder indem Sie den B-Scan-Rahmen auswählen und auf die Pfeiltasten nach links und rechts auf der Tastatur klicken. Beachten Sie, dass eine Übersicht über den aktuellen Bereich im BScan-Stack durch die rote Linie im EnFaceStack-Fenster und oben links im BScan-Fenster gegeben wird, wo die BScan-Nummer (z.B. 31/120) angezeigt wird.
- Klicken Sie auf OK , um eine neue .tsv-Datei im entsprechenden Ordner "OD_OCT" oder "OS_OCT" zu erstellen. Beachten Sie, dass sich der .tsv-Dateiname aus "Mark_Bscans_OCT" plus der eingegebenen Fall-ID, der Lateralität und der Modalität zusammensetzt, die im letzten Schritt der Mark_Bscans_OCT ausgewählt wurde. Zusätzlich werden nun farblich gekennzeichnete "Iso-Hüllen" der Drusen im EnFaceStack angezeigt.
Ergebnisse
Anzeigen der Ausgabe
Um die Ergebnisse angemessen analysieren und Schlussfolgerungen daraus ziehen zu können, ist es wichtig, die Ausgabedatei von Mark_Bscans_OCT zu verstehen. Die ersten drei Spalten sind nach der Fall-ID, der Lateralität der Datei und der ausgewählten Imaging-Modalität beschriftet. Die vierte Spalte wird nach Modus bezeichnet und ist mit Z-Score beschriftet. Beachten Sie, dass Mark BScans zum Zeitpunkt des Schreibens dieses Textes nur alle Läsionen auf einmal berechnen kann. Die Zeilen beziehen sich auf ISO-Hüllen, deren Abstände vom äußeren Rand der Läsion in den unteren und oberen Spalten der Tabelle angegeben sind. Iso-Hüllen messen AF in z-Scores (im Falle von QAF) in einem bestimmten Umfang, der die Läsion umgibt. Beachten Sie, dass der Minimalwert eines Pixels in einer ISO-Hülle in den Spalten mit der Bezeichnung min zu finden ist, während die Spalten mit den Bezeichnungen median, max, mean und stdev jeweils den Median, das Maximum, den Mittelwert und die Standardabweichung des Mittelwerts der Pixelwerte in eineriso-Hülle enthalten. Die Spalte n enthält die Gesamtzahl der Pixel in einer Iso-Hülle. Abbildung 1 zeigt eine einzelne markierte weiche Drusen eines 84-jährigen männlichen Patienten mit intermediärer altersbedingter Makuladegeneration (iAMD).
Abbildung 2 zeigt das linke Auge eines repräsentativen Patienten mit SDDs, die mit dem QAF-Workflow-Tool markiert wurden (Abbildung 3). SDDs bei diesem Patienten waren mit einem reduzierten Vorhofflimmern assoziiert (Z-Score = -0,4 ± 0,2). In ähnlicher Weise zeigten die Iso-Hüllen um das SDD herum einen reduzierten AF (z. B. nächstgelegene Iso-Hülle = -0,3 ± 0,3) im Vergleich zur StandardRetina. Eine plausible Erklärung für dieses Phänomen könnten Abschattungseffekte (verminderte Transluzenz) von SDD-Läsionen auf dem RPE sein. Der Einsatz von SDDs war vorbildlich. Das Tool ermöglicht die Beurteilung des lokalen Vorhofflimmerns auch bei anderen Läsionen, wie z. B. Drusen. Darüber hinaus ermöglicht das Tool die Verfolgung von AF-Veränderungen von Läsionen im Laufe der Zeit.
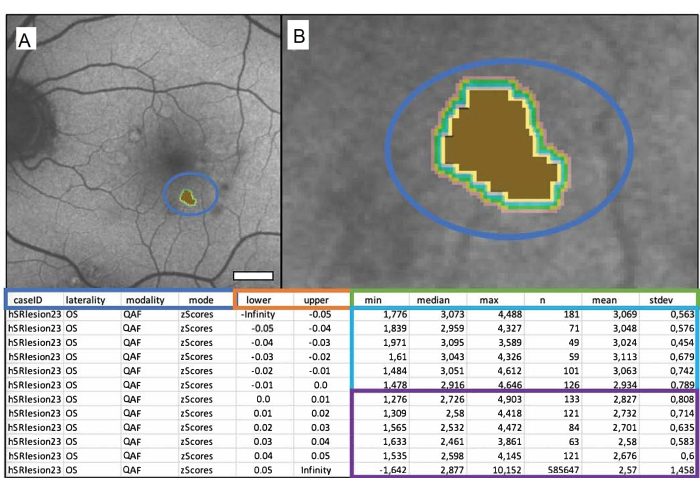
Abbildung 1: Eine einzelne markierte weiche Drusen eines 84-jährigen männlichen Patienten mit intermediärer altersbedingter Makuladegeneration (iAMD). (A) Das QAF-Bild eines linken Auges mit dem markierten Drusen. (B) Nahaufnahme der Drusen: braune Mitte, die die markierten Drusen darstellt, und farbige Bänder, die die umgebenden Iso-Rümpfe darstellen. Die folgende Tabelle zeigt die Ausgabedatei. QAF-Drusen-Werte werden mit entsprechenden QAF-Werten der entsprechenden Exzentrizität aus der StandardRetina verglichen. Dies führt zu Z-Werten, die eine Abweichung vom Mittelwert der nicht betroffenen Bereiche darstellen. Das blaue Kästchen zeigt von links nach rechts: die Fall-ID, die Lateralität des Auges, die verwendete Modalität und die gewünschte Ausgabe (in diesem Fall Z-Scores). Spalten innerhalb des orangefarbenen Kastens zeigen die Grenzen der gemessenen Fläche in Millimetern an (untere = untere Grenze, obere = obere Grenze). Das grüne Kästchen beschriftet die Spalten mit den QAF-Messungen. Diese enthalten von links nach rechts das Minimum, den Median, das Maximum, die Anzahl der Pixel, den Mittelwert und die Standardabweichung des Mittelwerts. Jede Zeile stellt eine Iso-Hülle dar, Zeilen innerhalb des blauen Kästchens stellen Werte innerhalb der Läsion dar und Zeilen innerhalb des violetten Kästchens zeigen die Iso-Hüllen, die jede Läsion umgeben (von oben nach unten mit zunehmendem Abstand zur Läsion). Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
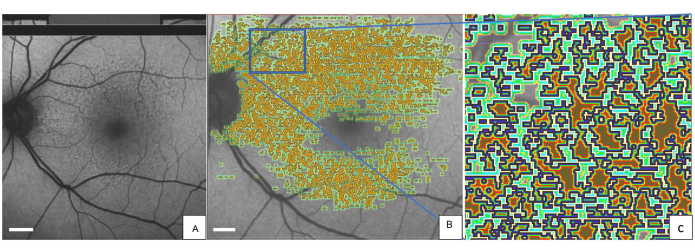
Abbildung 2: Markierte SDDs in einem QAF-Bild einer 80-jährigen Patientin mit AMD im Frühstadium. (A) SDDs sind im QAF-Bild zu sehen. Das gleiche QAF-Bild wird mit aufgedruckten Annotationen von SDDs gezeigt. (B) Um jede markierte Läsion herum sind die Iso-Hüllen mit einer Farbkodierung (hellgrün, dunkelgrün und rot) dargestellt. (C) Eine vergrößerte Version des blauen Rechtecks. Der äußere Rand jedes SDD ist blau markiert. Abkürzungen: QAF = quantitative Autofluoreszenz; AMD = altersbedingte Makuladegeneration; SDD = subretinale Drusenoidablagerung. Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
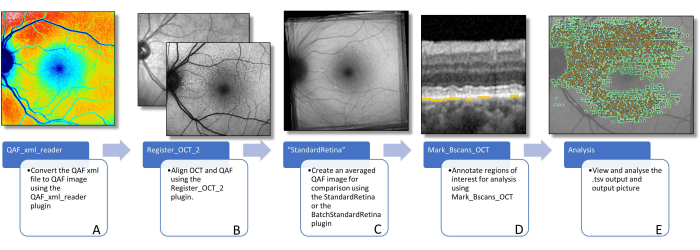
Abbildung 3: Arbeitsablauf zur Bestimmung des Vorhofflimmerns von Läsionen. Diese Abbildung visualisiert die Software-Plug-ins, die zur Bestimmung des läsionsspezifischen Vorhofflimmerns erforderlich sind. (A) Das Bild zeigt ein farbkodiertes QAF-Bild, das zur Visualisierung der Verteilung von QAF-Werten verwendet werden kann, aber nicht für weitere Analysen verwendet werden sollte. (B) Ein QAF-Bild im Vordergrund mit dem Infrarotbild des SD-OCT-Scans im Hintergrund. Damit soll die Ausrichtung anhand von Gefäßverzweigungen sichtbar gemacht werden. Dies kann mit dem Register_OCT_2-Plug-in erfolgen. (C) Ein StandardRetina, das zur Messung der Z-Score-Werte von Läsionen verwendet wird. StandardRetinas können mit StandardRetina/BatchStandardRetina erstellt werden. (D) Es wird ein BScan mit blauen Pfeilen dargestellt, die auf SDDs zeigen, die durch gelbe Linien hervorgehoben sind (Hinweis: Läsionen werden immer unterhalb des RPE markiert, unabhängig von der Lokalisation in z-Richtung). (E) Alle markierten Läsionen sind auf einem QAF-Bild aufgedruckt (siehe Abbildung 1). Die letzten beiden Schritte werden mit dem Mark_BScans_OCT-Plug-in ausgeführt. Abkürzungen: AF = Autofluoreszenz; QAF = quantitative Autofluoreszenz; SDD = subretinale Drusenoidablagerung; IR = Infrarot; RPE = retinales Pigmentepithel; SD-OCT = optische Kohärenztomographie im Spektralbereich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieser Arbeitsablauf bietet eine Schritt-für-Schritt-Anleitung zur Verwendung von Open-Source-FIJI-Plug-in-Tools zur Bestimmung und zum Vergleich von Vorhofflimmern von AMD-spezifischen Läsionen. Die Plug-ins bieten einfach zu bedienende Vorlagen, die keine Programmierkenntnisse erfordern und von Ärzten ohne technische Unterstützung angewendet werden können27. Unseres Wissens nach sind diese Werkzeuge einzigartig für die läsionsspezifische Quantifizierung von Vorhofflimmern.
Die QAF-Werte variieren auf natürliche Weise über die Netzhaut, wobei die Werte an der Peripherie höher und in der Makula niedriger sind, was auf eine ungleichmäßige Verteilung von Lipofuszin und Melanolipofuszin innerhalb der Netzhaut, den niedrigen AF der Gefäße und eine ungleichmäßige Verteilung der Makulapigmente zurückzuführen ist. Aufgrund der hohen Variation der natürlich vorkommenden QAF-Spiegel in der Netzhaut ist die direkte Analyse der absoluten QAF-Werte von Läsionen kein vielversprechender Ansatz. Zum Beispiel kann eine hypoautofluoreszierende Läsion in der Peripherie immer noch höhere absolute QAF-Werte aufweisen als physiologische Fluoreszenzwerte der Makula. Die Verwendung eines StandardRetina und die Verwendung von Z-Scores zur Messung der Fluoreszenzwerte von Drusen korrigieren diese natürlich auftretende Varianz der QAF-Werte.
Ein Z-Score ist ein numerisches Maß für die Beziehung eines Regions of Interest-Werts zum Mittelwert in der StandardRetina. Sie wird berechnet, indem der Mittelwert eines Individuums vom Mittelwert der StandardRetina an derselben Stelle subtrahiert und dann das Ergebnis durch die Standardabweichung dividiert wird. Diese Standardisierung ermöglicht den Vergleich verschiedener QAF-Bilder, da der Z-Score angibt, um wie viele Standardabweichungen ein Wert vom Mittelwert abweicht. Ein positiver Z-Wert gibt an, dass der Wert über dem Mittelwert liegt, während ein negativer Z-Wert angibt, dass er unter dem Mittelwert liegt.
Es ist wichtig zu beachten, dass es potenzielle Fallstricke geben kann, die berücksichtigt werden sollten. Obwohl diese Methode die unterschiedliche Anzahl von AF-Werten im gesamten Fundus berücksichtigt, ist sie möglicherweise immer noch nicht die genaueste Methode, um den AF eines RPE zu messen und zu vergleichen. Individuen haben unterschiedliche Konzentrationen und Topographien des Makula-Lutealpigments, und Läsionen können auch die Transluzenz der darüber liegenden Netzhaut beeinträchtigen28,29. Es ist daher plausibel, dass der gemessene reduzierte AF in Bereichen von SDDs (siehe repräsentative Ergebnisse) eher eine Folge von Abschattungseffekten als von verminderten Fluorophoren im RPEist 30,31,32.
Wir arbeiten derzeit an einem Workflow zur Berücksichtigung der retinalen Reflektivität, der Dicke und des quantifizierten Makulapigments (mit grünem und blauem AF) mit linearen Mischmodellen. Darüber hinaus verwendet QAF bisher einen altersabhängigen Korrekturfaktor zur Berücksichtigung der Lentikulartrübung, der interindividuelle Unterschiede in der Lentikulartrübung von Teilnehmern eines ähnlichen Alters von33 Jahren außer Acht lässt. Wir arbeiten daher derzeit an einem Workflow für einen personalisierten Korrekturfaktor der linsenförmigen Autofluoreszenz und Trübung. Um zuverlässig Informationen über Vorhofflimmern aus kleinen Läsionen zu extrahieren, ist eine angemessene Test-Retest-Reliabilität von QAF-Bildern erforderlich. Um diejenigen QAF-Bilder weiter zu differenzieren, bei denen eine detailliertere Analyse möglich ist, untersuchen wir "QAF-Bildzuverlässigkeitsindizes", die die Test-Retest-Reliabilität von QAF-Bildern vorhersagen können. Im gegenwärtigen Stadium besteht der vorsichtige Ansatz darin, doppelte Bilder aufzunehmen und die Reliabilität von läsionsspezifischem Vorhofflimmern zu untersuchen.
Die vorgestellte Methode zur zusätzlichen Analyse der Isohüllen von Läsionen war technisch schwierig umzusetzen, da Isohüllen benachbarter Läsionen verschmelzen. Bereiche mit verschmolzenen Iso-Hüllen konnten je nachdem, welche Läsion betrachtet wird, unterschiedlich charakterisiert werden. Unsere Lösung bestand darin, alle Läsionen eines Typs als eine Läsion zu betrachten und ihre Peripherie als gemeinsame Isohülle zu analysieren. Diese Methode reduziert jedoch drastisch die Fähigkeit, die Iso-Hüllen einzelner Drusen zu messen, und könnte als ein weiterer Fallstrick dieser Technik angesehen werden. Technisch ausgefeiltere Methoden zur Berücksichtigung von verschmolzenen Iso-Hüllen oder die ausgesetzte Meldung von Vorhofflimmern in Bereichen mit verschmolzenen Iso-Hüllen könnten in Zukunft die Analyse von Vorhofflimmern im Umfang von Läsionen erleichtern.
Für diese Studie haben wir AMD als Modellerkrankung verwendet. Der Arbeitsablauf kann auch für die Untersuchung von Läsionen bei anderen Krankheiten angepasst werden. Bisher wurde QAF bei vielen chorioretinalen Erkrankungen eingesetzt, darunter die rezessive Stargardt-Krankheit, Bestrophin-1-assoziierte Erkrankungen, verschiedene Formen der Retinitis pigmentosa, die akute zonale okkulte äußere Retinopathie, Pseudoxanthoma elasticum und andere 17,33,34,35,36,37 . Da für diesen Arbeitsablauf Open-Source-Software verwendet wird, ermutigen wir andere, diese Arbeit bei der Bestimmung von läsionsspezifischem Vorhofflimmern zu duplizieren und unser Wissen über Netzhauterkrankungen zu erweitern. Zusammenfassend stellen wir einen Arbeitsablauf vor, mit dem die AF-Konzentrationen verschiedener Netzhautläsionen in der gesamten Makula bestimmt und verglichen werden können. Dieser Arbeitsablauf ebnet den Weg für eine tiefergehende Analyse von Vorhofflimmern und könnte die Entwicklung neuer Biomarker bei AMD und darüber hinaus erleichtern.
Offenlegungen
Leon von der Emde berichtet, dass er Zahlungen von Heidelberg Engineering erhalten hat. Merten Mallwitz berichtet über keine finanziellen Angaben. Kenneth R. Sloan berichtet ebenfalls über keine finanziellen Offenlegungen. Frank G. Holz berichtet über Beratungs-/Privatzahlungen für Acucela, Alcon (C), Gyroscope Allergan Apellis, Bayer Bioeq/Formycon, CenterVue, Roche/Genentech, Geuder, Ivericbio, NightStarX, Novartis, Optos, Oxurion, Pixium Vision, Stealth BioTherapeutics, Zeiss und GRADE Reading Center. Thomas Ach berichtet über Consulting/Personal Payments für Bayer, Apellis, Roche und Novartis.
Danksagungen
Diese Arbeit wurde durch das Stipendium der Deutschen Ophthalmologischen Gesellschaft (DOG) für Doktoranden (MW) und das NIH/NEI 1R01EY027948 (TA) gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| BatchStandardRetina plugin | n.a. | n.a. | n.a. |
| FIJI (Image J) | n.a. | n.a. | n.a. |
| Mark_Bscans_OCT plugin | n.a. | n.a. | n.a. |
| Microspft office | Microsoft | n.a. | n.a. |
| QAF_xml_reader plugin | n.a. | n.a. | n.a. |
| Register_OCT_2 plugin | n.a. | n.a. | n.a. |
| Spectralis | Heidelberg Engineering | n.a. | QAF extension |
| StandardRetina plugin | n.a. | n.a. | n.a. |
Referenzen
- Schmitz-Valckenberg, S., et al. Fundus autofluorescence imaging. Progress in Retinal and Eye Research. 81, 100893(2021).
- Bermond, K., et al. Autofluorescent granules of the human retinal pigment epithelium: phenotypes, intracellular distribution, and age-related topography. Investigative Ophthalmology and Visual Science. 61 (5), 35(2020).
- Bermond, K., et al. Autofluorescent organelles within the retinal pigment epithelium in human donor eyes with and without age-related macular degeneration. Investigative Ophthalmology and Visual Science. 63 (1), 23(2022).
- Delori, F., et al. Quantitative measurements of autofluorescence with the scanning laser ophthalmoscope. Investigative Ophthalmology and Visual Science. 52 (13), 9379-9390 (2011).
- Fleckenstein, M., et al. Age-related macular degeneration. Nature Reviews Disease Primers. 7 (1), 31(2021).
- Greenberg, J. P., et al. Quantitative fundus autofluorescence in healthy eyes. Investigative Ophthalmology and Visual Science. 54 (8), 5684-5693 (2013).
- Sparrow, J. R., Boulton, M. RPE lipofuscin and its role in retinal pathobiology. Experimental Eye Research. 80 (5), 595-606 (2005).
- vonder Emde, L., et al. Natural history of quantitative autofluorescence in intermediate age-related macular degeneration. Retina. 41 (4), 694-700 (2021).
- Reiter, G. S., et al. Longitudinal changes in quantitative autofluorescence during progression from intermediate to late age-related macular degeneration. Retina. 41 (6), 1236-1241 (2021).
- Gliem, M., et al. Quantitative fundus autofluorescence in early and intermediate age-related macular degeneration. JAMA Ophthalmology. 134 (7), 817-824 (2016).
- Hussain, R. M., Gregori, N. Z., Ciulla, T. A., Lam, B. L. Pharmacotherapy of retinal disease with visual cycle modulators. Expert Opinion on Pharmacotherapy. 19 (5), 471-481 (2018).
- Ammar, M. J., Hsu, J., Chiang, A., Ho, A. C., Regillo, C. D. Age-related macular degeneration therapy: a review. Current Opinion in Ophthalmology. 31 (3), 215-221 (2020).
- Ach, T., et al. Lipofuscin redistribution and loss accompanied by cytoskeletal stress in retinal pigment epithelium of eyes with age-related macular degeneration. Investigative Ophthalmology and Visual Science. 56 (5), 3242-3252 (2015).
- Zanzottera, E. C., Messinger, J. D., Ach, T., Smith, R. T., Curcio, C. A. Subducted and melanotic cells in advanced age-related macular degeneration are derived from retinal pigment epithelium. Investigative Ophthalmology and Visual Science. 56 (5), 3269-3278 (2015).
- Cao, D., et al. Hyperreflective foci, optical coherence tomography progression indicators in age-related macular degeneration, include transdifferentiated retinal pigment epithelium. Investigative Ophthalmology and Visual Science. 62 (10), 34(2021).
- Zanzottera, E. C., et al. The Project MACULA retinal pigment epithelium grading system for histology and optical coherence tomography in age-related macular degeneration. Investigative Ophthalmology and Visual Science. 56 (5), 3253-3268 (2015).
- Sparrow, J. R., Duncker, T., Schuerch, K., Paavo, M., de Carvalho, dR. L. Lessons learned from quantitative fundus autofluorescence. Progress in Retinal and Eye Research. 74, 100774(2020).
- Schmitz-Valckenberg, S., et al. Correlation between the area of increased autofluorescence surrounding geographic atrophy and disease progression in patients with AMD. Investigative Ophthalmology and Visual Science. 47 (6), 2648-2654 (2006).
- Ach, T., Bermond, K. Autofluorescence of the human retinal pigment epithelium in normal aging and in age-related macular degeneration: histology and clinical correlation. Klinische Monatsblatter Fur Augenheilkunde. 236 (5), 672-681 (2017).
- Pollreisz, A., et al. Visualizing melanosomes, lipofuscin, and melanolipofuscin in human retinal pigment epithelium using serial block face scanning electron microscopy. Experimental Eye Research. 166, 131-139 (2018).
- Bernstein, P. S., et al. meso-zeaxanthin: The basic and clinical science underlying carotenoid-based nutritional interventions against ocular disease. Progress in Retinal and Eye Research. 50, 34-66 (2016).
- Göbel, A. P., Fleckenstein, M., Heeren, T. F. C., Holz, F. G., Schmitz-Valckenberg, S. In-vivo mapping of drusen by fundus autofluorescence and spectral-domain optical coherence tomography imaging. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (1), 59-67 (2016).
- Pfau, M., et al. Mesopic and dark-adapted two-color fundus-controlled perimetry in geographic atrophy secondary to age-related macular degeneration. Retina. 40 (1), 169-180 (2020).
- vonder Emde, L., et al. Mesopic and dark-adapted two-color fundus-controlled perimetry in choroidal neovascularization secondary to age-related macular degeneration. Translational Vision Science and Technology. 8 (1), 7(2018).
- Aumann, S., Donner, S., Fischer, J., Müller, F. Optical coherence tomography (OCT): principle and technical realization. High Resolution Imaging in Microscopy and Ophthalmology: New Frontiers in Biomedical Optics. , Cham (CH), Springer. 59-85 (2019).
- Schindelin, J., et al. FIJI: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Kleefeldt, N., et al. Quantitative fundus autofluorescence: advanced analysis tools. Translational Vision Science and Technology. 9 (8), 2(2020).
- Hong, I. H., Jung, W. H., Lee, J. H., Chang, I. B. Macular pigment optical density in the Korean population: a cross sectional study. Journal of Korean Medical Science. 35 (5), e30(2020).
- Putnam, C. M. Clinical imaging of macular pigment optical density and spatial distribution. Clinical and Experimental Optometry. 100 (4), 333-340 (2017).
- Zweifel, S. A., Spaide, R. F., Curcio, C. A., Malek, G., Imamura, Y. Reticular pseudodrusen are subretinal drusenoid deposits. Ophthalmology. 117 (2), 303-312 (2010).
- Curcio, C. A., et al. Subretinal drusenoid deposits in non-neovascular age-related macular degeneration: morphology, prevalence, topography, and biogenesis model. Retina. 33 (2), 265-276 (2013).
- Spaide, R. F. Outer retinal atrophy after regression of subretinal drusenoid deposits as a newly recognized form of late age-related macular degeneration. Retina. 33 (9), 1800-1808 (2013).
- Reiter, G. S. Influence of lens opacities and cataract severity on quantitative fundus autofluorescence as a secondary outcome of a randomized clinical trial. Scientific Reports. 11 (1), 12685(2021).
- Gliem, M., et al. Quantitative fundus autofluorescence in pseudoxanthoma elasticum. Investigative Ophthalmology and Visual Science. 58 (14), 6159-6165 (2017).
- Burke, T. R., et al. Quantitative fundus autofluorescence in recessive Stargardt disease. Investigative Ophthalmology and Visual Science. 55 (5), 2841-2852 (2014).
- Armenti, S. T., Greenberg, J. P., Smith, R. T. Quantitative fundus autofluorescence for the evaluation of retinal diseases. Journal of Visualized Experiments. (109), 53577(2016).
- Pröbster, C., et al. Quantitative fundus autofluorescence in the developing and maturing healthy eye. Translational Vision Science and Technology. 10 (2), 15(2021).
- Duncker, T., et al. Quantitative fundus autofluorescence and optical coherence tomography in PRPH2/RDS- and ABCA4-associated disease exhibiting phenotypic overlap. Investigative Ophthalmology and Visual Science. 56 (5), 3159-3170 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten