Method Article
Un flux de travail pour déterminer quantitativement les variations spécifiques de la lésion de la dégénérescence maculaire liée à l’âge dans l’autofluorescence du fond d’œil
Dans cet article
Résumé
Cette recherche décrit un flux de travail permettant de déterminer et de comparer les niveaux d’autofluorescence de régions d’intérêt individuelles (par exemple, les dépôts de drusen et de drusénoïdes sous-rétiniens dans la dégénérescence maculaire liée à l’âge [DMLA]) tout en tenant compte des niveaux d’autofluorescence variables dans le fond d’œil.
Résumé
L’imagerie par autofluorescence du fond d’œil (FAF) permet de cartographier de manière non invasive les fluorophores intrinsèques du fond d’œil oculaire, en particulier l’épithélium pigmentaire rétinien (EPR), désormais quantifiable avec l’avènement de l’autofluorescence quantitative (QAF) basée sur l’ophtalmoscopie confocale à balayage laser. Il a été démontré que la FAQ est généralement diminuée au pôle postérieur dans la dégénérescence maculaire liée à l’âge (DMLA). La relation entre le QAF et diverses lésions de la DMLA (drusen, dépôts drusénoïdes sous-rétiniens) n’est pas encore claire.
Cet article décrit un flux de travail permettant de déterminer la QAF spécifique à la lésion dans la DMLA. Une approche d’imagerie multimodale in vivo est utilisée, y compris, mais sans s’y limiter, la tomographie par cohérence optique dans le domaine spectral (SD-OCT), la scintigraphie du volume maculaire et la QAF. À l’aide de plug-ins FIJI personnalisés, l’image QAF correspondante est alignée avec l’image proche infrarouge du scan SD-OCT (repères caractéristiques, c’est-à-dire les bifurcations du vaisseau). La fovéole et le bord de la tête du nerf optique sont marqués dans les images OCT (et transférés sur l’image QAF enregistrée) pour un positionnement précis des grilles d’analyse.
Les lésions spécifiques à la DMLA peuvent ensuite être marquées sur des BScans OCT individuels ou sur l’image QAF elle-même. Les cartes QAF normatives sont créées pour tenir compte de la moyenne variable et de l’écart-type des valeurs QAF dans le fond d’œil (les images QAF d’un groupe représentatif de DMLA ont été moyennées pour construire des cartes normatives standard de DMLA QAF rétinienne). Les plug-ins enregistrent les coordonnées X et Y, le score z (une mesure numérique qui décrit la valeur QAF par rapport à la moyenne des cartes AF en termes d’écart type par rapport à la moyenne), la valeur d’intensité moyenne, l’écart type et le nombre de pixels marqués. Les outils déterminent également les scores z à partir de la zone de bordure des lésions marquées. Ce flux de travail et les outils d’analyse amélioreront la compréhension de la physiopathologie et de l’interprétation clinique des images de FA dans la DMLA.
Introduction
L’imagerie par autofluorescence du fond d’œil (FAF) fournit une cartographie non invasive des fluorophores naturels et pathologiques du fond d’œil1. L’autofluorescence bleue (AF) la plus courante (excitation à 488 nm) excite les granules de lipofuscine et de mélanolipofuscine de l’épithélium pigmentaire rétinien (EPR)2,3,4. La distribution et l’augmentation/diminution des granules jouent un rôle central dans le vieillissement normal et diverses maladies rétiniennes, y compris la dégénérescence maculaire liée à l’âge (DMLA)5.
Un autre développement de la FAF, l’autofluorescence quantitative du fond d’œil (QAF), permet désormais de déterminer avec précision lesintensités de FA rétinienne résolues topographiquement 4,6. En incorporant une référence dans la voie optique de l’appareil d’imagerie FAF, les intensités AF peuvent être comparées entre les appareils, les points temporels et les sujets. Cette technique a entraîné un changement de paradigme en ce qui concerne un facteur pathogénique présumé de la DMLA, qui a longtemps été supposé être dû à une accumulation excessive de lipofuscine dans les cellules RPE7. Cependant, la quantification histologique et clinique de la FA a révélé une diminution de la FA dans la DMLA (due à la redistribution et à la perte des granules autofluorescents de lipofuscine et de mélanolipofuscine), au lieu de l’augmentation proposée de la FA 8,9,10.
La surveillance de la FA a des implications cliniques. Von der Emde et al. et d’autres ont montré que la FA est non seulement diminuée, mais qu’elle diminue également au cours de l’évolution de la DMLA dans les yeux à haut risque et intermédiaires atteints de DMLA 8,9. De plus, des études histologiques suggèrent que la plupart des cellules d’EPR affectées par la DMLA présentent un comportement caractéristique avec l’agrégation et l’extrusion des granules avant la perte de cellules d’EPR par subduction, desquamation, migration ou atrophie13,14,15,16. Cela indique en outre que la perte de FA pourrait être un déclencheur ou un signal de substitution de la progression imminente de la maladie.
Jusqu’à présent, les études QAF n’ont évalué la FA qu’à l’échelle mondiale au pôle postérieur à l’aide de systèmes de coordonnées polaires à grille préfabriquée (par exemple, QAF8/Delori Grid)17. L’utilisation de grilles préfabriquées pour mesurer la mise au point automatique permet d’obtenir plusieurs valeurs de mise au point automatique sur des zones prédéterminées par œil d’un sujet. L’étude des valeurs de FA de cette manière pourrait manquer des changements locaux dans les zones où la FA est pathologiquement altérée, par exemple, dans la DMLA au-dessus ou à proximité de drusen ou de dépôts drusénoïdes sous-rétiniens (SDD). Drusen, et à un degré plus élevé les SDD, sont associés à un risque élevé de développer une DMLA tardive et une perte de vision. Les Drusen, en particulier, ont un cycle typique d’augmentation de taille sur de nombreuses années et peuvent se détériorer rapidement avant l’atrophie. Il est concevable, par exemple, que la FA globale diminue dans la DMLA, mais qu’elle augmente ou soit encore réduite dans et autour de ces lésions focales spécifiques liées à la maladie.
Différents profils locaux de FA pourraient également avoir une pertinence pronostique pour la progression de la maladie. Par exemple, les niveaux d’autofluorescence peuvent être utilisés pour évaluer si les drusen augmentent en taille ou s’ils sont déjà en régression vers l’atrophie. Il a déjà été démontré que la modification des profils périlésionnels de la FA dans l’atrophie géographique a un impact important sur la progression de l’atrophie au fil du temps18. De plus, les modèles d’autofluorescence locale pourraient révéler plus de détails sur l’état de santé de l’EPR. Souvent, la tomographie par cohérence optique (OCT) montre une hyperréflectance dans le choriocapillaire, bien que la couche RPE semble intacte. Une approche multimodale combinant les valeurs locales de QAF et l’OCT pourrait aider à différencier les lésions présentant un risque élevé de perturbation de l’EPR et d’atrophie imminente.
L’une des raisons pour lesquelles les analyses résolues spatialement dans les études n’ont pas été effectuées est que le logiciel du fabricant le plus couramment utilisé ne fournit pas d’outil pour ce type d’analyse. Les propriétés de la FA de différentes lésions en fonction du stade de la DMLA pourraient expliquer davantage la pathogenèse de la DMLA. Par conséquent, il serait souhaitable de disposer d’un outil permettant de mesurer la FA régionale spécifique à la lésion. Pour comparer avec précision les lésions situées dans l’ensemble de la rétine, le flux de travail doit trouver un moyen de prendre en compte les différents degrés de FA dans le fond d’œil humain19. Plus centralement, la FA est généralement plus faible en raison des effets d’ombrage du pigment maculaire et des différents nombres de granules20,21.
La FA atteint son maximum à ~9° (distance à la fovéa dans toutes les directions) et diminue dans une plus grande mesure en périphérie4. Par conséquent, si l’on comparait les valeurs absolues des niveaux de FA des drusen mous (situés à la fovéa et à la parafovéa dans les zones à faible FA) et des SDD (situés de manière paracentrale dans les zones à forte FA), les résultats ne seraient pas comparables22. S’inspirant des travaux de Pfau et al. et du concept de perte de sensibilité (correction de la sensibilité mesurée dans la DMLA pour la colline de vision [sensibilité rétinienne décroissante avec la distance à la fovéa] des témoins sains) pour la périmétrie contrôlée par le fond d’œil, la FA est comparée aux valeurs standardisées de la FA dans l’ensemble de la macula23,24. Les résultats sont présentés sous forme de scores z (mesure numérique de la relation entre la valeur d’une région d’intérêt et la moyenne).
L’objectif de cette étude est d’évaluer l’utilisation d’un nouvel outil de mesure des taux locaux de QAF dans différents types de lésions chez les patients atteints de DMLA. Cet outil est conçu pour mesurer les niveaux d’autofluorescence des lésions identifiées sur les tomodensitogrammes. Cela permet d’évaluer les niveaux d’autofluorescence locale dans les lésions, telles que les drusen mous ou les SDD, et de suivre les changements de FA des lésions au fil du temps. L’utilité potentielle de cet outil est de permettre la mise au point d’un nouveau biomarqueur structurel qui estime la santé de l’EPR et peut avoir une valeur pronostique pour les lésions étudiées.
Protocole
L’étude a été menée conformément à la Déclaration d’Helsinki et approuvée par le Comité d’éthique de l’Université de Bonn (code de protocole 305/21). Le consentement éclairé écrit de tous les sujets participant à l’étude a été obtenu. Nous avons demandé à tous les participants à la vidéo de signer des formulaires d’autorisation nous autorisant à utiliser leur image et leurs informations personnelles dans la création d’une vidéo en ligne.
1. Acquisition d’images par autofluorescence quantitative (QAF)
- Pour une acquisition d’image précise avec l’appareil QAF, assurez-vous que le participant est confortablement assis devant l’appareil. Demandez au participant d’appuyer son menton et son front contre le menton et l’appui-tête. Ajustez la hauteur de la mentonnière jusqu’à ce que l’angle latéral de la paupière soit à la même hauteur que le marquage rouge.
- Assurez-vous que l’image est mise au point dans le mode proche infrarouge en tournant la molette de l’appareil d’enregistrement jusqu’à ce que les petits vaisseaux soient nets. Effectuez un zoom avant sur l’œil en déplaçant l’appareil photo vers l’avant jusqu’à ce que les coins de l’image soient uniformément éclairés. En règle générale, ajustez la mise au point sur l’équivalent sphérique. Réduisez la mise au point avant l’imagerie QAF d’une ou deux dioptries, car le QAF bleu utilise une longueur d’onde plus courte, et changez le mode de l’appareil QAF du mode proche infrarouge au mode QAF.
- Réajustez et augmentez l’éclairage et affinez la mise au point de l’image jusqu’à ce que les petits vaisseaux les plus proches de la fovéa soient nets et que l’image soit bien éclairée sans points rouges (indiquant un sur-éclairage). Blanchir le photopigment en attendant au moins 30 s en mode QAF avant l’acquisition de l’image pour permettre à l’excitation continue de la lumière bleue de blanchir le pigment photorécepteur dans le champ de vision des réglages de l’appareil photo.
- Pour capturer des images, appuyez sur la touche d’acquisition d’images du pavé tactile de l’appareil d’imagerie ; assurez-vous de capturer plus d’une image QAF en cas de clignement ou de mouvements oculaires soudains pendant l’acquisition.
REMARQUE : Le flux de travail nécessite également des images de tomographie par cohérence optique dans le domaine spectral (SD-OCT). L’acquisition d’images OCT est expliquée ailleurs, car elle est largement utilisée dans la pratique clinique25.
2. Exportation d’images
- Pour ce pipeline d’analyse, assurez-vous que les images QAF et OCT sont au format de fichier XML (Extensible Markup Language). Dans la visionneuse HEYEX, cliquez avec le bouton droit de la souris sur l’image QAF/OCT souhaitée et sélectionnez Exporter | au format XML dans le menu déroulant.
3. Plug-ins open-source pour l’analyse QAF - installation du pipeline
REMARQUE : Le logiciel QAF présenté est un plug-in open-source nommé « Spectralis pipeline » créé pour le logiciel open-source ImageJ (extension FIJI)26.
- Pour accéder au plug-in, ouvrez FIJI, sélectionnez Aide puis Mise à jour dans le menu déroulant, puis cliquez sur Gérer les sites de mise à jour pour ajouter le site de mise à jour Creative Computation « https://sites.imagej.net/CreativeComputation/ » aux sites de mise à jour préexistants.
- Téléchargez les plug-ins, puis redémarrez FIJI. Maintenant, le pipeline Spectralis est installé. Les différents plug-ins Spectralis se trouvent dans le menu déroulant Plugins | Spectralis ou Plugins | SpectralisBatch.
4. Configuration - stockage des données
REMARQUE : Pour permettre un flux de travail transparent, il est recommandé de configurer la structure des dossiers comme suit. Tout d’abord, configurez un dossier pour chaque sujet d’étude. Oculus dexter (OD) et oculus sinister (OS) font référence à l’œil droit et à l’œil gauche, respectivement, et ces abréviations sont utilisées tout au long de ce flux de travail.
- Pour chaque œil examiné de chaque sujet de l’étude, créez un dossier pour un OPO, nommés respectivement OD_OCT et OS_OCT. Laissez le pipeline Spectralis stocker automatiquement sa sortie du plug-in « Mark_BScans_OCT » sous forme de valeurs séparées par des tabulations dans ces dossiers.
- Pour les images QAF, créez deux dossiers nommés OD_QAF et OS_QAF.
- Créez des dossiers supplémentaires si d’autres modalités d’imagerie multimodale sont utilisées. Assurez-vous que la structure de dossiers résultante ressemble à la structure répertoriée ci-dessous :
CASE_ID
OD_OCT
OD_QAF
OD_other_imaging_modality
OS_OCT
OS_QAF
OS_other_imaging_modality
5. Conversion du fichier XML QAF en image QAF (plug-in utilisé : QAF_xml_reader)
- Les fichiers d’exportation XML Spectralis QAF sont stockés au format rouge-vert-bleu (RVB), limité à une échelle de 0 à 255 (représentant les valeurs AF mesurées) et comprenant les régions d’étalonnage « standard » et « noir ». Le plug-in « QAF_xml_reader » produit une image QAF. Pour cela, ouvrez le menu déroulant des plug-ins , sélectionnez Spectralis | QAF_XML_Reader et défaussez l’écran d’ouverture.
- Une nouvelle fenêtre s’affiche et affiche l’invite Choisir un répertoire contenant un Spectralis XML QAF Export :. Sélectionnez le répertoire et cliquez sur Sélectionner.
- Entrez le facteur d’étalonnage de référence (FCR) de l’appareil QAF (inclus dans les informations d’image de l’image QAF) et l’âge du patient au moment où l’image a été prise.
- La fenêtre suivante s’intitule Paramètres QAF. Si le patient est pseudophaque au moment de l’acquisition de l’image, sélectionnez plutôt l’âge de 20 ans (cela a pour effet de ne pas appliquer de correction de l’âge). Après avoir cliqué sur OK, lorsqu’une fenêtre contextuelle intitulée Mapper à 8 bits s’affiche, entrez la valeur QAF minimale (qafMin) et la valeur QAF maximale (qafMax) pour une image QAF codée par couleur. Si qafMin et qafMax sont inconnus, utilisez les paramètres par défaut, cliquez sur OK et observez l’image d’origine intitulée Données QAF brutes qui s’affiche, ainsi que l’image QAF 32 bits et l’image QAF 8 bits codée par couleur.
REMARQUE : L’image QAF codée par couleur est uniquement utilisée à des fins d’illustration ; l’image QAF 32 bits avec les valeurs QAF réelles est utilisée pour une analyse plus approfondie.
6. Enregistrement des images QAF avec l’image OCT (plug-in utilisé : Register_OCT_2)
REMARQUE : Cette étape est nécessaire pour aligner avec précision l’image OCT avec l’image QAF, de sorte que les lésions dans les images QAF et les BScans OCT soient alignées.
- Accédez au plug-in via le menu déroulant Plugins | Spectralis, ou créez un raccourci clavier pour accéder aux différents plug-ins utilisés. Pour ce faire, sélectionnez-Register_OCT_2 sous Plugins | Raccourcis | Ajoutez un raccourci et choisissez le raccourci clavier souhaité.
- Après avoir ouvert le plug-in, cliquez sur OK dans la première fenêtre qui s’affiche. Ensuite, une fenêtre contenant l’invite : Choisissez un répertoire contenant l’export XML Spectralis OCT : apparaîtra dans la fenêtre principale d’ImageJ. Sélectionnez le dossier contenant l’exportation XML Spectralis OCT et cliquez sur Ouvrir.
REMARQUE : L’OCT va maintenant se charger, ce qui, en fonction de la puissance de traitement de l’ordinateur utilisé, peut prendre jusqu’à 2 minutes. - Ensuite, attendez qu’une fenêtre contenant l’invite Enregistrer les images enregistrées dans : s’affiche. Sélectionnez le répertoire dans lequel le fichier EnFaceStack (image alignée) sera stocké, puis cliquez sur Ouvrir.
- Attendez qu’une fenêtre pop-up contenant l’invite Choisissez une image à ajouter à l’EnFaceStack : pour apparaître, sélectionnez l’image QAF 32 bits pour aligner l’image avec le SD-OCT, puis cliquez sur Ouvrir. Si toutes les images nécessaires dans cet EnFaceStack sont incluses, sélectionnez Annuler.
- Lorsque la fenêtre suivante demande à l’utilisateur de sélectionner une étiquette pour EnFaceStack, sélectionnez l’étiquette QAF prédéfinie ; Vous pouvez également saisir le nom souhaité de la modalité dans la zone Autre. Sélectionnez OK pour enregistrer l’image.
REMARQUE : N’incluez pas d’espaces ou d’autres signes de ponctuation dans le champ Autre . - Observez les trois fenêtres qui s’ouvrent. Le premier est étiqueté Localizer et affiche le SD-OCT sous la forme d’une image de l’œil gauche (OS). La deuxième fenêtre est nommée QAF ou l’une des autres modalités sélectionnées précédemment comme œil gauche (OS) ou droit (OD) d’origine. La dernière fenêtre s’appelle Points de repère, qui demande de sélectionner un à trois points de repère dans chaque image.
- Alignez les deux images en sélectionnant un à trois points de repère par image, des bifurcations de vaisseau ou d’autres caractéristiques situées sur les deux modalités. Effectuez un zoom avant (utilisez le caractère « + » du clavier pour effectuer un zoom avant et « - » pour effectuer un zoom arrière) avant de sélectionner le point de repère. Assurez-vous que les points de repère sélectionnés sont répartis verticalement et horizontalement dans l’image. Une fois que tous les points de repère sont annotés, sélectionnez OK dans l’onglet Points de repère et Annuler à l’invite suivante.
- Lorsqu’une fenêtre vous invitant à afficher les résultats , sélectionnez Oui pour vérifier si l’image a été correctement alignée. Pour ce faire, zoomez sur un petit vaisseau et placez le curseur à côté de celui-ci, puis faites défiler vers le haut ou vers le bas pour vérifier à quel point le vaisseau se déplace par rapport au curseur. Si l’alignement n’est pas précis, supprimez le fichier « .tiff » dans le répertoire OD_QAF et recommencez le processus depuis le début de l’étape 2.
REMARQUE : Étant donné que les marquages sur Mark_BScans_OCT doivent être précis, l’alignement entre l’image SD-OCT et l’image QAF doit également être très précis. Un alignement parfait au pixel près peut être obtenu sur la plupart des images, bien que dans certains cas, l’alignement soit limité à une précision de trois ou quatre pixels.
7. Création d’une image QAF moyennée à des fins de comparaison (plug-in utilisé : StandardRetina/BatchStandardRetina)
REMARQUE : Les valeurs QAF dépendent fortement de l’emplacement de la rétine (par exemple, l’ombrage central causé par le pigment maculaire). Par conséquent, les valeurs QAF de drusen doivent être comparées aux valeurs QAF standard de la même région. Comme condition préalable à l’analyse, le StandardRetina crée une carte faciale d’images QAF moyennées (par exemple, à partir d’une cohorte témoin appariée selon l’âge). La carte de surface résultante montre une carte pixel par pixel d’une valeur QAF moyenne pour la rétine centrale.
- Il existe deux façons de créer des rétines standard dans le pipeline Spectralis : la première, AddToStandardRetina_OCT, autorise un nouveau cas à la fois sur la carte de face, tandis que la seconde, BatchStandardRetina, ajoute plusieurs cas à la fois.
- Pour ajouter une image à la fois, sélectionnez Plugins | Spectralis | AddToStandardRetina_OCT et fermer l’écran d’ouverture. Lorsqu’une fenêtre s’affiche affichant le texte Choisissez un répertoire contenant une exportation XML Spectralis OCT, sélectionnez le dossier et cliquez sur Sélectionner pour ouvrir le BScan.
- Lorsqu’une nouvelle fenêtre s’affiche affichant l’invite Choisissez un répertoire contenant les images EnFace enregistrées :, sélectionnez le dossier approprié et cliquez sur Sélectionner.
- Observez les trois fenêtres qui s’affichent, l’une intitulée EnFaceStack qui affiche les images empilées du dossier sélectionné à la deuxième étape, la seconde intitulée Bscan Stack affichant le BScan OCT et une troisième fenêtre apparaissant au milieu intitulée Choose Modality. Sélectionnez une modalité dans EnFaceStack.
- Sélectionnez une modalité et observez la nouvelle fenêtre qui s’affiche avec l’invite Choisissez un répertoire contenant la StandardRetina. S’il n’existe pas encore de répertoire contenant un StandardRetina , sélectionnez un dossier vide pour créer un nouveau StandardRetina.
- Examinez le nouveau StandardRetina, faites défiler vers le haut et vers le bas et déplacez le curseur pour afficher la moyenne et l’écart type pour cet emplacement spécifique. Cliquez sur le bouton Accepter ? Pour ajouter la dernière photo à la StandardRetina ou la supprimer.
- Pour ajouter plusieurs images à la fois, utilisez Batch_QAF_StandardRetina.
- Tout d’abord, préparez un fichier « manifest.txt » dans le même dossier que les ID de cas et assurez-vous qu’il répertorie le chemin relatif de l’emplacement du fichier .txt à l’OCT et à EnFaceStack. Séparez les deux par un espace de tabulation et assurez-vous qu’il n’y a pas d’espace supplémentaire devant et derrière les noms. Le fichier doit ressembler à cette configuration :
pathToOCT_1>pathToEnFaceStack_1>001/OD-OCT>001/OD-QAF
pathToOCT_2>pathToEnFaceStack_2>002/OD-OCT>002/OD-QAF - Créez le fichier dans un tableur et enregistrez-le en tant que fichier txt. Assurez-vous que tous les chemins d’accès contiennent la tranche (lettres de caractère) QAF pour que le fichier manifeste fonctionne correctement. Les plug-ins se trouvent dans le menu déroulant Plugins | SpectralisBatch-Batch | QAF_StandardRetina.
- Fermez l’écran d’ouverture et attendez qu’une nouvelle fenêtre s’ouvre affichant l’invite Sélectionnez la rétine standard initiale. Sélectionnez un dossier avec un StandardRetina préexistant ou sélectionnez un dossier vide pour créer un nouveau StandardRetina.
- Recherchez l’affichage d’une invite intitulée Sélectionner la modalité ; la valeur par défaut est QAF. Assurez-vous que le nom de fichier de la modalité respective correspond exactement au nom de fichier d’une tranche dans chaque EnFaceStack nommé dans le fichier manifeste. Ensuite, lorsqu’une fenêtre s’ouvre invitant l’utilisateur à choisir un fichier manifeste (décrit précédemment), cliquez sur Annuler si aucun autre fichier manifeste ne doit être ajouté à ce StandardRetina ou sélectionnez un autre fichier manifeste. Examinez le nouveau StandardRetina dans une nouvelle fenêtre intitulée Accepter ?, et décidez d’ajouter le dernier lot au StandardRetina ou de supprimer le dernier lot.
REMARQUE : Le processus de combinaison de tous les QAF à un StandardRetina peut prendre un certain temps.
- Tout d’abord, préparez un fichier « manifest.txt » dans le même dossier que les ID de cas et assurez-vous qu’il répertorie le chemin relatif de l’emplacement du fichier .txt à l’OCT et à EnFaceStack. Séparez les deux par un espace de tabulation et assurez-vous qu’il n’y a pas d’espace supplémentaire devant et derrière les noms. Le fichier doit ressembler à cette configuration :
8. Annotation des régions d’intérêt pour l’analyse (plug-in utilisé : Mark_BScans_OCT)
- Pour marquer des lésions (telles que drusen), ouvrez Plugins | Spectralis | Mark_BScans_OCT et ignorez l’invite d’ouverture. Recherchez une nouvelle fenêtre intitulée Choisir un répertoire contenant une exportation XML Spectralis OCT pour qu’elle s’affiche. Choisissez le dossier contenant l’OCT souhaité et cliquez sur OK.
- Une fois que FIJI a chargé l’OPO, observez la nouvelle fenêtre avec l’étiquette Choisissez un répertoire contenant les images de face enregistrées à apparaître. Sélectionnez le répertoire contenant EnFaceStack et cliquez sur Sélectionner.
- Trois nouvelles fenêtres s’affichent, l’une intitulée EnFaceStack, l’autre BscanStack et la troisième nommée User Parameters.
- La fenêtre Paramètres utilisateur invite l’utilisateur à entrer les paramètres suivants : ID de cas, qui apparaîtra alors dans le nom du fichier csv de sortie, bande passante en mm, largeur de ligne d’enface, largeur de ligne BScan et opacité du masque de région.
- Le paramètre largeur de bande en mm détermine la largeur de chaque isocoque en millimètres (mm). Utilisez la largeur de ligne Enface pour modifier la largeur de ligne des lésions marquées dans la fenêtre intitulée EnFaceStack.
- La largeur de ligne BScan détermine la largeur de ligne sur la fenêtre Bscan Stack. Notez que la définition de ce paramètre sur 1 est le meilleur paramètre de largeur de ligne dans la plupart des cas.
- Choisissez entre un masque facial ou une carte de distance affichée dans une fenêtre distincte pour décider si les bandes intérieures doivent être colorées. Ensuite, cliquez sur Terminé dans la fenêtre Marquer dans BScan du plug-in.
- Ensuite, lorsque vous êtes invité à sélectionner un StandardRetina préexistant, sélectionnez le dossier contenant le StandardRetina et cliquez sur Sélectionner. Notez que si un StandardRetina est sélectionné, le Mark_BScans_OCT de sortie sélectionnera le mode z-score (d’une valeur QAF mesurée par rapport à StandardRetina). Si vous préférez la valeur brute QAF, cliquez sur Annuler et attendez qu’une nouvelle fenêtre s’affiche et qu’un message avertisse que les résultats seront des valeurs brutes et non des scores z.
- La fenêtre Paramètres utilisateur invite l’utilisateur à entrer les paramètres suivants : ID de cas, qui apparaîtra alors dans le nom du fichier csv de sortie, bande passante en mm, largeur de ligne d’enface, largeur de ligne BScan et opacité du masque de région.
- Recherchez une nouvelle fenêtre qui s’affiche avec une invite Choisissez un répertoire contenant l’état enregistré avec les données enregistrées. S’il existe un fichier de sauvegarde, cliquez sur le répertoire contenant les tranches | Sélectionner. Si la progression ne doit pas être enregistrée, sélectionnez Annuler. Recherchez une nouvelle fenêtre intitulée Marquer dans BScan, et dans un menu déroulant, sélectionnez Enregistrer, Ignorer, Terminé et Marquer.
- Marque: Commencez à annoter les régions qui vous intéressent dans le BScan, avec des commandes similaires à celles du plug-in « Register_OCT_2 » expliqué ci-dessus. Pour marquer une région, sélectionnez Démarrer en cliquant avec le bouton droit de la souris et en faisant glisser le curseur de la souris jusqu’à l’extrémité de la lésion, assurez-vous que la marque est sélectionnée dans la fenêtre Marquer dans B-Scan , puis cliquez sur OK. La région d’intérêt est maintenant marquée dans ce BScan.
- Ignorer: Sélectionnez Ignorer dans la fenêtre Marquer dans BScan et cliquez sur OK pour ignorer le marquage.
- Sauvegarder: Sélectionnez enregistrer dans la fenêtre Marquer dans BScan et cliquez sur OK pour faire apparaître une nouvelle fenêtre, contenant l’invite de sélectionner un répertoire à sauvegarder. Sélectionnez un dossier déjà existant ou créez-en un. Ouvrez les fichiers déjà existants en démarrant « Mark_BScans_OCT » et sélectionnez le répertoire contenant l’état de sauvegarde lorsque la fenêtre Choisir un répertoire contenant l’état enregistré apparaît.
REMARQUE : Il n’est pas possible de stocker plusieurs états de sauvegarde dans un seul répertoire ; Les états de sauvegarde d’une locale à l’autre ne peuvent pas être facilement changés (par exemple, ALLEMAND vers USA). - Fait: Sélectionnez terminé dans la fenêtre Marquer dans BScan et cliquez sur OK pour faire apparaître une nouvelle fenêtre avec l’étiquette choisir la modalité .
- Lorsqu’une invite intitulée « Apportez la modalité correcte au-dessus de la pile enface » s’affiche, placez la modalité appelée QAF au-dessus, qui a été alignée à l’aide de « Register_OCT_2 ». Pour ce faire, faites défiler EnFaceStack, sélectionnez la fenêtre En face Stack ou cliquez sur la flèche gauche ou droite. Notez que le nom de la modalité est affiché dans le coin supérieur gauche.
- Pour mieux inspecter et marquer les lésions, zoomez sur la fenêtre Bscan. Cliquez sur la fenêtre B-Scan , pointez la souris dans la direction pour zoomer et appuyez sur la touche + ; Pour effectuer un zoom arrière, appuyez sur la touche -.
- Faites défiler la pile BScan en faisant défiler la souris vers le haut ou vers le bas, en faisant glisser la barre en bas vers la gauche ou la droite pour vous déplacer dans la numérisation, ou en sélectionnant le cadre B-Scan et en cliquant sur les touches fléchées gauche et droite du clavier. Notez qu’une vue d’ensemble de la zone actuelle de la pile BScan est fournie par la ligne rouge sur la fenêtre EnFaceStack, et en haut à gauche de la fenêtre BScan où le numéro BScan (par exemple, 31/120) est affiché.
- Cliquez sur OK pour créer un nouveau fichier .tsv dans le dossier « OD_OCT » ou « OS_OCT » correspondant. Notez que le nom du fichier .tsv sera composé de « Mark_Bscans_OCT » plus l’ID de cas qui a été saisi, la latéralité et la modalité qui a été choisie à la dernière étape de Mark_Bscans_OCT. De plus, les « iso-coques » des drusen codées par couleur seront désormais affichées dans l’EnFaceStack.
Résultats
Affichage de la sortie
Pour analyser et tirer des conclusions adéquates des résultats, il est important de comprendre le fichier de sortie de Mark_Bscans_OCT. Les trois premières colonnes sont étiquetées après l’ID de cas, la latéralité du fichier et la modalité d’imagerie choisie. La quatrième colonne est référencée par mode et est étiquetée z-score. Notez qu’au moment de la rédaction de ce texte, Mark BScans ne peut calculer toutes les lésions qu’en une seule fois ; Les lignes se réfèrent aux iso-coques, dont les distances par rapport au bord extérieur de la lésion sont spécifiées dans les colonnes inférieure et supérieure de la feuille de calcul. Les isocoques mesurent la FA en z-scores (dans le cas d’une QAF) dans une circonférence spécifiée autour de la lésion. Notez que la valeur minimale d’un pixel dans une iso-coque se trouve dans les colonnes intitulées min, les colonnes intitulées médian, max, moyenne et stdev, contiennent respectivement la médiane, le maximum, la moyenne et l’écart-type de la moyenne des valeurs de pixel dans uneiso-coque. La colonne n contient le nombre total de pixels d’une iso-coque. La figure 1 montre un drusen mou marqué singulier d’un patient de 84 ans atteint de dégénérescence maculaire liée à l’âge (DMLA) intermédiaire.
La figure 2 montre l’œil gauche d’un patient représentatif avec des SDD marqués avec l’outil QAF-Workflow (Figure 3). Les SDD chez ce patient étaient associés à une réduction de la FA (z-score = -0,4 ± 0,2). De même, les isocoques autour du SDD présentaient une AF réduite (par exemple, isocoque la plus proche = -0,3 ± 0,3) par rapport à la StandardRetina. Une explication plausible de ce phénomène pourrait être des effets d’ombrage (translucidité réduite) des lésions SDD sur l’EPR. L’utilisation des SDD a été exemplaire. L’outil permet également d’évaluer les niveaux locaux de FA dans d’autres lésions, telles que les drusen. De plus, l’outil permet de suivre les changements de FA des lésions au fil du temps.
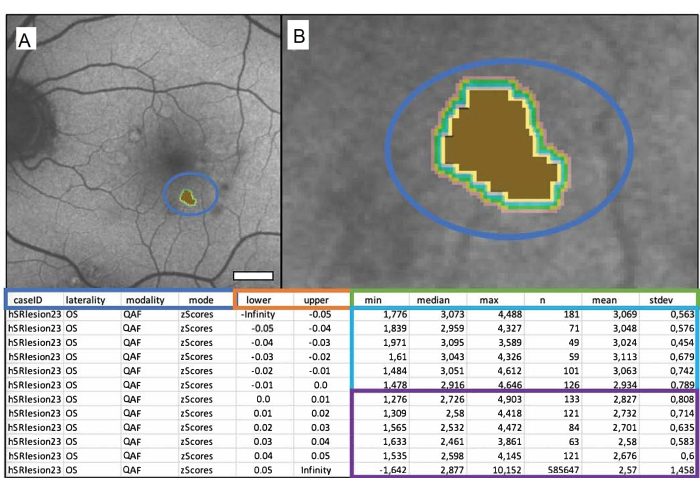
Figure 1 : Un drusen mou marqué singulier d’un patient de sexe masculin de 84 ans atteint de dégénérescence maculaire liée à l’âge (DMLA) intermédiaire. (A) L’image QAF d’un œil gauche avec le drusen marqué. (B) Gros plan sur le drusen : centre marron représentant le drusen marqué et bandes colorées représentant les iso-coques environnantes. Le tableau ci-dessous illustre le fichier de sortie. Les valeurs de drusen QAF sont comparées aux valeurs QAF correspondantes de l’excentricité correspondante de StandardRetina. Il en résulte des scores z qui représentent un écart par rapport à la moyenne des zones non touchées. L’encadré bleu affiche de gauche à droite : l’ID du cas, la latéralité de l’œil, la modalité utilisée et le résultat souhaité (dans ce cas, les z-scores). Les colonnes à l’intérieur de la zone orange indiquent les limites de la zone mesurée en millimètres (inférieure = limite inférieure, supérieure = limite supérieure). La case verte indique les colonnes indiquant les mesures QAF. De gauche à droite, ils contiennent le minimum, la médiane, le maximum, le nombre de pixels, la moyenne et l’écart-type de la moyenne. Chaque ligne représente une iso-coque, les rangées à l’intérieur de la boîte bleue représentent les valeurs à l’intérieur de la lésion, et les lignes à l’intérieur de la boîte violette montrent les iso-coques entourant chaque lésion (de haut en bas à mesure que la distance par rapport à la lésion augmente). Barre d’échelle = 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
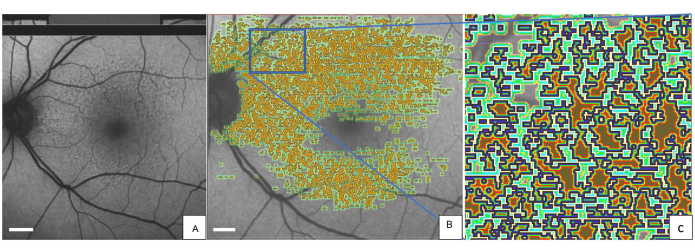
Figure 2 : SDD marqués dans une image QAF d’une patiente de 80 ans atteinte d’une DMLA précoce. (A) Les SDD peuvent être vus dans l’image QAF. La même image QAF est montrée avec des annotations imprimées de SDD. (B) Autour de chaque lésion marquée, les iso-coques sont représentées avec un code couleur (vert clair, vert foncé et rouge). (C) Une version agrandie du rectangle bleu. Le bord extérieur de chaque SDD est marqué en bleu. Abréviations : QAF = autofluorescence quantitative ; DMLA = dégénérescence maculaire liée à l’âge ; SDD = dépôt drusénoïde sous-rétinien. Barre d’échelle = 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
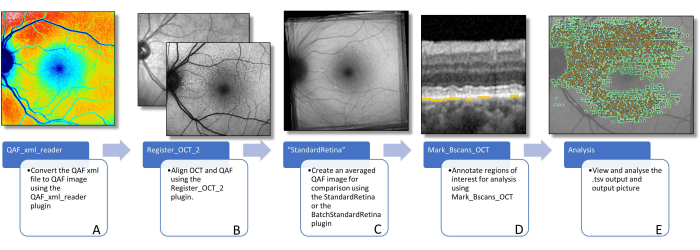
Figure 3 : Flux de travail pour déterminer la FA des lésions. Cette figure permet de visualiser les plug-ins logiciels nécessaires pour déterminer la FA spécifique à la lésion. (A) L’image montre une image QAF codée par couleur qui peut être utilisée pour visualiser la distribution des valeurs QAF, mais ne doit pas être utilisée pour une analyse plus approfondie. (B) Une image QAF au premier plan, avec l’image infrarouge du scan SD-OCT en arrière-plan, est affichée. Ceci est censé visualiser l’alignement à l’aide de bifurcations de vaisseaux. Cela peut être fait à l’aide du plug-in Register_OCT_2. (C) Une rétine standard qui est utilisée pour mesurer les valeurs du score z des lésions. StandardLes rétines peuvent être créées à l’aide de StandardRetina/BatchStandardRetina. (D) Un BScan avec des flèches bleues pointant vers des SDD, qui sont mis en évidence par des lignes jaunes (remarque : les lésions sont toujours marquées sous l’EPR indépendamment de l’emplacement dans la direction z) est représenté. (E) Toutes les lésions marquées sont imprimées sur une image QAF (voir Figure 1). Les deux dernières étapes sont effectuées à l’aide du plug-in Mark_BScans_OCT. Abréviations : AF = autofluorescence ; QAF = autofluorescence quantitative ; SDD = dépôt drusénoïde sous-rétinien ; IR = infrarouge ; RPE = épithélium pigmentaire rétinien ; SD-OCT = tomographie par cohérence optique dans le domaine spectral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce flux de travail fournit un guide étape par étape pour utiliser les outils de plug-in FIJI open source afin de déterminer et de comparer la FA des lésions spécifiques à la DMLA. Les plug-ins fournissent des modèles faciles à utiliser qui ne nécessitent aucune connaissance en codage et peuvent être appliqués par les médecins sans assistance technique27. À notre connaissance, ces outils sont uniques en leur genre pour la quantification de la FA spécifique à la lésion.
Les valeurs de QAF varient naturellement dans la rétine, les valeurs étant plus élevées à la périphérie et plus basses dans la macula en raison de la distribution inégale de la lipofuscine et de la mélanolipofuscine dans la rétine, de la faible FA des vaisseaux et de la distribution inégale du pigment maculaire. En raison de la forte variation des niveaux naturels de QAF dans la rétine, l’analyse directe des valeurs absolues de QAF des lésions n’est pas une approche prometteuse. Par exemple, une lésion hypoautofluorescente à la périphérie peut encore avoir des valeurs absolues QAF plus élevées que les niveaux physiologiques de fluorescence de la macula. L’utilisation d’une rétine standard et l’utilisation de z-scores pour mesurer les niveaux de fluorescence des drusen corrigent cette variance naturelle des valeurs QAF.
Un z-score est une mesure numérique de la relation entre la valeur d’une région d’intérêt et la moyenne de la rétine standard. Il est calculé en soustrayant la moyenne d’un individu de la moyenne de la rétine standard au même endroit, puis en divisant le résultat par l’écart-type. Cette standardisation permet de comparer différentes images QAF, car le score z indique le nombre d’écarts-types d’une valeur différente de la moyenne. Un score z positif indique que la valeur est supérieure à la moyenne, tandis qu’un score z négatif indique qu’elle est inférieure à la moyenne.
Il est important de noter qu’il peut y avoir des pièges potentiels qui doivent être pris en compte. Bien que cette méthode tienne compte de la quantité variable de niveaux de FA dans le fond d’œil, elle n’est peut-être pas le moyen le plus précis de mesurer et de comparer la FA d’un EPR. Les individus ont des niveaux et une topographie différents de pigment lutéal maculaire, et les lésions peuvent également affecter la translucidité de la rétine sus-jacente28,29. Il est donc plausible que la réduction de la FA mesurée dans les zones de SDD (voir résultats représentatifs) soit une conséquence des effets d’ombrage plutôt que de la diminution des fluorophores dans l’EPR30,31,32.
Nous travaillons actuellement sur un flux de travail pour prendre en compte la réflectivité rétinienne, l’épaisseur et le pigment maculaire quantifié (à l’aide de l’AF vert et bleu) avec des modèles mixtes linéaires. De plus, jusqu’à présent, QAF utilise un facteur de correction dépendant de l’âge pour tenir compte de l’opacification lenticulaire qui ne tient pas compte des différences interindividuelles dans l’opacification lenticulaire des participants d’un âge similaire33. Nous travaillons donc actuellement sur un workflow pour un facteur de correction personnalisé de l’autofluorescence lenticulaire et de l’opacification. Pour extraire de manière fiable les informations de la FA à partir de petites lésions, il est nécessaire de disposer d’une fiabilité test-retest adéquate des images QAF. Pour différencier davantage les images QAF pour lesquelles une analyse plus détaillée est viable, nous étudions les « indices de fiabilité des images QAF » qui peuvent prédire la fiabilité test-retest des images QAF. À l’étape actuelle, l’approche prudente consiste à acquérir des images en double et à étudier la fiabilité des nouveaux tests de la FA spécifique à la lésion.
La méthode présentée d’analyse supplémentaire des iso-coques des lésions était techniquement difficile à mettre en œuvre, car les iso-coques des lésions voisines fusionnent. Les zones d’isocoques fusionnées peuvent être caractérisées distinctement en fonction de la lésion considérée. Notre solution a été de considérer toutes les lésions d’un même type comme une seule lésion et d’analyser leur périphérie comme une iso-coque commune. Cette méthode, cependant, réduit considérablement la capacité de mesurer les iso-coques des drusen individuels et pourrait être considérée comme un autre écueil de cette technique. Des méthodes plus sophistiquées sur le plan technique pour tenir compte des isocoques fusionnées ou de la déclaration suspendue de la FA dans les zones d’isocoques fusionnées pourraient faciliter l’analyse de la FA dans la circonférence des lésions à l’avenir.
Nous avons utilisé la DMLA comme maladie modèle pour cette étude. Le flux de travail peut également être adapté pour étudier les lésions d’autres maladies. Jusqu’à présent, le QAF a été utilisé dans de nombreuses maladies choriorétiniennes, y compris la maladie de Stargardt récessive, les maladies associées à la béstrophine-1, diverses formes de rétinite pigmentaire, la rétinopathie externe occulte zonale aiguë, le pseudoxanthome élastique et d’autres 17,33,34,35,36,37. Comme ce flux de travail utilise des logiciels libres, nous encourageons les autres à dupliquer ce travail pour déterminer la FA spécifique à la lésion et élargir nos connaissances sur les troubles rétiniens. En résumé, nous présentons un flux de travail permettant de déterminer et de comparer les niveaux de FA de différentes lésions rétiniennes dans l’ensemble de la macula. Ce flux de travail ouvre la voie à une analyse plus approfondie de la FA et pourrait faciliter le développement de nouveaux biomarqueurs dans la DMLA et au-delà.
Déclarations de divulgation
Leon von der Emde indique avoir reçu des paiements de Heidelberg Engineering. Merten Mallwitz ne fait état d’aucune divulgation financière. Kenneth R. Sloan ne fait pas non plus état d’informations financières. Frank G. Holz déclare avoir consulté et effectué des paiements personnels pour Acucela, Alcon (C), Gyroscope Allergan Apellis, Bayer Bioeq/Formycon, CenterVue, Roche/Genentech, Geuder, Ivericbio, NightStarX, Novartis, Optos, Oxurion, Pixium Vision, Stealth BioTherapeutics, Zeiss et le centre de lecture GRADE. Thomas Ach est consultant et prestataire de services de paiement personnel pour Bayer, Apellis, Roche et Novartis.
Remerciements
Ce travail a été financé par la bourse de la Société allemande d’ophtalmologie (DOG) pour les doctorants (MW) et le NIH/NEI 1R01EY027948 (TA).
matériels
| Name | Company | Catalog Number | Comments |
| BatchStandardRetina plugin | n.a. | n.a. | n.a. |
| FIJI (Image J) | n.a. | n.a. | n.a. |
| Mark_Bscans_OCT plugin | n.a. | n.a. | n.a. |
| Microspft office | Microsoft | n.a. | n.a. |
| QAF_xml_reader plugin | n.a. | n.a. | n.a. |
| Register_OCT_2 plugin | n.a. | n.a. | n.a. |
| Spectralis | Heidelberg Engineering | n.a. | QAF extension |
| StandardRetina plugin | n.a. | n.a. | n.a. |
Références
- Schmitz-Valckenberg, S., et al. Fundus autofluorescence imaging. Progress in Retinal and Eye Research. 81, 100893(2021).
- Bermond, K., et al. Autofluorescent granules of the human retinal pigment epithelium: phenotypes, intracellular distribution, and age-related topography. Investigative Ophthalmology and Visual Science. 61 (5), 35(2020).
- Bermond, K., et al. Autofluorescent organelles within the retinal pigment epithelium in human donor eyes with and without age-related macular degeneration. Investigative Ophthalmology and Visual Science. 63 (1), 23(2022).
- Delori, F., et al. Quantitative measurements of autofluorescence with the scanning laser ophthalmoscope. Investigative Ophthalmology and Visual Science. 52 (13), 9379-9390 (2011).
- Fleckenstein, M., et al. Age-related macular degeneration. Nature Reviews Disease Primers. 7 (1), 31(2021).
- Greenberg, J. P., et al. Quantitative fundus autofluorescence in healthy eyes. Investigative Ophthalmology and Visual Science. 54 (8), 5684-5693 (2013).
- Sparrow, J. R., Boulton, M. RPE lipofuscin and its role in retinal pathobiology. Experimental Eye Research. 80 (5), 595-606 (2005).
- vonder Emde, L., et al. Natural history of quantitative autofluorescence in intermediate age-related macular degeneration. Retina. 41 (4), 694-700 (2021).
- Reiter, G. S., et al. Longitudinal changes in quantitative autofluorescence during progression from intermediate to late age-related macular degeneration. Retina. 41 (6), 1236-1241 (2021).
- Gliem, M., et al. Quantitative fundus autofluorescence in early and intermediate age-related macular degeneration. JAMA Ophthalmology. 134 (7), 817-824 (2016).
- Hussain, R. M., Gregori, N. Z., Ciulla, T. A., Lam, B. L. Pharmacotherapy of retinal disease with visual cycle modulators. Expert Opinion on Pharmacotherapy. 19 (5), 471-481 (2018).
- Ammar, M. J., Hsu, J., Chiang, A., Ho, A. C., Regillo, C. D. Age-related macular degeneration therapy: a review. Current Opinion in Ophthalmology. 31 (3), 215-221 (2020).
- Ach, T., et al. Lipofuscin redistribution and loss accompanied by cytoskeletal stress in retinal pigment epithelium of eyes with age-related macular degeneration. Investigative Ophthalmology and Visual Science. 56 (5), 3242-3252 (2015).
- Zanzottera, E. C., Messinger, J. D., Ach, T., Smith, R. T., Curcio, C. A. Subducted and melanotic cells in advanced age-related macular degeneration are derived from retinal pigment epithelium. Investigative Ophthalmology and Visual Science. 56 (5), 3269-3278 (2015).
- Cao, D., et al. Hyperreflective foci, optical coherence tomography progression indicators in age-related macular degeneration, include transdifferentiated retinal pigment epithelium. Investigative Ophthalmology and Visual Science. 62 (10), 34(2021).
- Zanzottera, E. C., et al. The Project MACULA retinal pigment epithelium grading system for histology and optical coherence tomography in age-related macular degeneration. Investigative Ophthalmology and Visual Science. 56 (5), 3253-3268 (2015).
- Sparrow, J. R., Duncker, T., Schuerch, K., Paavo, M., de Carvalho, dR. L. Lessons learned from quantitative fundus autofluorescence. Progress in Retinal and Eye Research. 74, 100774(2020).
- Schmitz-Valckenberg, S., et al. Correlation between the area of increased autofluorescence surrounding geographic atrophy and disease progression in patients with AMD. Investigative Ophthalmology and Visual Science. 47 (6), 2648-2654 (2006).
- Ach, T., Bermond, K. Autofluorescence of the human retinal pigment epithelium in normal aging and in age-related macular degeneration: histology and clinical correlation. Klinische Monatsblatter Fur Augenheilkunde. 236 (5), 672-681 (2017).
- Pollreisz, A., et al. Visualizing melanosomes, lipofuscin, and melanolipofuscin in human retinal pigment epithelium using serial block face scanning electron microscopy. Experimental Eye Research. 166, 131-139 (2018).
- Bernstein, P. S., et al. meso-zeaxanthin: The basic and clinical science underlying carotenoid-based nutritional interventions against ocular disease. Progress in Retinal and Eye Research. 50, 34-66 (2016).
- Göbel, A. P., Fleckenstein, M., Heeren, T. F. C., Holz, F. G., Schmitz-Valckenberg, S. In-vivo mapping of drusen by fundus autofluorescence and spectral-domain optical coherence tomography imaging. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (1), 59-67 (2016).
- Pfau, M., et al. Mesopic and dark-adapted two-color fundus-controlled perimetry in geographic atrophy secondary to age-related macular degeneration. Retina. 40 (1), 169-180 (2020).
- vonder Emde, L., et al. Mesopic and dark-adapted two-color fundus-controlled perimetry in choroidal neovascularization secondary to age-related macular degeneration. Translational Vision Science and Technology. 8 (1), 7(2018).
- Aumann, S., Donner, S., Fischer, J., Müller, F. Optical coherence tomography (OCT): principle and technical realization. High Resolution Imaging in Microscopy and Ophthalmology: New Frontiers in Biomedical Optics. , Cham (CH), Springer. 59-85 (2019).
- Schindelin, J., et al. FIJI: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Kleefeldt, N., et al. Quantitative fundus autofluorescence: advanced analysis tools. Translational Vision Science and Technology. 9 (8), 2(2020).
- Hong, I. H., Jung, W. H., Lee, J. H., Chang, I. B. Macular pigment optical density in the Korean population: a cross sectional study. Journal of Korean Medical Science. 35 (5), e30(2020).
- Putnam, C. M. Clinical imaging of macular pigment optical density and spatial distribution. Clinical and Experimental Optometry. 100 (4), 333-340 (2017).
- Zweifel, S. A., Spaide, R. F., Curcio, C. A., Malek, G., Imamura, Y. Reticular pseudodrusen are subretinal drusenoid deposits. Ophthalmology. 117 (2), 303-312 (2010).
- Curcio, C. A., et al. Subretinal drusenoid deposits in non-neovascular age-related macular degeneration: morphology, prevalence, topography, and biogenesis model. Retina. 33 (2), 265-276 (2013).
- Spaide, R. F. Outer retinal atrophy after regression of subretinal drusenoid deposits as a newly recognized form of late age-related macular degeneration. Retina. 33 (9), 1800-1808 (2013).
- Reiter, G. S. Influence of lens opacities and cataract severity on quantitative fundus autofluorescence as a secondary outcome of a randomized clinical trial. Scientific Reports. 11 (1), 12685(2021).
- Gliem, M., et al. Quantitative fundus autofluorescence in pseudoxanthoma elasticum. Investigative Ophthalmology and Visual Science. 58 (14), 6159-6165 (2017).
- Burke, T. R., et al. Quantitative fundus autofluorescence in recessive Stargardt disease. Investigative Ophthalmology and Visual Science. 55 (5), 2841-2852 (2014).
- Armenti, S. T., Greenberg, J. P., Smith, R. T. Quantitative fundus autofluorescence for the evaluation of retinal diseases. Journal of Visualized Experiments. (109), 53577(2016).
- Pröbster, C., et al. Quantitative fundus autofluorescence in the developing and maturing healthy eye. Translational Vision Science and Technology. 10 (2), 15(2021).
- Duncker, T., et al. Quantitative fundus autofluorescence and optical coherence tomography in PRPH2/RDS- and ABCA4-associated disease exhibiting phenotypic overlap. Investigative Ophthalmology and Visual Science. 56 (5), 3159-3170 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon