Dampf-Flüssigkeits-Gleichgewicht
Überblick
Quelle: Michael G. Benton und Kerry M. Dooley, Department of Chemical Engineering, Louisiana Landesuniversität, Baton Rouge, LA
Dampfflüssigkeit Gleichgewicht ist in technischen Anwendungen wie Destillation, Umgebungsmodellierung und allgemeine Prozessgestaltung von größter Bedeutung. Verständnis der Interaktionen der Komponenten in einer Mischung ist sehr wichtig in der Entwicklung, Betrieb und analysieren diese Separatoren. Der Aktivität-Koeffizient ist ein ausgezeichnetes Werkzeug für im Zusammenhang mit molekularen Wechselwirkungen zu Mischungszusammensetzung. Finden die molekulare Interaktion Parameter ermöglicht zukünftige Vorhersage der Tätigkeit Koeffizienten für eine Mischung mit Hilfe eines Modells.
Dampfflüssigkeit Gleichgewicht ist ein kritischer Faktor für gemeinsame Prozesse in der chemischen Industrie, wie die Destillation. Destillation ist der Prozess der Trennung von Flüssigkeiten durch ihren Siedepunkt. Eine flüssige Mischung in einer Destillationseinheit oder Spalte gefüttert, dann gekocht. Dampfflüssigkeit Gleichgewichtsdaten eignet sich zum bestimmende wie Flüssigkeitsgemischen trennen werden. Da die Flüssigkeiten unterschiedliche Siedepunkte haben, wird eine Flüssigkeit in Dampf kochen und steigen in der Spalte, während die andere als Flüssigkeit bleiben und durch das Gerät entleeren. Der Prozess ist sehr wichtig in den unterschiedlichsten Branchen.
In diesem Experiment die Tätigkeit Koeffizienten der Mischungen unterschiedlicher Zusammensetzung von Methanol, Isopropanol und deionisiertes Wasser erhält man mit einem Dampfflüssigkeit Gleichgewicht Gerät und Gaschromatographen. Zusätzlich werden die binäre Interaktion Parameter des Systems mit Wilsons Gleichung und die Tätigkeit Koeffizienten bestimmt werden.
Grundsätze
Dampfflüssigkeit Gleichgewicht ist ein Zustand, in dem eine reine Komponente oder Mischung in Flüssigkeit und Dampf Phasen mit mechanischen und thermischen Gleichgewicht und kein net Stoffaustausch zwischen den beiden Phasen vorhanden ist. Dampf und Flüssigkeit werden durch Schwerkraft und Hitze (Abbildung 1) getrennt. Die flüssige Mischung wird in das System eingefügt, die in einem Vakuum Zustand mit einer Vakuumpumpe genommen wird. Der Dampf wird kondensiert und zum Mischen mit der Flüssigkeit, die dann zurück in die kochende Kammer übergeben wird zurückgegeben. Unterschiede in der Siedepunkt resultiert eine Trennung des Gemisches. Der Siedepunkt des Wassers ist höher als die der zusätzlichen Komponenten, so dass die flüchtigen Bestandteile beginnen zu verdampfen.

Abbildung 1: Darstellung des Apparates
Eine Tätigkeit Koeffizient ist definiert als das Verhältnis der Vergänglichkeit einer Komponente in einer tatsächlichen Mischung, die Vergänglichkeit eine ideale Lösung für die gleiche Zusammensetzung. Vergänglichkeit ist eine Eigenschaft verwendet, um Unterschiede zwischen chemischen Potentialen bei standard Staaten zeigen. Vapor Phase Fugacities in Bezug auf die Vergänglichkeit Koeffizienten ausgedrückt werden können [φ: fichV = φich yich fich0V ], mit yich = ich Mol Bruchteil in der Dampfphase und fich0V = Dampf-Standard Vergänglichkeit der Staat (die Vergänglichkeit der reinen Komponente Dampf bei T und P). Für niedrige Drücke, wie dieses Experiment, φich = 1 und fich0V = P. Liquid Phase Fugacities eine Tätigkeit Koeffizient γichausgedrückt werden können: fichL = γi xich fich 0 L , mit xich = Mol Teil i in der flüssigen Phase, und fich0 L = standard flüssig Vergänglichkeit.
Bei der Sättigungsdruck (Pichs) von diesem T wäre der reinen Komponente flüssig Vergänglichkeit Pis, da die reine Dampf und Flüssigkeit im Gleichgewicht sind. Da flüssige Fugacities nur schwache Funktionen des Drucks sind, können wir die reinen Komponente flüssig Vergänglichkeit T und P (fich0 L) als Pichs, annähern, solange der Unterschied zwischen Pichs und P nicht groß ist. Diese Annäherung ist in der Regel "vernachlässigen die Poynting-Korrektur" genannt. Wenn Experimentatoren ein VLE-Gerät verwenden, um die Kompositionen von Dampf und Flüssigkeit zu messen, die im Gleichgewicht sind, Experimentatoren können direkt berechnen die Tätigkeit Koeffizienten zur Maßnahme auch P und T. T muss gemessen werden, um festzustellen, PichS für alle ich.
Das Herz des Geräts VLE, in dieses Experiment verwendet, um Kompositionen von Mischungen, zu bestimmen ist eine Cottrell-Pumpe, die "kochende Flüssigkeit in eine gut isolierte Gleichgewicht Kammer spuckt". Zwei magnetisch betätigten Probenahme-Ventile ermöglichen nach Abzug der flüssigen und kondensierten Dampf Proben. Ein großes Reservoir hilft, um Druckstöße im System als die on / off Ventil Steuerschalter und von Schwankungen durch die Cottrell-Pumpe zu dämpfen. Ein langsames Leck kann verwendet werden, um ein Gleichgewicht zwischen dem Kurs des Entzugs der Luft und die Rate für die Eingabe der Luft, um einen konstanten Druck, erhalten nach Bedarf erstellen.
Eine vergleichbare Möglichkeit für Dampfflüssigkeit Gleichgewicht zu lösen ist, eine Vielzahl von Modellen verwenden. Raoult Gesetz, Dalton Gesetz und das Gesetz von Henry sind alle theoretischen Modellen, die die Dampfflüssigkeit Gleichgewicht Konzentrationsdaten finden können. Alle drei Modelle beziehen sich auf die Verhältnismäßigkeit der Partialdrücke, Gesamtdruck und Maulwurf Brüche von Stoffen. Wilsons Gleichung ist nachgewiesen worden, genaue mischbaren Flüssigkeiten, werden zwar nicht übermäßig komplex. Darüber hinaus enthält Wilsons Modell Tätigkeit Koeffizienten um Abweichung vom idealen Werte zu berücksichtigen.
Verfahren
1. Grundieren das system
- Entlüften mit dem Vent/3-Wege Regelventil montiert auf dem Rahmen des Apparates, VLE und (falls erforderlich) durch Ablassen von Flüssigkeit aus dem System heraus in einem Abfall Kolben.
- Entfernen Sie die Probenröhrchen und ersetzen durch saubere Rohre (bei Bedarf). Die Flüssigkeit wird nicht vollständig aus dem System ablassen.
- Für den ersten Lauf der Experimente, etwa durch das Eingangsventil mit einer Mischung aus nachfüllen (Vol-%) 50 % Methanol, Isopropanol 30 % und 20 % Wasser. Für die zweite Woche mit etwa 25 % Methanol, Isopropanol 45 % und 30 % Wasser nachfüllen. Für die dritte Woche füllen Sie mit welcher Flüssigkeit müssen Sie wiederholen. Die flüssigen Gesamtkapazität beträgt ca. 130 cm3.
- Füllen Sie mit Flüssigkeit bis knapp unter die Stelle wo die Cottrell-Pumpe mit Vakuum Jacke schneidet. Zu wenig Flüssigkeit bewirkt, dass das System erfordern sehr hohe kochende Raten zu bekommen genug Flüssigkeit zu "spucken" (wenn Flüssigkeit erscheint während des Kochens intensiv).
- Verwenden Sie einen Becher und gießen Sie die Flüssigkeit in den Zusatz-Anschluss an der Spitze der Kammer Gleichgewicht. In der Nähe des Hafens.
- Überprüfen Sie den Luftdruck mit Quecksilber Manometer an der Wand. Passen Sie die "Null" auf dem digitalen Manometer entsprechen (falls erforderlich).
- Wechseln Sie das Dreiwege Entlüftungsventil zur "Kontrolle" und starten Sie die Vakuumpumpe und Druckregler.
- Öffnen Sie Drosselklappe auf dem Druck-Controller mehrere Umdrehungen und beobachten Sie den Druck schnell fallen. Beobachten Sie den Druck auf das digitale Manometer.
- Setzen den Druck Satz-Kontrollpunkt auf der Druckregler erhalten ~ 700 mm Hg. hören für das Anklicken des Steuerventils. Wenn der Kontrollpunkt erreicht ist, wird der Lärm von der Vakuumpumpe hörbar anders sein.
- Zu diesem Zeitpunkt eröffnete mit der Drosselklappe mehrere Umdrehungen, jedes Mal, wenn das Regelventil öffnet, zuviel Luft wird weggeworfen, die Vakuumpumpe und der Druck taucht unter 700 mm vor langsam erholt. Schließen Sie die Drosselklappe vollständig, dann öffnen Sie ihn über ½ Umdrehung.
- Warten auf das Steuerventil zu beginnen, wenn Sie erneut klicken, dann schließen Sie die Drosselklappe in kleinen Schritten, bis der Druck nur ~0.5 MmHg schwankt oder weniger, wenn das Ventil geöffnet ist. Anpassungen Sie geringfügige an den Kontrollpunkt oder das Leck-Ventil um zu sehr in der Nähe von 700 MmHg halten.
- Sobald die Mischung innerhalb von ± 10 MmHg von 700 MmHg ist, schalten Sie die Heizung, Heizwasser Mantel macht, Kondensator und Magnetrührer. Versuchen Sie 25-30 % Heizleistung und 1,5 bis 2 Umdrehungen Mantel macht zu starten. Das Gerät erfordert 20 min oder weniger zum Ansatz Gleichgewicht. Passen Sie halten Sie den Druck während dieser Zeit an.
2. Durchführung des Experiments
- Beim Kochen, die Cottrell-Pumpe startet Flüssigkeit zu spucken und Flüssigkeit tropft zurück in die kochende Kammer gesehen werden kann. Kondensierten Dampf erfordert mehr angezeigt werden. Wenn Gleichgewicht erreicht wird, sollten Experimentatoren stetig tropft der kondensierte Dampf sehen (2 - 3 Tropfen/s) und kehrte Flüssigkeit (2 - 3 Tropfen/s). Die Temperatur sollte stabil ± 0,03 º c und der Druck sollte bei 700,0 ± 0,5 MmHg stabil sein. Wenn diese Bedingungen für mindestens 2 Minuten (oder so) aufgestellt wurden, wird Gleichgewicht erreicht.
- Öffnen Sie die Magnetventile (markiert "1" und "2" auf dem Controller) 4 oder 5 Mal jede lange genug, um über 0,5 cm3 Flüssigkeit in jedem Beispiel Röhrchen sammeln, und schließen Sie die Rohre. Wenn ein Ventil nicht auf die Schaltfläche "reagiert, versuchen Sie, spiegeln den ein-/Ausschalter für den Controller ausschalten dann auf. In diesem ersten Beispiel wird verwendet, um die Rohre und Liefersystem waschen und werden verworfen. Waschen ersetzt keine verbleibenden chemischen auf den Seiten der Rohre mit der gleichen Chemikalie, die gemessen wird, ist, so daß es wird keinen Einfluss auf die Zusammensetzung des Tests.
- Schalten Sie einen Moment das Gerät an den Heizkörper, warten 30 s für das Kochen zum Abklingen, dann entlüften Sie das System mit 3-Wege Ventil/Regelventil. Entfernen Sie die Probenröhrchen, schwenken ein paar Mal, dann steckt sie in den Abfall Pot.
- Einbauen Sie die Probenröhrchen auf dem System wieder, drehen Sie das Entlüftungsventil zurück zu "kontrollieren", schalten das Gerät wieder auf die Heizung und warten auf Gleichgewicht wiederhergestellt werden. Dies dauert nur ein paar Minuten, wenn der Apparat nicht kühlt. Ein leichter Unterschied in der Temperatur kann beobachtet werden, wenn das Gleichgewicht wieder hergestellt ist. Dies kann aufgrund einer leichten Störung der Gesamtkomposition durch Abtastung sein.
- Sobald das Gleichgewicht wieder hergestellt ist, nehmen Sie zwei neue Proben. Haben Sie zwei beschriftete Fläschchen mit neuen Septen bereit.
- Schalten Sie nach der Einnahme von ~0.5 cm3 Proben in jedem Röhrchen wieder die Heizung entlüften Sie, entfernen Sie die Probenröhrchen und gießen Sie sie in das Fläschchen. Die Küvetten mit dem Deckel und ggf. die Probenröhrchen durch saubere Rohre ersetzen.
- Bereiten Sie bei der Analyse der Proben eine neue Probe vor. Entleeren Sie ~ 15 cm3 Flüssigkeit in ein Becherglas oder Fläschchen. ~ 20 cm3 reines Methanol oder 50/50 Methanol/Isopropanol durch den Probenport hinzufügen. Dies wird eine neue Gesamtkomposition geben.
- Achten Sie darauf die Probenröhrchen sind völlig leer, dann schließen Sie das System aus, wechseln Sie das Entlüftungsventil zur "Kontrolle" und die Heizung wieder einzuschalten. Wenn Sie schnell arbeiten, wird Gleichgewicht schnell wiederhergestellt werden. Beachten Sie, daß es eine Temperaturdifferenz aus dem vorherigen Beispiel.
- Wiederholen Sie die Gleichgewichtherstellung und Stichprobenverfahren als vor, daran zu denken, nehmen eine Probe zu waschen, und dann die endgültige Stichprobe. Die Experimente durch das Hinzufügen von Komponenten weiter. Zwölf Datenpunkte sind ausreichend, um die Tätigkeit Koeffizienten und (ungefähr) die binäre Interaktion Koeffizienten zu bestimmen.
3. Herunterfahren das system
- Schalten Sie die Heizung aus. Wenn das Gerät beginnt zu kühlen, schalten Sie das Rührwerk und Kondensator Wasser.
- Das System auf den atmosphärischen Druck zurückzusenden; Stellen Sie den Regler > 1020 Mbar, schließen Sie die Drosselklappe, legen Sie das Dreiwege Ventil entlüften und öffnen Sie das Ventil am Tank.
- Atmosphärischer Druck erreicht hat, schalten Sie die Pumpe. Lassen Sie die Flüssigkeit aus dem Behälter ab, bis es das Niveau des Ventils erreicht, aber überlassen Sie den Rest der Flüssigkeit im Behälter. Schließen Sie das 3-Wege-Ventil.
4. Analyse
- Nicht-lineare Regression und ein standard Summe der quadrierten Residuen Zielfunktion, Verwendung der Tätigkeit Koeffizienten berechnet aus den Rohdaten bilden die 6 Konstanten für die ternären Wilson-Gleichung (siehe unten), für dieses System. Beurteilung der Qualität der Passung durch grafische Methoden und Informatik die durchschnittliche prozentuale relative Abweichungen (APRD), die durchschnittliche eignen Fehler X 100.

- Konvergieren Sie auf die wahren optimale Werte aus mehreren unterschiedlichen Richtungen im Parameterraum Antwort mithilfe einer faktoriellen Methode für die anfänglichen Vermutungen. Berechnen Sie die Genauigkeit der Messungen GC, indem ausreichend repliziert eine GC-Probe um relative Genauigkeiten nach t-Kenngröße zu bestimmen, und verwenden Sie die Genauigkeiten um zu bestimmen, ob Sie akzeptieren / ablehnen einer bestimmten GC-Messung durch geeignete Hypothesentest.
- Die relative Genauigkeiten der GC-Messung an der APRDs zu vergleichen und diskutieren. Auch berichten die absolute Genauigkeiten von Druck und Temperatur Manometer - diese einmal pro Tag zu bestimmen.
Ergebnisse
Die Tätigkeit Koeffizienten der Daten zeigen keine signifikante Abweichungen vom Mittelwert für jede Komponente (Tabelle 1). Dies ist, wie erwartet, weil es Kompositionen für fortgeschrittene Komponente nicht große Unterschiede sind. Komponenten in der Nähe von 1 haben jedoch in der Nähe von γ 1. Niedrige Zusammensetzung Komponenten haben hohe γ. Komponenten höchste Konzentration in einer Mischung, die eine geringere Abweichung haben wird, also es werden näher an ideal (γ = 1). Komponenten mit niedrigeren Konzentrationen in einer Mischung haben höhere Abweichungen, so dass ihre γ größer als 1 werden.
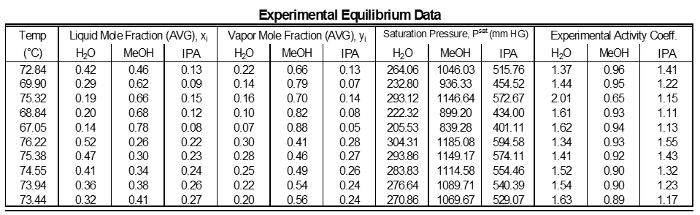
Tabelle 1: Ergebnisse der jeder Probenahme der experimentellen Daten.
Die Daten wurden an Wilson Modellparameter anpassen und die Koeffizienten berechnet wurden (Tabelle 2). Eine einfache Reduzierung der Summe der quadrierten Residuen zwischen experimentellen und Wilson Gleichung (1) Tätigkeit Koeffizienten verwendet wurde. Dies wurde erreicht mit Excel Solver-Funktion. Die Parität Handlung gezeigt betrifft die experimentell gefundenen Tätigkeit Koeffizienten der Wilsons Gleichung Modell Tätigkeit Koeffizienten. Die experimentelle Tätigkeit Koeffizienten wurden berechnet und grafisch im Vergleich zu den berechneten Modells Koeffizienten.

Tabelle 2: Ergebnisse der Anpassung der Daten an die Wilson-Modell-Parameter.
 (1)
(1)
Die Parameterwerte gefunden wurden die beste Passform (Tabelle 3). Im Idealfall die Korrelation ist entlang der y = x-Linie; Allerdings ergab eine signifikante Korrelation ähnelt das ideale Szenario (Abbildung 2). Die Tätigkeit Koeffizienten der Daten wurde nicht signifikante Abweichungen vom Mittelwert für jede Komponente angezeigt, wie erwartet. Eine Reduzierung der Summe der quadrierten Residuen zwischen experimentellen und Wilson Gleichung Tätigkeit Koeffizienten mit Excel Solver Funktion verwendet wurde. Die Parität Handlung betrifft die experimentell gefundenen Tätigkeit Koeffizienten der Wilsons Gleichung Modell Tätigkeit Koeffizienten.
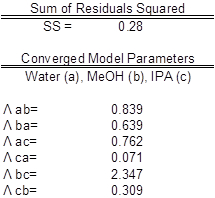
Tabelle 3: Modellparameter mit Wasser (a), MeOH (b) und IPA (c). Die experimentellen Werte sind im Vergleich zum erwarteten Werten.

Abbildung 2 : Darstellung der Zusammenhänge zwischen die experimentelle Tätigkeit Koeffizienten und das Modell Tätigkeit Koeffizienten.
Anwendung und Zusammenfassung
Dieses Experiment demonstriert die Gleichgewichtherstellung der Methanol - Isopropanol - Wasser-Dampf-Flüssig-Mischungen bei konstanter P = 700 mm Hg und wie Messen Sie Temperatur und Zusammensetzung und Aktivität Koeffizienten berechnen. Die Tätigkeit Koeffizienten der Daten einen Mittelwert für die einzelnen Komponenten nicht erheblich abweichen, wie erwartet. Eine Reduzierung der Summe der quadrierten Residuen zwischen experimentellen und Wilson Gleichung Tätigkeit Koeffizienten mit Excel Solver Funktion verwendet wurde. Die Parität Handlung betrifft die experimentell gefundenen Tätigkeit Koeffizienten der Wilsons Gleichung Modell Tätigkeit Koeffizienten.
In der Erdölindustrie ist Destillation des Hauptprozesses für Trennung von Erdölprodukten. Viele Ölraffinerien verwenden Destillation für Rohöl1. Leichte Kohlenwasserstoffen sind von schwereren Teilchen, basierend auf Siedepunkte1Trennung getrennt. Schwere Materialien wie Gas, die Öle in den unteren Platten, während leichte Materialien sammeln wie Propan und Butan1aufsteigen. Kohlenwasserstoffe, wie Benzin, Jet und Dieselkraftstoffe, sind getrennte1. Dieser Prozess wird oft viele Male wiederholt, vollständig getrennt und verfeinern die Produkte1. Raffinerien laufen diese Prozesse im Steady-State, ständig Schaffung neuer Produkte bei maximaler Leistung, also Effizienz Schlüssel1. Chemie-Ingenieure, die an diesen Prozessen arbeiten konzentrieren sich auf die Optimierung der Effizienz der Produktion1.
Tablett Destillationskolonnen werden auch verwendet, um eine Vielzahl von chemischen Produkten zu trennen. Ethanol ist ein solches Produkt. Durch die eng verwandte Prozesse eine Vielzahl von Produkten wie Kraftstoffqualität Ethanol, Bier und Schnaps können alle destilliertes sein2. Bestimmte Mengen von Alkohol können vom Wasser getrennt werden, um einen spezifischen Nachweis2zu schaffen. Dabei beschränkt sich auf die Verringerung des Anteils von Wasser in das Produkt, aber kann nicht vollständig beseitigen es2. Um Wasser vollständig zu entfernen, azeotrope Destillation ist erforderlich, die Extraktor Chemikalien verwendet, um Wasser von Ethanol2zu trennen.
Referenzen
- About the Refinery." Processing & Refining Crude Oil. Chevron.com, n.d. Web. 17 Nov. 2016.
- Madson, PW. Ethanol Distillation: The Fundamentals. Cincinnati: Katzen International, n.d. Print. Accessed from Web. 01 Oct. 2016.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Dampf-Flüssigkeits-Gleichgewicht
Chemical Engineering
89.0K Ansichten

Prüfung der Wärmeübertragungseffizienz eines Rippenrohrwärmetauschers
Chemical Engineering
17.9K Ansichten

Ein Tablett mit Trockner, leitfähige und konvektive Wärmeübertragung zu untersuchen
Chemical Engineering
43.9K Ansichten

Viskosität von Propylenglykol-Lösungen
Chemical Engineering
32.8K Ansichten

Porosimetrie eines Aluminiumsilikatpulvers
Chemical Engineering
9.6K Ansichten

Demonstration des Potenzgesetzmodells durch Extrusion
Chemical Engineering
10.0K Ansichten

Gas-Absorber
Chemical Engineering
36.7K Ansichten

Der Einfluss des Rückflussverhältnisses auf die Effizienz der Tray-Destillation
Chemical Engineering
77.8K Ansichten

Effizienz der Flüssig-Flüssig-Extraktion
Chemical Engineering
48.5K Ansichten

Flüssigphasenreaktor: Inversion von Saccharose
Chemical Engineering
9.7K Ansichten

Kristallisation von Salicylsäure durch chemische Modifikation
Chemical Engineering
24.3K Ansichten

Einphasen- und Zweiphasenströmung in einem Festbettreaktor
Chemical Engineering
18.9K Ansichten

Kinetik der Additionspolymerisation zu Polydimethylsiloxan
Chemical Engineering
16.1K Ansichten

Katalytischer Reaktor: Hydrierung von Ethylen
Chemical Engineering
30.4K Ansichten

Spin und Chill
Chemical Engineering
7.4K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten