Magnetaktivierte Zellsortierung (MACS): Isolierung von T-Lymphozyten
Überblick
Quelle: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Einheit für Lymphopoiese, Institut für Immunologie, Pasteur Institute, Paris, Frankreich
2 INSERM U1223, Paris, Frankreich
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, Frankreich
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Pasteur Institute, Paris, Frankreich
Die Abwehr von Krankheitserregern hängt von der Überwachung durch das Immunsystem ab. Dieses System ist komplex und umfasst viele Zelltypen, von denen jeder spezifische Funktionen hat. Diese komplexe Zusammensetzung ermöglicht Immunreaktionen auf eine große Vielfalt von Krankheitserregern und Verletzungen. Die adaptive Immunität ermöglicht spezifische Reaktionen gegen bestimmte Krankheitserreger. Die Mehrheit der Zellen, die für diese Art der Immunität verantwortlich sind, sind die Lymphozyten (B-Zellen und T-Zellen). In der Regel reagieren B-Zellen auf extrazelluläre Infektionen (z. B. bakterielle Infektionen) und T-Zellen auf intrazelluläre Infektionen (z. B. Virusinfektionen). Die verschiedenen Zelltypen in Lymphozytenpopulationen können durch die Kombination von Zelloberflächenproteinen, die sie exprimieren, und/oder durch eine Gruppe von abgesonderten Zytokinen charakterisiert werden.
Die magnetische Sortierung ermöglicht die Anreicherung von Zielzellpopulationen unter Verwendung magnetischer Eigenschaften und expressionierung eines oder mehrerer Zelloberflächenproteine (1, 2). Diese Technik besteht aus drei Schritten. Zunächst werden die Zellen mit magnetischen Perlen inkubiert, die mit einem oder mehreren monoklonalen Antikörpern gekoppelt sind. Zellen, die Oberflächenproteine ausdrücken, die an diese Antikörper binden, heften sich an die magnetischen Perlen. Dann werden die Zielzellpopulationen mit einem Magneten erfasst. Zum Abschluss werden die Zielzellen vom Magneten eluiert. Am Ende werden zwei Sortierprodukte erhalten, eines mit nicht beschrifteten Zellen und das zweite mit den Zielzellen gekoppelt mit den Magnetperlen. Säulen können verwendet werden, um die Effizienz der magnetischen Sortierung zu verbessern. In der Spalte verlängert ein nichtmagnetisches Element den Pfad der Zelle durch die Spalte. Daher wird der Zellfluss verlangsamt, was die Zellerfassung durch den Magneten erleichtert.
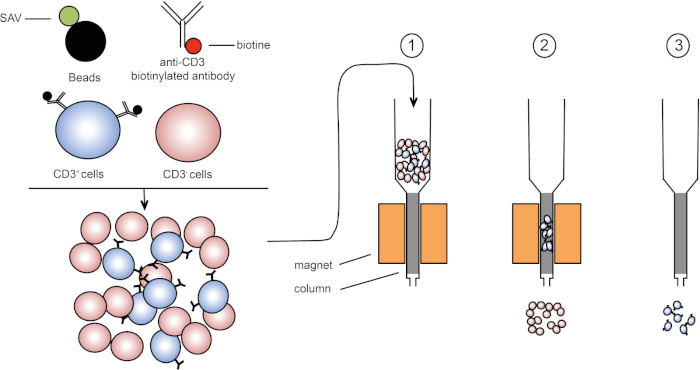
Abbildung 1: Schematische Darstellung der magnetischen Trennung. Thymische Leukozyten sind mit Anti-CD3-biotinylierten Antikörpern gefärbt. Nach dem Waschen fixieren Streptavidin (SAV) gekoppelte Perlen das Biotin gezielt auf Anti-CD3-Antikörper. (1) Zellen werden in eine Spalte übertragen. (2) Der Magnet behält keine unbeschrifteten Zellen, während CD3-positive Zellen in der Spalte verbleiben. Schließlich wird die Säule vom Magneten getrennt und (3) CD3-positive Zellen werden im Medium eluiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Es gibt zwei Arten der magnetischen Sortierung (3). Bei der positiven Sortierung werden Von interessede Zellen mit den Magnetperlen erfasst. Bei der negativen Sortierung werden unerwünschte Zellen entfernt, indem sie mit den magnetischen Perlen, die die entsprechenden Antikörper tragen, aufgenommen werden. Diese MACS-Technik ermöglicht eine gute Anreicherung von Zielzellen und verbessert den Anteil der zurückgewonnenen Zellen von 1-20% auf 60-98% in einem Organ. Nach der Sortierung ist es notwendig, die Zellreinheit und die Sortierung nach verschiedenen Methoden (z.B. Durchflusszytometrie) zu überprüfen. Die MACS-Technik ist ideal, um eine Zielpopulation für andere Experimente wie Zellkultur oder Zellzyklusanalyse zu bereichern.
In dieser Übungseinheit zeigen wir, wie thymische Leukozyten isoliert und anschließend thymische CD3-positive Zellen aus dem Mix mit der magnetischen Zellsortierungstechnik angereichert werden können.
Verfahren
1. Vorbereitung
- Vor Beginn Laborhandschuhe und entsprechende Schutzkleidung anziehen.
- Waschen Sie alle Sezierwerkzeuge, zuerst mit einem Waschmittel und dann mit 70% Ethanol und trocknen Sie sie dann mit einem sauberen Papiertuch.
- Bereiten Sie 200 ml von Hanks ausgewogener Salzlösung (HBSS) vor, die 2% fetales Kalbsserum (FCS) enthält.
2. Dissektion
- Pin eine eingeschläferte Maus auf eine Sezierplatte in der Supine-
Ergebnisse
In diesem Protokoll wurden CD3-positive Zellen mit Hilfe der magnetischen Zellsortierung aus thymischen Leukozyten angereichert (Abbildung 1). Vor der magnetischen Zellanreicherung machten CD3-positive Zellen 53,6 % der gesamten thymischen Zellen aus (Abbildung 2, obere Panels). Nach der anreicherung der magnetischen Zellen stieg der Anteil der CD3-positiven Zellen auf 95 % (Abbildung 2, untere Panels). Somit ist MACS eine einfache, schnelle und effiziente Zellanreicherungstechnik, um gew
Anwendung und Zusammenfassung
Die Magnetische Trenntechnologie ist eine gängige Methode, um eine Zielzellpopulation einfach und schnell zu sortieren. Mit T-Zellen spezifische Antikörper und magnetische Perlen haben wir T-Zellen Frequenz in unserer Probe angereichert. Die Reinheitsrate am Ende des Experiments hängt vom Prozentsatz der Zielzellen in der anfänglichen Zellsuspension ab. Zellen, die nach der magnetischen Zellsortierung gewonnen werden, können für verschiedene Zwecke wie zellübertragung oder Zellzyklusanalyse verwendet werden. Eine ...
Referenzen
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Magnetaktivierte Zellsortierung (MACS): Isolierung von T-Lymphozyten
Immunology
23.0K Ansichten

Durchflusszytometrie und fluoreszenzaktivierte Zellsortierung (FACS): Isolierung von B-Lymphozyten
Immunology
93.2K Ansichten

ELISA-Test: Indirekt, Sandwich und kompetitiv
Immunology
239.0K Ansichten

ELISPOT-Assay: Nachweis von IFN-γ-sezernierenden Splenozyten
Immunology
28.7K Ansichten

Immunhistochemie und Immunzytochemie: Gewebebildgebung mittels Lichtmikroskopie
Immunology
79.1K Ansichten

Antikörper-Generierung: Herstellung monoklonaler Antikörper mit Hybridomen
Immunology
43.6K Ansichten

Immunfluoreszenzmikroskopie: Immunfluoreszenzfärbung paraffin-embedded Tissue Sections
Immunology
53.9K Ansichten

Konfokale Fluoreszenzmikroskopie: Eine Technik zur Bestimmung der Lokalisierung von Proteinen in Maus-Fibroblasten
Immunology
43.3K Ansichten

Immunprecipitation-basierte Techniken: Reinigung endogener Proteine mit Agarose-Perlen
Immunology
87.8K Ansichten

Zellzyklusanalyse: Bewertung der Proliferation von CD4- und CD8-T-Zellen nach Stimulation mit CFSE-Färbung und Durchflusszytometrie
Immunology
24.3K Ansichten

Adoptivzelltransfer: Spendermaus-Splenozyten einer Host-Maus einführen und Erfolg über FACS bewerten
Immunology
22.5K Ansichten

Assay für Zelltod: Chrom Release Assay der zytotoxischen Fähigkeit
Immunology
151.4K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten