Assay für Zelltod: Chrom Release Assay der zytotoxischen Fähigkeit
Überblick
Quelle: Frances V. Sjaastad1,2, Whitney Swanson2,3, und Thomas S. Griffith1,2,3,4
1 Mikrobiologie, Immunologie und Krebsbiologie Graduate Program, University of Minnesota, Minneapolis, MN 55455
2 Zentrum für Immunologie, University of Minnesota, Minneapolis, MN 55455
3 Institut für Urologie, University of Minnesota, Minneapolis, MN 55455
4 Freimaurerkrebszentrum, University of Minnesota, Minneapolis, MN 55455
Eine der Hauptfunktionen der Zellen des Immunsystems ist es, Zielzellen zu entfernen, die mit Viren infiziert wurden oder sich in eine Tumorzelle verwandelt haben. In-vitro-Assays zur Messung der zytotoxischen Kapazität von Immunzellen sind seit vielen Jahren ein Grundnahrungsmittel in Laboratorien. Diese Assays wurden verwendet, um die Fähigkeit von T-Zellen, NK-Zellen oder anderen Immunzellen zu bestimmen, Zielzellen in einer antigen-spezifischen oder -unspezifischen Weise abzutöten. Todesliganden (z. B. FasLigand oder TRAIL), Zytokine (z. B. IFNg oder TNF) oder zytotoxische Granulate (z. B. Perforin/Granzym B), ausgedrückt durch Effektorzellen, sind einige Möglichkeiten, wie der Tod von Zielzellen induziert werden kann. Mit der Explosion in der Tumorimmuntherapie Forschung in den letzten Jahren, gibt es wachsendes Interesse an der Suche nach Wirkstoffen, um die zytotoxische Aktivität von Immunzellen zu erhöhen, um die Patientenergebnisse zu verbessern. Umgekehrt sind einige Krankheiten durch die überausuberliche Aktivität der zytotoxischen Aktivität der Immunzelle gekennzeichnet, was zu Bemühungen führt, Wirkstoffe zu identifizieren, um diese Reaktionen zu mildern. So kann ein Assay, bei dem der Anwender eine beliebige Anzahl verschiedener Effektorzellen, Zielzellen und/oder Ansprechmodifikatoren problemlos in das experimentelle Design integrieren kann, als wertvolles Mittel zur schnellen Beurteilung der zytotoxischen Kapazität von Effektorzellen und/oder oder die Reaktionsfähigkeit der Zielzelle.
Diese In-vitro-Assays beinhalten die Vermischung verschiedener Zellpopulationen sowie die Verwendung einer relativ geringen Anzahl von Effektor- und Zielzellen. Eine Notwendigkeit des Assays besteht daher darin, die Zielzellen so zu kennzeichnen, dass sie leicht erkannt und quantitiert werden können, so dass der Benutzer dann die "prozentspezifische Lyse" bestimmen kann, die von den Effektorzellen vermittelt wird. Radioaktivität - insbesondere Chrom 51 (51Cr) in Form von Na251CrO4- ist eine kostengünstige Möglichkeit, zelluläre Proteine innerhalb der Zielzellen schnell und nicht spezifisch zu kennzeichnen (1). Die kurze Etikettierung und die Gesamt-Assay-Zeiten reduzieren das Potenzial für signifikante Veränderungen in der Anzahl und/oder dem Phänotyp der Zielzellen, die das Ergebnis des Tests beeinflussen könnten. Nach dem Verlust der Membranintegrität der Zielzellen infolge der zytotoxischen Aktivität der Effektorzellen werden die 51Cr-markierten Zellproteine innerhalb der Zielzellen in den Kulturüberstand freigesetzt und Quantifizierung. Wie bei jedem Test, der die Funktion von Immunzellen in vitrountersucht, gibt es eine Reihe wichtiger Überlegungen, die Die Leistung des Experiments zu verbessern. Eines der wichtigsten Merkmale ist die Verwendung gesunder Effektor (für maximale zytotoxische Aktivität) und Ziel (für maximale Reaktionsfähigkeit und minimale spontane Tod /51Cr Freisetzung) Zellen. Effektor- und Zielzellkontakt ist erforderlich (was zur allgemeinen Verwendung von rund-bodenden 96-Well-Platten zur Förderung des Zell-Zell-Kontakts führt) (2). Schließlich hängt die Datenanalyse von der Einbeziehung positiver und negativer Zielzellpopulationen ab.
Das folgende Protokoll wird die Schritte zur Durchführung eines Standard-Freisetzungsassaysvon 51 Cr zur Messung der zytotoxischen Fähigkeit einer Population von Effektorzellen skizzieren, obwohl vor kurzem eine nicht radioaktive Version mit Europium entwickelt wurde. 51 Cr ist ein leistungsstarker Strahlenstrahler. Folglich erfordert die Verwendung dieses Tests ein angemessenes Strahlensicherheitstraining, einen speziellen Laborraum, einen Gammazähler und die Entsorgung radioaktiver Proben.
Die allgemeine Abfolge der Ereignisse in diesem Test sind: 1) 51Cr-markierte Ziele vorbereiten; 2) Effektorzellen vorbereiten und zur Platte hinzufügen, während Die Zielzellen etikettieren; 3) Beschriftete Targets zu Platte hinzufügen; 4) Inkubationsplatte; 5) Ernte Überstand; und 6) Daten analysieren, nachdem Proben auf dem Zähler ausgeführt wurden. Die Proben werden üblicherweise in dreifacher Ausführung vorbereitet und dann gemittelt, um etwaige subtile Pipettierunterschiede zu berücksichtigen.
Die richtige PSA ist für diesen Test wichtig. Insbesondere sollte der Benutzer einen Labormantel und Handschuhe tragen. Sicherheitsbrillen können auf der Grundlage des Labors oder der Institution erforderlich sein. Es sollte eine ausreichende Bleiabschirmung für die sichere Lagerung und Verwendung der 51Cr in allen Schritten vorhanden sein. Schließlich sollte es spezielle Laborräume und Ausrüstung für die Verwendung von 51Cr, einschließlich aller richtigen Beschilderung, um anzugeben, wo Proben mit 51Cr gehalten werden und ein GeigerZähler mit Gamma-Sonde ausgestattet, um den Raum für mögliche verschmutzung.
In dieser Übungsübung werden wir die Fähigkeit bestimmen, die menschlichen peripheren mononukleären Blutzellen (PBMCs), (CpG stimuliert vs. unstimuliert), Melanomzellen abzutöten, indem wir die menschliche Melanomzelllinie WM793 als Modell und den Chromfreisetzungstest verwenden.
Verfahren
Prozessübersicht
Der typische 51Cr-Release-Assay zur Messung des Zelltodes umfasst folgende Schritte:
- Zunächst werden die Zielzellen mit Na2[51Cr]O4beschriftet. Dies unterscheidet sie von den Effektorzellen im Assay.
- Während die Zielzellen etikettiert werden, werden die Effektorzellen gesammelt und mit der seriellen Verdünnungstechnik wird eine abnehmende Titration der Effektorzellen in einer runden unteren 96-Well-Assay-Platte erzeugt.
- Am Ende der Zielzellkennzeichnung werden die Zellen zuerst gewaschen und dann eine feste Anzahl von Zellen der Assayplatte hinzugefügt, die bereits eine Reihe von Verdünnungen von Effektorzellen enthält.
- Als Nächstes wird der Zellmix des Zieleffektors für einen definierten Zeitraum inkubiert, um eine ausreichende Zellinteraktion mit den Zielzellen zu ermöglichen, um die Zelllyse zu mediat.
- Schließlich werden die Kulturüberstande geerntet und in Röhren gesammelt. Der 51-Cr-Betrag wird mit einem Gammazähler quantifiziert.
- Am Ende werden die Daten gesammelt und verwendet, um die "prozentuale spezifische Zelllyse" der Zielzellen zu berechnen.
1. Kennzeichnung von Zielzellen mit 51Cr
- Zunächst bereiten Sie die Zielzellen (hier- menschliche Melanom-Zelllinie WM793) zu einer einzelzelligen Suspension vor.
- Entfernen Sie dazu zunächst die Medien aus dem Gewebekulturkolben.
- Dann waschen Sie die Zellen mit 5 ml 1X PBS.
- Versuchen Sie die Zellen, indem Sie 1 ml Trypsin für 2 min auf die Platte legen.
- Tippen Sie vorsichtig auf den Kolben, um die Zellen von der Kolbenoberfläche zu lösen.
- Fügen Sie dem Kolben 5 ml RPMI-Medien hinzu und pipen sie das Medium nach oben und unten, um die Zellen zu lösen.
- Sammeln Sie die Zellsuspension in ein 15 ml konisches Rohr und zentrieren Sie die Zellsuspension für 5 min bei 1200 U/min. Dekant den Überstand.
- Fügen Sie 10 ml Medien in das Pellet und sanft Pipetten sie die Medien nach oben und unten, um die Zellen in Suspension zu bringen.
- Bestimmen Sie die Zellkonzentration mit einem Hämozytometer.
- Übertragen Sie 1x106 Zellen in ein neues 15 ml konisches Rohr.
- Zentrifugieren Sie die Zellsuspension für 5 min bei 1200 U/min und dekanieren Sie den Überstand.
- Kurz wirbeln Sie das Rohr, um das Zellpellet in dem kleinen Volumen des zurückgelassenen Mediums wieder aufzuhängen.
- Fügen Sie der WM793-Zielzellsuspension 100 CIs von 51Cr direkt hinzu.
Hinweis: Für die jeweilige Radioaktivität sollte ein spezieller Laborraum eingerichtet werden. Darüber hinaus sollte es eine ausreichende Bleiabschirmung für die sichere Lagerung und Verwendung des 51Cr während aller Schritte sowie eine ordnungsgemäße Beschilderung geben, um anzugeben, wo Proben mit 51Cr aufbewahrt werden. Ein Geigerzähler, der mit einer Pfannkuchensonde ausgestattet ist, ist ebenfalls notwendig, um den Raum für eine mögliche Kontamination zu vermessen. - Fügen Sie ein kleines Stück radioaktives Klebeband in die Röhre, um anzuzeigen, dass die Röhre jetzt radioaktiv ist.
- Legen Sie das Rohr in einen 37°C Inkubator mit einem Bleischild und inkubieren Sie 1 h. Streichen Sie das Rohr alle 15-20 Minuten, um die Aufnahme der Zielzelle des Chroms zu erhöhen.
- Waschen Sie nach der Inkubationszeit die Zielzellen mit 5 ml FBS, um überschüssige 51Cr zu entfernen.
- Zentrifugieren Sie die Zellen bei 1200 U/min für 5 min. Decant radioaktive FBS waschen in entsprechenden Abfallbehälter.
- Das Pellet wieder aufhängen und ein zweites Mal mit FBS waschen. Überprüfen Sie das Pellet auf eingebaute Radioaktivität mit einem Geigerzähler.
- Setzen Sie das Pellet in 10 ml komplettem Medium wieder auf und erreichen Sie eine Zellkonzentration von 105 Zellen/ml.
Hinweis: Der Zellzählschritt nach der 51Cr-Kennzeichnung wird hier weitgehend aus Sicherheitsgründen weggelassen. Es kann davon ausgegangen werden, dass die WM793-Zellkonzentration mit der vor der 51Cr-Kennzeichnung identisch war.
2. Vorbereiten von Effektorzellen
- Es können verschiedene Effektorzellen verwendet werden, z. B. menschliche oder Maus-T-Zellen und NK-Zellen. In diesem Beispiel wurden PBMCs verwendet, die durch Standarddichtegradientenzentrifugation (bis zu einer Konzentration von 5x106) aus Vollblut isoliert wurden.
- Zunächst fügen Sie jedem Brunnen einer der Reihen (hier Reihe A, siehe Tabelle 1) einer 96-well-Rundbodenplatte 100 L Gewebekulturmedium hinzu. Hier werden keine Effektorzellen hinzugefügt, und sie dienen als "Leer" zur Bestimmung der "minimalen/spontanen 51Cr-Freisetzung" aus den Zielzellen.
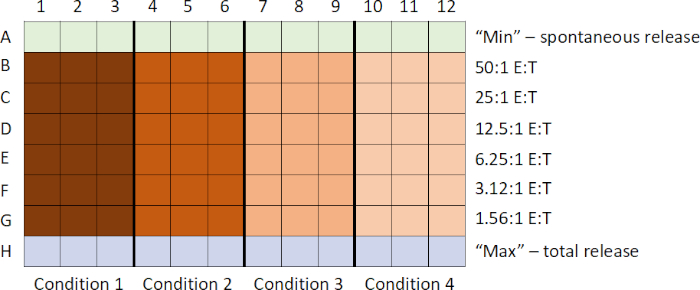
Tabelle 1: 51Cr Release Assay Layout: Reihe A- Zielzellen (104 Zellen / 100 l) nur mit Medien inkubiert (erzeugt 'leer' zur Bestimmung der "minimum/spontan 51Cr Release"). Zeilen B bis C- Brunnen mit unterschiedlichen Effektor: Zielzellen (E:T)-Verhältnisse, die von 50:1 bis 1,5:1 reichen. Zeile H- Zielzellen (104 Zellen/100 l) inkubiert mit 1% NP-40 (NP-40 lyses die Zielzellen, erzeugung "maximale oder insgesamt 51Cr Freisetzung"). Jedes E:T-Verhältnis wird in dreifacher Auslage für jeden Versuchszustand getestet. Spalte 1-3- unstimulierte PBMCs und Spalte 4-6- CpG-stimulierte PBMCs.
- Als nächstes erzeugen Sie eine 2-fache serielle Zellverdünnung der PBMCs (in Dreifacharbeit für jede Versuchsbedingung), um eine Effektorzellkonzentration von 5x105 bis 15.625 Zellen/100 l Medien zu erhalten (hier Zeilen B bis G).
Hinweis: In diesem Beispiel ist das Anfangseffektor: Zielzelle (E: T) Verhältnis ist 50:1. Dieses Verhältnis kann jedoch je nach experimentellen Besonderheiten angepasst werden. - Lassen Sie die letzte Zeile leer (hier Zeile H), indem Sie diesen Brunnen keine Effektorzellen hinzufügen. (Diese Zeile wird verwendet, um die "Gesamtanzahl/min oder (ca. p. m)" oder die "maximale 51Cr-Version") zu generieren.
- Legen Sie die Platte in den 37°C-Inkubator, bis die Zielzellen bereit sind, hinzugefügt zu werden.
3. Hinzufügen von 51Cr beschrifteten WM793-Zielzellen zum Assay
- Nach der Inkubationszeit die Zielzellen aus dem Inkubator entfernen und mit 5 ml FBS waschen, um überschüssige 51Cr zu entfernen.
- Zentrifugieren Sie die Zellen bei 1200 U/min für 5 min, mit einer bestimmten Zentrifuge.
- Entfernen Sie die FBS-Waschanlage (radioaktiver Überstand) in einen geeigneten Abfallbehälter.
- Wiederholen Sie den Waschschritt, indem Sie das Pellet in einem frischen 5 ml FBS wieder aufhängen.
- Zentrifugieren Sie die Zellen wieder bei 1200 U/min für 5 min.
- Schließlich das Pellet in 10 ml des kompletten Mediums wieder aussetzen.
- Gießen Sie die 51Cr-markierte WM793-Zellsuspension (105 Zellen/ml) in ein Einweg-Reagenzreservoir.
- Fügen Sie dann 100 l dieser beschrifteten Zielzellen zu jedem Brunnen der 96-Well-Effektor-Zellplatte hinzu, wobei eine Mehrkanalpipette verwendet wird.
- Als Nächstes fügen Sie 100 L von 1% NP-40 (in Wasser) in die Reihe der Brunnen, die frei von Effektorzellen sind (hier Zeile H). 1% NP-40 wird die Zielzellen lysieren, und somit dienen diese Brunnen als Kontrollen, um die "Gesamtanzahl/min, oder (c. p. m)" oder die maximale 51Cr-Freisetzung zu bestimmen.
- Befestigen Sie deckel auf Platte, indem Sie ein kleines Stück gasdurchlässiges Klebeband auf jeder Seite der Platte hinzufügen und legen Sie ein Stück radioaktives Klebeband auf den Deckel, um anzuzeigen, dass es 51Cr enthält.
- Kurz gesagt, zentrieren Sie die Platte bei 1200 U/min. Wenn nur eine Versuchsplatte verwendet wird, fügen Sie der Zentrifuge eine Ausgleichsplatte hinzu.
Hinweis: Es ist wichtig, eine Zentrifuge zu verwenden, die für den Umgang mit radioaktiven Proben markiert ist. - Entfernen Sie die Platte aus der Zentrifuge.
- Legen Sie die Platte in einen 37°C Inkubator mit einem kleinen Stück Bleiabschirmung über die Platte für zusätzliche Sicherheit. Inkubieren Sie für 16 h, um eine Zielzelllyse zu ermöglichen.
Hinweis: Die Inkubationszeit kann je nach verwendeten Effektorzellen und möglichem Tötungsmechanismus zwischen 4 und 18 h variieren.
4. Ernte der Übertreibungen
- Am Ende der Inkubationszeit entfernen Sie vorsichtig das Band um den Rand der Platte und entfernen Sie den Deckel.
- Als nächstes legen Sie den Ernterahmen auf die Platte, um sicherzustellen, dass die kleinen Filterscheiben für jeden der Baumwollstecker vorhanden sind. Dadurch wird die Sammlung eines zellfreien Überstandes sichergestellt.
- Nun drücken Sie langsam und sanft die Baumwollstopfen in die Brunnen.
- Nach ca. 10 Sekunden den Druck auf die Baumwollstecker loslassen und dann die Baumwollstecker auf Rohrstreifen übertragen.
- Legen Sie jedes dieser Rohre in ein sekundäres FACS-Rohr.
- Schließlich laden Sie FACS-Röhren auf den Gammazähler und führen Sie die Proben aus, um die Menge von 51Cr zu quantifizieren, die in jedem Zustand freigesetzt wird. Die Proben werden in der Regel 1 Minute lang gemessen, was eine einfache Bestimmung der "Zählungen/Minute" ermöglicht.
- Zeichnen Sie sorgfältig die Reihenfolge auf, in der die Rohre in den Zähler geladen wurden.
5. Datenanalyse
- Hier wurden den ersten drei Spalten unstimulierte PBMCs hinzugefügt und cpG-stimulierte PBMCs (CpG ODN, (1 g/ml) für 24 h) zu den Spalten 4-6 hinzugefügt. Siehe Tabelle 2.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| pro | 1251 | 1157 | 1086 | 917 | 1118 | 1140 | ||
| B | 1832 | 1986 | 1971 | 7629 | 7913 | 8180 | ||
| c | 1677 | 1739 | 1428 | 5454 | 5055 | 5268 | ||
| D | 1638 | 1552 | 1734 | 4239 | 3582 | 3786 | ||
| E | 1658 | 1580 | 1339 | 2818 | 2623 | 2750 | ||
| f | 1579 | 1472 | 1483 | 2028 | 1779 | 1769 | ||
| g | 1326 | 1325 | 1184 | 1801 | 1654 | 1565 | ||
| h | 9220 | 9367 | 8067 | 8774 | 9647 | 8236 | ||
| Ⅰ | Durchschnitt von A1,A2,A3 -> | 1164.67 | Spontanc.p.m | 1058.33 | ||||
| J | Durchschnitt von B1,B2,B3 -> | 1929.67 | 9.91% | 7907.33 | 87.50% | 50:1 | ||
| kb | Durchschnitt von C1,C2,C3 -> | 1614.67 | 5.83% | 5259 | 53.67% | 25:1 | ||
| l | Durchschnitt d1,D2,D3 -> | 1641.33 | 6.17% | 3869 | 35.91% | 12.5:1 | ||
| m | Durchschnitt von E1,E2,E3 -> | 1525.67 | 4.68% | 2730.33 | 21.36% | 6.25:1 | ||
| N | Durchschnitt von F1,F2,F3 -> | 1511.33 | 4.49% | 1858.67 | 10.22% | 3.12:1 | ||
| O | Durchschnitt von G1,G2,G3 -> | 1278.33 | 1.47% | 1673.33 | 7.86% | 1.56:1 | ||
| seiten | Durchschnitt h1,H2,H3 -> | 8884.67 | Maximal c.p.m | 8885.67 | ||||
| Unstim PBMC | CpG-Stim PBMC | E:T-Verhältnis | ||||||
Tabelle 2: 51Cr-Release-Assay-Daten: Datenwerte "Anzahl pro Minute" / "c. p. m", durchschnitts c. p. m-Werte und berechnete prozentspezifische Lysewerte.
- Die gesammelten Daten (Anzahl pro Minute, d.h. c.p.m) wurden in die Zellen einer Kalkulationstabelle in der gleichen Weise eingegeben, wie die Proben in der Originalplatte angeordnet waren.
- Zunächst wurden die Durchschnittswerte der Triplicate berechnet. Tabelle 2 - Zellen I3 bis P3, für nicht stimulierte PBMCs und Zellen I6 bis P6, für CpG-stimulierte PBMCs.
- Nach der Ermitteltur der Durchschnittswerte wurde der prozentuale Anteil der spezifischen Lyse für jede Bedingung anhand der folgenden Formeln
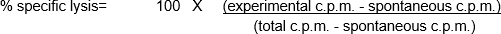
- Der Prozentuale Anteil der spezifischen Lyse wurde für jede Bedingung berechnet (Tabelle 2 - Zellen J4 bis O4, für nicht stimulierte PBMCs und J7 bis O7, für nicht stimulierte PBMCs).
Ergebnisse
In diesem Beispiel töteten Effektorzellen, die mit CpG stimuliert wurden (Abbildung 1, schwarze Kreise),die Zielzellen effektiver ab, da das Verhältnis von Effektorzellen zu Zielzellen zunahm. Dieser Anstieg wurde in den nicht stimulierten PBMCs(weiße Kreise)nicht beobachtet, was darauf hindeutet, dass eine CpG-Stimulation für die beobachtete Erhöhung der Zielzelllyse notwendig ist.
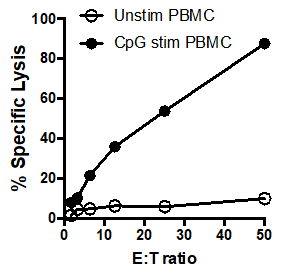
Abbildung 1: 51Cr-Assay-Streudiagramm: Tumorzidenaktivität durch humane PBMCs, unstimuliert(weiße Kreise)und nach Stimulation mit CpG (schwarze Kreise), getestet mit verschiedenen Effektoren: Zielzellverhältnisse (E: T) . 50:1 bis 1,5:1).
Anwendung und Zusammenfassung
Der hier beschriebene Assay hat eine erhebliche Flexibilität, da je nach gestellter Frage eine Vielzahl von Effektor- und Zielzellen eingesetzt werden kann. Beispielsweise kann die Spezifität der Effektorzellen durch die Verwendung verschiedener Zielzellen oder den Mechanismus der Effektorzelltötung durch die Verwendung von Zellen mit einem Mangel an bestimmten Proteinen oder die Verwendung von proteinspezifischen Inhibitoren bestimmt werden. Ein großes Problem mit dem 51Cr Release Assay ist das Potenzial für eine hohe spontane Freisetzungsrate durch die Zielzellen. Allein (ohne Effektorzellen) sollte die spontane Freisetzung von 51Cr durch die Zielzellen idealerweise nicht mehr als 30% der gesamten ("maximalen") Freisetzung durch die Zielzellen sofort Lyse betragen. Höhere spontane Freisetzungsraten können auf die Verwendung ungesunder Zielzellen zurückzuführen sein, entweder aufgrund schlechter Gesundheit (z. B. verlängerte Kultur einer Zelllinie) oder einer übermäßig langen Etikettierungszeit.
Referenzen
- Brunner, K. T., Mauel, J., Cerottini, J. C. and Chapuis. B. Quantitative assay of the lytic action of immune lymphoid cells on 51Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology, 14 (2):181-196, (1968).
- Kemp, T. J., B. D. Elzey, and T. S. Griffith. Plasmacytoid dendritic cell-derived IFN-alpha induces TNF-related apoptosis-inducing ligand/Apo-2L-mediated antitumor activity by human monocytes following CpG oligodeoxynucleotide stimulation. The Journal of Immunology, 171 (1): 212-218, (2003).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Assay für Zelltod: Chrom Release Assay der zytotoxischen Fähigkeit
Immunology
151.4K Ansichten

Durchflusszytometrie und fluoreszenzaktivierte Zellsortierung (FACS): Isolierung von B-Lymphozyten
Immunology
93.1K Ansichten

Magnetaktivierte Zellsortierung (MACS): Isolierung von T-Lymphozyten
Immunology
22.9K Ansichten

ELISA-Test: Indirekt, Sandwich und kompetitiv
Immunology
238.8K Ansichten

ELISPOT-Assay: Nachweis von IFN-γ-sezernierenden Splenozyten
Immunology
28.5K Ansichten

Immunhistochemie und Immunzytochemie: Gewebebildgebung mittels Lichtmikroskopie
Immunology
79.0K Ansichten

Antikörper-Generierung: Herstellung monoklonaler Antikörper mit Hybridomen
Immunology
43.6K Ansichten

Immunfluoreszenzmikroskopie: Immunfluoreszenzfärbung paraffin-embedded Tissue Sections
Immunology
53.9K Ansichten

Konfokale Fluoreszenzmikroskopie: Eine Technik zur Bestimmung der Lokalisierung von Proteinen in Maus-Fibroblasten
Immunology
43.2K Ansichten

Immunprecipitation-basierte Techniken: Reinigung endogener Proteine mit Agarose-Perlen
Immunology
87.8K Ansichten

Zellzyklusanalyse: Bewertung der Proliferation von CD4- und CD8-T-Zellen nach Stimulation mit CFSE-Färbung und Durchflusszytometrie
Immunology
24.3K Ansichten

Adoptivzelltransfer: Spendermaus-Splenozyten einer Host-Maus einführen und Erfolg über FACS bewerten
Immunology
22.5K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten